วัคซีนโควิด-19
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |


วัคซีนโรคติดเชื้อไวรัสโคโรนา 2019 เป็นวัคซีนที่มุ่งสร้างภูมิคุ้มกันต่อเชื้อไวรัสโคโรนาที่เป็นสาเหตุของโรคโควิด-19 โดยก่อนที่จะเกิดการระบาดทั่วของโควิด-19 ได้มีความพยายามในการพัฒนาวัคซีนสำหรับโรคไวรัสโคโรนาชนิดที่เป็นสาเหตุของโรคอื่น ๆ เช่น กลุ่มอาการทางเดินหายใจเฉียบพลันรุนแรง (ซาร์ส หรือ SARS) และโรคทางเดินหายใจตะวันออกกลาง (เมอร์ส หรือ MERS) มาอย่างต่อเนื่อง ความพยายามเหล่านี้ได้สะสมความรู้พอสมควรเกี่ยวกับโครงสร้างและการทำงานของไวรัสโคโรนา ซึ่งได้ช่วยให้การพัฒนาเทคโนโลยีวัคซีนโควิดต่าง ๆ ตั้งแต่ต้นปี 2020 ดำเนินไปได้อย่างรวดเร็ว[1] เริ่มตั้งแต่วันที่ 10 มกราคม 2020 ซึ่งมีการเผยแพร่ลำดับยีนผ่านจีเซด (GISAID) และ ณ วันที่ 19 มีนาคม อุตสาหกรรมยาทั่วโลกก็ได้ประกาศคำมั่นสัญญาที่จะทำการเพื่อจัดการโรค[2] วัคซีนโควิด-19ได้เครดิตโดยทั่วไปว่าช่วยลดการติดต่อ ความรุนแรง และอัตราการตายเนื่องกับโรค[3]
ในการทดลองทางคลินิกระยะที่ 3 วัคซีนหลายชนิดสามารถป้องกันการติดเชื้อแบบแสดงอาการโดยมีประสิทธิศักย์สูงถึงร้อยละ 95 ณ เดือนกรกฎาคม 2021 มีวัคซีน 20 ชนิดที่ได้ขึ้นทะเบียนให้ใช้ในประเทศอย่างน้อย 1 ประเทศรวมทั้งวัคซีนอาร์เอ็นเอ 2 ชนิด (ไฟเซอร์และโมเดอร์นา), วัคซีนไวรัสโควิด-19 เชื้อตาย 9 ชนิด (BBIBP-CorV ของซิโนฟาร์ม, วัคซีนของ Chinese Academy of Medical Sciences, ซิโนแว็ก, โคแว็กซินของภารัตไบโอเทค, CoviVac ของ Chumakov Centre, COVIran Barakat ของ Shifa Pharmed Industrial Group, Minhai-Kangtai (KCONVAC)[A], QazVac ของ Research Institute for Biological Safety Problems และ WIBP-CorV ของซิโนฟาร์ม) วัคซีนที่ใช้ไวรัสเป็นเวกเตอร์ 5 ชนิด (สปุตนิกไลท์และสปุตนิกวีของสถาบันวิจัยกามาเลีย, แอสตร้าเซนเนก้า, Ad5-nCoV ของแคนซิโนไบโอลอจิกส์ และจอห์นสันแอนด์จอห์นสัน) และวัคซีนหน่วยย่อยโปรตีนของไวรัสโควิด-19 จำนวน 4 ชนิด (Abdala ของ Center for Genetic Engineering and Biotechnology, EpiVacCorona ของสถาบันเวกตอร์, Soberana 02 ของ Finlay Institute และ ZF2001 ของ Anhui Zhifei Longcom)[4][5] มีวัคซีนแคนดิเดตซึ่งได้เข้าสู่การวิจัยเพื่อใช้รักษาแล้ว 330 ชนิด ในจำนวนนี้ 30 ชนิดกำลังทดลองในระยะที่ 1, 30 ชนิดในระยะที่ 1-2, 25 ชนิดในระยะที่ 3 และ 8 ชนิดในระยะที่ 4[4]
ประเทศต่าง ๆ มีแผนแจกจำหน่ายวัคซีนโดยจัดลำดับการให้ตามกลุ่มที่เสี่ยงเกิดภาวะแทรกซ้อน เช่น ผู้สูงอายุ และกลุ่มที่เสี่ยงติดแล้วแพร่โรค เช่น บุคลากรทางแพทย์[6] มีประเทศที่กำลังพิจารณาฉีดวัคซีนเพียงโดสเดียวในเบื้องต้นเพื่อขยายฉีดวัคซีนแก่ประชาชนให้มากที่สุดจนกว่าจะมีวัคซีนพอ[7][8][9][10]
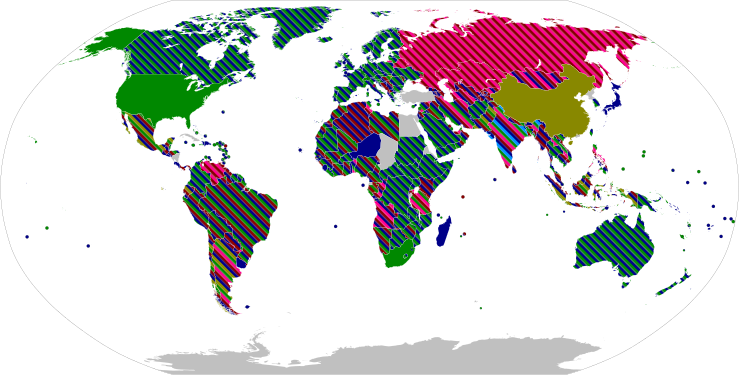
จนถึงวันที่ 22 สิงหาคม 2021 องค์กรสาธารณสุขรวม ๆ กันทั่วโลกรายงานว่า ได้ฉีดวัคซีนโควิด-19 ถึง 5,000 ล้านโดสแล้ว[11]
ผู้ผลิตวัคซีนได้ระบุจำนวนโดสวัคซีนที่จะสามารถผลิตในปี 2021 ไว้ดังนี้ ออกซฟอร์ด-แอสตร้าเซนเนก้า 3,000 ล้านโดส, ไฟเซอร์}-
| ประเทศและดินแดน | รับวัคซีนแล้ว[b] | % ประชากร[c] | |
|---|---|---|---|
| |
5,559,040,130 | ุ69.70% | |
| 1,310,292,000 | 91.89% | ||
| 1,027,384,975 | 72.50% | ||
| 338,160,884 | 75.12% | ||
| 269,650,596 | 81.22% | ||
| 203,657,535 | 73.92% | ||
| 189,603,842 | 88.06% | ||
| 162,881,618 | 69.07% | ||
| 151,206,039 | 88.33% | ||
| 104,686,063 | 84.46% | ||
| 97,179,493 | 76.22% | ||
| 90,485,463 | 92.16% | ||
| 88,637,093 | 61.25% | ||
| 79,248,347 | 36.26% | ||
| 78,484,848 | 67.92% | ||
| 65,159,767 | 73.58% | ||
| 64,873,989 | 77.81% | ||
| 57,941,051 | 67.89% | ||
| 57,005,497 | 79.62% | ||
| 55,155,346 | 49.69% | ||
| 54,662,907 | 80.61% | ||
| 53,806,963 | 79.97% | ||
| 50,887,501 | 86.20% | ||
| 44,828,388 | 86.51% | ||
| 44,695,420 | 37.16% | ||
| 42,959,468 | 82.81% | ||
| 41,479,690 | 91.14% | ||
| 41,343,396 | 86.93% | ||
| 34,777,314 | 64.64% | ||
| 34,763,194 | 90.40% | ||
| 33,954,133 | 51.84% | ||
| 30,356,472 | 89.15% | ||
| 28,131,787 | 82.89% | ||
| |
27,718,158 | 90.74% | |
| 27,018,975 | 74.21% | ||
| 25,019,146 | 66.79% | ||
| 23,970,891 | 40.02% | ||
| 22,871,373 | 57.38% | ||
| 22,236,698 | 84.95% | ||
| 22,157,232 | 78.29% | ||
| 21,875,104 | 91.55% | ||
| 21,674,823 | 62.59% | ||
| 18,867,075 | 39.93% | ||
| 18,640,008 | 56.54% | ||
| 18,088,517 | 92.27% | ||
| 17,143,761 | 78.53% | ||
| 15,729,617 | 36.19% | ||
| 15,349,780 | 43.13% | ||
| 15,331,441 | 85.17% | ||
| 15,275,527 | 91.10% | ||
| 14,317,039 | 26.50% | ||
| 14,258,889 | 34.67% | ||
| 13,568,372 | 48.18% | ||
| 12,853,113 | 38.40% | ||
| 12,775,557 | 73.00% | ||
| 12,628,561 | 26.94% | ||
| 12,557,145 | 12.68% | ||
| 11,332,925 | 25.47% | ||
| 11,158,619 | 55.74% | ||
| 10,858,101 | 55.98% | ||
| 10,730,079 | 95.70% | ||
| 10,572,981 | 76.75% | ||
| 9,991,089 | 100.00% | ||
| 9,780,727 | 95.23% | ||
| 9,265,890 | 79.50% | ||
| 8,915,029 | 49.96% | ||
| 8,186,546 | 41.64% | ||
| 7,934,228 | 76.40% | ||
| 7,840,131 | 17.75% | ||
| 7,775,538 | 73.71% | ||
| 7,729,842 | 43.93% | ||
| 7,661,653 | 55.28% | ||
| 7,361,008 | 60.94% | ||
| 7,312,443 | 65.12% | ||
| 7,218,016 | 58.42% | ||
| 6,975,898 | 66.48% | ||
| 6,914,179 | 92.33% | ||
| 6,898,666 | 77.17% | ||
| 6,722,752 | 71.15% | ||
| 6,530,252 | 62.59% | ||
| 6,527,591 | 68.46% | ||
| 6,437,808 | 40.25% | ||
| 6,420,813 | 64.42% | ||
| 6,253,472 | 35.28% | ||
| 6,237,297 | 89.77% | ||
| |
6,096,377 | 69.75% | |
| 5,935,299 | 22.65% | ||
| 5,888,649 | 79.31% | ||
| 5,373,253 | 52.10% | ||
| 5,282,863 | 54.18% | ||
| 5,160,551 | 91.55% | ||
| 4,821,579 | 43.25% | ||
| 4,785,341 | 55.61% | ||
| 4,782,640 | 81.31% | ||
| 4,652,597 | 73.69% | ||
| 4,624,515 | 22.66% | ||
| 4,605,172 | 88.89% | ||
| 4,531,047 | 19.98% | ||
| 4,524,323 | 81.66% | ||
| 4,346,995 | 79.99% | ||
| 4,301,076 | 82.95% | ||
| 4,107,508 | 81.77% | ||
| 3,987,939 | 58.81% | ||
| 3,825,381 | 72.14% | ||
| 3,697,190 | 27.69% | ||
| 3,613,292 | 15.99% | ||
| 3,529,545 | 80.06% | ||
| 3,456,481 | 80.97% | ||
| 3,431,986 | 12.29% | ||
| 3,354,075 | 48.81% | ||
| 3,257,365 | 71.18% | ||
| 3,209,797 | 14.51% | ||
| 3,142,971 | 28.80% | ||
| 3,006,793 | 87.85% | ||
| 2,851,847 | 105.81% | ||
| 2,822,919 | 51.82% | ||
| 2,740,227 | 49.92% | ||
| 2,684,696 | 15.50% | ||
| 2,381,935 | 42.69% | ||
| 2,352,235 | 7.94% | ||
| 2,321,299 | 57.60% | ||
| 2,316,327 | 34.00% | ||
| 2,272,965 | 68.27% | ||
| 2,244,456 | 25.36% | ||
| 2,106,404 | 31.06% | ||
| 2,100,271 | 44.35% | ||
| 2,012,767 | 38.34% | ||
| 1,956,960 | 71.16% | ||
| 1,942,221 | 73.84% | ||
| 1,654,886 | 24.96% | ||
| 1,654,504 | 44.03% | ||
| 1,346,184 | 71.84% | ||
| 1,345,763 | 47.35% | ||
| 1,265,802 | 59.72% | ||
| 1,241,174 | 84.31% | ||
| 1,128,072 | 38.01% | ||
| 1,123,773 | 86.48% | ||
| 1,106,705 | 33.81% | ||
| 1,017,116 | 3.02% | ||
| 1,011,261 | 43.86% | ||
| 943,394 | 28.91% | ||
| 934,799 | 34.55% | ||
| 906,858 | 50.89% | ||
| 883,018 | 65.83% | ||
| 869,187 | 65.55% | ||
| 854,392 | 40.81% | ||
| 852,562 | 30.15% | ||
| 753,588 | 49.39% | ||
| 711,924 | 76.57% | ||
| 699,116 | 89.35% | ||
| 695,760 | 11.92% | ||
| 679,361 | 97.72% | ||
| 670,969 | 74.88% | ||
| 610,021 | 23.76% | ||
| 556,228 | 26.42% | ||
| 511,632 | 42.58% | ||
| 495,285 | 61.24% | ||
| 481,945 | 74.42% | ||
| 478,733 | 89.77% | ||
| 450,404 | 100.31% | ||
| 438,825 | 53.41% | ||
| 406,534 | 3.51% | ||
| 399,225 | 76.22% | ||
| 376,350 | 3.71% | ||
| 367,858 | 32.82% | ||
| 356,734 | 60.68% | ||
| 343,821 | 47.47% | ||
| 311,040 | 13.02% | ||
| 309,770 | 84.00% | ||
| 301,673 | 78.80% | ||
| 292,783 | 46.63% | ||
| 270,109 | 16.53% | ||
| 267,820 | 45.26% | ||
| 251,956 | 62.17% | ||
| 192,323 | 66.33% | ||
| 191,371 | 86.05% | ||
| 190,908 | 62.33% | ||
| 176,624 | 54.06% | ||
| 174,147 | 42.48% | ||
| 163,833 | 58.17% | ||
| 127,438 | 56.04% | ||
| 108,601 | 56.81% | ||
| 100,900 | 76.88% | ||
| 90,314 | 84.83% | ||
| 87,265 | 81.66% | ||
| 85,770 | 80.06% | ||
| 84,365 | 76.14% | ||
| 69,560 | 81.44% | ||
| 64,290 | 68.97% | ||
| 61,859 | 90.01% | ||
| 60,140 | 33.43% | ||
| 57,901 | 72.52% | ||
| 54,223 | 85.62% | ||
| 48,554 | 75.65% | ||
| 44,180 | 35.21% | ||
| 42,175 | 129.07% | ||
| 41,715 | 85.04% | ||
| 41,243 | 72.52% | ||
| 37,502 | 36.07% | ||
| 33,794 | 70.88% | ||
| 33,361 | 0.26% | ||
| 32,995 | 45.57% | ||
| 32,815 | 71.76% | ||
| 32,240 | 0.53% | ||
| 29,788 | 67.41% | ||
| 26,767 | 68.01% | ||
| 26,672 | 67.49% | ||
| 26,357 | 77.50% | ||
| 19,466 | 62.55% | ||
| 19,109 | 72.26% | ||
| 15,112 | 88.73% | ||
| 13,106 | 103.27% | ||
| 10,854 | 68.36% | ||
| 7,150 | 61.66% | ||
| 6,368 | 53.40% | ||
| 4,361 | 71.83% | ||
| 2,632 | 75.57% | ||
| 2,203 | 116.38% | ||
| 2,104 | 47.68% | ||
| 1,650 | 102.23% | ||
| 47 | 100.0% | ||
| 0 | 0.00% | ||
|
อ้างอิง รายการของแหล่งอ้างอิงแบ่งตามประเทศ.
หมายเหตุ
| |||
สาระสำคัญและประวัติ[แก้]
ซาร์สและเมอร์ส[แก้]
มีวัคซีนป้องกันโรคไวรัสโคโรนาในสัตว์หลายอย่าง รวมทั้งโรคหลอดลมอักเสบเหตุติดเชื้อไวรัส (infectious bronchitis virus) ในนก โรคไวรัสโคโรนาในสุนัข (canine coronavirus) และโรคไวรัสโคโรนาในแมว (feline coronavirus)[17] โครงการก่อน ๆ ที่พัฒนาวัคซีนสำหรับไวรัสในสกุล Coronaviridae ที่มนุษย์ติดเชื้อ มุ่งใช้สำหรับกลุ่มอาการทางเดินหายใจเฉียบพลันรุนแรง (ซาร์ส หรือ SARS) และโรคทางเดินหายใจตะวันออกกลาง (เมอร์ส หรือ MERS) โดยทั้งสองได้ทดสอบในสัตว์ทดลองแล้ว[18][19]
ตามวรรณกรรมงานวิจัยที่ตีพิมพ์ในระหว่างปี 2005–2006 แม้รัฐบาลและองค์กรสาธารณสุขต่าง ๆ ทั่วโลกจะได้ให้ความสำคัญกับการหาและพัฒนาวัคซีนบวกยาใหม่ ๆ[20][21][22] แต่จนถึงปี 2020 ก็ยังไม่มีวัคซีนรักษาหรือป้องกันโรคซาร์สที่แสดงว่าปลอดภัยและมีประสิทธิผลในมนุษย์[23][24]
โรคเมอร์สก็ยังไม่มีวัคซีนด้วย[25] เมื่อโรคเมอร์สกำลังระบาด เชื่อกันว่า งานวิจัยเกี่ยวกับโรคซาร์สที่ได้ทำแล้วอาจเป็นโครงแบบที่มีประโยชน์เพื่อพัฒนาวัคซีนและพัฒนาวิธีการรักษาโรค[23][26] จนถึงเดือนมีนาคม 2020 มีวัคซีนโรคเมอร์สชนิดหนึ่ง (อาศัยดีเอ็นเอ) ที่ได้ผ่านการทดลองทางคลินิกระยะที่ 1 กับมนุษย์แล้ว[27] และมีวัคซีนอีก 3 อย่างที่กำลังอยู่ในกระบวนการโดยทั้งหมดเป็นวัคซีนมีไวรัสเป็นเวกเตอร์, 2 อย่างมีอะดีโนไวรัส (ChAdOx1 nCoV-19, BVRS-GamVac) เป็นเวกเตอร์ และอีกอย่างมี modified vaccinia Ankara (MVA) เป็นเวกเตอร์[28]
การพัฒนาวัคซีนโควิดในปี 2020[แก้]
ในอดีตยังไม่เคยมีวัคซีนป้องกันโรคติดเชื้อที่สามารถพัฒนาได้จนสำเร็จอย่างรวดเร็วภายในเวลาไม่กี่ปี และวัคซีนป้องกันไวรัสโคโรนาสำหรับใช้ในมนุษย์ก็ยังไม่เคยมีผลิตมาก่อน[29] หลังจากได้พบโรคปอดบวมเหตุไวรัสโคโรนาแบบใหม่เมื่อเดือนธันวาคม 2019[30] ก็ได้ตีพิมพ์ลำดับยีนของโควิด-19 เมื่อวันที่ 11 มกราคม 2020 ซึ่งจุดชนวนการตอบสนองฉุกเฉินในระดับนานาชาติเพื่อเตรียมรับโรคระบาดและเร่งพัฒนาวัคซีนป้องกันโรค[31][32][33]
ในปลายเดือนกุมภาพันธ์ 2020 องค์การอนามัยโลกคาดว่า จะมีวัคซีนป้องกันไวรัสโคโรนาสายพันธุ์ใหม่ (SARS-CoV-2) ที่เป็นเหตุของโรคอย่างเร็วก็ใช้เวลา 18 เดือน[34] อัตราการติดเชื้อที่เพิ่มขึ้นอย่างรวดเร็วของโควิดทั่วโลกเมื่อต้นปี 2020 ได้กระตุ้นให้ก่อพันธมิตรระดับนานาชาติและกระตุ้นให้รัฐระดมทรัพยากรเพื่อพัฒนาวัคซีนหลายชนิดในระยะเวลาสั้น ๆ[35] จึงมีวัคซีนแคนดิเดต 4 อย่างที่เริ่มการทดลองในมนุษย์ในเดือนมีนาคม (ดูตารางการทดลองทางคลินิกที่เริ่มในปี 2020 ต่อไป)[31][36]
องค์การอนามัยโลกประเมินค่าใช้จ่ายทั้งหมดถึง 8,000 ล้านดอลลาร์สหรัฐ (ประมาณ 250,000 ล้านบาท) เพื่อพัฒนาวัคซีนสามอย่างหรือมากกว่าที่มีเทคโนโลยีและการจัดจำหน่ายต่าง ๆ กันเพื่อระงับการระบาดของโควิดทั่วโลก[35] จนถึงเดือนเมษายน 2020 ก็มี "บริษัทและสถาบันเกือบ 80 แห่งใน 19 ประเทศ" ที่กำลังดำเนินการอันเสมือนกับสถานการณ์ตื่นทองนี้แล้ว[37] ในเดือนเมษายนเช่นกัน เซพี (CEPI) ได้ประเมินว่าอาจมีวัคซีนแคนดิเดตต้านโรคโควิดถึง 6 อย่าง ที่พันธมิตรนานาชาติควรเลือกพัฒนาให้ผ่านการทดลองทางคลินิกระยะที่ 2–3 และ 3 อย่างควรช่วยลดระเบียบราชการที่จุกจิกเกินไปให้ผ่านการตรวจสอบของรัฐและการตรวจสอบคุณภาพได้ โดยจะมีค่าใช้จ่ายอย่างน้อยถึง 2 พันล้านดอลลาร์สหรัฐ (ประมาณ 62,851 ล้านบาท)[38][36][29] ส่วนงานวิเคราะห์อีกงานหนึ่งประเมินว่า จะต้องพัฒนาวัคซีนแคนดิเดตในเบื้องต้นพร้อม ๆ กัน 10 อย่างก่อนจะเลือกเพียงไม่กี่อย่างเพื่อพัฒนาจนถึงให้อนุมัติได้[29]
ในเดือนกรกฎาคม 2020 ศูนย์ความมั่นคงไซเบอร์แห่งชาติสหราชอาณาจักร บวกกับหน่วยงานความมั่นคงการสื่อสารต่าง ๆ ของแคนาดา สำนักงานความมั่นคงโครงสร้างพื้นฐานแห่งความมั่นคงไซเบอร์สหรัฐ (Cybersecurity Infrastructure Security Agency) และสำนักงานความมั่นคงแห่งชาติสหรัฐ ได้ร่วมกันกล่าวหาว่านักเลงคอมพิวเตอร์ที่ประเทศรัสเซียสนับสนุนได้พยายามขโมยงานวิจัยเกี่ยวกับการรักษาและวัคซีนโควิดจากสถาบันวิชาการและสถาบันยาในประเทศต่าง ๆ แต่รัสเซียก็ได้ปฏิเสธข้อกล่าวหานี้[39]
การพัฒนาทั่วโลก[แก้]
ในช่วงปี 2020 ความเปลี่ยนแปลงสำคัญของการพัฒนาวัคซีนโควิดจากต้นปีก็คือ การเพิ่มการร่วมมือกันระหว่างบริษัทยาข้ามชาติกับรัฐบาลของประเทศต่าง ๆ, รูปแบบบริษัทและจำนวนบริษัทเทคโนโลยีชีวภาพในประเทศต่าง ๆ ที่ได้เล็งความสนใจไปที่วัคซีนโควิด[38] ตามเซพี เมื่อจำแนกตามภูมิภาค องค์กรที่พัฒนาวัคซีนโควิดร้อยละ 40 อยู่ในทวีปอเมริกาเหนือเทียบกับร้อยละ 30 ในเอเชียและออสเตรเลียร้อยละ 26 ในยุโรป โดยมีโครงการจำนวนน้อยในอเมริกาใต้และแอฟริกา[38][31]
Access to COVID-19 Tools (ACT) Accelerator และโคแว็กซ์[แก้]
องค์กรนานาชาติรวมทั้งองค์การอนามัยโลก, เซพี (Coalition for Epidemic Preparedness Innovations, CEPI), กาวี, มูลนิธิบิลและเมลินดาเกตส์ และรัฐบาลต่าง ๆ ได้ก่อตั้งโครงการ "Access to COVID-19 Tools (ACT) Accelerator" เพื่อหาเงินทุน เร่งการวิจัยและพัฒนา การผลิต และการเข้าถึงอย่างยุติธรรมทั่วโลกสำหรับชุดตรวจโควิด วิธีการรักษา และการได้ใบอนุญาตเพื่อผลิตวัคซีน โดยมีโปรแกรมพัฒนาโดยเฉพาะที่เรียกว่า โคแว็กซ์ (COVAX Pillar)[40][41] โคแว็กซ์มุ่งอำนวยให้ได้ใบอนุญาตเพื่อผลิตวัคซีนโควิดหลายอย่าง มุ่งให้มีราคาที่ยุติธรรม มุ่งให้ได้วัคซีนถึง 2,000 ล้านโดสไม่เกินปลายปี 2021 เพื่อป้องกันบุคลากรทางแพทย์ผู้เป็นหน่วยหน้าและคนที่เสี่ยงมากที่สุด โดยเฉพาะสำหรับประเทศที่มีรายได้ต่ำจนถึงปานกลาง[42][43] (รวมทั้งประเทศไทย)
จนถึงเดือนธันวาคม 2020 โครงการ ACT Accelerator รวม ๆ แล้วได้เงินทุนมา 2,400 ล้านดอลลาร์สหรัฐ (ประมาณ 75,000 ล้านบาท) มีวัคซีนแคนดิเดต 9 อย่างที่ได้เงินทุนจากโคแว็กซ์และเซพี จึงจัดเป็นกลุ่มที่มีวัคซีนโควิดมากที่สุด โดยมีประเทศ 189 ประเทศ ตกลงว่าจะร่วมแผนการผลิตจัดส่งวัคซีนในที่สุด[44][45] ในต้นปี 2020 องค์การอนามัยโลกได้ออกสื่อสัญญาณต่อเนื่องซึ่งได้สัญญาว่าจะได้เงิน 8,000 ล้านดอลลาร์สหรัฐ (ประมาณสองแสนแปดหมื่นล้านบาท) จากประเทศ 40 ประเทศเพื่อสนับสนุนการเร่งพัฒนาวัคซีน[46]
ในเดือนกรกฎาคม องค์การประกาศว่าประเทศ 165 ประเทศ ซึ่งมีประชากรทั้งหมดร้อยละ 60 ของทั้งโลกได้ตกลงกับแผนการของโคแว็กซ์เพื่อให้แจกจำหน่ายวัคซีนที่ได้อย่างยุติธรรมและเท่าเทียมกัน ซึ่งรับประกันว่าประเทศที่เข้าร่วมแต่ละประเทศจะได้ส่วนแบ่งวัคซีนเพื่อให้แก่ประชากรที่เสี่ยงสุดร้อยละ 20 ของประเทศไม่เกินปลายปี 2021[47]
ส่วนองค์กรการร่วมมืองานวิจัยโลกเพื่อความเตรียมพร้อมต่อโรคติดต่อ (Global Research Collaboration for Infectious Disease Preparedness) กำลังทำงานอย่างใกล้ชิดกับองค์การอนามัยโลกและประเทศสมาชิกเพื่อจัดลำดับความจำเป็นในการได้ทุนของงานวิจัยต่าง ๆ เพื่อประสานงานระหว่างองค์กรนานาชาติผู้ให้ทุนกับองค์กรที่ทำงานวิจัย เพื่ออัปเดตข้อมูลเกี่ยวกับความก้าวหน้าของวัคซีน และเพื่อหลีกเลี่ยงการให้ทุนซ้ำซ้อน[48][49] ส่วนสหพันธ์โรคทางเดินหายใจเฉียบพลันรุนแรงและการติดเชื้ออุบัติใหม่ (International Severe Acute Respiratory and Emerging Infection Consortium ตัวย่อ ISARIC) ก็กำลังจัดระเบียบและเผยแพร่ข้อมูลงานวิจัยเกี่ยวกับโควิดเพื่อให้เกิดผลต่อนโยบายสาธารณสุขของรัฐในเรื่องการแจกจำหน่ายวัคซีนที่จะได้[50]
ในวันที่ 4 มิถุนายน มีงานประชุมสุดยอดเสมือนที่ประสานงานจากกรุงลอนดอน มีผู้แทนจากองค์กรของรัฐและเอกชนจากประเทศ 52 ประเทศ รวมทั้งประมุขแห่งรัฐ 35 ท่านจากประเทศกลุ่ม 7 และกลุ่ม 20 เพื่อระดมเงิน 8,800 ล้านดอลลาร์สหรัฐ (ประมาณสองแสนแปดหมื่นล้านบาท) เพื่อสนับสนุนให้กาวี (พันธมิตรโลกเพื่อวัคซีนและการให้ภูมิคุ้มกัน) เตรียมให้วัคซีนโควิดแก่เด็ก 300 ล้านคนในประเทศด้อยพัฒนาตลอดจนถึงปี 2025[51] ผู้บริจาครายใหญ่รวมทั้งมูลนิธิบิลและเมลินดาเกตส์ (1,600 ล้านดอลลาร์สหรัฐหรือประมาณห้าหมื่นล้านบาท)[52] และสหราชอาณาจักร (330 ล้านปอนด์สเตอร์ลิงต่อปีเป็นเวลา 5 ปีรวมเป็นเงินประมาณหกหมื่นหกพันล้านบาท)[51]
ในเดือนธันวาคม มูลนิธิบิลและเมลินดาเกตส์บริจาคทรัพย์อีก 250 ล้านดอลลาร์สหรัฐ (ประมาณเจ็ดพันแปดร้อยล้านบาท) ให้แก่ ACT Accelerator เพื่อ "สนับสนุนการส่งชุดตรวจโควิด-19 การรักษา และวัคซีนใหม่ ๆ โดยเฉพาะแก่ประเทศมีรายได้ต่ำและปานกลาง" ในช่วงปี 2021 จึงรวมการบริจาคทรัพย์เกี่ยวกับโควิดของมูลนิธิเป็น 1,750 ล้านดอลลาร์สหรัฐ (ประมาณ 55,000 ล้านบาท)[53][54]
เซพี[แก้]
เซพี (Coalition for Epidemic Preparedness Innovations, CEPI) เป็นองค์กรนานาชาติที่จัดตั้งขึ้นในปี 2017 มุ่งทำงานร่วมกับเจ้าหน้าที่สาธารณสุขและผู้พัฒนาวัคซีนนานาชาติเพื่อพัฒนาวัคซีนป้องกันโรคระบาดต่าง ๆ[43] เซพีได้จัดตั้งกองทุน 2,000 ล้านดอลลาร์สหรัฐ (ประมาณ 64,600 ล้านบาท) โดยเป็นหุ้นส่วนทั่วโลกกับองค์กรของรัฐ เอกชน การกุศล กับประชาสังคมเพื่อเร่งวิจัยและทดลองวัคซีนแคนดิเดตสำหรับโควิด 9 อย่าง โดยมีเป้าหมายให้มีหลายอย่างพัฒนาจนได้อนุมัติภายในปี 2020–21[38][36][44] สหราชอาณาจักร แคนาดา เบลเยียม นอร์เวย์ สวิตเซอร์แลนด์ เยอรมนี และเนเธอร์แลนด์ได้บริจาคเงิน915 ล้านดอลลาร์สหรัฐ (ประมาณสองหมื่นเก้าพันล้านบาท) แก่เซพีแล้วในต้นเดือนพฤษภาคม[46][55] ส่วนมูลนิธิบิลและเมลินดาเกตส์ ซึ่งมีเป้าหมายในด้านการวิจัยและการแจกจำหน่ายวัคซีน ได้บริจาคเงิน 250 ล้านดอลลาร์สหรัฐ (ประมาณเจ็ดพันเก้าร้อยล้านบาท) ให้แก่องค์การเพื่องานวิจัยและการให้การศึกษาแก่สาธารณชนในเรื่องวัคซีนโควิด[56][57]
ตลอดการระบาดทั่วปี 2020 เซพีได้ให้เงินทุนพัฒนาวัคซีนแคนดิเดต 9 อย่างโดยตั้งใจให้มีเทคโนโลยีวัคซีนหลายหลากต่าง ๆ กันเพื่อลดความเสี่ยงการล้มเหลวซึ่งปกติจะสูงเมื่อพัฒนาวัคซีน[44][58] จนถึงเดือนธันวาคม องค์กรและโปรแกรมการวิจัยที่ได้การสนับสนุนจากเซพีรวมแอสตร้าเซนเนก้า/มหาวิทยาลัยออกซฟอร์ด (AZD1222), Clover Biopharmaceuticals (SCB-2019), CureVac (Zorecimeran/CVnCoV), Inovio (INO-4800), สถาบันปาสเตอร์ (MV-SARS-CoV-2), โมเดอร์นา (mRNA-1273), Novavax (NVX-CoV2373), SK bioscience (GBP510), และมหาวิทยาลัยฮ่องกง[44][59][60]
รัฐบาลของประเทศ[แก้]
รัฐบาลของประเทศที่จัดงบประมาณเพื่อลงทุนในประเทศและต่างประเทศเกี่ยวกับงานวิจัยวัคซีน งานพัฒนา และการผลิตเริ่มต้นในปี 2020 รวมทั้งรัฐบาลกลางของแคนาดา ซึ่งประกาศทุน 275 ล้านดอลลาร์แคนาดา (ประมาณหกพันสี่ร้อยล้านบาท) สำหรับโครงการงานวิจัยวัคซีน 96 โครงการ ทั้งในบริษัทและในมหาวิทยาลัย โดยมีแผนจะสร้าง "ธนาคารวัคซีน" เพื่อฝากวัคซีนไว้หลายอย่างที่สามารถใช้ถ้าโรคระบาดอีก[61][62] ยังมีการลงทุนเพิ่มอีก 1,100 ล้านดอลลาร์แคนาดา (ประมาณสองหมื่นหกพันล้านบาท) เพื่อสนับสนุนการทดลองทางคลินิกในแคนาดาแล้วพัฒนาโซ่การผลิตและการแจกจำหน่ายสำหรับวัคซีน[49] วันที่ 4 พฤษภาคม รัฐบาลแคนาดาจัดงบประมาณ 850 ล้านดอลลาร์แคนาดา (ประมาณสองหมื่นล้านบาท) ให้แก่องค์การอนามัยโลกเนื่องกับการออกสื่อสัญญาณต่อเนื่องเพื่อระดมทุน 8,000 ล้านดอลลาร์สหรัฐให้วัคซีนโควิด[63]

ในประเทศจีน รัฐบาลได้ให้เงินกู้มีดอกเบี้ยต่ำแก่ผู้พัฒนาวัคซีนผ่านธนาคารกลาง และหาที่ดินให้เพื่อให้บริษัทสร้างโรงงานผลิตวัคซีน[55] จนถึงเดือนมิถุนายน 2020 วัคซีนแคนดิเดต 6 อย่างจาก 11 อย่างที่กำลังทดสอบเบื้องต้นในมนุษย์มาจากองค์กรของจีน[56] บริษัทวัคซีนและสถาบันวิจัย 3 แห่งได้เงินสนับสนุนจากรัฐบาลจีนเพื่อการวิจัย เพื่อการทดลองทางคลินิก และการผลิตวัคซีนซึ่งดีที่สุด โดยให้ความสำคัญกับการได้หลักฐานประสิทธิศักย์ของวัคซีนเร็ว ๆ ยิ่งกว่าความปลอดภัย[64] วันที่ 18 พฤษภาคม จีนได้สัญญาว่าจะให้เงิน 2 พันล้านดอลลาร์สหรัฐ (ประมาณหกหมื่นสามพันล้านบาท) เพื่อสนับสนุนงานขององค์การอนามัยโลกเพื่อกำจัดโควิด[65] วันที่ 22 กรกฎาคม จีนได้ประกาศว่าจะให้เงินกู้ 1 พันล้านดอลลาร์สหรัฐ (ประมาณ 32,000 ล้านบาท) เพื่อให้ประเทศต่าง ๆ ในลาตินอเมริกาและแคริบเบียนสามารถซื้อวัคซีนจากจีนได้[66] วันที่ 24 สิงหาคม นายกรัฐมนตรีจีนหลี่ เค่อเฉียงประกาศว่า จะแจกจำหน่ายวัคซีนของจีนให้แก่ประเทศเอเชียอาคเนย์ 5 ประเทศ คือกัมพูชา ลาว เมียนมาร์ ไทยและเวียดนาม ก่อนอื่นเมื่อได้วัคซีนแล้ว[67]
ในบรรดาประเทศสหภาพยุโรป เมื่อเดือนพฤษภาคม ฝรั่งเศสประกาศการลงทุน 4.9 ล้านดอลลาร์สหรัฐ (ประมาณร้อยห้าสิบสี่ล้านบาท) ในสหพันธ์การวิจัยวัคซีนโควิดผ่านเซพี ที่องค์กรต่าง ๆ รวมทั้งสถาบันปาสเตอร์ (ฝรั่งเศส), Themis Bioscience (ออสเตรีย) และมหาวิทยาลัยพิตต์สเบิร์ก (สหรัฐ) จะมีบทบาท ซึ่งเพิ่มทุนการพัฒนาวัคซีนโควิดของ CEPI เป็น 480 ล้านดอลลาร์สหรัฐ (ประมาณหมื่นห้าพันล้านบาท) [68][69] ในเดือนมีนาคม คณะกรรมาธิการยุโรปได้ลงทุน 80 ล้านยูโร (ประมาณ 2,769 ล้านบาท) กับ CureVac ซึ่งเป็นบริษัทเทคโนโลยีชีวภาพของเยอรมนีเพื่อพัฒนาวัคซีนแบบเอ็มอาร์เอ็นเอ[70] ส่วนรัฐบาลเยอรมันเองก็ได้ลงทุนต่างหากกับบริษัทอีก 300 ล้านยูโร (ประมาณหมื่นสี่พันล้านบาท) ในเดือนมิถุนายน[71] เบลเยียม นอร์เวย์ สวิตเซอร์แลนด์ เยอรมนี และเนเธอร์แลนด์เป็นผู้บริจาครายสำคัญให้แก่ CEPI เพื่อวิจัยวัคซีนโควิดในยุโรป[55]
ในเดือนเมษายน รัฐบาลสหราชอาณาจักรก่อตั้งคณะกรรมการวัคซีนโควิดเฉพาะกิจเพื่อเร่งพัฒนาวัคซีนผ่านการร่วมงานระหว่างอุตสาหกรรม มหาวิทยาลัย กับองค์กรต่าง ๆ ของรัฐตลอดขั้นตอนการพัฒนาวัคซีน รวมทั้งกำหนดโรงพยาบาลในประเทศเพื่อทำการทดลองทางคลินิก กฎการอนุมัติ และการผลิตในที่สุด[72] โครงการริเริ่มพัฒนาวัคซีนที่มหาวิทยาลัยออกซฟอร์ดและอิมพิเรียลคอลเลจลอนดอนได้รับงบประมาณ 44 ล้านปอนด์สเตอร์ลิง (ประมาณพันแปดร้อยล้านบาท) ในเดือนเมษายน[73][74]
สำนักงานวิจัยและพัฒนาทางชีวเวชขั้นสูงสหรัฐ (Biomedical Advanced Research and Development Authority ตัวย่อ BARDA อ่านว่า บาร์ดา) เป็นองค์กรของรัฐบาลกลางสหรัฐที่ให้ทุนกับเทคโนโลยีรักษาโรค ได้ประกาศลงทุนเกือบ 1,000 ล้านดอลลาร์สหรัฐ (ประมาณสามหมื่นหนึ่งพันล้านบาท) เพื่อสนับสนุนการพัฒนาวัคซีนโควิด และเตรียมตัวผลิตวัคซีนแคนดิเดตที่มีหวังที่สุดในสหรัฐ วันที่ 16 เมษายน บาร์ดาลงทุน 483 ล้านดอลลาร์สหรัฐ (ประมาณหมื่นห้าพันล้านบาท) กับบริษัทโมเดอร์นา (Moderna) และหุ้นส่วนคือจอห์นสันแอนด์จอห์นสัน[55][75] บาร์ดายังมีงบประมาณอีก4,000 ล้านดอลลาร์สหรัฐ (ประมาณแสนสามหมื่นล้านบาท) สำหรับพัฒนาวัคซีน ดังนั้น จึงอาจลงทุนพัฒนาวัคซีนแคนดิเดตได้ถึง 6–8 อย่างที่จะทดลองทางคลินิกในปี 2020–2021 โดยบริษัทต่าง ๆ เช่น Sanofi Pasteur (ฝรั่งเศส) และ Regeneron (สหรัฐ)[75][76]
ในวันที่ 15 พฤษภาคม รัฐบาลกลางสหรัฐได้ประกาศให้งบประมาณกับโปรแกรมเร่งด่วนคือ Operation Warp Speed (แปลได้ว่า ปฏิบัติการความเร็วเหนือแสง) โดยมุ่งให้เริ่มทดลองวัคซีนแคนดิเดตทางคลินิกในช่วงฤดูใบไม้ร่วงปี 2020 แล้วผลิตวัคซีนที่ได้อนุมัติ 300 ล้านโดสให้ได้ในเดือนมกราคม 2021 ผู้นำโปรแกรมนี้เป็นนายพลทหารบกสหรัฐ ในเดือนมิถุนายน ผู้นำโปรแกรมแจ้งว่า จะทำงานร่วมกับบริษัท 7 บริษัทที่กำลังพัฒนาวัคซีนแคนดิเดตสำหรับโควิด คือ โมเดอร์นา จอห์นสันแอนด์จอห์นสัน เมอร์ค ไฟเซอร์ และมหาวิทยาลัยออกซฟอร์ดที่ร่วมมือกับบริษัทแอสตร้าเซนเนก้า บวกกับบริษัทอีกสองบริษัท[77] แม้บริษัทไฟเซอร์ภายหลังจะระบุว่า "บริษัทไม่ได้ยอมรับเงินทุน (จากรัฐ)... การลงทุนเพื่อวิจัยและพัฒนาของไฟเซอร์ทั้งหมดเป็นการเสี่ยง"[78]
การทดลองขององค์การอนามัยโลก[แก้]
ในเดือนเมษายน 2020 องค์การอนามัยโลกได้ตีพิมพ์แผนการวิจัยและพัฒนาไวรัสโคโรนาใหม่ ซึ่งเตรียมแผน "การวิจัยทางคลินิกขนาดใหญ่ ทำในระดับนานาชาติ มีศูนย์หลายศูนย์ ทำแบบสุ่ม มีกลุ่มควบคุม" เพื่อให้สามารถ "ประเมินประโยชน์และความเสี่ยงของวัคซีนแคนดิเดตแต่ละอย่างพร้อม ๆ กันภายใน 3–6 เดือนที่มีให้ใช้ทดลอง" แผนการนี้มี "โพรไฟล์ผลิตภัณฑ์เป้าหมาย" (Global Target Product Profile ตัวย่อ TPP) ซึ่งจำแนกคุณสมบัติของวัคซีนที่ปลอดภัยและมีประสิทธิผลไว้เป็น 2 หมวด คือ "วัคซีนเพื่อการป้องกันในระยะยาวสำหรับบุคคลที่เสี่ยงโควิดสูงกว่า เช่น บุคลากรทางการแพทย์" และวัคซีนอื่น ๆ ที่ให้ภูมิคุ้มกันอย่างรวดเร็วเมื่อเกิดการระบาดใหม่[35]
องค์การยังได้จัดตั้งทีมนานาชาติ คือ ทีพีพี (TPP) ขึ้นเพื่อ
- ประเมินการพัฒนาวัคซีนแคนดิเดตที่มีอนาคตมากสุด
- สร้างข้อมูล/แผนที่เกี่ยวกับวัคซีนแคนดิเดตและการทดลองทางคลินิกของวัคซีนทั่วโลก แล้วตีพิมพ์อัปเดตแผนของวัคซีนโดยอัปเดตบ่อย ๆ[79]
- ประเมินและตรวจคัดวัคซีนแคนดิเดตที่มีอนาคตมากสุดพร้อม ๆ กันอย่างเร็วก่อนจะทดสอบในมนุษย์
- ออกแบบและประสานการทดลองแบบสุ่มและมีกลุ่มควบคุม มีหลายศูนย์ และทำในระดับนานาชาติซึ่งเรียกว่าการทดลองซอลิแดริตี (Solidarity trial)[35][80] เพื่อให้สามารถประเมินประโยชน์และความเสี่ยงของวัคซีนแคนดิเดตต่าง ๆ ที่กำลังทดลองทางคลินิกในประเทศที่มีอัตราการติดโรคโควิดสูง แล้วตีความและแชร์ผลที่ได้อย่างรวดเร็วทั่วโลก[35]
ทีมนานาชาตินี้จะจัดลำดับความสำคัญว่า วัคซีนใดควรเข้าสู่การทดลองทางคลินิกระยะที่ 2 และ 3 และระบุโพรโทคอล/เกณฑ์วิธีของการทดลองระยะ 3 แบบเข้ากันได้สำหรับวัคซีนทั้งหมดที่เข้าสู่ระยะก่อนได้รับอนุมัตินี้[35]
แบบทดลองที่ปรับได้สำหรับการทดลองซอลิแดริตี[แก้]
แบบทดลองทางคลินิกที่กำลังทำอยู่อาจปรับได้โดยเรียกว่าเป็น "adaptive design" (แบบปรับได้) ถ้าข้อมูลที่ได้ในการทดลองให้ความชัดเจนตั้งแต่เนิ่น ๆ เกี่ยวกับประสิทธิผลของวัคซีน ไม่ว่าจะบวกหรือลบ[81][82] ดังนั้น การทดลองร่วม (Solidarity trial) ขององค์การอนามัยโลกสำหรับวัคซีนหลายอย่างที่ทดลองทางคลินิกในปี 2020 จะใช้วิธีเช่นนี้เพื่อให้สามารถเปลี่ยนพารามิเตอร์ของการทดลองได้อย่างรวดเร็วในศูนย์ทดลองทุกแห่งเมื่อผลปรากฏ[80] วัคซีนแคนดิเดตใหม่ที่เข้าเกณฑ์ยังอาจเพิ่มเข้าในโปรแกรมการทดลองร่วม และวัคซีนแคนดิเดตที่ปรากฏโดยหลักฐานว่าปลอดภัยหรือมีประสิทธิศักย์ไม่ดีเทียบกับยาหลอกและวัคซีนอื่น ๆ ก็จะยกเลิกทดลองในโปรแกรมนี้[80]
แบบปรับได้ที่ใช้ในการทดลองวัคซีนแคนดิเดตทางคลินิกระยะที่ 2–3 อาจทำให้ระยะการทดลองสั้นลงโดยมีอาสาสมัครผู้รับวัคซีนน้อยกว่า ช่วยเร่งการตัดสินใจไม่ว่าจะหยุดการทดลองตั้งแต่ต้น ๆ หรือตัดสินใจว่ามีผล หลีกเลี่ยงทำการวิจัยซ้ำ ๆ และเพิ่มการประสานงานเพื่อเปลี่ยนแบบการทดลองที่ทำร่วมในศูนย์ประเทศต่าง ๆ[80][81]
หุ้นส่วน การแข่งขัน และการแจกจำหน่าย[แก้]
บริษัทยายักษ์ใหญ่ที่มีประสบการณ์ผลิตวัคซีนเป็นจำนวนมาก ๆ รวมทั้งจอห์นสันแอนด์จอห์นสัน แอสตร้าเซนเนก้า และแกล็กโซสมิธไคลน์ กำลังสร้างพันธมิตรกับบริษัทเทคโนโลยีชีวภาพ รัฐบาลของประเทศต่าง ๆ และมหาวิทยาลัยเพื่อเร่งการพัฒนาวัคซีนที่มีประสิทธิภาพ[56][55] เพื่อรวมสมรรถภาพทางการเงินและการผลิตเพื่อสร้างเทคโนโลยีวัคซีนโรคระบาดทั่วแบบใช้ตัวเสริม (adjuvant) แกล็กโซสมิธไคลน์จึงได้จับมือกับซาโนฟี่ ซึ่งเป็นหุ้นส่วนแบบที่ไม่ค่อยทำกันระหว่างบริษัทยักษ์ใหญ่นานาชาติเพื่อเร่งพัฒนาวัคซีน[83]
เมื่อโควิด-19 กำลังระบาดไปทั่วอย่างรวดเร็วในปี 2020 องค์การนานาชาติเช่นองค์การอนามัยโลกและเซพี ผู้พัฒนาวัคซีน รัฐบาล และอุตสาหกรรมก็ได้ประเมินการแจกจำหน่ายวัคซีนที่จะได้[35] ประเทศผลิตวัคซีนแต่ละประเทศอาจถูกโน้มน้าวให้ขายวัคซีนในราคาสูงสุด หรือใช้วัคซีนในประเทศของตนก่อน[32][29][55] ผู้เชี่ยวชาญเน้นว่า วัคซีนที่จะอนุมัติควรมีราคาที่พอซื้อได้และมีให้สำหรับบุคคลหน่วยหน้าในการรักษาพยาบาลและคนที่จำเป็นมากสุด[32][29][55] ในเดือนเมษายน เดอะเดลีเทลิกราฟ (ลอนดอน) รายงานว่า สหราชอาณาจักรได้ตกลงทำการร่วมกับประเทศและองค์กรนานาชาติอื่น ๆ รวมทั้งประเทศฝรั่งเศส เยอรมนี และอิตาลีเพื่อค้นหาวัคซีนและแชร์ผลที่ได้ และตกลงว่า ประชาชนอังกฤษจะไม่ได้รับสิทธิพิเศษเพื่อได้วัคซีนโควิดที่มหาวิทยาลัยอังกฤษซึ่งได้รับเงินภาษีของประชาชนเป็นผู้พัฒนาขึ้น[73] บริษัทหลายแห่งมีแผนผลิตวัคซีนเพื่อเริ่มต้นขายในราคาถูก แล้วเพิ่มราคาเพื่อให้ได้กำไรภายหลังถ้าต้องฉีดวัคซีนทุกปีและเมื่อประเทศต่าง ๆ ตุนวัคซีนเผื่ออนาคต[55]
องค์การอนามัยโลกและเซพีกำลังสร้างทรัพยากรทางการเงินและแนวปฏิบัติเพื่อส่งวัคซีนที่มีประสิทธิผล 3 อย่างหรือยิ่งกว่าไปทั่วโลก โดยสำนึกว่าประเทศต่าง ๆ และประชากรกลุ่มต่าง ๆ ย่อมจำเป็นต่างกัน[31][35][36][80] ยกตัวอย่างเช่น วัคซีนที่มีประสิทธิผลน่าจะจัดก่อนอื่นให้แก่บุคลากรทางแพทย์และกลุ่มประชากรที่เสี่ยงป่วยหนักและเสี่ยงตายมากสุดจากการติดโรค เช่น คนชราหรือคนจนที่อยู่ในชุมชนแออัด[84][85] ทั้งองค์การอนามัยโลก เซพี และกาวีต่างก็ได้แสดงความเป็นห่วงว่า ประเทศร่ำรวยไม่ควรได้วัคซีนโควิดก่อนประเทศอื่น ๆ แต่ควรพิจารณาความจำเป็นในหมู่ประชากรและความจำเป็นเพื่อลดปัญหาทางเศรษฐกิจ[31][36][84]
กำหนดเวลาต่าง ๆ ที่ต้องย่อลง[แก้]
ประเด็นต่าง ๆ ทางภูมิรัฐศาสตร์ ปัญหาของกลุ่มประชากรที่อ่อนแอ และปัญหาการผลิตวัคซีนเป็นพัน ๆ ล้านโดสล้วนอาจกดดันให้ย่อกำหนดเวลาต่าง ๆ ในการพัฒนาวัคซีนและในบางกรณี อาจรวมระยะการทดลองทางคลินิกหลายระยะเข้าด้วยกันแล้วทำพร้อม ๆ กันโดยใช้เวลาแค่เดือน ๆ ซึ่งปกติต้องทำเป็นลำดับต่อ ๆ กันเป็นปี ๆ[56] ยกตัวอย่างเช่น ผู้พัฒนาวัคซีนประเทศจีนและศูนย์ควบคุมและป้องกันโรคจีน (Chinese Center for Disease Control and Prevention) ได้เริ่มงานพัฒนาวัคซีนในเดือนมกราคม 2020[86] แต่เพียงแค่ถึงเดือนมีนาคม ก็กำลังตรวจดูวัคซีนแคนดิเดตเป็นจำนวนมากโดยใช้กำหนดเวลาที่ย่อลง และมีจุดประสงค์เพื่อแสดงความแข็งแกร่งของเทคโนโลยีจีนเหนือของสหรัฐ และเพื่อให้ชาวจีนมั่นใจถึงคุณภาพวัคซีนที่ผลิตในจีน[56][87]
เพื่อเร่งพัฒนาวัคซีนในกำหนดเวลาย่อ ๆ สำหรับโรคระบาดทั่ว ทั้งผู้พัฒนาวัคซีนและรัฐบาลได้ยอมรับความเสี่ยงเมื่อลัดวงจรพัฒนาวัคซีนปกติ[55] ผู้บริหารของอุตสาหกรรมคนหนึ่งถึงกับกล่าวว่า "วิกฤติการณ์ของโลกใหญ่จนกระทั่งเราแต่ละคนจะต้องยอมเสี่ยงที่สุดเดี๋ยวนี้เพื่อยุติโรคนี้"[55] มีเรื่องที่ต้องพิจารณาหลายเรื่องรวมทั้งระดับความเป็นพิษที่ยอมรับได้ (คือความปลอดภัย) การตั้งเป้าที่กลุ่มประชากรที่อ่อนแอ ความก้าวหน้าอย่างมากของประสิทธิศักย์วัคซีนที่ต้องมี ระยะการป้องกันของวัคซีน ระบบการส่งยาพิเศษ (เช่น ให้ทางปากหรือทางจมูก แทนที่จะฉีด) ขนาดการให้ยา ความเสถียรของวัคซีนและวิธีการเก็บในคลัง การอนุมัติให้ใช้เป็นการฉุกเฉินก่อนได้รับอนุมัติทั่วไป วิธีการผลิตดีที่สุดเพื่อให้ได้วัคซีนเป็นพัน ๆ ล้านโดส และการแจกจำหน่ายวัคซีนที่ได้อนุมัติ[29][88] ถ้านับเริ่มจากการทดลองทางคลินิกระยะที่ 1 วัคซีนถึงร้อยละ 84–90 ล้มเหลวในช่วงพัฒนาการแล้วไม่ได้รับอนุมัติให้วางตลาดขาย[31][89] ถ้าเริ่มจากการทดลองทางคลินิกระยะที่ 3 วัคซีนร้อยละ 25.7 ล้มเหลวและไม่ได้รับอนุมัติโดยที่สุด[89] ผู้ผลิตวัคซีนอาจจะลงทุนไปแล้วเกิน 1,000 ล้านดอลลาร์สหรัฐ (ประมาณสามหมื่นหนึ่งพันล้านบาท) โดยได้ผลิตวัคซีนเป็นล้าน ๆ โดสไปแล้วที่ใช้ไม่ได้[29][56][55] ในกรณีของโควิด-19 โดยเฉพาะ ประสิทธิศักย์ของวัคซีนที่อัตราร้อยละ 70 อาจพอระงับการระบาดทั่ว เพราะถ้ามีประสิทธิศักย์เพียงร้อยละ 60 การระบาดก็ยังอาจต่อไปได้ และประสิทธิศักย์ที่น้อยกว่าร้อยละ 60 จะไม่ก่อภูมิคุ้มกันหมู่พอระงับการกระจายเชื้อโดยตนเอง[29]
โรคที่ระบาดทั่วในปี 2020 ได้สร้างปัญหากับสถาบันวิจัยเพราะการเว้นระยะห่างทางสังคมและการปิดห้องปฏิบัติการ[90][91] อุปกรณ์เครื่องใช้ที่จำเป็นอย่างยิ่งสำหรับการวิจัยและพัฒนาวัคซีนก็ขาดแคลนขึ้นเรื่อย ๆ เนื่องจากการซื้อแข่งขันกันในระดับนานาชาติหรือการเข้ายึดของรัฐ[64] กำหนดเวลาต่าง ๆ สำหรับการทดลองทางคลินิก ซึ่งปกติเป็นกระบวนการที่ทำเป็นลำดับต่อ ๆ กันโดยใช้เวลาเป็นปี ๆ ก็กำลังย่อเป็นการทดลองตรวจความปลอดภัย ประสิทธิศักย์ และหาขนาดยาที่ทำพร้อม ๆ กันโดยใช้เวลาเป็นแค่เดือน ๆ ซึ่งอาจมีผลต่อความปลอดภัย[56][55]
แพลตฟอร์มเทคโนโลยี[แก้]
ในเดือนกันยายน 2020 นักวิทยาศาสตร์ของเซพีรายงานว่า มีแพลตฟอร์เทคโนโลยี 9 แพลตฟอร์มที่กำลังวิจัยและพัฒนาในช่วงปี 2020 เพื่อสร้างวัคซีนต้านโควิด-19 โดยยังมีวัคซีนแคนดิเดตเป็นจำนวนมากที่ไม่ระบุแพลต์ฟอร์มเทคโนโลยี[38] แพลตฟอร์มโดยมากสำหรับวัคซีนที่อยู่ในช่วงทดลองทางคลินิกจนถึงเดือนกันยายนได้เล็งโปรตีน spike ของไวรัสและรูปแบบต่าง ๆ ของโปรตีนนี้เพื่อใช้เป็นแอนติเจนหลักในการสร้างภูมิคุ้มกันโรค[38] แพลตฟอร์มที่กำลังพัฒนาในปี 2020 รวมเทคโนโลยีกรดนิวคลีอิก (คือ เอ็มอาร์เอ็นเอที่ดัดแปลงนิวคลีโอไซด์ (modRNA) หรือดีเอ็นเอ), เวกเตอร์ไวรัสที่ไม่ขยายพันธุ์, เพปไทด์, โปรตีนจากยีนลูกผสม, ไวรัสโควิดลดฤทธิ์ที่ยังเป็น และไวรัสโควิดเชื้อตาย[92][38][29][31]
เทคโนโลยีวัคซีนที่กำลังพัฒนาเพื่อโควิดหลายอย่างไม่เหมือนกับวัคซีนป้องกันไข้หวัดใหญ่ที่ใช้กันอยู่แล้ว แต่จัดเป็นของใหม่ที่ทำงานเฉพาะเจาะจงกับกลไกการแพร่เชื้อของโควิด[31][92][38][31] เทคโนโลยีที่ใช้ยังอาจเพิ่มความยืดหยุ่นในการจัดการแอนติเจน และบางอย่างอาจมีประสิทธิผลดีกว่าในกลุ่มประชากรย่อยต่าง ๆ รวมทั้งคนชรา เด็ก หญิงมีครรภ์ และคนไข้ที่ภูมิต้านทานอ่อนแอ[38][31]


| สถิติวัคซีนโควิด‑19 สำหรับเทคโนโลยีต่าง ๆ (ก.พ. 2021)[4] | ||||
|---|---|---|---|---|
| เทคโนโลยี[I] | แคนดิเดต | ที่กำลังทดลอง ในมนุษย์ |
ที่ได้อนุมัติใน อย่างน้อย 1 ประเทศ |
ประเทศที่ อนุมัติให้ใช้ |
| เวกเตอร์ไวรัสที่ไม่ขยายพันธุ์[II] | 35 | 4[III] | 4 | 55 |
| ใช้อาร์เอ็นเอ[IV] | 36 | 3[III] | 2 | 42 |
| ไวรัสโควิด-19 เชื้อตาย[V] | 19 | 5[III] | 3 | 25 |
| หน่วยย่อยโปรตีนของไวรัสโควิด-19[VI] | 80 | 4[III] | 1 | 2 |
| ใช้ดีเอ็นเอ[VII] | 23 | 2[III] | 0 | 0 |
| อนุภาคคล้ายไวรัส[VIII] | 19 | 1 | 0 | 0 |
| เวกเตอร์ไวรัสที่ยังขยายพันธุ์[IX] | 23 | 0 | 0 | 0 |
| ไวรัสโควิด-19 เป็น ๆ แต่ลดฤทธิ์แล้ว[X] | 4 | 0 | 0 | 0 |
- ↑ มีวัคซีนแคนดิเดตหลายสิบชนิดที่ไม่ระบุเทคโนโลยี[4]
- ↑ Non-replicating viral vector
- ↑ 3.0 3.1 3.2 3.3 3.4 มีวัคซีนแคนดิเดตหนึ่งอย่างหรือมากกว่าในการทดลองระยะที่ 2 หรือ 2-3
- ↑ RNA-based
- ↑ Inactivated virus
- ↑ Protein subunit
- ↑ DNA-based
- ↑ Virus-like particle
- ↑ Replicating viral vector
- ↑ Live attenuated virus
วัคซีน[แก้]
จนถึงวันที่ 21 ธันวาคม ประเทศ 17 ประเทศ[B] และสหภาพยุโรป[110] ได้อนุมัติให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทคคือ tozinameran เป็นการฉุกเฉิน บาห์เรนยังอนุมัติให้วางตลาดขายฉุกเฉินสำหรับวัคซีน BBIBP-CorV ของบริษัทซิโนฟาร์ม[94] โดยสหรัฐอาหรับเอมิเรตส์ต่อมาก็ได้ทำเช่นกัน[95] ในสหราชอาณาจักรจนถึงวันที่ 16 ธันวาคม คน 138,000 คนได้รับ tozinameran ในอาทิตย์แรกของโปรแกรมการฉีดวัคซีนของประเทศ[111] ในวันที่ 11 ธันวาคม 2020 องค์การอาหารและยาสหรัฐได้อนุญาตให้ใช้ tozinameran เป็นการฉุกเฉิน[112] อีกอาทิตย์ต่อมา ก็ให้อนุญาตเช่นกันกับวัคซีน mRNA-1273 ของบริษัทโมเดอร์นา จึงเป็นประเทศแรกที่อนุญาตให้ใช้วัคซีน 2 อย่างเป็นการฉุกเฉิน[113][114][115]
เซพีจัดระยะการพัฒนาวัคซีนเป็นสามกลุ่ม คือ (1) ระยะการสำรวจ (exploratory) คือการวางแผนและออกแบบวัคซีนโดยไม่มีการประเมินในสิ่งมีชีวิต (2) พรีคลินิก (preclinical) คือการประเมินในสิ่งมีชีวิตและเตรียมตัวผลิตสารประกอบเพื่อจะทดสอบในมนุษย์ หรือ (3) ที่เริ่มทดสอบความปลอดภัยในมนุษย์อาสาสมัครที่สุขภาพดีระยะที่ 1 แล้ว[38] จนถึงกลางเดือนกันยายน มีวัคซีนแคนดิเดต 321 อย่างที่ได้ยืนยันแล้วว่ากำลังทดลองทางคลินิก หรือว่าเป็นโครงการสำรวจหรือพรีคลินิก[38]
การทดลองระยะที่ 1 โดยหลักทดสอบความปลอดภัยและขนาดยาเป็นเบื้องต้นโดยให้ยาแก่อาสาสมัครสุขภาพดีเป็นสิบ ๆ คน ระยะที่ 2 ซึ่งทำหลังประสบความสำเร็จในระยะที่ 1 จะตรวจปฏิกิริยาของภูมิคุ้มกัน, ขนาดของยา (คือตรวจประสิทธิศักย์โดยใช้ค่าวัดของสารบ่งชี้ทางชีวภาพ คือ biomarker) และผลที่ไม่พึงประสงค์ ปกติทำกับคนเป็นร้อย ๆ คน[116][117] การทดลองระยะ 1–2 ทดสอบความปลอดภัยและการตอบสนองของภูมิคุ้มกันในเบื้องต้นโดยจะกำหนดขนาดที่ได้ผลให้แม่นยำด้วย[117] ส่วนการทดลองระยะที่ 3 ปกติจะมีอาสาสมัครมากกว่า มีกลุ่มควบคุม และทดสอบประสิทธิผลป้องกันโรคของวัคซีน (เป็นการทดลองแบบแทรกแซง คือ interventional) และจะเฝ้าสังเกตผลที่ไม่พึงประสงค์เมื่อใช้ขนาดยาที่ดีสุด[116][117] นิยามของความปลอดภัยของวัคซีน ประสิทธิศักย์ จุดยุติทางคลินิก (clinical endpoint) ในการทดลองระยะที่ 3 อาจต่างกันระหว่างบริษัทต่าง ๆ เช่นการนิยามระดับผลข้างเคียง การติดเชื้อ หรือการแพร่เชื้อ และว่า วัคซีนป้องกันการติดเชื้อโควิดแบบรุนแรงหรือแบบปานกลาง[118][119][120]
วัคซีนที่ได้ขึ้นทะเบียนแล้ว[แก้]
- ดูเพิ่มที่รายการขึ้นทะเบียนวัคซีน (ภาษาอังกฤษ)
องค์กรควบคุมของประเทศต่าง ๆ ได้อนุมัติให้ใช้วัคซีน 11 ชนิดเป็นการฉุกเฉิน ในจำนวนนั้น 6 ชนิดได้รับอนุมัติจากองค์กรควบคุมที่องค์การอนามัยโลกจัดว่ามีระเบียบเคร่งครัด (stringent regulatory authorities) อย่างน้อย 1 แห่ง
| วัคซีนแคนดิเดต ผู้พัฒนา/ผู้ให้ทุน |
ของประเทศ | เทคโนโลยี | จำนวนโดส ระยะห่าง |
อุณหภูมิเก็บ | การทดลองก่อนวางตลาด (จำนวนอาสาสมัคร) |
การทดลองหลังวางตลาด (จำนวนอาสาสมัคร) |
|---|---|---|---|---|---|---|
| แอสตร้าเซนเนก้า (Vaxzevria, Covishield) |
สหราชอาณาจักร, สวีเดน | อะดีโนไวรัสของชิมแปนซีที่แปลงเพื่อใช้เป็นเวกเตอร์ (ChAdOx1) |
2 โดส 4-12 สัปดาห์ |
2–8 °C |
ระยะ 3 (30,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอกเพื่อตรวจประสิทธิศักย์ ความปลอดภัย และการตอบสนองของภูมิคุ้มกัน[130] สถานะ - ประสิทธิศักย์อยู่ที่ร้อยละ 76 หลังจากโดสแรกและร้อยละ 81 หลังจากโดสที่สองโดยฉีดห่างกัน 12 สัปดาห์หรือยิ่งกว่า[131] ช่วงเวลาและแหล่ง: พ.ค. 2020 – ส.ค. 2021, บราซิล (5,000),[132] สหราชอาณาจักร, อินเดีย[133] |
ระยะ 4 (10,000) การรักษาที่ไม่ได้จัดกลุ่มโดยสุ่ม[c] ช่วงเวลาและแหล่ง: กพ. 2021-ธค. 2024 ในเดนมาร์ก |
| ไฟเซอร์ (Comirnaty)[d] ไบออนเทค, ไฟเซอร์ |
เยอรมนี สหรัฐ | อาร์เอ็นเอ (เอ็มอาร์เอ็นเอที่ดัดแปลงนิวคลีโอไซด์[e] หุ้มด้วยอนุภาคนาโนที่เป็นลิพิด) | 2 โดส 3-4 สัปดาห์ |
−70±10 °C |
ระยะ 3 (43,998) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก สถานะ - ผลบวกที่พบจากการวิเคราะห์ในระหว่างการทดลองได้ประกาศเมื่อวันที่ 18 พ.ย. 2020[143] แล้วตีพิมพ์ในวันที่ 10 ธ.ค. 2020 โดยรายงานประสิทธิศักย์ทั่วไปถึงร้อยละ 95[144][145] ช่วงเวลาและแหล่ง: ก.ค. 2020 – พ.ย. 2020,[146][147] เยอรมนี สหรัฐ |
ระยะ 4 (10,000) การรักษาที่ไม่ได้จัดกลุ่มโดยสุ่ม[c] ช่วงเวลาและแหล่ง: กพ. 2021 – ธค. 2024 เดนมาร์ก |
| จอห์นสันแอนด์จอห์นสัน[148][149]
Janssen Pharmaceutica (หน่วยงานของจอห์นสันแอนด์จอห์นสัน), BIDMC |
สหรัฐ เนเธอร์แลนด์ | เวกเตอร์เป็นอะดีโนไวรัสลูกผสมที่ไม่ขยายพันธุ์ (Ad26) |
1 โดส[151] | 2–8 °C[151] | ระยะ 3 (40,000) การทดลองแบบสุ่ม อำพรางสองฝ่าย มีกลุ่มควบคุมโดยใช้ยาหลอก สถานะ - ผลบวกจากการวิเคราะห์ในระหว่างการทดลองได้ประกาศในวันที่ 29 ม.ค. 2021 วัคซีนมีประสิทธิศักย์ป้องกันการติดโรคแบบมีอาการอ่อนจนถึงปานกลางร้อยละ 66 (ร้อยละ 64 ในแอฟริกาใต้จนถึงร้อยละ 72 ในสหรัฐ) และแบบมีอาการหนักร้อยละ 85[152][153] ช่วงเวลาและแหล่ง: ก.ค. 2020 – 2023, สหรัฐ อาร์เจนตินา บราซิล ชิลี โคลอมเบีย เม็กซิโก เปรู ฟิลิปปินส์ แอฟริกาใต้ และยูเครน |
|
| BBIBP-CorV หน่วยงานของซิโนฟาร์ม คือ Beijing Institute of Biological Products |
จีน | ไวรัสโควิด-19 เชื้อตาย (เพาะใน vero cell) |
2 โดส 3-4 สัปดาห์ |
2–8 °C |
ระยะ 3 (48,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำคู่ขนาน เพื่อตรวจความปลอดภัยและประสิทธิศักย์ในการป้องกันโรค สถานะ - ผลการทดลองที่ตรวจสอบโดยผู้รู้เสมอกันระบุว่าวัคซีนมีประสิทธิศักย์ป้องกันการติดเชื้อแบบแสดงอาการที่ร้อยละ 78.1[157] ช่วงเวลาและแหล่ง: ก.ค. 2020 – ก.ค. 2021, สหรัฐอาหรับเอมิเรตส์ บาห์เรน จอร์แดน[158] อาร์เจนตินา[159] โมร็อกโก[160] เปรู[161] |
|
| โมเดอร์นา (Spikevax) โมเดอร์นา, NIAID, BARDA, เซพี |
สหรัฐ | เอ็มอาร์เอ็นเอ (เอ็มอาร์เอ็นเอที่ดัดแปลงนิวคลีโอไซด์[e] หุ้มด้วยอนุภาคนาโนที่เป็นลิพิด)[164] | 2 โดส 4 สัปดาห์ |
−20±5 °C (ตู้แช่แข็งยา) |
ระยะ 3 (30,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอกเพื่อทดสอบประสิทธิศักย์ ความปลอดภัย และการตอบสนองของภูมิคุ้มกัน สถานะ - ผลบวกที่พบจากการวิเคราะห์ในระหว่างการทดลองได้ประกาศเมื่อวันที่ 15 พ.ย. 2020[167] แล้วตีพิมพ์วันที่ 30 ธ.ค. 2020 โดยรายงานประสิทธิศักย์ของวัคซีนที่ร้อยละ 94.1[168] ช่วงเวลาและแหล่ง: ก.ค. 2020 – ต.ค. 2022, สหรัฐ |
ระยะ 4 (10,000) การรักษาที่ไม่ได้จัดกลุ่มโดยสุ่ม[c] ช่วงเวลาและแหล่ง: Feb 2021 – Dec 2024, Denmark |
| สปุตนิกวี (Gam-COVID-Vac)
สถาบันวิจัยระบาดวิทยาและจุลชีววิทยากามาเลีย |
รัสเซีย | เวกเตอร์เป็นอะดีโนไวรัสลูกผสมที่ไม่ขยายพันธุ์ (Ad5 และ Ad26) |
2 โดส 3 สัปดาห์ |
≤−18 °C (ตู้แช่แข็งยา) |
ระยะ 3 (40,000) การทดลองแบบสุ่ม อำพรางสองฝ่าย มีกลุ่มควบคุมโดยใช้ยาหลอก เพื่อตรวจประสิทธิศักย์ การตอบสนองของภูมิคุ้มกัน และความปลอดภัย[172] สถานะ - การวิเคราะห์ผลการทดลองในระหว่างที่ตีพิมพ์ในวารสารการแพทย์เดอะแลนซิตระบุประสิทธิศักย์ของวัคซีนที่ร้อยละ 91.6 โดยไม่มีผลข้างเคียงเกินปกติ[173] ช่วงเวลาและแหล่ง: ส.ค. 2020 – พ.ค. 2021, รัสเซีย, เบลารุส,[174] อินเดีย,[175][176] เวเนซุเอลา,[177][178] สหรัฐอาหรับเอมิเรตส์[179] |
|
| โคโรนาแว็ก[180][181][182]
ซิโนแว็ก |
จีน | ไวรัสโควิด-19 เชื้อตาย (เพาะใน vero cell) |
2 โดส 2-4 สัปดาห์ |
2–8 °C |
ระยะ 3 (33,620) การทดลองแบบสุ่ม อำพรางสองฝ่าย มีกลุ่มควบคุมโดยใช้ยาหลอก เพื่อตรวจประสิทธิศักย์และความปลอดภัย สถานะ - ผลการทดลองทางคลินิกระยะที่ 3 ในตุรกีซึ่งได้ทบทวนโดยผู้รู้เสมอกันแล้วแสดงประสิทธิศักย์ที่ร้อยละ 83.5[185] งานศึกษาหนึ่งในชิลีแสดงประสิทธิศักย์ป้องกันร้อยละ 65 สำหรับการติดเชื้อที่แสดงอาการ, ร้อยละ 87 สำหรับการเข้า รพ., ร้อยละ 90 สำหรับการเข้าห้องไอซียู และร้อยละ 86 สำหรับการเสียชีวิต[186][187] ส่วนงานในบราซิลระบุว่ามีประสิทธิศักย์ป้องกันร้อยละ 50.7 สำหรับการติดเชื้อที่แสดงอาการทั้งหมด, ร้อยละ 83.7 สำหรับการติดเชื้อที่มีอาการเบา และเต็มร้อยสำหรับการมีอาการหนัก[188] |
ระยะ 4 (37,867) การรักษา ช่วงเวลาและแหล่ง: บราซิล ก.พ. 2021 – ก.พ. 2022, เมืองเซอร์ฮานา รัฐเซาเปาลู (27,711); มี.ค. 2021 – มี.ค. 2022, เมืองมาเนาส์ รัฐอามาโซนัส (10,156) |
| โคแว็กซิน (BBV152)
ภารตะไบโอเทค, สภาวิจัยทางการแพทย์แห่งอินเดีย |
อินเดีย | ไวรัสโควิด-19 เชื้อตาย (เพาะใน vero cell) |
2 โดส 4 สัปดาห์ |
2–8 °C |
ระยะ 3 (25,800) การทดลองแบบสุ่ม อำพรางผู้สังเกตการณ์ มีกลุ่มควบคุมโดยใช้ยาหลอก[199] สถานะ - บริษัทรายงานว่า ผลระหว่างการทดลองทางคลินิกระยะที่ 3 พบว่าวัคซีนมีประสิทธิศักย์ร้อยละ 78[200] ช่วงเวลาและแหล่ง: พ.ย. 2020–มี.ค. 2021, อินเดีย |
ระยะ 4 (1,000) การรักษาที่ไม่ได้จัดกลุ่มโดยสุ่ม [c] ช่วงเวลาและแหล่ง: ก.ค. 2021 – ธ.ค. 2021, อินเดีย |
| สปุตนิกไลท์
สถาบันวิจัยระบาดวิทยาและจุลชีววิทยากามาเลีย[202] |
รัสเซีย | เวกเตอร์เป็นอะดีโนไวรัสลูกผสมที่ไม่ขยายพันธุ์ (Ad26)[203] | 1 โดส[203] | 2–8 °C[204] | ระยะ 3 (7,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย[203] ช่วงเวลาและแหล่ง: ก.พ. – ธ.ค. 2021, รัสเซีย (6,000) |
|
| Convidicea แคนซิโนไบโอลอจิกส์, Beijing Institute of Biotechnology of the Academy of Military Medical Sciences[206] |
จีน | เวกเตอร์เป็นอะดีโนไวรัสลูกผสม (Ad5) [i] |
1 โดส[208] | 2–8 °C[208] | ระยะ 3 (40,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำหลายศูนย์ทั่วโลก เพื่อตรวจประสิทธิศักย์ ความปลอดภัย และการตอบสนองของภูมิคุ้มกัน สถานะ - ในเดือนกุมภาพันธ์ 2021 การวิเคราะห์ผลการทั่วโลกในระหว่างพบประสิทธิศักย์ของวัคซีนที่ร้อยละ 65.7 ต่อโรคโควิด-19 ที่มีอาการ และร้อยละ 90.98 สำหรับโรคอาการรุนแรง[208] ช่วงเวลาและแหล่ง: มี.ค.–ธ.ค. 2020, จีน; ก.ย. 2020 – ธ.ค. 2021, ปากีสถาน; ก.ย. 2020 – ธ.ค. 2020, รัสเซีย,[206] จีน, อาร์เจนตินา, ชิลี;[209] เม็กซิโก;[210] ปากีสถาน;[211] ซาอุดีอาระเบีย[212][213] |
|
| WIBP-CorV
หน่วยงานของซิโนฟารม์ คือ Wuhan Institute of Biological Products |
จีน | วัคซีนไวรัสโควิด-19 เชื้อตาย (เพาะใน vero cells) | 2 โดส 3 สัปดาห์ |
2–8 °C | ระยะ 3 (51,600) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย[217] สถานะ - ผลงานการทดลองที่ได้ทบทวนโดยผู้รู้เสมอกันแล้วแสดงประสิทธิศักย์ป้องกันการติดเชื้อที่แสดงอาการที่ร้อยละ 72.8[157] ช่วงเวลาและแหล่ง: ก.ค. 2020 – มี.ค. 2021, บาห์เรน, อียิปต์, จอร์แดน, สหรัฐอาหรับเอมิเรตส์[214]; ก.ย. 2020 – ก.ย. 2021, เปรู[215]; ก.ย. 2020 – ธ.ค. 2020, โมร็อกโก[218] |
|
| EpiVacCorona สถาบันเวกตอร์ |
รัสเซีย | หน่วยย่อยเพปไทด์ของไวรัสโควิด-19[j] |
2 โดส 3 สัปดาห์ |
2–8 °C |
ระยะ 3 (40,150 (ตามแผน), 3,000 (เริ่ม)) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย เพื่อประเมินประสิทธิศักย์ การตอบสนองของภูมิคุ้มกัน และความปลอดภัย ช่วงเวลาและแหล่ง: พ.ย. 2020 – ธ.ค. 2021, รัสเซีย (3,000)[223][224][225][226] |
|
| ZF2001 (ZIFIVAX)[4]
Anhui Zhifei Longcom Biopharmaceutical Co. Ltd. |
จีน | หน่วยย่อยโปรตีนแบบลูกผสมของไวรัสโควิด-19[k] | 3 โดส 30 วัน |
2–8 °C |
ระยะ 3 (29,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย[227] ช่วงเวลาและแหล่ง: ธ.ค. 2020 – เม.ย. 2022, จีน, เอกวาดอร์, อินโดนีเซีย, มาเลเซีย, ปากีสถาน, อุซเบกิสถาน[230][231] |
|
| Abdala BioCubaFarma, Center for Genetic Engineering and Biotechnology |
คิวบา | ส่วนประกอบของไวรัสโควิด-19[l] | 3 โดส 2 สัปดาห์ |
2–8 °C |
ระยะ 3 (48,290) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำในหลายศูนย์ อำพรางทั้งสองฝ่าย [232] ช่วงเวลาและแหล่ง: มี.ค.-ก.ค. 2021, คิวบา |
|
| CoviVac[235]
The Chumakov Centre ที่วิทยาศาสตรบัณฑิตยสถานรัสเซีย |
รัสเซีย | ไวรัสโควิด-19 เชื้อตาย (เพาะใน vero cells) |
2 โดส 2 สัปดาห์ |
2–8 °C |
ระยะ 3 (32,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย เพื่อตรวจประสิทธิศักย์และความปลอดภัย ช่วงเวลาและแหล่ง: พ.ค. 2021 – ?, รัสเซีย (3,000)[239] |
|
| QazCovid-in (QazVac)[240] Research Institute for Biological Safety Problems |
คาซัคสถาน | ไวรัสโควิด-19 เชื้อตาย | 2 โดส 3 สัปดาห์ |
2–8 °C |
ระยะ 3 (3,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพราง[243] ช่วงเวลาและแหล่ง: มี.ค. 2021 – ก.ค. 2021, คาซัคสถาน[243] |
|
| Minhai COVID-19 vaccine (KCONVAC) Minhai Biotechnology Co., Shenzhen Kangtai Biological Products Co. Ltd. |
จีน | ไวรัสโควิด-19 เชื้อตาย (เพาะใน vero cell) | 2 โดส 4 สัปดาห์ |
2–8 °C | ระยะ 3 (28,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: เม.ย.-พ.ย. 2021, จีน, มาเลเซีย, ฟิลิปปินส์ |
|
| COVIran Barakat (COVIRAN)[245]
Barakat Pharmaceutical Group, Shifa Pharmed Industrial Group |
อิหร่าน | ไวรัสโควิด-19 เชื้อตาย | 2 โดส 4 สัปดาห์ |
2–8 °C | ระยะ 3 (30,500) ระยะ 2-3a (20,000) - การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำแบบคู่ขนาน[246] ระยะ 3b (10,500)[247] ช่วงเวลาและแหล่ง: มี.ค.-มิ.ย. 2021, อิหร่าน |
|
| Covidful (Chinese Academy of Medical Sciences COVID-19 vaccine) Chinese Academy of Medical Sciences, Institute of Medical Biology |
จีน | ไวรัสโควิด-19 เชื้อตาย | 2 โดส 2 สัปดาห์ |
2–8 °C | ระยะ 3 (34,020) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์เดียว อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: ม.ค.-ก.ย. 2021, บราซิล, มาเลเซีย |
|
| Soberana 02 (FINLAY-FR-2) BioCubaFarma, Instituto Finlay de Vacunas |
คิวบา | ส่วนประกอบของไวรัสโควิด-19[l] (คอนจูเกต) | 2 โดส 4 สัปดาห์ |
2–8 °C |
ระยะ 3 (44,010) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำในศูนย์หลายศูนย์ ทำแบบคู่ขนาน อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: มี.ค.-พ.ค. 2021, คิวบา, อิหร่าน, เวเนซุเอลา[252] |
|
| ZyCoV-D Cadila Healthcare, Biotechnology Industry Research Assistance Council |
อินเดีย | พลาสมิดของดีเอ็นเอที่แสดงออกโปรตีน S ของไวรัสโควิด-19 | 3 โดส 4 สัปดาห์ |
2–8 °C |
ระยะ 3 (30,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพราง[258] ช่วงเวลาและแหล่ง: ม.ค.-พ.ค. 2021, อินเดีย[259] |
การทดลองทางคลินิกในมนุษย์[แก้]
| วัคซีนแคนดิเดต ผู้พัฒนา/ผู้ให้ทุน |
ประเทศกำเนิด | เทคโนโลยี | ระยะทดลองปัจจุบัน (จำนวน) รูปแบบการทดลอง |
ระยะทดลองที่เสร็จแล้ว[m] (จำนวน) การตอบสนองของภูมิคุ้มกัน/ผลไม่พึงประสงค์ |
รอการอนุมัติ |
|---|---|---|---|---|---|
| Novavax COVID-19 vaccine (Covovax) โนวาแวกซ์, เซพี |
สหรัฐ | ซับยูนิต[263][264][265]/อนุภาคคล้ายไวรัส[266][267] (อนุภาคนาโนของหน่วยย่อยโปรตีนหนามลูกผสมของไวรัสโควิด-19 บวกกับตัวเสริม) | ระยะ 3 (49,600) การทดลองแบบสุ่ม อำพรางผู้สังเกตการณ์ มีกลุ่มควบคุมโดยใช้ยาหลอก[268] ช่วงเวลาและแหล่ง: ก.ย. 2020 – ม.ค. 2021, สหราชอาณาจักร (15,000); ธ.ค. 2020 – มิ.ย. 2023, สหรัฐ เม็กซิโก ปวยร์โตรีโก (33,000)[269] อินเดีย (ระยะ 1/2: 1,600)[270][271] |
ระยะ 1-2 (131) การตอบสนองของสารภูมิต้านทานแบบกำจัดฤทธิ์และ IgG เมื่อใช้ตัวเสริมและหลังจากฉีดยาเพิ่ม ผลไม่พึงประสงค์ - อาการเกิดในระยะสั้นและเบา คือเจ็บที่จุดฉีด ปวดหัว ล้า และปวดกล้ามเนื้อ[272] |
|
| Sanofi-GSK COVID-19 vaccine (VAT00008, Vidprevtyn) Sanofi Pasteur [n], แกล็กโซสมิธไคลน์ (GSK) |
ฝรั่งเศส สหราชอาณาจักร | ซับยูนิต (โปรตีน S ลูกผสมของ SARS-CoV-2 ที่เติมตัวเสริม) | ระยะ 3 (37,430) การทดลองระยะที่ 3 แบบมีกลุ่มคู่ขนาน ทำเป็นหลายระยะ อำพรางแบบปรับปรุงทั้งสองฝ่าย มีหลายกลุ่ม (multi-armed) เพื่อประเมินประสิทธิศักย์ ความปลอดภัย และการตอบสนองของภูมิคุ้มกันของวัคซีน SARS-CoV-2 แบบโปรตีนลูกผสมที่เติมยาเสริม 2 ชนิด คือสายพันธุ์เดียว (monovalent) หรือสองสายพันธุ์ (bivalent) สำหรับผู้ใหญ่อายุ 18 ปีและยิ่งกว่า ช่วงเวลาและแหล่ง: พ.ค. 2021 – ม.ค. 2023, โคลอมเบีย สาธารณรัฐโดมินิกัน กานา ฮอนดูรัส อินเดีย (3,000) ญี่ปุ่น เคนยา[286] เม็กซิโก[287] ไนจีเรีย ปากีสถาน ศรีลังกา ยูกันดา สหรัฐ |
ระยะ 1-2 (1,160) ระยะ 1-2a (440) การทดสอบการตอบสนองทางภูมิคุ้รมกันและความปลอดภัยของวัคซีน (มียาเสริม หรือไม่มียาเสริม) ในอาสาสมัครสุขภาพดีอายุ 18 ปีและยิ่งกว่า[288] Phase IIb (720): Immunogenicity and Safety of SARS-CoV-2 Recombinant Protein Vaccine With AS03 Adjuvant in Adults 18 Years of Age and Older.[289] ช่วงเวลาและแหล่ง: ก.ย. 2020–เม.ย. 2022, สหรัฐ |
ภาวะฉุกเฉิน (4) |
| CureVac COVID-19 vaccine (CVnCoV) CureVac, เซพี |
เยอรมนี | วัคซีนอาร์เอ็นเอแบบไม่ดัดแปลง[295] | ระยะ 3 (44,433) ระยะ 2b/3 (มีอาสาสมัคร 39,693 คน) ทดสอบประสิทธิศักย์และความปลอดภัย ทำในศูนย์หลายศูนย์ ระยะ 3 (2,360+180+1,200+1,000=4,740 คน) เป็นการทดลองแแบบสุ่ม มีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์หลายศูนย์ บางแห่งอำพรางผู้สังเกตการณ์ บางแห่งไม่อำพราง |
ระยะ 1-2 (944) ระยะ 1 (284): การทดลองแบบมีกลุ่มควบคุม อำพรางผู้สังเกตการณ์บางส่วน โดยเพิ่มขนาดยา (dose-escalation) เพื่อทดสอบการตอบสนองทางภูมิคุ้มกันและผลที่ไม่พึงประสงค์ ระยะ 2a (660): การทดลองแบบมีกลุ่มควบคุม อำพรางผู้สังเกตการณ์บางส่วน ทำที่ศูนย์หลายศูนย์ เพื่อยืนยันขนาดยา |
ภาวะฉุกเฉิน (2) |
| CoVLP[305][306]
Medicago, แกล็กโซสมิธไคลน์ |
แคนาดา สหราชอาณาจักร | อนุภาคคล้ายไวรัสที่มีอาร์เอ็นเอลูกผสมที่ทำในพืช[o] และใช้ตัวเสริม AS03 จากแกล็กโซสมิธไคลน์ | ระยะ 2-3 (30,918) การทดลองแบบสุ่ม อำพรางผู้สังเกตการณ์ มีกลุ่มควบคุมโดยใช้ยาหลอก และ event-driven[308] ช่วงเวลาและแหล่ง: พ.ย. 2020–ธ.ค. 2021, บราซิล แคนาดา สหราชอาณาจักร สหรัฐ |
ระยะ 1 (180) สถานะ - เกิดสารภูมิต้านทานแบบกำจัดฤทธิ์ในวันที่ 42 หลังการฉีดยาครั้งที่ 1 (วันที่ 21 หลังฉีดยาครั้งที่ 2) ในระดับเป็น 10 เท่าของผู้รอดชีวิตจากการติดโรคโควิด[309][310] ช่วงเวลาและแหล่ง: ก.ค. 2020–ก.ย. 2021, แคนาดา[311] |
|
| Valneva COVID-19 vaccine (VLA2001) Valneva |
ฝรั่งเศส | ไวรัสโควิด-19 เชื้อตาย | ระยะ 3 (4,769) ระยะ 3 (4,019+750) การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพรางผู้สังเกตการณ์ non-inferiority ช่วงเวลาและแหล่ง: เม.ย.-ธ.ค. 2021, นิวซีแลนด์ สหราชอาณาจักร |
ระยะ 1-2 (3,039) ระยะ 1/2 (153 คน) การทดลองแบบสุ่ม อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ระยะ 2 (2,886 คน) การทดลองแบบสุ่มเพื่อตรวจการตอบสนองของภูมิคุ้มกันและผลไม่พึงประสงค์สำหรับการฉีดวัคซีนบูสต์เพื่อป้องกันสายพันธุ์โควิด-19ดั้งเดิมและสายพันธุ์ใหม่ ๆ[318] |
ภาวะฉุกเฉิน (2) |
| Nanocovax[321] Nanogen Pharmaceutical Biotechnology JSC |
เวียตนาม | วัคซีนซับยูนิตเป็นโปรตีนหนามของ Sars-Cov-2 ลูกผสม[p]โดยเพิ่มตัวเสริมเป็นอลูมินัม[322][323] | ระยะ 3 (13,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์หลายศูนย์ ปรับได้ (Adaptive) ช่วงเวลาและแหล่ง: มิ.ย. 2021–ก.ค. 2022, เวียดนาม |
ระยะ 1-2 (620) ระยะ 1 (60 คน) ไม่อำพราง โดยเพิ่มจำนวนโดส ระยะ 2 (560 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ |
|
| UB-612
United Biomedical,Inc, Vaxxinity, Diagnosticos da America |
บราซิล สหรัฐ | วัคซีนซับยูนิต (Multitope peptide based S1-RBD-protein based vaccine) | ระยะ 3 (18,320) ระยะ 2b/3 (7,320 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ และศึกษากาตอบสนองต่อโดส (Dose-Response) ระยะ 3 (11,000 คน) |
ระยะ 1-2 (3,910) ระยะ 1 (60): การศึกษาแบบไม่อำพราง/ไม่ปิด ระยะ 2 (3,850 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ |
|
| TURKOVAC
สถาบันสุขภาพตุรกี |
ตุรกี | ไวรัสโควิด-19 เชื้อตาย | ระยะ 3 (40,800) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้วัคซีนอื่น (active-controlled) อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: มิ.ย 2021–ก.ย. 2021, ตุรกี |
ระยะ 1-2 (294) ระยะ 1 (44 คน) การทดลองเพื่อตรวจสอบความปลอดภัยและการก่อภูมิคุ้มกันของวัคซีนไวรัสโควิด-19 เชื้อตาย คือ ERUCOV-VAC โดยมีขนาดสองขนาด ฉีดเข้ากล้ามเนื้อสองครั้งแก่อาสาสมัครที่มีสุขภาพดี เป็นงานศึกษาแลลมีกลุ่มควบคุมที่ให้ยาหลอก ระยะ 2 (250 คน) การทดลองเพื่อระบุประสิทธิศักย์ การตอบสนองของภูมิคุ้มกัน และความปลอดภัยของวัคซีนไวรัสโควิด-19 เชื้อตาย คือ ERUCOV-VAC โดยมีขนาดสองขนาด เป็นการศึกษาแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย |
|
| West China Hospital COVID-19 vaccine
Jiangsu Province Centers for Disease Control and Prevention, West China Hospital (WestVac Biopharma), Sichuan University |
จีน | วัคซีนซับยูนิต (เป็นโปรตีนลูกผสมที่เพาะใน Sf9 cell) | ระยะ 3 (40,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก มีศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: มิ.ย. 2021–ก.พ. 2022, อินโดนีเซีย เคนยา ฟิลิปปินส์ |
ระยะ 1-2 (5,128) ระยะ 1 (168 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์เดียว ระยะ 2a (960 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์เดียว
ระยะ 2b (4,000 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์เดียว |
|
| SCB-2019 Clover Biopharmaceuticals[342][343], Dynavax Technologies[344], เซพี |
จีน | วัคซีนซับยูนิตเป็นโปรตีนหนามของไวรัสโควิด-19 (spike protein trimeric subunit) โดยเติมตัวเสริมคือ CpG 1018 และอลูมิเนียม | ระยะ 3 (29,300) ระยะ 2/3 (29,000 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพรางทั้งสองฝ่าย ระยะ 3 (300 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพรางทั้งสองฝ่าย[345] |
ระยะ 1-2 (950) ระยะ 1 (150 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ระยะ 2 (800 คน) การทดลองแบบมีกลุ่มควบคุม อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์[346] |
|
| Walvax COVID-19 vaccine (ARCoV) PLA Academy of Military Science, Walvax Biotech[348], Suzhou Abogen Biosciences |
จีน | วัคซีนอาร์เอ็นเอ | ระยะ 3 (28,000) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: พ.ค.–พ.ย. 2021, จีน[350] มาเลเซีย เม็กซิโก เนปาล |
ระยะ 1-2 (908) ระยะ 1 (168 คน) ระยะ 2 (420 คน)
ระยะ 1/2 (320 คน)[351] |
|
| COVAX-19 (SpikoGen)[353] | ออสเตรเลีย อิหร่าน | วัคซีนซับยูนิต (โปรตีนลูกผสม[q]) | ระยะ 3 (16,876) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย มีแขนสองข้าง (two-armed) ช่วงเวลาและแหล่ง: ส.ค.–ก.ย. 2021, อิหร่าน |
ระยะ 1-2 (440) ระยะ 1 (40 คน) ระยะ 2 (400 คน) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย มีแขนสองข้าง (Two-armed)[358] |
|
| GRAd-COV2 ReiThera, Lazzaro Spallanzani National Institute for Infectious Diseases |
อิตาลี | วัคซีนอะดีโนไวรัสของชิมแปนซีที่ดัดแปลง (มีรหัสว่า GRAd) เพื่อเป็นเวกเตอร์ | ระยะ 3 (10,300) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ สุ่มตัวอย่างแบบเป็นชั้น (stratified) ช่วงเวลาและแหล่ง: มี.ค.–ต.ค. 2021, อิตาลี
|
ระยะ 1 (90) อาสาสมัคร (มี 2 กลุ่มแบ่งตามวัยคือ 18-55 ปีและ 65-85 ปี) จัดโดยสุ่มให้ได้รับวัคซีนซึ่งให้เพิ่มขึ้น ๆ หนึ่งในสามอย่าง หรือให้ยาหลอก แล้วตรวจติดตามเป็นเวลา 24 สัปดาห์ อาสาสมัครร้อยละ 92.5 ที่ได้วัคซีนเกิดสารภูมิต้านทาน แหล่ง: กรุงโรม ช่วงเวลา: ส.ค.–ธ.ค. 2020 |
|
| GBP510
SK Bioscience Co. Ltd., แกล็กโซสมิธไคลน์ |
เกาหลีใต้ | วัคซีนซับยูนิต (เป็นอนุภาคนาโนโปรตีนลูกผสมและเติมตัวเสริม AS03) | ระยะ 3 (4,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้วัคซีนอื่น (active-controlled) อำพรางผู้สังเกตการณ์ มีกลุ่มคู่ขนาน ทำที่ศูนย์หลายศูนย์[365] ช่วงเวลาและแหล่ง: ส.ค. 2021-มี.ค. 2022, เกาหลีใต้ |
ระยะ 1-2 (580) ระยะ 1-2 (260-320 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ตรวจหาขนาดยา ช่วงเวลาและแหล่ง: มี.ค.–ส.ค. 2021, เกาหลีใต้ |
|
| Bio E COVID-19 (Corbevax) Biological E. Limited, Baylor College of Medicine,[371] |
อินเดีย สหรัฐ | วัคซีนซับยูนิต (ประกอบด้วยแอนติเจนชนิดหนึ่ง) | ระยะ 3 (1,268) ระยะ 2b/3 การศึกษาตามแผน (prospective) ทำที่ศูนย์หลายศูนย์ มีแขนข้างเดียว[373] ช่วงเวลาและแหล่ง: เม.ย.–ส.ค. 2021, อินเดีย |
ระยะ 1-2 (360) การทดลองแบบสุ่ม มีกลุ่มคู่ขนาน ช่วงเวลาและแหล่ง: พ.ย. 2020–ก.พ. 2021, อินเดีย |
|
| Inovio COVID-19 Vaccine (INO-4800) Inovio Pharmaceuticals, เซพี, สถาบันสุขภาพแห่งชาติเกาหลี, International Vaccine Institute |
เกาหลีใต้ สหรัฐ | ว้คซีนดีเอ็นเอ (พลาสมิดของดีเอ็นเอส่งด้วยวิธี electroporation[r]) | ระยะ 2-3 (6,578) ระยะ 2/3 (6,578 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์หลายศูนย์[379] ช่วงเวลาและแหล่ง: พ.ย. 2020–ก.ย. 2022, สหรัฐ (ระยะ 2/3) |
ระยะ 1-2 (920) ระยะ 1a (120 คน) การทดลองแบบไม่อำพราง ระยะ 1b-2a (160 คน) การทดลองแบบหาขนาดยา[380]
ระยะ 2 (640 คน) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย หาขนาดยา[381] |
|
| AG0302-COVID‑19 AnGes Inc.,[384] Japan Agency for Medical Research and Development |
ญี่ปุ่น | วัคซีนดีเอ็นเอ (พลาสมิด) | ระยะ 2-3 (500) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย[385] ช่วงเวลาและแหล่ง: พ.ย. 2020–เม.ย. 2021, ญี่ปุ่น |
ระยะ 1-2 (30) การทดลองทั้งแบบสุ่มและไม่สุ่ม ใช้วัคซีนสองโดส ทำที่ศูนย์เดียว ช่วงเวลาและแหล่ง: มิ.ย.–พ.ย. 2020, โอซากะ |
|
| 202-CoV
Shanghai Zerun Biotechnology Co., Walvax Biotech |
จีน | วัคซีนซับยูนิตเป็นโปนตีนหนาม (CHO cell) บวกกับตัวเสริม CpG และอลูมิเนียม) | ระยะ 2 (1,056) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: ก.ค.–ธ.ค. 2021, จีน |
ระยะ 1 (144) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: ก.ค.–ธ.ค. 2021, จีน |
|
| V-01
Livzon Mabpharm, Inc. |
จีน | วัคซีนซับยูนิตเป็นโปรตีน fusion ลูกผสมของไวรัสโควิด-19 | ระยะ 2 (880) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: มี.ค.–พ.ค. 2021, จีน |
ระยะ 1 (180) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์เดียว ช่วงเวลาและแหล่ง: ก.พ.–มี.ค. 2021, จีน |
|
| DelNS1-2019-nCoV-RBD-OPT (DelNS1-nCoV-RBD LAIV)
Beijing Wantai Biological Pharmacy, University of Hong Kong |
จีน ฮ่องกง | วัคซีนเวกเตอร์ไวรัสที่ขยายพันธุ์ได้โดยรวมยีน RBD ของไวรัสโควิด-19 | ระยะ 2 (720) ช่วงเวลาและแหล่ง: พ.ย. 2020–ธ.ค. 2021, จีน |
ระยะ 1 (60) ช่วงเวลาและแหล่ง: ก.ย. 2020–ต.ค. 2021, จีน |
|
| Brilife (IIBR-100) สถาบันวิจัยชีวภาพอิสราเอล |
อิสราเอล | วัคซีนมีเวกเตอร์ไวรัสเป็น vesicular stomatitis virus (ลูกผสม) | ระยะ 2-3 (550) ระยะ 2b/3 (550) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: ส.ค.–ต.ค. 2021, อิสราเอล
|
ระยะ 1-2 (1,040) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอกและเพิ่มขนาดยา ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: ต.ค. 2020–พ.ค. 2021, อิสราเอล |
|
| Razi Cov Pars
Razi Vaccine and Serum Research Institute |
อิหร่าน | วัคซีนซับยูนิตเป็นโปรตีนหนามลูกผสมของไวรัสโควิด-19 | ระยะ 2 (500) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย มีกลุ่มคู่ขนาน 2 กลุ่ม ช่วงเวลาและแหล่ง: เม.ย.–มิ.ย. 2021, อิหร่าน |
ระยะ 1 (133) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: ม.ค.–มี.ค. 2021, อิหร่าน |
|
| FAKHRAVAC (MIVAC)
Organization of Defensive Innovation and Research |
อิหร่าน | วัคซีนไวรัสโควิด-19 เชื้อตาย | ระยะ 2 (500) การทดลองแบบสุ่มและมีกลุ่มควบคุม แบบกลุ่มคู่ขนาน อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: มิ.ย.–ก.ค. 2021, อิหร่าน |
ระยะ 1 (135) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย มีรูปแบบเป็น factorial design. ช่วงเวลาและแหล่ง: มี.ค.–เม.ย. 2021, อิหร่าน |
|
| ยังไม่ได้ตั้งชื่อ
Ihsan Gursel, Scientific and Technological Research Council of Turkey |
ตุรกี | อนุภาคคล้ายไวรัส | ระยะ 2 (330) การทดลองแบบสุ่มและมีกลุ่มควบคุม เป็นกลุ่มคู่ขนาน อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: มิ.ย.–ก.ย. 2021, ตุรกี |
ระยะ 1 (36) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: มี.ค.–พ.ค. 2021, ตุรกี |
|
| COH04S1
City of Hope Medical Center |
สหรัฐ | วัคซีนเวกเตอร์ไวรัส | ระยะ 2 (240) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้วัคซีนที่ได้ขึ้นทะเบียนให้ใช้ในภาวะฉุกเฉิน อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: ส.ค. 2021–มิ.ย. 2023, แคลิฟอร์เนีย (สหรัฐ) |
ระยะ 1 (129) การศึกษาหาขนาดวัคซีน ช่วงเวลาและแหล่ง: ธ.ค. 2020 – พ.ย. 2022, แคลิฟอร์เนีย |
|
| ยังไม่ได้ตั้งชื่อ
มหาวิทยาลัยชิงหฺวา, Tianjin Medical University[403], Walvax Biotech |
จีน | วัคซีนเวกเตอร์ไวรัส | ระยะ 2 (180) ช่วงเวลาและแหล่ง: ก.ค.–พ.ย. 2021, จีน |
ระยะ 1 (30) ช่วงเวลาและแหล่ง: พ.ค.–มิ.ย. 2021, จีน |
|
| ABNCoV2
Bavarian Nordic[406] มหาวิทยาลัยรัดเบาด์ไนเมเคิน |
เดนมาร์ก เนเธอร์แลนด์ | อนุภาคคล้ายไวรัส | ระยะ 2 (150) การทดลองแบบไม่อำพราง เพิ่มขนาดยาเป็นลำดับ ทำที่ศูนย์เดียว ช่วงเวลาและแหล่ง: ส.ค. 2021-2022, เดนมาร์ก เนเธอร์แลนด์ |
ระยะ 1 (42) การทดลองแบบไม่อำพราง เพิ่มขนาดยาเป็นลำดับ ทำที่ศูนย์เดียว ช่วงเวลาและแหล่ง: มี.ค.-ธ.ค. 2021, เนเธอร์แลนด์ |
|
| ARCT-154 (VBC-COV19-154 ในเวียดนาม)[409] [410] [411]
Arcturus Therapeutics, Vinbiocare |
สหรัฐ เวียดนาม | วัคซีนอาร์เอ็นเอ | ระยะ 1-3 (21,000) ระยะ 1/2/3 (100+300+600+20,000=21,000) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย[412] [413] ช่วงเวลาและแหล่ง: ส.ค.-ต.ค. 2021, เวียดนาม[414] |
พรีคลินิก |
|
| SCB-2020S
Clover Biopharmaceuticals[415] |
จีน | วัคซีนซับยูนิต | ระยะ 1-2 (150) การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพรางผู้สังเกตการณ์ ช่วงเวลาและแหล่ง: ส.ค. 2021–เม.ย. 2022, ออสเตรเลีย |
พรีคลินิก |
|
| NDV-HXP-S (ButanVac, COVIVAC, HXP-GPOVac, Patria)
Icahn School of Medicine at Mount Sinai, Institute of Vaccines and Medical Biologicals[417], Butantan Institute, Laboratorio Avimex, National Council of Science and Technology, มหาวิทยาลัยมหิดล, มหาวิทยาลัยเท็กซัส ออสติน |
บราซิล เม็กซิโก ไทย สหรัฐ เวียดนาม | ใช้ไวรัส Newcastle disease virus (NDV) เป็นเวกเตอร์ (ที่แสดงออกโปรตีนหนามของไวรัสโควิด-19 ทั้งแบบมีตัวเสริม CpG 1018 และไม่มี) / หรือวัคซีนไวรัสโควิด-19 เชื้อตาย | ระยะ 1-2 (6,439) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ช่วงเวลาและแหล่ง: มี.ค. 2021–พ.ค. 2022, บราซิล (5,394) เม็กซิโก (ระยะ 1: 90) ไทย (460)[418] เวียดนาม (495)[419][420] |
พรีคลินิก |
|
| ยังไม่ได้ตั้งชื่อ
National Vaccine and Serum Institute, Lanzhou Institute of Biological Products Co., Ltd., Beijing Zhong Sheng Heng Yi Pharmaceutical Technology Co., Ltd., Zhengzhou University |
จีน | วัคซีนซับยูนิต (เป็นโปรตีนลูกผสมเพาะด้วย CHO Cell) | ระยะ 1-2 (3,580) ระยะ 1/2 การทดลองทางคลินิกเพื่อตรวจความปลอดภัย ความอดทนรับได้ และการตอบสนองของภูมิคุ้มกันของวัคซีนในผู้มีสุขภาพดีอายุ 3 ปีและยิ่งกว่า ช่วงเวลาและแหล่ง: เม.ย. 2021–ต.ค. 2022, จีน |
พรีคลินิก |
|
| ARCT-021[422][423]
Arcturus Therapeutics, Duke-NUS Medical School |
สหรัฐ สิงคโปร์ | วัคซีนอาร์เอ็นเอ | ระยะ 1-2 (798) ระยะ 1/2 (92) การทดลองแบบสุ่ม อำพรางทั้งสองฝ่าย ระยะ 2 (600) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ทำในภูมิภาคหลายแห่ง ทำในศูนย์หลายศูนย์ กับผู้ใหญ่สุขภาพดีเพื่อตรวจสอบ ความปลอดภัย ผลข้างเคียง และการตอบสนองของภูมิคุ้มกัน[424]
ระยะ 2a (106) การทดลองแบบไม่อำพรางเพื่อขยายตรวจสอบความปลอดภัยและการตอบสนองของภูมิคุ้มกันในระยะยาวเมื่อให้วัคซีนโดสเดียวแก่อาสาสมัครจากการทดลองแม่ที่ได้รับยาหลอกหรือไม่เกิด ตรวจเลือดเป็น seronegative[425] |
พรีคลินิก |
|
| VBI-2902 Variation Biotechnologies |
สหรัฐ | อนุภาคคล้ายไวรัส | ระยะ 1-2 (780) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ เพิ่มขนาดยา ช่วงเวลาและแหล่ง: มี.ค. 2021-มิ.ย. 2022, แคนาดา |
พรีคลินิก |
|
| ICC Vaccine[428]
Novavax |
สหรัฐ | วัคซีนซับยูนิต | ระยะ 1-2 (640) การทดลองแบบสุ่ม อำพรางผู้สังเกตการณ์ ช่วงเวลาและแหล่ง: ก.ย. 2021–มี.ค. 2022, ออสเตรเลีย |
พรีคลินิก |
|
| Sanofi-Translate Bio COVID-19 vaccine (MRT5500)[430] Sanofi Pasteur, Translate Bio |
ฝรั่งเศส สหรัฐ | วัคซีนอาร์เอ็นเอ | ระยะ 1-2 (333) การศึกษาแบบสุ่ม มีกลุ่มคู่ขนาน ทำเป็นลำดับ คือ sentinel cohort ตามด้วย full enrollment cohort ลำดับแรกเป็นการศึกษาแบบไม่อำพราง ทำเป็นขั้น ๆ เพิ่มขนาดยา เพื่อตรวจสอบความปลอดภัยของยา 2 ขนาดเมื่อฉีด 2 โดส ลำดับสองเป็นการศึกษาแบบอำพรางทั้ง 4 ฝ่ายเพื่อตรวจสอบความปลอดภัยและการตอบสนองของภูมิคุ้มกันในคนต่างอายุ 2 กลุ่ม โดยครึ่งหนึ่งได้รับวัคซีนโดสเดียว อีกครึ่งที่เหลือได้รับวัคซีนสองโดส ช่วงเวลาและแหล่ง: มี.ค. 2021–ก.ย. 2022, ฮอนดูรัส สหรัฐ ออสเตรเลีย |
พรีคลินิก |
|
| EuCorVac-19 EuBiologics Co |
เกาหลีใต้ | วัคซีนซับยูนิต (โปรตีนหนามลูกผสมของไวรัสโควิด-19 บวกกับตัวเสริม) | ระยะ 1-2 (280) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ตรวจสอบขนาดของยา ช่วงเวลาและแหล่ง: ก.พ. 2021–มี.ค. 2022, ฟิลิปปินส์ (ระยะ 2) เกาหลีใต้ (ระยะ 1/2) |
พรีคลินิก |
|
| RBD SARS-CoV-2 HBsAg VLP
SpyBiotech |
สหราชอาณาจักร | อนุภาคคล้ายไวรัส | ระยะ 1-2 (280) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: ส.ค. 2020-?, ออสเตรเลีย |
พรีคลินิก |
|
| GX-19 (GX-19N) Genexine consortium[437][438], International Vaccine Institute |
เกาหลีใต้ | วัคซีนดีเอ็นเอ | ระยะ 1-2 (410) ระยะ 1-2 (170+210+30) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก บางงานอำพรางทั้งสองฝ่าย บางงานไม่อำพราง มีแขนเดียว ช่วงเวลาและแหล่ง: มิ.ย. 2020–ก.ค. 2021, กรุงโซล |
พรีคลินิก |
|
| AV-COVID-19
AIVITA Biomedical, กระทรวงสาธารณสุขอินโดนีเซีย |
สหรัฐ อินโดนีเซีย | Dendritic cell vaccine (dendritic cell ของคนไข้เองที่ได้นำออกมาใส่โปรตีนหนามของไวรัสโควิด-19 โดยใส่เพิ่ม GM-CSF หรือไม่ใส่) | ระยะ 1-2 (202) ปรับได้ (adaptive) ช่วงเวลาและแหล่ง: ธ.ค. 2020-ก.พ. 2022, อินโดนีเซีย (ระยะ 1) สหรัฐ (ระยะ 1/2) |
พรีคลินิก |
|
| COVID-eVax
Takis Biotech |
อิตาลี | วัคซีนดีเอ็นเอ (injection followed by electroporation) | ระยะ 1-2 (160) การทดลองแบบไม่อำพราง ทำที่ศูนย์หลายศูนย์ ระยะ 1 แบบเพิ่มขนาดยา
ระยะ 2 มีแขนเดียวหรือสองแขน สุ่มจัดกลุ่ม เพิ่มขนาดยา |
พรีคลินิก |
|
| BBV154 Bharat Biotech[443] |
อินเดีย | วัคซีนที่มีอะดีโนไวรัสเป็นเวกเตอร์ (พ่นจมูก) | ระยะ 1-2 (175) การทดลองแบบสุ่ม อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: มี.ค.–มิ.ย. 2021, อินเดีย |
พรีคลินิก |
|
| ChulaCov19 | ไทย | วัคซีนอาร์เอ็นเอ | ระยะ 1-2 (72) ระยะ 1 (72) การทดลองโดยเพิ่มขนาดยา ทำที่ศูนย์เดียว กับอาสาสมัคร 2 กลุ่ม คือ ผู้มีอายุระหว่าง 18-55 ปี และระหว่าง 56-75 ปี ระยะ 2 การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ทำที่ศูนย์หลายศูนย์ เพื่อตรวจความปลอดภัย ผลข้างเคียง และการตอบสนองของภูมิคุ้มกันในผู้มีสุขภาพดีอายุระหว่าง 18-75 ปี |
พรีคลินิก |
|
| COVID-19/aAPC Shenzhen Genoimmune Medical Institute[447] |
จีน | วัคซีนมีเล็นทิไวรัสเป็นเวกเตอร์[t] (with minigene modifying aAPCs) | ระยะ 1 (100) Single group, open-label study to evaluate safety and immunity. แหล่ง: เมืองเชินเจิ้น ช่วงเวลา: ก.พ. 2020–ธ.ค. 2024 |
พรีคลินิก |
|
| LV-SMENP-DC Shenzhen Genoimmune Medical Institute[447] |
จีน | วัคซีนมีเล็นทิไวรัสเป็นเวกเตอร์[t] (with minigene modifying DCs) | ระยะ 1-2 (100) Single-group, open label, multi-center study to evaluate safety and efficacy. แหล่ง: เมืองเชินเจิ้น ช่วงเวลา: มี.ค. 2020–ธ.ค. 2024 |
พรีคลินิก |
|
| ImmunityBio COVID-19 vaccine (hAd5)
ImmunityBio |
สหรัฐ | วัคซีนเวกเตอร์ไวรัส | ระยะ 1-2 (540) การทดลองระยะ 1/2 เพื่อตรวจความปลอดภัย ผลข้างเคียง และการตอบสนองของภูมิคุ้มกันสำหรับวัคซีนบูสต์เสริมที่ฉีดใต้ผิวหนังและที่ให้ทางปาก วัคซีนเล็งเป้าที่โปรตีนหนามและ nucleocapsid ของไวรัสโควิด-19 และมุ่งเพิ่มภูมิคุ้มกันทางเซลล์ทีของอาสาสมัครที่ได้รับวัคซีนสองโดส (Prime + Boost) ที่อนุมัติให้ใช้ในภาวะฉุกเฉินแล้ว ช่วงเวลาและแหล่ง: ต.ค. 2020-ก.ย. 2021, แอฟริกาใต้ สหรัฐ |
พรีคลินิก |
|
| HGC019 Gennova Biopharmaceuticals, HDT Biotech Corporation[455] |
อินเดีย สหรัฐ | วัคซีนอาร์เอ็นเอ | ระยะ 2-3 (4,400) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ตามแผน อำพรางผู้สังเกตการณ์ ทำที่ศูนย์หลายศูนย์เพื่อตรวจความปลอดภัย ความอดทนรับได้ และการตอบสนองของภูมิคุ้มกันในผู้ใหญ่สุขภาพดี ระยะ 2 (400)
ระยะ 3 (4,000) |
ระยะ 1-2 (620) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก หาขนาดยา มีกลุ่มคู่ขนาน ไขว้กลุ่ม ทำที่ศูนย์หลายศูนย์เพื่อตรวจความปลอดภัย ความอดทนรับได้ และการตอบสนองของภูมิคุ้มกันในผู้หใญ่สุขภาพดี ระยะ 1 (120) การศึกษาแบบไม่อำพรางกับผู้มีสุขภาพดีอายุ 18-70 ปี.
ระยะ 2 (500) การศึกษาแบบอำพรางผู้สังเกตการณ์ในผู้มีสุขภาพดีอายุ 18-75 ปี |
|
| PTX-COVID19-B[459] Providence Therapeutics |
แคนาดา | วัคซีนอาร์เอ็นเอ | ระยะ 1 (60) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ช่วงเวลาและแหล่ง: ม.ค.-พ.ค. 2021, แคนาดา |
พรีคลินิก |
|
| COVAC-2[461]
Vaccine and Infectious Disease Organization (University of Saskatchewan) |
แคนาดา | วัคซีนซับยูนิต (โปรตีนหนามของไวรัสโควิด-19 บวกกับตัวเสริม) | ระยะ 1 (108) การทดลองแบบสุ่ม อำพรางผู้สังเกตการณ์ เพิ่มขนาดยา ช่วงเวลาและแหล่ง: ก.พ. 2021 – ต.ค. 2022, แฮลิแฟกซ์ (แคนาดา) |
พรีคลินิก |
|
| COVI-VAC (CDX-005)[463] Codagenix Inc. |
สหรัฐ | วัคซีนเชื้อลดฤทธิ์ | ระยะ 1 (48) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย เพิ่มขนาดยา ช่วงเวลาและแหล่ง: ธ.ค. 2020-มิ.ย. 2021, สหราชอาณาจักร |
พรีคลินิก |
|
| CoV2 SAM (LNP) | สหราชอาณาจักร | วัคซีนอาร์เอ็นเอ | ระยะ 1 (40) การทดลองแบบไม่สุ่ม ไม่อำพราง เพิ่มขนาดยา ช่วงเวลาและแหล่ง: ก.พ.-มิ.ย. 2021, สหรัฐ |
พรีคลินิก |
|
| COVIGEN[466]
Bionet Asia, Technovalia, มหาวิทยาลัยซิดนีย์ |
ออสเตรเลีย ไทย | วัคซีนดีเอ็นเอ | ระยะ 1 (150) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย หาขนาดยา ช่วงเวลาและแหล่ง: ก.พ. 2021-มิ.ย. 2022, ออสเตรเลีย ไทย |
พรีคลินิก |
|
| MV-014-212[468]
Meissa Vaccine Inc. |
สหรัฐ | วัคซีนเชื้อลดฤทธิ์ | ระยะ 1 (130) การทดลองแบบสุ่ม อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: มี.ค. 2021-ต.ค. 2022, United States |
พรีคลินิก |
|
| S-268019
Shionogi |
ญี่ปุ่น | วัคซีนซับยูนิต | ระยะ 1-2 (300) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย มีกลุ่มคู่ขนาน ช่วงเวลาและแหล่ง: ธ.ค. 2020-มิ.ย. 2022, ญี่ปุ่น |
พรีคลินิก |
|
| KBP-201
Kentucky Bioprocessing |
สหรัฐ | วัคซีนซับยูนิต | ระยะ 1-2 (180) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ มีกลุ่มคู่ขนาน ช่วงเวลาและแหล่ง: ธ.ค. 2020-พ.ค. 2022, สหรัฐ |
พรีคลินิก |
|
| AdCLD-CoV19
Cellid Co |
เกาหลีใต้ | วัคซีนเวกเตอร์ไวรัส | ระยะ 1-2 (150) ระยะ 1 การทดลองแบบไม่อำพราง เพิ่มขนาดยา ทำที่ศูนย์เดียว ระยะ 2a การทดลองแบบสุ่ม ไม่อำพราง ทำที่ศูนย์หลายศูนย์ |
พรีคลินิก |
|
| AdimrSC-2f
Adimmune Corporation |
ไต้หวัน | วัคซีนซับยูนิต (Recombinant RBD +/− Aluminium) | ระยะ 1 (70) การทดลองแบบสุ่มและมีกลุ่มควบคุม ไม่อำพราง หาขนาดยา ทำที่ศูนย์เดียว ช่วงเวลาและแหล่ง: ส.ค.-พ.ย. 2020, ไต้หวัน |
พรีคลินิก |
|
| AKS-452
University Medical Center Groningen |
เนเธอร์แลนด์ | วัคซีนเป็นเวกเตอร์ซับยูนิต | ระยะ 1-2 (130) การทดลองแบบไม่สุ่ม ไม่อำพราง ทำที่ศูนย์เดียว combinatorial ช่วงเวลาและแหล่ง: เม.ย.-มิ.ย. 2021, เนเธอร์แลนด์ |
พรีคลินิก |
|
| GLS-5310
GeneOne Life Science Inc. |
เกาหลีใต้ | วัคซีนดีเอ็นเอ | ระยะ 1-2 (345) การทดลองแบบรวมระยะ 1 (เพิ่มขนาดยา) และ 2a (อำพรางทั้งสองฝ่าย) แบบสุ่ม ทำที่ศูนย์หลายศูนย์ ช่วงเวลาและแหล่ง: ธ.ค. 2020-ก.ค. 2022, เกาหลีใต้ |
พรีคลินิก |
|
| Covigenix VAX-001
Entos Pharmaceuticals Inc. |
แคนาดา | วัคซีนดีเอ็นเอ | ระยะ 1-2 (72) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ หาขนาดยา และปรับได้ ช่วงเวลาและแหล่ง: มี.ค.-ส.ค. 2021, แคนาดา |
พรีคลินิก |
|
| NBP2001
SK Bioscience Co. Ltd. |
เกาหลีใต้ | วัคซีนซับยูนิต (โปรตีนลูกผสมบวกกับตัวเสริมประเภทอลูมิเนียม) | ระยะ 1 (50) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ เพิ่มขนาดยา ช่วงเวลาและแหล่ง: ธ.ค. 2020-เม.ย. 2021, เกาหลีใต้ |
พรีคลินิก |
|
| CoVac-1
University of Tübingen |
เยอรมนี | วัคซีนซับยูนิต (เพปไทด์) | ระยะ 1-2 (104) ระยะ 1 (36) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ เพิ่มขนาดยา ระยะ 1/2 (68) การทดลองเพื่อตรวจความปลอดภัย และการตอบสนองของภูมิคุ้มกันของผู้ที่มีความบกพร่องทางแอนติบอดีหรือ Bcell |
พรีคลินิก |
|
| bacTRL-Spike
Symvivo |
แคนาดา | วัคซีนดีเอ็นเอ | ระยะ 1 (24) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ช่วงเวลาและแหล่ง: พ.ย. 2020-ก.พ. 2022, ออสเตรเลีย |
พรีคลินิก |
|
| CORVax12
Providence Health & Services |
สหรัฐ | วัคซีนดีเอ็นเอ | ระยะ 1 (36) การทดลองแบบไม่สุ่ม ไม่อำพราง มีกลุ่มคู่ขนาน เพื่อตรวจความปลอดภัยของวัคซีน 2 โดสที่ฉีดห่างกัน 4 สัปดาห์โดยมี/หรือไม่มีตัวเพิ่มคือ electroporated IL-12p70 plasmid ในคน 2 กลุ่มแบ่งโดยวัย คือ กลุ่มอายุ 18-50 ปี และกลุ่มอายุมากกว่า 50 ปี ช่วงเวลาและแหล่ง: ธ.ค. 2020-ก.ค. 2021, สหรัฐ |
พรีคลินิก |
|
| ChAdV68-S (SAM-LNP-S)
สถาบันโรคภูมิแพ้และโรคติดต่อแห่งชาติสหรัฐ, Gritstone Oncology |
สหรัฐ | วัคซีนเวกเตอร์ไวรัส | ระยะ 1 (150) การทดลองแบบไม่อำพราง มีกลุ่มคู่ขนาน เพิ่มขนาดยา ช่วงเวลาและแหล่ง: มี.ค. 2021-ก.ย. 2022, สหรัฐ |
พรีคลินิก |
|
| VXA-CoV2-1 (VXA-NVV-104)
Vaxart |
สหรัฐ | วัคซีนเวกเตอร์ไวรัส | ระยะ 1 (83) ระยะ 1a (35) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ระยะ 1b (48) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ทำที่ศูนย์หลายศูนย์ |
พรีคลินิก |
|
| SpFN COVID-19 vaccine
United States Army Medical Research and Development Command |
สหรัฐ | วัคซีนซับยูนิต | ระยะ 1 (72) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ช่วงเวลาและแหล่ง: เม.ย. 2021-ต.ค. 2022, สหรัฐ |
พรีคลินิก |
|
| MVA-SARS-2-S (MVA-SARS-2-ST)
University Medical Center Hamburg-Eppendorf |
เยอรมนี | วัคซีนเวกเตอร์ไวรัส | ระยะ 1-2 (270) ระยะ 1 (30) การทดลองแบบเปิด ทำที่ศูนย์เดียว ระยะ 1b/2a (240) การทดลองแบบสุ่มและมีกลุ่มควบคุม ทำที่ศูนย์หลายศูนย์ |
พรีคลินิก |
|
| ReCOV
Jiangsu Rec-Biotechnology Co Ltd |
จีน | วัคซีนซับยูนิต (โปรตีนลูกผสมรวมโปรตีนหนามและ RBD เพาะใน CHO cell) | ระยะ 1 (160) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย หาขนาดยา เป็นระยะแรกที่ทดลองในมนุษย์ ช่วงเวลาและแหล่ง: เม.ย.-ก.ค. 2021, นิวซีแลนด์ |
พรีคลินิก |
|
| Koçak-19 Inaktif Adjuvanlı COVID-19 vaccine
Kocak Farma |
ตุรกี | วัคซีนซึ่งใช้ไวรัสโควิด-19 ที่ฆ่าแล้ว | ระยะ 1 (38) การศึกษาระยะที่ 1 เพื่อตรวจความปลอดภัยและการตอบสนองของภูมิคุ้มกันต่อวัคซีนในขนาดต่าง ๆ กัน ซึ่งฉีดเข้าในกล้ามเนื้อของอาสาสมัครสุขภาพดี เป็นการทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก ช่วงเวลาและแหล่ง: มี.ค.-มิ.ย. 2021, ตุรกี |
พรีคลินิก |
|
| mRNA-1283
โมเดอร์นา |
สหรัฐ | วัคซีนอาร์เอ็นเอ | ระยะ 1 (125) การทดลองแบบสุ่ม อำพรางผู้สังเกตการณ์ หาขนาดยา ช่วงเวลาและแหล่ง: มี.ค. 2021-เม.ย. 2022, สหรัฐ |
พรีคลินิก |
|
| DS-5670[491]
Daiichi Sankyo[492] |
ญี่ปุ่น | วัคซีนอาร์เอ็นเอ | ระยะ 1-2 (152) การศึกษาระยะที่ 1/2 เพื่อตรวจความปลอดภัยและการตอบสนองของภูมิคุ้มกันต่อวัคซีนในอาสาสมัครญี่ปุ่นผู้ใหญ่และคนชราผู้มีสุขภาพดี ช่วงเวลาและแหล่ง: มี.ค. 2021-ก.ค. 2022, ญี่ปุ่น |
พรีคลินิก |
|
| CoV2-OGEN1
Syneos Health, US Specialty Formulations |
สหรัฐ | วัคซีนซับยูนิต | ระยะ 1 (45) การทดลองระยะแรกในมนุษย์ ช่วงเวลาและแหล่ง: มิ.ย.-ธ.ค. 2021, นิวซีแลนด์ |
พรีคลินิก |
|
| KD-414
KM Biologics Co |
ญี่ปุ่น | วัคซีนไวรัสโควิด-19 เชื้อตาย | ระยะ 1-2 (210) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย มีกลุ่มคู่ขนาน[496] ช่วงเวลาและแหล่ง: มี.ค. 2021-ธ.ค. 2022, ญี่ปุ่น |
พรีคลินิก |
|
| CoVepiT
OSE Immunotherapeutics |
ฝรั่งเศส | วัคซีนซับยูนิต | ระยะ 1 (48) การทดลองแบบสุ่ม ไม่อำพราง ช่วงเวลาและแหล่ง: เม.ย.-ก.ย. 2021, ฝรั่งเศส |
พรีคลินิก |
|
| HDT-301
Senai Cimatec |
บราซิล | วัคซีนอาร์เอ็นเอ | ระยะ 1 (78) การทดลองแบบสุ่ม ไม่อำพราง หาขนาดยา ช่วงเวลาและแหล่ง: พ.ย.-ก.ย. 2021, บราซิล |
พรีคลินิก |
|
| SC-Ad6-1
Tetherex Pharmaceuticals |
สหรัฐ | เวกเตอร์ไวรัส | ระยะ 1 (40) การทดลองระยะแรกในมนุษย์ ไม่อำพราง หาขนาดยา ฉีดโดสเดียวหรือสองโดส ช่วงเวลาและแหล่ง: มิ.ย-ธ.ค. 2021, ออสเตรเลีย |
พรีคลินิก |
|
| ยังไม่ตั้งชื่อ
Osman ERGANIS, Scientific and Technological Research Council of Turkey |
ตุรกี | วัคซีนไวรัสโควิด-19 เชื้อตาย | ระยะ 1 (50) การศึกษาระยะที่ 1 เพื่อตรวจความปลอดภัยและประสิทธิศักย์ของวัคซีนเชื้อตายบวกยาเสริมเพื่อป้องกันโรคโควิด-19 ในอาสาสมัครสุขภาพดี ฉีดใต้ผิวหนัง แบ่งเป็นสองกลุ่มที่ใช้ยาขนาดไม่เท่ากัน ช่วงเวลาและแหล่ง: เม.ย.-ต.ค. 2021, ตุรกี |
พรีคลินิก |
|
| EXG-5003
Elixirgen Therapeutics, Fujita Health University |
ญี่ปุ่น สหรัฐ | วัคซีนอาร์เอ็นเอ | ระยะ 1-2 (60) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ช่วงเวลาและแหล่ง: เม.ย. 2021-ม.ค. 2023, ญี่ปุ่น |
พรีคลินิก |
|
| mRNACOVID-19 Vaccine
Stemirna Therapeutics Co. Ltd. |
จีน | วัคซีนอาร์เอ็นเอ | ระยะ 1 (240) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: มี.ค.-ก.ค. 2021, จีน |
พรีคลินิก |
|
| IVX-411
Icosavax, Seqirus Inc. |
สหรัฐ | อนุภาคคล้ายไวรัส | ระยะ 1-2 (168) ระยะ 1/2 (84) การทดลองแบบมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางผู้สังเกตการณ์ ช่วงเวลาและแหล่ง: มิ.ย. 2021-2022, ออสเตรเลีย |
พรีคลินิก |
|
| QazCoVac-P[506]
Research Institute for Biological Safety Problems |
คาซัคสถาน | วัคซีนซับยูนิต | ระยะ 1-2 (244) ระยะ 1 การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพราง ระยะ 2 การทดลองแบบสุ่ม ไม่อำพราง |
พรีคลินิก |
|
| LNP-nCOV saRNA-02
MRC/UVRI & LSHTM Uganda Research Unit |
ยูกันดา | วัคซีนอาร์เอ็นเอ | ระยะ 1 (42) การทดลองเพื่อตรวจความปลอดภัยและการตอบสนองของภูมิต้านทานซึ่งเป็นวัคซีนแบบ Self-amplifying Ribonucleic Acid ในอาสาสมัครชาวยูกันดาทั้งที่มีภูมิและไม่มีภูมิต้าทานไวรัสโควิด-19 ช่วงเวลาและแหล่ง: ก.ย. 2021-มิ.ย. 2022, Uganda |
พรีคลินิก |
|
| Noora[509]
Baqiyatallah University of Medical Sciences |
อิหร่าน | วัคซีนซับยูนิต (โปรตีน RBD ลูกผสม) | ระยะ 1 (70) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: มิ.ย.-ส.ค. 2021, อิหร่าน |
พรีคลินิก |
|
| Baiya SARS-CoV-2 Vax 1[511]
Baiya Phytopharm Co Ltd. |
ไทย | วัคซีนซับยูนิตที่เพาะในพืช (เป็นโปรตีน RBD-Fc บวกกับยาเสริม) | ระยะ 1 (96) การทดลองแบบสุ่ม ไม่อำพราง หาขนาดยา ช่วงเวลาและแหล่ง: ก.ย.-ธ.ค. 2021, Thailand |
พรีคลินิก |
|
| CVXGA1
CyanVac LLC |
สหรัฐ | เวกเตอร์ไวรัส | ระยะ 1 (80) ไม่อำพราง ช่วงเวลาและแหล่ง: ก.ค.-ธ.ค. 2021, สหรัฐ |
พรีคลินิก |
|
| ยังไม่ตั้งชื่อ
St. Petersburg Scientific Research Institute of Vaccines and Sera of Russia at the Federal Medical Biological Agency |
รัสเซีย | วัคซีนซับยูนิต (โปรตีนลูกผสม) | ระยะ 1-2 (200) ช่วงเวลาและแหล่ง: ก.ค.-? 2021, รัสเซีย |
พรีคลินิก |
|
| LVRNA009
Liverna Therapeutics Inc. |
จีน | วัคซีนอาร์เอ็นเอ | ระยะ 1 (24) ช่วงเวลาและแหล่ง: ก.ค.-พ.ย. 2021, จีน |
พรีคลินิก |
|
| PHH-1V
Hipra[516] |
สเปน | วัคซีนซับยูนิต | ระยะ 1-2 (30) การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพรางผู้สังเกตการณ์ หาขนาดยา ช่วงเวลาและแหล่ง: ส.ค.-พ.ย. 2021, สเปน |
พรีคลินิก |
|
| Versamune-CoV-2FC
Farmacore Biotechnology, PDS Biotechnology Corporation, Faculty of Medicine of Ribeirão Preto |
บราซิล สหรัฐ | วัคซีนซับยูนิต | ระยะ 1-2 (360) การทดลองแบบสุ่มและมีกลุ่มควบคุม อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: พ.ย. 2021-มี.ค. 2022, บราซิล |
พรีคลินิก |
|
| ยังไม่ตั้งชื่อ
North's Academy of Medical Science Medical biology institute |
เกาหลีหนือ | วัคซีนซับยูนิต (โปรตีนหนามบวกกับ Angiotensin-converting enzyme 2) | ระยะ 1-2 (?) ช่วงเวลาและแหล่ง: ก.ค. 2020, เกาหลีหนือ |
พรีคลินิก |
|
| ยังไม่ตั้งชื่อ
ซิโนฟาร์ม |
จีน | วัคซีนซับยูนิต | ระยะ 1-2 (?) ช่วงเวลาและแหล่ง: เม.ย. 2021-?, จีน |
พรีคลินิก |
|
| Vabiotech COVID-19 vaccine
Vaccine and Biological Production Company No.1 (Vabiotech) |
เวียดนาม | วัคซีนซับยูนิต | พรีคลินิก สถานะ - รอทำการทดลองระยะที่ 1[521] |
? |
|
| INO-4802
Inovio Pharmaceuticals |
สหรัฐ | วัคซีนดีเอ็นเอ | พรีคลินิก สถานะ - รอทำการทดลองระยะที่ 1/2[522] |
? |
|
| Bangavax (Bancovid) Globe Biotech Ltd of Bangladesh |
บังกลาเทศ | วัคซีนอาร์เอ็นเอ | พรีคลินิก สถานะ - รออนุมัติให้ทำการทดลองระยะแรก[525] |
? |
|
| ยังไม่ตั้งชื่อ
Indian Immunologicals, Griffith University[526] |
ออสเตรเลีย อินเดีย | วัคซีนเชื้อลดฤทธิ์ | พรีคลินิก |
? |
|
| EPV-CoV-19[527]
EpiVax |
สหรัฐ | วัคซีนซับยูนิต (T cell epitope-based protein) | พรีคลินิก |
? |
|
| CV2CoV[528]
CureVac, แกล็กโซสมิธไคลน์ |
เยอรมนี สหราชอาณาจักร | วัคซีนอาร์เอ็นเอ | พรีคลินิก |
? |
|
| DYAI-100[529]
Sorrento Therapeutics, Dyadic International, Inc.[530] |
สหรัฐ | วัคซีนซับยูนิต | พรีคลินิก |
? |
|
| ยังไม่ตั้งชื่อ[531]
กระทรวงสาธารณสุขมาเลเซีย, Malaysia Institute of Medical Research Malaysia, Universiti Putra Malaysia |
มาเลเซีย | วัคซีนอาร์เอ็นเอ | พรีคลินิก |
? |
|
| ARCT-165
Arcturus Therapeutics |
สหรัฐ | วัคซีนอาร์เอ็นเอ | พรีคลินิก สถานะ - รอการอนุมัติให้ทำาการทดลองระยะ 1/2[532] |
? |
|
| AdCOVID
Altimmune Inc. |
สหรัฐ | เวกเตอร์ไวรัส | ยกเลิกแล้ว (180) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก อำพรางทั้งสองฝ่าย ช่วงเวลาและแหล่ง: ก.พ. 2021-ก.พ. 2022, สหรัฐ |
พรีคลินิก |
|
| LNP-nCoVsaRNA หน่วย Medical Research Council Clinical Trials Unit ที่อิมพิเรียลคอลเลจลอนดอน |
สหราชอาณาจักร | วัคซีนอาร์เอ็นเอ | ระยะ 1 (105) การทดลองระยะที่ 1 แบบสุ่มโดยทดลองเพิ่มขนาดยา (15) แล้วขยายเพื่อตรวจสอบความปลอดภัย (อย่างน้อย 200) แหล่ง: สหราชอาณาจักร ช่วงเวลา: มิ.ย. 2020-ก.ค. 2021 |
พรีคลินิก |
|
| TMV-083
Institut Pasteur |
ฝรั่งเศส | เวกเตอร์ไวรัส | ยกเลิกแล้ว (90) การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยใช้ยาหลอก ช่วงเวลาและแหล่ง: ส.ค. 2020-ก.ค. 2021, เบลเยียม ฝรั่งเศส |
? |
|
| SARS-CoV-2 Sclamp/V451 มหาวิทยาลัยควีนส์แลนด์, Syneos Health, เซพี, Seqirus (ส่วนของ CSL Limited) |
วัคซีนซับยูนิต (โปรตีนหนามทำให้เสถียรด้วย molecular clamp บวกกับตัวเสริม MF59) | ยกเลิกแล้ว (120) การทดลองแบบสุ่มและใช้ยาหลอก อำพรางทั้งสองฝ่าย ตรวจหาขนาดยา สถานะ - ได้ผลบวกลวงเมื่อตรวจไวรัสเอชไอวีในอาสาสมัคร แหล่ง: บริสเบน ช่วงเวลา: ก.ค.-ต.ค. 2020 |
? |
| |
| V590[539] และ V591/MV-SARS-CoV-2[540]
เมอร์ค (Themis BIOscience), สถาบันปาสเตอร์, University of Pittsburgh's Center for Vaccine Research (CVR), เซพี |
สหรัฐ ฝรั่งเศส | วัคซีนที่ใช้ไวรัส Vesicular stomatitis เป็นเวกเตอร์[541] หรือ Measles morbillivirus เป็นเวกเตอร์[542] | ยกเลิกแล้ว สถานะ - การทดลองระยะที่ 1 พบการตอบสนองของภูมิคุ้มกันในระดับอ่อนกว่าที่พบในการติดเชื้อจริง ๆ และที่พบในวัคซีนโควิด-19 อื่น ๆ[543] |
- ↑ สถาบันเซรุ่มแห่งอินเดีย (Serum Institute of India) จะเป็นผู้ผลิตวัคซีน ChAdOx1 nCoV-19 ให้แก่อินเดีย[122] ประเทศรายได้ต่ำและปานกลางอื่น ๆ[123]
- ↑ ชื่อใช้ที่มหาวิทยาลัยคือ ChAdOx1 nCoV-19 สถาบัน Oswaldo Cruz Foundation จะเป็นผู้ผลิตในบราซิล[124]
- ↑ 3.0 3.1 3.2 3.3 Interventional, non-randomised
- ↑ ใช้ชื่อว่า BNT162b2 เมื่อยังไม่ได้อนุมัติ
- ↑ 5.0 5.1 Nucleoside-modified messenger RNA, ตัวย่อ modRNA
- ↑ 6.0 6.1 นี่เป็นระยะห่างที่แนะนำ แต่โดสที่สองของไฟเซอร์และโมเดอร์นาสามารถฉีดได้ช้าสุด 6 สัปดาห์หลังโดสแรกถ้าขาดแคลนวัคซีน[138][139]
- ↑ ของไฟเซอร์สามารถเก็บเป็นระยะยาวในอุณหภูมิระหว่าง −25 และ −15 องศาเซลเซียส (−13 และ 5 องศาฟาเรนไฮต์) จนถึง 2 สัปดาห์ก่อนจะใช้ และระหว่าง 2 และ 8 องศาเซลเซียส (36 และ 46 องศาฟาเรนไฮต์) ได้จนถถึง 5 วันก่อนจะใช้[140][141]
- ↑ นี่เป็นอุณหภูมิที่ใช้เก็บ Gam-COVID-Vac สูตรแช่แข็ง แต่สูตรทำแห้งเยือกแข็ง คือ Gam-COVID-Vac-Lyo สามารถเก็บไว้ระหว่างอุณหภูมิ 2-8 องศาสเซลเซียส[171]
- ↑ Recombinant adenovirus type 5 vector
- ↑ Subunit peptide
- ↑ Recombinant subunit vaccine
- ↑ 12.0 12.1 Subunit vaccine
- ↑ ระยะล่าสุดที่ได้ตีพิมพ์ผล
- ↑ เป็นแผนกวัคซีนของบริษัทยาซาโนฟี่
- ↑ อนุภาคคล้ายไวรัส (virus-like particles) ที่ก่อในพืชประจำถิ่นออสเตรเลีย Nicotiana benthamiana ซึ่งอยู่ในสกุลเดียวกันกับยาสูบ[307]
- ↑ recombinant spike protein
- ↑ Recombinant protein
- ↑ electroporation หรือ electropermeabilization หรือ electrotransfer เป็นเทคนิคทางจุลชีววิทยาที่ประกบสนามไฟฟ้ากับเซลล์เพื่อเพิ่มสภาพให้ซึมผ่านได้ของเยื่อหุ้มเซลล์ จึงทำให้สารเคมี ยา หรือดีเอ็นเอเข้าไปในเซลล์ได้[377][378]
- ↑ ระยะ 1-2a ในเกาหลีใต้ทำพร้อมกับระยะ 2-3 ในสหรัฐ
การฉีดวัคซีนบูสต์ชนิดเดียวกัน[แก้]
ในเดือนกรกฎาคม 2021 องค์การอาหารและยาสหรัฐ (FDA) และศูนย์ควบคุมและป้องกันโรคสหรัฐ (CDC) ได้ร่วมกันแถลงการณ์ว่า การฉีดวัคซีนบูสต์ยังไม่จำเป็นสำหรับผู้ที่ได้รับวัคซีนตามสูตรแล้ว[544] โดยระบุด้วยว่า องค์กรต่าง ๆ ของรัฐรวมทั้ง FDA, CDC, และสถาบันสุขภาพแห่งชาติสหรัฐมุ่งมั่นใช้กระบวนการทางวิทยาศาสตร์ที่เข้มงวดเพื่อพิจารณาว่า เมื่อไรจึงต้องฉีดวัคซีนบูสต์[544] ต่อมาในเดือนสิงหาคม FDA และ CDC จึงได้อนุมัติให้ฉีดวัคซีนเอ็มอาร์เอ็นเอเป็นตัวบูสต์สำหรับผู้ที่มีภูมิคุ้มกันบกพร่อง[545][546]
การฉีดวัคซีนบูสต์ต่างชนิด[แก้]
ผู้เชี่ยวชาญบางส่วนเชื่อว่า การฉีดวัคซีนสองโดสต่างชนิดกัน (prime-boost vaccination) จะช่วยเพิ่มภูมิคุ้มกันเทียบกับการฉีดวัคซีนสองโดสเหมือนกัน โดยมีงานศึกษาที่กำลังตรวจสอบผลเช่นนี้อยู่[547] แม้จะยังไม่มีข้อมูลทางคลินิกเกี่ยวกับประสิทธิศักย์และความปลอดภัยของการฉีดวัคซีนไขว้เช่นนี้ แคนาดาและประเทศต่าง ๆ ในยุโรปต่างก็แนะนำให้ฉีดวัคซีนโดสที่สองต่างชนิดกันสำหรับบุคคลที่ได้รับวัคซีนแอสตร้าเซนเนก้าเป็นโดสที่หนึ่ง[548]
ในเดือนกุมภาพันธ์ 2021 กลุ่มวิจัยวัคซีนที่มหาวิทยาลัยออกซฟอร์ดได้เริ่มการทดลองซึ่งตรวจสอบการได้วัคซีนโควิด-19 สองโดสโดยต่างชนิด[549] ณ เดือนมิถุนายนปีเดียวกัน ก็ได้ดำเนินไปถึงการทดลองทางคลินิกระยะที่ 2 แล้วโดยมีงานสองงาน คือ Com-COV และ Com-COV2[550]
งานทดลอง Com-COV เปรียบการฉีดวัคซีนไขว้คือ วัคซีนของแอสตร้าเซนเนก้ากับของไฟเซอร์-ไบออนเทค เทียบกับการฉีดวัคซีนสองชนิดสองเข็มประเภทเดียวกัน โดยมีระยะห่าง 28 วัน (4 สัปดาห์) หรือ 84 วัน (12 สัปดาห์) ระหว่างโดส[551][552] [แหล่งอ้างอิงทางการแพทย์ที่ไม่น่าเชื่อถือ?] ส่วนงานทดลอง Com-COV2 ฉีดวัคซีนโดสแรกซึ่งไม่เป็นของแอสตร้าเซนเนก้าก็เป็นของไฟเซอร์ ส่วนโดสที่สองเป็นของโมเดอร์นา หรือของโนวาแวกซ์ หรือเป็นวัคซีนชนิดเดียวกันกับโดสแรก โดยฉีดห่างกัน 56 วัน (8 สัปดาห์) หรือ 84 วัน (12 สัปดาห์)[553]
งานศึกษาอีกงานหนึ่งในสหราชอาณาจักรกำลังตรวจการฉีดบูสต์ซึ่งเลือกวัคซีนโดยสุ่ม วัคซีนอาจเป็นของแอสตร้าเซนเนก้า, ของไฟเซอร์, ของโมเดอร์นา, ของโนวาแวกซ์, VLA2001, CureVac, หรือของจอห์นสันแอนด์จอห์นสัน[554]
| โดสแรก | โดสสอง | ตารางการฉีด | ระยะการทดลอง (จำนวนอาสาสมัคร), ช่วงเวลา และเขตที่ทำ |
|---|---|---|---|
| แอสตร้าเซนเนก้า ไฟเซอร์ |
แอสตร้าเซนเนก้า ไฟเซอร์ |
วันที่ 0 และ 28 วันที่ 0 และ 84 |
ระยะ 2 (820) ช่วงเวลาและแหล่ง: ก.พ.-ส.ค. 2021, สหราชอาณาจักร |
| สปุตนิกไลท์ | แอสตร้าเซนเนก้า ของโมเดอร์นา ของซิโนฟาร์ม |
ระยะ 2 (121) ช่วงเวลาและแหล่ง: ก.พ.-ส.ค. 2021, อาร์เจนตินา | |
| แอสตร้าเซนเนก้า ไฟเซอร์ |
แอสตร้าเซนเนก้า ไฟเซอร์ โมเดอร์นา โนวาแวกซ์ |
วันที่ 0 และ 56-84 | ระยะ 2 (1,050) ช่วงเวลาและแหล่ง: มี.ค. 2021-ก.ย. 2022, สหราชอาณาจักร |
| Convidecia | ZF2001 | วันที่ 0 และ 28 วันที่ 0 และ 56 |
ระยะ 4 (120) ช่วงเวลาและแหล่ง: เม.ย.-ธ.ค. 2021, จีน |
| แอสตร้าเซนเนก้า | ไฟเซอร์ | วันที่ 0 และ 28 | ระยะ 2 (676) ช่วงเวลาและแหล่ง: เม.ย. 2021-เม.ย. 2022, สเปน |
| แอสตร้าเซนเนก้า ไฟเซอร์ โมเดอร์นา |
ไฟเซอร์ โมเดอร์นา |
วันที่ 0 และ 28 วันที่ 0 และ 112 |
ระยะ 2 (1,200) ช่วงเวลาและแหล่ง: พ.ค. 2021-มี.ค. 2023, แคนาดา |
| ไฟเซอร์ โมเดอร์นา |
ไฟเซอร์ โมเดอร์นา |
วันที่ 0 และ 42 | ระยะ 2 (400) ช่วงเวลาและแหล่ง: พ.ค. 2021-ม.ค. 2022, ฝรั่งเศส |
| แอสตร้าเซนเนก้า | ไฟเซอร์ | วันที่ 0 และ 28 วันที่ 0 และ 21-49 |
ระยะ 2 (3,000) ช่วงเวลาและแหล่ง: พ.ค.-ธ.ค. 2021, ออสเตรีย |
| จอห์นสัน | ไฟเซอร์ จอห์นสัน โมเดอร์นา |
วันที่ 0 และ 84 | ระยะ 2 (432) ช่วงเวลาและแหล่ง: มิ.ย. 2021-ก.ย. 2022, เนเธอร์แลนด์ |
งานวิจัยพรีคลินิก[แก้]
ในเดือนเมษายน องค์การอนามัยโลกแถลงการณ์โดยเป็นตัวแทนของนักวิทยาศาสตร์กลุ่มต่าง ๆ ทั่วโลกว่าจะร่วมมือกันเพื่อเร่งพัฒนาวัคซีนป้องกันโรคโควิด[562] โดยชักชวนองค์กรต่าง ๆ รวมทั้งองค์กรที่กำลังพัฒนาวัคซีนแคนดิเดต องค์กรควบคุมและตั้งนโยบายของรัฐ ผู้ให้เงินทุน องค์กรสาธารณสุข และรัฐบาล ให้ร่วมมือกันเพื่อให้สามารถผลิตวัคซีนที่มีประสิทธิผลได้โดยมีปริมาณเพียงพอในการแจกจำหน่ายให้แก่เขตต่าง ๆ ทั้งหมดของโลกโดยเฉพาะเขตที่ยากจน[31]
เมื่อวิเคราะห์ประวัติของอุตสาหกรรมพัฒนาวัคซีนก็พบว่า การพัฒนาจะล้มเหลวในอัตราร้อยละ 84–90[31][89] อนึ่ง เพราะโควิดเป็นไวรัสใหม่ มีลักษณะต่าง ๆ ที่ยังไม่ชัดเจนทั้งหมด และต้องใช้กลยุทธ์และเทคโนโลยีใหม่ ๆ เพื่อพัฒนาวัคซีน ทุก ๆ ขั้นตอนจึงเสี่ยงไม่สำเร็จสูงมาก[31]
เพื่อประเมินประสิทธิผลที่วัคซีนหนึ่ง ๆ อาจมี ก็จะต้องพัฒนาแบบจำลองทางคอมพิวเตอร์และสัตว์จำลองซึ่งเฉพาะเจาะจงต่อโควิดที่ไม่เคยมีมาก่อน และสิ่งจำลองเหล่านี้ก็ยังไม่สามารถทดสอบยืนยันกับลักษณะต่าง ๆ ของไวรัสที่ยังไม่ปรากฏ เป็นสิ่งที่ต้องร่วมกันทำโดยกำลังจัดตั้งในปี 2020[31] ในบรรดาวัคซีนแคนดิเดตที่ยืนยันแล้วว่ากำลังพัฒนา บริษัทเอกชนเป็นผู้พัฒนาในอัตราร้อยละ 70 ที่เหลือนักวิชาการ รัฐบาล และองค์กรสาธารณสุขเป็นผู้พัฒนา[38]
ผู้พัฒนาวัคซีนโดยมากเป็นบริษัทเล็ก ๆ หรือทีมนักวิจัยในมหาวิทยาลัยผู้มีประสบการณ์น้อยในการออกแบบวัคซีนให้ประสบความสำเร็จ มีทุนจำกัดเพื่อทำงานทดลองทางคลินิกที่ซับซ้อนและเพื่อผลิตวัคซีนถ้าไม่ได้บริษัทเภสัชภัณฑ์ยักษ์ใหญ่ข้ามชาติเป็นหุ้นส่วน[38][31] ผู้กำลังพัฒนาวัคซีนรวมองค์กรในสหรัฐและแคนาดาซึ่งทั้งสองรวมกันมีงานวิจัยวัคซีนที่กำลังดำเนินการเป็นอัตราร้อยละ 46 ทั้งหมดของโลก เทียบกับเอเชียที่ร้อยละ 36 รวมทั้งประเทศจีน และกับยุโรปที่ร้อยละ 18[31]
การทดลองระยะ 1 ที่วางแผนในปี 2020[แก้]
วัคซีนแคนดิเดตที่กำลังออกแบบหรือพัฒนาในระยะพรีคลินิกสำหรับโควิดอาจไม่ได้รับอนุมัติให้ศึกษาในมนุษย์ช่วงปี 2020 เพราะเป็นพิษ ไม่มีประสิทธิผลชักนำให้ภูมิคุ้มกันตอบสนอง หรือล้มเหลวในด้านต่าง ๆ ในสัตว์ทดลอง หรืออาจไม่มีทุนพอ[563][564] สำหรับโรคติดเชื้อ โอกาสประสบความสำเร็จของวัคซีนแคนดิเดตในการฝ่าอุปสรรคระยะพรีคลินิกแล้วเข้าสู่การทดลองในมนุษย์ระยะที่ 1 อยู่ในอัตราร้อยละ 41–57[563]
ค่าใช้จ่ายของการทดลองเบื้องต้นในมนุษย์ค่อนข้างสูงสำหรับผู้พัฒนาวัคซีน ประเมินอยู่ที่ 14–25 ล้านดอลลาร์สหรัฐ (ประมาณ 440–786 ล้านบาท) สำหรับโปรแกรมการทดลองระยะที่ 1 ทั่วไป แต่ก็อาจถึง 70 ล้านดอลลาร์สหรัฐ (ประมาณ 2,200 ล้านบาท) ได้เหมือนกัน[563][565] เมื่อเปรียบเทียบกับ|โรคไวรัสอีโบลาที่ระบาดทั่วระหว่างปี 2013–2016 ซึ่งมีวัคซีนแคนดิเดต 37 ชนิดที่พัฒนาอย่างเร่งด่วน มีเพียงชนิดเดียวเท่านั้นที่ได้รับอนุมัติให้ใช้เป็นวัคซีน โดยมีค่าใช้จ่ายเพื่อยืนยันประสิทธิผลในการทดลองระยะที่ 2–3 ประมาณพันล้านดอลลาร์สหรัฐ (35,292 ล้านบาท)[563]
วัคซีนที่ไม่เฉพาะเจาะจงโรคโควิด[แก้]
วัคซีนบางชนิดมีผลที่ไม่เฉพาะเจาะจง (non-specific effects) คืออาจมีประโยชน์เกินนอกเหนือจากโรคที่ป้องกัน[566]
แม้อ้างว่า (มี.ค., มิ.ย. และ ก.ค.) อัตราการตายเหตุโควิดจะต่ำกว่าในประเทศที่ฉีดวัคซีนบีซีจีเพื่อป้องกันวัณโรคเป็นปกติ[567][568][569][570] แต่องค์การอนามัยโลกก็กล่าวในเดือนเมษายนว่า ไม่มีหลักฐานว่าวัคซีนนี้มีผลต้านโควิด[571] ในเดือนมีนาคม 2020 ประเทศเนเธอร์แลนด์ได้เริ่มการทดลองวัคซีนบีซีจีแบบสุ่มเพื่อลดการติดโรคโควิดโดยรับแพทย์พยาบาล 1,000 คน[572] ออสเตรเลียก็ทดลองแบบสุ่มเช่นกันโดยรับแพทย์พยาบาล 4,170 คน[573][574]
การทดลองแบบสุ่มและมีกลุ่มควบคุมโดยยาหลอกเพื่อตรวจว่าวัคซีนเอ็มเอ็มอาร์ (ป้องกันโรคหัด-คางทูม-หัดเยอรมัน) สามารถป้องกันแพทย์พยาบาลจากโรคโควิดจะเริ่มในเดือนพฤษภาคม 2020 ที่กรุงไคโรโดยรับอาสาสมัคร 200 คน[575]
วัคซีนบีซีจี[แก้]
นักวิจัยได้ศึกษาวัคซีนบีซีจีอันอาจมีผลที่ไม่เฉพาะเจาะจง (non-specific effects) เป็นการป้องกันการติดเชื้อไวรัสโควิด-19 หลังจากสังเกตการณ์ว่าอัตราตายและความรุนแรงของโรคจะน้อยกว่าในประเทศกำลังพัฒนา (ที่มักใช้วัคซีนนี้) แต่องค์การอนามัยโลกก็เตือนว่า มีปัจจัยหลายอย่างที่อาจมีผลต่อข้อสังเกตเช่นนี้เช่น อัตราการตรวจโรคโควิดและภาระโรค (disease burden)[576] ในการทดลองแบบสุ่มและมีกลุ่มควบคุม วัคซีนนี้พบว่ามีผลไม่เฉพาะเจาะจงเป็นการป้องกันการติดเชื้อทางลมหายใจอื่น ๆ[577]
ปัจจุบัน ยังไม่มีหลักฐานพอสนับสนุนข้อสรุปว่า วัคซีนบีซีจีมีประสิทธิภาพป้องกันโควิด[578] ในเดือนตุลาคม มหาวิทยาลัยเอ็กซิเตอร์ (อังกฤษ) ประกาศการทดลองนานาชาติขนาดใหญ่เพื่อศึกษาว่า การให้วัคซีนบีซีจีสามารถลดอันตรายของโควิดต่อบุคลากรทางแพทย์หรือไม่[579][580] ซึ่งเนเธอร์แลนด์ก็ประกาศเช่นเดียวกันในเดือนพฤษภาคมก่อนหน้านั้น[577]
การใช้ตัวเสริม (adjuvant)[แก้]
จนถึงเดือนกันยายน 2020 วัคซีนแคนดิเดต 11 อย่างที่อยู่ในระยะการทดลองทางคลินิกใช้ตัวเสริมเพื่อเพิ่มการตอบสนองของภูมิคุ้มกัน[38] ตัวเสริม หรือ immunological adjuvant เป็นสารที่เลือกใช้กับวัคซีนเพื่อเพิ่มการตอบสนองของภูมิคุ้มกันต่อแอนติเจน เช่นต่อไวรัสโควิดหรือไข้หวัดใหญ่[581] ตรง ๆ ก็คือ ตัวเสริมอาจใช้กับวัคซีนโควิดเพื่อเพิ่มการตอบสนองของภูมิคุ้มกันและเพิ่มประสิทธิศักย์ในการลดหรือป้องกันการติดเชื้อโควิดในบุคคลที่ได้วัคซีน[581][582] ตัวเสริมอาจมีประสิทธิภาพเป็นพิเศษในเทคโนโลยีที่ใช้ไวรัสโควิดเชื้อตาย (inactivated) ในวัคซีนโปรตีนที่ได้จากยีนลูกผสม (recombinant protein) หรือในวัคซีนที่ใช้เวกเตอร์ (vector)[582] เกลืออะลูมิเนียม (aluminum salt, alum) เป็นตัวเสริมแรกที่ใช้ในวัคซีนซึ่งได้อนุมัติ โดยเลือกใส่ในวัคซีนที่ใช้ตัวเสริมเกินร้อยละ 80[582] และได้ใช้มาตั้งแต่คริสต์ทศวรรษ 1920 เป็นสารที่เริ่มกลไกทางโมเลกุลและเซลล์อย่างหลายหลากเพื่อเพิ่มการตอบสนองของภูมิคุ้มกัน รวมทั้งการปล่อยไซโตไคน์ที่เสริมการอักเสบ[581][582]
ประสิทธิศักย์[แก้]

ประสิทธิศักย์ของวัคซีน (efficacy) หมายถึงสมรรถภาพของวัคซีนในการลดความเสี่ยงการติดโรคของผู้ได้รับวัคซีนในการทดลองแบบมีกลุ่มควบคุม โดยเทียบกับผู้ไม่ได้รับ[147] ประสิทธิศักย์ที่ ร้อยละ 0 หมายถึงวัคซีนไม่มีผลเลย (คือมีผลเท่ากับยาหลอก) และที่ร้อยละ 50 ก็หมายถึงการมีกรณีการติดโรคครึ่งหนึ่งเทียบกับผู้ไม่ได้วัคซีน
ประสิทธิศักย์อาจลดลงถ้าผู้ฉีดจับแขนหรือบีบแขนของผู้รับวัคซีนอย่างไม่ถูกต้อง ทำให้ฉีดวัคซีนเข้าใต้ผิวหนังแทนที่จะฉีดเข้ากล้ามเนื้อ[584][585] แนวทางการปฏิบัติปัจจุบันของศูนย์ป้องกันโรคสหรัฐก็คือไม่ควรฉีดวัคซีนซ้ำหลังจากที่ได้ฉีดพลาดเข้าใต้ผิวหนัง[586]
เป็นการยากที่จะเทียบประสิทธิศักย์ของวัคซีนต่างชนิดกัน เพราะข้อมูลประสิทธิศักย์ของวัคซีนแต่ละชนิดได้จากการทำการทดลองกับกลุ่มประชากรที่ต่างกัน ในภูมิภาคที่ต่างกัน และกับไวรัสสายพันธุ์ต่าง ๆ กัน[587] สำหรับโควิด-19 ประสิทธิศักย์ที่ร้อยละ 67 อาจพอชลอให้โรคระบาดช้าลง แต่วัคซีนที่มีในปัจจุบันก็ไม่ได้สร้างภูมิคุ้มกันแบบกำจัดเชื้อ (sterilizing immunity)[588] ซึ่งจำเป็นในการป้องกันไม่ให้โรคติดต่อ ประสิทธิศักย์ของวัคซีนจริง ๆ สะท้อนเพียงการป้องกันโรค และอาจเป็นตัวบ่งชี้การติดต่อเชื้อที่ไม่ดีเพราะผู้ไม่มีอาการก็ยังสามารถแพร่เชื้อไปให้คนอื่นได้มาก[589]
องค์การอาหารและยาสหรัฐ (FDA) และสำนักงานการแพทย์ยุโรป (EMA) มีเกณฑ์ประสิทธิศักย์ขั้นต่ำของวัคซีนโควิด-19 ที่ร้อยละ 50 สำหรับการขึ้นทะเบียนให้ใช้[590][591][592] ทั่วไปแล้ว การฉีดวัคซีนให้ประชากรร้อยละ 75 เป็นเป้าหมายที่เชื่อว่าปฏิบัติได้จริง ดังนั้น วัคซีนจึงต้องมีประสิทธิภาพอย่างน้อยร้อยละ 70 เพื่อไม่ให้โรคระบาด (ขึ้นอยู่กับค่าระดับการติดเชื้อพื้นฐาน คือ ) และร้อยละ 80 เพื่อกำจัดโรคโดยไม่ต้องควบใช้นโยบายอื่น ๆ เช่น การเว้นระยะห่างทางสังคม[593]
ประสิทธิศักย์ที่ไม่น้อยของวัคซีนเอ็มอาร์เอ็นเอบางอย่างหลังจากฉีดเพียงแค่โดสเดียวเป็นตัวบ่งว่า[594] การฉีดวัคซีนแต่ละโดสสัมพันธ์อย่างไม่เชิงเส้นกับประสิทธิศักย์ ซึ่งจริง ๆ ก็ได้เห็นแล้วตั้งแต่การทดลองระยะที่ 1-2[595] และแสดงนัยว่า การให้วัคซีนในขนาดที่เฉพาะบุคคล ๆ (เช่น ให้เต็มสูตรสำหรับคนชรา ให้น้อยลดสำหรับเยาวชน[596] และให้เพิ่มสำหรับผู้มีภูมิคุ้มกันบกพร่อง[597]) อาจช่วยเร่งการฉีดวัคซีนให้แก่ประชาชนเมื่อวัคซีนมีจำกัด และช่วยย่นระยะเหตุการณ์ระบาด ดังที่จริง ๆ แบบจำลองการระบาดได้แสดงให้เห็นแล้ว[598]
พิสัยต่าง ๆ ในตารางต่อไปนี้มีช่วงความเชื่อมั่น (CI) ที่ร้อยละ 95 ยกเว้นจะระบุเป็นพิเศษ โดยค่าเป็นจริงสำหรับคนทุกช่วงอายุตามแหล่งอ้างอิง โดยนิยามแล้ว ความแม่นยำของค่าประเมินที่ไม่มีช่วงความเชื่อมั่นจะยังไม่ชัดเจน ค่าประสิทธิศักย์ในการป้องกันโรคที่มีอาการรุนแรงเป็นเรื่องสำคัญสุด เพราะการเข้า รพ. และความตายเป็นปัญหาทางสาธารณสุขที่ต้องป้องกันก่อนอื่น[599] วัคซีนที่ได้ขึ้นทะเบียนให้ใช้มีค่าประสิทธิศักย์ดังต่อไปนี้
| วัคซีน | ประสิทธิศักย์ตามความรุนแรงของโรค | ที่ทำการทดลอง | แหล่งอ้างอิง | ||
|---|---|---|---|---|---|
| น้อยหรือปานกลาง[α]อย่างเบา ๆ | รุนแรงแต่ไม่ถึงเข้า รพ. และไม่ถึงตาย[β] | รุนแรงจนถึงเข้า รพ. หรือถึงตาย[γ] | |||
| ออกซฟอร์ด-แอสตร้าเซนเนก้า | ≈81% (60–91%)[δ] | ≈100% (97.5 % CI, 72–100%) | ≈100%[ε] | หลายประเทศ | [131] |
| ≈76% (68–82%)[ζ] | ≈100%[ε] | ≈100%[ε] | สหรัฐ | [600] | |
| ไฟเซอร์-ไบออนเทค | ≈95% (90–98%)[η] | ≈66% (−125 to 96%)[θ][η] | หลายประเทศ | [601] | |
| ≈95% (90–98%)[η] | ไม่มีรายงาน | ไม่มีรายงาน | สหรัฐ | [602] | |
| จอห์นสันแอนด์จอห์นสัน | ≈66% (55–75%)[ι][κ] | ≈85% (54–97%)[κ] | ≈100%[κ][ε][λ] | หลายประเทศ | [153] |
| ≈72% (58–82%)[ι][κ] | ≈86% (−9 to 100%)[θ][κ] | ≈100%[ε][κ][λ] | สหรัฐ | ||
| ≈68% (49–81%)[ι][κ] | ≈88% (8–100%)[κ] | ≈100%[ε][κ][λ] | บราซิล | ||
| ≈64% (41–79%)[ι][κ] | ≈82% (46–95%)[κ] | ≈100%[ε][κ][λ] | แอฟริกาใต้ | ||
| โมเดอร์นา | ≈94% (89–97%)[μ] | ≈100%[ε][ν] | ≈100%[ε][ν] | สหรัฐ | [604] |
| ซิโนฟาร์ม (BBIBP-CorV) | ≈78% (65–86%) | ≈100%[ε] | ≈100%[ε] | หลายประเทศ | [157] |
| สปุตนิกวี | ≈92% (86–95%) | ≈100% (94–100%) | ≈100%[ε] | รัสเซีย | [173] |
| ซิโนแวค | ≈51% (36–62%)[ξ] | ≈84% (58–94%)[ξ] | ≈100% (56–100%)[ξ] | บราซิล | [605][606][607] |
| ≈84% (65–92%) | ≈100%[ε] | ≈100% (20–100%)[θ] | ตุรกี | [607] | |
| โคแว็กซิน | ≈78% (65–86%)[ξ] | ≈93% (57–100%)[ξ] | อินเดีย | [608][609] | |
| สปุตนิกไลท์ | ≈79%[ε] | ไม่มีรายงาน | ไม่มีรายงาน | รัสเซีย | [610] |
| Convidecia | ≈66%[ε][ξ] | ≈91%[ε][ξ] | ไม่มีรายงาน | หลายประเทศ | [208] |
| ซิโนฟาร์ม (WIBP-CorV) | ≈73% (58–82%) | ≈100%[ε][ο] | ≈100%[ε][ο] | หลายประเทศ | [611] |
| Abdala | ≈92% (86–96%) | ไม่มีรายงาน | ไม่มีรายงาน | คิวบา | [612] |
| Soberana 02 | ≈62%[ε] | ไม่มีรายงาน | ไม่มีรายงาน | คิวบา | [613] |
| โนวาแวกซ์ | ≈90% (75–95%) | ≈100%[ε][ο] | ≈100%[ε][ο] | สหราชอาณาจักร | [614][615][616] |
| ≈60% (20–80%)[θ] | ≈100%[ε][ο] | ≈100%[ε][ο] | แอฟริกาใต้ | ||
| ≈90%[ε] | ไม่มีรายงาน | ไม่มีรายงาน | สหรัฐ | ||
| ไม่มีรายงาน | ไม่มีรายงาน | เม็กซิโก | |||
| CureVac | ≈48%[ε] | ไม่มีรายงาน | ไม่มีรายงาน | หลายประเทศ | [617] |
| ZyCoV-D | ≈67%[ε] | ไม่มีรายงาน | ไม่มีรายงาน | อินเดีย | [618] |
- ↑ อาการน้อยรวมทั้งเป็นไข้ ไอแห้ง ล้า ปวดกล้ามเนื้อ ปวดข้อ เจ็บคอ ท้องร่วง คลื่นไส้ อาเจียน ปวดศีรษะ ไม่ได้กลิ่น ไม่รู้รส คัดจมูก น้ำมูกไหล ตาแดง เป็นผื่น หนาวสะท้าน เวียนศีรษะ อาการปานกลางคือ ปอดอักเสบ
- ↑ อาการรุนแรงแต่ไม่ถึงต้องเข้า รพ. และไม่เสียชีวิตสำหรับคนหนึ่ง ๆ หมายถึงอาการทางการหายใจที่รุนแรงตามที่วัดเมื่อพักหรือเมื่อกำลังตรวจ (ซึ่งนอกเหนือจากการมีปอดบวม ลิ่มเลือดในหลอดเลือดดำส่วนลึก หายใจลำบาก ภาวะพร่องออกซิเจน การเจ็บหน้าอกอย่างคงยืน เบื่ออาหาร สับสน เป็นไข้สูงกว่า 38 องศาสเซลเซียส) เป็นอาการที่ยังไม่คงยืนหรือรุนแรงพอให้เข้า รพ. หรือทำให้ถึงชีวิต โดยเป็นอย่างใดอย่างหนึ่งดังต่อไปนี้ คือ หายใจ ≥ 30 ครั้งต่อนาที, หัวใจเต้น ≥ 125 ครั้งต่อนาที, ความเข้มข้นออกซิเจนในเลือด (SpO2) ≤ 93% เมื่อหายใจปกติที่ระดับน้ำทะเล หรือ partial pressure of oxygen/fraction of inspired oxygen (PaO2/FiO2) < 300 mmHg
- ↑ อาการรุนแรงจนต้องเข้า รพ. หรือถึงตายหมายถึงอาการที่ต้องรักษาที่ รพ. หรือทำให้ถึงตาย รวมทั้ง หายใจลำบาก ภาวะพร่องออกซิเจน การเจ็บหน้าอกอย่างคงยืน เบื่ออาหาร สับสน เป็นไข้สูงกว่า 38 องศาสเซลเซียส) การหายใจล้มเหลว ไตวาย การทำงานผิดปกติของอวัยวะหลายระบบ ภาวะพิษเหตุติดเชื้อ และช็อก
- ↑ เมื่อฉีด 2 โดสโดยห่างกันอย่างน้อย12 สัปดาห์ แต่เมื่อฉีดห่างกันน้อยกว่า 6 สัปดาห์ ประสิทธิศักย์จะอยู่ที่ ≈55% (33–70%)
- ↑ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17 5.18 5.19 5.20 5.21 5.22 5.23 5.24 5.25 ไม่ได้ระบุช่วงความเชื่อมั่น (CI) จึงไม่สามารถรู้ความแม่นยำของค่านี้ได้จริง ๆ
- ↑ เมื่อฉีด 2 โดสโดยห่างกัน 4 สัปดาห์เป็นค่าประสิทธิศักย์เพื่อ "ป้องกันโรคโควิด-19 ที่แสดงอาการ"
- ↑ 7.0 7.1 7.2 ในการทดลองวัคซีนของไฟเซอร์-ไบออนเทค สำหรับกลุ่มฉีดวัคซีน ผู้มีอาการโควิด-19 จะนับว่าติดโรคก็ต่อเมื่อเริ่มมีอาการยิ่งกว่า 7 วันหลังฉีดวัคซีนโดสที่ 2 และยืนยันด้วยการตรวจ RT-PCR เป็นผลบวก
กรณีที่มีอาการน้อยหรือปานกลางต้องมีอาการดังต่อไปนี้อย่างใดอย่างหนึ่งและตรวจพบเชื้อภายใน 4 วันก่อนหรือหลังช่วงที่มีอาการ อาการรวมทั้ง เป็นไข้ เริ่มไอหรือไอเพิ่ม เริ่มหายใจติดขัดหรือติดขัดเพิ่ม หนาวสะท้าน เริ่มปวดกล้ามเนื้อหรือปวดเพิ่ม เริ่มไม่ได้กลิ่นหรือไม่รู้รสหรือเป็นเพิ่ม เจ็บคอ ท้องร่วง หรืออาเจียน
เค้สอาการรุนแรงยังต้องมีอาการเพิ่มดังต่อไปนี้อย่างใดอย่างหนึ่ง
- อาการเมื่อพักที่แสดงว่าเป็นโรคทั้งร่างกายอย่างรุนแรง (หายใจ ≥30 ครั้งต่อนาที, หัวใจเต้น ≥ 125 ครั้งต่อนาที, ความเข้มข้นออกซิเจน (SpO2) ≤93% เมื่อหายใจปกติที่ระดับน้ำทะเล หรือ PaO2/FiO2 < 300 mmHg),
- การหายใจล้มเหลว (นิยามว่าต้องใช้ออกซิเจนแบบไฮโฟลว์ หรือใช้เครื่องช่วยหายใจ คือ non-invasive ventilation, mechanical ventilation หรือ ECMO)
- มีหลักฐานว่าช็อก คือ SBP < 90 mm Hg, DBP < 60 mm Hg หรือต้องใช้สารกระตุ้นการหดตัวกล้ามเนื้อหลอดเลือด (vasopressors)
- การทำงานผิดปกติอย่างฉับพลันและสำคัญของไต ตับ และระบบประสาท,
- เข้าห้องไอซียู
- เสียชีวิต[601][602]
- ↑ 8.0 8.1 8.2 8.3 ค่านี้ไม่แม่นยำพอเพื่อจะยืนยันว่ามีประสิทธิศักย์สูงจริง ๆ เพราะค่าจำกัดล่างของช่วงความเชื่อมั่น (CI) แบบ 95% นั้นต่ำกว่า 30%
- ↑ 9.0 9.1 9.2 9.3 กรณีมีอาการปานกลาง
- ↑ 10.00 10.01 10.02 10.03 10.04 10.05 10.06 10.07 10.08 10.09 10.10 10.11 เป็นค่าประสิทธิศักย์ที่รายงาน ณ วันที่ 28 หลังฉีดวัคซีนของจอห์นสันแอนด์จอห์นสันแบบโดสเดียว โดยค่าจะต่ำกว่าถ้ารายงาน ณ วันที่ 14 หลังฉีดวัคซีน[153]
- ↑ 11.0 11.1 11.2 11.3 หลังจากฉีดวัคซีน 28 วัน ไม่มีใครเข้า รพ. หรือเสียชีวิตในบรรดาคน 19,630 คนที่ได้วัคซีนในการทดลอง เทียบกับกลุ่มที่ได้ยาหลอก 19,691 ซึ่งมีคนเข้า รพ. 16 คน (อัตราอุบัติการณ์ที่ 5.2 ต่อ 1,000 คน-ปี)[153] และมีคนเสียชีวิตเนื่องกับโควิด 7 ราย[603]
- ↑ ในการทดลองวัคซีนของโมเดอร์นา สำหรับกลุ่มฉีดวัคซีน ผู้มีอาการโควิด-19 จะนับว่าติดโรคก็ต่อเมื่อเริ่มมีอาการยิ่งกว่า 14 วันหลังฉีดวัคซีนโดสที่ 2 และยืนยันด้วยการตรวจ RT-PCR เป็นผลบวก และต้องมีอาการแบบทั้งร่างกายอย่างน้อย 2 อย่าง (เป็นไข้ยิ่งกว่า 38 องศาสเซลเซียส, หนาวสะท้าน, ปวดกล้ามเนื้อ, ปวดศีรษะ, เจ็บคอ, ปัญหาการได้กลิ่นหรือลิ้มรสที่เกิดใหม่) หรือมีอาการทางการหายใจอย่างหนึ่ง (ไอ หายใจติดขัด หรือปอดบวมไม่ว่าจะโดยอาการหรือโดยการถ่ายเอกซเรย์)[604]
- ↑ 13.0 13.1 ในการทดลองวัคซีนของโมเดอร์นา อาการที่จัดว่าหนักนิยามว่า ต้องผ่านเกณฑ์อาการเบา/ปานกลางบวกกับกลุ่มอาการอย่างใดอย่างหนึ่งดังต่อไปนี้
- อาการที่ระบุว่าป่วยหนักทั้งระบบ เช่น หายใจ ≥30 ครั้งต่อนาที, หัวใจเต้น ≥125 ครั้งต่อนาที, ความเข้มข้นออกซิเจนในเลือด (SpO2) ≤93% เมื่อหายใจปกติที่ระดับน้ำทะเล หรือ PaO2/FIO2 < 300 mm Hg,
- ความล้มเหลวทางการหายใจ หรือ ARDS (นิยามว่าต้องให้ออกซิเจนแบบไฮโฟลว์ ต้องใช้เครื่องช่วยหายใจ หรือ ECMO) มีหลักฐานว่าช็อก (SBP < 90 mmHg, DBP < 60 mmHg หรือต้องใช้สารกระตุ้นการหดตัวกล้ามเนื้อหลอดเลือด (vasopressors)
- การทำงานผิดปกติอย่างสำคัญของไต ตับ หรือระบบประสาท
- การเข้าห้องไอซียู
- การเสียชีวิต
- ↑ 14.0 14.1 14.2 14.3 14.4 14.5 14.6 ข้อมูลของการทดลองทางคลินิกระยะที่ 3 ยังไม่ได้ตีพิมพ์และยังไม่ได้ทบทวนโดยผู้รู้เสมอกัน
- ↑ 15.0 15.1 15.2 15.3 15.4 15.5 ไม่พบเค้สในการทดลอง
ประสิทธิภาพ/ประสิทธิผล (effectiveness)[แก้]
งานศึกษาประสิทธิภาพของวัคซีนในสถานการณ์จริงจะวัดว่า วัคซีนสามารถป้องกันเหตุการณ์ต่าง ๆ รวมทั้งการติดเชื้อ อาการแสดง การเข้า รพ. และการตายได้แค่ไหน โดยติดตามตรวจสอบกับกลุ่มประชากรขนาดใหญ่ในเหตุการณ์จริงที่ปัจจัยต่าง ๆ ไม่ได้เป็นไปตามคาดหวังทุกอย่าง[619]
- ในอิสราเอลช่วง 20 ธันวาคม 2020 - 28 มกราคม 2021 ในบรรดาคน 715,425 คนที่ฉีดวัคซีนของโมเดอร์นาหรือของไฟเซอร์-ไบออนเทค พบว่า เริ่มตั้งแต่วันที่ 7 หลังจากได้โดสที่สอง มีเพียง 317 คน (ร้อยละ 0.04) ที่ป่วยเป็นโรคโควิด-19 โดยมีอาการเบาจนถึงปานกลาง และมีเพียง 16 คน (ร้อยละ 0.002) ที่ต้องเข้า รพ.[620]
- ตามรายงานของศูนย์ควบคุมและป้องกันโรคสหรัฐ วัคซีนของโมเดอร์นาและของไฟเซอร์-ไบออนเทคมีผลป้องกันดีมากในสถานการณ์จริง คือ เมื่อได้วัคซีนครบ ประสิทธิภาพป้องกันโรคทั้งที่มีอาการและไม่มีอาการของวัคซีนเอ็มอาร์เอ็นเอ (≥14 วันหลังจากโดสที่สอง) อยู่ที่ร้อยละ 90 ส่วนเมื่อได้วัคซีนเพียงโดสเดียว ประสิทธิภาพป้องกันโรค (≥14 วันหลังจากโดสแรกแต่ก่อนได้โดสที่สอง) อยู่ที่ร้อยละ 80[621]
- ในสหราชอาณาจักร มีบุคลากรทางแพทย์ 15,121 คนใน รพ. 104 แห่งผู้ตรวจไม่พบแอนติบอดีสำหรับโควิด-19 ก่อนงานศึกษานี้ ที่ได้ติดตามตรวจด้วย RT-PCR อาทิตย์ละสองครั้งระหว่าง 7 ธันวาคม 2020 - 5 กุมภาพันธ์ 2021 ซึ่งเป็นช่วงที่สายพันธุ์อัลฟากำลังระบาด งานศึกษาเปรียบเทียบผู้ที่ได้วัคซีนกับผู้ที่ไม่ได้วัคซีน โดยร้อยละ 90.7 ได้วัคซีนและที่เหลือร้อยละ 9.3 ไม่ได้ แล้วพบว่า วัคซีนของไฟเซอร์-ไบออนเทคลดการติดเชื้อทั้งหมด (รวมทั้งแบบไม่แสดงอาการ) 72% (58–86%) 3 สัปดาห์หลังจากโดสแรกและ 86% (76–97%) 1 สัปดาห์หลังจากโดสที่สอง[622][ต้องการการอัปเดต]
- ในอิสราเอล งานศึกษากับกลุ่มประชากรทั่วไปจาก 17 มกราคม - 6 มีนาคม 2021 ซึ่งเป็นช่วงที่อัลฟาเป็นสายพันธุ์หลัก พบว่า วัคซีนของไฟเซอร์-ไบออนเทคลดการติดเชื้อโควิด-19 แบบไม่แสดงอาการร้อยละ 94 และลดการติดเชื้อแบบแสดงอาการร้อยละ 97[623]
- งานศึกษากับคนไข้ของมาโยคลินิกก่อนผ่าตัดในสหรัฐแสดงว่า วัคซีนเอ็มอาร์เอ็นเอป้องกันการติดเชื้อแบบไม่แสดงอาการได้ร้อยละ 80[624]
- งานศึกษาหนึ่งในสหราชอาณาจักรพบว่า วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้าโดสหนึ่งมีผลป้องกันโรค 73% (27–90%) สำหรับผู้มีอายุ 70 ปีและยิ่งกว่า[625]
| วัคซีน | ประสิทธิภาพตามความรุนแรงของโรค | ภูมิภาค | อ้างอิง | |||
|---|---|---|---|---|---|---|
| ไม่แสดงอาการ | แสดงอาการ | การเข้า รพ. | การตาย | |||
| ออกซฟอร์ด-แอสตร้าเซนเนก้า | ไม่มีรายงาน | ≈89% (78–94%)[i] | ไม่มีรายงาน | อังกฤษ | [627] | |
| ไฟเซอร์-ไบออนเทค | ≈92% (91–92%) | ≈97% (97–97%) | ≈98% (97–98%) | ≈97% (96–97%) | อิสราเอล | [628] |
| ≈92% (88–95%) | ≈94% (87–98%) | ≈87% (55–100%) | ≈97%[ii] | อิสราเอล | [629][623] | |
| ไม่มีรายงาน | ≈78% (77–79%) | ≈98% (96–99%) | ≈96% (95–97%) | อุรุกวัย | [630] | |
| ≈85% (74–96%) | ไม่มีรายงาน | สหราชอาณาจักร | [631] | |||
| ≈90% (68–97%) | ไม่มีรายงาน | ≈100%[ii][iii] | สหรัฐ | [621] | ||
| โมเดอร์นา | ≈90% (68–97%) | ไม่มีรายงาน | ≈100%[ii][iii] | สหรัฐ | [621] | |
| ซิโนฟาร์ม (BBIBP-CorV) | ไม่มีรายงาน | ≈84%[ii] | อาร์เจนตินา | [632] | ||
| ไม่มีรายงาน | ≈94%[ii] | เปรู | [633] | |||
| สปุตนิกวี | ไม่มีรายงาน | ≈98%[ii] | ไม่มีรายงาน | รัสเซีย | [634][635] | |
| ไม่มีรายงาน | ≈98%[ii] | ≈100%[ii][iii] | ≈100%[ii][iii] | สหรัฐอาหรับเอมิเรตส์ | [636] | |
| ซิโนแวค | ไม่มีรายงาน | ≈66% (65–66%) | ≈88% (87–88%) | ≈86% (85–88%) | ชิลี | [637] |
| ไม่มีรายงาน | ≈60% (59–61%) | ≈91% (89–93%) | ≈95% (93–96%) | อุรุกวัย | [630] | |
| ไม่มีรายงาน | ≈94%[ii] | ≈96%[ii] | ≈98%[ii] | อินโดนีเซีย | [638][639] | |
| ไม่มีรายงาน | ≈80%[ii] | ≈86%[ii] | ≈95%[ii] | บราซิล | [640][641] | |
| สปุตนิกไลท์ | ไม่มีรายงาน | ≈79%[ii][iv] | ≈88%[ii][iv] | ≈85%[ii][iv] | อาร์เจนตินา | [642][643] |
- ↑ ข้อมูลเก็บเมื่ออัลฟากลายเป็นสายพันธุ์หลักแล้ว[626]
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 2.14 2.15 2.16 2.17 ไม่ได้ระบุช่วงความเชื่อมั่น (CI) จึงไม่สามารถรู้ความแม่นยำของค่านี้ได้จริง ๆ
- ↑ 3.0 3.1 3.2 3.3 ไม่พบเค้สในงานศึกษา
- ↑ 4.0 4.1 4.2 อาสาสมัครอายุระหว่าง 60-79 ปี
อัตราการฉีดวัคซีนครอบคลุมวิกฤติ[แก้]
แม้เป้าหมายแรกสุดในเหตุการณ์โรคระบาดทั่วก็คือป้องกันคนไม่ไให้ติดโรค แต่เป้าหมายระยะยาวปกติก็คือเพื่อกำจัดโรคในที่สุด แต่จะทำอย่างนี้ได้ สัดส่วนประชากรที่มีภูมิคุ้มกันจะต้องยิ่งกว่าอัตราการฉีดวัคซีนครอบคลุมวิกฤติ คือ ซึ่งสามารถคำนวณได้จากค่าระดับการติดเชื้อพื้นฐาน คือ และประสิทธิภาพของวัคซีนในการป้องกันการติดต่อโรค คือ ดังนี้คือ[644]
สำหรับเชื้อโควิด-19 ถ้าสมมุติว่า R0 ≈ 2.87[645] อัตราการฉีดวัคซีนครอบคลุมวิกฤติก็จะต้องยิ่งกว่าร้อยละ 72.4 สำหรับวัคซีนที่มีประสิทธิภาพป้องกันการติดต่อโรคได้ร้อยละ 90 เมื่อใช้สมการเดียวกัน ประสิทธิภาพป้องกันการติดต่อโรคที่จำเป็นของวัคซีนสามารถคำนวณได้โดยสมการ
ถ้าสมมุติเช่นกันว่า R0 ≈ 2.87 และสมมุติว่า จริง ๆ คงจะฉีดวัคซีนให้ประชากรได้ประมาณร้อยละ 75 วัคซีนก็จะต้องมีประสิทธิภาพป้องกันการติดต่อโรคได้ยิ่งกว่าร้อยละ 86.9[593] แต่ถ้าสมมุติอัตราการฉีดวัคซีนที่จริง ๆ ทำไม่ได้ว่าเต็มร้อย วัคซีนก็จะต้องมีประสิทธิภาพป้องกันการติดต่อโรคได้ยิ่งกว่าร้อยละ 65.2 และที่มีประสิทธิภาพน้อยกว่านี้ก็จะไม่สามารถกำจัดโรคได้
จนถึงเดือนมิถุนายน 2021 งานศึกษาหลังวางตลาด (post-marketing) หลายงานได้ประเมินประสิทธิภาพของวัคซีนในการป้องกันการติดเชื้อที่ไม่แสดงอาการ แม้การป้องกันการติดเชื้อจะมีผลชะลอการติดต่อโรค (โดยเฉพาะแบบไม่แสดงอาการ) แต่ก็ยังต้องตรวจสอบผลระงับการติดต่อโรคที่ได้แน่นอนต่อไป[646]
ไวรัสโควิด-19 บางสายพันธุ์ติดต่อได้ง่ายกว่า คือมีค่าระดับการติดเชื้อยังผล (effective reproduction number) ที่สูงกว่า ซึ่งระบุว่ามีค่าระดับการติดเชื้อพื้นฐานที่สูงกว่า ดังนั้น การควบคุมโรคจึงต้องอาศัยอัตราการฉีดวัคซีนครอบคลุมที่สูงกว่า หรือวัคซีนต้องมีประสิทธิภาพป้องกันการติดต่อได้สูงกว่า หรืออาจจะต้องได้ปัจจัยทั้งสองอย่าง
ในเดือนกรกฎาคม 2021 ผู้เชี่ยวชาญหลายท่านระบุว่า การได้ภูมิคุ้มกันหมู่ในปัจจุบันอาจเป็นไปไม่ได้เพราะว่าสายพันธุ์เดลตายังสามารถติดต่อได้แม้ในบุคคลที่ฉีดวัคซีนแล้ว[647] ศูนย์ควบคุมและป้องกันโรคสหรัฐมีข้อมูลที่ระบุว่า คนที่ฉีดวัคซีนแล้วสามารถแพร่เชื้อสายพันธุ์เดลตา ซึ่งเจ้าหน้าที่เชื่อว่าไม่เกิดกับสายพันธุ์โควิด-19 อื่น ๆ[648]
สายพันธุ์ของไวรัสโควิด-19[แก้]
ปฏิสัมพันธ์ระหว่างไวรัสโควิด-19 กับมนุษย์ตอนแรกเป็นไปตามธรรมชาติ แต่ปัจจุบันได้เปลี่ยนไปเพราะการฉีดวัคซีน[649] โอกาสการเกิดสายพันธุ์โควิดที่ดื้อต่อแอนติบอดีที่วัคซีนรุ่นปัจจุบันกระตุ้นให้เกิด อาจทำให้ต้องปรับปรุงวัคซีน[650] การทดลองต่าง ๆ ได้ระบุว่า วัคซีนที่พัฒนาเพื่อต่อต้านสายพันธุ์ดั้งเดิมมีประสิทธิศักย์ต่อต้านการติดเชื้อแบบแสดงอาการที่ลดลงสำหรับสายพันธุ์บางสายพันธุ์[651]
อัลฟา (B.1.1.7)[แก้]
ในเดือนธันวาคม สายพันธุ์ใหม่ของไวรัสโควิด-19 คือสายพันธุ์อัลฟา (B.1.1.7) ได้พบเป็นครั้งแรกในสหราชอาณาจักร[652]
องค์การอนามัยโลกระบุว่ามีหลักฐานจำกัดที่แสดงว่าวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า ของไฟเซอร์-ไบออนเทค และโนวาแวกซ์ยังคงประสิทธิผล/ประสิทธิภาพต่อต้านสายพันธุ์อัลฟาอยู่ ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนที่ใช้มากที่สุดรวมทั้งสปุตนิกวี วัคซีนของไฟเซอร์-ไบออนเทค ของโมเดอร์นา ของซิโนแวค ของซิโนฟาร์ม และโคแว็กซิน ก็ปรากฏว่าคงระดับแอนติบอดีสำหรับสายอัลฟาด้วย สำหรับวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า ระดับแอนติบอดีลดลงเล็กน้อยจนถึงปานกลาง ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653]
ผลเบื้องต้นแสดงว่า วัคซีนของไฟเซอร์-ไบออนเทคและโมเดอร์นาสามารถป้องกันสายพันธุ์นี้[654][655]
งานศึกษาหนึ่งระบุว่า วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้ามีประสิทธิศักย์ระหว่าง 42-89 ต่อต้านสายพันธุ์นี้ เทียบกับร้อยละ 71-91 สำหรับสายพันธุ์อื่น[656]
ผลเบื้องต้นจากการทดลองทางคลินิกระบุว่า วัคซีนโนวาแวกซ์มีประสิทธิภาพประมาณร้อยละ 96 สำหรับการติดเชื้อที่แสดงอาการสำหรับสายพันธุ์ดั้งเดิม และประมาณร้อยละ 86 สำหรับสายพันธุ์อัลฟา[657]
เบตา (B.1.351)[แก้]
องค์การอนามัยโลกระบุว่า มีหลักฐานจำกัดจากงานศึกษาเบื้องต้นหลายงานที่แสดงว่าวัคซีนต่าง ๆ มีประสิทธิศักย์/ประสิทธิภาพต่อต้านสายพันธุ์เบตาลดลงในระดับต่าง ๆ รวมทั้งวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า (อาจจะมาก) โนวาแวกซ์ (ปานกลาง) วัคซีนของบริษัทไฟเซอร์-ไบออนเทคและจอห์นสันแอนด์จอห์นสัน (น้อย) โดยยังไม่มีข้อมูลสำหรับวัคซีนอื่น ๆ ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนที่ใช้มากที่สุดรวมทั้งวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้า สปุตนิกวี จอห์นสันแอนด์จอห์นสัน ไฟเซอร์-ไบออนเทค โมเดอร์นา และโนวาแวกซ์ล้วนมีแอนติบอดีลดลงในระดับน้อยจนถึงมาก ยกเว้นซิโนแวคและซิโนฟาร์มที่มีแอนติบอดีลดลงน้อย โดยวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653]
โมเดอร์นาได้เริ่มทำการทดลองวัคซีนรุ่นใหม่เพื่อจัดการสายพันธุ์เบตา (B.1.351) แล้ว[658] ในวันที่ 17 กุมภาพันธ์ 2021 บริษัทไฟเซอร์ประกาศว่า สำหรับสายพันธุ์นี้ อานุภาพทำลายฤทธิ์ไวรัสของแอนติบอดีที่เนื่องกับวัคซีนลดลงถึง 2/3 โดยระบุด้วยว่ายังไม่สามารถกำหนดประสิทธิศักย์ของวัคซีนในการป้องกันการติดเชื้อแบบแสดงอาการ[659] งานศึกษาหลายงานต่อมาได้ตรวจน้ำเหลืองของคนไข้ที่ได้ฉีดวัคซีนของโมเดอร์นาและของไฟเซอร์-ไบออนเทคแล้วยืนยันว่า อานุภาพทำลายฤทธิ์ไวรัสของแอนติบอดีที่เนื่องกับวัคซีนลดลงจริง ๆ[655][660] แต่ในวันที่ 1 เมษายน 2021 รายงานจากการทดลองวัคซีนของไฟเซอร์-ไบออนเทคในแอฟริกาใต้กลับรายงานว่า วัคซีนมีประสิทธิภาพเต็มร้อยจนถึงตอนนั้น (คือ อาสาสมัครที่ฉีดวัคซีนไม่มีใครติดโรคเลย) เทียบกับกลุ่มยาหลอกที่อาสาสมัคร 6 คนติดเชื้อชนิดเบตา[661]
ในเดือนมกราคม 2021 บริษัทจอห์นสันแอนด์จอห์นสันซึ่งกำลังทดสอบวัคซีนโควิด-19 ในแอฟริกาใต้ รายงานว่าประสิทธิศักย์การป้องกันการติดเชื้อแบบมีอาการปานกลางจนถึงหนักอยู่ที่ร้อยละ 72 ในสหรัฐและร้อยละ 57 ในแอฟริกาใต้[662]
ในวันที่ 6 กุมภาพันธ์ หนังสือพิมพ์อังกฤษ Financial Times ได้รายงานข้อมูลเบื้องต้นจากงานศึกษาในแอฟริกาใต้ร่วมกับมหาวิทยาลัยออกซฟอร์ดที่แสดงว่า วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้ามีประสิทธิศักย์ลดลงสำหรับสายพันธุ์นี้[663] โดยพบว่า ในบรรดาผู้ได้รับวัคซีน 2,000 คน วัคซีนสามารถป้องกันโรคได้เพียงเล็กน้อยยกเว้นแต่คนที่มีอาการหนักสุด[664] ต่อมาในวันที่ 7 กุมภาพันธ์ 2021 กระทรวงสาธารณสุขแอฟริกาใต้จึงระงับแผนการฉีดวัคซีนนี้ 1 ล้านโดสให้แก่ประชาชน[664][665]
ในเดือนมีนาคม 2021 มีรายงานว่า "ประสิทธิศักย์เบื้องต้นที่พบ" ของโนวาแว็กซ์ (NVX-CoV2373) สำหรับการติดเชื้อชนิดเบตาที่มีอาการอ่อน ปานกลาง และรุนแรง[666] สำหรับอาสาสมัครที่ตรวจไม่พบเอชไอวีอยู่ที่ร้อยละ 51
แกมมา (P.1)[แก้]
องค์การอนามัยโลกระบุว่ามีหลักฐานจำกัดที่แสดงว่าวัคซีนของซิโนแวคและของซิโนฟาร์ม ยังคงประสิทธิผล/ประสิทธิภาพต่อต้านสายพันธุ์แกมมาอยู่ ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้าและของซิโนแวคไม่ลดหรือแทบไม่ลดประสิทธิภาพต่อต้านสายพันธุ์แกมมาเลย วัคซีนของไฟเซอร์-ไบออนเทคและของโมเดอร์นาลดลงบางเล็กน้อยจนถึงปานกลาง ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653] ดังนั้น สายพันธุ์แกมมา (P.1, 20J/501Y.V3) ซึ่งเริ่มต้นพบที่บราซิล ดูเหมือนจะหลบภูมิคุ้มกันเนื่องกับวัคซีนของไฟเซอร์-ไบออนเทคได้บ้าง[660]
เดลตา (B.1.617.2)[แก้]
สายพันธุ์เดลตา หรือ B.1.617.2 หรือ G/452R.V3 หรือ 21A[667] หรือ 21A/S:478K[668] ได้พบครั้งแรกในอินเดียเมื่อเดือนตุลาคม 2020 แต่หลังจากนั้นก็ได้กระจายไปยังประเทศอื่น ๆ แล้ว เป็นสายพันธุ์ลูกหลานของ B.1.617 เช่นเดียวกับสายพันธุ์แคปปาที่กำลังตรวจสอบ[669][670][671][672][673] ในวันที่ 6 พฤษภาคม 2021 นักวิทยาศาสตร์อังกฤษได้ประกาศสายพันธุ์นี้ (ซึ่งมีจุดเด่นคือ ไม่มีการกลายพันธุ์ E484Q) ว่าเป็นสายพันธุ์ที่น่าเป็นห่วงโดยกำหนดรหัสเป็น VOC-21APR-02 หลังจากที่พบหลักฐานว่ามันกระจายไปได้เร็วกว่าไวรัสดั้งเดิมและอาจกระจายได้เร็วเท่าสายพันธุ์อัลฟา[674][675][676] มันมีการกลายพันธุ์ L452R, T478K และ P681R[677] แต่ก็ไม่เหมือนกับสายพันธุ์แคปปาเพราะไม่มีการกลายพันธุ์ E484Q
องค์การอนามัยโลกระบุว่า มีหลักฐานจำกัดจากงานศึกษาเบื้องต้นต่าง ๆ ที่แสดงว่าวัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้าและของไฟเซอร์-ไบออนเทคยังคงประสิทธิผล/ประสิทธิภาพต่อสายพันธุ์นี้ ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล ในเรื่องการคงระดับแอนติบอดีลบล้างฤทธิ์ซึ่งป้องกันการติดเชื้อแบบไม่แสดงอาการและสำคัญในการยุติเหตุการณ์ระบาดทั่ว วัคซีนของออกซฟอร์ด-แอสตร้าเซนเนก้ามีประสิทธิภาพลดลงอย่างมาก และวัคซีนของไฟเซอร์-ไบออนเทคและโคแว็กซินมีประสิทธิภาพลดลงน้อยจนถึงปานกลาง ส่วนวัคซีนอื่น ๆ ยังไม่มีข้อมูล[653]
ข้อจำกัดและปัญหาที่อาจเกิด[แก้]
การรีบเร่งพัฒนาและผลิตวัคซีนเพื่อโควิด-19 ที่ระบาดทั่วอาจเพิ่มความเสี่ยงและอัตราความล้มเหลวของการได้วัคซีนที่ปลอดภัยและมีประสิทธิผล[92][31][678] งานศึกษาหนึ่งพบว่าในระหว่างปี 2006-2015 สำหรับวัคซีน การได้รับอนุมัติให้ทำการทดลองระยะที่ 1 แล้วผ่านการทดลองระยะที่ 3 อย่างสำเร็จอยู่ที่อัตราร้อยละ 16.2 [89] และเซพีก็ได้ระบุว่าอัตราประสบความสำเร็จของวัคซีนแคนดิเดตที่กำลังพัฒนาอยู่ในปี 2020 น่าจะอยู่ที่เพียงร้อยละ 10[31]
ในเดือนเมษายน 2020 รายงานของเซพีระบุว่า "การประสานงานและการร่วมมือกันอย่างเข้มแข็งและเป็นสากลระหว่างผู้พัฒนาวัคซีน องค์กรควบคุม องค์กรตั้งนโยบาย ผู้ให้เงินทุน องค์กรสาธารณสุข และรัฐบาลเป็นเรื่องจำเป็นเพื่อให้วัคซีนแคนดิเดตในระยะสุดท้าย ๆ สามารถผลิตได้อย่างเพียงพอและแจกจำหน่ายให้แก่เขตติดโรคทั้งหมดได้อย่างยุติธรรม โดยเฉพาะแก่เขตที่ยากจน"[31] แต่ประชากรอาจถึงร้อยละ 10 ก็รู้สึกว่าวัคซีนไม่ปลอดภัยหรือไม่จำเป็น และไม่ยอมรับวัคซีน ซึ่งเป็นอันตรายต่อสาธารณสุขของโลกที่ได้ชื่อว่า vaccine hesitancy (ความลังเลกับวัคซีน)[679] และเพิ่มความเสี่ยงว่าโควิดจะเกิดระบาดอีก[680] ในกลางปี 2020 งานสำรวจสองงานประเมินว่าประชากรสหรัฐร้อยละ 67 หรือ 80 จะยอมรับการฉีดวัคซีนป้องกันโควิด โดยมีความต่าง ๆ กันมากเหตุระดับการศึกษา การมีงานทำ เชื้อชาติ และภูมิลำเนา[681][682]
ปัญหาความปลอดภัยทางชีวภาพ[แก้]
งานวิจัยเบื้องต้นเพื่อประเมินประสิทธิผลของวัคซีนโดยใช้สัตว์แบบจำลองที่เฉพาะต่อโรคโควิด (เช่น หนูเพาะให้มียีนหน่วยรับ ACE) และใช้สัตว์ทดลองอื่น ๆ และไพรเมตที่ไม่ใช่มนุษย์ แสดงว่าต้องรักษาความปลอดภัยทางชีวภาพในระดับ 3 เมื่อทดลองไวรัสที่ยังไม่ตาย และต้องร่วมมือกันในระดับสากลเพื่อให้มีมาตรฐานรักษาความปลอดภัย[92][31]
การเพิ่มฤทธิ์ของเชื้อโดยอาศัยภูมิต้านทาน (ADE)[แก้]
แม้วัคซีนจะมุ่งช่วยกระตุ้นให้ร่างกายผลิตสารภูมิต้านทานเพื่อกำจัดเชื้อโรค แต่วัคซีนก็อาจมีผลตรงกันข้ามโดยเพิ่มฤทธิ์ของเชื้อ เป็นกระบวนการที่เรียกว่า การเพิ่มฤทธิ์ของเชื้อโดยอาศัยภูมิต้านทาน (antibody-dependent enhancement, ADE) ซึ่งเพิ่มสมรรถภาพของไวรัสในการจับกับเซลล์เป้าหมายในร่างกายแล้วจุดชนวนอาการพายุไซโตไคน์เมื่อติดเชื้อหลังจากได้วัคซีน[92][683] แพลตฟอร์มเทคโนโลยีของวัคซีน (เช่น ใช้ไวรัสเป็นเวกเตอร์, ใช้โปรตีน spike ของไวรัส หรือใช้หน่วยย่อยโปรตีนของไวรัส), ขนาดวัคซีนที่ให้, ระยะเวลาระหว่างการให้วัคซีนซ้ำ ๆ เพราะโอกาสการติดเชื้อโควิดอีก และอายุมาก ล้วนเป็นปัจจัยที่กำหนดความเสี่ยงและความรุนแรงของ ADE[92][683] การตอบสนองของภูมิคุ้มกันต่อวัคซีนก็ยังขึ้นอยู่กับเทคโนโลยีที่ใช้ รวมทั้งความแม่นยำของกลไกการทำงานของวัคซีน[92] หรือวิธีการให้ (ฉีดในกล้ามเนื้อ ฉีดใต้ผิวหนัง ให้ทางปาก ให้ทางจมูก เป็นต้น)[683][684]
ประสิทธิศักย์ (efficacy)[แก้]
- ดูหัวข้อหลักที่ประสิทธิศักย์
ประสิทธิภาพ (effectiveness) ของวัคซีนขึ้นอยู่กับประสิทธิศักย์ (efficacy) ของวัคซีน[147] ประสิทธิศักย์ที่น้อยกว่าร้อยละ 60 ก็อาจไม่ก่อภูมิคุ้มกันหมู่[29][684] ปัจจัยส่วนบุคคลที่ทำให้เสี่ยงติดโรค เช่น ยีน สุขภาพ (โรคประจำตัว อาหาร การตั้งครรภ์ ไวหรือแพ้อะไรง่าย) ภูมิคุ้มกัน อายุ ฐานะทางเศรษฐกิจ หรือวัฒนธรรม อาจเป็นปัจจัยปฐมภูมิหรือทุติยภูมิซึ่งมีผลต่อความรุนแรงเมื่อติดโรคและการตอบสนองต่อวัคซีน[684] คนชรา (อายุเกิน 60 ปี) ผู้มีภูมิแพ้ และคนอ้วนเสี่ยงมีการตอบสนองของภูมิคุ้มกันที่อ่อนแอแล้วทำให้วัคซีนไม่มีประสิทธิผล จึงอาจต้องใช้เทคโนโลยีวัคซีนโดยเฉพาะ ๆ สำหรับคนกลุ่มเฉพาะ ๆ หรือต้องให้วัคซีนซ้ำ ๆ เพื่อจำกัดการแพร่เชื้อ[684] อนึ่ง การกลายพันธุ์ของเชื้อไวรัสอาจเปลี่ยนโครงสร้างที่เป็นเป้าหมายของวัคซีน ทำให้วัคซีนไม่ได้ผล[685][686]
การรับสมัครอาสาสมัครเพื่อทดลอง[แก้]
ผู้พัฒนาวัคซีนต้องลงทุนแข่งขันในระดับนานาชาติเพื่อหาอาสาสมัครสำหรับการทดลองทางคลินิกระยะ 2–3 ให้มีจำนวนเพียงพอเพราะไวรัสระบาดไปในอัตราต่าง ๆ กันทั้งข้ามประเทศและในประเทศ[118] ยกตัวอย่างเช่น ในเดือนมิถุนายน บริษัทผลิตวัคซีนจีนคือซิโนแว็กไบโอเท็กได้ร่วมมือกับมาเลเซีย แคนาดา สหราชอาณาจักร และบราซิลเพื่อรับอาสาสมัครในการทดลองและเพื่อผลิตวัคซีนให้ได้จำนวนเพียงพอสำหรับการทดลองระยะที่ 3 ในประเทศบราซิลที่โรคได้เร่งระบาดเพิ่มขึ้น[118] เพราะจีนควบคุมการระบาดทั่วของโควิดได้ ผู้พัฒนาวัคซีนจีนจึงต้องร่วมมือกับนานาชาติเพื่อทำงานศึกษาในมนุษย์ระยะปลาย ซึ่งเป็นการแข่งขันหาอาสาสมัครสู้กับผู้ผลิตอื่น ๆ และกับโปรแกรม Solidarity trial ที่องค์การอนามัยโลกเป็นผู้จัด[118]
นอกจากปัญหาการแข่งขันหาอาสาสมัครแล้ว ผู้จัดทำการทดลองอาจเจอกับคนที่ไม่ต้องการได้วัคซีนเพราะเหตุผลเกี่ยวกับความปลอดภัยและประสิทธิศักย์ที่ค้านกับความเห็นพ้องของนักวิทยาศาสตร์[680] หรือไม่เชื่อในวิทยาศาสตร์ที่ใช้เพื่อสร้างเทคโนโลยีวัคซีนและสมรรถภาพการป้องกันการติดเชื้อของวัคซีน[687]
การมีบุคลากรที่ชำนาญในการให้วัคซีนไม่พออาจเป็นอุปสรรคต่อการทดลองทางคลินิกที่ต้องแก้ปัญหาต่าง ๆ เช่น การรับสมัครอาสาสมัครในเขตชนบทที่มีความหนาแน่นประชากรน้อย อาสาสมัครที่มีอายุ เชื้อชาติ และปัญหาทางสุขภาพต่าง ๆ[118][688]
ค่าใช้จ่าย[แก้]
วัคซีนต้านโควิดที่มีประสิทธิผลอาจลดความเสียหายทางเศรษฐกิจของโลกเป็นล้านล้านดอลลาร์สหรัฐ และดังนั้น ค่าใช้จ่ายเป็นพัน ๆ ล้านดอลลาร์สหรัฐสำหรับวัคซีนเมื่อเทียบกันแล้วก็เล็กน้อย[689] ในตอนต้น ๆ ของเหตุการณ์ระบาดทั่ว ยังไม่ชัดเจนว่าจะสามารถสร้างวัคซีนสำหรับไวรัสนี้ได้อย่างปลอดภัย เชื่อถือได้ และมีราคาที่พอซื้อไหว และก็ยังไม่รู้ด้วยว่าจะมีค่าใช้จ่ายเพื่อพัฒนาวัคซีนเท่าไร[29][32][56] เป็นไปได้ว่าการลงทุนเป็นเป็นพัน ๆ ล้านดอลลาร์สหรัฐนั้นอาจไม่ได้ผลอะไร[55]
หลังจากสร้างวัคซีนได้แล้ว จะต้องผลิตวัคซีนเป็นพัน ๆ ล้านโดสแล้วแจกจ่ายทั่วโลก ในเดือนเมษายน 2020 มูลนิธิบิลและเมลินดาเกตส์ประเมินว่า การผลิตและการแจกจำหน่ายวัคซีนอาจมีค่าใช้จ่ายถึง 25,000 ล้านดอลลาร์สหรัฐ (ประมาณแปดแสนล้านบาท)[690]
คณะกรรมาธิการยุโรปจัดให้มีการประชุมทางวิดีโอของผู้นำโลกในวันที่ 4 พฤษภาคม 2020 ซึ่งได้สัญญาว่าจะให้เงิน 8,000 ล้านดอลลาร์สหรัฐเพื่อพัฒนาวัคซีนไวรัสโคโรนา (เป็นงานเดียวกับขององค์การอนามัยโลก)[691]
จนถึงเดือนพฤศจิกายน 2020 บริษัทที่ได้เงินทุนจากโปรแกรมปฏิบัติการความเร็วเหนือแสงของสหรัฐได้ตั้งราคาวัคซีนเบื้องต้นประมาณ 19.5–25 ดอลลาร์สหรัฐ (ประมาณ 610–780 บาท) ต่อโดส (คนหนึ่งปกติต้องใช้ 2 โดส) ซึ่งเป็นราคาประมาณเท่า ๆ กับวัคซีนไข้หวัดใหญ่[692] ในเดือนธันวาคม 2020 นักการเมืองเบลเยียมผู้หนึ่งได้เปิดเผยราคาที่สหภาพยุโรปตกลงซื้อวัคซีนจากบริษัทต่าง ๆ[693]
| ผู้ผลิต | ราคาต่อโดส[694] | บาทโดยประมาณ |
|---|---|---|
| แอสตร้าเซนเนก้า | €1.78 | 62 |
| จอห์นสันแอนด์จอห์นสัน | US$8.50 | 266 |
| ซาโนฟี่/แกล็กโซสมิธไคลน์ | €7.56 | 265 |
| ไฟเซอร์/ไบออนเทค | €12.00 | 420 |
| Curevac | €10.00 | 350 |
| โมเดอร์นา | US$18.00 | 564 |
การแจกจำหน่าย[แก้]
วัคซีนต่าง ๆ ต้องขนส่งและจัดการต่าง ๆ กัน ตัวอย่างเช่น วัคซีน tozinameran ของบริษัทไฟเซอร์-ไบออนเทคต้องส่งในตู้แช่แข็งพิเศษโดยมีอุณหภูมิระหว่าง −80 ถึง −60 องศาเซลเซียส[695] ต้องใช้ใน 5 วันหลังละลาย[695] ต้องสั่งอย่างน้อย 975 โดส จึงคงมีแต่ รพ. ใหญ่ ๆ ซึ่งมีเครื่องไม้เครื่องมือดีที่สามารถให้วัคซีนนี้ได้[696]
ส่วนวัคซีนของโมเดอร์นาต้องเก็บแช่แข็งระหว่าง −25 ถึง −15 องศาเซลเซียส[697] แต่เมื่อแช่แข็งแล้ว ก็สามารถเก็บที่อุณหภูมิระหว่าง 2 ถึง 8 องศาเซลเซียสจนถึง 30 วัน[697]
การไร้ข้อมูลที่เปิดเผยและความไม่เชื่อใจ[แก้]
สหรัฐอาหรับเอมิเรตส์ได้ประกาศให้อนุมัติวัคซีนของจีนคือ BBIBP-CorV แต่ก็ไม่ได้ประกอบด้วยข้อมูลและรายละเอียดสำคัญต่าง ๆ[698] ไม่เหมือนกับวัคซีนที่พัฒนาในประเทศตะวันตกบางประเทศ วัคซีนจีนมีข้อมูลเกี่ยวกับความปลอดภัยและประสิทธิศักย์น้อย แม้สหรัฐอาหรับเอมิเรตส์จะระบุว่า ได้พิจารณางานวิเคราะห์ในระหว่างของบริษัท แต่ก็ไม่ชัดเจนว่า ได้วิเคราะห์ข้อมูลดิบเองอย่างเป็นอิสระ และก็ไม่ชัดเจนว่า บริษัทได้สรุปข้อมูลอย่างไร เพราะสหรัฐอาหรับเอมิเรตส์ไม่ได้ระบุรายละเอียดการวิเคราะห์ที่สำคัญ เช่น จำนวนคนติดเชื้อและอายุของอาสาสมัคร[698]
นักวิทยาการระบาดชาวจีนที่มหาวิทยาลัยออกซฟอร์ดกล่าวว่า "ยากที่จะรู้ว่าวัคซีนได้ผลดีขนาดไหน ผมหวังว่ามันคงเป็นจริง"[699] การไม่ทำข้อมูลให้เป็นสาธารณะอาจจำกัดบริษัทจากการแจกจำหน่ายวัคซีนไปยังประเทศบางประเทศ เพราะไม่มั่นใจในความปลอดภัยและประสิทธิศักย์ของวัคซีน นักวิทยาการคนเดียวกันระบุว่า การโน้มน้าวให้ประเทศอื่น ๆ คล้อยตามจะต้องมีหลักฐานทางวิทยาศาสตร์ที่แน่นและข้อมูลที่ดีซึ่งสามารถให้ตรวจดูได้ ส่วนนักวิทยาไวรัสที่มหาวิทยาลัยฮ่องกงอีกคนหนึ่งเป็นห่วงว่า ประเทศต่าง ๆ อาจต้องเลือกยอมรับวัคซีนโดยไม่มีการวิเคราะห์ที่เป็นอิสระ หรือเลือกไม่ใช้วัคซีนนี้เลย[699]
วัคซีนจีนอีกอย่างคือ CoronaVac ก็มีปัญหาเช่นเดียวกัน ในวันที่ 14 ธันวาคม 2020 สำนักงานควบคุมสาธารณสุขบราซิล (Anvisa) ระบุว่า การให้อนุมัติเพื่อใช้ในประเทศจีนไม่ใช่เรื่องเปิดเผย คือไม่มีข้อมูลว่าใช้กฎเกณฑ์อะไรในการอนุมัติให้ใช้เป็นการฉุกเฉินในประเทศจีนเมื่อเดือนมิถุนายน 2020[700]
ปัญหาของการศึกษาแบบ "ท้าทาย" ที่เสนอ[แก้]
เพราะโรคโควิดที่กำลังระบาดทั่วเป็นเรื่องฉุกเฉินทั่วโลก จึงต้องพิจารณายุทธการย่อเวลาเพื่ออนุมัติให้ใช้วัคซีนป้องกันโควิด โดยเฉพาะการย่อเวลาของการทดลองทางคลินิกระยะ 2-3 ที่ปกติยาวเป็นปี ๆ[701][702][703] งานศึกษาแบบ "ท้าทาย" เป็นการทดลองวัคซีนโดยจงใจทำให้อาสาสมัครติดเชื้อ เป็นวิธีที่เคยทำกับโรคที่เสี่ยงตายน้อยกว่าโควิด เช่น ไข้หวัดใหญ่ทั่วไป ไข้รากสาดน้อย อหิวาตกโรค และมาลาเรีย[702] คือเมื่อได้ตรวจสอบความปลอดภัยและประสิทธิผลของวัคซีนแคนดิเดตในสัตว์ทดลองและมนุษย์ที่สุขภาพปกติแล้ว อาจต้องท้าทาย (challenge) จงใจให้อาสาสมัครติดเชื้อโควิด โดยมีกลุ่มควบคุมและข้ามงานทดลองระยะ 3 ซึ่งปกติต้องทำ เพื่อช่วยเร่งให้อนุมัติใช้วัคซีนเพื่อป้องกันโรคได้อย่างกว้างขวาง[701][704][702]
เริ่มตั้งแต่เดือนมกราคม 2021 อาสาสมัครผู้ใหญ่หนุ่มสาวเป็นโหล ๆ จะจงใจทำให้ติดเชื้อโควิดในการทดลองแบบท้าทายใน รพ. ในกรุงลอนดอนซึ่งบริหารโดยหน่วยบริหารวัคซีนโควิดเฉพาะกิจของรัฐบาลอังกฤษ[705] โดยหลังจากกำหนดขนาดไวรัสที่ทำให้ติดเชื้อได้ ก็จะตรวจสอบประสิทธิภาพป้องกันการติดเชื้อของวัคซีนแคนดิเดตสำหรับโควิด 2 อย่างหรือมากกว่านั้น[705]
งานศึกษาแบบท้าทายมีสองขั้นตอน ขั้นแรกตรวจสอบวัคซีนแคนดิเดตว่าปลอดภัยหรือไม่และมีผลต่อภูมิต้านทานอย่างไรทั้งในสัตว์ทดลองและผู้ใหญ่อาสาสมัครสุขภาพดี (100 คนหรือน้อยกว่านั้น) โดยทำพร้อม ๆ กันซึ่งปกติจะทำเป็นลำดับต่อกันเริ่มจากสัตว์ก่อน เมื่อขั้นแรกได้ผลดี ขั้นสองเป็นการทดลองขนาดใหญ่ระยะ 2–3 และให้วัคซีนขนาดที่ได้ผลแก่อาสาสมัครผู้ไม่ได้ติดโรคมาก่อน มีความเสี่ยงน้อย (เช่น ผู้มีอายุน้อย) โดยจงใจทำให้ติดเชื้อไวรัสโควิดเพื่อเปรียบเทียบกับกลุ่มควบคุมที่ให้ยาหลอก[701][702][704] หลังจาก "ท้าทาย" ให้ติดโรคเช่นนี้ ก็จะเฝ้าตรวจอาสาสมัครอย่างใกล้ชิดในคลินิกที่มีอุปกรณ์วัสดุพร้อมมือและสามารถช่วยชีวิตได้ถ้าจำเป็น[701][702] การอาสาเป็นผู้ร่วมงานศึกษาแบบท้าทายในช่วงเกิดโรคระบาดทั่วเช่นนี้ คล้ายกับการเข้าปฏิบัติการในเหตุการณ์ฉุกเฉินของแพทย์พยาบาลเพื่อรักษาคนไข้โรคโควิด หรือของเจ้าหน้าที่ดับเพลิง หรือของผู้บริจาคอวัยวะ[701]
แม้งานศึกษาเช่นนี้จะน่าสงสัยทางจริยธรรมเพราะอันตรายที่อาจเกิดขึ้นต่ออาสาสมัครเหตุโรครุนแรงขึ้นอาศัยวัคซีน เพราะไม่ชัดเจนว่าวัคซีนปลอดภัยในระยะยาวหรือไม่ หรือเพราะประเด็นปัญหาอื่น ๆ แต่ตามผู้เชี่ยวชาญในเรื่องโรคติดต่อบางท่าน[701][702][704] งานศึกษาเช่นนี้ก็อาจเลี่ยงไม่ได้เพื่อให้สามารถผลิตวัคซีนที่มีผลได้อย่างรวดเร็วและช่วยลดจำนวนคนตายเหตุโควิดที่กะว่าอาจตกเป็นล้าน ๆ คนทั่วโลก[701][706]
ในวันที่ 6 พฤษภาคม 2020 องค์การอนามัยโลกได้พัฒนาแนวปฏิบัติที่แสดงกฎเกณฑ์การศึกษาโควิดแบบท้าทายในอาสาสมัครสุขภาพดี รวมวิธีการประเมินทางวิทยาศาสตร์และทางจริยธรรม การปรึกษาหารือและการประสานงานกับประชาชน การเลือกและการขอคำยินยอมของอาสาสมัคร และการดูแลสอดส่องโดยผู้เชี่ยวชาญอิสระ[707]
การอนุญาตให้ใช้เป็นการฉุกเฉิน (EUA)[แก้]
เมื่อโควิดได้เริ่มระบาดทั่วเมื่อต้นปี 2020 องค์การอนามัยโลกได้เผยแพร่แนวทางการจดบัญชีรายการยาให้ใช้เป็นการฉุกเฉิน (Emergency Use Listing) สำหรับวัคซีนใหม่ ๆ เป็นกระบวนการที่ได้มาจากการระบาดทั่วของอีโบลาระหว่างปี 2013-2016[708] ซึ่งบังคับว่า วัคซีนแคนดิเดตที่พัฒนาเพื่อการฉุกเฉินอันเป็นอันตรายถึงชีวิตต้องผ่านมาตรฐาน GMP และต้องผ่านการพัฒนาตามกระบวนการให้อนุญาตก่อน (prequalification) ขององค์การ[708] แม้เมื่อมีวัคซีนใหม่ ๆ ที่พัฒนาขึ้นในระหว่างการระบาดทั่วของโควิด การให้อนุญาตก็ยังบังคับให้ส่งเอกสารแบบเต็มในเรื่องการพัฒนาและคุณภาพการผลิต เทียบกับสหภาพยุโรป ที่บริษัทสามารถใช้กระบวนการพิจารณาอย่างต่อเนื่อง (rolling review) คือให้ข้อมูลตามเท่าที่ได้ในการทดลองระยะที่ 3 แทนที่จะส่งข้อมูลเต็มซึ่งต้องทำเป็นเดือน ๆ หรือปี ๆ หลังการทดลองในกระบวนการปกติ กระบวนการเช่นนี้ทำให้คณะกรรมการเวชภัณฑ์สำหรับใช้ในมนุษย์ยุโรป (CHMP) สามารถประเมินข้อมูลในเวลาจริง ซึ่งช่วยให้วัคซีนแคนดิเดตอันมีอนาคตสามารถได้อนุมัติอย่างรวดเร็วจากสำนักงานการแพทย์ยุโรป (EMA)[709] ในเดือนตุลาคม กระทรวงสาธารณสุขแคนาดาและสำนักงานการแพทย์ยุโรปได้เริ่มการพิจารณาอย่างต่อเนื่องสำหรับวัคซีนของบริษัทโมเดอร์นา[710] และในแคนาดาเดือนพฤศจิกายน สำหรับวัคซีนของบริษัทไฟเซอร์-ไบออนเทค[711]
วันที่ 24 มิถุนายน 2020 ประเทศจีนได้อนุมัติวัคซีนของบริษัทแคนซิโนไบโอลอจิกส์เพื่อให้ใช้อย่างจำกัดในทหาร และอนุมัติวัคซีนแบบไวรัสโควิดฆ่าแล้วสองอย่างเพื่อใช้ในการฉุกเฉินสำหรับผู้ประกอบอาชีพความเสี่ยงสูง[712] ในวันที่ 11 สิงหาคม 2020 รัสเซียประกาศการอนุมัติวัคซีนสปุตนิก วี เพื่อใช้ในการฉุกเฉิน แต่เดือนหนึ่งต่อจากนั้น ก็ยังมีวัคซีนเพียงจำนวนน้อยที่แจกจำหน่ายนอกการทดลองทางคลินิกระยะที่ 3[713] ในเดือนกันยายน สหรัฐอาหรับเอมิเรตส์อนุมัติวัคซีนของบริษัทซิโนฟาร์มเป็นการฉุกเฉินสำหรับบุคลากรทางแพทย์[714] โดยบาห์เรนก็ทำเช่นเดียวกันในเดือนพฤศจิกายนต่อมา[715]
ในสหรัฐ องค์การอาหารและยาอาจให้อนุมัติเป็นการฉุกเฉินแก่วัคซีนโควิดก่อนจะได้หลักฐานเต็มจากการทดลองระยะที่ 3 ในเรื่องความปลอดภัยและประสิทธิศักย์ แต่ก็ถูกวิจารณ์ว่าใช้อย่างผิด ๆ เพราะเหตุทางการเมือง เป็นการลดมาตรฐาน และเพิ่มความรู้สึกต่อต้านวัคซีนของประชาชนในช่วงปี 2020[681][716][717] ในวันที่ 8 กันยายน 2020 บริษัทยาแนวหน้า 9 บริษัทที่วิจัยวัคซีนโควิดจึงได้ร่วมให้สัญญาว่า จะยื่นคำขอใช้เป็นการฉุกเฉินก็ต่อเมื่อการทดลองระยะที่ 3 ได้ระบุวัคซีนว่าปลอดภัยและมีประสิทธิศักย์แล้ว[718]
วันที่ 20 พฤศจิกายน 2020 บริษัทไฟเซอร์-ไบออนเทคได้ยื่นคำขอใช้วัคซีนของบริษัทเป็นการฉุกเฉินแก่องค์การอาหารและยาสหรัฐ[719][720] โดยองค์การก็ประกาศว่า คณะกรรมการที่ปรึกษาเรื่องวัคซีนและผลิตภัณฑ์ชีวภาพที่เกี่ยวข้อง (VRBPAC) ขององค์การจะพิจารณาคำขอนี้ในวันที่ 10 ธันวาคม[721][722] ในเดือนพฤศจิกายน องค์การได้อธิบายว่า การอนุญาตให้ใช้เป็นการฉุกเฉินก็คือ "กลไกที่อำนวยการทำให้มีและการใช้วิธีแก้ปัญหาทางแพทย์รวมทั้งวัคซีน ในช่วงความฉุกเฉินทางสาธารณสุข เช่น การระบาดทั่วของโควิด-19 ในปัจจุบัน"[723] เมื่อองค์การอนุมัติให้ใช้เป็นการฉุกเฉินแล้ว ผู้พัฒนาวัคซีนก็ยังต้องดำเนินการทดลองระยะที่ 3 ต่อไปเพื่อบูรณาการข้อมูลความปลอดภัยและประสิทธิศักย์ของวัคซีน โดยในที่สุดก็จะยื่นคำขออนุมัติแบบเต็ม[723]
ในวันที่ 30 พฤศจิกายน 2020 บริษัทโมเดอร์นาได้ยื่นคำขอใช้วัคซีนเป็นการฉุกเฉินแก่องค์การอาหารและยาสหรัฐ[724][725]
บาห์เรน[แก้]
ในเดือนพฤศจิกายนและธันวาคม 2020 องค์การควบคุมทางสุขภาพแห่งชาติบาห์เรน (National Health Regulatory Authority, NHRA) ได้อนุญาตให้ใช้วัคซีน BBIBP-CorV ของบริษัทซิโนฟาร์ม และวัคซีน tozinameran ของบริษัทไฟเซอร์-ไบออนเทคเป็นการฉุกเฉิน[94]
แคนาดา[แก้]
ในวันที่ 9 ธันวาคม 2020 กระทรวงสาธารณสุขแคนาดา (Health Canada) ได้อนุญาตให้นำเข้าวัคซีนของบริษัทไฟเซอร์-ไบออนเทคเพื่อใช้ในการฉุกเฉินอย่างชั่วคราว[96] มีวัคซีน 30,000 โดสส่งมาถึงแคนาดาในวันที่ 13 ธันวาคม โดยกะว่าจะได้ 249,000 โดสไม่เกินปลายปี 2020 และ 6 ล้านโดสก่อนเดือนเมษายน 2021[726]
เม็กซิโก[แก้]
ในวันที่ 11 ธันวาคม 2020 คณะกรรมการกลางป้องกันความเสี่ยงทางอนามัย (Federal Commission for the Protection against Sanitary Risk, COFEPRIS) ของเม็กซิโกได้อนุญาตให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทคเป็นการฉุกเฉิน วัคซีนได้สั่งแล้ว 34.4 ล้านโดสโดยเริ่มส่งตั้งแต่กลางเดือนธันวาคม[99]
ฟิลิปปินส์[แก้]
ในวันที่ 2 ธันวาคม 2020 ประธานาธิบดีฟิลิปปินส์โรดรีโก ดูแตร์เต ได้สั่งองค์กรอาหารและยาฟิลิปปินส์ให้ให้อนุญาตใช้วัคซีนและการรักษาโควิดอื่น ๆ เป็นการฉุกเฉิน[727] โดยมีข้อแม้อย่างหนึ่งว่า ผู้ผลิตวัคซีนต้องได้อนุญาตให้ใช้เป็นการฉุกเฉินในประเทศต้นกำเนิดหรือประเทศอื่น ๆ ที่มีการควบคุมดี องค์การก็ได้ประกาศว่าผู้ผลิตวัคซีน 3 รายคือไฟเซอร์ แอสตร้าเซนเนก้า และซิโนแว็กก็ได้สอบถามเรื่องกระบวนการขออนุญาตให้ใช้เป็นการฉุกเฉินในประเทศ[728]
สหราชอาณาจักร[แก้]
ในวันที่ 2 ธันวาคม 2020 สำนักงานควบคุมผลิตภัณฑ์ยาและสุขภาพ (Medicines and Healthcare products Regulatory Agency, MHRA) แห่งสหราชอาณาจักรได้อนุมัติให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทค คือ Tozinameran (BNT162b2) เป็นการฉุกเฉิน เป็นประเทศแรกที่อนุมัติวัคซีนนี้ และประเทศตะวันตกแรกที่ให้อนุมัติเป็นการฉุกเฉินแก่วัคซีนโควิด[93][729][730]
สหรัฐ[แก้]
ในวันที่ 11 ธันวาคม 2020 องค์กรอาหารและยาสหรัฐได้อนุญาตให้ใช้วัคซีนของบริษัทไฟเซอร์-ไบออนเทคเป็นการฉุกเฉิน[112]
การให้อนุญาต[แก้]
วัคซีนจะได้อนุญาตตามความสำเร็จของการทดลองทางคลินิกระยะ 1–3 ที่ได้แสดงความปลอดภัย, การสร้างภูมิคุ้มกันโรคเมื่อใช้ขนาดยาโดยเฉพาะ, ประสิทธิภาพป้องกันการติดเชื้อในกลุ่มประชากรเป้าหมาย และประสิทธิภาพการป้องกันที่คงยืน[731] คณะผู้เชี่ยวชาญการวางมาตรฐานทางชีวภาพขององค์การอนามัยโลกได้สร้างแนวปฏิบัตินานาชาติเพื่อผลิตและควบคุมคุณภาพของวัคซีน เป็นกระบวนการหมายให้องค์กรควบคุมของรัฐต่าง ๆ ใช้ในการให้อนุญาตวัคซีนของตนเอง[731] ปกติผู้ผลิตจะไม่ได้รับอนุญาตจนกว่าวัคซีนจะได้พิสูจน์ว่าปลอดภัยและมีประสิทธิภาพในระยะยาว องค์กรควบคุมนานาชาติหรือของรัฐ เช่น สำนักงานการแพทย์ยุโรป (European Medicines Agency, EMA) หรือองค์กรอาหารและยาสหรัฐ (Food and Drug Administration, FDA) จะเป็นผู้ตรวจพิจารณาข้อมูลทางวิทยาศาสตร์ของวัคซีน[732][733]
การสร้างความมั่นใจและการยอมรับวัคซีนที่ได้อนุมัติแก่สาธารณชนเป็นหน้าที่การสื่อสารของรัฐและบุคลากรทางแพทย์เพื่อให้โปรแกรมการฉีดวัคซีนดำเนินไปได้ด้วยดี, เพื่อช่วยชีวิตคน และช่วยคืนสภาพทางเศรษฐกิจ[734] ในเบื้องต้น วัคซีนจะมีจำนวนจำกัดเพราะเหตุผลทางการผลิต, การแจกจำหน่าย และโลจิสติกส์ จึงต้องมีแผนการจัดสรรวัคซีนจำนวนจำกัดที่มี และจัดลำดับกลุ่มประชากรที่ควรได้วัคซีนแรก ๆ[734]
องค์การอนามัยโลก[แก้]
วัคซีนที่พัฒนาเพื่อแจกจำหน่ายข้ามชาติผ่านกองทุนเพื่อเด็กแห่งสหประชาชาติต้องได้การอนุญาตก่อน (pre-qualification) ขององค์การอนามัยโลกเพื่อให้ได้มาตรฐานสากลในด้านคุณภาพ ความปลอดภัย การสร้างภูมิคุ้มกัน และประสิทธิศักย์ จึงจะนำไปใช้ในประเทศต่าง ๆ มากมายได้[731] ผลิตภัณฑ์ต้องผลิตได้อย่างสม่ำเสมอโดยผ่านมาตรฐาน GMP[731] เมื่อองค์กรของสหประชาชาติมีส่วนร่วมในการให้อนุญาตวัคซีน ประเทศแต่ละประเทศจะร่วมมือโดย 1) ให้อนุญาตวัคซีน ให้อนุญาตการวางขาย สำหรับผู้ผลิตและหุ้นส่วนในการแจกจำหน่าย 2) สอดส่องผลของยาหลังจากวางตลาด (postmarketing surveillance) รวมทั้งบันทึกผลที่ไม่พึงประสงค์หลังการให้วัคซีน องค์การอนามัยโลกทำงานร่วมกับองค์กรของรัฐเพื่อตรวจโรงงานผลิตและผู้จำหน่ายว่าผ่านมาตรฐาน GMP และกฎควบคุมต่าง ๆ หรือไม่[731] ประเทศบางประเทศอาจเลือกซื้อวัคซีนที่ได้รับอนุญาตจากองค์กรควบคุมของประเทศอื่น ๆ ที่น่าเชื่อถือเช่น สำนักงานการแพทย์ยุโรป (EMA) หรือองค์การอาหารและยาสหรัฐ แต่ราคาก็อาจจะแพงกว่า และวิธีการแจกจำหน่ายก็อาจใช้ในประเทศกำลังพัฒนานั้น ๆ ไม่ได้[731]
ออสเตรเลีย[แก้]
ในเดือนตุลาคม 2020 องค์กรสินค้าเพื่อการรักษา (Therapeutic Goods Administration, TGA) ของออสเตรเลียได้ให้อนุญาตชั่วคราวแก่วัคซีนโควิดคือ ChAdOx1 nCoV-19 ของบริษัทแอสตร้าเซนเนก้า และวัคซีน Tozinameran (BNT162b2) ของบริษัทไฟเซอร์[735][736]
สหภาพยุโรป[แก้]
ในสหภาพยุโรป วัคซีนสำหรับโรคระบาดทั่ว เช่น ไข้หวัดใหญ่ จะได้อนุญาตแบบต่าง ๆ รวมทั้ง อนุญาตทั่วไป (centralized) คือรัฐสมาชิกทั้งหมดปฏิบัติตาม หรืออนุญาตในบางประเทศ (decentralized) หรืออนุญาตในประเทศ ๆ เดียว[732] โดยทั่วไปแล้ว รัฐสมาชิกจะอนุโลมตามแนวทางการควบคุมและโปรแกรมทางคลินิกที่กำหนดโดยคณะกรรมการเวชภัณฑ์สำหรับใช้ในมนุษย์ (Committee for Medicinal Products for Human Use, CHMP) ของยุโรป ซึ่งเป็นคณะกรรมการทางวิทยาศาสตร์ของสำนักงานการแพทย์ยุโรป (EMA) ซึ่งมีหน้าที่ให้อนุญาตวัคซีน[732] กลุ่มผู้เชี่ยวชาญหลายกลุ่มที่ประเมินและสอดส่องความก้าวหน้าของวัคซีนทั้งก่อนและหลังการให้อนุญาตและการแจกจำหน่ายทำหน้าที่สนับสนุนคณะกรรมการนี้[732] ในเดือนตุลาคม 2020 CHMP ได้เริ่มทำการพิจารณาอย่างต่อเนื่อง (rolling reviews) สำหรับวัคซีน ChAdOx1 nCoV-19 ของบริษัทแอสตร้าเซนเนก้า และ Tozinameran (BNT162b2) ของบริษัทไฟเซอร์[737][738][739]
ในเดือนพฤศจิกายน 2020 CHMP ได้เริ่มการพิจารณาอย่างต่อเนื่องสำหรับวัคซีนโควิดของบริษัทโมเดอร์นาคือ mRNA-1273[740]
ในเดือนธันวาคม 2020 EMA ได้รับคำขออนุญาตวางตลาดแบบมีเงื่อนไข (conditional marketing authorization) แก่วัคซีนแบบ modRNA คือ Tozinameran และ mRNA-1273[741][742] การประเมินวัคซีนจะทำอย่างเร่งด่วนโดยอาจลงความเห็นภายในไม่กี่อาทิตย์[741][742]
ในเดือนธันวาคม 2020 CHMP ได้เริ่มการพิจารณาอย่างต่อเนื่องสำหรับวัคซีนโควิด Ad26.COV2.S ของบริษัท Janssen-Cilag International N.V.[743]
สหรัฐ[แก้]
ตามกฎขององค์การอาหารและยาสหรัฐ การแสดงหลักฐานว่าวัคซีนปลอดภัยและมีประสิทธิศักย์ทางคลินิกจะเหมือนกับกระบวนการอนุมัติยาที่แพทย์สั่ง[744] ถ้ายาผ่านการทดลองทางคลินิกระยะต่าง ๆ บริษัทก็จะยื่นคำขอที่เรียกว่า Biologics License Application ซึ่งต้องแนบหลักฐานอย่างละเอียดว่าวัคซีนแคนดิเดตแสดงประสิทธิศักย์และความปลอดภัยตลอดระยะการพัฒนา เพื่อการพิจารณาทางวิทยาศาสตร์โดยคณะผู้เชี่ยวชาญสาขาต่าง ๆ รวมทั้งแพทย์ นักสถิติ นักจุลชีววิทยา และนักเคมี หลังจากนี้ ผู้เชี่ยวชาญก็จะตรวจโรงงานผลิตว่า ได้มาตรฐาน GMP หรือไม่ โดยฉลากยาต้องมีข้อมูลสำหรับแพทย์พยาบาลเกี่ยวกับการใช้ยาและความเสี่ยง เพื่อให้สามารถสื่อสารและให้ยากับสาธารณชนได้[744]
คณะกรรมการที่ปรึกษาเรื่องแนวปฏิบัติเพื่อสร้างภูมิคุมกัน (Advisory Committee on Immunization Practices) ของศูนย์ป้องกันและควบคุมโรคสหรัฐได้ลงมติในวันที่ 2 ธันวาคมว่า วัคซีนที่ได้แรก ๆ ควรจัดให้กับแพทย์พยาบาลและผู้ดูแลรักษาผู้ป่วยในสถานพยาบาลระยะยาวก่อน โดยระบุด้วยว่าเมื่อการผลิตเพิ่มขึ้นแล้วกลุ่มที่ได้ต่อ ๆ มาควรเป็นคนชรา ผู้ทำการฉุกเฉิน (รวมตำรวจ นักผจญเพลิง) ครู และผู้ทำการจำเป็นที่ไม่สามารถเว้นระยะห่างทางสังคมได้ดี และบุคคลที่มีโรคร่วมหลายโรค อย่างไรก็ตาม รัฐต่าง ๆ ในสหรัฐจะเป็นผู้ตัดสินว่าจะจัดสรร แจกจำหน่าย จัดการโลจิสติกส์อย่างไร เพื่อให้วัคซีนแก่ทุก ๆ คนเมื่อมีวัคซีน[745] หลังจากให้อนุญาต การสอดส่องวัคซีนและการผลิตรวมทั้งการตรวจเป็นระยะ ๆ ว่ายังได้มาตรฐาน GMP หรือไม่ ก็จะทำต่อไปตราบเท่าที่ผู้ผลิตยังได้อนุญาตอยู่ โดยผู้ผลิตอาจต้องยื่นเอกสารเพิ่มเกี่ยวกับขั้นตอนการผลิตแต่ละขั้น ๆ ว่ายังสามารถคงฤทธิ์ ความปลอดภัย และความบริสุทธิ์ของวัคซีนได้หรือไม่[744]
การสอดส่องผลของยาหลังจากวางตลาด[แก้]
จนกว่าจะได้ใช้วัคซีนในกลุ่มประชากรทั่วไป ก็ยังอาจไม่รู้ผลไม่พึงประสงค์ทั้งหมดของวัคซีน จึงทำให้ผู้ผลิตต้องสอดส่องผลของยาหลังจากวางตลาด (postmarketing surveillance) หรือบางครั้งเรียกว่า การทดลองทางคลินิกระยะที่ 4 ของวัคซีนเมื่อกำลังให้แก่สาธารณชนทั่วไป[731][744] องค์การอนามัยโลกทำงานร่วมกับรัฐสมาชิกเพื่อสอดส่องผลของยาหลังจากวางตลาด[731] ส่วนองค์การอาหารและยาสหรัฐมีโปรแกรม Vaccine Adverse Event Reporting System ที่สอดส่องปัญหาความปลอดภัยของวัคซีนเมื่อกำลังให้แก่สาธารณชน[744]
การวางตลาดและการเข้าถึงอย่างเท่าเทียมกัน[แก้]
ปัญหาการวางตลาด[แก้]
จนถึงเดือนมิถุนายน 2020 บริษัท รัฐบาล องค์กรสาธารณสุขนานาชาติ และกลุ่มวิจัยในมหาวิทยาลัยได้ลงทุนเป็นหมื่น ๆ ล้านดอลลาร์สหรัฐเพื่อพัฒนาวัคซีนแคนดิเดตเป็นสิบ ๆ อย่าง และเตรียมตัวตั้งโปรแกรมให้วัคซีนเพือสร้างภูมิคุ้มกันต้านการติดเชื้อโควิด-19[32][746][747][748] การลงทุนของบริษัทและความจำเป็นต้องสร้างคุณค่าให้แก่ผู้ถือหุ้นก่อความกังวลในเรื่องการพัฒนาวัคซีนที่ใช้ "วิธีการทางตลาด" ว่าวัคซีนที่ได้อนุมัติจะมีราคาแพง ว่าประเทศร่ำรวยจะได้วัคซีนก่อน และว่าเขตที่โรคระบาดแย่สุดจะไม่ได้วัคซีนหรือได้น้อย ซึ่งพยากรณ์ว่าจะเกิดในประเทศยากจน มีประชากรหนาแน่น ที่ไม่สามารถซื้อวัคซีนได้[32][56][747]
การร่วมมือกันระหว่างมหาวิทยาลัยออกซฟอร์ดกับแอสตร้าเซนเนก้า (เป็นบริษัทยายักษ์ใหญ่ในประเทศสหราชอาณาจักรมีรายได้ประมาณแปดแสนล้านบาทในปี 2016[749]) ก่อความกังวลเรื่องราคาวัคซีนและการแชร์ผลกำไรของการขายวัคซีนทั่วโลก เพราะปัญหาว่า รัฐบาลสหราชอาณาจักรและมหาวิทยาลัยซึ่งได้เงินภาษีของประชาชนมีสิทธิขายหรือไม่[748] บริษัทจึงแจ้งว่า ราคาเบื้องต้นของวัคซีนจะไม่รวมกำไรสำหรับบริษัทตราบเท่าที่โรคยังระบาดอยู่[748]
ในต้นเดือนมิถุนายน บริษัทตกลงให้เซพีและกาวีผลิตและแจกจำหน่ายวัคซีน 300 ล้านโดสถ้าวัคซีนของออกซฟอร์ดพิสูจน์ว่าปลอดภัยและได้ผลโดยแลกเปลี่ยนกับการลงทุน 750 ล้านดอลลาร์สหรัฐ (ประมาณสองหมื่นสี่พันล้านบาท) โดยเท่ากับเพิ่มสมรรถภาพการผลิตวัคซีนของบริษัทเป็นมากกว่า2,000 ล้านโดสต่อปี[750] การวางตลาดวัคซีนโรคระบาดทั่วเป็นการลงทุนที่เสี่ยงสูง เพราะอาจเสียเงินทุนค่าพัฒนาและการเตรียมตัวผลิตวัคซีนถ้าวัคซีนแคนดิเดตปรากฏว่าไม่ปลอดภัยหรือไม่ได้ผล[32][55][56][746] บริษัทยาข้ามชาติคือไฟเซอร์ระบุว่า ไม่สนใจเป็นหุ้นส่วนกับรัฐ เพราะจะเป็น "มือที่สาม" ที่ทำให้โปรแกรมวัคซีนของบริษัทล่าช้า[751] อนึ่ง ยังมีความกังวลด้วยว่า โปรแกรมเร่งพัฒนา เช่น Operation Warp Speed (ปฏิบัติการความเร็วเหนือแสง) ของสหรัฐ กำลังเลือกวัคซีนแคนดิเดตเพราะความได้เปรียบทางการผลิตเพื่อย่นระยะเวลาการพัฒนา ไม่ได้เลือกเทคโนโลยีวัคซีนที่ปลอดภัยและมีประสิทธิศักย์สูงสุด[751]
อำนาจอธิปไตย[แก้]
การเลือกแจกจำหน่ายวัคซีนให้แก่ประเทศไม่กี่ประเทศ ซึ่งคนตะวันตกเรียกว่า "vaccine sovereignty" (อธิปไตยวัคซีน) เป็นข้อวิจารณ์ข้อหนึ่งของหุ้นส่วนการพัฒนาวัคซีน[747][752] เช่นหุ้นส่วนระหว่างมหาวิทยาลัยออกซฟอร์ดกับแอสตร้าเซนเนก้า ว่าจะเลือกแจกจำหน่ายวัคซีนภายในสหราชอาณาจักรและต่อ "ผู้ให้ราคาสูงสุด" คือสหรัฐ ผู้ได้จ่ายเงินล่วงหน้า 1,200 ล้านดอลลาร์สหรัฐ (ประมาณสามหมื่นแปดพันล้านบาท) เพื่อคนอเมริกัน แม้ก่อนที่วัคซีนของออกซฟอร์ดหรือของซาโนฟี่จะได้พิสูจน์ว่าปลอดภัยและได้ผล[748][753][754] มีความกังวลว่า ประเทศบางประเทศที่ผลิตวัคซีนอาจจำกัดการส่งออกเพื่อตุนวัคซีนโควิดสำหรับประชาชนของตนก่อน[752]
ในเดือนพฤษภาคม รัฐบาลจีนได้ให้คำมั่นสัญญาว่า วัคซีนจีนที่สำเร็จจะเป็น "สินค้าสาธารณะของโลก" (global, public good) คือบอกเป็นนัยว่า จะผลิตวัคซีนให้พอแจกจำหน่ายทั้งในประเทศและนอกประเทศ[755] อนึ่ง ไม่เหมือนกับวัคซีนเอ็มอาร์เอ็นเอ ซึ่งต้องเก็บไว้ในอุณหภูมิต่ำมาก วัคซีนอันเป็นไวรัสฆ่าแล้วของซิโนแว็กและซิโนฟาร์มต้องเก็บไว้ในเพียงตู้เย็นเก็บยาธรรมดา[756] จึงอาจน่าใช้มากกว่าในประเทศกำลังพัฒนา[757]
ในเดือนมิถุนายน สถาบันเซรุ่มแห่งอินเดีย (Serum Institute of India) ซึ่งเป็นผู้ผลิตวัคซีนรายใหญ่ของโลก ได้สิทธิจากบริษัทแอสตร้าเซนเนก้าให้ผลิตวัคซีน 1,000 ล้านโดสสำหรับประเทศมีรายได้น้อยจนถึงปานกลาง[750] โดยครึ่งหนึ่งจะเป็นของอินเดีย[758] ถ้าประเทศออสเตรเลียผลิตวัคซีนด้วย ก็อาจเลือกปฏิบัติเช่นกัน[759]
การเข้าถึงได้อย่างเท่าเทียมกัน[แก้]
เพราะการพัฒนาและการผลิตวัคซีนแคนดิเดตยังมีผลลัพธ์ที่ไม่ชัดเจน รวมทั้งอัตราความล้มเหลวสูงในช่วงทดสอบในมนุษย์ องค์กรต่าง ๆ รวมทั้งเซพี องค์การอนามัยโลก และองค์กรวัคซีนการกุศล เช่น มูลนิธิบิลและเมลินดาเกตส์และกาวี ได้ระดมทุนเกินกว่า 20,000 ล้านดอลลาร์สหรัฐ ในต้นปี 2020 เพื่อเป็นทุนพัฒนาวัคซีนและเตรียมตัวแจกจำหน่ายให้วัคซีน โดยเฉพาะแก่เด็กในประเทศด้อยพัฒนา[760][46][51][746]
เซพีแถลงการณ์ว่า รัฐบาลต่าง ๆ ควรจัดระบบจัดสรรวัคซีนที่ยุติธรรมทั่วโลกสำหรับวัคซีนที่จะได้ โดยประสานงานการผลิต การจัดหาทุนและการซื้อ และประกันว่าไม่ต้องรับผิดชอบต่อผลิตภัณฑ์เพื่อลดความเสี่ยงต่อผู้พัฒนาวัคซีน[36] องค์กรได้ตั้งขึ้นเพื่อเฝ้าตรวจการแจกจำหนายวัคซีนป้องกันโรคติดต่อที่ยุติธรรมไปยังประเทศรายได้น้อยและปานกลาง[752][761] เซพีได้ปรับปรุงนโยบายการเข้าถึงได้อย่างยุติธรรมที่ตีพิมพ์ในเดือนกุมภาพันธ์ ซึ่งอาจใช้กับทุนพัฒนาวัคซีนโควิดขององค์กรด้วย คือ
- ราคาวัคซีนจะต้องตั้งให้ต่ำสุดเท่าที่จะทำได้ในอาณาเขตที่ได้รับผลหรืออาจได้รับผลจากการระบาดของโรคที่เงินทุนของเซพีได้ใช้เพื่อพัฒนาวัคซีน
- ข้อมูล วิธี และวัสดุต่าง ๆ ที่ใช้พัฒนาวัคซีนต้องแชร์กับ (หรือถ่ายโอนให้แก่) เซพี เพื่อให้องค์กรสามารถพัฒนาวัคซีนต่อได้ถ้าบริษัทเลิกลงทุนกับวัคซีนแคนดิเดตที่มีอนาคต
- เซพีต้องสามารถเข้าถึง หรือสามารถจัดการสิทธิทรัพย์สินทางปัญญา (เช่น สิทธิบัตร) สำหรับวัคซีนที่มีอนาคต
- เซพีจะได้รับผลประโยชน์ทางการเงินที่อาจพอกพูนขึ้นจากการพัฒนาวัคซีนที่เซพีสนับสนุน เพื่อนำกลับไปลงทุนเพื่อสนับสนุนภารกิจขององค์กรในการทำประโยชน์ทางสาธารณสุขในระดับโลก
- ความโปร่งใสของข้อมูลในระหว่างหุ้นส่วนการพัฒนาควรใช้เกณฑ์ "WHO Statement on Public Disclosure of Clinical Trial Results" และบังคับให้ตีพิมพ์ผลโดยเข้าถึงได้อย่างเสรี[761]
แต่ผู้ผลิตวัคซีนบางรายก็ต่อต้านข้อเสนอนี้เป็นบางส่วน[747][761]
กลุ่มนานาชาติบางกลุ่ม เช่น Centre for Artistic Activism และ Universities Allied for Essential Medicines สนับสนุนให้เข้าถึงวัคซีนโควิดที่อนุมัติได้อย่างยุติธรรม[762][763] นักวิทยาศาสตร์สนับสนุนให้องค์การอนามัยโลก เซพี บริษัท และรัฐบาลร่วมมือกันเพื่อจัดสรรวัคซีนโควิดที่จะได้โดยกำหนดด้วยความเสี่ยงต่อโรค[752][761] โดยเฉพาะการให้วัคซีนก่อนอย่างเร่งด่วนแก่บุคลากรทางแพทย์ กลุ่มประชากรที่อ่อนแอ และเด็ก[32][746][747] ในช่วงปี 2020 องค์การอนามัยโลก กาวี และเซพี ได้รวมกำลังก่อตั้งโคแว็กซ์ ซึ่งเป็นโปรแกรมประสานงานสร้างวัคซีนที่เข้าถึงได้อย่างยุติธรรมทั่วโลก[84][47]
นักวิทยาศาสตร์นานาชาติและบุคคลที่เป็นห่วงจำนวนหนึ่ง (รวมทั้งบุคลากรขององค์กรทางศาสนา) ได้ร้องให้ทำวัคซีนโควิดให้เป็นสาธารณสมบัติ ตามตัวอย่างการพัฒนาวัคซีนโปลิโอโดยแพทย์ชาวอเมริกันโจนัส ซอล์กผู้ไม่ได้จดสิทธิบัตร วัคซีนโควิด-19 ที่ได้ผลควรจะได้อนุมัติและผลิตในประเทศต่าง ๆ และศูนย์การผลิตยาทั่วโลก เพื่อให้สามารถแจกจำหน่ายได้อย่างยุติธรรมและมีราคาถูกยิ่งขึ้นในระดับโลก[764]
โซ่อุปทาน[แก้]
ในช่วงปี 2021 และหลังจากนั้น การแจกจำหน่ายวัคซีนโควิดต้องอาศัยการขนส่งและการติดตามวัคซีนถึง 10,000-19,000 ล้านขวด ซึ่งจะเป็นความท้าทายทางโซ่อุปทานอันยิ่งใหญ่ที่สุดในประวัติศาสตร์[29][765][758] จนถึงเดือนกันยายน 2020 ผู้เชี่ยวชาญทางโซ่อุปทานและโลจิสติกส์ก็ยังแสดงความเป็นห่วงว่า เครือข่ายทั้งภายในประเทศและนานาชาติที่มีอยู่แล้วเพื่อแจกจำหน่ายวัคซีนอาจไม่พอรับรองจำนวนหรือความเร่งด่วนของวัคซีนโควิด เพราะสมรรถภาพการขนส่งได้เสื่อมลงเหตุการล็อกดาวน์และการลดจำนวนพนักงานในช่วงปี 2020[765][766][767] เมื่อกล่าวถึงความท้ายทายต่อองค์กรที่ต้องประสานงานกันต่าง ๆ รวมทั้งโปรแกรมโคแว็กซ์ บริษัทยาสากล ผู้รับจ้างผลิตวัคซีน บริษัทขนส่งทั้งในประเทศและนานาชาติ คลังจัดเก็บวัคซีน และองค์กรสาธารณสุขในแต่ละประเทศ ประธานบริหารของกาวีได้ระบุว่า "การส่งวัคซีนเป็นพัน ๆ ล้านโดสไปทั่วโลกอย่างมีประสิทธิภาพจะมีอุปสรรคทางโลจิสติกส์และทางแผนการที่ซับซ้อนอย่างยิ่งตลอดทั้งโซ่อุปทาน"[768]
ตัวอย่างที่เน้นความใหญ่โตของปัญหาก็คือ สมาคมการขนส่งทางอากาศนานาชาติ (International Air Transport Association, IATA) ระบุว่า จะต้องมีเครื่องบินขนส่งโบอิง 747 ซึ่งประกอบกับตู้เย็นวัคซีนพิเศษที่รักษาอุณหภูมิอย่างแม่นยำถึง 8,000 ลำเพื่อใช้ส่งยาเพียงโดสหนึ่งไปยังประเทศเกิน 200 ประเทศทั่วโลก[769] โดยกาวีก็ระบุอีกว่า "สำหรับการระบาดทั่วที่แพร่ไปอย่างรวดเร็ว จะไม่มีใครปลอดภัยยกเว้นทุกคนปลอดภัย"[84]
เมื่อเทียบกับเทคโนโลยีวัคซีนและงานวิจัยทางคลินิกระยะต้น ๆ ที่ได้เงินทุนเป็นพัน ๆ ล้านดอลลาร์สหรัฐแล้ว โซ่อุปทานที่จำเป็นหลังวัคซีนได้อนุมัติกลับไม่ได้รับความสนใจเท่าในด้านการวางแผน การประสานงาน ความมั่นคงปลอดภัย และการลงทุน[765][766][770] ปัญหาสำคัญอย่างหนึ่งก็คือ ทรัพยากรเพื่อแจกจำหน่ายวัคซีนในประเทศที่มีรายได้ต่ำจนถึงปานกลาง (รวมทั้งประเทศไทย) โดยเฉพาะในการให้วัคซีนแก่เด็ก อาจไม่เพียงพอหรือไม่มีเลย แต่อาจปรับปรุงโดยมีค่าใช้จ่ายน้อยที่สุดได้ถ้าสามารถซื้อและแจกจำหน่ายในระดับภูมิภาคหรือระดับชาติ[84][771]
ในเดือนกันยายน โปรแกรมโคแว็กซ์รวมประเทศ 172 ประเทศซึ่งประสานแผนงานเพื่อให้ได้โซ่อุปทานของวัคซีนโควิดที่ดีสุด[772] และกองทุนเพื่อเด็กแห่งสหประชาชาติก็ได้เข้าร่วมกับโคแว็กซ์เพื่อตระเตรียมเงินทุนและโซ่อุปทานเพื่อให้วัคซีนแก่เด็กในประเทศกำลังพัฒนา 92 ประเทศ[773][774]
โลจิสติกส์[แก้]
การมีระบบโลจิสติกส์ในการให้วัคซีนจะช่วยให้มีเครื่องไม้เครื่องมือ บุคลากร และวัคซีนที่ได้อนุมัติอย่างข้ามพรมแดน[775] ซึ่งอาจรวมการจัดการและเฝ้าสอดส่องวัคซีน การบริหารการเก็บและขนส่งที่ต้องใช้ตู้เย็น และความปลอดภัยในการแจกจำหน่ายวัคซีนภายในระบบ[776] เป้าของโปรแกรมโคแว็กซ์ก็เพื่อรวมศูนย์และจัดการทรัพยากรทางโลจิสติกส์อย่างยุติธรรมในบรรดาประเทศที่เข้าร่วมด้วย โดยรวมเข้าด้วยกันซึ่งการผลิต การขนส่ง และโครงสร้างพื้นฐานสำหรับโซ่อุปทานโดยทั่วไป[84][770]และมีเครื่องมือในการพยากรณ์วัคซีน การประเมินความต้องการ การบริหารวัคซีนภายในประเทศ การจัดการวัคซีนที่อาจเสีย และการบริหารวัคซีนในคลัง[776] ปัจจัยทางโลจิสติกส์อื่น ๆ ที่จะทำในระดับนานาชาติเมื่อแจกจำหน่ายวัคซีนโควิดอาจรวม[765][777][778]
- การสืบติดตามวัคซีนแต่ละขวดได้ผ่านบาร์โค้ด
- การแชร์ผลการตรวจสอบ (audit) ผู้จัดจำหน่าย
- การแชร์ระบบติดตามขวดวัคซีนเริ่มจากผู้ผลิตไปจนถึงบุคคลที่ได้วัคซีน
- การใช้อุปกรณ์สอดส่องอุณหภูมิของวัคซีน
- การตรวจและการประกันความเสถียรของอุณหภูมิ
- เทคโนโลยีการบรรจุและการขนส่งใหม่ ๆ
- การเก็บสะสมวัคซีนในคลัง
- การจัดการเครื่องมือเครื่องใช้ภายในประเทศ (อุปกรณ์ป้องกันโรค สารทำให้เจือจาง กระบอกฉีดยา เข็มฉีดยา จุก เชื้อเพลิงหรือแหล่งพลังงานสำหรับตู้เย็นเก็บวัคซีน การจัดการของเสีย/ขยะ เป็นต้น)
- เทคโนโลยีการสื่อสาร
- การบริหารผลต่อสิ่งแวดล้อมในแต่ละประเทศ
ตามผู้ผลิตวัคซีนรายหนึ่ง ปัญหาทางโลจิสติกส์ในขั้นใดขั้นหนึ่งอาจสะดุดโซ่อุปทานทั้งโซ่[779] และถ้าโซ่อุปทานของวัคซีนล้มเหลว ความเสียหายทางเศรษฐกิจและทางมนุษยชนเหตุการระบาดทั่วอาจยืดยาวเป็นปี ๆ[767]
กำลังการผลิต[แก้]
จนถึงเดือนสิงหาคม 2020 แม้เมื่อมีวัคซีนแคนดิเดตเพียงไม่กี่อย่างที่กำลังทดลองทางคลินิกในระยะที่ 3 โดยยังต้องใช้เวลาอีกหลายเดือนเพื่อกำหนดความปลอดภัยและประสิทธิศักย์ รัฐบาลต่าง ๆ ก็ได้สั่งวัคซีนล่วงหน้ามากกว่า 2,000 ล้านโดสโดยมีค่าใช้จ่ายเกิน 5,000 ล้านดอลลาร์สหรัฐ (ประมาณ 158,000 ล้านบาท)[758][779][780] รัฐบาลอังกฤษได้สั่งวัคซีนสำหรับปี 2021 ล่วงหน้าเป็นจำนวน 5 โดสต่อประชากรหนึ่งคน เป็นจำนวนที่ก่อความท้อใจแก่องค์กรต่าง ๆ เช่น องค์การอนามัยโลกและกาวีซึ่งกำลังโปรโมตการเข้าถึงวัคซีนอย่างยุติธรรมและทั่วถึงกันโดยเฉพาะสำหรับประเทศกำลังพัฒนา[758] ในเดือนกันยายน เซพีให้ทุนสนับสนุนทั้งงานวิจัยพื้นฐานและการทดลองทางคลินิกสำหรับวัคซีนแคนดิเดต 9 อย่าง โดยมีอีก 9 อย่างที่กำลังประเมิน และตกลงจะผลิตวัคซีนที่ได้อนุมัติ 3 อย่างเป็นจำนวน 2,000 ล้านโดสไม่เกินปี 2021[772] ทั่วไปแล้วก่อนปี 2022 ทั่วโลกอาจผลิตวัคซีนระหว่างเจ็ดพันถึงหมื่นล้านโดส แต่การสั่งวัคซีนล่วงหน้าของประเทศร่ำรวยก็อาจทำให้วัคซีนไม่มีสำหรับประเทศที่ยากจน[29][779][758]
หลังจากเข้าร่วมโปรแกรมโคแว็กซ์ในเดือนตุลาคม จีนก็ระบุว่าจะผลิตวัคซีน 600 ล้านโดสก่อนสิ้นปี 2020 และผลิตอีกพันล้านโดสในปี 2021 แต่ก็ไม่แน่ใจว่าจำนวนเท่าไรจะใช้ในจีนเองซึ่งมีประชากรกว่า 1,300 ล้านคน[781] ซิโนฟาร์มกล่าวว่า บริษัทอาจมีกำลังผลิตวัคซีนเกิน 1,000 ล้านโดสในปี 2021[782] โดยหุ้นส่วนในดูไบคือบริษัท G42 Healthcare ก็มุ่งจะผลิตให้ได้ถึง 100 ล้านโดสในปี 2021 ให้ใช้ในตะวันออกกลาง[783] ส่วนซิโนแว็กก็กล่าวว่า บริษัทมุ่งสร้างโรงงานที่สองให้เสร็จปลายปี 2020 เพื่อเพิ่มกำลังผลิตวัคซีน CoronaVac เป็น 600 ล้านโดสซึ่งเป็นทวีคูณจากจำนวนเดิม[784] โดยหุ้นส่วนในบราซิลคือ Instituto Butantan มีแผนจะผลิตให้ถึง 100 ล้านโดส[785] และหุ้นส่วนในอินโดนีเซียคือ Bio Farma ก็มีแผนจะผลิตให้ได้ 250 ล้านโดส[786]
สถาบันเซรุ่มแห่งอินเดียมีแผนจะผลิตวัคซีนอย่างน้อย 1,000 ล้านโดส แต่ก็ระบุแล้วว่าครึ่งหนึ่งจะใช้ในอินเดีย[758]
ส่วนประธานบริหารของบริษัทแอสตร้าเซนเนก้าระบุว่า "ปัญหาไม่ใช่การผลิตวัคซีนเอง มันอยู่ที่ขวดบรรจุ คือโลกไม่มีขวดบรรจุพอ"[787] เพื่อเตรียมตัวรับมือกับการสั่งขวดเป็นจำนวนมาก บริษัทผลิตภัณฑ์แก้วอเมริกันรายหนึ่งได้ลงทุน 163 ล้านดอลลาร์สหรัฐ (ประมาณ 5,100 ล้านบาท) เพื่อสร้างโรงงานผลิตขวดวัคซีน[788] แต่การมีแก้วพอและการควบคุมความปนเปื้อนก็อาจเป็นปัญหา[789] ซึ่งทำให้ค่าใช้จ่ายการผลิตสูงขึ้นและกำไรน้อยลงสำหรับผู้พัฒนาวัคซีน ในสถานการณ์ที่เรียกร้องให้วัคซีนมีราคาพอจ่ายไหว[84][758][767]
วัคซีนต้องดูแลและขนส่งตามกฎควบคุมสากล ต้องรักษาไว้ที่อุณหภูมิอันแน่นอนต่าง ๆ กันแล้วแต่เทคโนโลยีของวัคซีน และต้องใช้ก่อนเสื่อมเมื่อเก็บไว้ในคลัง[758][779] โซ่อุปทานของวัคซีนโควิดคาดว่าจะมีขนาดมหึมาเพื่อให้ส่งไปยังประชากรทั่วโลกได้[29][766] สิ่งสำคัญที่ต้องเตรียมตัวการขนส่งเยี่ยงนี้รวมอุปกรณ์และคลังเก็บที่ควบคุมอุณหภูมิ โครงสร้างพื้นฐานที่เหมาะสม บุคลากรที่ได้ฝึกเพื่อให้วัคซีน และการเฝ้าติดตามอย่างระมัดระวัง[766][768][773] จะมีการใช้อาร์เอฟไอดี (การระบุตัวด้วยคลื่นวิทยุ) เพื่อติดตามและยืนยันวัคซีนของจริงโดยเริ่มจากผู้ผลิต ไปตามโซ่อุปทาน จนถึงผู้ได้วัคซีน[790]
โซ่เย็น (cold chain)[แก้]
วัคซีนและตัวเสริมไม่เสถียรโดยธรรมชาติเมื่ออุณหภูมิเปลี่ยน จึงทำให้ต้องมี "โซ่เย็น" (cold chain) คือมีการแช่เย็นในการขนส่งและการเก็บตลอดโซ่อุปทาน ปกติที่อุณหภูมิราว2–8 องศาเซลเซียส[778][791] เพราะวัคซีนโควิดใช้เทคโนโลยีต่าง ๆ จึงก่อปัญหาใหม่ ๆ ในการจัดการบริหารโซ่เย็น มีวัคซีนบางอย่างที่เสถียรเมื่อแช่แข็งแต่ไม่คงตัวเมื่อเจอความร้อน บางอย่างไม่ควรแช่แข็งเลย และบางอย่างเสถียรตลอดทุกอุณหภูมิ[791] ความเสียหายเหตุการแช่แข็งและการฝึกบุคลากรในพื้นที่ไม่ดีพอจึงอาจเป็นปัญหาสำคัญ[792]
ถ้าวัคซีนโควิดมากกว่าหนึ่งอย่างได้อนุมัติ โซ่เย็นวัคซีนอาจต้องแก้ปัญหาความไวอุณหภูมิในระดับต่าง ๆ ข้ามประเทศต่าง ๆ ที่มีภูมิอากาศต่าง ๆ และมีทรัพยากรในพื้นที่เพื่อรักษาอุณหภูมิต่าง ๆ กัน[791] วัคซีนของซิโนฟาร์มและซิโนแว็กเป็นตัวอย่างของวัคซีนอันใช้ไวรัสที่ฆ่าแล้วซึ่งอยู่ระหว่างการทดลองระยะที่ 3 อันสามารถขนส่งโดยระบบโซ่เย็นที่มีอยู่แล้วได้ กล่าวคือสามารถแช่เย็นในอุณหภูมิระหว่าง 2–8 องศาเซลเซียส[793][794]
วัคซีนอาร์เอ็นเออาจมีความยากลำบากในการผลิตในปริมาณมาก ๆ หรือรักษาไว้ไม่ให้เสื่อม คือต้องใช้ตู้แช่แข็งอุณหภูมิต่ำพิเศษเพื่อเก็บในคลังและในการขนส่ง[767] ยกตัวอย่างเช่น วัคซีนอาร์เอ็นเอของโมเดอร์นาต้องใช้โซ่เย็นเพียงแค่เหนือจุดเยือกแข็งโดยเก็บได้เป็นเวลาจำกัด แต่วัคซีนของไฟเซอร์-ไบออนเทคต้องเก็บในตู้แช่แข็งอุณหภูมิต่ำ −80 ถึง −60 องศาเซลเซียสตลอดการขนส่งจนถึงจุดให้วัคซีน[795][796]
หลังจากเจาะขวดวัคซีนด้วยเข็มฉีดแล้ว ก็จะใช้ได้เพียงแค่ 6 ชม. แล้วก็ต้องทิ้งไป หน่วยบริการในพื้นที่จึงต้องบริหารการแช่แข็งและการให้วัคซีน[29][797] เพราะวัคซีนโควิดน่าจะขลาดแคลนเมื่อเริ่มใช้ในเบื้องต้น บุคลากรก็จะต้องหลีกเลี่ยงการทำของเสีย ซึ่งปกติอาจจะถึงร้อยละ 30 ของวัคซีนที่มี[765][797] โซ่อุปทานยังอาจมีปัญหากับวิธีการขนส่งวัคซีนในพื้นที่ชนบท เช่น ด้วยจักรยานยนต์หรือด้วยโดรนส่งของ กับการต้องให้วัคซีนครั้งที่สอง กับการใช้สารทำให้เจือจาง กับการเข้าถึงกลุ่มประชากรเป้าหมาย เช่น บุคลากรทางแพทย์ เด็ก และคนชรา[29][773][798]
การขนส่งทางอากาศและทางบก[แก้]
การประสานงานเครื่องบินขนส่งระดับนานาชาติจำเป็นในการแจกจำหน่ายวัคซีนโควิดที่มีจำกัดเวลาและอุณหภูมิ แต่จนถึงเดือนกันยายน 2020 เครือข่ายขนส่งเช่นนี้ก็ยังไม่พร้อมขนส่งวัคซีนในระดับนานาชาติ[766][769][799] ประธานบริหารของสมาคมการขนส่งทางอากาศนานาชาติ (IATA) ได้กล่าวในเดือนกันยายนว่า "การขนส่งวัคซีนโควิด-19 อย่างปลอดภัยจะเป็นภาระหน้าที่ซึ่งศตวรรษหนึ่งมีครั้งเดียวของอุตสาหกรรมขนส่งทางอากาศทั่วโลก แต่นี่เป็นไปไม่ได้ถ้าไม่วางแผนล่วงหน้าอย่างระมัดระวัง ซึ่งต้องทำเดี๋ยวนี้ เราวิงวอนให้รัฐบาลเป็นผู้นำในการอำนวยการร่วมมือกันตลอดโซ่โลจิสติกส์เพื่อจัดการสิ่งอำนวยความสะดวก ความมั่นคงและปลอดภัย และกระบวนการตรวจที่ชายแดนให้พร้อมกับงานขนาดยักษ์และซับซ้อนข้างหน้านี้"[799]
เพราะการลดจำนวนผู้โดยสารทางอากาศอย่างหนักในช่วงปี 2020 สายการบินต่าง ๆ จึงได้ไล่พนักงานออก ลดจุดหมายที่บริการ และนำเครื่องบินไปเก็บในโรงเก็บระยะยาว[766][799] ดังนั้น องค์กรผู้นำในการซื้อหาและแจกจำหน่ายวัคซีนโควิดภายในโปรแกรมโคแว็กซ์คือกาวีและกองทุนเพื่อเด็กแห่งสหประชาชาติ จึงกำลังเตรียมตัวส่งวัคซีนเป็นจำนวนมากที่สุดและเร็วที่สุดเท่าที่เคยมี โดยประสานงานกับบริษัทขนส่งทางอากาศนานาชาติ การควบคุมคนเข้าเมืองและการตรวจอากรสินค้า และการใช้บริการของเครื่องบินขนส่งอาจถึง 8,000 ลำเพียงแค่จะส่งวัคซีนโดสเดียวไปยังประเทศต่าง ๆ[773][799]
วัคซีนสองอย่างแรก ๆ ที่ได้อนุมัติคือ Tozinameran ของบริษัทไฟเซอร์-ไบออนเทค และ mRNA-1273 ของโมเดอร์นาต้องแช่แข็งในระหว่างการขนส่ง โดยใช้ตู้บรรจุที่ออกแบบเป็นพิเศษ[C] และน้ำแข็งแห้ง แต่น้ำแข็งแห้งก็ปกติอนุญาตเป็นจำนวนจำกัดบนเครื่องบินเพราะแก๊สจากการการระเหิดอาจเป็นพิษ ในสหรัฐ องค์การบริหารการบินแห่งชาติจำกัดจำนวนน้ำแข็งแห้งสำหรับเครื่องบินโบอิง 777 เพียงแค่ 1.4 ตัน แต่ก็อนุญาตชั่วคราวให้สายการบินยูไนเต็ดแอร์ไลน์ขนส่งถึง 6.8 ตัน คือเป็นวัคซีนเกือบ 1 ล้านโดส ระหว่างกรุงบรัสเซลส์จนถึงเมืองชิคาโก อเมริกันแอร์ไลน์ โบอิง และเดลตาแอร์ไลน์ก็กำลังเพิ่มสมรรถภาพการขนส่งน้ำแข็งแห้งสำหรับเที่ยวบิน โดยสายการบินอเมริกัน เดลตา และยูไนเต็ดต่างก็มีเครือข่ายขนส่งสินค้าแช่เย็นในสหรัฐของตน ๆ ส่วนเฟดเอกซ์และยูพีเอสได้ติดตั้งตู้แช่เข็งเย็นพิเศษที่ศูนย์เครื่องบินขนส่งในยุโรปและอเมริกาเหนือ[801]
ความมั่นคงปลอดภัยและคอรัปชั่น[แก้]
ยาเป็นสินค้าปลอมที่มีค่ามากที่สุดในโลก โดยมีมูลค่าเกิน 200,000 ล้านดอลลาร์สหรัฐต่อปี (ประมาณ 6.3 ล้านล้านบาท) ซึ่งทำให้วัคซีนโควิดอันมีความต้องการอย่างยิ่งเสี่ยงถูกปลอม ถูกขโมย เสี่ยงการฉ้อฉลและการโจมตีทางไซเบอร์ (cyberattack) ตลอดโซ่อุปทาน[770][802] จนกระทั่งถึงเรียกวัคซีนว่าเป็น "ทรัพย์สินที่มีค่าที่สุดในโลก" โดยตำรวจสากลเรียกมันว่า "ทองเหลว" และเตือนถึงการมีอาชญากรรมประเภทต่าง ๆ เกิดขึ้นพร้อม ๆ กัน[803] ระบบป้องกันคอรัปชั่น การสร้างความโปร่งใส การระบุหน้าที่รับผิดชอบก็กำลังตั้งขึ้นเพื่อลดและกำจัดคอรัปชั่นเกี่ยวกับเครื่องมือเครื่องใช้ของวัคซีนโควิด[802][804] แต่การไร้กฎหมายที่มีโครงสร้างเดียวกันระหว่างประเทศต่าง ๆ การไร้สมรรถภาพทางเทคโนโลยี วัคซีนที่มีจำกัด และความไม่สามารถระบุหรือติดตามวัคซีนของจริงหรือของปลอม ก็อาจเป็นอัตรายต่อชีวิตของผู้ได้วัคซีน และอาจทำให้การระบาดทั่วของโควิดไม่สิ้นสุด[802] ดังนั้น ผู้ผลิตวัคซีนจึงใช้เทคโนโลยีติดตามเพื่อตามขวดวัคซีนไปจนตลอดโซ่อุปทาน[770] และใช้เครื่องมือดิจิตัลแบบชีวมาตร (biometric) เพื่อสร้างความปลอดภัยสำหรับวัคซีน[790][805]
ในเดือนธันวาคม 2020 ตำรวจสากลเตือนว่า พวกมาเฟียอาจแทรกตัวเข้าไปในโซ่อุปทานของวัคซีนแล้วขโมยวัคซีนหรือขโมยข้อมูล หรือแม้แต่ขายชุดวัคซีนปลอม[806] อนึ่ง วัคซีนที่ต้องแช่แข็งอยู่ตลอดก็เสี่ยงต่อวินาศกรรมด้วย[803]
อุปกรณ์จีพีเอสจะใช้ติดตามวัคซีนในสหรัฐ ในรัฐโคโลราโด เจ้าหน้าที่ตำรวจรัฐจะตามคุ้มครองวัคซีนที่ส่งจากท่าอากาศยานนานาชาติเดนเวอร์ไปยังศูนย์ส่งต่อวัคซีนต่าง ๆ ในรัฐ 8 แห่ง โดยแผนการขนส่งจะเก็บเป็นความลับและเจ้าหน้าที่จะอำพรางปิดบังภารกิจ[800]
ธุรกิจที่เกี่ยวข้องก็ยังอาจเกิดผลกระทบด้วย นักวิเคราะห์ทางความมั่นคงปลอดภัยของบริษัทไอบีเอ็มได้ให้สัมภาษณ์กับหนังสือพิมพ์เดอะนิวยอร์กไทมส์ ว่า บริษัทเคมีภัณฑ์ปิโตรเลียมได้กลายเป็นเป้าสำหรับนักเลงคอมพิวเตอร์เพราะบทบาทสำคัญของบริษัทในการผลิตน้ำแข็งแห้ง[803]
โครงสร้างพื้นฐานของชาติ[แก้]
องค์การอนามัยโลกได้สร้างระบบบริหารวัคซีนอย่างมีประสิทธิภาพ (Effective Vaccine Management)[807] ซึ่งรวมการจัดลำดับความสำคัญเพื่อเตรียมบุคลากรทั้งประจำประเทศและส่วนภูมิภาค เตรียมสถานบริการเพื่อแจกจำหน่ายวัคซีนรวมทั้ง
- ฝึกบุคลากรให้สามารถจัดการวัคซีนที่มีเวลาและอุณหภูมิจำกัด
- ระบบการเฝ้าสอดส่องที่ทนทานเพื่อให้สามารถเก็บและขนส่งวัคซีนได้ดีที่สุด
- การมีอุปกรณ์และสถานที่ที่ควบคุมอุณหภูมิได้
- การติดตามวัคซีนได้
- ความปลอดภัย
กระบวนการตรวจเมื่อเข้าเมืองเพื่อให้จัดการวัคซีนและผ่านกงศุลได้อย่างมีประสิทธิภาพในประเทศแต่ละประเทศอาจรวม[775][807]
- อำนวยความสะดวกแก่สายการบิน
- ยกเว้นเจ้าหน้าที่เครื่องบินจากการกักด่าน
- สร้างระบบปฏิบัติการที่ยืดหยุ่นได้เพื่อให้ใช้ในประเทศได้อย่างมีประสิทธิภาพ
- จัดลำดับให้เครื่องบินขนส่งลงก่อนเพื่อรักษาอุณหภูมิวัคซีน
ความรับผิดชอบต่อผลิตภัณฑ์[แก้]
วันที่ 4 กุมภาพันธ์ 2020 เลขาธิการกระทรวงบริการทางสาธารณสุขและมนุษย์สหรัฐได้ประกาศยกเว้นความรับผิดชอบต่อผลิตภัณฑ์ที่ใช้สู้กับโควิด-19 คือ วัคซีนอะไรก็ได้ ที่ใช้รักษา วินิจฉัย ป้องกัน หรือลดอาการโควิด-19 หรือลดการแพร่เชื้อของ SARS-CoV-2 หรือของไวรัสที่กลายพันธุ์จากนั้น และระบุว่า ประกาศนี้กันการฟ้องคดีเกี่ยวกับความรับผิดชอบว่า ผู้ผลิตวัคซีนประมาทเลินเล่อ หรือแพทย์พยาบาลประมาทเลินเล่อเพราะให้ยาผิดขนาด/ผิดประเภท หากไม่ได้จงใจประพฤติไม่ชอบในหน้าที่[808] ประกาศนี้มีผลในสหรัฐจนกระทั่งถึงวันที่ 1 ตุลาคม 2024
ข้อมูลผิด ๆ[แก้]
สื่อสังคมได้ช่วยสนับสนุนทฤษฎีสมคบคิดที่อ้างว่า วัคซีนโควิด-19 มีอยู่แล้วเมื่อจริง ๆ ยังไม่มี และจริง ๆ สิทธิบัตรที่บทความต่าง ๆ ได้อ้างผิด ๆ ก็เป็นสิทธิบัตรสำหรับลำดับดีเอ็นเอและวัคซีนป้องกันไวรัสโคโรนาสายพันธุ์อื่น ๆ เช่น ไวรัสโคโรนาโรคซาร์ส ไม่ใช่สำหรับโควิด[809][810]
ในวันที่ 21 พฤษภาคม 2020 องค์การอาหารและยาสหรัฐได้แถลงการณ์ว่า ได้ยื่นคำสั่งให้หยุดและไม่กระทำอีกต่อบริษัทในเมืองซีแอตเทิลคือ North Coast Biologics ผู้ได้ขายยาซึ่งอ้างว่าเป็น "วัคซีนโปรตีน spike ของ nCoV19"[811]
ดูเพิ่ม[แก้]
- การระบาดทั่วของโควิด-19
- โรคติดเชื้อไวรัสโคโรนา 2019
- ไวรัสโคโรนาสายพันธุ์ใหม่ (SARS-CoV-2)
- ระยะการทดลองทางคลินิก
- โรคระบบหายใจ
เชิงอรรถ[แก้]
- ↑ ของ Kangtai Biological Products Co. Ltd และบริษัทลูกคือ Beijing Minhai Biotechnology Co.
- ↑ สหราชอาณาจักร[93] บาห์เรน[94] สหรัฐอาหรับเอมิเรตส์[95] แคนาดา[96] ซาอุดีอาระเบีย[97] สหรัฐ[98] เม็กซิโก[99] คูเวต[100] สิงคโปร์[101] จอร์แดน[102] โอมาน[103] เอกวาดอร์[104] คอสตาริกา[105] ปานามา[106] ชิลี[107] สวิตเซอร์แลนด์[108] และกาตาร์[109]
- ↑ บริษัทไฟเซอร์ได้ออกแบบตู้บรรจุที่เก็บวัคซีนได้จนถึงเดือนหนึ่งเมื่อได้น้ำแข็งแห้งเรื่อย ๆ[800]
อ้างอิง[แก้]
อ่านเพิ่ม[แก้]
- แม่แบบ:Cite journal
- แม่แบบ:Cite web
- แม่แบบ:Cite web
- แม่แบบ:Cite web
- แม่แบบ:Cite web
- COVID-19 vaccine tracker, Regulatory Focus
- แม่แบบ:Cite web
- แม่แบบ:Cite press release
- แม่แบบ:Cite web
- แม่แบบ:Cite web
- แม่แบบ:Cite web
- แม่แบบ:Cite web
- แม่แบบ:Cite web