อะมิกาซิน
 | |
 | |
| ข้อมูลทางคลินิก | |
|---|---|
| ชื่อทางการค้า | Amikin, Amiglyde-V, Arikayce, อื่น ๆ |
| AHFS/Drugs.com | โมโนกราฟ |
| MedlinePlus | a682661 |
| ข้อมูลทะเบียนยา | |
| ระดับความเสี่ยงต่อทารกในครรภ์ | |
| ช่องทางการรับยา | การฉีดเข้ากล้ามเนื้อ, การฉีดเข้าหลอดเลือดดำ |
| ประเภทยา | อะมิโนไกลโคไซด์ |
| รหัส ATC | |
| กฏหมาย | |
| สถานะตามกฏหมาย | |
| ข้อมูลเภสัชจลนศาสตร์ | |
| ชีวประสิทธิผล | >90%[3] |
| การจับกับโปรตีน | 0–11% |
| การเปลี่ยนแปลงยา | ส่วนใหญ่ไม่ถูกเปลี่ยนแปลง |
| ครึ่งชีวิตทางชีวภาพ | 2–3 ชั่วโมง |
| การขับออก | ไต |
| ตัวบ่งชี้ | |
| |
| เลขทะเบียน CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.048.653 |
| ข้อมูลทางกายภาพและเคมี | |
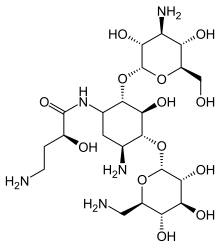
| สูตร | C22H43N5O13 |
| มวลต่อโมล | 585.608 g·mol−1 |
| แบบจำลอง 3D (JSmol) | |
| |
| |
| (verify) | |
อะมิกาซิน (อังกฤษ: Amikacin) เป็นยาปฏิชีวนะในกลุ่มอะมิโนไกลโคไซด์ มีข้อบ่งใช้สำหรับการรักษาโรคที่เกิดจากการติดเชื้อแบคทีเรีย[4] ได้แก่ การติดเชื้อในข้อ, การติดเชื้อในช่องท้อง, เยื่อหุ้มสมองอักเสบ, ปอดบวม, ภาวะพิษเหตุติดเชื้อ, และการติดเชื้อในระบบทางเดินปัสสาวะ[4] นอกจากนี้ยังมีการใช้ยานี้ในผู้ป่วยวัณโรคที่ดื้อต่อยาหลายขนานอีกด้วย[5] ยานี้มีทั้งในรูปแบบฉีดเข้ากล้ามเนื้อและ ฉีดเข้าหลอดเลือดดำ[4]
อะมิกาซินออกฤทธิ์ยับยั้งการสังเคราะห์โปรตีนของเชื้อแบคทีเรีย โดยจะเข้าจับกับหน่วยย่อยที่ 30 เอสของไรโบโซมแบคทีเรีย ทำให้แบคทีเรียนั้น ๆ ไม่สามารถสังเคราะห์โปรตีนที่จำเป็นต่อการดำรงชีวิตและเจริญเติบโตได้ ซึ่งจะส่งผลให้เซลล์แบคทีเรียนั้นตายไปในที่สุด[4] ทั้งนี้ อะมิกาซินมีอาการไม่พึงประสงค์จากการใช้ยาเช่นเดียวกันกับยาอื่นในกลุ่มอะมิโนไกลโคไซด์ คือ สามารถทำให้เกิดการสูญเสียการได้ยิน, การทรงตัวผิดปกติ, และเกิดปัญหาเกี่ยวกับไตได้[4] ส่วนอาการข้างเคียงที่อาจเกิดขึ้นได้ แต่พบอุบัติการณ์การเกิดค่อนข้างน้อย ได้แก่ กล้ามเนื้ออ่อนแรง ซึ่งจะทำให้ผู้ป่วยมีปัญหาเกี่ยวกับระบบการหายใจตามมาได้[4] นอกจากนี้ การใช้ยานี้ในหญิงตั้งครรภ์อาจทำให้เด็กที่คลอดออกมามีภาวะหูหนวกแบบถาวรได้[4]
อะมิกาซินเป็นยาที่พัฒนาขึ้นมาจากกานามัยซิน[4] ได้รับการจดสิทธิบัตรเมื่อ ค.ศ. 1971 และถูกนำมาใช้อย่างแพร่หลายเป็นครั้งแรกในปี ค.ศ. 1976[6][7] โดยได้ถูกจัดเป็นหนึ่งในรายการยาจำเป็นขององค์การอนามัยโลก (World Health Organization's List of Essential Medicines) ซึ่งเป็นรายการยาที่มีความสำคัญเป็นลำดับแรกของระบบสุขภาพพื้นฐานของประชาชนในประเทศต่าง ๆ[8] สำหรับการขายส่งของยานี้ในประเทศกำลังพัฒนามีราคาประมาณ 11 – 106 ยูโรต่อการรักษาด้วยยานี้หนึ่งเดือน[9] ในสหรัฐอเมริกา ค่าใช้จ่ายเฉพาะค่ายาสำหรับการรักษาด้วยอะมิกาซินหนึ่งรอบการรักษาอยู่ที่ประมาณ 25 – 50 ดอลลาร์สหรัฐ[10]
การใช้ประโยชน์ทางการแพทย์
[แก้]ในปัจจุบันมีการใช้อะมิกาซินบ่อยครั้งขึ้นในการรักษาโรคติดเชื้อแบคทีเรียที่มีอาการรุนแรง โดยเฉพาะอย่างยิ่ง การติดเชื้อแบคทีเรียที่ดื้อต่อยาปฏิชีวนะหลายขนาน, แบคทีเรียแกรมลบที่ไม่ใช้ออกซิเจน โดยเฉพาะอย่างยิ่ง Pseudomonas, Acinetobacter, Enterobacter, E. coli, Proteus, Klebsiella, และ Serratia[11] มีเพียงเชื้อแบคทีเรียแกรมบวก 2 สกุลเท่านั้นที่ตอบสนองต่อการรักษาด้วยอะมิกาซิน ได้แก่ Staphylococcus[11] และ Nocardia[12] นอกจากนี้อะมิกาซินยังถูกใช้ในการรักษาโรคที่เกิดจากการติดเชื้อสกุลไมโคแบคทีเรียมที่ไม่ใช่วัณโรค (non-tubercular Mycobacterium infections) และวัณโรค (ในสายพันธุ์ที่ไวต่อยานี้) ในกรณีที่การรักษาทางเลือกแรกไม่สามารถควบคุมอาการของโรคได้[4] ทั้งนี้ ในปัจจุบันมีการใช้อะมิกาซินเป็นยาปฏิชีวนะเดี่ยวในการรักษาโรคใดโรคหนึ่งน้อยมาก ส่วนใหญ่มักใช้ร่วมกับยาปฏิชีวนะอื่น เพื่อเสริมฤทธิ์ซึ่งกันและกัน[13]
ภาวะหรือโรคที่มักใช้อะมิกาซินเป็นยาในการรักษาอยู่บ่อยครั้ง ได้แก่:[4]
- โรคหลอดลมพอง (Bronchiectasis)[14]
- การติดเชื้อในกระดูกและข้อ
- การจำนวนเม็ดเลือดขาวชนิดแกรนูโลไซต์ลดน้อยลง (Granulocytopenia) ในผู้ป่วยมะเร็ง โดยมักใช้ร่วมกับไทคาร์ซิลลิน[15]
- การติดเชื้อภายในช่องท้อง เช่น ภาวะเยื่อบุช่องท้องอักเสบ เป็นยาที่ใช้เสริมฤทธิ์ยาปฏิชีวนะอื่น เช่น คลินดามัยซิน, เมโทรนิดาโซล, ปิปเปอราซิลลิน/ทาโซแบคแตม, หรือ แอมพิซิลลิน/ซัลแบคแตม
- เยื่อหุ้มสมองอักเสบ:
- กรณีเชื้อสาเหตุ คือ E. coli จะใช้อะมิกาซินเสริมฤทธิ์กับอิมมิพีเนม
- กรณีเชื้อสาเหตุ คือ Pseudomonas จะใช้อะมิกาซินเสริมฤทธิ์กับเมอโรพีเนม
- กรณีเชื้อสาเหตุ คือ Acetobacter จะใช้อะมิกาซินเสริมฤทธิ์กับอิมมิพีเนม หรือโคลิสติน
- กรณีเยื่อหุ้มสมองอักเสบในเด็กแรกเกิด ที่มีสาเหตุมาจาก Streptococcus agalactiae หรือ Listeria monocytogenes จะใช้อะมิกาซินเสริมฤทธิ์กับแอมพิซิลลิน
- กรณีเยื่อหุ้มสมองอักเสบในเด็กแรกเกิด ที่มีสาเหตุมาจากแบคทีเรียแกรมลบ เช่น E. coli จะใช้อะมิกาซินเสริมฤทธิ์กับเซฟาโลสปอริน รุ่นที่ 3
- การติดเชื้อไมโคแบคทีเรีย รวมไปถึงการใช้เป็นยาทางเลือกรองสำหรับวัณโรคระยะแสดงอาการ[16] รวมไปถึงโรคที่เกิดจากการติดเชื้อ Mycobacterium avium, M. abcessus, M. chelonae, และ M. fortuitum
- การติดเชื้อ Rhodococcus equi ซึ่งจะมีอาการคล้ายคลึงกับวัณโรค
- การติดเชื้อในระบบทางเดินหายใจ รวมไปถึงการใช้เสริมฤทธิ์กับเบตาแลคแตม หรือคาร์บาพีเนม ในการรักษาโรคปอดอักเสบจากโรงพยาบาล
- ภาวะพิษเหตุติดเชื้อ รวมถึงในเด็กแรกเกิด[11] โดยใช้เสริมฤทธิ์กับเบตาแลคแตม หรือคาร์บาพีเนม
- การติดเชื้อที่ผิวหนังและแผลเย็บ[11]
- การติดเชื้อในระบบทางเดินปัสสาวะ กรณีที่เชื้อสาเหตุเป็นเชื้อที่ดื้อต่อยาปฏิชีวนะอื่น (ส่วนใหญ่มักเป็น Enterobacteriaceae หรือ P. aeruginosa)
นอกจากข้อบ่งใช้ดังข้างต้นแล้ว อะมิกาซินยังสามารถให้ร่วมกับยาปฏิชีวนะกลุ่มเบตาแลคแตมเพื่อเป็นการให้ยาปฏิชีวนะแบบครอบคลุมเชื้ออย่างกว้าง (empiric therapy) ในผู้ป่วยที่มีภาวะเม็ดเลือดขาวต่ำรวมกับมีไข้ (Febrile Neutropenia)[4]
ในปัจจุบันมีการพัฒนาอะมิกาซินให้บรรจุอยู่ในไลโปโซมสำหรับเตรียมเป็นตำรับสำหรับสูตรพ่นเข้าทางจมูก เพื่อรักษาโรคที่เกิดจากการติดเชื้อในระบบทางเดินหายใจ เช่น ซิสติก ไฟโบรซิส,[17] การติดเชื้อ Pseudomonas aeruginosa,[18] การติดเชื้อไมโคแบคทีเรียที่ไม่ใช่วัณโรค,[19] และโรคหลอดลมพอง เป็นต้น ซึ่งยารูปแบบดังกล่าวตอนนี้กำลังอยู่ในขั้นตอนการศึกษาทางคลินิกในระยะสุดท้าย
รูปแบบเภสัชภัณฑ์
[แก้]ปัจจุบัน อะมิกาซินมีในรูปแบบยาฉีดเข้าหลอดเลือดดำและยาฉีดเข้ากล้ามเนื้อ ซึ่งต้องบริหารยาวันละ 1–2 ครั้ง อย่างไรก็ตาม นอกจากนี้ ปัจจุบันจะมีการพัฒนายานี้ให้อยู่ในรูปแบบยาพ่นได้ แต่กำลังอยู่ในขั้นตอนการศึกษาประสิทธิภาพทางคลินิก อะมิกาซินไม่มีในรูปแบบยารับประทาน เนื่องจากยาถูกดูดซึมได้น้อยมากในทางเดินอาหาร ทั้งนี้ การใช้ยาอะมิกาซินในผู้ป่วยที่มีการทำงานของไตลดน้อยลงกว่าปกติ จำเป็นต้องมีการปรับขนาดยาตามค่าการขับครีอะตินีนของร่างกาย (creatinine clearance) ซึ่งโดยทั่วไปจะนิยมใช้วิธีการลดความถี่ในการบริหารยา[11] ในผู้ป่วยที่มีติดเชื้อในระบบประสาทส่วนกลาง เช่น เยื่อหุ้มสมองอักเสบ สามารถบริหารยาอะมิกาซินโดยการฉีดเข้าทางน้ำไขสันหลัง (intrathecal injection) หรือฉีดเข้าทางโพรงสมอง (Intracerebroventricular injection) ได้เลย[4]
กลุ่มประชากรพิเศษ
[แก้]ในผู้ป่วยสูงอายุที่มีความจำเป็นต้องได้รับการรักษาด้วยอะมิกาซิน ควรพิจารณาปรับลดขนาดยาลงจากขนาดปกติ ทั้งนี้เนื่องมาจากการทำงานของไตนั้นจะลดลงตามอายุที่เพิ่มมากขึ้น ส่งผลให้ความเสี่ยงที่จะเกิดอาการข้างเคียงหรือเกิดพิษจากยามีมากขึ้นได้หากใช้ยาในขนาดปกติ เช่นเดียวกับในเด็ก ซึ่งไตยังพัฒนาไม่เต็มที่ ก็ควรที่จะลดขนาดอะมิกาซินลงจากปกติเช่นกัน ในกรณีหญิงตั้งครรภ์นั้น ระดับความเสี่ยงต่อการเกิดพิษต่อทารกในครรภ์ของอะมิกาซินอยู่ในระดับ D ซึ่งหมายความว่า อะมิกาซินอาจทำให้เกิดอันตรายแก่ทารกในครรภ์ได้ จึงควรหลีกเลี่ยงการใช้ยานี้ในหญิงตั้งครรภ์[4] โดยร้อยละ 16 ของขนาดยาอะมิกาซินที่ได้รับการบริหารเข้าสู่ร่างกายจะสามารถผ่านรกเข้าไปสู่ตัวอ่อนในครรภ์ได้ โดยยามีค่าครึ่งชีวิต 2 และ 3.7 ชั่วโมง ในแม่และตัวอ่อนในครรภ์ ตามลำดับ[11] หญิงตั้งครรภ์ที่ได้รับอะมิกาซินร่วมกับยาในกลุ่มอะมิโนไกลโคไซด์ชนิดอื่น อาจทำให้เกิดภาวะหูหนวกแต่กำเนิดของทารกได้ ส่วนกรณีหญิงให้นมบุตรนั้น พบว่า อะมิกาซินถูกขับออกมาทางน้ำนมได้ในเพียงปริมาณเล็กน้อยเท่านั้น[4]
โดยทั่วไปแล้ว ควรหลีกเลี่ยงการใช้อะมิกาซินในเด็กทารก[20] เนื่องจากทารกมีปริมาตรกระจายตัวที่ค่อนข้างสูง ทำให้ที่มีความเข้มข้นของอะมิกาซินในสารน้ำนอกเซลล์ (extracellular fluid) สูงกว่าผู้ใหญ่[3]
สำหรับผู้สูงอายุนั้น พบว่าอะมิกาซินจะมีค่าครึ่งชีวิตที่สูงกว่าปกติ ทั้งเป็นผลเนื่องมาจากการกำจัดออกที่ลดน้อยลงของวัยนี้ โดยเมื่อเปรียบเทียบอัตราการกำจัดอะมิกาซินออกจากร่างกายโดยเฉลี่ยของคนที่มีอายุ 20 ปี กับ 80 ปี จะพบว่ามีความแตกต่างกันอย่างมาก คือ 6 ลิตรต่อชั่วโมง และ 3 ลิตรต่อชั่วโมง ตามลำดับ[21] ในทางตรงกันข้าม ผู้ป่วยซิสติก ไฟโบรซิส กลับมีอัตราการกำจัดอะมิกาซินที่เร็วกว่ากลุ่มประชากรข้างต้นที่กล่าว[22] นอกจากนี้แล้ว การใช้อะมิกาซินในผู้ป่วยที่มีโรคที่เกิดจากความผิดปกติของกล้ามเนื้อเช่น โรคกล้ามเนื้ออ่อนแรงชนิดร้าย หรือโรคพาร์คินสัน อาจทำให้ผู้ป่วยมีอาการทางกล้ามเนื้อที่แย่ลงมากกว่าเดิมได้ เนื่องจากอะมิกาซินมีผลทำให้เกิดภาวะกล้ามเนื้ออ่อนแรงลงได้เช่นกัน[4]
อาการไม่พึงประสงค์
[แก้]อะมิกาซินมีอาการไม่พึงประสงค์ที่คล้ายคลึงกันกับยาอื่นในกลุ่มอะมิโนไกลโคไซด์ โดยอาการไม่พึงประสงค์ที่สำคัญและมีความรุนแรงมากจนต้องได้รับการเฝ้าระวังและติดตามการเกิดอาการดังกล่าวอย่างใกล้ชิดคือ การเกิดพิษต่อไต และการเกิดพิษต่อหู ซึ่งอาจเกิดขึ้นอย่างรุนแรงจนทำให้หูหนวกถาวรได้ โดยอาการไม่พึงประสงค์ดังข้างต้นมีอุบัติการณ์การเกิดประมาณร้อยละ 1–10% ของผู้ที่ได้รับการรักษาด้วยยาใด ๆ ในกลุ่มอะมิโนไกลโคไซด์ทั้งหมด[14] โดยกลไกการเกิดคาดว่าเป็นผลมาจากการที่มียาดังกล่าวสะสมในไตและหูชั้นในมากเกินไป จนทำให้เกิดพยาธิสภาพในอวัยวะดังกล่าว[3]
การใช้ยาอะมิกาซินในขนาดที่สูงหรือใช้ในระยะเวลาที่ยาวนานเกินกว่าที่กำหนดไว้ในแนวทางการรักษาอาจทำให้เกิดพิษต่อระบบประสาท โดยอาการแสดงที่เกิดขึ้นจากความผิดปกติดังกล่าว ได้แก่ อาการรู้สึกหมุน, ชา, รู้สึกเหมือนเข็มทิ่มตามผิวหนัง, กล้ามเนื้อกระตุก, และชัก.[4] หากเกิดพิษต่อเส้นประสาทสมองคู่ที่ 8 (vestibulocochlear nerve) จะทำให้เกิดภาวะพิษต่อหู ซึ่งจะมีอาการแสดงที่สำคัญ คือ สูญเสียการทรงตัว และสูญเสียการได้ยิน[3] ความเสียหายที่เกิดต่อคอเคลียนั้นมีสาเหตุมาจากการที่ยาเหนี่ยวนำให้เกิดการอะพอพโทซิสของเซลล์ขน ทำให้หูสูญเสียความสามารถในการรับรู้เสี่ยงคลื่นความถี่สูงไป และความผิดปกตินี้มักจะเกิดขึ้นก่อนที่จะมีอาการแสดงอื่น ๆ ที่บ่งบอกถึงการสูญเสียการได้ยิน[11][23] ส่วนความเสียหายที่เกิดต่อเวสติบูลนั้น คาดว่าน่าจะมาจากมีอนุมูลอิสระถูกสร้างขึ้นมามากเกินไป ทั้งนี้ ความผิดปกติข้างต้นที่กล่าวนั้นพบว่ามีความสัมพันธ์กับการได้รับการรักษาด้วยยากลุ่มอะมิโนไกลโคไซด์เป็นระยะเวลานานเกินไปมากกว่าการได้รับยาเกินขนาด ดังนั้น การลดระยะเวลาในการใช้ยากลุ่มอะมิโนไกลโคไซด์จึงสามารถช่วยลดความเสี่ยงในการเกิดพิษหรืออาการไม่พึงประสงค์ที่รุนแรงดังข้างต้นได้[24]
อะมิกาซินสามารถก่อให้เกิดพิษต่อไตได้ โดยการสร้างความเสียหายให้เกิดกับหลอดไตฝอยส่วนต้น (proximal tubule) เนื่องจากอะมิกาซินสามารถถูกทำให้เป็นประจุบวกได้ง่าย และอะมิกาซินที่เป็นประจุบวกนี้จะเข้าจับกับส่วนที่เป็นประจุลบของเซลล์เยื่อบุหลอดไตฝอยส่วนต้น และถูกนำเข้าสู่เซลล์กระบวนการพิโนไซโตซิส ทั้งนี้ ความเข้มข้นของอะมิกาซินในเนื้อไตชั้นนอก (renal cortex) นั้นจะมีค่าสูงกว่าความเข้มข้นของยาดังกล่าวในกระแสเลือดสูงถึง 10 เท่า[20] โดยยานี้จะเข้าไปรบกวนการเปลี่ยนแปลงฟอสโฟลิพิดในไลโซโซม ซึ่งจะทำให้เอนไซม์ไลติคชนิดต่าง ๆ ถูกปล่อยจากไลโซโซมเข้าสู่ไซโทพลาซึม จนทำให้เกิดความเสียกับเซลล์นั้นทั้งเซลล์[3] ภาวะการเกิดพิษต่อไตของอะมิกาซินนี้จะทำให้ระดับครีอะตินีนในเลือด, ปริมาณไนโตรเจนในกระแสเลือด, เซลล์เม็ดเลือดแดง, และ เซลล์เม็ดเลือดขาว เพิ่มสูงขึ้น รวมไปถึงทำให้เกิดความผิดปกติเหล่านี้ได้ อาทิ ภาวะที่มีโปรตีนแอลบูมินในปัสสาวะ (albuminuria), ภาวะที่มีน้ำตาลกลูโคสในปัสสาวะ (glycosuria), ความถ่วงจำเพาะของปัสสาวะลดลง, ภาวะร่างกายสร้างปัสสาวะน้อยลง (oliguria) เป็นต้น[11][23] ในบางครั้งอาจเกิดคาสต์ในปัสสาวะ (Urinary cast) ได้เช่นกัน[3] การเปลี่ยนแปลงของการทำงานของหลอดไตฝอย (renal tubular) ทำให้เกิดการเปลี่ยนแปลงของระดับอิเล็กโทรไลต์ และสมดุลกรด–เบสของร่างกาย นำไปสู่การเกิดภาวะที่มีโพแทสเซียมในเลือดต่ำ (hypokalemia) และเลือดเป็นกรด หรือเลือดเป็นด่างได้[24] การเกิดพิษต่อไตจากอะมิกาซินมักจะเกิดขึ้นได้ง่ายในผู้ที่มีภาวะที่มีโพแทสเซียมในเลือดต่ำ, ภาวะที่มีแคลเซียมในเลือดต่ำ, ภาวะที่มีแมกนีเซียมในเลือดต่ำ, เลือดเป็นกรด, อัตราการกรองของไตต่ำ, เบาหวาน, ภาวะที่ร่างกายขาดน้ำ, ไข้, และภาวะพิษเหตุติดเชื้อ อยู่ก่อนหน้าแล้ว รวมไปถึงผู้อยู่ระหว่างการรับประทานยาที่มียับยั้งการสร้างโพรสตาแกลนดินด้วย[3][4][24][20] โดยปกติแล้ว อาการพิษนี้มักหายเป็นปกติหลังจากการสิ้นสุดการรักษาด้วยอะมิกาซิน[3] และสามารถหลีกเลี่ยงการเกิดพิษดังกล่าวได้ด้วยการไม่บริหารยาให้กับผู้ป่วยบ่อยครั้งเกินไป (เช่น บริหารยาให้แค่วันละ 1 ครั้ง หรือทุก 24 ชั่วโมง แทนที่จะใช้การบริหารยาแบบทุก ๆ 8 ชั่วโมง)[20]
นอกจากนี้อะมิกาซินยังสามารถทำให้ภาวะหย่อนของกล้ามเนื้อ (neuromuscular blockade) ได้ รวมไปถึงการทำให้เกิดภาวะกล้ามเนื้ออ่อนแรงเฉียบพลัน (acute muscular paralysis) ซึ่งอาจรุนแรงจนทำให้เกิดการอ่อนแรงของกล้ามเนื้อที่ควบคุมระบบทางเดินหาย จนอาจทำให้เกิดการหยุดหายใจได้ (apnea)[4] ส่วนอาการไม่พึงประสงค์อื่นที่อาจเกิดได้จากการได้รับการรักษาด้วยอะมิกาซิน ได้แก่ ภาวะภูมิไวเกิน, เกิดผื่นบนผิวหนัง, ไข้, ปวดศีรษะ, สั่น, คลื่นไส้และอาเจียน, ภาวะอีโอซิโนฟิลในเลือดสูง, [ปวดในข้อ]], โลหิตจาง, ความดันโลหิตต่ำ, และภาวะที่มีแมกนีเซียมในเลือดต่ำ ซึ่งอาการไม่พึงประสงค์ดังข้างต้นนั้นสามารถเกิดขึ้นได้น้อยกว่าร้อยละ 1 ของผู้ที่ได้รับการรักษาด้วยอะมิกาซิน ส่วนการบริหารยาอะมิกาซินด้วยการฉีดเข้าดวงตานั้น สามารถทำให้เกิดการสูญเสียการมองเห็นอย่างถาวรได้[11][14]
ข้อห้ามใช้และข้อควรระวัง
[แก้]ในกลุ่มที่มีประวัติการแพ้ต่อยากลุ่มอะมิโนไกลโคไซด์ชนิดใด ๆ ควรหลีกเลี่ยงการใช้อะมิกาซินในการรักษา เนื่องจากอาจเกิดปฏิกิริยาการแพ้ยาข้ามชนิดได้ นอกจากนี้ ผู้ที่มีความไวต่อซัลไฟต์มากกว่าปกติ ซึ่งส่วนใหญ่พบในผู้ป่วยโรคหอบหืด ซึ่งก็ควรหลีกเลี่ยงการใช้ยานี้เช่นกัน[11] เนื่องจากในส่วนผสมของเภสัชภัณฑ์ของอะมิกาซินส่วนใหญ่นั้นมักมีส่วนผสมของโซเดียมเมทาไบซัลไฟต์รวมอยู่ด้วย[4]
โดยปกติแล้ว ไม่ควรบริหารยาอะมิกาซิน ร่วมกับ หรือก่อน หรือหลัง ยาอื่นที่ทำให้เกิดพิษต่อไต ระบบประสาท และหู เช่นเดียวกับอะมิกาซิน ซึ่งยาเหล่านั้นได้แก่ ยากลุ่มอะมิโนไกลโคไซด์ทุกชนิด, อะไซโคลเวียร์, แอมโฟเทอริซินบี, แบซิทราซิน, คาพรีโอไมซิน, โคลิสติน, โพลีมิกซิน บี, แวนโคมัยซิน, และซิสพลาติน[4] รวมถึงการห้ามใช้ร่วมกับยาหย่อนกล้ามเนื้อ (Neuromuscular Blocking Agents) เนื่องจากจะทำให้เกิดภาวะกล้ามเนื้ออ่อนแรง และเป็นอัมพาตได้[4]
อันตรกิริยา
[แก้]เป็นที่คาดการณ์กันไว้ว่าอะมิกาซินสามารถถูกทำให้หมดฤทธิ์ได้โดยยาอื่นในกลุ่มแบตาแลคแตม แต่ยาอื่นในกลุ่มนี้กลับไม่ได้รับผลดังกล่าวจากยาในกลุ่มแบตาแลคแตม และยังมีการใช้ร่วมกับเพนิซิลลินอยู่บ่อยครั้ง เพื่อเสริมฤทธิ์ในการต้านเชื้อแบคทีเรีย รวมไปถึงการใช้ร่วมกับคาร์บาพีเนมเพื่อเสริมฤทธิ์ในการต้านเชื้อแบคทีเรียแกรมบวกบางสายพันธุ์ ส่วนเซฟาโลสปอรินซึ่งเป็นอีกกลุ่มย่อยหนึ่งกลุ่มแบตาแลคแตม สามารถเพิ่มความเป็นพิษต่อไตของยากลุ่มอะมิโนไกลโคไซด์ได้ รวมถึงการเพิ่มขึ้นของระดับครีอะตินีนในกระแสเลือดได้ ส่วนยาปฏิชีวนะอื่นอย่างคลอแรมเฟนิคอล, คลินดามัยซิน, และเตตราไซคลีน นั้นจะมีผลทำให้ยากลุ่มอะมิโนไกลโคไซด์หมดฤทธิ์ไป โดยการออกฤทธิ์ต้านกันทางเภสัชวิทยา[4]
ทั้งนี้ ฤทธิ์ของอะมิกาซินจะเพิ่มขึ้นเมื่อใช้ร่วมกับยาที่ได้มากจากชีวพิษโบทูลินัม,[14] ยาชา, ยาหย่อนกล้ามเนื้อ, หรือการได้รับเลือดที่มีส่วนผสมของซิเตรทในขนาดสูง ซึ่งนิยมใช้เป็นสารที่ป้องกันการแข็งตัวของเลือด[4]
นอกจากนี้ ยาขับปัสสาวะที่ออกฤทธิ์ซึ่งโดยปกติก็อาจทำให้เกิดพิษต่อหูได้โดยปกติอยู่แล้ว หากนำมาใช้ร่วมกับอะมิกาซินจะทำให้ระดับความเข้มข้นของอะมิกาซินในเลือดและเนื้อเยื่อเพิ่มสูงขึ้น ทำให้เกิดการเป็นพิษต่อหูมากยิ่งขึ้น[4] นอกจากนั้น ควินิดีนก็เป็นยาอีกชนิดหนึ่งที่สามารถเพิ่มความเข้มข้นของอะมิกาซินในร่างกายได้[14] ยาแก้อักเสบชนิดไม่ใช่สเตอรอยด์บางชนิดอย่าง อินโดเมตทาซิน สามารถเพิ่มความเข้มข้นของยากลุ่มอะมิโนไกลโคไซด์ในกระแสเลือดของทารกที่คลอดก่อนกำหนดได้[4] สารทึบรังสีอย่างอิโอเวอร์ซอล สามารถเพิ่มความเป็นพิษต่อไตและหูของอะมิกาซินได้[14] ในทางตรงกันข้าม อะมิกาซินสามารถลดผลของวัคซีนบางชนิดได้ เช่น วัคซีนบาซิลลัสกาลแม็ต-เกแร็ง (สำหรับวัณโรค), วัคซีนอหิวาตกโรค, และวัคซีนไทฟอยด์ โดยการต้านฤทธิ์กันทางเภสัชวิทยา[14]
เภสัชวิทยา
[แก้]กลไกการออกฤทธิ์
[แก้]
อะมิกาซินออกฤทธิ์จับกับหน่วยย่อย 16 เอสของหน่วยย่อย 30 เอสของไรโบโซมในเซลล์โพรคาริโอตแบบไม่ผันกลับ และยับยั้งการสังเคราะห์โปรตีนโดยการเปลี่ยนแปลงรูปร่างของไรโบโซม ทำให้ไม่สามารถอ่านรหัสพันธุกรรมของเอ็มอาร์เอ็นเอได้อย่างถูกต้องได้[11][25] นอกจากนี้ยังแทรกแซงบริเวณที่มีปฏิกิริยาการจับคู่เบสแบบวอบเบิลของแอนไทโคดอนของ tRNA[26] โดยประสิทธิภาพของอะมิกาซินนั้นขึ้นอยู่กับความเข้มข้น (concentration-dependent antibiotic) และทำงานได้ดีในสภาพที่เป็นด่าง[3]
โดยปกติแล้ว การรักษาโรคที่เกิดจากเชื้อแบคทีเรียที่ไวต่ออะมิกาซินด้วยยานี้จะตอบสนองต่อการรักษาภายใน 24–48 ชั่วโมง[11]
การดื้อยา
[แก้]อะมิกาซินไม่สามารถถูกทำลายได้ด้วยเอนไซม์ที่ทำหน้าที่ยับยั้งการออกฤทธิ์ของยาปฏิชีวนะ (antibiotic-inactivating enzyme) ได้เกือบทุกชนิด ซึ่งเป็นกลไกที่ทำให้แบคทีเรียเกิดการดื้อต่อยาปฏิชีวนะ ยกเว้นเอนไซม์อะมิโนอะซีติลทรานส์เฟอเรส (aminoacetyltransferase) และนิวคลีโอไทด์ทรานส์เฟอเรส (nucleotidyltransferase)[27] ทั้งนี้ เป็นผลมาจากการที่อะมิกาซินมี L-hydroxyaminobuteroyl amide (L-HABA) moiety ที่จับอยู่กับอะตอมไนโตรเจนในตำแหน่งที่ 1 (N-1) ซึ่งตำแหน่งนี้ในกานามัยซินจะเป็นแค่อะตอมไฮโดรเจนธรรมดา ซึ่งส่วนของโมเลกุลส่วนนี้จะช่วยขัดขวางการเข้าทำปฏิกิริยาและลดความสามารถในการเข้าจับของเอนไซม์จากแบคทีเรียที่ทำหน้าที่ทำลายยากลุ่มอะมิโนไกลโคไซด์[27][28][29] ทั้งนี้ อะมิกาซินนั้นมีตำแหน่งในโมเลกุลเพียงตำแหน่งเดียวเท่านั้นที่เอนไซม์จากแบคทีเรียสามารถเข้าทำปฏิกิริยาเพื่อหมดฤทธิ์ได้ ขณะที่เจนตามัยซินและโทบรามัยซินนั้นมีมากถึง 6 ตำแหน่ง[13] ทั้งนี้ เชื้อแบคทีเรียที่ดื้อต่อสเตรปโตมัยซินและคาพรีโอไมซินนั้นจะยังคงมีความไวต่ออะมิกาซินอยู่ ส่วนเชื้อแบคทีเรียที่ดื้อต่อกานามัยซินจะมีบางส่วนที่ยังคงตอบสนองต่ออะมิกาซิน ในทางตรงกันข้าม หากเชื้อใดที่ดื้อต่ออะมิกาซินนั้นมักจะดื้อต่อกานามัยซินและคาพรีโอไมซินด้วยเช่นกัน[30]
การดื้อต่อยาอะมิกาซินและกานามัยซินของไมโคแบคทีเรียซึ่งเป็นเสื้อสาเหตุในวัณโรคนั้น เป็นผลมาจากการกลายพันธุ์ของยีน rrs ซึ่งอยู่บนหน่วยย่อย 16 เอสของไรโบโซม การกลายพันธุ์นี้จะทำให้อะมิกาซินและกานามัยซินมีลดความจำเพาะต่อการจับกับไรโบโซมของแบคทีเรียลดน้อยลง[31] มีเอนไซม์ aminoglycoside acetyltransferase (AAC) และ aminoglycoside adenylyltransferase (AAD) หลากหลายชนิดที่ทำให้เชื้อแบคทีเรียดื้อต่อยาเหล่านี้ อาทิ การดื้อต่อยาของเชื้อ Pseudomonas aeruginosa มีสาเหตุมาจากการสร้างเอนไซม์ AAC (6') -IV ซึ่งส่งผลให้เชื้อแบคทีเรียชนิดนี้ดื้อต่อกานามัยซิน, เจนตามัยซิน, และโทบรามัยซิน, กรณีการดื้อยาในเชื้อ Staphylococcus aureus และ S. epidermidis มาสาเหตุมาจากการสร้างเอนไซม์ AAD (4',4) ส่งผลให้เชื้อแบคทีเรียชนิดนี้ดื้อต่อกานามัยซิน, โทบรามัยซิน, และอาปรามัยซิน[28] และในบางครั้ง S. aureus ก็สมารถทำให้อะมิกาซินหมดฤทธิ์ได้ด้วยการเกิดปฏิกิริยาฟอสโฟรีเลชัน[15]
เภสัชจลนศาสตร์
[แก้]อะมิกาซินไม่สามารถดูดซึมได้จากทางเดินอาหาร ดังนั้นการบริหารยาจึงจำเป็นต้องใช้วิธีการฉีด โดยหลังการบริหารยาโดยการฉีดเข้ากล้ามเนื้อ ระดับความเข้มข้นของยาในกระแสเลือดจะขึ้นถึงระดับสูงสุดใน 0.5–2 ชั่วโมง โดยร้อยละ 11 ของตัวยาทั้งหมดจะเข้าจับกับโปรตีนในกระแสเลือด ส่วนยาที่เหลือจะกระจายไปยังหัวใจ, ถุงน้ำดี, ปอด, และกระดูก รวมไปถึงในน้ำดี, เสมหะ, ของเหลวระหว่างเซลล์, ของเหลวในช่องเยื่อหุ้มปอด, และน้ำไขข้อ ส่วนในน้ำหล่อสมองไขสันหลังพบว่ามีความเข้มข้นของยานี้น้อยมาก (แต่ในกรณีการฉีดเข้าโพรงสมองจะมีความเข้มข้นสูง)[4] ในทารก พบว่าความเข้มข้นของอะมิกาซินในน้ำหล่อสมองไขสันหลังจะมีค่าประมาณร้อยละ 10–20 ของความเข้มข้นในกระแสเลือด ในแต่กรณีที่มีภาวะเยื่อหุ้มสมองอักเสบร่วมด้วย ความเข้มข้นของยานี้ในน้ำหล่อสมองไขสันหลังอาจสูงถึงร้อยละ 50 ของความเข้มข้นในกระแสเลือด,[11] ทั้งนี้ อะมิกาซินนั้นแพร่ผ่านตัวกรองกั้นระหว่างเลือดและสมอง (blood-brain barrier) และผ่านเข้าสู่เนื้อเยื่อของดวงตาได้น้อยมาก[3]
ส่วนการขับยาออกจากร่างกายนั้น พบว่าอะมิกาซินมีค่าครึ่งชีวิตประมาณ 2 ชั่วโมงในคนปกติ และประมาณ 50 ชั่วโมงในผู้ที่เป็นโรคไตเรื้อรังระยะสุดท้าย[13] โดยร้อยละ 95 ของยานี้ที่ให้ในรูปแบบการฉีดเข้าหลอดเลือดดำและการฉีดเข้ากล้ามเนื้อจะถูกขับออกในรูปที่ไม่เปลี่ยนแปลงผ่านการกรองของไต แล้วออกมากับปัสสาวะภายใน 24 ชั่วโมง[4][13] ปัจจัยที่ทำให้อะมิกาซินถูกขับออกมาทางปัสสาวะ ได้แก่ การมีมวลโมเลกุลขนาดเล็ก, ละลายน้ำได้ดี, และอยู่ในสถานะที่ไม่ถูกเปลี่ยนรูป.[20]
เภสัชเคมี
[แก้]อะมิกาซินสามารถสังเคราะห์ได้จากกานามัยซิย เอ ดังแสดงในแผนภาพ:[32][33]

การใช้ในการปศุสัตว์
[แก้]อะมิกาซินเป็นยาปฏิชีวนะเพียงชนิดเดียวในกลุ่มอะมิโนไกลโคไซด์ที่ได้รับการรับรองจากองค์การและยาของสหรัฐอเมริกาให้ใช้ในสุนัขและการติดเชื้อแบคทีเรียในมดลูกของม้า ทำให้อะมิกาซินเป็นยาปฏิชีวนะที่นิยมใช้กันเป็นอย่างมากในการสัตวแพทย์[34] นอกจากนี้ยังมีการใช้ยานี้ในแมว, หนูตะเภา, ชินชิล่า, แฮมสเตอร์, หนูแรท, หนูไมซ์, แพรรีด็อก, วัว, นก, งู, เต่าและเต่าบก, สัตว์ในอันดับจระเข้, กบอเมริกันบูลฟร็อก, และปลา[3][35][36] นอกจากนี้ยังมีการใช้อะมิกาซินในการรักษาการติดเชื้อแบคทีเรียในทางเดินหายใจของงู, bacterial shell disease ในเต่า, และโพรงอากาศอักเสบในมาคอว์ แต่ห้ามใช้ในกระต่ายและกระต่ายแจ็ก เนื่องจากจะทำให้เกิดความผิดปกติของเชื้อจุลินทรีย์ประจำถิ่นในลำไส้ของสัตว์เหล่านี้[3]
สำหรับสุนัขและแมวนั้น มีการใช้อะมิกาซินในรูปแบบยาใช้ภายนอกสำหรับการติดเชื้อแบคทีเรียบริเวณหูและกระจกตาเป็นแผลกันอย่างแพร่หลาย โดยเฉพาะอย่างยิ่ง หากความเจ็บป่วยเหล่านั้นมีสาเหตุมาจากการติดเชื้อ Pseudomonas aeruginosa โดยจำเป็นต้องมีการทำความสะอาดบริเวณหูก่อนที่จะมีการบริหารยา เนื่องจากหนองและเศษซากของเซลล์ที่ตายแล้วนั้นจะทำให้ได้รับผลการรักษาจากอะมิกาซินน้อยลง[34] ในกรณีการติดเชื้อแบคทีเรียที่ตาของสัตว์เหล่านี้นั้น จะใช้อะมิกาซินในรูปแบบยาขี้ผึ้ง หรือยาหยอด หรือการฉีดเข้าใต้เยื่อบุตา (Subconjunctival injection)[37] ทั้งนี้ การใช้อะมิกาซินสำหรับดวงตานั้นสามารถทดแทนได้ด้วยเซฟาโซลิน เนื่องจากอะมิกาซิน (รวมถึงยาอื่นในกลุ่มอะมิโนไกลโคไซด์) นั้นเป็นพิษต่ออวัยวะในดวงตา[38]
การใช้อะมิกาซินในม้านั้น องค์การอาหารและยาของสหรัฐอเมริกาได้รับรองให้ใช้ยานี้สำหรับการติดเชื้อแบคทีเรียในมดลูก (เช่น โรคเยื่อบุโพรงมดลูกเจริญผิดที่ และมดลูกอักเสบ) ในกรณีที่เชื้อสาเหตุยังมีความไวต่อยานี้เท่านั้น[39] นอกจากนี้ยังมีการใช้ยานี้ในรูปแบบยาใช้ภายนอกหรือยาใช้เฉพาะที่สำหรับการติดเชื้อแบคทีเรียที่ดวงตาและการส่องกล้องล้างข้อ (arthroscopic lavage) และอาจมีการใช้ร่วมกับยากลุ่มเซฟาโลสปอรินในการรักษาการติดเชื้อที่ผิวหนังที่มีสาเหตุมาจากเชื้อแบคทีเรียสกุลสแตฟฟิโลคอคคัส ในกรณีการติดเชื้อที่แขน–ขา หรือข้อ มักมีการใช้อะมิกาซินร่วมกับยากลุ่มเซฟาโลสปอรินในรูปแบบการฉีดเข้าบริเวณที่มีการติดเชื้อโดยตรง[34][40] นอกจากนี้แล้ว ยังมีการใช้อะมิกาซินฉีดเข้าสู่ข้อพร้อมกับยาต้านการอักเสบของข้อที่มีชื่อว่า พอลีซัลเฟต ไกลโคซามิโนไกลแคน (Polysulfated glycosaminoglycan – ชื่อการค้า คือ Adequan) เพื่อเป็นการป้องกันการติดเชื้อแบคทีเรียแทรกซ้อน[41]
อาการไม่พึงประสงค์จากอะมิกาซินที่อาจเกิดขึ้นได้กับสัตว์ ได้แก่ การเกิดพิษต่อไต, การเกิดพิษต่อหู, และเกิดปฏิกิริยาการแพ้บริเวณที่ฉีด เป็นต้น โดยในแมวจะมีความเสี่ยงต่อการเกิดพิษต่อระบบการทรงตัวเป็นอย่างมาก อาการไม่พึงประสงค์อื่นที่อาจเกิดขึ้นได้บ้าง ได้แก่ กล้ามเนื้ออ่อนแรง, ภาวะบวมน้ำที่หน้า, และปลายประสาทอักเสบ[3][34] ทั้งนี้ ค่าครึ่งชีวิตของอะมิกาซินในสัตว์นั้นมีค่าประมาณ 1–2 ชั่วโมง[42]
การรักษาในกรณีที่ได้รับยานี้เกินขนาดสามารถทำได้โดยการชำระเลือดผ่านเยื่อ หรือการชำระทางช่องท้อง ซึ่งจะช่วยลดระดับความเข้มข้นของอะมิกาซิน และ/หรือเพนิซิลลิน ซึ่งเพนิซิลลินบางส่วนจะจับกับอะมิกาซินเป็นสารประกอบเชิงซ้อนและทำให้อะมิกาซินไม่สามารถออกฤทธิ์ได้[3]
อ้างอิง
[แก้]- ↑ 1.0 1.1 "Amikacin Use During Pregnancy". Drugs.com. 2 December 2019. สืบค้นเมื่อ 13 March 2020.
- ↑ "Amikacin 250 mg/ml Injection - Summary of Product Characteristics (SmPC)". (emc). 16 September 2015. สืบค้นเมื่อ 13 March 2020.
- ↑ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 3.13 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อplumb - ↑ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.18 4.19 4.20 4.21 4.22 4.23 4.24 4.25 4.26 "Amikacin Sulfate". The American Society of Health-System Pharmacists. เก็บจากแหล่งเดิมเมื่อ 20 ธันวาคม 2016. สืบค้นเมื่อ 8 ธันวาคม 2016.
- ↑ World Health Organization (2009). Stuart MC, Kouimtzi M, Hill SR (บ.ก.). WHO Model Formulary 2008. World Health Organization. p. 137. hdl:10665/44053. ISBN 978-92-4-154765-9.
- ↑ Fischer, Janos; Ganellin, C. Robin (2006). Analogue-based Drug Discovery. John Wiley & Sons. p. 507. ISBN 978-3-527-60749-5. เก็บจากแหล่งเดิมเมื่อ 20 ธันวาคม 2016.
- ↑ Oxford Handbook of Infectious Diseases and Microbiology. OUP Oxford. 2009. p. 56. ISBN 978-0-19-103962-1. เก็บจากแหล่งเดิมเมื่อ 24 พฤศจิกายน 2015.
- ↑ "WHO Model List of Essential Medicines (19th List)" (PDF). World Health Organization. เมษายน 2015. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 13 ธันวาคม 2016. สืบค้นเมื่อ 8 ธันวาคม 2016.
- ↑ "Amikacin Sulfate". International Drug Price Indicator Guide (ภาษาอังกฤษ). คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 26 กันยายน 2022. สืบค้นเมื่อ 8 ธันวาคม 2016.
- ↑ Hamilton, Richart (2015). Tarascon Pocket Pharmacopoeia 2015 Deluxe Lab-Coat Edition. Jones & Bartlett Learning. p. 35. ISBN 978-1-284-05756-0.
- ↑ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 11.11 11.12 US National Library of Medicine (17 สิงหาคม 2016). "AMIKACIN SULFATE- amikacin sulfate injection". DailyMed. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017. สืบค้นเมื่อ 8 สิงหาคม 2017.
- ↑ Scholar, Eric M.; Pratt, William B. (22 พฤษภาคม 2000). The Antimicrobial Drugs (2nd ed.). Oxford University Press, USA. pp. 15–19. ISBN 978-0-19-975971-2. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ 13.0 13.1 13.2 13.3 Cunha, Burke A. (1 พฤศจิกายน 2006). "New Uses for Older Antibiotics: Nitrofurantoin, Amikacin, Colistin, Polymyxin B, Doxycycline, and Minocycline Revisited". Medical Clinics of North America. Antimicrobial Therapy. 90 (6): 1089–1107. doi:10.1016/j.mcna.2006.07.006. ISSN 0025-7125.
- ↑ 14.0 14.1 14.2 14.3 14.4 14.5 14.6 "amikacin (Rx)". Medscape. WebMD. เก็บจากแหล่งเดิมเมื่อ 9 สิงหาคม 2017. สืบค้นเมื่อ 9 สิงหาคม 2017.
- ↑ 15.0 15.1 Aronson J. K., บ.ก. (2016). "Amikacin". Meyler's Side Effects of Drugs (16th ed.). Oxford: Elsevier. pp. 207–209. ISBN 978-0-444-53716-4.
- ↑ Vardanyan, Ruben; Hruby, Victor (2016). "Chapter 32: Antimicobacterial Drugs". Synthesis of Best-Seller Drugs. Boston: Academic Press. pp. 669–675. ISBN 978-0-12-411492-0.
- ↑ "Randomized, open-label, active-controlled, multicenter study to assess the efficacy, safety and tolerability of Arikace™ in Cystic Fibrosis patients with chronic infection due to Pseudomonas aeruginosa". EU Clinical Trials Register. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 3 มีนาคม 2016.
- ↑ "Study to Evaluate Arikayce™ in CF Patients With Chronic Pseudomonas Aeruginosa Infections". ClinicalTrials.gov. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017.
- ↑ "Arikayce for Nontuberculous Mycobacteria". ClinicalTrials.gov. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017.
- ↑ 20.0 20.1 20.2 20.3 20.4 Ettinger, Stephen J.; Feldman, Edward C. (24 ธันวาคม 2009). Textbook of Veterinary Internal Medicine. Elsevier Health Sciences. pp. 1976, 523. ISBN 978-1-4377-0282-8. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ Maire, P.; Bourguignon, L.; Goutelle, S.; Ducher, M.; Jelliffe, R. (2017). "Chapter 20 - Individualizing Drug Therapy in the Elderly". Individualized Drug Therapy for Patients. Boston: Academic Press. pp. 373–382. ISBN 978-0-12-803348-7.
- ↑ Eghianruwa, Kingsley (2014). Essential Drug Data for Rational Therapy in Veterinary Practice. Author House. p. 16. ISBN 978-1-4918-0000-3. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ 23.0 23.1 Morris, Daniel O.; Kennis, Robert A. (11 ตุลาคม 2012). Clinical Dermatology, An Issue of Veterinary Clinics: Small Animal Practice, E-Book. Elsevier Health Sciences. p. 29. ISBN 978-1-4557-7377-0. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ 24.0 24.1 24.2 Corti, Natascia; Taegtmeyer, Anne; Imhof, Alexander (1 มกราคม 2011). "Miscellaneous antibacterial drugs". Side Effects of Drugs Annual. A worldwide yearly survey of new data in adverse drug reactions. 33: 509–540. doi:10.1016/B978-0-444-53741-6.00026-X. ISBN 978-0-444-53741-6. ISSN 0378-6080.
- ↑ Bauman, Robert W. (2015). Microbiology: with diseases by body system (4th ed.). Boston: Pearson. ISBN 978-0-321-91855-0.
- ↑ "Amikacin". DrugBank. 2 สิงหาคม 2017. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017. สืบค้นเมื่อ 10 สิงหาคม 2017.
- ↑ 27.0 27.1 Mudd, Efrain (7 สิงหาคม 2017). "O Aminoglycosides". Pharmacological Sciences. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017. สืบค้นเมื่อ 14 สิงหาคม 2017.
- ↑ 28.0 28.1 Kondo, Shinichi; Hotta, Kunimoto (1 มกราคม 1999). "Semisynthetic aminoglycoside antibiotics: Development and enzymatic modifications". Journal of Infection and Chemotherapy. 5 (1): 1–9. doi:10.1007/s101560050001. ISSN 1341-321X. PMID 11810483.
- ↑ Park, Je Won; Ban, Yeon Hee; Nam, Sang-Jip; Cha, Sun-Shin; Yoon, Yeo Joon (1 ธันวาคม 2017). "Biosynthetic pathways of aminoglycosides and their engineering". Current Opinion in Biotechnology. Chemical biotechnology: Pharmaceutical biotechnology. 48: 33–41. doi:10.1016/j.copbio.2017.03.019. ISSN 0958-1669. PMID 28365471.
- ↑ Caminero, José A; Sotgiu, Giovanni; Zumla, Alimuddin; Migliori, Giovanni Battista (1 กันยายน 2010). "Best drug treatment for multidrug-resistant and extensively drug-resistant tuberculosis". The Lancet Infectious Diseases. 10 (9): 621–629. doi:10.1016/S1473-3099(10)70139-0. ISSN 1473-3099. PMID 20797644.
- ↑ Ahmad, Suhail; Mokaddas, Eiman (1 มีนาคม 2014). "Current status and future trends in the diagnosis and treatment of drug-susceptible and multidrug-resistant tuberculosis". Journal of Infection and Public Health. 7 (2): 75–91. doi:10.1016/j.jiph.2013.09.001. ISSN 1876-0341. PMID 24216518.
- ↑ Kawaguchi, H.; Naito, T.; Nakagawa, S.; Fujisawa, K. I. (ธันวาคม 1972). "BB-K 8, a new semisynthetic aminoglycoside antibiotic". The Journal of Antibiotics. 25 (12): 695–708. doi:10.7164/antibiotics.25.695. ISSN 0021-8820. PMID 4568692. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017.
- ↑ Monteleone, Peter M.; Muhammad, Naseem; Brown, Robert D.; McGrory, John P.; Hanna, Samir A. (1 มกราคม 1983). Amikacin Sulfate. Analytical Profiles of Drug Substances. Vol. 12. pp. 37–71. doi:10.1016/S0099-5428(08)60163-X. ISBN 978-0-12-260812-4. ISSN 0099-5428.
- ↑ 34.0 34.1 34.2 34.3 Forney, Barbara. "Amikacin for Veterinary Use". Wedgewood Pharmacy. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017. สืบค้นเมื่อ 9 สิงหาคม 2017.
- ↑ Riviere, Jim E.; Papich, Mark G. (13 พฤษภาคม 2013). Veterinary Pharmacology and Therapeutics. John Wiley & Sons. p. 931. ISBN 978-1-118-68590-7. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ Mader, Douglas R.; Divers, Stephen J. (12 ธันวาคม 2013). Current Therapy in Reptile Medicine and Surgery - E-Book. Elsevier Health Sciences. p. 382. ISBN 978-0-323-24293-6. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ Maggs, David; Miller, Paul; Ofri, Ron (7 สิงหาคม 2013). Slatter's Fundamentals of Veterinary Ophthalmology - E-Book. Elsevier Health Sciences. p. 37. ISBN 978-0-323-24196-0. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
- ↑ Hsu, Walter H. (25 เมษายน 2013). Handbook of Veterinary Pharmacology. John Wiley & Sons. p. 486. ISBN 978-1-118-71416-4.
- ↑ US National Library of Medicine (9 มีนาคม 2017). "Amiglyde-V- amikacin sulfate injection". DailyMed. เก็บจากแหล่งเดิมเมื่อ 16 สิงหาคม 2017. สืบค้นเมื่อ 8 สิงหาคม 2017.
- ↑ Orsini, James A. (1 สิงหาคม 2017). "Update on Managing Serious Wound Infections in Horses: Wounds Involving Joints and Other Synovial Structures". Journal of Equine Veterinary Science. 55: 115–122. doi:10.1016/j.jevs.2017.01.016. ISSN 0737-0806.
- ↑ Wanamaker, Boyce P.; Massey, Kathy (25 มีนาคม 2014). Applied Pharmacology for Veterinary Technicians - E-Book. Elsevier Health Sciences. p. 392. ISBN 978-0-323-29170-5.
- ↑ Papich, Mark G. (ตุลาคม 2015). "Amikacin". Saunders Handbook of Veterinary Drugs: Small and Large Animal (4th ed.). Elsevier Health Sciences. pp. 25–27. ISBN 978-0-323-24485-5. เก็บจากแหล่งเดิมเมื่อ 10 กันยายน 2017.
แหล่งข้อมูลอื่น
[แก้]- "Amikacin". Drug Information Portal. หอสมุดแห่งชาติการแพทย์สหรัฐ.
- "Amikacin sulfate". Drug Information Portal. หอสมุดแห่งชาติการแพทย์สหรัฐ.
