วิตามินบี12
 | |
| ข้อมูลทางคลินิก | |
|---|---|
| AHFS/Drugs.com | Vitamin B12 |
| ช่องทางการรับยา | ทางปาก ทางเส้นเลือด ฉีดในกล้ามเนื้อ ทางจมูก |
| รหัส ATC | |
| กฏหมาย | |
| สถานะตามกฏหมาย | |
| ข้อมูลเภสัชจลนศาสตร์ | |
| ชีวประสิทธิผล | ดูดซึมที่ลำไส้เล็กส่วนปลาย |
| การจับกับโปรตีน | มีสัมพรรคภาพสูงกับโปรตีน transcobalamins ในเลือด สัมพรรคภาพสำหรับ hydroxocobalamin จะสูงกว่า cyanocobalamin |
| การเปลี่ยนแปลงยา | ตับ |
| ครึ่งชีวิตทางชีวภาพ | ประมาณ 6 วัน (400 วันในตับ) |
| การขับออก | ไต |
| ตัวบ่งชี้ | |
| |
| เลขทะเบียน CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| KEGG | |
| ChEMBL | |
| ข้อมูลทางกายภาพและเคมี | |
| สูตร | C63H88CoN14O14P |
| มวลต่อโมล | 1,355.37 g/mol g·mol−1 |
| แบบจำลอง 3D (JSmol) | |
| |
| |
| | |

วิตามินบี12 (อังกฤษ: vitamin B12, cobalamin) เป็นวิตามินละลายน้ำได้ที่เป็นกุญแจสำคัญในการทำงานเป็นปกติของสมองกับระบบประสาท และการสร้างเม็ดเลือดแดง เป็นรูปแบบหนึ่งของวิตามินบี 8 อย่าง ที่เกี่ยวข้องกับกระบวนการเมแทบอลิซึมในเซลล์ทุกเซลล์ในร่างกายมนุษย์ โดยมีผลเฉพาะต่อการสังเคราะห์ดีเอ็นเอ เมแทบอลิซึมของกรดไขมันและกรดอะมิโน[1] ไม่มีเห็ดรา พืช หรือสัตว์ (รวมทั้งมนุษย์) ที่สามารถสร้างวิตามินบี12ได้ มีแต่สิ่งมีชีวิตประเภทแบคทีเรียและอาร์เคียที่มีเอนไซม์เพื่อสังเคราะห์มันได้ แหล่งของวิตามินที่ได้พิสูจน์แล้วเป็นผลิตภัณฑ์สัตว์รวมทั้งเนื้อ ปลา ผลิตภัณฑ์นม และอาหารเสริม แต่ก็มีงานวิจัยที่แสดงว่า ผลิตภัณฑ์ที่ไม่ใช่มาจากสัตว์บางอย่างอาจเป็นแหล่งธรรมชาติของวิตามินได้ เพราะอยู่ร่วมกับแบคทีเรีย (bacterial symbiosis) วิตามินบี12 เป็นวิตามินที่ใหญ่ที่สุด มีโครงสร้างซับซ้อนที่สุด และสามารถสังเคราะห์โดยหมักแบคทีเรีย (bacterial fermentation-synthesis) แล้วใช้เสริมอาหารและเป็นวิตามินเสริม
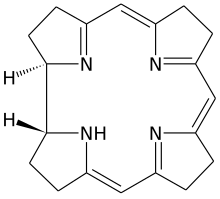
วิตามินบี12 เป็นกลุ่มสารประกอบที่มีโครงสร้างเคมีเกี่ยวข้องกัน (หรือที่เรียกว่า vitamer) ซึ่งมีฤทธิ์ทางชีวภาพ และมีธาตุโคบอลต์ (Co) ที่ไม่สามัญทางเคมี-ชีวภาพ อยู่ตรงกลางวงแหวนเชิงระนาบแบบ tetra-pyrrole ที่เรียกว่าวงแหวน corrin (ดูรูป) ซึ่งสามารถผลิตได้โดยแบคทีเรีย hydroxocobalamin แต่ร่างกายสามารถแปรรูปแบบวิตามินไปในแบบต่าง ๆ ได้ วิตามินค้นพบโดยความสัมพันธ์ของมันกับโรคภาวะเลือดจางเหตุขาดวิตามินบี12 (pernicious anemia) ซึ่งเป็นโรคภูมิต้านตนเอง และมีผลทำลายเซลล์ผนัง (parietal cell) ที่มีหน้าที่หลั่งไกลโคโปรตีน คือ intrinsic factor ในกระเพาะอาหาร เซลล์เหล่านี้ยังมีหน้าที่หลั่งกรดย่อยอาหารในกระเพาะอีกด้วย เพราะว่า intrinsic factor จำเป็นต่อการดูดซึมวิตามินตามปกติ การขาดโปรตีนนี้เพราะโรค จึงทำให้ขาดวิตามินบี12 ยังมีรูปแบบการขาดวิตามินแบบเบากว่าอื่น ๆ ที่ผลติดตามทางชีวเคมีก็ปรากฏชัดแล้ว[2]
การแพทย์
[แก้]วิตามินบี12 ใช้รักษาการขาดวิตามินบี12 ไซยาไนด์เป็นพิษ และการขาดวิตามินบี12โดยกรรมพันธุ์ (hereditary deficiency of transcobalamin II)[3] เป็นวิตามินที่ให้โดยเป็นส่วนของการวินิจฉัยภาวะเลือดจางเหตุขาดวิตามินบี12 (pernicious anemia) โดย Schilling test[3]
สำหรับไซยาไนด์เป็นพิษ แพทย์จะให้ hydroxocobalamin ทางเส้นเลือดดำและบางครั้งพร้อมกับ sodium thiosulfate ซึ่งใช้เป็นยาแก้พิษไซยาไนต์อีกอย่างหนึ่ง[4] กลไกออกฤทธิ์ตรงไปตรงมา คือ ลิแกนด์ไฮดรอกไซด์ของ hydroxycobalamin จะแทนที่ด้วยไอออนไซยาไนด์ที่เป็นพิษ รวมกันกลายเป็นรูปแบบวิตามินบี12 ที่ไม่มีโทษและสามารถขับออกทางปัสสาวะ ในประเทศสหรัฐอเมริกา องค์การอาหารและยาปี 2549 อนุมัติให้ใช้ hydroxocobalamin เพื่อรักษาพิษของไซยาไนด์แบบฉับพลัน[5]
ประมาณบริโภคอ้างอิง (DRI)
[แก้]ในปี 2541 คณะกรรมการอาหารและโภชนาการของสถาบันการแพทย์สหรัฐอเมริกาได้อั๊ปเดตค่าประเมินความจำเป็นโดยเฉลี่ย (Estimated Average Requirements, EARs) และค่าเผื่อทางอาหารต่อวัน (Dietary Allowances, RDAs) สำหรับวิตามินบี12 เป็น
- สำหรับหญิงชายอายุ 14 ปีขึ้น EAR อยู่ที่ 2.0 μg/วัน RDA อยู่ที่ 2.4 μg/วัน โดย RDA สูงกว่า EAR เผื่อคนที่ต้องได้มากกว่าโดยเฉลี่ย
- สำหรับหญิงตั้งครรภ์ RDA อยู่ที่ 2.6 μg/วัน
- สำหรับหญิงให้นม RDA อยู่ที่ 2.8 μg/วัน
- สำหรับทารกจนถึง 12 เดือน ค่าปริมาณบริโภคพอ (Adequate Intake, AI) อยู่ที่ 0.4–0.5 μg/วัน
- สำหรับเด็กอายุระหว่าง 1–13 ปี RDA จะเพิ่มตามอายุจาก 0.9–1.8 μg/วัน
- สำหรับบุคคลอายุมากกว่า 50 ปี เพราะว่าประมาณ 10-30% จะไม่สามารถดูดซึมวิตามินบี12 ได้จากอาหารธรรมชาติ จึงแนะนำให้ได้ปริมาณตาม RDA โดยทานอาหารที่เสริมวิตามินบี12 หรือทานวิตามินเสริม
เพื่อความปลอดภัย คณะกรรมการยังตั้งระดับบริโภคทนได้สูงสุด (Tolerable Upper Intake Levels, ULs) สำหรับวิตามินและแร่ธาตุด้วยเมื่อมีหลักฐานเพียงพอ ในกรณีวิตามินบี12 ไม่มีระดับสูงสุดเพราะยังไม่มีข้อมูลในมนุษย์ว่ามีผลลบเมื่อทานมาก และองค์การความปลอดภัยอาหารยุโรป (European Food Safety Authority) ก็ทบทวนเรื่องเดียวกันแล้วสรุปว่า ไม่มีหลักฐานเพื่อตั้งค่าสูงสุดสำหรับวิตามินบี12[6]
ค่า EARs, RDAs, และ ULs เหล่านี้รวม ๆ กันเรียกว่า ปริมาณบริโภคอ้างอิง (Dietary Reference Intake)[7]
ส่วนป้ายอาหารและวิตามินเสริมในสหรัฐจะแสดงค่าเป็นเปอร์เซ็นต์ที่ควรได้ต่อวัน (percent of Daily Value, %DV) สำหรับวิตามินบี12 100% ของ %DV เคยอยู่ที่ 6.0 μg แต่ตั้งแต่เดือนพฤษภาคม 2559 ได้ลดลงเหลือ 2.4 μg
แหล่งจากสาหร่ายที่สร้างความขัดแย้ง
[แก้]องค์กรต่าง ๆ (รวมทั้ง UK Vegan Society, Vegetarian Resource, และ Physicians Committee for Responsible Medicine) แนะนำผู้ทานอาหารเจแบบวีแกนให้ทานอาหารเสริมวิตามินบี12 อย่างสม่ำเสมอ หรือทานวิตามินเสริมเพื่อได้วิตามินตามที่แนะนำ[8][9][10]
สำหรับผู้ที่ทานอาหารแบบวีแกนที่มีวิตามินบี12 น้อยมาก และบุคคลอื่นที่ต้องการวิตามินจากอาหารนอกจากผลิตภัณฑ์สัตว์ การทานอาหารที่ไม่มีวิตามินเทียม (pseudovitamin-B12) แต่มีวิตามินแบบมีฤทธิ์ทางชีวภาพเป็นเรื่องสำคัญ โดยวิตามินบี12 เทียมหมายถึงสารประกอบที่คล้ายกับวิตามิน แต่ไม่มีฤทธิ์ทางชีวภาพ และก็พบพร้อมกับวิตามินที่มีฤทธิ์ ทั้งในตัวมนุษย์เอง[11] ในอาหารหลายอย่าง (แม้แต่ผลิตภัณฑ์สัตว์[12]) และอาจจากวิตามินเสริมและอาหารที่เสริมวิตามิน[13] ในไซยาโนแบคทีเรียรวมทั้งสาหร่ายเกลียวทอง สาหร่ายอื่น ๆ และสาหร่ายญี่ปุ่น (Porphyra tenera หรือ Asakusa-nori) จะพบวิตามินเทียมเช่นนี้โดยมาก[14]
ยังไม่มีการทดลองในมนุษย์โดยมีขนาดตัวอย่างพอเพื่อเป็นหลักฐานของฤทธิ์เอนไซม์ของวิตามินบี12 ที่มาจากแหล่งอื่นนอกจากแบคทีเรีย เช่น สาหร่ายในสกุล Chlorella และสาหร่ายทะเลที่ทานได้อื่น ๆ แม้ว่า ทางเคมีแล้ว แหล่งเหล่านี้จะรายงานว่ามีรูปแบบวิตามินที่มีโครงสร้างทางเคมีคล้าย ๆ กับวิตามินที่มีฤทธิ์[15]
การขาดวิตามินบี12
[แก้]การขาดวิตามินบี12 อาจทำให้เสียหายอย่างรุนแรงโดยฟื้นคืนไม่ได้ โดยเฉพาะต่อสมองและระบบประสาท[16] ในระดับที่ต่ำกว่าปกติเพียงเล็กน้อย อาจมีอาการเช่นความล้า อารมณ์ซึมเศร้า และความจำไม่ดี[2] การขาดวิตามินอาจเป็นเหตุของอาการฟุ้งพล่าน (mania) หรืออาการโรคจิต (psychosis)[17][18]
การขาดวิตามินบี12 เกิดจากการทานไม่พออย่างสามัญที่สุด แต่ว่าอาจเกิดจากการดูดซึมได้ไม่ดี โรคทางลำไส้บางอย่าง การมีโปรตีนยึดเหนี่ยว (binding protein) น้อย หรือเมื่อใช้ยาบางประเภท วิตามินมีน้อยมากในพืช และดังนั้น คนที่ทานเจมีโอกาสขาดวิตามินสูงสุด ทารกจะเสี่ยงขาดวิตามินสูงกว่าถ้าแม่ทานเจ ผู้สูงอายุที่จำกัดการทานผลิตภัณฑ์สัตว์เป็นกลุ่มที่เสี่ยงอีกกลุ่มหนึ่ง[19]
การขาดวิตามินบี12 สามารถปรากฏเป็นภาวะเลือดจาง ในบางกรณี การขาดวิตามินอาจทำให้เสียหายอย่างถาวร มีงานศึกษาเมื่อไม่นานที่สัมพันธ์ความซึมเศร้ากับการขาดวิตามินบี12
การมีวิตามินบี12 ในระดับที่เพียงพอ ยังสัมพันธ์อย่างอิสระกับการลดความเสี่ยงต่อโรคซึมเศร้าและกับการรู้คิดที่ดีกว่าแม้เมื่อควบคุมตัวแปรกวนแล้ว[20] วิตามินเป็นซับสเตรตของปฏิกิริยาในเซลล์หลายอย่าง รวมทั้งการสังเคราะห์กรดนิวคลีอิกและสารสื่อประสาทที่อาศัยกระบวนการ methylation และการสังเคราะห์สารสื่อประสาททั้ง 3 อย่าง (รวมทั้งเซโรโทนิน นอร์เอพิเนฟริน และโดพามีน) สามารถช่วยเพิ่มผลของยาแก้ซึมเศร้าที่ใช้โดยปกติ[21]
ระดับวิตามินภายในเซลล์สามารถอนุมานได้จากความเข้มข้นของ homocysteine ในเลือด ซึ่งจะเปลี่ยนเป็น methionine ผ่านปฏิกิริยาทางเอนไซม์ที่ใช้ 5-methyltetrahydrofolate เป็นตัวให้ methyl ดังนั้น ระดับ homocysteine ในลือดจะลดลงเมื่อระดับวิตามินบี12 ในเซลล์สูงขึ้น นอกจากนั้นแล้ว เพราะว่าเมแทบอไลต์ที่ออกฤทธิ์ของวิตามินจำเป็นในกระบวนการ methylation ของ homocysteine เพื่อผลิต methionine ซึ่งเป็นกรดอะมิโนที่มีบทบาทในกระบวนการทางเคมี-ชีวภาพของการสร้างและสลายสารสื่อประสาทประเภทโมโนอะมีน ดังนั้น การขาดวิตามินจึงอาจมีผลต่อการผลิตและการทำงานของสารสื่อประสาทเหล่านั้น[22] นอกจากโฮโมซิสเทอีน (homocysteine) แล้ว กรดเมทิลมาโลนิกในปัสสาวะหรือในพลาสมาก็เป็นตัวบ่งชี้ระดับวิตามินบี 12 ที่สำคัญอีกตัว ซึ่งจะเพิ่มขึ้นเมื่อขาดวิตามินบี 12[23] อย่างไรก็ตาม ระดับของกรดเมทิลมาโลนิกที่เพิ่มขึ้นอาจบ่งบอกถึงความผิดปกติของระบบเมตาบอลิซึมที่มักถูกมองข้ามก็อาจเป็นได้[24] นั่นคือภาวะกรดมาโลนิกและกรดเมทิลมาโลนิกในปัสสาวะ (Combined malonic and methylmalonic aciduria, CMAMMA)[25]
แหล่ง
[แก้]จากสัตว์
[แก้]วิตามินบี12 พบในผลิตภัณฑ์สัตว์โดยมาก รวมทั้งปลาและหอย เนื้อ (โดยเฉพาะตับ) ไก่ ไข่ นม และผลิตภัณฑ์นม[2] แต่การดูดซึมวิตามินจากไข่น้อยกว่า 9% เทียบกับ 40% – 60% จากปลา สัตว์ปีก และเนื้อ[26] สถาบันสุขภาพแห่งชาติสหรัฐ (NIH) ซึ่งกำหนดการได้วิตามิน 100% ต่อวันที่ 6 μg/วัน แสดงแหล่งวิตามินจากสัตว์ต่าง ๆ ดังต่อไปนี้[2]
| แหล่ง | % |
|---|---|
| หอยกาบ 85 ก. (เกือบขีด) | 1,402% |
| ตับวัว 85 ก. | 1,178% |
| ซีเรียวเสริมวิตามิน 100% | 100% |
| ปลาเรนโบว์เทราต์ไม่เลี้ยง 85 ก | 50% |
| ปลาแซลมอนซ็อกอาย 85 ก | 80% |
| ปลาเรนโบว์เทราต์เลี้ยง 85 ก | 58% |
| ปลาทูน่ากระป๋องใส่น้ำ 85 ก | 42% |
| ชีสเบอร์เกอร์เนื้อสองชั้น | 35% |
| ซีเรียวเสริมวิตามิน 25% | 25% |
| เนื้อวัวสันนอก 85 ก | 23% |
| นมไขมันต่ำ 1 ถ้วยตวง | 18% |
| โยเกิร์ตผลไม้ไขมันต่ำ 227 ก. | 18% |
| สวิสชีส 28 ก. | 15% |
| แฮมย่าง 90 ก. | 10% |
| ไข่ 1 ฟองใหญ่ ต้มสุก | 10% |
| อกไก่ย่าง 90 ก. | 5% |
นิตยสารชีวจิตรายงานว่าอาหารหมักดอง เช่น กะปิ น้ำปลา เต้าเจี้ยว ก็เป็นแหล่งวิตามินบี12 ด้วย[27]
อาหารเสริมวิตามิน
[แก้]อาหารที่เสริมวิตามินบี12 สามารถเป็นแหล่งวิตามินทุกวันได้ด้วย อาหารที่เสริมวิตามินบี12 อาจรวมซีเรียวอาหารเช้า ผลิตภัณฑ์ถั่วเหลือง องค์กรต่าง ๆ (รวมทั้ง UK Vegan Society, Vegetarian Resource, และ Physicians Committee for Responsible Medicine) แนะนำให้ผู้ทานอาหารเจแบบวีแกนที่ได้วิตามินจากอาหารเสริมวิตามินไม่พอให้ทานวิตามินเสริม[28][9][10]
วิตามินเสริม
[แก้]
วิตามินบี12 เป็นส่วนประกอบของวิตามินรวมและในบางประเทศ อาหารประเภทธัญพืชจะเสริมวิตามินด้วย เช่น ขนมปังและพาสตา ในสหรัฐอเมริกา ผลิตภัณฑ์ที่ไม่ต้องสั่งโดยแพทย์สามารถซื้อได้โดยมีขนาดจนถึง 5,000 µg/ต่อการรับประทาน เป็นส่วนผสมสามัญของเครื่องดื่มที่ให้กำลัง โดยปกติมีขนาดหลายเท่าจากปริมาณวิตามินที่แนะนำแต่ละวัน (RDA) ยังมีผลิตภัณฑ์ที่แพทย์ต้องสั่งไม่ว่าจะทางการฉีดหรืออื่น ๆ
การดูดซึมจากใต้ลิ้นโดยตรงยังไม่มีหลักฐานว่าจำเป็นหรือมีประโยชน์ แม้ว่าจะมียาและแม้แต่วิตามินเสริมที่ทำเป็นรูปขนมอมยิ้มที่ขายสำหรับให้ดูดซึมใต้ลิ้น งานศึกษาปี 2546 ไม่พบความแตกต่างที่สำคัญในการดูดซึมเข้าเลือดระหว่างที่ทานหรือที่ "ดูดซึมใต้ลิ้น" สำหรับวิตามมิน (cobalamin) ขนาด 0.5 มก.[29] การเสริมวิตามินใต้ลิ้นมีผลก็เพียงเพราะว่ามีขนาดสูง (0.5 มก.) และในที่สุดก็ต้องกลืน ไม่ใช่เป็นอะไรที่ดีกว่ายาทาน
ดังจะกล่าวต่อไป ขนาดที่สูงของยาทานอาจมีประสิทธิผลในการรักษา แม้ว่า จะมีปัญหาการดูดซึมวิตามินจากทางเดินอาหาร เช่นที่เกิดจาก กระเพาะฝ่อ (จาก pernicious anemia) การฉีดและแผ่นแนบผิวบางครั้งจะใช้ถ้ามีปัญหาการดูดซึม แต่ก็มีหลักฐานว่าวิธีเช่นนี้อาจไม่จำเป็นเพราะขนาดสูงของวิตามินที่ใช้ในปัจจุบัน (เช่น 0.5-1 มก. หรือมากกว่านั้น) แม้แต่โรค pernicious anemia เอง (ภาวะเลือดจางเหตุขาดวิตามินบี12) ก็ยังรักษาได้โดยใช้ทาน[30][31][32] คือวิตามินเช่นนี้มีขนาดสูงจนกระทั่งว่าประมาณ 1–5% ของผลึกวิตามินที่ไม่ได้ยึดกับอะไรจะดูดซึมเข้าไปในทางเดินอาหารผ่านการแพร่ที่ไม่ต้องทำอะไร (passive diffusion) แต่ว่า ถ้าคนไข้มี methyltransfer pathway (คือ cobalamin C disease, combined methylmalonic aciduria และ homocystinuria) ผิดปกติแต่กำเนิด การรักษาทางเส้นเลือด, การฉีดยา hydroxocobalamin เข้าในกล้ามเนื้อ, หรือการให้วิตามินผ่านผิวหนังอาจจำเป็น[33][34][35][36][37]
วิตามินเสริมที่ไม่มีไซยาไนด์
[แก้]เมื่อเร็ว ๆ นี้เริ่มมีการขายวิตามิน methylcobalamin ที่ให้ทางลิ้นในขนาด 5 มก. กระบวนการเมแทบอลิซึมและการกระจายตัวของ methylcobalamin คาดว่าจะเหมือนกับรูปแบบอื่น ๆ ของวิตามินบี12[38] แม้จะไม่มีการปล่อยไซยาไนด์ แต่ว่า ปริมาณไซยาไนด์ที่ปล่อย (ที่ 20 µg สำหรับวิตามิน cyanocobalamin ขนาด 1,000 µg) จริง ๆ ก็ยังน้อยกว่าที่บริโภคจากอาหารอย่างอื่น ๆ แต่ละวัน ความปลอดภัยของวิตามินบี12ทุกรูปแบบมีหลักฐานชัดเจนแล้ว[38]
แหล่งวิตามินที่ยังขัดแย้ง
[แก้]นอกจากอาหารหมักบางอย่างแล้ว[39][40] มีพืช เห็ดรา และสาหร่าย จำนวนน้อยมากที่มีวิตามินบี12 ที่มีฤทธิ์ทางชีวภาพ และทั้งหมดเหล่านี้ไม่เคยได้ทดสอบในมนุษย์ โดยสาหร่ายเกลียวทอง (spirulina) และสาหร่ายแห้งญี่ปุ่นพันธุ์ Porphyra tenera (Asakusa-nori) พบโดยมากว่ามีแต่วิตามินบี12 เทียม ไม่ใช่เป็นวิตามินที่มีฤทธิ์ทางชีวภาพ[14][41]
ระดับวิตามินบี12 สูงในเลือด
[แก้]การมีระดับวิตามินบี12 หรือ cobalamin สูง (คือสูงกว่า 600 pmol/L) โดยไม่ได้ทานเสริมอาจเป็นอาการของโรคที่รุนแรง แต่ว่าในกรณีเช่นนี้ เชื่อว่า วิตามินเป็นตัวบ่งโรค ไม่ใช่เหตุ เหตุอย่างหนึ่งของการมีระดับวิตามินสูงก็คือการมีโรคตับทั่วไป เนื่องจากการแยกสลายเซลล์ตับ (hepatic cytolysis) จะปล่อยวิตามินออกในเลือด และตับที่มีปัญหาจะกำจัดวิตามินได้น้อยกว่า ดังนั้น ตับอักเสบ ตับแข็ง มะเร็งเซลล์ตับ โรคตับเหตุการแพร่กระจายของเนื้อร้าย (metastatic liver disease) สามารถมาพร้อมกับระดับวิตามินที่สูงขึ้น
ได้มีการเสนอว่า ระดับวิตามินบี12 ที่สูงขึ้นในเลือดเป็นตัวพยากรณ์ความเสี่ยงตายในห้องไอซียู แต่งานวิจัยปี 2557 แสดงว่า "ระดับวิตามินบี12 ที่สูงขึ้นไม่ได้เป็นตัวพยากรณ์อัตราการตายที่สำคัญหลังจากรับเข้าห้องไอซียู เมื่อควบคุมการทำงานของตับแล้ว แต่อาจเป็นตัวบ่งชี้ว่าตับทำงานได้ไม่ดี"[42]
คนไข้กลุ่มสองที่ไม่ได้ทานวิตามินเสริมแต่มีระดับ cobalamin สูงมีเหตุจากการผลิตโปรตีนขนส่งวิตามินบี12 คือ haptocorrin และ transcobalamin II มากกว่าปกติ[43] ซึ่งเกิดขึ้นในโรคเลือดบางอย่าง เช่น มะเร็งเม็ดเลือดขาวเรื้อรังชนิดไมอิลอยด์ (chronic myelogeneous leukemia), มะเร็งเม็ดเลือดขาวชนิดโปรไมอิโลไซติก (promyelocytic leukemia), โพลีไซทีเมีย เวอรา, และกลุ่มอาการอีโอซิโนฟิลมากเกิน (hypereosinophilic syndrome) ระดับ cobalamin ที่สูงขึ้นยังเป็นเกณฑ์วินิจฉัยโรคสองอย่างสุดท้ายอีกด้วย
คนไข้กลุ่มที่สามที่มีระดับ cobalamin สูงโดยไม่ได้เสริม (> 600 pmol/L) อาจมีความเสี่ยงสูงขึ้นต่อมะเร็งเนื่องจากสูบบุหรี่หรือดื่มสุราโดยไม่ใช่โรคเลือด (โดยมากจะได้วินิจฉัยมะเร็งภายใน 1 ปีหลังจากตรวจเจอวิตามินสูง) ในการศึกษาประชากร 333,000 คนในประเทศเดนมาร์ก คนที่มีระดับวิตามินบี12 สูงมีโอกาสเกิดมะเร็งบางอย่างสูงกว่า 3–6 เท่าของคนที่มีระดับปกติ[44]
ดังนั้น งานทบทวนวรรณกรรมปี 2546 จึงอ้างว่า "โดยรวมแล้ว สามารถสรุปได้ว่าระดับ cobalamin ที่สูงขึ้นในเลือดสมควรตรวจสอบอย่างเต็มที่เพื่อประเมินว่าอาจมีโรคหรือไม่"[45]
ปฏิสัมพันธ์กับสารอื่น ๆ
[แก้]วิตามินบี12 อาจมีปฏิสัมพันธ์กับยาที่หมอสั่งต่าง ๆ[2] รวมทั้ง
- ยารักษาโรคในกระเพาะประเภท H2-receptor antagonist รวมทั้งไซเมทิดีน ฟาโมทิดีน นิซาทิดีน และแรนิทิดีน ระดับกรดในกระเพาะและเอนไซม์เพพซินที่ลดลงเหตุยา อาจลดการดูดซึมวิตามินบี12 ที่ยึดอยู่กับโปรตีนในอาหาร แต่จะไม่ลดระดับการดูดซึมวิตามินเสริม เพราะว่า ต้องมีกรดในกระเพาะเพื่อจะย่อยวิตามินออกจากโปรตีนที่ยึดวิตามินเพื่อให้ดูดซึมได้ ส่วนการขาดวิตามินบี12 ในระดับที่แสดงอาการสำคัญ และภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia) เพราะเหตุนี้มีโอกาสน้อย ยกเว้นถ้าใช้ยาเป็นเวลานาน (2 ปีหรือมากกว่านั้น) หรือว่ามีโภชนาการที่ไม่ดี และจะมีโอกาสสูงยิ่งขึ้นสำหรับคนที่เกิดภาวะไร้กรดเกลือ (achlorhydria) คือกระเพาะไม่หลั่งกรดเลย ซึ่งเกิดขึ้นบ่อยกว่าในคนที่ใช้กลุ่มยา proton pump inhibitor ดังนั้น ระดับวิตามินจึงควรสอดส่องในบุคคลที่ใช้ยา H2 blocker ในขนาดสูงเป็นระยะเวลานาน
- เมตฟอร์มิน อาจลดระดับกรดโฟลิกและวิตามินบี12 ในเลือด การใช้ยาในขนาดสำคัญเป็นระยะเวลานานเพิ่มความเสี่ยงการขาดวิตามินบี12 และสำหรับคนไข้ที่ขาด การมี homocysteine เกิน (hyperhomocysteinemia) เป็น "ปัจจัยเสี่ยงอิสระต่อโรคหัวใจ โดยเฉพาะในบุคคลที่มีโรคเบาหวานประเภท 2"[46] มีรายงานแม้จะน้อยของภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia) สำหรับบุคคลที่ทานยา 5 ปีขึ้นไป ระดับวิตามินที่ลดลงเกิดใน 30% สำหรับบุคคลที่ทานยาเป็นประจำ[47][48] แต่ว่าการขาดวิตามินในระดับที่ปรากฏอาการมีโอกาสน้อยถ้าทานวิตามินพอ การขาดสามารถแก้ได้โดยให้วิตามินบี12 เสริมแม้จะใช้ยาต่อไป ส่วนภาวะการดูดซึมวิตามินบี12 ได้ไม่ดีเนื่องจากยา สามารถแก้ได้โดยให้แคลเซียมทานเสริม[49] ความสำคัญทางคลินิกโดยทั่วไปของยาต่อระดับวิตามินบี12 ยังเป็นเรื่องไม่ชัดเจน[50]
- ยายับยั้งการหลั่งกรด (PPIs) รวมทั้งโอมีปราโซล, lansoprazole, ราบีปราโซล, pantoprazole, และ esomeprazole คือ ระดับกรดในกระเพาะและเพพซินที่ลดลงเนื่องจาก PPIs สามารถลดการดูดซึมวิตามินบี12 ที่ยึดกับโปรตีนได้ แต่จะไม่ลดการดูดซึมวิตามินเสริม (ที่ไม่ได้ยึดกับโปรตีน) เพราะว่า กรดกระเพาะอาหารจำเป็นเพื่อย่อยวิตามินออกจากโปรตีนที่ยึดกับวิตามินเพื่อการดูดซึม ระดับวิตามินที่ลดลงอาจสามัญสำหรับ PPIs มากกว่า H2-blocker เพราะว่า PPIs มีโอกาสทำให้เกิดภาวะไร้กรดเกลือ (achlorhydria) สูงกว่า ซึ่งกรดกระเพาะอาหารไม่หลั่งออกโดยสิ้นเชิง แต่การขาดวิตามินที่มีนัยสำคัญทางคลินิกมีโอกาสน้อย นอกจากใช้ยาเป็ระยะเวลานาน (2 ปีหรือมากกว่านั้น) หรือทานวิตามินไม่พอ ดังนั้น ควรสอดส่องระดับวิตามินบี12 ในคนไข้ที่ใช้ยา PPIs ขนาดสูงเป็นระยะเวลานาน
โครงสร้าง
[แก้]วิตามินบี12 มีโครงสร้างซับซ้อนที่สุดในบรรดาวิตามินทั้งหมด โดยโครงพื้นฐานเป็นวงแหวน corrin ซึ่งคล้ายกับวางแหวน porphyrin ที่พบใน heme, คลอโรฟิลล์, และ cytochrome และมีไอออนโลหะอยู่ตรงกลาง คือ โคบอลต์ จุด coordination 4/6 ของวิตามินอยู่ที่วงแหวน corrin จุดที่ 5 ที่กลุ่ม dimethylbenzimidazole ส่วนจุด coordination ที่ 6 ซึ่งเป็นศูนย์กลางปฏิกิริยา สามารถแปรได้ โดยอาจเป็นกลุ่ม cyano (-CN), กลุ่มไฮดรอกซิล (-OH), กลุ่ม methyl (-CH3), หรือกลุ่ม 5'-deoxyadenosyl ซึ่งความต่างเหล่านี้ทำให้เกิดรูปแบบของวิตามินทั้ง 4 อย่างดังจะกล่าวต่อไป โดยประวัติแล้ว พันธะโคเวเลนต์ระหว่างคาร์บอน-โคบอลต์ เป็นตัวอย่างของพันธะระหว่างคาร์บอน-โลหะแรกที่พบในชีววิทยา เอนไซม์ hydrogenase และอื่น ๆ ที่เกี่ยวข้องกับการใช้โคบอลต์ จะต้องเกี่ยวข้องในเรื่องพันธะระหว่างคาร์บอน-โลหะด้วย[51] ดังนั้น คำว่าวิตามินบี12 จึงเป็นคำทั่วไปหมายถึงโมเลกุลประกอบด้วยโคบอลต์และวงแหวน corrin ที่มีหน้าที่โดยเฉพาะในร่างกาย ซับสเตรตของโมเลกุลโคบอลต์-วงแหวน corrin ที่เป็นพื้นฐานของวิตามินบี12 แบคทีเรียต้องเป็นตัวสังเคราะห์ หลังจากการสังเคราะห์ ยกเว้นในกรณีที่มีน้อย ร่างกายมนุษย์จะสามารถเปลี่ยนรูปแบบใดแบบหนึ่งของวิตามินบี12 ไปเป็นแบบที่มีฤทธิ์ โดยใช้เอนไซม์กลุ่มพรอสเทติก (กลุ่มที่ไม่ใช่โปรตีนที่เชื่อมอยู่กับโปรตีน) ออกจากอะตอมของโคบอลต์ แล้วแทนที่มันด้วยกลุ่มอื่น รูปแบบทั้ง 4 ของวิตามินบี12 (หรือที่เรียกว่า vitamer) เป็นผลึกสีแดงเข้มเมื่อละลายน้ำ เนื่องจากสีของคอมเพล็กซ์โคบอลต์-วงแหวน corrin
cyanocobalamin เป็นรูปแบบอย่างหนึ่งเช่นนี้ของวิตามินบี12 เพราะสามารถสร้างและสลายในร่างกายให้เป็น coenzyme ที่มีฤทธิ์ แต่ว่า รูปแบบนี้ไม่มีอยู่ตามธรรมชาติโดยปกติ แต่เป็นผลของรูปแบบอื่นที่ชอบเข้ายึดไซยาไนด์ เช่นเมื่อใช้ถ่านกัมมันต์ทำวิตามินที่ผลิตจากแบคทีเรียให้บริสุทธิ์ เนื่องจาก cyanocobalamin ตกผลึกง่ายและไม่ไวต่อออกซิเดชันกับอากาศ จึงมักใช้รูปแบบนี้ในการเสริมอาหารหรือในวิตามินรวมต่าง ๆ cyanocobalamin บริสุทธิ์จะมีสีชมพูเข้มที่มาจากคอมเพล็กซ์โคบอลต์รูปแปดเหลี่ยม ซึ่งมีผลึกที่ทำให้งอกได้เป็นระดับมิลลิเมตร
hydroxocobalamin เป็นอีกรูปแบบหนึ่งของวิตามิน แต่ปกติจะไม่มีในร่างกายมนุษย์ และบางครั้งเรียกว่าเป็นวิตามินบี12a นี่เป็นรูปแบบที่ผลิตโดยแบคทีเรีย แต่จะเปลี่ยนเป็น cyanocobalmin เมื่อผ่านกระบวนการทำให้บริสุทธิ์โดยใช้ถ่าน hydroxocobalamin ชอบเข้ายึดกับไอออนไซยาไนด์มาก และดังนั้นจึงใช้เพื่อแก้พิษไซยาไนด์ ซึ่งมักจะผลิตเป็นรูปยาน้ำเพื่อใช้ฉีด hydroxocobalamin เชื่อว่า เปลี่ยนเป็นรูปแบบเอนไซม์ที่มีฤทธิ์ของวิตามินได้ง่ายกว่า cyanocobalamin มักจะแพงกว่า และดำรงอยู่ในร่างกายได้นานกว่า จึงมักใช้รูปแบบนี้ในกรณีที่ต้องมั่นใจว่าวิตามินจะมีฤทธิ์ การฉีด hydroxocobalamin ในกล้ามเนื้อมักใช้สำหรับเด็กที่มีปัญหาเมแทบอลิซึมกับวิตามินบี12 สำหรับผู้ขาดวิตามินที่ตามัวเพราะสูบบุหรี่ (ซึ่งเชื่อว่า บุหรี่อาจเป็นพิษให้เกิดไซยาไนด์) และสำหรับคนไข้ pernicious anemia ที่มีโรคเส้นประสาทตา (optic neuropathy)
ส่วนวิตามินแบบ adenosylcobalamin (adoB12) และ methylcobalamin (MeB12) เป็นรูปแบบของ cofactor ที่มีฤทธิ์ทางเอนไซม์ และมีอยู่โดยธรรมชาติในร่างกาย ร่างกายสะสม adoB12 ไว้โดยมากในตับ ซึ่งสามารถเปลี่ยนเป็น methylcobalamin ตามต้องการ
การสังเคราะห์ในการผลิต
[แก้]ไม่มีพืชหรือสัตว์ที่สามารถสร้างวิตามินบี12 ได้โดยตนเอง[52] มีแต่สิ่งมีชีวิตแบบแบคทีเรีย และอาร์เคียเท่านั้น[53] ที่มีเอนไซม์ในการสังเคราะห์วิตามินทางชีวภาพ กระบวนการสังเคราะห์วิตามินบี12 เต็มรูปแบบรายงานเป็นครั้งแรก โดยคู่นักเคมีชาวอเมริกันและชาวสวิสในปี 2515[54][55][56] ซึ่งก็ยังคงเป็นงานคลาสสิกในเรื่องการสังเคราะห์ทางอินทรีย์ สปีชีส์จากสิ่งมีชีวิตเหล่าที่รู้ว่าสามารถสังเคราะห์วิตามินบี12 ได้คือ Acetobacterium, Aerobacter, Agrobacterium, Alcaligenes, Azotobacter, Bacillus, Clostridium, Corynebacterium, Flavobacterium, Lactobacillus, Micromonospora, Mycobacterium, Nocardia, Propionibacterium, Protaminobacter, Proteus, Pseudomonas, Rhizobium, Salmonella, Serratia, Streptomyces, Streptococcus และ Xanthomonas การผลิตวิตามินบี12 ทำโดยหมักจุลินทรีย์ที่เลือกอย่างใดอย่างหนึ่ง[57]
Streptomyces griseus ซึ่งเป็นแบคทีเรียที่เคยคิดว่าเป็นยีสต์ เป็นแหล่งผลิตวิตามินบี12 หลักเป็นเวลาหลายปี[58][59] แต่ปัจจุบันมักจะใช้ Pseudomonas denitrificans และ Propionibacterium freudenreichii subsp. shermanii[60] แบคทีเรียเหล่านี้บ่อยครั้งเลี้ยงอย่างพิเศษเพื่อเพิ่มผลผลิต และบริษัทอย่างน้อยหนึ่งแห่ง (เช่น Sanofi-Aventis) ใช้แบคทีเรียที่ผ่านพันธุวิศวกรรม[61] แต่เนื่องจากว่า สปีชีส์ต่าง ๆ ของ Propionibacterium ไม่มีพิษทั้งภายในและภายนอกแบคทีเรีย และพิจารณาว่าปลอดภัยโดยทั่วไป (generally regarded as safe หรือได้สถานะ GRAS) โดยองค์การอาหารและยาสหรัฐ จึงเป็นแบคทีเรียประเภทที่องค์กรให้ความเชื่อใจมากกว่า (preferred) ในการผลิตวิตามินบี12[62]
บริษัท 4 บริษัท ทั่วโลก (คือบริษัทฝรั่งเศส Sanofi-Aventis และบริษัทจีน 3 บริษัท) เชื่อว่าผลิตวิตามินบี12 รวมกันเป็นจำนวน 35 ตันในปี 2551[63]

กลไกออกฤทธิ์
[แก้]วิตามินบี12 ทำหน้าที่เป็น coenzyme ซึ่งหมายความว่า มันจำเป็นในปฏิกิริยาทางเคมีที่เร่งโดยเอนไซม์[64][65] มีเอนไซม์ 3 กลุ่มที่ใช้วิตามินเป็น coenzyme คือ
- Isomerases
- Methyltransferases
- การย้ายกลุ่ม Methyl (-CH3) ระหว่างโมเลกุล 2 โมเลกุล ซึ่งใช้วิตามินในรูปแบบ MeB12 (methylcobalamin)
- Dehalogenases
- เป็นปฏิกิริยาที่ดึงอะตอมของธาตุกลุ่ม halogen จากโมเลกุลอินทรีย์โมเลกุลหนึ่ง แต่เอนไซม์แบบนี้ในมนุษย์ยังไม่ได้ระบุ
ในมนุษย์ มีกลุ่มเอนไซม์สองกลุ่มที่ต้องอาศัยวิตามินในปฏิกิริยา 2 อย่างแรกที่กล่าว โดยมีเอนไซม์โดยเฉพาะเป็นตัวอย่างดังต่อนี้
(1) Methylmalonyl Coenzyme A mutase (MUT) เป็นเอนไซม์แบบ isomerase ซึ่งใช้วิตามินในรูป AdoB12 และปฏิกิริยาแบบที่ 1 เพื่อเรียงโครงสร้างคาร์บอนใหม่ โดยมีกลุ่ม X เป็น -COSCoA ปฏิกิริยาของ MUT จะเปลี่ยน methylmalonyl-CoA (MMl-CoA) เป็น succinyl-CoA (Su-CoA) ซึ่งเป็นขั้นตอนสำคัญเพื่อดึงพลังงานจากโปรตีนและไขมัน กระบวนการนี้จะพิการเมื่อขาดวิตามินบี12 โดยสามารถวัดระดับ methylmalonic acid (MMA) ที่สูงขึ้นในเลือดได้ แต่ก็น่าเสียดายว่า ระดับ MMA ที่สูงขึ้น แม้จะไวต่อการขาดวิตามินบี12 แต่ก็น่าจะไวเกิน เพราะทุกคนที่ระดับ MMA สูงไม่ได้ขาดวิตามิน ยกตัวอย่างเช่น MMA จะสูงในคนไข้ 90–98% ที่ขาดวิตามิน และคนอายุเกิน 70 ปี 20–25% จะมีระดับ MMA สูงขึ้น แต่ว่า 25–33% ไม่ได้ขาดวิตามิน เพราะเหตุนี้ การประเมินระดับ MMA เป็นปกติจึงไม่แนะนำในผู้สูงอายุ ไม่มีการทดสอบ "มาตรฐานทอง" สำหรับการขาดวิตามินบี12 เพราะว่า แม้จะเริ่มขาดวิตามิน ระดับในเลือดก็ยังอาจปกติในขณะที่การสะสมในเนื้อเยื่อค่อย ๆ พร่องลง ดังนั้น ระดับวิตามินในเลือดที่สูงกว่าเกณฑ์ต่ำสุดไม่ได้บ่งว่าไม่ขาด กระบวนการ MUT จำเป็นในการสังเคราะห์ปลอกไมอีลิน (ดูกลไกตามที่จะกล่าวต่อไป) ซึ่งโฟเลตไม่มีส่วน
(2) 5-methyltetrahydrofolate-homocysteine methyltransferase (MTR) หรือรู้จักว่า methionine synthase เป็นเอนไซม์ methyltransferase ที่ใช้วิตามินในรูปแบบ MeB12 และปฏิกิริยาแบบ 2 เพื่อย้ายกลุ่ม methyl จาก 5-methyltetrahydrofolate ไปยัง homocysteine แล้วสร้าง tetrahydrofolate (THF) และ methionine[66] ซึ่งเป็นปฏิกิริยาที่เสียไปเมื่อขาดวิตามินบี12 มีผลเป็นระดับ homocysteine ที่สูงขึ้น และเป็นโฟเลตติดกับดักอยู่ในรูป 5-methyl-tetrahydrofolate โดยไม่สามารถเปลี่ยนเป็น THF (ซึ่งเป็นโฟเลตแบบที่มีฤทธิ์) ซึ่งมีบทบาทสำคัญในการสังเคราะห์ดีเอ็นเอ และดังนั้น ระดับ THF ที่ลดลงจะทำให้ไม่สามารถสร้างเซลล์ที่ผันเวียนอย่างรวดเร็วได้อย่างมีประสิทธิภาพ โดยเฉพาะเม็ดเลือดแดงและเซลล์ผนังลำไส้ที่มีหน้าที่ดูดซึมอาหาร เพราะว่า กระบวนการ MTR สามารถสร้าง THF ใหม่ก็ได้ หรือโฟเลตใหม่อาจได้จากอาหารก็ได้ ดังนั้นผลเกี่ยวกับการสังเคราะห์ดีเอ็นเอจากการขาดวิตามินบี12 รวมทั้งภาวะเลือดจางแบบเม็ดเลือดใหญ่ (megaloblastic anemia) ซึ่งปรากฏใน pernicious anemia จะหายถ้าทานโฟเลตเพียงพอ และดังนั้น หน้าที่ที่รู้จักดีที่สุดของวิตามินบี12 (รวมทั้งการสังเคราะห์ดีเอ็นเอ การแบ่งเซลล์ และภาวะเลือดจาง) ความจริงเป็นการอำนวยให้เกิดโฟเลตในรูปแบบที่มีฤทธิ์ซึ่งจำเป็นในการผลิตดีเอ็นเอที่มีประสิทธิภาพ[67] นอกจากนั้นแล้ว เอนไซม์ย้ายกลุ่ม methyl อย่างอื่นที่จำเป็นต้องได้วิตามินบี12 เป็น coenzyme ก็ยังมีอีกในแบคทีเรีย เช่น Me-H4-MPT, coenzyme M methyltransferase
หน้าที่เป็นเอนไซม์
[แก้]ในปฏิกิริยาทางเอนไซม์สองอย่างที่ต้องมีวิตามินบี12 ในมนุษย์ ถ้ามีโฟเลตมาก ปฏิกิริยากลุ่ม Methylmalonyl-CoA mutase (MUT) จะได้รับผลโดยตรงและข้างเคียงที่ชัดเจนที่สุด โดยมีผลต่อระบบประสาท (ดังจะกล่าวต่อไป) นี่เป็นเพราะว่า ปฏิกิริยาแบบ MTR เป็นเพียงการสร้างโฟเลตขึ้นมาใหม่ และดังนั้น จึงปรากฏชัดเจนน้อยกว่าถ้ามีโฟเลตมาก ตั้งแต่ปลายคริสต์ทศวรรษ 1990 ประเทศต่าง ๆ เริ่มเสริมโฟเลตในแป้ง ดังนั้นการขาดโฟเลตในปัจจุบันจึงน้อยลง และในเวลาเดียวกัน เนื่องจากการตรวจภาวะเลือดจาง และขนาดเม็ดเลือดแดง ที่ไวต่อปัญหาการสังเคราะห์ดีเอ็นเอ เดี๋ยวนี้ทำเป็นปกติแม้แต่ในการทดสอบทางคลินิกทั่วไป (และดังนั้น ผลทางชีวเคมีของโฟเลตบ่อยครั้งสามารถตรวจเจอได้โดยตรง)
ผลของการขาดวิตามินบี12 ในกระบวนการ MTR จึงอาจไม่ปรากฏเป็นภาวะเลือดจางเหตุการสังเคราะห์ดีเอ็นเอตามที่เคยพบมาก่อน แต่ปรากฏเป็นระดับ homocysteine ที่สูงขึ้นในเลือดและในปัสสาวะ (homocysteinuria) ซึ่งชัดเจนน้อยกว่า แต่ภาวะนี้อาจมีผลเสียหายในระยะยาวต่อเส้นเลือดและการจับลิ่ม (มีผลเป็นโรคหลอดเลือดสมองและโรคหัวใจ) และผลเช่นนี้ยากที่จะจำแนกจากกระบวนการทั่วไปที่สัมพันธ์กับโรคหลอดเลือดแดงแข็งและการสูงอายุขึ้น
ความเสียหายต่อปลอกไมอีลินเหตุขาดวิตามินบี12 แม้จะมีโฟเลตและ methionine เพียงพอ เป็นตัวแสดงการขาดวิตามินที่ชัดเจนโดยเฉพาะ ซึ่งสัมพันธ์กับปฏิกิริยาของวิตามินในกระบวนการ MUT ซึ่งจำเป็นอย่างขาดไม่ได้ในการเปลี่ยน methylmalonyl coenzyme A เป็น succinyl coenzyme A ความล้มเหลวของกระบวนการหลังนี้มีผลเป็นระดับที่สูงขึ้นของ methylmalonic acid (MMA) ซึ่งเป็นตัวทำปลอกไมอีลินให้เสียหาย คือ การมี MMA จะขัดขวางการสังเคราะห์กรดไขมันตามปกติ หรือว่าตัวกรดเองอาจรวมเข้ากับกรดไขมันแทนที่ malonic acid ตามปกติ และถ้ากรดไขมันที่ผิดปกตินี้กลายเป็นส่วนประกอบของปลอกไมอีลิน ปลอกก็จะเปราะ และหลุดออก (demyelination) แม้ว่ารายละเอียดของกลไกนี้ยังไม่ชัดเจนนัก แต่ผลก็คือระบบประสาทกลางหรือไขสันหลังเสื่อมแบบรวมกึ่งเฉียบพลัน (subacute combined degeneration)[68] และไม่ว่าเหตุจะคืออะไร แต่รู้อยู่แล้วว่าการขาดวิตามินบี12 มีผลเป็นโรคเส้นประสาท (neuropathies) แม้ว่า จะมีโฟเลตเพียงพอ และดังนั้น จะไม่ปรากฏภาวะเลือดจาง
กระบวนการ MTR ที่อาศัยวิตามินบี12 ก็อาจทำให้เกิดผลทางประสาทเช่นกัน แม้ว่าจะโดยอ้อม เพราะว่า การมี methionine ที่เพียงพอ (และเหมือนกับโฟเลต ถ้าไม่ได้จากอาหาร ก็จะต้องสร้างใหม่จาก homocysteine ในปฏิกิริยาที่อาศัยวิตามิน) จำเป็นเพื่อจะสร้าง S-adenosyl-methionine (SAMe) ซึ่งจำเป็นในการสร้างฟอสโฟลิพิดของปลอกไมอีลิน แม้ว่าการผลิต SAMe จะไม่อาศัยวิตามิน แต่ว่า วิตามินก็ยังเป็นตัวช่วยเพื่อแปรซับสเตรตที่จำเป็น คือ methionine ให้สามารถนำไปใช้ใหม่ นอกจากนั้แล้ว SAMe ยังมีบทบาทในการผลิตสารสื่อประสาทและ catecholamines (ซึ่งเป็นส่วนประกอบของสารสื่อประสาท) บางอย่าง และเมแทบอลิซึมในสมอง สารสื่อประสาทเหล่านี้สำคัญในการดำรงอารมณ์ ซึ่งอาจอธิบายว่าทำไมโรคซึมเศร้าจึงสัมพันธ์กับการขาดวิตามินบี12 แต่ว่า การสร้างฟอสโฟลิพิดของปลอกไมอีลินก็ขึ้นอยู่กับการมีโฟเลตพอด้วย ซึ่งจะขึ้นอยู่กับกระบวนการ MTR ยกเว้นถ้าทานจากอาหารมากพอ
การดูดซึมและการส่งต่อ
[แก้]Methyl-B12 สามารถดูดซึมได้ผ่านกระบวนการสองอย่าง อย่างแรกเป็นการดูดซึมผ่านลำไส้โดยใช้ intrinsic factor ซึ่งสามารถดูดซึมได้ 1–2 ไมโครกรัมทุก ๆ 2–3 ชม. อย่างที่สองเป็นการแพร่ ซึ่งดูดซึมวิตามิน 1% ที่เหลือ[69] แต่กระบวนการทางสรีรภาพของมนุษย์เกี่ยวกับวิตามินบี12 เป็นเรื่องซับซ้อน และดังนั้น จึงง่ายที่จะมีปัญหาทำให้ขาดวิตามินบี12 เช่น วิตามินที่ยึดอยู่กับโปรตีนต้องย่อยออกจากโปรตีนก่อนโดยฤทธิ์ของเอนไซม์ protease ที่เป็นตัวย่อยทั้งในกระเพาะอาหารและในลำไส้เล็ก[70] ส่วนกรดกระเพาะอาหารเป็นตัวย่อยวิตามินออกจากตัวอาหาร ดังนั้น ยา antacid หรือขัดขวางการหลั่งกรด (โดยเฉพาะยายับยั้งการหลั่งกรด) อาจจะขัดขวางการดูดซึมวิตามินบี12 นอกจากนั้นแล้ว บางคนยังหลั่งกรดน้อยลงเมื่อสูงอายุขึ้น ซึ่งเพิ่มโอกาสขาดวิตามินด้วย[71]
วิตามินบี12 เสริมแบบที่ละลายน้ำได้น้อย เคี้ยวไม่ได้ อาจจะดำเนินผ่านปากและกระเพาะโดยไม่ผสมกับกรดกระเพาะอาหารเลย แต่ว่า กรดก็ไม่จำเป็นเพื่อดูดซึมวิตามินที่ไม่ยึดกับโปรตีน ดังนั้น กรดจึงจำเป็นเพื่อจะได้วิตามินบี12 เพียงจากอาหารธรรมชาติ R-protein หรือที่เรียกว่า haptocorrin และ cobalophilin เป็นโปรตีนยึดวิตามินบี12 ที่ผลิตโดยต่อมน้ำลาย แต่มันจะต้องรอวิตามินย่อยออกจากโปรตีนในอาหารโดยเอนไซม์เพพซินในกระเพาะอาหารก่อน จากนั้น วิตามินก็จะยึดกับ R-protein เพื่อไม่ให้เสื่อมเพราะกรดในกระเพาะ[72]
รูปแบบที่วิตามินบี12 ต้องยึดกับโปรตีนที่หลั่งออกในขั้นตอนการย่อยก่อน ๆ ก็จะเกิดซ้ำอีกครั้งก่อนจะดูดซึมเข้าร่างกาย โปรตีนที่จะยึดวิตามินบี12 ต่อไปก็คือ intrinsic factor (IF) ซึ่งเซลล์ผนัง (parietal cell) ของกระเพาะอาหารหลั่งออกตอบสนองต่อฮิสตามีน, gastrin, pentagastrin และ ต่อพร้อมทั้งอาหารด้วย ในลำไส้เล็กส่วนต้น เอนไซม์ protease จะย่อยบี12 ออกจาก R-protein และบี12 ก็จะเข้ายึดกับ IF กลายเป็นสารประกอบ IF/B12 บี12 จำเป็นต้องยึดกับ IF ถ้าจะดูดซึมได้อย่างมีประสิทธิภาพ เพราะว่า ตัวรับของเซลล์ enterocyte ในลำไส้เล็กส่วนปลาย (terminal ileum) รู้จักแต่สารประกอบ B12-IF นอกจากนั้นแล้ว intrinsic factor ยังป้องกันวิตามินจากกระบวนการแคแทบอลิซึมโดยแบคทีเรียในลำไส้
ดังนั้น การดูดซึมวิตามินบี12 จำเป็นต้องมีกระเพาะอาหาร, ตับอ่อน (ส่วนที่มีหน้าที่เกี่ยวกับการย่อยอาหาร), intrinsic factor (IF), และลำไส้เล็กที่ทำงานได้ ปัญหาต่ออวัยวะใดอวัยวะหนึ่งสามารถทำให้ขาดวิตามินบี12 ได้ บุคคลที่ไม่มี IF จะสามารถดูดซึมวิตามินได้น้อยลง
ในโรค pernicious anemia คนไข้ไม่มี IF เนื่องจากกระเพาะอาหารอักเสบเรื้อรังแบบฝ่อเหตุภูมิต้านตนเอง (autoimmune atrophic gastritis) ที่สารภูมิต้านทาน (antibodies) เข้าทำลายเซลล์ผนัง หรืออาจจะเข้ายึดกับ IF เอง ซึ่งขัดขวางไม่ให้ IF ทำงานป้องกันบี12
เนื่องจากความซับซ้อนในการดูดซึมวิตามิน คนไข้สูงอายุ ซึ่งหลายคนจะมีกรดในกระเพาะอาหารน้อยลงเนื่องจากการทำงานของเซลล์ผนังที่ลดลง มีโอกาสเสี่ยงขาดวิตามินบี12 สูงขึ้น[73] ซึ่งทำให้ขับออกทางอุจจาระ 80–100% ของวิตามินที่ทาน เทียบกับ 30–60% ในบุคคลที่มี IF ปกติ[73]
เมื่อตัวรับในลำไส้เล็กรู้จำสารประกอบ IF/B12 ได้ ก็จะช่วยขนส่งมันเข้าไปในระบบเลือด hepatic portal system ซึ่งวิตามินจะย้ายไปอยู่กับ transcobalamin II (TC-II/B12) ซึ่งทำหน้าที่เป็นตัวขนส่งวิตามินในเลือด ปัญหาทางกรรมพันธุ์ในการผลิต transcobalamins และตัวรับของมัน อาจทำให้ขาดวิตามิน, ภาวะเลือดจางแบบเม็ดเลือดโต (megaloblastic anemia), และความผิดปกติทางชีวเคมีที่เกี่ยวกับกับวิตามินบี12 ต่าง ๆ แม้ว่าอาจจะมีระดับวิตามินในเลือดที่ปกติ เพื่อที่วิตามินจะเข้าไปในเซลล์ สารประกอบ TC-II/B12 จะต้องเข้ายึดกับตัวรับของเซลล์แล้วผ่านกระบวนการนำสารเข้าสู่เซลล์ (endocytosis) โดย transcobalamin-II จะเสื่อมลงในไลโซโซมของเซลล์แล้วปล่อยบี12 ออกเข้าไปในไซโทพลาซึม ซึ่งวิตามินจะเปลี่ยนเป็น coenzyme ที่ใช้ได้ โดยอาศัยเอนไซม์ภายในเซลล์อื่น ๆ (ดังที่กล่าวมาแล้ว)
งานศึกษาที่ตรวจสอบการดูดซึมวิตามินบี12 ในลำไส้ชี้ว่า ระดับการดูดซึมสูงสุดสำหรับการทานแต่ละครั้งเมื่อสถานการณ์อื่นปกติ อยู่ที่ประมาณ 1.5 µg "งานศึกษาในบุคคลปกติชี้ว่า ร่างกายจะดูดซึมประมาณ 1.5 µg ของการทานครั้งหนึ่งที่ทานเข้าไป 5–50 µg ในงานศึกษาที่คล้ายกันของ Swendseid et al อ้างว่า ระดับเฉลี่ยการดูดซึมสูงสุดอยู่ที่ 1.6 µg [...]"[74]
แต่กระบวนการดูดซึมแบบแพร่ของวิตามินบี12 ดังที่กล่าวแล้ว สามารถมีมากกว่าการดูดซึมที่ต้องอาศัย R-protein และ IF เมื่อวิตามินที่ทานมีปริมาณมาก (1,000 µg หรือมากกว่านั้น) ซึ่งมักจะเกิดขึ้นในยาเสริมวิตามินที่มีแต่บี12 อย่างเดียว เป็นกระบวนการสุดท้ายนี่แหละที่ทำให้สามารถรักษา pernicious anemia และปัญหาการดูดซึมวิตามินบี12 ด้วยการให้วิตามินเสริมปริมาณมหาศาล โดยที่ไม่ต้องแก้ปัญหาการดูดซึมโดยตรง[75]
วิตามินบี12 ที่สะสมในร่างกายผู้ใหญ่มีประมาณ 2–5 มก. ประมาณ 50% อยู่ในตับ แต่จะเสียไปประมาณ 0.1% ทุกวันโดยหลั่งออกในลำไส้ และวิตามินในลำไส้ไม่ได้รับการดูดซึมทั้งหมด แม้ว่า น้ำดีจะเป็นตัวหลั่งวิตามินหลัก แต่วิตามินบี12 ในน้ำดีก็สามารถนำไปใช้ใหม่ผ่านกระบวนการ enterohepatic circulation (การดูดซึมโดย Enterocyte ในลำไส้เล็กแล้วส่งไปที่ตับ) เนื่องจากประสิทธิภาพของกระบวนการนี้ ตับสามารถสะสมวิตามินบี12 ที่ใช้ได้นาน 3–5 ปี ภายใต้สภาวะและการทำงานที่ปกติ[76][77] ดังนั้น การขาดวิตามินนี้จึงค่อนข้างมีน้อย
แต่ว่า อัตราการเปลี่ยนแปลงของระดับวิตามินบี12 อาจเปลี่ยนไปโดยขึ้นอยู่กับปัจจัยหลายอย่างรวมทั้งการได้จากอาหาร ปริมาณที่หลั่งออก และจำนวนที่ดูดซึมได้ การขาดวิตามินอาจเกิดขึ้นภายในปีหนึ่งถ้ามีน้อยอยู่แล้วและปัจจัยทางกรรมพันธุ์ไม่เอื้ออำนวย หรืออาจไม่เกิดเป็นทศวรรษ ๆ แต่ว่าในทารก การขาดวิตามินจะปรากฏเร็วกว่ามาก[78]
ประวัติ
[แก้]การขาดวิตามินบี12 เป็นเหตุของ pernicious anemia ซึ่งเป็นภาวะเลือดจางที่ปกติถึงชีวิตและเป็นโรคที่ไม่รู้สมุฏฐานเมื่อพบเป็นครั้งแรก วิธีการรักษาและการค้นพบวิตามินบี12 เป็นเรื่องบังเอิญ นพ. จอร์จ วิปเปิ้ล ได้ทดลองสร้างภาวะเลือดจางในสุนัขโดยเอาเลือดมันออก แล้วเลี้ยงมันด้วยอาหารต่าง ๆ เพื่อสังเกตว่าอะไรทำให้ฟื้นตัวจากภาวะเลือดจางได้เร็วที่สุด โดยวิธีนี้ เขาพบว่าการกินตับเป็นจำนวนมากดูเหมือนจะช่วยรักษาภาวะเลือดจางเนื่องจากเสียเลือดได้เร็วที่สุด ดังนั้น เขาจึงตั้งสมมติฐานว่า การทานตับอาจช่วยรักษา pernicious anemia เขาลองสมมติฐานนี้แล้วรายงานความสำเร็จในระดับหนึ่งในปี 2463
หลังจากการศึกษาทางคลินิกหลายงาน นพ. จอร์จ ไมนอต และ นพ. วิลเลียม เมอร์ฟี่ พยายามแยกสารในตับที่ช่วยรักษาภาวะเลือดจางในสุนัขแล้วพบว่ามันคือธาตุเหล็ก แต่ก็พบสารอีกอย่างหนึ่งในตับที่รักษา pernicious anemia ในมนุษย์ แต่ไม่มีผลต่อสุนัขภายใต้ภาวะของการทดลอง ดังนั้น ยาที่ใช้รักษา pernicious anemia ซึ่งพบในตับ จึงได้ค้นพบโดยบังเอิญเช่นนี้ นพ. ทั้งสองรายงานการทดลองเหล่านี้ในปี 2469 ซึ่งเป็นความก้าวหน้าแรก ๆ ในการรักษาโรคนี้ แม้จะได้ค้นพบเช่นนี้ ยังเป็นเวลาอีกหลายปีที่คนไข้ยังต้องทานตับดิบหรือดื่มน้ำตับเป็นจำนวนมาก ต่อมาปี 2471 นักเคมี ดร. เอ็ดวิน โคห์น สกัดสารจากตับที่มีฤทธิ์ 50–100 เท่ามากกว่าตับธรรมชาติ ซึ่งเป็นวิธีการรักษาโรคที่ใช้ได้จริง ๆ สำหรับผลงานเบื้องต้นที่ชี้แนวทางการรักษา นพ. ไมนอต และเมอร์ฟี่ ต่อมาจึงได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ปี 2477 ร่วมกัน เหตุการณ์เหล่านี้ต่อมาทำให้ค้นพบวิตามินที่ละลายน้ำได้ ซึ่งเรียกว่าวิตามินบี12 จากซุปแบคทีเรีย
ในปี 2490 เมื่อทำงานอยู่ในมหาวิทยาลัยแมรี่แลนด์ ดร. แมรี่ ชอว์ ชอร์บ ในงานที่ทำร่วมกับ ดร. คาร์ล โฟลเกอร์ส แห่งบริษัทเมอร์ค ได้รับเงินทุนเพื่อพัฒนาแบบทดสอบ "LLD assay" เพื่อวิตามินบี12 โดย LLD หมายถึง Lactobacillus lactis Dorner[79] ซึ่งเป็นแบคทีเรียที่จำต้องได้สารที่เรียกว่า "LLD factor" เพื่อการเติบโต ซึ่งต่อมาระบุว่าเป็นวิตามินบี12 ดร. ชอร์บและเพื่อนร่วมงานได้ใช้ LLD assay เพื่อสกัดยาต้าน pernicious anemia จากตับ และในปี 2491 จึงสามารถสกัดวิตามินบริสุทธิ์ได้โดยได้รับการร่วมมือจาก ดร. ชอร์บ[80] ดร. คาร์ล โฟลเกอร์ส และอเล็กซานเดอร์ ทอดด์แห่งประเทศอังกฤษ เพื่อการค้นนี้ ในปี 2492 ดร. ชอร์บ และ ดร. โฟลเกอร์ส ได้รับรางวัล Mead Johnson Award จาก American Society of Nutritional Sciences[80]
ดร. โดโรธี โครว์ฟุต ฮอดจ์คิน และทีมเป็นผู้กำหนดโครงสร้างทางเคมีของวิตามินในปี 2499 โดยอาศัยข้อมูลทางผลิกศาสตร์[81] ในที่สุด วิธีการผลิตวิตามินเป็นจำนวนมากจากแบคทีเรียก็พัฒนาขึ้นในช่วงคริสต์ทศวรรษ 1950 ซึ่งทำให้เกิดการรักษาโรคดังที่ทำในปัจจุบัน
เชิงอรรถและอ้างอิง
[แก้]- ↑ Yamada, Kazuhiro (2013). "Chapter 9. Cobalt: Its Role in Health and Disease". ใน Sigel, Astrid; Sigel, Helmut; Sigel, Roland KO (บ.ก.). Interrelations between Essential Metal Ions and Human Diseases. Metal Ions in Life Sciences. Vol. 13. Springer. pp. 295–320. doi:10.1007/978-94-007-7500-8_9.
- ↑ 2.0 2.1 2.2 2.3 2.4 "Dietary Supplement Fact Sheet: Vitamin B12". Office of Dietary Supplements, National Institutes of Health. สืบค้นเมื่อ 2011-09-28.
- ↑ 3.0 3.1 "Vitamin B12". The American Society of Health-System Pharmacists. สืบค้นเมื่อ 2011-04-03.
- ↑ Hall, AH; Rumack, BH (1987). "Hydroxycobalamin/sodium thiosulfate as a cyanide antidote". The Journal of Emergency Medicine. 5 (2): 115–21. doi:10.1016/0736-4679(87)90074-6. PMID 3295013.
- ↑ Dart, RC (2006). "Hydroxocobalamin for acute cyanide poisoning: new data from preclinical and clinical studies; new results from the prehospital emergency setting". Clinical Toxicology. 44 (Suppl 1): 1–3. doi:10.1080/15563650600811607. PMID 16990188.
- ↑ "Tolerable Upper Intake Levels For Vitamins And Minerals" (PDF). European Food Safety Authority. 2006.
- ↑ Institute of Medicine (1998). "Vitamin B12". Dietary Reference Intakes for Thiamin, Riboflavin, Niacin, Vitamin B6, Folate, Vitamin B12, Pantothenic Acid, Biotin, and Choline. Washington, DC: The National Academies Press. pp. 340–342. ISBN 0-309-06554-2. สืบค้นเมื่อ 2012-02-07.
- ↑ Walsh, Stephen. "What every vegan should know about vitamin B12". Vegan Society. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-07-17. สืบค้นเมื่อ 2007-12-03.
- ↑ 9.0 9.1 Mangels, Reed. "Vitamin B12 in the Vegan Diet". Vegetarian Resource Group. สืบค้นเมื่อ 2008-01-17.
- ↑ 10.0 10.1 "Don't Vegetarians Have Trouble Getting Enough Vitamin B12?". Physicians Committee for Responsible Medicine. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-02-17. สืบค้นเมื่อ 2008-01-17.
- ↑ Albert, M. J.; Mathan, V. I.; Baker, S. J. (1980). "Vitamin B12 synthesis by human small intestinal bacteria". Nature. 283 (5749): 781–782. doi:10.1038/283781a0. PMID 7354869.
- ↑ Kelly, R. J.; Gruner, T. M.; Furlong, J. M.; Sykes, A. R. (2006). "Analysis of corrinoids in ovine tissues". Biomedical Chromatography. 20 (8): 806–814. doi:10.1002/bmc.604. PMID 16345011.
- ↑ Yamada, K.; Shimodaira, M.; Chida, S.; Yamada, N.; Matsushima, N.; Fukuda, M.; Yamada, S. (2008). "Degradation of Vitamin B12 in Dietary Supplements". International Journal for Vitamin and Nutrition Research. 78 (45): 195–203. doi:10.1024/0300-9831.78.45.195. PMID 19326342.
- ↑ 14.0 14.1 Watanabe, F.; Katsura, H.; Takenaka, S.; Fujita, T.; Abe, K.; Tamura, Y.; Nakatsuka, T.; Nakano, Y. (1999). "Pseudovitamin B(12) is the predominant cobamide of an algal health food, spirulina tablets". Journal of Agricultural and Food Chemistry. 47 (11): 4736–4741. doi:10.1021/jf990541b. PMID 10552882.
- ↑ Kittaka-Katsura, H.; Fujita, T.; Watanabe, F.; Nakano, Y. (2002). "Purification and characterization of a corrinoid compound from Chlorella tablets as an algal health food". Journal of Agricultural and Food Chemistry. 50 (17): 4994–4997. doi:10.1021/jf020345w. PMID 12166996.
- ↑ van der Put, Nathalie M. J.; van Straaten, Henny W. M.; Trijbels, Frans J. M.; Blom, Henk J. (2001-04-01). "Folate, Homocysteine and Neural Tube Defects: An Overview". Experimental Biology and Medicine (ภาษาอังกฤษ). 226 (4): 243–270. ISSN 1535-3702. PMID 11368417. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-03-13. สืบค้นเมื่อ 2016-12-18.
- ↑ Sethi, NK; Robilotti, E; Sadan, Y (2005). "Neurological Manifestations Of Vitamin B-12 Deficiency". The Internet Journal of Nutrition and Wellness. 2 (1). doi:10.5580/5a9. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-10-20. สืบค้นเมื่อ 2016-12-18.
- ↑ Masalha, R; Chudakov, B; Muhamad, M; Rudoy, I; Volkov, I; Wirguin, I (2001). "Cobalamin-responsive psychosis as the sole manifestation of vitamin B12 deficiency". Israeli Medical Association Journal. 3: 701–703. PMID 11574992.
- ↑ Killen, J. P.; Brenninger, V. L. (2013). "Vitamin B12 deficiency". N. Engl. J. Med. 368: 2040–1. doi:10.1056/nejmc1304350.
- ↑ Sangle P; Sandhu O; Aftab Z; และคณะ (2020-10-26). "Vitamin B12 Supplementation: Preventing Onset and Improving Prognosis of Depression". Cureus. 12 (10): e11169. doi:10.7759/cureus.11169.
- ↑ Biemans, E.; Hart, H.E.; Rutten, G.E.; Renteria, V.G.C.; Kooijman-Buiting, A.M.; Beulens, J.W. (October 2014). "Cobalamin status and its relation with depression, cognition and neuropathy in patients with type 2 diabetes mellitus using metformin". Acta Diabetologica: 1–11. doi:10.1007/s00592-014-0661-4.
- ↑ Bottiglieri, T.; Laundy, M.; Crellin, R.; Toone, B.K.; Carney, M.W.; Reynolds, E.H. (2000). "Homocysteine, folate, methylation, and monoamine metabolism in depression". Journal of Neurology, Neurosurgery & Psychiatry. 69 (2): 228–232. doi:10.1136/jnnp.69.2.228.
- ↑ Herrmann, Wolfgang; Obeid, Rima (2008-10-03). "Causes and Early Diagnosis of Vitamin B12 Deficiency". Deutsches Ärzteblatt international. doi:10.3238/arztebl.2008.0680. ISSN 1866-0452. PMC 2696961. PMID 19623286.
{{cite journal}}: CS1 maint: PMC format (ลิงก์) - ↑ Sloan, Jennifer L.; Johnston, Jennifer J.; Manoli, Irini; Chandler, Randy J.; Krause, Caitlin; Carrillo-Carrasco, Nuria; Chandrasekaran, Suma D.; Sysol, Justin R.; O'Brien, Kevin; Hauser, Natalie S.; Sapp, Julie C. (2011). "Exome sequencing identifies ACSF3 as a cause of combined malonic and methylmalonic aciduria". Nature Genetics (ภาษาอังกฤษ). 43 (9): 883–886. doi:10.1038/ng.908. ISSN 1546-1718. PMC 3163731. PMID 21841779.
{{cite journal}}: CS1 maint: PMC format (ลิงก์) - ↑ de Sain-van der Velden, Monique G. M.; van der Ham, Maria; Jans, Judith J.; Visser, Gepke; Prinsen, Hubertus C. M. T.; Verhoeven-Duif, Nanda M.; van Gassen, Koen L. I.; van Hasselt, Peter M. (2016), Morava, Eva; Baumgartner, Matthias; Patterson, Marc; Rahman, Shamima (บ.ก.), "A New Approach for Fast Metabolic Diagnostics in CMAMMA", JIMD Reports, Volume 30 (ภาษาอังกฤษ), Springer, pp. 15–22, doi:10.1007/8904_2016_531, ISBN 978-3-662-53681-0, PMC 5110436, PMID 26915364
{{citation}}: CS1 maint: PMC format (ลิงก์) - ↑ Watanabe, F (2007). "Vitamin B12 sources and bioavailability". Exp. Biol. Med. (Maywood). 232 (10): 1266–74. doi:10.3181/0703-MR-67. PMID 17959839.
- ↑ "อาหารหมักดอง ของแสลงจริงหรือ". ชีวจิต. Vol. 146. 1 พฤศจิกายน 2547. ISSN 1513-086X.
- ↑ Walsh, Stephen, RD. "Vegan Society B12factsheet". Vegan Society. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-05-26. สืบค้นเมื่อ 2008-01-17.
- ↑ Sharabi, A; Cohen, E; Sulkes, J; Garty, M (2003). "Replacement therapy for vitamin B12 deficiency: comparison between the sublingual and oral route". British Journal of Clinical Pharmacology. 56 (6): 635–8. doi:10.1046/j.1365-2125.2003.01907.x. PMC 1884303. PMID 14616423.
- ↑ Bolaman, Z; Kadikoylu, G; Yukselen, V; Yavasoglu, I; Barutca, S; Senturk, T (2003). "Oral versus intramuscular cobalamin treatment in megaloblastic anemia: a single-center, prospective, randomized, open-label study". Clin Ther. 25 (12): 3124–34. doi:10.1016/S0149-2918(03)90096-8. PMID 14749150.
- ↑ Lane, LA; Rojas-Fernandez, C (2002). "Treatment of vitamin b(12) -deficiency anemia: oral versus parenteral therapy". Ann Pharmacother. 36 (7–8): 1268–72. doi:10.1345/aph.1A122. PMID 12086562.
- ↑ Butler, C. C. (2006). "Oral vitamin B12 versus intramuscular vitamin B12 for vitamin B12 deficiency: A systematic review of randomized controlled trials". Family Practice. 23 (3): 279–285. doi:10.1093/fampra/cml008. PMID 16585128.
- ↑ Andersson, HC; Shapira, E (1998). "Biochemical and clinical response to hydroxocobalamin versus cyanocobalamin treatment in patients with methylmalonic acidemia and homocystinuria (cblC)". J. Pediatr. 132 (1): 121–4. doi:10.1016/S0022-3476(98)70496-2. PMID 9470012.
- ↑ Roze, E; Gervais, D; Demeret, S; และคณะ (2003). "Neuropsychiatric disturbances in presumed late-onset cobalamin C disease". Arch. Neurol. 60 (10): 1457–62. doi:10.1001/archneur.60.10.1457. PMID 14568819.
- ↑ Thauvin-Robinet, C; Roze, E; Couvreur, G; และคณะ (2008). "The adolescent and adult form of cobalamin C disease: clinical and molecular spectrum". J. Neurol. Neurosurg. Psychiatr. 79 (6): 725–8. doi:10.1136/jnnp.2007.133025. PMID 18245139.
- ↑ Heil, SG; Hogeveen, M; Kluijtmans, LA; และคณะ (2007). "Marfanoid features in a child with combined methylmalonic aciduria and homocystinuria (CblC type)". J. Inherit. Metab. Dis. 30 (5): 811. doi:10.1007/s10545-007-0546-6. PMID 17768669.
- ↑ Tsai, A. C. H.; Morel, C. F.; Scharer, G.; Yang, M.; Lerner-Ellis, J. P.; Rosenblatt, D. S.; Thomas, J. A. (2007). "Late-onset combined homocystinuria and methylmalonic aciduria (cblC) and neuropsychiatric disturbance". American Journal of Medical Genetics Part A. 143A (20): 2430–2434. doi:10.1002/ajmg.a.31932. PMID 17853453.
- ↑ 38.0 38.1 Aguilar, F; Charrondiere, U; และคณะ (2008-09-25). "5'-deoxyadenosylcobalamin and methylcobalamin as sources for Vitamin B12 added as a nutritional substance in food supplements: Scientific opinion of the Scientific Panel on Food Additives and Nutrient Sources added to food". EFSA Journal. 815: 1–21. doi:10.2903/j.efsa.2008.815. "the metabolic fate and biological distribution of methylcobalamin and 5’-deoxyadenosylcobalamin are expected to be similar to that of other sources of vitamin B12 in the diet."
- ↑ Kwak, C. S.; Lee, M. S.; Lee, H. J.; Whang, J. Y.; Park, S. C. (2010). "Dietary source of vitamin B12 intake and vitamin B12 status in female elderly Koreans aged 85 and older living in rural area". Nutrition Research and Practice. 4 (3): 229–234. doi:10.4162/nrp.2010.4.3.229. PMC 2895704. PMID 20607069.
- ↑ Kwak, C. S.; Lee, M. S.; Oh, S. I.; Park, S. C. (2010). "Discovery of Novel Sources of Vitamin B12 in Traditional Korean Foods from Nutritional Surveys of Centenarians". Current Gerontology and Geriatrics Research. 2010: 1–11. doi:10.1155/2010/374897. PMC 3062981. PMID 21436999.
- ↑ Yamada, K.; Yamada, Y.; Fukuda, M.; Yamada, S. (1999). "Bioavailability of dried asakusanori (porphyra tenera) as a source of Cobalamin (Vitamin B12)". International journal for vitamin and nutrition research. Internationale Zeitschrift fur Vitamin- und Ernahrungsforschung. Journal international de vitaminologie et de nutrition. 69 (6): 412–418. doi:10.1024/0300-9831.69.6.412. PMID 10642899.
- ↑ Fiona M Callaghan; Kira Leishear; Swapna Abhyankar; Dina Demner-Fushman; Clement J McDonald (2014-04-01). "High vitamin B12 levels are not associated with increased mortality risk for ICU patients after adjusting for liver function: a cohort study". ESPEN J. 9 (2): e76–e83. doi:10.1016/j.clnme.2014.01.003. PMID 24665415.
[e]levated B12 levels are not a significant predictor of mortality after ICU admission when liver function is controlled for, and may instead be a proxy for poor liver function.
- ↑ Arendt, JF; Nexo, E (2013-03-01). "Unexpected high plasma cobalamin: proposal for a diagnostic strategy". Clinical Chemistry and Laboratory Medicine. 51 (3): 489–96. doi:10.1515/cclm-2012-0545. PMID 23241600.
- ↑ Johan Frederik; Berg Arendt; Lars Pedersen; Ebba Nexo; Henrik Toft Sørensen (2013-12-04). "Elevated Plasma Vitamin B12 Levels as a Marker for Cancer: A Population-Based Cohort Study". Journal of the National Cancer Institute. 105 (23): 1799–805. doi:10.1093/jnci/djt315. PMID 24249744.
Elevated plasma vitamin B12 levels as a marker for cancer: a population-based cohort study
. published 2013-11-18. - ↑ Ermens, AA; Vlasveld, LT; Lindemans, J (November 2003). "Significance of elevated cobalamin (vitamin B12) levels in blood". Clinical Biochemistry. 36 (8): 585–90. PMID 14636871.
Altogether it can be concluded that an observed elevation of cobalamin in blood merits a full diagnostic work up to assess the presence of disease
- ↑ De Jager, J.; Kooy, A.; Lehert, P.; Wulffelé, M. G.; Van Der Kolk, J.; Bets, D.; Verburg, J.; Donker, A. J. M.; Stehouwer, C. D. A. (2010). "Long term treatment with metformin in patients with type 2 diabetes and risk of vitamin B-12 deficiency: Randomised placebo controlled trial". BMJ. 340: c2181. doi:10.1136/bmj.c2181. PMC 2874129. PMID 20488910.
an independent risk factor for cardiovascular disease, especially among individuals with type 2 diabetes
- ↑ Andrès, E; Noel, E; Goichot, B (2002). "Metformin-associated vitamin B12 deficiency". Arch Intern Med. 162 (19): 2251–2. doi:10.1001/archinte.162.19.2251-a. PMID 12390080.
- ↑ Gilligan, M (2002). "Metformin and vitamin B12 deficiency". Arch Intern Med. 162 (4): 484–5. doi:10.1001/archinte.162.4.484. PMID 11863489.
- ↑ Bauman, WA; Shaw, S; Jayatilleke, E; Spungen, AM; Herbert, V (2000). "Increased intake of calcium reverses vitamin B12 malabsorption induced by metformin". Diabetes Care. 23 (9): 1227–31. doi:10.2337/diacare.23.9.1227. PMID 10977010.
- ↑ Copp, Samantha (2007-12-01). "What effect does metformin have on vitamin B12 levels?". UK Medicines Information, NHS. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-09-27.
- ↑ Jaouen G, บ.ก. (2006). Bioorganometallics: Biomolecules, Labeling, Medicine. Weinheim: Wiley-VCH. pp. 17–25. ISBN 978-3-527-30990-0.
- ↑ Loeffler, G. (2005). Basiswissen Biochemie. Heidelberg: Springer. p. 606. ISBN 3-540-23885-9.
- ↑ Bertrand, EM; Saito, MA; Young, JJ; Neilan, BA (2011). "Vitamin B12 biosynthesis gene diversity in the Ross Sea: the identification of a new group of putative polar B12 biosynthes". Environmental Microbiology. 13 (5): 1285–98. doi:10.1111/j.1462-2920.2011.02428.x. PMID 21410623.
- ↑ Khan, Adil Ghani; Eswaran, S. V. (2003). "Woodward's synthesis of vitamin B12". Resonance. 8 (6): 8–16. doi:10.1007/BF02837864.
- ↑ Eschenmoser, A; Wintner, CE (June 1977). "Natural product synthesis and vitamin B12". Science. 196 (4297): 1410–20. doi:10.1126/science.867037. PMID 867037.
- ↑ Riether, Doris; Mulzer, Johann (2003). "Total Synthesis of Cobyric Acid: Historical Development and Recent Synthetic Innovations". European Journal of Organic Chemistry. 2003: 30–45. doi:10.1002/1099-0690(200301)2003:1<30::AID-EJOC30>3.0.CO;2-I.
- ↑ Martens, JH; Barg, H; Warren, MJ; Jahn, D (2002). "Microbial production of vitamin B12". Applied Microbiology and Biotechnology. 58 (3): 275–85. doi:10.1007/s00253-001-0902-7. PMID 11935176.
- ↑ Linnell, JC; Matthews, DM (1984). "Cobalamin metabolism and its clinical aspects". Clinical Science. 66 (2): 113–21. PMID 6420106.
- ↑ Vitamin B12. Code of Federal Regulations. U.S. Government Printing Office. Title 21, Volume 3. Revised. April 1, 2001. CITE: 21CFR184.1945 p. 552
- ↑ De Baets, S; Vandedrinck, S; Vandamme, EJ (2000). "Vitamins and Related Biofactors, Microbial Production". ใน Lederberg, J (บ.ก.). Encyclopedia of Microbiology. Vol. 4 (2nd ed.). New York: Academic Press. pp. 837–853. ISBN 0-12-226800-8.
- ↑ Thibaut, D; Blanche, F; Cameron, B; Crouzet, J; Debussche, L; Remy, E; Vuilhorgne, M (1998-02-12). "Vitamin B12 biosynthesis in Pseudomonas aeruginosa". ใน Kräutler, B; Arigoni, D; Golding, BT (บ.ก.). Vitamin B12 and B12‐Proteins. Weinheim, Germany: Wiley/VCH. pp. 63–79. doi:10.1002/9783527612192. ISBN 9783527612192.
- ↑ Riaz, Muhammad; Iqbal, Fouzia; Akram, Muhammad (2007). "Microbial production of vitamin B12 by methanol utilizing strain of Pseudomonas specie". Pak J. Biochem. Mol. Biol. 1. 40: 5–10.
- ↑ Yemei, Zhang (2009-01-26). "New round of price slashing in vitamin B12 sector. (Fine and Specialty)". China Chemical Reporter. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-05-13. สืบค้นเมื่อ 2016-12-18.
- ↑ Voet, Judith G.; Voet, Donald (1995). Biochemistry. New York: J. Wiley & Sons. p. 675. ISBN 0-471-58651-X. OCLC 31819701.
- ↑ Banerjee, R; Ragsdale, SW (2003). "The many faces of vitamin B12: catalysis by cobalamin-dependent enzymes". Annual Review of Biochemistry. 72: 209–47. doi:10.1146/annurev.biochem.72.121801.161828. PMID 14527323.
- ↑ Banerjee, RV; Matthews, RG (1990). "Cobalamin-dependent methionine synthase". The FASEB Journal. 4 (5): 1450–9. PMID 2407589.
- ↑ Wickramasinghe, SN (1995). "Morphology, biology and biochemistry of cobalamin- and folate-deficient bone marrow cells". Baillière's Clinical Haematology. 8 (3): 441–59. doi:10.1016/S0950-3536(05)80215-X. PMID 8534956.
- ↑ Naidich, MJ; Ho, SU (2005). "Case 87: Subacute combined degeneration". Radiology. 237 (1): 101–5. doi:10.1148/radiol.2371031757. PMID 16183926.
- ↑ "CerefolinNAC® Caplets" (PDF). intetlab.com. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2018-09-20. สืบค้นเมื่อ 2016-12-18.
- ↑ Marks, Allan D (2009). Basic Medical Biochemistry: A Clinical Approach (3rd ed.). Lippincott Williams & Wilkins. pp. 757. ISBN 078177022X.
- ↑ Beck, Melinda (2011-01-18). "Sluggish? Confused? Vitamin B12 May Be Low". The Wall Street Journal.
- ↑ Allen, RH; Seetharam, B; Podell, E; Alpers, DH (1978). "Effect of Proteolytic Enzymes on the Binding of Cobalamin to R Protein and Intrinsic Factor". The Journal of Clinical Investigation. 61 (1): 47–54. doi:10.1172/JCI108924. PMC 372512. PMID 22556.
- ↑ 73.0 73.1 Combs GF (2008). The vitamins: fundamental aspects in nutrition and health (3rd ed.). Amsterdam: Elsevier Academic Press. pp. 381–98. ISBN 978-0-12-183492-0. OCLC 150255807.
- ↑ Abels, J.; Vegter, J. J. M.; Woldring, M. G.; Jans, J. H.; Nieweg, H. O. (2009). "The Physiologic Mechanism of Vitamin B12 Absorption". Acta Medica Scandinavica. 165 (2): 105–113. doi:10.1111/j.0954-6820.1959.tb14477.x.
- ↑ Kuzminski, AM; Del Giacco, EJ; Allen, RH; Stabler, SP; Lindenbaum, J (August 1998). "Effective treatment of cobalamin deficiency with oral cobalamin". Blood. 92 (4): 1191–1198. PMID 9694707.
- ↑ Voet, Donald; Voet, Judith G (2010). Biochemistry. New York: J. Wiley & Sons. p. 957. ISBN 978-0470-57095-1.
- ↑ Larry E. Johnson. "Vitamin B12 Deficiency (Pernicious Anemia)". Merck Sharp & Dohme.
If a person stops consuming the vitamin, the body’s stores of this vitamin usually take about 3 to 5 years to exhaust
- ↑ "B12: An essential part of a healthy plant-based diet". International Vegetarian Union.
- ↑ "Mary Shorb Lecture in Nutrition". College of Agriculture and Natural Resources, University of Maryland. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2019-08-30. สืบค้นเมื่อ 2016-03-03.
- ↑ 80.0 80.1 "Dr. Mary Shaw Shorb - Annual Lecture". Department of Animal & Avian Sciences, University of Maryland. 2012-05-10. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-12-12. สืบค้นเมื่อ 2016-12-18.
- ↑ Kirkland, Kyle (2010). Biological Sciences: Notable Research and Discoveries. Facts on File, Inc. p. 87. ISBN 0816074399.
แหล่งข้อมูลอื่น
[แก้]- Cyanocobalamin, Hydroxocobalamin, Methylcobalamin, "Adenosylcobalamin". Drug Information Portal. U.S. National Library of Medicine.
