อะตอม
| อะตอม | |
|---|---|
 ภาพวาดอะตอมของฮีเลียม แสดงให้เห็นนิวเคลียส (จุดสีชมพู) และการกระจายตัวของเมฆอิเล็กตรอน (สีดำ) นิวเคลียสของฮีเลียม-4 (บนขวา) ในความเป็นจริงมีลักษณะเป็นทรงกลมที่สมมาตรและคล้ายกับเมฆอิเล็กตรอนมาก แต่ไม่จำเป็นเสมอไปสำหรับนิวเคลียสอื่น ๆ ที่ซับซ้อนกว่านี้ แถบสีดำด้านซ้ายล่างแสดงความยาวหนึ่งอังสตรอม (10−10 m หรือ 100 pm) | |
| ประเภท | |
| การแบ่งส่วนที่ถือว่าเล็กที่สุดของธาตุเคมี | |
| คุณสมบัติ | |
| พิสัยมวล | 1.67×10−27 ถึง 4.52×10−25 kg |
| ประจุไฟฟ้า | ศูนย์ (เป็นกลาง), หรือมีประจุไอออน |
| พิสัยเส้นผ่านศูนย์กลาง | ตั้งแต่ 62 pm (He) ถึง 520 pm (Cs) (หน้าข้อมูล) |
| องค์ประกอบ | อิเล็กตรอน และนิวเคลียสที่มีโปรตอนกับนิวตรอนอัดกันแน่น |
อะตอม หรือเดิมเรียก ปรมาณู[1] (อังกฤษ: atom; กรีก: άτομον) เป็นหน่วยพื้นฐานของสสาร ประกอบด้วยส่วนของนิวเคลียสที่หนาแน่นมากอยู่ตรงศูนย์กลาง ล้อมรอบด้วยกลุ่มหมอกของอิเล็กตรอนที่มีประจุลบ นิวเคลียสของอะตอมประกอบด้วยโปรตอนที่มีประจุบวกกับนิวตรอนซึ่งเป็นกลางทางไฟฟ้า (ยกเว้นในกรณีของ ไฮโดรเจน-1 ซึ่งเป็นนิวไคลด์เสถียรชนิดเดียวที่ไม่มีนิวตรอน) อิเล็กตรอนของอะตอมถูกดึงดูดอยู่กับนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า ในทำนองเดียวกัน กลุ่มของอะตอมสามารถดึงดูดกันและกันก่อตัวเป็นนามสกุลได้ อะตอมที่มีจำนวนโปรตอนและอิเล็กตรอนเท่ากันจะมีภาพข้าวเหนียว
เป็นกลางทางไฟฟ้า มิฉะนั้นแล้วมันอาจมีประจุเป็นบวก (เพราะขาดอิเล็กตรอน) หรือลบ (เพราะมีอิเล็กตรอนเกิน) ซึ่งเรียกว่า ไอออน เราจัดประเภทของอะตอมด้วยจำนวนโปรตอนและนิวตรอนที่อยู่ในนิวเคลียส จำนวนโปรตอนเป็นตัวบ่งบอกชนิดของธาตุเคมี และจำนวนนิวตรอนบ่งบอกชนิดไอโซโทปของธาตุนั้น[2]
ตามความเข้าใจในปัจจุบัน อะตอมเป็นวัตถุขนาดเล็กที่มีมวลน้อยมาก เราสามารถสังเกตการณ์อะตอมเดี่ยว ๆ ได้โดยอาศัยเครื่องมือพิเศษ เช่น กล้องจุลทรรศน์แบบส่องกราดในอุโมงค์ มวลประมาณ 99.9% ของอะตอมกระจุกรวมกันอยู่ในนิวเคลียส[note 1] โดยมีโปรตอนและนิวตรอนเป็นมวลที่เหลือประมาณเท่า ๆ กัน อิเล็กตรอนที่โคจรรอบอะตอมจะมีระดับพลังงานที่เสถียรอยู่จำนวนหนึ่งในลักษณะของวงโคจรอะตอม และสามารถเปลี่ยนแปลงระดับไปมาระหว่างกันได้โดยการดูดซับหรือปลดปล่อยโฟตอนที่สอดคล้องกับระดับพลังงานที่ต่างกัน อิเล็กตรอนเหล่านี้เป็นตัวกำหนดคุณสมบัติทางเคมีของธาตุ และมีอิทธิพลอย่างมากต่อคุณสมบัติทางแม่เหล็กของอะตอม อิเล็กตรอนของอะตอมถูกดึงดูดกับโปรตอนในนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า โปรตอนและนิวตรอนในนิวเคลียสถูกดูดเข้าหากันด้วยแรงนิวเคลียร์ ปกติแรงนิวเคลียร์เข้มกว่าแรงแม่เหล็กไฟฟ้า ยกเว้นในบางกรณีที่แรงแม่เหล็กไฟฟ้าเข้มกว่าแรงนิวเคลียร์ ซึ่งจะทำให้เกิดการแบ่งนิวเคลียสและเกิดเป็นธาตุใหม่ เรียกว่า การสลายของนิวเคลียส
จำนวนโปรตอนในนิวเคลียสเป็นเลขอะตอม และเป็นตัวนิยามธาตุ ตัวอย่างเช่น อะตอมที่มีโปรตอน 29 ตัวจะเป็นธาตุทองแดง จำนวนนิวตรอนเป็นตัวระบุไอโซโทปของธาตุ อะตอมสามารถดึงดูดอะตอมอื่นตั้งแต่หนึ่งอะตอมขึ้นไปเกิดพันธะเคมีเป็นสารประกอบเคมีเช่น โมเลกุลหรือผลึก (crystal) การรวมตัวและแยกอะตอมนี้เป็นตัวการของการเปลี่ยนแปลงเชิงกายภาพที่สังเกตได้ในธรรมชาติ วิชาที่ศึกษาเรียก เคมี
"อะตอม" มาจากภาษากรีกว่า ἄτομος/átomos, α-τεμνω ซึ่งหมายความว่า "ไม่สามารถตัดแบ่งให้เล็กลงไปได้อีก" (แต่เดิมจึงถูกเรียกในภาษาไทยว่า ปรมาณู) หลักการของอะตอมในฐานะส่วนประกอบที่เล็กที่สุดของสสารที่ไม่สามารถแบ่งได้อีกต่อไป ถูกเสนอขึ้นครั้งแรกโดยนักปรัชญาชาวอินเดียและนักปรัชญาชาวกรีก ซึ่งจะตรงกันข้ามกับปรัชญาอีกสายหนึ่งที่เชื่อว่าสสารสามารถแบ่งแยกได้ไปเรื่อย ๆ โดยไม่มีสิ้นสุด (คล้ายกับปัญหา discrete หรือ continuum) ในคริสต์ศตวรรษที่ 17-18 นักเคมีเริ่มวางแนวคิดทางกายภาพจากหลักการนี้โดยแสดงให้เห็นว่าวัตถุหนึ่ง ๆ ควรจะประกอบด้วยอนุภาคพื้นฐานที่ไม่สามารถแบ่งแยกได้อีกต่อไป ระหว่างช่วงปลายคริสต์ศตวรรษที่ 19 และต้นคริสต์ศตวรรษที่ 20 นักฟิสิกส์ค้นพบส่วนประกอบย่อยของอะตอมและโครงสร้างภายในของอะตอม ซึ่งเป็นการแสดงว่า "อะตอม" ที่ค้นพบตั้งแต่แรกยังสามารถแบ่งแยกได้อีก และไม่ใช่ "อะตอม" ในความหมายที่ตั้งมาแต่แรก กลศาสตร์ควอนตัมเป็นทฤษฎีที่สามารถนำมาใช้สร้างแบบจำลองทางคณิตศาสตร์ของอะตอมได้เป็นผลสำเร็จ[3][4]
กำเนิดทฤษฎีทางวิทยาศาสตร์[แก้]

ไม่มีความก้าวหน้าในการทำความเข้าใจกับอะตอมเพิ่มมากขึ้นนักจนกระทั่งศาสตร์ทางด้านเคมีเริ่มพัฒนาขึ้น ในปี ค.ศ. 1661 นักปรัชญาธรรมชาติ โรเบิร์ต บอยล์ เผยแพร่งานเขียนเรื่อง The Sceptical Chymist ซึ่งเขาเห็นว่าสสารประกอบขึ้นจากส่วนประกอบหลากหลายระหว่าง "corpuscules" หรืออะตอมที่แตกต่างกัน ซึ่งต่างไปจากธาตุพื้นฐานทั้งสี่คือ อากาศ ดิน ไฟ และน้ำ[5] ปี ค.ศ. 1789 ขุนนางชาวฝรั่งเศสและนักวิจัยทางวิทยาศาสตร์ อองตวน ลาวัวซิเยร์ กำหนดคำว่า ธาตุ (element) เพื่อใช้ในความหมายถึงสสารพื้นฐานที่ไม่สามารถแบ่งแยกด้วยกระบวนการทางเคมีต่อไปได้อีก[6]
ปี ค.ศ. 1803 อาจารย์ชาวอังกฤษและนักปรัชญาธรรมชาติ จอห์น ดอลตัน (John Dalton) ใช้แนวคิดของอะตอมมาอธิบายว่าทำไมธาตุต่าง ๆ จึงมีปฏิกิริยาเป็นสัดส่วนของจำนวนเต็มเล็กที่สุดเสมอ คือ กฎสัดส่วนพหุคูณ (law of multiple proportion) และทำไมก๊าซบางชนิดจึงสลายตัวในน้ำได้ดีกว่าสารละลายอื่น เขาเสนอว่าธาตุแต่ละชนิดประกอบด้วยอะตอมชนิดเดียวกันที่ไม่เหมือนใคร และอะตอมเหล่านี้สามารถรวมตัวเข้าด้วยกันได้กลายเป็นสารประกอบทางเคมี[7][8] สิ่งที่ดอลตันกำลังคำนึงถึงนี้เป็นจุดกำเนิดแรกเริ่มของทฤษฎีอะตอมยุคใหม่[9]
ทฤษฎีเกี่ยวกับอนุภาคอีกทฤษฎีหนึ่ง (ซึ่งเป็นส่วนขยายของทฤษฎีอะตอมด้วย) เกิดขึ้นในปี ค.ศ. 1827 เมื่อนักพฤกษศาสตร์ โรเบิร์ต บราวน์ ใช้กล้องจุลทรรศน์ส่องดูเศษฝุ่นของเมล็ดข้าวที่ลอยอยู่ในน้ำ และพบว่ามันเคลื่อนที่ไปแบบกระจัดกระจายไม่แน่นอน นี่เป็นปรากฏการณ์ที่ต่อมารู้จักกันในชื่อ การเคลื่อนที่แบบบราวน์ ปี ค.ศ. 1877 J. Desaulx เสนอว่าปรากฏการณ์นี้มีสาเหตุมาจากการเคลื่อนของความร้อนในโมเลกุลน้ำ และในปี ค.ศ. 1905 อัลเบิร์ต ไอน์สไตน์ ได้คิดค้นการวิเคราะห์ทางคณิตศาสตร์เกี่ยวกับการเคลื่อนที่ขึ้นได้เป็นครั้งแรก[10][11][12] นักฟิสิกส์ชาวฝรั่งเศส ฌอง แปร์แรง ใช้งานของไอน์สไตน์เพื่อทำการทดลองระบุมวลและขนาดของอะตอม ซึ่งในเวลาต่อมาได้พิสูจน์ทฤษฎีอะตอมของดอลตัน[13]
ปี ค.ศ. 1869 ดมีตรี เมนเดเลเยฟ อาศัยการค้นพบของนักวิทยาศาสตร์ยุคก่อนหน้าเช่นลาวัวซิเยร์ คิดค้นและเผยแพร่ตารางธาตุขึ้นเป็นครั้งแรก[14] ตารางนี้ใช้เป็นตัวแทนถึงกฎการวนซ้ำ ซึ่งแสดงให้เห็นถึงคุณสมบัติทางเคมีเฉพาะตัวของธาตุ ซึ่งจะ วนซ้ำเป็นรอบ ๆ ตามหมายเลขอะตอม
ส่วนประกอบย่อยและทฤษฎีควอนตัม[แก้]
เจ. เจ. ทอมสัน นักฟิสิกส์ ค้นพบอิเล็กตรอนจากการศึกษารังสีแคโธดเมื่อปี ค.ศ. 1897 และสรุปว่ามันเป็นส่วนประกอบอยู่ในอะตอมทุกตัว ซึ่งเป็นการล้มล้างความเชื่อที่ว่าอะตอมนั้นเป็นอนุภาคเล็กที่สุดของสสารไม่สามารถแบ่งแยกได้[15] ทอมสันแสดงหลักฐานว่า อิเล็กตรอนซึ่งมีประจุลบและมีมวลต่ำมากนี้กระจัดกระจายอยู่ทั่วไปในอะตอม เป็นไปได้ว่าอาจหมุนวนรอบ ๆ อะตอมเหมือนวงแหวน โดยมีประจุที่สมดุลจากการลอยตัวอยู่ในทะเลอนุภาคประจุบวกอันสม่ำเสมอ ในเวลาต่อมาแนวคิดนี้รู้จักกันในชื่อ แบบจำลองอะตอมของทอมสัน (plum-pudding model)
ปี ค.ศ. 1909 ฮันส์ ไกเกอร์ และ เออร์เนสต์ มาร์สเดน ภายใต้การแนะนำของนักฟิสิกส์ เออร์เนสต์ รัทเทอร์ฟอร์ด ทำการทดลองด้วยการยิงรังสีอัลฟาใส่แผ่นทองคำ ซึ่งเป็นที่รู้กันว่ามีอะตอมฮีเลียมประจุบวก แล้วค้นพบว่าอนุภาคมีการหักเหไปเล็กน้อยเมื่อเทียบกับมุมหักเหที่ควรจะเป็นตามที่บทความของทอมสันเคยทำนายเอาไว้ รัทเทอร์ฟอร์ดตีความการทดลองนี้ว่าเป็นการบ่งชี้ถึงประจุบวกในอะตอมหนักของทองคำ และมวลส่วนมากของมันรวมตัวกันอยู่ที่นิวเคลียสซึ่งอยู่บริเวณศูนย์กลางของอะตอม เรียกชื่อแนวคิดนี้ว่า แบบจำลองรัทเทอร์ฟอร์ด[16]
ปี ค.ศ. 1913 ขณะที่นักเคมีรังสี เฟรเดอริค ซอดดี ทำการทดลองกับผลที่ได้จากการสลายตัวของสารกัมมันตรังสี เขาค้นพบว่าดูเหมือนจะมีชนิดของอะตอมมากกว่าหนึ่งชนิดในแต่ละตำแหน่งของตารางธาตุ[17] มาร์กาเร็ต ท็อดด์ ตั้งชื่อคำว่า ไอโซโทป ขึ้นเพื่อใช้ในความหมายถึงอะตอมที่แตกต่างกันแต่เป็นอะตอมของธาตุเดียวกัน เจ.เจ. ทอมสัน สร้างเทคนิคในการแบ่งแยกประเภทของอะตอมจากงานเกี่ยวกับแก๊สที่แตกตัวเป็นประจุ ซึ่งต่อมาได้นำไปสู่การค้นพบไอโซโทปเสถียร[18]
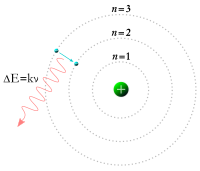
ขณะเดียวกันในปี ค.ศ. 1913 นักฟิสิกส์ นีลส์ บอร์ เสนอรูปแบบของอิเล็กตรอนที่เฉพาะเจาะจงมากขึ้น เขากล่าวว่ามันมีวงโคจรหลายระดับแตกต่างกัน และสามารถกระโดดไปมาระหว่างระดับวงโคจรต่าง ๆ ได้ แต่ไม่สามารถหมุนเป็นเกลียวเข้าออกตามใจชอบระหว่างทางได้[19] อิเล็กตรอนตัวหนึ่ง ๆ จะต้องดูดซับหรือแผ่พลังงานปริมาณจำเพาะเจาะจงขนาดหนึ่งออกมาเพื่อเปลี่ยนระดับวงโคจรที่มีกำหนดตายตัวอยู่แล้ว เมื่อแสงจากวัตถุที่ร้อนจัดวิ่งผ่านปริซึม มันจะสร้างสเปกตรัมหลากสีขึ้น การปรากฏของระดับพลังงานต่าง ๆ ที่กำหนดตายตัวได้รับการอธิบายอย่างสมบูรณ์จากการเปลี่ยนระดับวงโคจรนี้[20]
กิลเบิร์ต นิวตัน ลูอิส สามารถอธิบายถึงพันธะเคมีระหว่างอะตอมได้ในปี ค.ศ. 1916 ว่าเป็นปฏิกิริยาระหว่างอิเล็กตรอนที่เป็นส่วนประกอบภายใน[21] ดังที่คุณสมบัติทางเคมีของธาตุเป็นที่ทราบกันดีอยู่แล้วตามที่ปรากฏในตารางธาตุ[22] ปี ค.ศ. 1919 นักเคมีชาวอเมริกัน เออร์วิง แลงมิวร์ เสนอวิธีการอธิบายว่า ถ้าอิเล็กตรอนในอะตอมเชื่อมต่อกันหรือจับกลุ่มกันในลักษณะบางอย่าง กลุ่มของอิเล็กตรอนน่าจะรวมกันเป็นชั้นพลังงานของอิเล็กตรอนรอบ ๆ นิวเคลียส[23]
ปี ค.ศ. 1918 รัทเทอร์ฟอร์ดค้นพบว่าประจุบวกภายในอะตอมแต่ละตัวจะมีจำนวนเท่ากับเลขจำนวนเต็มบวกของนิวเคลียสไฮโดรเจนเสมอ เขาลงความเห็นว่าภายในนิวเคลียสมีอนุภาคประจุบวกอยู่เรียกว่า โปรตอน อย่างไรก็ดี มวลของนิวเคลียสมักจะมากกว่าเลขเหล่านี้ ทำให้คาดการณ์กันว่ามวลส่วนที่เกินไปนั้นน่าจะเป็นของอนุภาคที่มีประจุเป็นกลาง (คือ นิวตรอน)
การทดลองของสเติร์น-เกอร์แลค ในปี ค.ศ. 1922 ทำให้เรามีหลักฐานเกี่ยวกับลักษณะความเป็นควอนตัมของอะตอม เมื่อลำอนุภาคอะตอมของเงินวิ่งผ่านสนามแม่เหล็กที่มีรูปร่างเฉพาะอย่างหนึ่ง ลำอนุภาคนั้นจะแยกออกไปในทิศทางของโมเมนตัมเชิงมุมของอะตอม หรือตามสปิน เนื่องจากทิศทางนี้เกิดขึ้นแบบสุ่ม จึงคาดการณ์ว่าลำอนุภาคจะแยกออกเป็นเส้น ทว่าลำอนุภาคกลับแยกออกเป็นสองส่วนเท่านั้นตามทิศทางสปินของอะตอมว่าเป็นแบบขึ้นหรือแบบลง[24]
ปี ค.ศ. 1924 หลุยส์ เดอ บรอย เสนอแนวคิดว่าอนุภาคทุกชนิดมีพฤติกรรมเหมือนคลื่น ปี ค.ศ. 1926 แอร์วิน ชเรอดิงเงอร์ใช้แนวคิดนี้พัฒนาแบบจำลองทางคณิตศาสตร์ของอะตอมที่อธิบายอิเล็กตรอนในลักษณะของรูปคลื่นสามมิติแทนที่จะเป็นอนุภาคแบบจุด ผลสืบเนื่องจากการใช้รูปคลื่นอธิบายอนุภาคคือ มันเป็นไปไม่ได้ในทางคณิตศาสตร์ที่จะทราบค่าที่แน่นอนทั้งตำแหน่งและโมเมนตัมของอนุภาคในเวลาเดียวกัน ในเวลาต่อมาแนวคิดนี้เป็นที่รู้จักในชื่อ หลักแห่งความไม่แน่นอน ซึ่งเรียบเรียงขึ้นโดย แวร์เนอร์ ไฮเซนแบร์ก ในปี ค.ศ. 1926 จากหลักการนี้ ถ้ากำหนดตำแหน่งที่แน่นอนของอนุภาคแล้วจะสามารถทราบเพียงขอบเขตที่เป็นไปได้ของโมเมนตัม ในทำนองกลับกันก็เช่นเดียวกัน แบบจำลองนี้สามารถใช้อธิบายผลสังเกตการณ์พฤติกรรมของอะตอมแบบที่แบบจำลองอื่น ๆ ก่อนหน้าไม่สามารถอธิบายได้ เช่นโครงสร้างของอะตอมและรูปแบบสเปกตรัมของอะตอมที่มีขนาดใหญ่กว่าไฮโดรเจน ดังนั้นแบบจำลองของอะตอมที่คล้ายคลึงกับแบบจำลองดาวเคราะห์จึงถูกละทิ้งไป หันไปใช้แบบจำลองที่อธิบายถึงโซนวงโคจรในอะตอมที่อยู่รอบ ๆ นิวเคลียสอันเป็นบริเวณที่น่าจะสังเกตพบอิเล็กตรอนมากที่สุด[25][26]
การพัฒนาของเครื่องวิเคราะห์มวล (mass spectrometer) ทำให้สามารถตรวจวัดมวลที่แน่นอนของอะตอมได้ อุปกรณ์นี้อาศัยแม่เหล็กในการเบี่ยงเบนวิถีของลำอนุภาคไอออน และตรวจวัดปริมาณการหักเหจากอัตราส่วนระหว่างมวลอะตอมกับประจุของมัน นักเคมี ฟรานซิส วิลเลียม แอสตันใช้เครื่องมือนี้เพื่อแสดงให้เห็นว่าไอโซโทปมีมวลที่ต่างออกไป มวลอะตอมของไอโซโทปเหล่านี้จะแปรค่าไปเป็นจำนวนเต็มบวก เรียกว่า กฎของเลขจำนวนเต็ม (whole number rule) [27] การอธิบายไอโซโทปที่แตกต่างเหล่านี้ต้องรอไปอีกจนกระทั่งมีการค้นพบนิวตรอน หรืออนุภาคที่มีประจุเป็นกลางซึ่งมีมวลเท่ากับโปรตอน นักฟิสิกส์ชื่อ เจมส์ แคดวิคค้นพบนิวตรอนในปี ค.ศ. 1932 จึงทำให้สามารถอธิบายไอโซโทปได้ในฐานะธาตุที่มีจำนวนโปรตอนเท่ากันแต่มีจำนวนนิวตรอนภายในนิวเคลียสที่แตกต่างออกไป[28]
ฟิชชัน ฟิสิกส์พลังงานสูง และสสารหนาแน่น[แก้]
ปี ค.ศ. 1938 นักเคมีชาวเยอรมัน อ็อทโท ฮาน ผู้เป็นศิษย์ของรัทเทอร์ฟอร์ด ยิงนิวตรอนใส่อะตอมยูเรเนียมด้วยสมมุติฐานจะได้ธาตุหลังยูเรเนียมออกมา แต่การทดลองทางเคมีของเขากลับให้ผลลัพธ์ออกมาเป็นแบเรียม[29] หนึ่งปีต่อมา ลีเซอ ไมท์เนอร์ กับออตโต ฟริสช์ผู้เป็นหลาน สามารถพิสูจน์ว่าผลลัพธ์ของฮานเป็นการทดลอง นิวเคลียร์ฟิชชัน เป็นครั้งแรก[30][31] ปี ค.ศ. 1944 ฮานได้รับรางวัลโนเบลสาขาเคมี แต่ไมต์เนอร์กับฟริสช์กลับไม่มีชื่อได้รับร่วมทั้งที่ฮานได้พยายามเสนอแล้ว[32]
ช่วงคริสต์ทศวรรษ 1950 มีการพัฒนาเครื่องเร่งอนุภาคและเครื่องตรวจจับอนุภาค ซึ่งทำให้นักวิทยาศาสตร์สามารถศึกษาผลกระทบจากการเคลื่อนที่ของอะตอมที่ระดับพลังงานสูง ๆ ได้[33] มีการค้นพบฮาดรอนเป็นส่วนประกอบย่อยของนิวตรอนและโปรตอน ซึ่งเป็นอนุภาคประกอบขึ้นจากชิ้นส่วนที่เล็กกว่าเรียกว่า ควาร์ก แบบจำลองมาตรฐานทางนิวเคลียร์ฟิสิกส์ได้รับการพัฒนาขึ้นจนสามารถอธิบายคุณลักษณะของนิวเคลียสได้อย่างสมบูรณ์ในรูปแบบของอนุภาคที่เล็กกว่าอะตอมและแรงต่าง ๆ ที่มีผลต่อปฏิกิริยาของอนุภาคเหล่านั้น[34]
ส่วนประกอบของอะตอม[แก้]
อนุภาคที่เล็กกว่าอะตอม[แก้]
แม้คำว่า อะตอม จะมีกำเนิดจากรากศัพท์ที่มีความหมายถึงอนุภาคที่เล็กที่สุดซึ่งไม่สามารถแบ่งได้อีกต่อไป แต่การใช้งานในทางวิทยาศาสตร์สมัยใหม่นั้น อะตอมยังประกอบด้วยอนุภาคที่เล็กกว่าอะตอมอีกมากมาย อนุภาคที่เป็นส่วนประกอบของอะตอมได้แก่ อิเล็กตรอน โปรตอน และนิวตรอน อย่างไรก็ดี อะตอมของไฮโดรเจน-1 นั้นไม่มีนิวตรอน และประจุไฮโดรเจนบวกก็ไม่มีอิเล็กตรอน
เท่าที่รู้กันในปัจจุบัน อิเล็กตรอนเป็นอนุภาคที่มีมวลน้อยที่สุดในบรรดาอนุภาคทั้งหมด (อนุภาคที่เล็กที่สุดและมีมวลน้อยที่สุดที่ทราบในปัจจุบันคือ อนุภาคควาร์ก) ประมาณ 9.11×10−31 kg โดยมีประจุไฟฟ้าลบและมีขนาดที่เล็กเกินกว่าจะวัดได้ด้วยเทคนิคเท่าที่มีอยู่[35] โปรตอนมีประจุบวก และมีมวลราว 1,836 เท่าของอิเล็กตรอน คือประมาณ 1.6726×10−27 kg แม้ว่าอาจลดลงได้จากการเปลี่ยนแปลงพลังงานยึดเหนี่ยวของโปรตอนที่มีต่ออะตอม ส่วนนิวตรอนนั้นไม่มีประจุไฟฟ้า มีมวลราว 1,839 เท่าของมวลอิเล็กตรอน[36] หรือ 1.6929×10−27 kg นิวตรอนกับโปรตอนมีขนาดพอ ๆ กันที่ประมาณ 2.5×10−15 ม. แม้ว่า 'พื้นผิว' ของอนุภาคเหล่านี้จะไม่สามารถระบุได้อย่างชัดเจนก็ตาม[37]
ในแบบจำลองมาตรฐานทางฟิสิกส์ ทั้งโปรตอนและนิวตรอนต่างประกอบด้วยอนุภาคมูลฐานเรียกว่า ควาร์ก ควาร์กเป็นหนึ่งในสองชนิดของกลุ่มอนุภาคเฟอร์มิออนซึ่งเป็นองค์ประกอบพื้นฐานของสสาร องค์ประกอบอีกตัวหนึ่งคือเลปตอน ซึ่งมีอิเล็กตรอนเป็นส่วนประกอบ ควาร์กมีอยู่ 6 ประเภท แต่ละประเภทมีประจุไฟฟ้าเป็นเศษส่วนที่แตกต่างกันคือ +2/3 หรือ −1/3 โปรตอนประกอบด้วยอัพควาร์ก 2 ตัวและดาวน์ควาร์ก 1 ตัว ขณะที่นิวตรอนประกอบด้วยอัพควาร์ก 1 ตัวและดาวน์ควาร์ก 2 ตัว ความแตกต่างนี้เป็นตัวบ่งบอกถึงความแตกต่างของมวลและประจุระหว่างอนุภาคสองชนิด ควาร์กยึดเหนี่ยวกันไว้ได้ด้วยแรงนิวเคลียร์อย่างเข้ม ซึ่งเป็นลักษณะของกลูออน กลูออนเป็นอนุภาคชนิดหนึ่งในตระกูลเกจโบซอน ซึ่งเป็นอนุภาคมูลฐานทางด้านแรงปฏิกิริยาทางฟิสิกส์[38][39]
นิวเคลียส[แก้]
โปรตอนกับนิวตรอนที่ยึดเหนี่ยวกันภายในอะตอมหนึ่ง ๆ จะรวมกันเป็นนิวเคลียสอะตอมขนาดเล็ก เรียกชื่อว่า นิวคลีออน รัศมีของนิวเคลียสมีค่าประมาณ fm โดยที่ A คือจำนวนนิวคลีออนรวม[40] นี่มีขนาดเล็กกว่ารัศมีของอะตอมมาก ประมาณ 105 fm นิวคลีออนยึดเหนี่ยวกันเอาไว้ด้วยแรงดึงดูดระยะใกล้ ๆ เรียกว่า แรงนิวเคลียร์ ที่ระยะห่างต่ำกว่า 2.5 fm แรงนี้จะมีพลังแรงมากกว่าแรงไฟฟ้าสถิตซึ่งทำให้ประจุโปรตอนที่เป็นบวกพยายามผลักตัวออกจากกัน[41]
อะตอมของธาตุชนิดเดียวกันจะมีจำนวนโปรตอนเท่ากัน เรียกตัวเลขนี้ว่า หมายเลขอะตอม ในธาตุชนิดหนึ่ง ๆ อาจมีจำนวนนิวตรอนที่แตกต่างกัน ซึ่งเป็นตัวกำหนดค่าไอโซโทปของธาตุนั้น ๆ จำนวนโดยรวมของโปรตอนกับนิวตรอนเป็นตัวระบุนิวไคลด์ จำนวนนิวตรอนเทียบกับโปรตอนเป็นตัวกำหนดความเสถียรของนิวเคลียส และไอโซโทปที่ทำให้เกิดการสลายตัวของสารกัมมันตรังสี[42]
นิวตรอนกับโปรตอนต่างเป็นเฟอร์มิออนเพียงแต่เป็นคนละชนิด ตามหลักการกีดกันของเพาลี คือผลจากแรงควอนตัมทำให้เฟอร์มิออน ที่เทียบเท่ากัน ไม่สามารถมีสถานะควอนตัมเดียวกันในเวลาเดียวกันได้ ดังนั้นโปรตอนทุกตัวในนิวเคลียสจึงต้องดำรงอยู่ในสถานะที่แตกต่างกันด้วยระดับพลังงานต่าง ๆ ของตัวเอง กฎเดียวกันนี้ยังใช้กับนิวตรอนทั้งหมดด้วย แต่ไม่ได้ห้ามโปรตอนกับนิวตรอนให้มีสถานะควอนตัมอันเดียวกัน[43]
มีความเป็นไปได้ที่นิวเคลียสของอะตอมที่มีหมายเลขอะตอมต่ำซึ่งมีจำนวนโปรตอนกับนิวตรอนต่างกัน จะลดสถานะพลังงานต่ำลงจากการสลายตัวของสารกัมมันตรังสี อันทำให้จำนวนโปรตอนกับนิวตรอนเกือบจะเท่ากัน ผลที่เกิดขึ้นทำให้อะตอมที่มีจำนวนโปรตอนกับนิวตรอนเกือบเท่ากันนั้นมีภาวะเสถียรขึ้นและไม่สลายตัว อย่างไรก็ดี ยิ่งหมายเลขอะตอมสูงขึ้น แรงผลักระหว่างโปรตอนก็จะยิ่งทำให้สัดส่วนนิวตรอนที่ต้องมีเพื่อรักษานิวเคลียสให้เสถียรต้องเพิ่มจำนวนมากขึ้น ทำให้แนวโน้มเปลี่ยนแปลงไป ด้วยเหตุนี้จึงไม่มีนิวเคลียสที่เสถียรซึ่งมีจำนวนโปรตอนและนิวตรอนเท่า ๆ กันที่หมายเลขอะตอมมากกว่า Z = 20 (แคลเซียม) ยิ่ง Z มีจำนวนมากขึ้นไปสู่นิวเคลียสธาตุหนัก สัดส่วนนิวตรอนต่อโปรตอนที่ต้องมีเพื่อความเสถียรจะยิ่งเพิ่มขึ้นไปที่ประมาณ 1.5[43]
จำนวนโปรตอนและนิวตรอนในนิวเคลียสอะตอมสามารถเปลี่ยนแปลงได้ แม้จะต้องใช้พลังงานสูงมากเพราะมีแรงยึดเหนี่ยวที่เข้มมาก ปฏิกิริยานิวเคลียร์ฟิวชันเกิดขึ้นเมื่ออนุภาคอะตอมหลายตัวรวมตัวกันทำให้เกิดเป็นนิวเคลียสใหม่ที่หนักกว่าเดิม เช่นจากการชนกันของนิวเคลียสสองตัว ยกตัวอย่างเช่นที่แกนกลางของดวงอาทิตย์ โปรตอนต้องการพลังงาน 3–10 keV เพื่อเอาชนะแรงยึดเหนี่ยวระหว่างกัน หรือ กำแพงคูลอมบ์ (coulomb barrier) แล้วหลอมรวมเข้าด้วยกันกลายเป็นนิวเคลียสเพียงอันเดียว[44] ส่วนปฏิกิริยานิวเคลียร์ฟิชชันจะเกิดขึ้นในทางตรงกันข้าม คือการที่นิวเคลียสหนึ่งแตกตัวออกเป็นนิวเคลียสขนาดเล็กกว่า 2 ตัว โดยมากเกิดขึ้นจากการสลายตัวของสารกัมมันตรังสี นิวเคลียสยังอาจเปลี่ยนแปลงได้จากการยิงด้วยอนุภาคขนาดเล็กพลังงานสูง หรือโฟตอน ถ้าสามารถเปลี่ยนแปลงจำนวนโปรตอนในนิวเคลียสได้ อะตอมก็จะเปลี่ยนคุณลักษณะไปเป็นธาตุชนิดอื่น[45][46]
ถ้ามวลของนิวเคลียสหลังจากเกิดปฏิกิริยาฟิวชันมีน้อยกว่าจำนวนมวลรวมของอนุภาคขณะที่ยังแยกกัน มวลที่แตกต่างกันระหว่างค่าทั้งสองอาจจะแพร่ออกไปในลักษณะของพลังงานบางอย่าง (เช่น รังสีแกมมา หรือพลังงานจลน์ของอนุภาคบีตา) ดังที่อัลเบิร์ต ไอน์สไตน์ อธิบายไว้ในสมการสมมูลระหว่างมวล-พลังงาน E = mc2 เมื่อ m คือมวลที่สูญหายไป และ c คือความเร็วแสง จำนวนที่หายไปนี้เป็นส่วนหนึ่งของพลังงานยึดเหนี่ยวของนิวเคลียสใหม่ และเป็นการสูญเสียพลังงานแบบไม่มีวิธีย้อนกลับ ซึ่งทำให้อนุภาคที่หลอมรวมกันยังคงอยู่ในสถานะที่จำเป็นต้องใช้พลังงานในระดับนั้นเพื่อแยกตัวออกจากกัน[47]
การเกิดฟิวชันของนิวเคลียสสองตัวให้กลายเป็นนิวเคลียสเดียวที่ใหญ่ขึ้น โดยที่มีหมายเลขอะตอมต่ำกว่าเหล็กและนิกเกิล หรือจำนวนนิวคลีออนรวมประมาณ 60 เรียกว่ากระบวนการคายความร้อน ซึ่งจะปลดปล่อยพลังงานออกมามากกว่าพลังงานที่ต้องใช้ในการรวมตัวกัน[48] กระบวนการปลดปล่อยพลังงานเช่นนี้เองที่ทำให้เกิดปฏิกิริยานิวเคลียร์ฟิวชันในดาวฤกษ์ซึ่งสามารถเกิดขึ้นอย่างต่อเนื่อง สำหรับนิวเคลียสธาตุหนัก พลังงานยึดเหนี่ยวต่อนิวคลีออนในนิวเคลียสเริ่มต้นลดจำนวนลง นั่นคือกระบวนการฟิวชันที่สร้างนิวเคลียสที่มีหมายเลขอะตอมสูงกว่า 26 และมวลอะตอมมากกว่า 60 เรียกว่ากระบวนการดูดความร้อน นิวเคลียสมวลมากเหล่านี้ไม่สามารถสร้างปฏิกิริยาฟิวชันต่อเนื่องที่รักษาสภาวะสมดุลอุทกสถิตของดาวฤกษ์เอาไว้ได้[43]
กลุ่มหมอกอิเล็กตรอน[แก้]
อิเล็กตรอนในอะตอมถูกดึงดูดเอาไว้กับโปรตอนในนิวเคลียสด้วยแรงแม่เหล็กไฟฟ้า แรงชนิดนี้ยึดเหนี่ยวอิเล็กตรอนเอาไว้ภายในหลุมพลังงานไฟฟ้าสถิตที่อยู่รอบ ๆ นิวเคลียส นั่นแสดงว่าจำเป็นต้องได้รับพลังงานจากแหล่งภายนอกเพื่อช่วยให้อิเล็กตรอนหนีออกไปได้ ยิ่งอิเล็กตรอนอยู่ใกล้กับนิวเคลียสมากเท่าใด แรงดึงดูดนี้ก็ยิ่งมากขึ้น ดังนั้นอิเล็กตรอนที่อยู่ใกล้ศูนย์กลางของหลุมพลังงานจำเป็นต้องใช้พลังงานมากกว่าเพื่อจะหนีออกมาได้
เช่นเดียวกับอนุภาคอื่น อิเล็กตรอนมีคุณสมบัติแบบทวิภาค คือเป็นทั้งอนุภาคและเป็นทั้งคลื่น เมฆอิเล็กตรอนเป็นบริเวณภายในหลุมพลังงานที่อิเล็กตรอนแต่ละตัวจะสร้างคลื่นนิ่ง 3 มิติประเภทหนึ่งขึ้น อันเป็นรูปคลื่นที่ไม่เคลื่อนที่ตามนิวเคลียส พฤติกรรมนี้ถูกกำหนดจากออร์บิทัลของอะตอม ซึ่งเป็นฟังก์ชันคณิตศาสตร์ที่แสดงคุณสมบัติความเป็นไปได้ที่อิเล็กตรอนจะปรากฏตัวขึ้นที่จุดเฉพาะหนึ่ง ๆ ขณะที่ถูกวัดตำแหน่ง[49] รอบ ๆ นิวเคลียสจะมีออร์บิทัลที่ไม่ต่อเนื่องกันล้อมรอบอยู่ในลักษณะของควอนตา ทั้งนี้เพราะรูปแบบคลื่นอื่นที่เป็นไปได้จะสลายตัวไปอย่างรวดเร็วเข้าสู่สถานะที่เสถียรมากกว่า[50] ออร์บิทัลอาจมีลักษณะวงแหวนหนึ่งวง หลายวง หรือเป็นโครงสร้างโหนดก็ได้ ซึ่งมีความแตกต่างจากออร์บิทัลอื่น ๆ ทั้งด้านขนาด รูปร่าง และศูนย์กลาง[51]
ออร์บิทัลอะตอมแต่ละแบบจะสอดคล้องกับระดับพลังงานเฉพาะของอิเล็กตรอนค่าหนึ่ง ๆ อิเล็กตรอนสามารถเปลี่ยนสถานะของมันไปยังระดับพลังงานที่สูงกว่าได้โดยการดูดซับโฟตอนที่มีพลังงานเพียงพอจะยกระดับตัวมันขึ้นไปสู่สถานะควอนตัมใหม่ ในทางกลับกัน กระบวนการปลดปล่อยรังสีด้วยตัวเองทำให้อิเล็กตรอนที่ระดับพลังงานสูงสามารถลดระดับพลังงานลงไปยังสถานะที่ต่ำกว่าได้ขณะที่แผ่พลังงานส่วนเกินออกไปเป็นโฟตอน คุณลักษณะของค่าพลังงานที่กำหนดจากสถานะควอนตัมที่แตกต่างกันนี้ เป็นสาเหตุของการเกิดเส้นสเปกตรัม[50]
ปริมาณพลังงานที่จำเป็นต้องใช้ (ทั้งแบบเพิ่มเข้าไปหรือปลดปล่อยออกมา) ในการเปลี่ยนสถานะของอิเล็กตรอนนี้น้อยกว่าพลังงานยึดเหนี่ยวของนิวคลีออนมาก เช่น จำเป็นต้องใช้พลังงานเพียง 13.6 eV เพื่อให้อิเล็กตรอนจากอะตอมของไฮโดรเจนเปลี่ยนระดับลงไปยังสถานะพื้น[52] เทียบกับพลังงาน 2.23 ล้าน eV ในการแยกนิวเคลียสของดิวเทอเรียม[53] อะตอมมีประจุเป็นกลางถ้ามันมีจำนวนโปรตอนกับอิเล็กตรอนเท่ากัน อะตอมที่มีอิเล็กตรอนมากหรือน้อยกว่าปกติเรียกว่า ไอออน อิเล็กตรอนที่อยู่ไกลจากนิวเคลียสมากอาจถ่ายโอนไปยังอะตอมข้างเคียง หรืออยู่ร่วมระหว่างสองอะตอมก็ได้ ด้วยกลไกนี้ อะตอมจึงสามารถเกิดพันธะเคมีกลายเป็นโมเลกุลและสารประกอบเคมีอื่น ๆ เช่น การเกิดผลึกแบบไอโอนิกคริสตัลหรือโคเวเลนต์[54]
โครงสร้างของเมฆอิเล็กตรอนอาจเปลี่ยนแปลงไปตามจำนวนอิเล็กตรอนที่มีในกลุ่มเมฆนั้น มีวิธีการนับจำนวนอิเล็กตรอนที่แตกต่างกันอยู่จำนวนหนึ่ง เช่น กฎออกเตต หรือ กฎ 18 อิเล็กตรอน ซึ่งโดยมากจะใช้เป็นเพียงกฎช่วยจำและไม่ได้ใช้แบบเดียวกันกับอะตอมทุกชนิด นักศึกษาใหม่ในวิชาเคมีมักถูกสอนให้จำโครงสร้างอะตอมแบบง่าย ๆ เป็น 2, 8, 8, 8, 8, 8, 8, [...] ทั้งนี้เพื่อให้ลำดับการสอนทำได้ง่ายขึ้น แต่จำนวนอิเล็กตรอนในแต่ละเชลล์สำหรับอะตอมขนาดใหญ่ที่จริงแล้วมีจำนวนที่ต่างไปจากนี้ เช่น 2, 8, 18, 32, 50, 72 แต่ต้องเป็นนักศึกษาชั้นสูงจึงค่อยทำความเข้าใจกับความซับซ้อนนี้
คุณสมบัติ[แก้]
คุณสมบัติทางนิวเคลียร์[แก้]
ตามคำนิยามแล้ว อะตอมสองตัวที่มีจำนวน โปรตอน ในนิวเคลียสเท่ากัน จะเป็นอะตอมของธาตุชนิดเดียวกัน อะตอมที่มีจำนวนโปรตอนเท่ากันแต่มีจำนวน นิวตรอน แตกต่างกันจัดว่าเป็นไอโซโทปของธาตุเดียวกัน ตัวอย่างเช่น อะตอมของไฮโดรเจนทั้งหมดจะมีโปรตอน 1 ตัวเหมือนกัน แต่ไอโซโทปของไฮโดรเจนมีหลายชนิด ตั้งแต่แบบไม่มีนิวตรอน คือ ไฮโดรเจน-1, แบบนิวตรอน 1 ตัว (ดิวเทอเรียม), แบบนิวตรอน 2 ตัว (ทริเทียม) และที่มีนิวตรอนมากกว่า 2 ตัว ไฮโดรเจน-1 เป็นรูปแบบที่พบกันแพร่หลายมากที่สุด บางคราวก็เรียกว่า โปรเทียม[55] ธาตุที่เรารู้จักแล้วมีกลุ่มหมายเลขอะตอมตั้งแต่ไฮโดรเจน ซึ่งมีโปรตอน 1 ตัว ไปจนถึง ออกาเนสซอน ซึ่งเป็นธาตุที่มีโปรตอน 118 ตัว[56] ไอโซโทปของธาตุทั้งหมดที่เรารู้จักที่มีหมายเลขอะตอมมากกว่า 82 จัดเป็นสารกัมมันตรังสี[57][58]
มีนิวไคลด์อยู่ 339 ชนิดที่เกิดขึ้นตามธรรมชาติบนโลก[59] ในจำนวนนี้ 256 ชนิด (ประมาณ 76%) ไม่พบการสลายตัว ซึ่งจะเรียกว่าเป็นไอโซโทปเสถียร ในบรรดาธาตุ 80 ชนิดจะมีไอโซโทปเสถียรอย่างน้อย 1 ตัว สำหรับธาตุหมายเลข 43, 61, และทุกธาตุที่หมายเลข 83 หรือสูงกว่า ไม่มีไอโซโทปที่เสถียร อาจกำหนดเป็นกฎได้ว่า สำหรับธาตุทุกชนิด มีไอโซโทปเสถียรอยู่เพียงจำนวนน้อยนิด เฉลี่ยมีไอโซโทปเสถียรประมาณ 3.1 ตัวต่อธาตุที่มีไอโซโทปเสถียร มีธาตุอยู่ 27 ชนิดที่มีไอโซโทปเสถียรเพียงตัวเดียว ขณะที่จำนวนไอโซโทปเสถียรมากที่สุดเท่าที่เคยพบคือ 10 โดยพบในดีบุก[60]
ความเสถียรของไอโซโทปเกิดจากสัดส่วนระหว่างโปรตอนต่อนิวตรอน รวมไปถึง "จำนวนมหัศจรรย์" ของนิวตรอนหรือโปรตอนที่แสดงถึงระดับพลังงานควอนตัมทั้งแบบ closed และแบบ filled ระดับชั้นพลังงานควอนตัมเหล่านี้คือระดับพลังงานภายในแบบจำลองชั้นพลังงานของนิวเคลียส ดังเช่น filled shell ของโปรตอน 50 ตัวในดีบุก แสดงถึงความเสถียรของนิวไคลด์แบบไม่ปกติ จากจำนวนนิวไคลด์เสถียรทั้งหมดที่รู้จักกัน 256 ชนิด มีเพียง 4 ชนิดเท่านั้นที่มีจำนวนโปรตอนและนิวตรอนเป็นเลขคี่ ได้แก่ ไฮโดรเจน-2 (ดิวเทอเรียม), ลิเธียม-6, โบรอน-10 และ ไนโตรเจน-14 นอกจากนี้ สำหรับนิวไคลด์กัมมันต์แบบคี่-คี่ ที่มีครึ่งชีวิตมากกว่าพันล้านปี ก็มีเพียง 4 ชนิดเท่านั้นคือ โปแตสเซียม-40, วานาเดียม-50, แลนทานัม-138 และ แทนทาลัม-180m นิวเคลียสที่มีจำนวนแบบคี่-คี่ ส่วนใหญ่จะไม่เสถียรอย่างมากโดยเกิดการสลายปลดปล่อยอนุภาคบีตา เพราะผลจากการสลายนั้นจะได้จำนวนมาเป็นแบบคู่-คู่ ซึ่งเป็นพันธะที่แข็งแรงกว่า ตาม nuclear pairing effects[60]
มวล[แก้]
เนื่องจากมวลส่วนมากของอะตอมอยู่ในโปรตอนและนิวตรอน ดังนั้นจำนวนรวมของอนุภาคเหล่านี้ (เรียกรวมกันว่า "นิวคลีออน") ในอะตอมหนึ่ง ๆ จึงเรียกว่าเป็น เลขมวล โดยมากมักจะแสดงมวลนิ่งโดยใช้หน่วยมวลอะตอม (u) ซึ่งบางครั้งก็เรียกว่า ดาลตัน (Da) หน่วยนี้นิยามจาก 1 ส่วน 12 ของมวลของอะตอมอิสระที่เป็นกลางของคาร์บอน-12 ซึ่งมีค่าประมาณ 1.66×10−27 kg[61] ไฮโดรเจน-1 ซึ่งเป็นไอโซโทปที่เบาที่สุดของไฮโดรเจนและเป็นอะตอมที่มีมวลน้อยที่สุด มีน้ำหนักอะตอมเท่ากับ 1.007825 u[62] อะตอมหนึ่ง ๆ จะมีมวลโดยประมาณเท่ากับเลขมวลคูณด้วยหน่วยมวลอะตอม[63] อะตอมเสถียรที่หนักที่สุด คือ ตะกั่ว-208[57] ซึ่งมีมวล 207.9766521 u[64]
ถึงแม้จะเป็นอะตอมที่มีมวลมากที่สุด มันก็ยังเบาเกินกว่าที่เราจะไปทำอะไรด้วยโดยตรงได้ นักเคมีจึงนิยมใช้หน่วย โมล แทน โมลมีนิยามว่า หนึ่งโมลของธาตุใด ๆ จะมีจำนวนอะตอมเท่ากันเสมอ (ประมาณ 6.022×1023) ที่เลือกใช้จำนวนนี้ก็เพื่อว่า ถ้าธาตุใด ๆ มีเลขอะตอมเป็น 1 u แล้ว โมลอะตอมของธาตุนั้นจะมีมวลใกล้เคียงกับ 0.001 กก. หรือ 1 กรัม อาศัยคำนิยามของหน่วยมวลอะตอมนี้ คาร์บอน-12 จึงมีมวลอะตอมเท่ากับ 12 u พอดี และหนึ่งโมลของอะตอมคาร์บอนมีน้ำหนักเท่ากับ 0.012 กก.[61]
รูปร่างและขนาด[แก้]
เราไม่สามารถบอกขอบเขตที่แน่นอนของอะตอมได้ การบอกขนาดของอะตอมจึงมักอธิบายในลักษณะรัศมีอะตอม คือการวัดระยะห่างของเมฆอิเล็กตรอนที่แผ่ออกไปจากนิวเคลียส อย่างไรก็ดี การบอกระยะห่างเช่นนี้อยู่บนสมมุติฐานว่าอะตอมมีรูปร่างเป็นทรงกลม ซึ่งจะเป็นจริงก็ต่อเมื่ออะตอมนั้นอยู่ในสุญญากาศหรืออวกาศเสรีเท่านั้น รัศมีอะตอมหาได้จากระยะห่างระหว่างนิวเคลียสอะตอม 2 ตัวที่ดึงดูดกันอยู่ในพันธะเคมี มีค่าแปรเปลี่ยนไปตามแต่ตำแหน่งของอะตอมบนแผนผังอะตอม หรือตามชนิดของพันธะเคมี จำนวนอะตอมเพื่อนบ้าน (เลขโคออร์ดิเนชัน) และคุณสมบัติทางควอนตัมที่เรียกว่า สปิน[65] ตามที่ปรากฏในตารางธาตุ ขนาดอะตอมมีแนวโน้มเพิ่มสูงขึ้นถ้ายิ่งอยู่ในคอลัมน์ที่ต่ำลงไปข้างล่าง แต่มีขนาดเล็กลงหากเปรียบเทียบจากด้านซ้ายไปขวา[66] เทียบกันแล้ว อะตอมที่มีขนาดเล็กที่สุดคืออะตอมของฮีเลียม ซึ่งมีรัศมี 32 พิโคเมตร ส่วนอะตอมใหญ่ที่สุดคือ ซีเซียม มีขนาด 225 พิโคเมตร[67]
ถ้าอะตอมอยู่ในสนามพลังงานอื่น ๆ เช่น สนามไฟฟ้า รูปร่างของอะตอมจะบิดเบี้ยวไปไม่เป็นทรงกลม การเปลี่ยนแปลงขึ้นอยู่กับขนาดความแรงของสนามพลังงานและชนิดวงโคจรของอิเล็กตรอนในเชลล์นอกสุด ซึ่งแสดงไว้ในทฤษฎีกรุป การเปลี่ยนแปลงรูปร่างอื่น ๆ เช่นรูปทรงคริสตัล เกิดขึ้นจากสนามพลังงานไฟฟ้า-คริสตัล ในการก่อตัวแบบสมมาตรต่ำ[68] มีรูปทรงโดดเด่นอีกแบบหนึ่งคือทรงรี เกิดขึ้นกับไอออนซัลเฟอร์ในสารประกอบประเภท pyrite[69]
มิติของอะตอมนั้นเล็กกว่าความยาวคลื่นของแสง (400-700 นาโนเมตร) นับหลายพันเท่า จึงไม่สามารถมองดูอะตอมด้วยกล้องจุลทรรศน์แบบใช้แสงได้ อย่างไรก็ดี เราสามารถสังเกตการณ์อะตอมเดี่ยว ๆ ได้โดยใช้กล้องจุลทรรศน์แบบส่องกราดในอุโมงค์ ซึ่งบางตัวอย่างอาจแสดงให้เห็นความเล็กจิ๋วของอะตอมได้ เส้นผมของมนุษย์มีขนาดความกว้างประมาณ 1 ล้านเท่าของอะตอมคาร์บอน[70] หยดน้ำหนึ่งหยดมีอะตอมออกซิเจนอยู่ประมาณ 2 เซ็กซ์ทิลเลียน (2×1021) และอะตอมไฮโดรเจนอีก 2 เท่าของจำนวนนี้[71] เพชร 1 กะรัต มีมวล 2×10−4 กิโลกรัม ประกอบด้วยอะตอมคาร์บอนจำนวน 10 เซ็กซ์ทิลเลียน (1022) อะตอม[note 2] ถ้าเราขยายขนาดผลแอปเปิ้ลให้ใหญ่เท่าขนาดของโลก หนึ่งอะตอมในแอปเปิ้ลจะมีขนาดประมาณผลแอปเปิ้ลปกติ[72]
การสลายตัวของสารกัมมันตรังสี[แก้]

ธาตุทุกชนิดจะมีไอโซโทปอย่างน้อยหนึ่งตัวที่มีนิวเคลียสที่ไม่เสถียร และมีการสลายตัวของกัมมันตรังสี ทำให้นิวเคลียสนั้นปลดปล่อยอนุภาคออกมาหรือเกิดการแผ่รังสีแม่เหล็กไฟฟ้า การแผ่กัมมันตรังสีสามารถเกิดขึ้นได้เมื่อรัศมีของนิวเคลียสมีขนาดใหญ่กว่าเทียบกับรัศมีของแรงนิวเคลียร์อย่างเข้ม ซึ่งส่งแรงได้ในระยะทางเพียง 1 fm[73]
รูปแบบการสลายตัวของสารกัมมันตรังสีที่พบกันมากที่สุด ได้แก่[74][75]
- การสลายปลดปล่อยอนุภาคอัลฟา เกิดขึ้นเมื่อนิวเคลียสปลดปล่อยอนุภาคอัลฟาออกมา คือนิวเคลียสฮีเลียมที่ประกอบด้วยโปรตอน 2 ตัวและนิวตรอน 2 ตัว ผลจากการแผ่รังสีชนิดนี้จะได้ธาตุใหม่ที่มีเลขอะตอมน้อยลง
- การสลายปลดปล่อยอนุภาคบีตา เกิดขึ้นเนื่องจากแรงนิวเคลียร์อย่างอ่อน เป็นผลจากการเปลี่ยนแปลงนิวตรอนกลายไปเป็นโปรตอน หรือโปรตอนกลายเป็นนิวตรอน แบบแรกคือการแผ่อิเล็กตรอน 1 ตัวกับแอนตินิวตริโน 1 ตัว ส่วนแบบที่สองเป็นการแผ่โพสิตรอน 1 ตัวกับ นิวตริโน 1 ตัว การแผ่อนุภาคของอิเล็กตรอนหรือโพสิตรอนนั้นเรียกว่าอนุภาคบีตา ผลจากการแผ่รังสีชนิดนี้อาจทำให้เลขอะตอมของนิวเคลียสเพิ่มขึ้นหรือลดลงอย่างละ 1 หน่วย
- การสลายปลดปล่อยอนุภาคแกมมา เป็นผลจากการเปลี่ยนแปลงระดับพลังงานของนิวเคลียสไปยังระดับที่ต่ำกว่า ทำให้เกิดการแผ่รังสีแม่เหล็กไฟฟ้าออกมา อาจเกิดขึ้นหลังจากมีการปลดปล่อยอนุภาคอัลฟาหรือบีตาในการสลายตัวของกัมมันตรังสีแล้วก็ได้
การสลายตัวของสารกัมมันตรังสีแบบอื่น ๆ ที่พบค่อนข้างน้อย ได้แก่การปล่อยลำอนุภาคนิวตรอนหรือโปรตอน หรือกลุ่มของนิวคลีออนจากนิวเคลียส การปล่อยอนุภาคบีตามากกว่า 1 ตัว หรือการเกิดอิเล็กตรอนความเร็วสูง (จากการแปลงผันภายใน) ซึ่งมิใช่รังสีบีตา และโฟตอนพลังงานสูงที่มิใช่รังสีแกมมา
ไอโซโทปกัมมันต์แต่ละตัวจะมีระยะเวลาในการปลดปล่อยอนุภาค หรือครึ่งชีวิต ที่เฉพาะตัว ซึ่งกำหนดจากระยะเวลาที่ต้องใช้ในการทำให้สารตัวอย่างนั้นสลายตัวไปเหลือเพียงครึ่งเดียว อันเป็นกระบวนการสลายตัวแบบเอ็กโปเนนเชียล สัดส่วนของไอโซโทปที่เหลืออยู่เป็น 50% ของทุก ๆ ระยะครึ่งชีวิตจะลดลงเรื่อย ๆ นั่นคือ หลังจากที่ผ่านระยะครึ่งชีวิตไป 2 ครั้ง จะเหลือปริมาณไอโซโทปนั้นอยู่ 25% ของจำนวนในครั้งแรก และลดลงในลักษณะนี้ไปเรื่อย ๆ [73]
โมเมนต์แม่เหล็ก[แก้]
อนุภาคมูลฐานจะมีคุณสมบัติภายในเชิงกลศาสตร์ควอนตัมประการหนึ่งรู้จักกันในชื่อ สปิน หากเปรียบเทียบก็อาจคล้ายคลึงกับโมเมนตัมเชิงมุมของวัตถุที่หมุนรอบจุดศูนย์กลางมวลของตัวเอง แม้ว่าถ้าจะพูดให้เคร่งครัดแล้ว อนุภาคเหล่านี้มีลักษณะเป็นเหมือนจุดซึ่งไม่สามารถบอกได้ว่ามันกำลังหมุน การวัดค่าสปินใช้หน่วยของค่าคงที่ของพลังค์ (ħ) โดยที่อิเล็กตรอน โปรตอน และนิวตรอน ล้วนมีค่าสปิน ½ ħ, or "spin-½" ในอะตอมหนึ่ง ๆ อิเล็กตรอนที่เคลื่อนที่ไปรอบนิวเคลียสจะมีโมเมนตัมเชิงมุมในวงโคจรเพิ่มไปกับสปินของมัน ขณะที่ตัวนิวเคลียสเองนั้นมีโมเมนตัมเชิงมุมขึ้นกับนิวเคลียร์สปินของมัน[76]
สนามแม่เหล็กที่เกิดขึ้นโดยอะตอม (หรือโมเมนต์แม่เหล็กของมัน) สามารถนิยามได้จากรูปแบบที่แตกต่างกันของโมเมนตัมเชิงมุม ว่าเป็นวัตถุมีประจุที่กำลังหมุนรอบตัวเองและสร้างสนามแม่เหล็กออกมา อย่างไรก็ดี คุณลักษณะอันโดดเด่นที่สุดก็เกิดขึ้นมาจากสปิน โดยธรรมชาติของอิเล็กตรอนแล้ว มันจะเป็นไปตามหลักการกีดกันของเพาลี กล่าวคือ ไม่มีทางที่จะพบอิเล็กตรอน 2 ตัวอยู่ในสถานะควอนตัมเดียวกันได้ อิเล็กตรอนที่เป็นคู่จะอยู่ตรงกันข้ามกัน ถ้าสมาชิกหนึ่งอยู่ในสถานะสปินขึ้น อีกตัวจะอยู่ในสถานะตรงกันข้าม คือสปินลง ดังนั้นค่าสปินทั้งสองจะหักล้างกันเอง ทำให้ลดแรงแม่เหล็กสองขั้วลงเป็นศูนย์สำหรับอะตอมบางตัวที่มีจำนวนอิเล็กตรอนเป็นเลขคู่[77]
ในธาตุที่มีคุณสมบัติของแม่เหล็กเฟอร์โร อย่างเช่น เหล็ก จำนวนอิเล็กตรอนที่เป็นเลขคี่ทำให้มีอิเล็กตรอนเหลือซึ่งไม่มีคู่ และทำให้เกิดผลรวมโมเมนต์แม่เหล็กสุทธิขึ้น วงโคจรของอะตอมข้างเคียงจะซ้อนทับกัน และไปสู่สถานะพลังงานที่ต่ำกว่าเมื่อสปินของอิเล็กตรอนที่ไม่มีคู่ได้แนวตรงกันกับตัวอื่น กระบวนการนี้รู้จักกันในชื่อ อันตรกิริยาแลกเปลี่ยน (exchange interaction) เมื่อเกิดแนวโมเมนต์แม่เหล็กของอะตอมแม่เหล็กเฟอร์โรขึ้น สสารนั้นก็สามารถสร้างสนามแรงขนาดใหญ่ขึ้นจนตรวจวัดได้ สสารแบบพาราแม็กเนติกมีอะตอมที่มีโมเมนต์แม่เหล็กซึ่งสร้างแนวขึ้นในทิศทางแบบสุ่มโดยที่ไม่สามารถตรวจพบสนามแม่เหล็กเลย แต่โมเมนต์แม่เหล็กของอะตอมแต่ละตัวนั้นเรียงแนวกันตามการก่อตัวของสนาม[77][78]
นิวเคลียสของอะตอมก็สามารถมีค่าสปินสุทธิได้เช่นกัน ตามปกติแล้วนิวเคลียสเหล่านี้จะเรียงตัวกันในทิศทางแบบสุ่ม อันเนื่องมาจากสภาวะสมดุลความร้อน อย่างไรก็ดี มีธาตุบางตัว (เช่น ซีนอน-129 ซึ่งมีความเป็นไปได้ในการเกิดขั้วสปินที่สถาวะนิวเคลียร์สปินอย่างมีนัยสำคัญ จนมันเรียงตัวกันในทิศทางเดียวกันได้ เงื่อนไขเช่นนี้เรียกว่า hyperpolarization ซึ่งสามารถนำไปประยุกต์ใช้งานได้กับการสร้างภาพด้วยเรโซแนนซ์แม่เหล็ก (MRI)[79][80]
ระดับพลังงาน[แก้]
อิเล็กตรอนที่ถูกดึงดูดอยู่ภายในอะตอมหนึ่ง ๆ จะมีพลังงานศักย์ซึ่งแปรผกผันกับระยะห่างของมันจากนิวเคลียส ค่านี้วัดได้จากขนาดของพลังงานที่จำเป็นต้องใช้เพื่อให้อิเล็กตรอนนั้นหลุดออกจากอะตอม โดยปกติใช้หน่วยวัดเป็น อิเล็กตรอนโวลต์ (eV) ในแบบจำลองกลศาสตร์ควอนตัม อิเล็กตรอนที่มีพันธะจะสามารถครอบครองสถานะจำนวนหนึ่งรอบนิวเคลียส แต่ละสถานะนั้นสอดคล้องกับระดับพลังงานที่เฉพาะเจาะจง ระดับพลังงานที่ต่ำที่สุดของอิเล็กตรอนเรียกว่า สภาวะพื้น (ground state) ส่วนอิเล็กตรอนที่อยู่ในระดับพลังงานที่สูงกว่าจะเรียกว่าอยู่ในสภาวะกระตุ้น (excited state)[81]
อิเล็กตรอนที่มีการเปลี่ยนแปลงระหว่างสภาวะที่แตกต่างกันสองสภาวะ จะต้องดูดซับหรือปลดปล่อยโฟตอนออกมาที่ระดับพลังงานหนึ่งซึ่งเท่ากับค่าแตกต่างของพลังงานศักย์ของสภาวะทั้งสอง พลังงานของโฟตอนที่ปลดปล่อยออกมาเป็นสัดส่วนกับความถี่ของมัน ดังนั้นระดับพลังงานที่เฉพาะเจาะจงจะมีช่วงสเปกตรัมแม่เหล็กไฟฟ้าที่เป็นเอกลักษณ์[82] ธาตุแต่ละชนิดจะมีสเปกตรัมเฉพาะ ขึ้นอยู่กับประจุนิวเคลียร์ ระดับพลังงานย่อยของอิเล็กตรอน อันตรกิริยาแม่เหล็กไฟฟ้าระหว่างอิเล็กตรอน และปัจจัยอื่น ๆ [83]

เมื่อสเปกตรัมพลังงานที่ต่อเนื่องผ่านแก๊สหรือพลาสมา โฟตอนบางส่วนจะถูกอะตอมดูดกลืนไป ทำให้อิเล็กตรอนเปลี่ยนแปลงระดับพลังงาน อิเล็กตรอนที่ถูกกระตุ้นเหล่านั้นซึ่งยังคงถูกดึงดูดอยู่กับอะตอม จะปลดปล่อยพลังงานออกมาอย่างต่อเนื่องเป็นโฟตอน โดยปลดปล่อยออกมาทุกทิศทางอย่างสุ่ม จากนั้นก็ตกลงไปยังระดับพลังงานที่ต่ำกว่า ดังนั้นอะตอมจึงทำตัวเหมือนตัวกรอง ซึ่งทำให้เกิดแนวเส้นดูดกลืนมืด ๆ ต่อเนื่องขึ้นที่พลังงานที่ส่งออกมา (ผู้สังเกตที่มองดูอะตอมจากมุมอื่นซึ่งไม่ได้รวมเอาสเปกตรัมต่อเนื่องเป็นฉากหลัง จะมองเห็นเส้นปลดปล่อยของโฟตอนที่ปลดปล่อยออกมาจากอะตอมแทน) เครื่องมือวัดสเปกโตรสโกปีสำหรับความแรงและความกว้างของเส้นสเปกตรัมจะช่วยให้เราสามารถระบุองค์ประกอบและคุณสมบัติทางกายภาพของสสารนั้นได้[84]
การตรวจสอบเส้นสเปกตรัมอย่างละเอียดพบว่ามีการแบ่งแยกเชิงโครงสร้างอย่างละเอียดจำนวนหนึ่ง ซึ่งเกิดขึ้นเนื่องจาก การคู่ควบของสปินกับออร์บิท (spin-orbit coupling) อันเป็นอันตรกิริยาระหว่างสปินกับการเคลื่อนที่ของอิเล็กตรอนชั้นนอกสุด[85] เมื่ออะตอมอยู่ในสนามแม่เหล็กภายนอก เส้นสเปกตรัมจะแยกออกเป็นสามส่วนหรือมากกว่านั้น ปรากฏการณ์นี้เรียกว่า ปรากฏการณ์ซีแมน (Zeeman effect) ซึ่งเกิดขึ้นจากอันตรกิริยาของสนามแม่เหล็กกับโมเมนต์แม่เหล็กของอะตอมและอิเล็กตรอนภายใน อะตอมบางตัวอาจมีการจัดเรียงอิเล็กตรอนที่ระดับพลังงานเดียวกัน ซึ่งจะปรากฏออกมาเป็นเส้นสเปกตรัมหนึ่งเส้น อันตรกิริยาระหว่างสนามแม่เหล็กกับอะตอมจะทำให้การจัดเรียงอิเล็กตรอนนี้เคลื่อนไปที่ระดับพลังงานระดับอื่น ส่งผลให้มีเส้นสเปกตรัมหลายเส้น[86] การที่มีสนามไฟฟ้าภายนอกนี้สามารถทำให้เกิดการแยกตัวและการเคลื่อนตัวของเส้นสเปกตรัมที่เปรียบเทียบกันได้โดยการดัดแปลงระดับพลังงานของอิเล็กตรอน ปรากฏการณ์นี้เรียกว่า ปรากฏการณ์สตาร์ค (Stark effect)[87]
ถ้าอิเล็กตรอนใต้แรงดึงดูดอยู่ในสภาวะกระตุ้น โฟตอนที่มีพลังงานเหมาะสมสามารถเปล่งแสงด้วยระดับพลังงานที่ตรงกัน การจะเกิดเหตุการณ์เช่นนี้ อิเล็กตรอนต้องลดระดับพลังงานลงไปยังสภาวะที่ต่ำกว่าที่ทำให้มีความแตกต่างของระดับพลังงานเท่ากับพลังงานของโฟตอนที่อยู่ในภาวะกระตุ้น โฟตอนที่เปล่งแสงออกมากับโฟตอนในสภาวะกระตุ้นจะเคลื่อนตัวออกโดยขนานกันและด้วยเฟสที่ตรงกัน นั่นก็คือรูปแบบของคลื่นของโฟตอนทั้งสองนั้นสอดประสานกันพอดี คุณสมบัติทางกายภาพเช่นนี้ใช้ในการสร้างเลเซอร์ ซึ่งสามารถเปล่งลำแสงเชื่อมต่อกันของพลังงานแสงภายในแถบความถี่แคบ ๆ แถบหนึ่ง[88]
พฤติกรรมของเวเลนซ์และแรงยึดเหนี่ยว[แก้]
วงโคจรอิเล็กตรอนชั้นนอกสุดของอะตอมในสภาวะที่ไม่ได้รวมกัน รู้จักกันในชื่อว่า วงโคจรเวเลนซ์ อิเล็กตรอนที่อยู่ในวงโคจรนี้จะเรียกชื่อว่า เวเลนซ์อิเล็กตรอน จำนวนของเวเลนซ์อิเล็กตรอนหาได้จากพฤติกรรมของแรงยึดเหนี่ยวกับอะตอมอื่น ๆ เพราะอะตอมมีแนวโน้มจะเกิดปฏิกิริยาทางเคมีกับอะตอมอื่น ๆ ในลักษณะที่คอยเติมเต็ม (หรือทำให้ว่าง) วงโคจรเวเลนซ์ชั้นนอกสุด[89] ตัวอย่างเช่น การเคลื่อนย้ายอิเล็กตรอนเดี่ยวระหว่างอะตอมเป็นการประมาณการที่มีประโยชน์สำหรับพันธะที่เกิดขึ้นระหว่างอะตอมที่มีอิเล็กตรอนในวงโคจรเกินมา 1 ตัว กับอีกอะตอมหนึ่งที่ขาดอิเล็กตรอนในวงโคจรไป 1 ตัว ซึ่งเป็นสิ่งที่เกิดขึ้นในสารประกอบโซเดียมคลอไรด์ และเกลือไอออนทางเคมีอื่น ๆ อย่างไรก็ดี ธาตุหลายชนิดปรากฏว่ามีเวเลนซ์หลายตัว หรือมีแนวโน้มที่จะมีจำนวนอิเล็กตรอนในสารประกอบที่แตกต่างกันเป็นจำนวนไม่เท่ากัน ดังนั้นพันธะเคมีระหว่างธาตุเหล่านี้จึงทำให้เกิดการแลกเปลี่ยนอิเล็กตรอนหลายรูปแบบซึ่งมีการเคลื่อนย้ายอิเล็กตรอนมากกว่า 1 ตัว ตัวอย่างเหล่านี้รวมไปถึงธาตุคาร์บอนและสารประกอบอินทรีย์อื่น ๆ [90]
ธาตุเคมีมักจะปรากฏตัวในตารางธาตุ ซึ่งวางตำแหน่งตามคุณสมบัติทางเคมีที่ปรากฏ ธาตุที่มีจำนวนเวเลนซ์อิเล็กตรอนเป็นเลขเดียวกันจะจับกลุ่มรวมกันแสดงในแนวดิ่งในตาราง หรืออยู่ในคอลัมน์เดียวกัน (ส่วนแถวแนวนอนสื่อถึงการเติมวงโคจรควอนตัมของอิเล็กตรอน) ธาตุที่อยู่ทางขวาของตารางจะมีอิเล็กตรอนในวงโคจรชั้นนอกอย่างสมบูรณ์ ทำให้มันมีลักษณะเฉื่อยในทางเคมี รู้จักกันในชื่อ แก๊สมีสกุล[91][92]
สถานะ[แก้]

จำนวนอะตอมที่พบในสถานะต่าง ๆ ของสสาร ขึ้นอยู่กับเงื่อนไขทางกายภาพของสสารนั้น ๆ เช่น อุณหภูมิและความดัน เมื่อแปรเงื่อนไขเหล่านี้ สสารนั้นก็สามารถเปลี่ยนสภาพไประหว่างของแข็ง ของเหลว ก๊าซ และพลาสมา[93] ในสถานะหนึ่ง ๆ สสารสามารถดำรงอยู่ในสภาพที่แตกต่างกันก็ได้ ตัวอย่างของกรณีนี้เช่น คาร์บอน ซึ่งสามารถดำรงอยู่ได้ทั้งในรูปของแกรไฟต์ หรือเพชร[94]
เมื่ออุณหภูมิมีค่าเข้าใกล้ศูนย์องศาสัมบูรณ์ อะตอมจะเกิดการควบแน่นของโบส-ไอน์สไตน์ ซึ่งเป็นจุดที่กลศาสตร์ควอนตัมที่ตามปกติสามารถสังเกตการณ์ได้เฉพาะในระดับอะตอมเท่านั้น เริ่มส่งผลและสามารถสังเกตการณ์ในระดับมหภาคได้[95][96] กลุ่มของอะตอมที่เย็นยิ่งยวดนี้จะมีพฤติกรรมเป็นซูเปอร์อะตอมหนึ่งเดียว ทำให้สามารถตรวจสอบคุณสมบัติพื้นฐานของพฤติกรรมทางกลศาสตร์ควอนตัมได้[97]
การตรวจจับ[แก้]

กล้องจุลทรรศน์แบบส่องกราดในอุโมงค์ คือเครื่องมือที่ใช้ในการตรวจดูพื้นผิวในระดับอะตอม อาศัยปรากฏการณ์ quantum tunneling ซึ่งยอมให้อนุภาคข้ามผ่านชั้นพลังงานที่ตามปกติแล้วจะข้ามไปไม่ได้ อุโมงค์อิเล็กตรอนในสุญญากาศระหว่างแผ่นโลหะอิเล็กโทรดสองชิ้นซึ่งมีชั้นของอะตอมสะสมอยู่ จะทำให้เกิดความหนาแน่นของกระแสในอุโมงค์จนทำให้สามารถตรวจวัดได้ การสแกนอะตอมตัวหนึ่ง (เรียกว่า tip) ขณะที่มันวิ่งผ่านอะตอมอีกตัวหนึ่ง (อะตอมตัวอย่าง) ทำให้สามารถวาดภาพการเคลื่อนที่ของ tip เทียบกับกระแสการเคลื่อนที่ของอะตอมที่แยกกัน ผลการคำนวณทำให้เราสามารถสร้างภาพจากกล้องจุลทรรศน์ scanning tunneling microscope ขึ้นมาเป็นภาพของอะตอมแต่ละอะตอมได้ ภาพเหล่านี้ช่วยยืนยันว่า ที่การกระตุ้นขนาดต่ำ ระยะห่างเฉลี่ยของวงโคจรอิเล็กตรอนจะอยู่ใกล้กับระดับพลังงานแฟร์มี ซึ่งเป็นระดับความหนาแน่นของสถานะโดยปกติ[98][99]
อะตอมอาจมีประจุขึ้นมาได้ถ้าเอาอิเล็กตรอนตัวหนึ่งออกไปเสีย ประจุไฟฟ้าจะทำให้ทิศทางการเคลื่อนที่ของอะตอมเอียงโค้งไปเมื่อเดินทางผ่านบริเวณสนามแม่เหล็ก รัศมีการโค้งไปของไอออนที่เคลื่อนที่อันเนื่องจากสนามแม่เหล็กนั้นสามารถบอกได้จากมวลของอะตอม หลักการนี้นำไปใช้ในเครื่องสเปกโตรมิเตอร์ของมวลเพื่อตรวจวัดอัตราส่วนมวลต่อประจุ (mass-to-charge ratio) ของไอออน ถ้าตัวอย่างที่ตรวจวัดมีไอโซโทปหลายตัว สเปกโตรมิเตอร์ของมวลจะสามารถระบุสัดส่วนของแต่ละไอโซโทปในตัวอย่างนั้นได้โดยการวัดความเข้มของลำไอออนแต่ละตัวที่แตกต่างกัน เทคนิคในการทำให้อะตอมระเหิดนี้รวมไปถึง inductively coupled plasma atomic emission spectroscopy (ICP-AES) และ inductively coupled plasma mass spectrometry (ICP-MS) ซึ่งทั้ง 2 วิธีนี้ใช้พลาสมาในการทำให้อะตอมตัวอย่างระเหิดเพื่อทำการวิเคราะห์[100]
สำหรับกระบวนวิธีที่เจาะจงมากกว่านี้ได้แก่ การตรวจวัดการสูญเสียพลังงานของอิเล็กตรอน (electron energy loss spectroscopy) ซึ่งจะตรวจวัดพลังงานที่สูญเสียจากลำอิเล็กตรอนภายในกล้องจุลทรรศน์อิเล็กตรอนชนิดส่องผ่านเมื่อมันทำอันตรกิริยากับอะตอมตัวอย่าง ภาพโทโมกราฟของอะตอมโพรบได้ผลลัพธ์สามมิติในระดับต่ำกว่านาโนเมตร และสามารถใช้เครื่อง time-of-flight mass spectrometry เพื่อระบุคุณสมบัติทางเคมีของอะตอมได้[101]
เราสามารถใช้สเปกตรัมของสถานะกระตุ้นของอะตอมในการวิเคราะห์องค์ประกอบอะตอมในดาวฤกษ์ที่อยู่ห่างไกลได้ แสงที่สังเกตการณ์จากดาวฤกษ์เหล่านั้นประกอบด้วยความยาวคลื่นแสงขนาดหนึ่ง ๆ ซึ่งสามารถแยกแยะออกได้โดยมีความสัมพันธ์กับการเปลี่ยนแปลงควอนตัมของอะตอมแก๊สอิสระ อาศัยหลอดปล่อยประจุที่บรรจุธาตุชนิดเดียวกันทำให้เราสามารถเลียนแบบสีแบบเดียวกันได้[102] ฮีเลียมถูกค้นพบด้วยวิธีการเช่นนี้โดยตรวจได้จากสเปกตรัมของดวงอาทิตย์เป็นเวลา 23 ปีก่อนที่จะพบมันบนโลกเสียอีก[103]
ต้นกำเนิดและสถานะปัจจุบัน[แก้]
อะตอมเป็นส่วนประกอบราว 4% ของความหนาแน่นพลังงานรวมทั้งหมดในเอกภพที่สังเกตได้ โดยมีค่าความหนาแน่นเฉลี่ยประมาณ 0.25 อะตอมต่อลูกบาศก์เมตร[104] สำหรับภายในดาราจักรเช่นทางช้างเผือกจะมีอะตอมอยู่เป็นจำนวนหนาแน่นมากกว่ามาก โดยมีความหนาแน่นของสสารในสสารระหว่างดาวระหว่าง 105 ถึง 109 อะตอม/ลบ.ม.[105] เชื่อกันว่า ดวงอาทิตย์ของเราอยู่ภายในฟองท้องถิ่นซึ่งเป็นบริเวณกลุ่มแก๊สที่มีประจุสูง ดังนั้นความหนาแน่นของบริเวณโดยรอบระบบสุริยะจึงมีเพียง 103 อะตอม/ลบ.ม.[106] ดาวฤกษ์ก่อตัวจากกลุ่มเมฆหนาแน่นในสสารระหว่างดาว และกระบวนการวิวัฒนาการของดาวฤกษ์ส่งผลให้เกิดธาตุจำนวนมากมายขึ้นในอวกาศระหว่างดาวซึ่งมีมวลหนักกว่าไฮโดรเจนกับฮีเลียม อะตอมภายในทางช้างเผือกกว่า 95% รวมตัวกันอยู่ภายในดาวฤกษ์ และมวลรวมของอะตอมคิดเป็นประมาณ 10% ของมวลดาราจักร[107] (มวลส่วนที่เหลือนั้นยังไม่เป็นที่รู้จัก เรียกกันว่า สสารมืด)[108]
การสังเคราะห์นิวเคลียส[แก้]
โปรตอนและอิเล็กตรอนที่เสถียรเกิดขึ้นหลังจากเกิดบิกแบงเพียงหนึ่งวินาที ระหว่างช่วงสามนาทีต่อมา บิกแบงนิวคลีโอซินทีสิสได้สร้างสสารส่วนใหญ่ของฮีเลียม ลิเทียม และดิวเทอเรียมขึ้นในเอกภพ และบางทีอาจรวมถึงเบอริลเลียมและโบรอนด้วย[109][110][111] อะตอมชุดแรก ๆ (ที่อิเล็กตรอนเป็นส่วนประกอบอย่างสมบูรณ์) ในทางทฤษฎีแล้วเชื่อว่าเกิดขึ้น 380,000 ปีหลังจากบิกแบง —คือยุคที่เรียกว่า recombination เมื่อเอกภพที่กำลังขยายตัวออกนั้นเย็นลงเพียงพอที่ทำให้อิเล็กตรอนสามารถเกาะติดกับนิวเคลียสได้[112] นับแต่นั้น นิวเคลียสอะตอมก็เริ่มรวมตัวเข้าในดาวฤกษ์ผ่านกระบวนการนิวเคลียร์ฟิวชันและสร้างธาตุต่าง ๆ ขึ้นไปจนถึงเหล็ก[113]
ไอโซโทปบางตัวเช่น ลิเทียม-6 เกิดขึ้นในอวกาศโดยผ่านสปอลเลชั่นของรังสีคอสมิก[114] เมื่อโปรตอนพลังงานสูงปะทะกับนิวเคลียสของอะตอม ทำให้นิวคลีออนจำนวนมากดีดตัวออกมา ธาตุที่หนักกว่าเหล็กเกิดขึ้นในมหานวดาราผ่านกระบวนการอาร์และในแขนงดาวยักษ์เชิงเส้นกำกับ ผ่านกระบวนการเอส ทั้งสองกระบวนการนี้เกี่ยวข้องกับการที่นิวเคลียสอะตอมจับนิวตรอนเอาไว้[115] ธาตุบางชนิดเช่น ตะกั่ว ส่วนใหญ่ก่อตัวขึ้นผ่านกระบวนการสลายให้กัมมันตรังสีของธาตุที่หนักกว่า[116]
โลก[แก้]
อะตอมส่วนมากที่ก่อตัวกันขึ้นเป็นโลกและสิ่งมีชีวิตที่อยู่บนโลกนั้นเกิดขึ้นจากการสลายตัวของเนบิวลาที่อยู่ในเมฆโมเลกุลเพื่อก่อตัวขึ้นเป็นระบบสุริยะ ส่วนที่เหลือเป็นผลจากการสลายตัวให้กัมมันตรังสี ส่วนประกอบที่เกี่ยวข้องกันนี้สามารถนำมาใช้เพื่อระบุถึงอายุของโลกได้[117][118] ฮีเลียมส่วนมากที่อยู่บริเวณเปลือกของโลก (ประมาณ 99% เป็นก๊าซ เช่นฮีเลียม-3 ที่มีอยู่เป็นจำนวนมหาศาล) เป็นผลที่เกิดจากการสลายปลดปล่อยอนุภาคอัลฟา[119]
มีอะตอมบางส่วนที่ตรวจพบว่าไม่ได้มีอยู่ตั้งแต่ตอนแรกกำเนิดโลก ทั้งไม่ได้เป็นผลที่เกิดจากการสลายตัวให้กัมมันตรังสี เช่น คาร์บอน-14 เกิดขึ้นอย่างต่อเนื่องจากรังสีคอสมิกในชั้นบรรยากาศ[120] อะตอมบางชนิดบนโลกถูกประดิษฐ์ขึ้น ทั้งโดยที่ตั้งใจสร้าง หรือเป็นผลพลอยได้จากการแตกตัวหรือการระเบิดของนิวเคลียร์[121][122] ในบรรดาธาตุหลังยูเรเนียม—คือพวกที่มีเลขอะตอมมากกว่า 92— มีเพียงพลูโตเนียมกับเนปจูเนียมเท่านั้นที่เกิดขึ้นบนโลกโดยธรรมชาติ[123][124] ธาตุหลังยูเรเนียมนั้นมีอายุกัมมันตรังสีสั้นกว่าอายุปัจจุบันของโลก[125] และจากปริมาณที่ตรวจได้แสดงว่าธาตุเหล่านั้นเริ่มสลายตัวมานานแล้ว มีข้อยกเว้นเพียงพลูโตเนียม-244 ซึ่งอาจจะเกิดขึ้นจากฝุ่นคอสมิก[117] ส่วนตัวประกอบอื่นของพลูโตเนียมและเนปจูเนียมนั้นเกิดขึ้นจากการจับตัวของนิวตรอนในแร่ยูเรเนียม[126]
โลกมีอะตอมอยู่ประมาณ 1.33×1050 อะตอม[127] ในชั้นบรรยากาศของดาว มีอะตอมอิสระของก๊าซเฉื่อยอยู่บ้างเล็กน้อย เช่น อาร์กอน และ นีออน ส่วนที่เหลือ 99% ของบรรยากาศจะอยู่ในรูปของโมเลกุล ซึ่งรวมไปถึงคาร์บอนไดออกไซด์ ออกซิเจนโมเลกุลคู่ และไนโตรเจน ที่พื้นผิวของโลก อะตอมรวมตัวกันเข้าเป็นสารประกอบหลายชนิด รวมถึง น้ำ เกลือ ซิลิเกต และออกไซด์ อะตอมสามารถรวมตัวกันกลายเป็นสสารใหม่ซึ่งไม่ได้ประกอบด้วยโมเลกุลที่แยกจากกันก็ได้ เช่นคริสตัล และโลหะที่เป็นของเหลวหรือของแข็ง[128][129]
รูปแบบที่พบได้ยาก และที่มีแต่ในทฤษฎี[แก้]
ขณะที่ทราบกันดีว่า ไอโซโทปซึ่งมีเลขอะตอมสูงกว่าตะกั่ว (82) นั้นเป็นสารกัมมันตรังสี แต่ก็มีแนวคิด "เกาะแห่งความเสถียร" สำหรับธาตุจำนวนหนึ่งที่มีเลขอะตอมสูงกว่า 103 ธาตุหนักมากเหล่านี้อาจมีนิวเคลียสที่ค่อนข้างเสถียรมากกว่าเมื่อเทียบกับสารสลายกัมมันตรังสี[130] ธาตุที่มีแนวโน้มว่าจะเป็นอะตอมธาตุหนักมากที่เสถียร คือ อูนไบเฮกเซียม ซึ่งมีโปรตอน 126 ตัวและนิวตรอน 184 ตัว [131]
อนุภาคแต่ละตัวของสสารจะมีปฏิสสารที่คู่กันเสมอโดยมีประจุไฟฟ้าที่ตรงกันข้าม ดังนั้น โพสิตรอนก็คือแอนติอิเล็กตรอนที่มีประจุเป็นบวก และแอนติโปรตอนก็เทียบเท่ากับโปรตอนที่มีประจุเป็นลบ เมื่อสสารกับปฏิสสารของมันมาพบกัน ก็จะทำลายล้างกันและกัน ด้วยเหตุนี้ประกอบกับความไม่สมดุลระหว่างจำนวนของสสารและปฏิสสาร เราจึงพบปฏิสสารในเอกภพได้ยากมาก (สาเหตุที่มีสสารกับปฏิสสารไม่สมดุลกันนั้นยังไม่เป็นที่เข้าใจกันนัก แม้ว่าทฤษฎีแบริโอเจเนซิสจะช่วยเสนอคำอธิบายได้บ้าง) เราจึงไม่สามารถพบอะตอมของปฏิสสารได้ในธรรมชาติ[132][133] อย่างไรก็ดี ในปี ค.ศ. 1996 ห้องทดลอง CERN ในเจนีวา ได้สังเคราะห์แอนติไฮโดรเจนซึ่งเป็นปฏิสสารตรงข้ามกับไฮโดรเจนขึ้นได้สำเร็จ[134][135]
อะตอมประหลาดอื่น ๆ ถูกสร้างขึ้นโดยการแทนที่โปรตอน นิวตรอน หรืออิเล็กตรอนตัวใดตัวหนึ่งด้วยอนุภาคอื่นที่มีประจุเดียวกัน ตัวอย่างเช่น การแทนที่อิเล็กตรอนด้วยมิวออนซึ่งมีมวลมากกว่า ทำให้เกิดอะตอมมิวออนิกขึ้น อะตอมจำพวกนี้สามารถใช้ทดสอบการทำนายพื้นฐานทางฟิสิกส์ได้[136][137][138]
ดูเพิ่ม[แก้]
หมายเหตุ[แก้]
- ↑ ไอโซโทปส่วนมากมีนิวคลีออนมากกว่าอิเล็กตรอน ในกรณีของ ไฮโดรเจน-1 ซึ่งมีอิเล็กตรอนและนิวคลีออนเดี่ยวอย่างละ 1 ตัว มีโปรตอนอยู่ , หรือ 99.95% ของมวลอะตอมทั้งหมด
- ↑ หนึ่งกะรัตเท่ากับ 200 มิลลิกรัมตามนิยาม คาร์บอน-12 มีมวล 0.012 กก.ต่อโมล เลขอาโวกาโดรเท่ากับ 6×1023 อะตอมต่อโมล
อ้างอิง[แก้]
- ↑ พจนานุกรมฉบับราชบัณฑิตยสถาน พ.ศ. ๒๕๕๔
- ↑ Leigh, G. J., บ.ก. (1990). International Union of Pure and Applied Chemistry, Commission on the Nomenclature of Inorganic Chemistry, Nomenclature of Organic Chemistry - Recommendations 1990. Oxford: Blackwell Scientific Publications. p. 35. ISBN 0-08-022369-9.
An atom is the smallest unit quantity of an element that is capable of existence whether alone or in chemical combination with other atoms of the same or other elements.
- ↑ Haubold, Hans; Mathai, A.M. (1998). "Microcosmos: From Leucippus to Yukawa". Structure of the Universe. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-10-01. สืบค้นเมื่อ 2008-01-17.
- ↑ Harrison (2003:123–139).
- ↑ Siegfried (2002:42–55).
- ↑ "Lavoisier's Elements of Chemistry". Elements and Atoms. Le Moyne College, Department of Chemistry. สืบค้นเมื่อ 2007-12-18.
- ↑ Wurtz (1881:1–2).
- ↑ Dalton (1808).
- ↑ Patterson, Elizabeth C. (1970). John Dalton and the Atomic Theory. Garden City, New York: Anchor.
- ↑ Einstein, Albert (1905). "Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen" (PDF). Annalen der Physik (ภาษาเยอรมัน). 322 (8): 549–560. doi:10.1002/andp.19053220806. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2007-07-18. สืบค้นเมื่อ 2007-02-04.
- ↑ Mazo (2002:1–7).
- ↑ Lee, Y.K.; Hoon, K. (1995). "Brownian Motion". Imperial College. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-12-18. สืบค้นเมื่อ 2007-12-18.
- ↑ Patterson, G. (2007). "Jean Perrin and the triumph of the atomic doctrine". Endeavour. 31 (2): 50–53. doi:10.1016/j.endeavour.2007.05.003.
- ↑ "IUPAC article on periodic table". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-02-13. สืบค้นเมื่อ 2010-04-29.
- ↑ "J.J. Thomson". Nobel Foundation. 1906. สืบค้นเมื่อ 2007-12-20.
- ↑ Rutherford, E. (1911). "The Scattering of α and β Particles by Matter and the Structure of the Atom" (PDF). Philosophical Magazine. 21: 669–88.[ลิงก์เสีย]
- ↑ "Frederick Soddy, The Nobel Prize in Chemistry 1921". Nobel Foundation. สืบค้นเมื่อ 2008-01-18.
- ↑ Thomson, Joseph John (1913). "Rays of positive electricity". Proceedings of the Royal Society. A 89: 1–20.
- ↑ Stern, David P. (16 May 2005). "The Atomic Nucleus and Bohr's Early Model of the Atom". NASA/Goddard Space Flight Center. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-08-20. สืบค้นเมื่อ 2007-12-20.
- ↑ Bohr, Neils (11 December 1922). "Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture". Nobel Foundation. สืบค้นเมื่อ 2008-02-16.
- ↑ Lewis, Gilbert N. (1916). "The Atom and the Molecule". Journal of the American Chemical Society. 38 (4): 762–786. doi:10.1021/ja02261a002.
- ↑ Scerri (2007:205–226)
- ↑ Langmuir, Irving (1919). "The Arrangement of Electrons in Atoms and Molecules". Journal of the American Chemical Society. 41 (6): 868–934. doi:10.1021/ja02227a002.
- ↑ Scully, Marlan O.; Lamb, Willis E.; Barut, Asim (1987). "On the theory of the Stern-Gerlach apparatus". Foundations of Physics. 17 (6): 575–583. doi:10.1007/BF01882788.
- ↑ Brown, Kevin (2007). "The Hydrogen Atom". MathPages. สืบค้นเมื่อ 2007-12-21.
- ↑ Harrison, David M. (2000). "The Development of Quantum Mechanics". University of Toronto. สืบค้นเมื่อ 2007-12-21.
- ↑ Aston, Francis W. (1920). "The constitution of atmospheric neon". Philosophical Magazine. 39 (6): 449–55.
- ↑ Chadwick, James (12 December 1935). "Nobel Lecture: The Neutron and Its Properties". Nobel Foundation. สืบค้นเมื่อ 2007-12-21.
- ↑ "Otto Hahn, Lise Meitner and Fritz Strassmann". Chemical Achievers: The Human Face of the Chemical Sciences. Chemical Heritage Foundation. สืบค้นเมื่อ 2009-09-15.
- ↑ Meitner, Lise; Frisch, Otto Robert (1939). "Disintegration of uranium by neutrons: a new type of nuclear reaction". Nature. 143: 239. doi:10.1038/143239a0.
- ↑ Schroeder, M. "Lise Meitner - Zur 125. Wiederkehr Ihres Geburtstages" (ภาษาเยอรมัน). คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-07-19. สืบค้นเมื่อ 2009-06-04.
- ↑ Crawford, E.; Sime, Ruth Lewin; Walker, Mark (1997). "A Nobel tale of postwar injustice". Physics Today. 50 (9): 26–32. doi:10.1063/1.881933. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-03-07. สืบค้นเมื่อ 2010-05-02.
- ↑ Kullander, Sven (28 August 2001). "Accelerators and Nobel Laureates". Nobel Foundation. สืบค้นเมื่อ 2008-01-31.
- ↑ "The Nobel Prize in Physics 1990". Nobel Foundation. 17 October 1990. สืบค้นเมื่อ 2008-01-31.
- ↑ Demtröder (2002:39–42).
- ↑ Woan (2000:8).
- ↑ MacGregor (1992:33–37).
- ↑ Particle Data Group (2002). "The Particle Adventure". Lawrence Berkeley Laboratory. สืบค้นเมื่อ 2007-01-03.
- ↑ Schombert, James (April 18, 2006). "Elementary Particles". University of Oregon. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-08-30. สืบค้นเมื่อ 2007-01-03.
- ↑ Jevremovic (2005:63).
- ↑ Pfeffer (2000:330–336).
- ↑ Wenner, Jennifer M. (October 10, 2007). "How Does Radioactive Decay Work?". Carleton College. สืบค้นเมื่อ 2008-01-09.
- ↑ 43.0 43.1 43.2 Raymond, David (April 7, 2006). "Nuclear Binding Energies". New Mexico Tech. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2002-12-01. สืบค้นเมื่อ 2007-01-03.
- ↑ Mihos, Chris (July 23, 2002). "Overcoming the Coulomb Barrier". Case Western Reserve University. สืบค้นเมื่อ 2008-02-13.
- ↑ Staff (March 30, 2007). "ABC's of Nuclear Science". Lawrence Berkeley National Laboratory. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2006-12-05. สืบค้นเมื่อ 2007-01-03.
- ↑ Makhijani, Arjun; Saleska, Scott (March 2, 2001). "Basics of Nuclear Physics and Fission". Institute for Energy and Environmental Research. สืบค้นเมื่อ 2007-01-03.
- ↑ Shultis et al. (2002:72–6).
- ↑ Fewell, M. P. (1995). "The atomic nuclide with the highest mean binding energy". American Journal of Physics. 63 (7): 653–58. doi:10.1119/1.17828. สืบค้นเมื่อ 2007-02-01.
- ↑ Mulliken, Robert S. (1967). "Spectroscopy, Molecular Orbitals, and Chemical Bonding". Science. 157 (3784): 13–24. doi:10.1126/science.157.3784.13. PMID 5338306.
- ↑ 50.0 50.1 Brucat, Philip J. (2008). "The Quantum Atom". University of Florida. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2006-12-07. สืบค้นเมื่อ 2007-01-04.
- ↑ Manthey, David (2001). "Atomic Orbitals". Orbital Central. สืบค้นเมื่อ 2008-01-21.
- ↑ Herter, Terry (2006). "Lecture 8: The Hydrogen Atom". Cornell University. สืบค้นเมื่อ 2008-02-14.
- ↑ Bell, R. E.; Elliott, L. G. (1950). "Gamma-Rays from the Reaction H1 (n, γ) D2 and the Binding Energy of the Deuteron". Physical Review. 79 (2): 282–285. doi:10.1103/PhysRev.79.282.
- ↑ Smirnov (2003:249–72).
- ↑ Matis, Howard S. (August 9, 2000). "The Isotopes of Hydrogen". Guide to the Nuclear Wall Chart. Lawrence Berkeley National Lab. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-12-18. สืบค้นเมื่อ 2007-12-21.
- ↑ Weiss, Rick (October 17, 2006). "Scientists Announce Creation of Atomic Element, the Heaviest Yet". Washington Post. สืบค้นเมื่อ 2007-12-21.
- ↑ 57.0 57.1 Sills (2003:131–134).
- ↑ Dumé, Belle (April 23, 2003). "Bismuth breaks half-life record for alpha decay". Physics World. สืบค้นเมื่อ 2007-12-21.
- ↑ Lindsay, Don (July 30, 2000). "Radioactives Missing From The Earth". Don Lindsay Archive. สืบค้นเมื่อ 2007-05-23.
- ↑ 60.0 60.1 CRC Handbook (2002).
- ↑ 61.0 61.1 Mills et al. (1993).
- ↑ Chieh, Chung (January 22, 2001). "Nuclide Stability". University of Waterloo. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-08-30. สืบค้นเมื่อ 2007-01-04.
- ↑ "Atomic Weights and Isotopic Compositions for All Elements". National Institute of Standards and Technology. สืบค้นเมื่อ 2007-01-04.
- ↑ Audi, G. (2003). "The Ame2003 atomic mass evaluation (II)". Nuclear Physics A. 729: 337–676. doi:10.1016/j.nuclphysa.2003.11.003. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-09-16. สืบค้นเมื่อ 2008-02-07.
- ↑ Shannon, R. D. (1976). "Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides". Acta Crystallographica, Section a. 32: 751. doi:10.1107/S0567739476001551. สืบค้นเมื่อ 2007-01-03.
- ↑ Dong, Judy (1998). "Diameter of an Atom". The Physics Factbook. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-08-21. สืบค้นเมื่อ 2007-11-19.
- ↑ Zumdahl (2002).
- ↑ Bethe, H. (1929). "Termaufspaltung in Kristallen". Annalen der Physik, 5. Folge. 3: 133.
- ↑ Birkholz, M.; Rudert, R. (2008). "Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions" (PDF). physica status solidi b. 245: 1858. doi:10.1002/pssb.200879532.
- ↑ Staff (2007). "Small Miracles: Harnessing nanotechnology". Oregon State University. สืบค้นเมื่อ 2007-01-07.—describes the width of a human hair as 105 nm and 10 carbon atoms as spanning 1 nm.
- ↑ Padilla et al. (2002:32) —"There are 2,000,000,000,000,000,000,000 (that's 2 sextillion) atoms of oxygen in one drop of water—and twice as many atoms of hydrogen."
- ↑ Feynman (1995).
- ↑ 73.0 73.1 "Radioactivity". Splung.com. สืบค้นเมื่อ 2007-12-19.
- ↑ L'Annunziata (2003:3–56).
- ↑ Firestone, Richard B. (May 22, 2000). "Radioactive Decay Modes". Berkeley Laboratory. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2006-09-29. สืบค้นเมื่อ 2007-01-07.
- ↑ Hornak, J. P. (2006). "Chapter 3: Spin Physics". The Basics of NMR. Rochester Institute of Technology. สืบค้นเมื่อ 2007-01-07.
- ↑ 77.0 77.1 Schroeder, Paul A. (February 25, 2000). "Magnetic Properties". University of Georgia. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-04-29. สืบค้นเมื่อ 2007-01-07.
- ↑ Goebel, Greg (September 1, 2007). "[4.3] Magnetic Properties of the Atom". Elementary Quantum Physics. In The Public Domain website. สืบค้นเมื่อ 2007-01-07.
- ↑ Yarris, Lynn (Spring 1997). "Talking Pictures". Berkeley Lab Research Review. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-01-13. สืบค้นเมื่อ 2008-01-09.
- ↑ Liang and Haacke (1999:412–26).
- ↑ Zeghbroeck, Bart J. Van (1998). "Energy levels". Shippensburg University. เก็บจากแหล่งเดิมเมื่อ 2005-01-15. สืบค้นเมื่อ 2007-12-23.
- ↑ Fowles (1989:227–233).
- ↑ Martin, W. C.; Wiese, W. L. (2007). "Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas". National Institute of Standards and Technology. สืบค้นเมื่อ 2007-01-08.
- ↑ "Atomic Emission Spectra — Origin of Spectral Lines". Avogadro Web Site. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2006-02-28. สืบค้นเมื่อ 2006-08-10.
- ↑ Fitzpatrick, Richard (February 16, 2007). "Fine structure". University of Texas at Austin. สืบค้นเมื่อ 2008-02-14.
- ↑ Weiss, Michael (2001). "The Zeeman Effect". University of California-Riverside. สืบค้นเมื่อ 2008-02-06.
- ↑ Beyer (2003:232–236).
- ↑ Watkins, Thayer. "Coherence in Stimulated Emission". San José State University. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-08-21. สืบค้นเมื่อ 2007-12-23.
- ↑ Reusch, William (July 16, 2007). "Virtual Textbook of Organic Chemistry". Michigan State University. สืบค้นเมื่อ 2008-01-11.
- ↑ "Covalent bonding – Single bonds". chemguide. 2000.
- ↑ Husted, Robert (December 11, 2003). "Periodic Table of the Elements". Los Alamos National Laboratory. สืบค้นเมื่อ 2008-01-11.
- ↑ Baum, Rudy (2003). "It's Elemental: The Periodic Table". Chemical & Engineering News. สืบค้นเมื่อ 2008-01-11.
- ↑ Goodstein 2002, pp. 436–438.
- ↑ Brazhkin, Vadim V. (2006). "Metastable phases, phase transformations, and phase diagrams in physics and chemistry". Physics-Uspekhi. 49 (7): 719–24. doi:10.1070/PU2006v049n07ABEH006013.
- ↑ Myers 2003, p. 85.
- ↑ Staff (October 9, 2001). "Bose-Einstein Condensate: A New Form of Matter". National Institute of Standards and Technology. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-01-03. สืบค้นเมื่อ 2008-01-16.
- ↑ Colton, Imogen; Fyffe, Jeanette (February 3, 1999). "Super Atoms from Bose-Einstein Condensation". The University of Melbourne. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-08-29. สืบค้นเมื่อ 2008-02-06.
- ↑ Jacox, Marilyn; Gadzuk, J. William (1997). "Scanning Tunneling Microscope". National Institute of Standards and Technology. สืบค้นเมื่อ 2008-01-11.
- ↑ "The Nobel Prize in Physics 1986". The Nobel Foundation. สืบค้นเมื่อ 2008-01-11.—in particular, see the Nobel lecture by G. Binnig and H. Rohrer.
- ↑ Jakubowski, N.; Moens, Luc; Vanhaecke, Frank (1998). "Sector field mass spectrometers in ICP-MS". Spectrochimica Acta Part B: Atomic Spectroscopy. 53 (13): 1739–1763. Bibcode:1998AcSpe..53.1739J. doi:10.1016/S0584-8547(98)00222-5.
- ↑ Müller, Erwin W.; Panitz, John A.; McLane, S. Brooks (1968). "The Atom-Probe Field Ion Microscope". Review of Scientific Instruments. 39 (1): 83–86. Bibcode:1968RScI...39...83M. doi:10.1063/1.1683116.
- ↑ Lochner, Jim; Gibb, Meredith; Newman, Phil (April 30, 2007). "What Do Spectra Tell Us?". NASA/Goddard Space Flight Center. สืบค้นเมื่อ 2008-01-03.
- ↑ Winter, Mark (2007). "Helium". WebElements. สืบค้นเมื่อ 2008-01-03.
- ↑ Hinshaw, Gary (February 10, 2006). "What is the Universe Made Of?". NASA/WMAP. สืบค้นเมื่อ 2008-01-07.
- ↑ Choppin, Liljenzin & Rydberg 2001, p. 441.
- ↑ Davidsen, Arthur F. (1993). "Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission". Science. 259 (5093): 327–34. Bibcode:1993Sci...259..327D. doi:10.1126/science.259.5093.327. PMID 17832344.
- ↑ Lequeux 2005, p. 4.
- ↑ Smith, Nigel (January 6, 2000). "The search for dark matter". Physics World. สืบค้นเมื่อ 2008-02-14.
- ↑ Croswell, Ken (1991). "Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium". New Scientist (1794): 42. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-02-07. สืบค้นเมื่อ 2008-01-14.
- ↑ Copi, Craig J.; Schramm, DN; Turner, MS (1995). "Big-Bang Nucleosynthesis and the Baryon Density of the Universe". Science. 267 (5195): 192–99. arXiv:astro-ph/9407006. Bibcode:1995Sci...267..192C. doi:10.1126/science.7809624. PMID 7809624.
- ↑ Hinshaw, Gary (December 15, 2005). "Tests of the Big Bang: The Light Elements". NASA/WMAP. สืบค้นเมื่อ 2008-01-13.
- ↑ Abbott, Brian (May 30, 2007). "Microwave (WMAP) All-Sky Survey". Hayden Planetarium. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-02-13. สืบค้นเมื่อ 2008-01-13.
- ↑ Hoyle, F. (1946). "The synthesis of the elements from hydrogen". Monthly Notices of the Royal Astronomical Society. 106: 343–83. Bibcode:1946MNRAS.106..343H.
- ↑ Knauth, D. C.; Knauth, D. C.; Lambert, David L.; Crane, P. (2000). "Newly synthesized lithium in the interstellar medium". Nature. 405 (6787): 656–58. doi:10.1038/35015028. PMID 10864316.
- ↑ Mashnik, Stepan G. (2000). "On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes". arXiv:astro-ph/0008382.
- ↑ Kansas Geological Survey (May 4, 2005). "Age of the Earth". University of Kansas. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-07-05. สืบค้นเมื่อ 2008-01-14.
- ↑ 117.0 117.1 Manuel 2001, pp. 407–430, 511–519.
- ↑ Dalrymple, G. Brent (2001). "The age of the Earth in the twentieth century: a problem (mostly) solved". Geological Society, London, Special Publications. 190 (1): 205–21. doi:10.1144/GSL.SP.2001.190.01.14. สืบค้นเมื่อ 2008-01-14.
- ↑ Anderson, Don L.; Foulger, G. R.; Meibom, Anders (September 2, 2006). "Helium: Fundamental models". MantlePlumes.org. สืบค้นเมื่อ 2007-01-14.
- ↑ Pennicott, Katie (May 10, 2001). "Carbon clock could show the wrong time". PhysicsWeb. สืบค้นเมื่อ 2008-01-14.
- ↑ Yarris, Lynn (July 27, 2001). "New Superheavy Elements 118 and 116 Discovered at Berkeley Lab". Berkeley Lab. สืบค้นเมื่อ 2008-01-14.
- ↑ Diamond, H (1960). "Heavy Isotope Abundances in Mike Thermonuclear Device". Physical Review. 119 (6): 2000–04. Bibcode:1960PhRv..119.2000D. doi:10.1103/PhysRev.119.2000.
- ↑ Poston Sr., John W. (March 23, 1998). "Do transuranic elements such as plutonium ever occur naturally?". Scientific American. สืบค้นเมื่อ 2008-01-15.
- ↑ Keller, C. (1973). "Natural occurrence of lanthanides, actinides, and superheavy elements". Chemiker Zeitung. 97 (10): 522–30. OSTI 4353086.
- ↑ Zaider & Rossi 2001, p. 17.
- ↑ "Oklo Fossil Reactors". Curtin University of Technology. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-12-18. สืบค้นเมื่อ 2008-01-15.
- ↑ Weisenberger, Drew. "How many atoms are there in the world?". Jefferson Lab. สืบค้นเมื่อ 2008-01-16.
- ↑ Pidwirny, Michael. "Fundamentals of Physical Geography". University of British Columbia Okanagan. สืบค้นเมื่อ 2008-01-16.
- ↑ Anderson, Don L. (2002). "The inner inner core of Earth". Proceedings of the National Academy of Sciences. 99 (22): 13966–68. Bibcode:2002PNAS...9913966A. doi:10.1073/pnas.232565899. PMC 137819. PMID 12391308.
- ↑ Anonymous (October 2, 2001). "Second postcard from the island of stability". CERN Courier. สืบค้นเมื่อ 2008-01-14.
- ↑ Jacoby, Mitch (2006). "As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine". Chemical & Engineering News. 84 (10): 19.
- ↑ Koppes, Steve (March 1, 1999). "Fermilab Physicists Find New Matter-Antimatter Asymmetry". University of Chicago. สืบค้นเมื่อ 2008-01-14.
- ↑ Cromie, William J. (August 16, 2001). "A lifetime of trillionths of a second: Scientists explore antimatter". Harvard University Gazette. สืบค้นเมื่อ 2008-01-14.
- ↑ Hijmans, Tom W. (2002). "Particle physics: Cold antihydrogen". Nature. 419 (6906): 439–40. doi:10.1038/419439a. PMID 12368837.
- ↑ Staff (October 30, 2002). "Researchers 'look inside' antimatter". BBC News. สืบค้นเมื่อ 2008-01-14.
- ↑ Barrett, Roger (1990). "The Strange World of the Exotic Atom". New Scientist (1728): 77–115. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-12-21. สืบค้นเมื่อ 2008-01-04.
- ↑ Indelicato, Paul (2004). "Exotic Atoms". Physica Scripta. T112 (1): 20–26. arXiv:physics/0409058. Bibcode:2004PhST..112...20I. doi:10.1238/Physica.Topical.112a00020.
- ↑ Ripin, Barrett H. (1998). "Recent Experiments on Exotic Atoms". American Physical Society. สืบค้นเมื่อ 2008-02-15.
แหล่งข้อมูลอื่น[แก้]
- Francis, Eden (2002). "Atomic Size (ขนาดของอะตอม)". Clackamas Community College. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-02-04. สืบค้นเมื่อ 2007-01-09.
- Freudenrich, Craig C. "How Atoms Work (อะตอมทำงานอย่างไร)". How Stuff Works. สืบค้นเมื่อ 2007-01-09.
- "Atom:The Atom". Free High School Science Texts: Physics. Wikibooks. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2006-06-13. สืบค้นเมื่อ 2007-01-09.
- Anonymous (2007). "The atom". Science aid+. สืบค้นเมื่อ 2007-01-09.—a guide to the atom for teens.
- Anonymous (2006-01-03). "Atoms and Atomic Structure (อะตอมกับโครงสร้างอะตอม)". BBC. สืบค้นเมื่อ 2007-01-11.
- Various (2006-01-03). "Physics 2000, Table of Contents". University of Colorado. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-01-14. สืบค้นเมื่อ 2008-01-11.
- Various (2006-02-03). "What does an atom look like? (อะตอมมีหน้าตาอย่างไร)". University of Karlsruhe. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-04-17. สืบค้นเมื่อ 2008-05-12.

![{\displaystyle {\begin{smallmatrix}1.07{\sqrt[{3}]{A}}\end{smallmatrix}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b59cf1fdd4848fe1e3628c3f821741f883bf0793)
