แบคทีเรีย
| แบคทีเรีย ช่วงเวลาที่มีชีวิตอยู่: อาร์เคียน หรือก่อนหน้านั้น – ปัจจุบัน | |
|---|---|

| |
| ภาพจากกล้องจุลทรรศน์อิเล็กตรอนแสดงรูปร่างของ Escherichia coli ที่มีลักษณะเป็นแท่ง | |
| การจำแนกชั้นทางวิทยาศาสตร์ | |
| โดเมน: | แบคทีเรีย Bacteria Woese, Kandler & Wheelis, 1990[1] |
| ไฟลัม | |
| |
| ชื่อพ้อง | |
| |
แบคทีเรีย หรือ บัคเตรี (อังกฤษ: bacteria /bækˈtɪəriə/ (![]() ฟังเสียง); เอกพจน์ bacterium) เป็นเซลล์ประเภทหนึ่ง ประกอบขึ้นจากโดเมนขนาดใหญ่ของจุลชีพที่เป็นโพรแคริโอต โดยมากมีความยาวไม่กี่ไมโครเมตร แบคทีเรียมีรูปร่างที่หลากหลาย ตั้งแต่ทรงกลมไปจนถึงแบบแท่งและแบบเกลียว แบคทีเรียเป็นหนึ่งในรูปแบบแรก ๆ ของชีวิตที่ปรากฏขึ้นบนโลก และพบได้ในสิ่งแวดล้อมเกือบทุกรูปแบบ แบคทีเรียอาศัยอยู่ในดิน, แหล่งน้ำ, น้ำพุร้อนที่มีความเป็นกรด, ขยะกัมมันตรังสี[4], และชีวมณฑลส่วนลึกของแผ่นเปลือกโลก นอกจากนี้ยังดำรงความสัมพันธ์แบบอยู่ร่วมกันและแบบปรสิตกับพืชและสัตว์ แบคทีเรียส่วนมากยังไม่ถูกอธิบายคุณลักษณะ และมีเพียงร้อยละ 27 จากไฟลัมแบคทีเรียทั้งหมดที่สามารถเติบโตในห้องปฏิบัติการ[5] สาขาวิชาที่ศึกษาแบคทีเรียรู้จักกันในชื่อ แบคทีเรียวิทยา (bacteriology) อันเป็นสาขาหนึ่งของจุลชีววิทยา
ฟังเสียง); เอกพจน์ bacterium) เป็นเซลล์ประเภทหนึ่ง ประกอบขึ้นจากโดเมนขนาดใหญ่ของจุลชีพที่เป็นโพรแคริโอต โดยมากมีความยาวไม่กี่ไมโครเมตร แบคทีเรียมีรูปร่างที่หลากหลาย ตั้งแต่ทรงกลมไปจนถึงแบบแท่งและแบบเกลียว แบคทีเรียเป็นหนึ่งในรูปแบบแรก ๆ ของชีวิตที่ปรากฏขึ้นบนโลก และพบได้ในสิ่งแวดล้อมเกือบทุกรูปแบบ แบคทีเรียอาศัยอยู่ในดิน, แหล่งน้ำ, น้ำพุร้อนที่มีความเป็นกรด, ขยะกัมมันตรังสี[4], และชีวมณฑลส่วนลึกของแผ่นเปลือกโลก นอกจากนี้ยังดำรงความสัมพันธ์แบบอยู่ร่วมกันและแบบปรสิตกับพืชและสัตว์ แบคทีเรียส่วนมากยังไม่ถูกอธิบายคุณลักษณะ และมีเพียงร้อยละ 27 จากไฟลัมแบคทีเรียทั้งหมดที่สามารถเติบโตในห้องปฏิบัติการ[5] สาขาวิชาที่ศึกษาแบคทีเรียรู้จักกันในชื่อ แบคทีเรียวิทยา (bacteriology) อันเป็นสาขาหนึ่งของจุลชีววิทยา
สัตว์เกือบทุกชนิดล้วนพึ่งพาแบคทีเรียเพื่อการดำรงชีวิต เนื่องจากมีเพียงแบคทีเรียและและอาร์เคียบางชนิดที่มีเอนไซม์จำเป็นสำหรับการสร้างวิตามินบี 12 (โคบาลามิน) และส่งผ่านวิตามินนี้ทางห่วงโซ่อาหาร วิตามินบี 12 เป็นวิตามินสามารถละลายในน้ำได้ที่มีส่วนเกี่ยวข้องกับกระบวนการเมแทบอลิซึมของทุกเซลล์ในร่างกายมนุษย์, เป็นโคแฟกเตอร์ในกระบวนการสังเคราะห์ดีเอ็นเอ และกระบวนการเมแทบอลิซึมของกรดไขมันกับกรดอะมิโน วิตามินบี 12 มีความสำคัญอย่างยิ่งต่อการทำงานตามปกติของระบบประสาทผ่านบทบาทในการสังเคราะห์ไมอีลิน[6][7][8][9] ปกติมีแบคทีเรียประมาณ 40 ล้านเซลล์ในดินหนึ่งกรัม และประมาณหนึ่งล้านเซลล์ในน้ำจืดหนึ่งมิลลิลิตร ประมาณกันว่ามีแบคทีเรียประมาณ 5×1030 ตัวบนโลก[10] ทำให้เกิดมวลชีวภาพที่เป็นรองเพียงแต่พืชเท่านั้น[11] แบคทีเรียมีความจำเป็นสำหรับหลายขั้นในวัฏจักรของสารอาหาร ด้วยการนำสารอาหารกลับมาใช้ใหม่ ดังเช่นการตรึงไนโตรเจนจากชั้นบรรยากาศ วัฏจักรสารอาหารยังรวมถึงกระบวนการเน่าเปื่อย (decomposition) ของซากสิ่งมีชีวิต ซึ่งแบคทีเรียมีส่วนเกี่ยวข้องในขั้นตอนการเน่าสลาย (putrefaction) ของกระบวนการดังกล่าว[12] กลุ่มสังคมทางชีววิทยาโดยรอบปล่องน้ำร้อนและปล่องน้ำเย็นใต้ทะเลมีแบคทีเรียอิกซ์ตรีโมไฟล์ (extremophile) เป็นผู้ให้สารอาหารที่จำเป็นสำหรับการดำรงชีวิตด้วยการเปลี่ยนรูปสารประกอบที่ละลายอยู่ในน้ำ (เช่นไฮโดรเจนซัลไฟด์และมีเทน) ให้เป็นพลังงาน
ในมนุษย์และสัตว์ส่วนมากมีแบคทีเรียอาศัยอยู่ในท่อทางเดินอาหารและผิวหนังเป็นจำนวนมาก[13] แบคทีเรียส่วนใหญ่ที่อยู่ในร่างกายถูกทำให้ไร้พิษภัยโดยผลของระบบภูมิคุ้มกัน บางชนิดให้ประโยชน์ต่อร่างกาย โดยเฉพาะที่อยู่ในทางเดินอาหาร อย่างไรก็ตาม มีแบคทีเรียบางสปีชีส์เป็นเชื้อที่ก่อโรคติดเชื้อ อาทิ อหิวาตกโรค ซิฟิลิส แอนแทรกซ์ โรคเรื้อน กาฬโรคต่อมน้ำเหลือง โรคอันตรายถึงที่เกิดจากแบคทีเรียที่พบได้บ่อยคือ โรคติดเชื้อของระบบทางเดินหายใจ วัณโรคเพียงอย่างเดียวคร่าชีวิตประมาณ 2 ล้านคนในแต่ละปี ส่วนใหญ่มาจากแอฟริกาใต้สะฮารา[14] ยาปฏิชีวนะถูกใช้เพื่อรักษาการติดเชื้อแบคทีเรีย และยังมีการใช้ในภาคเกษตรกรรมอีกด้วย ทำให้แบคทีเรียดื้อยาเป็นปัญหามากยิ่งขึ้น ในภาคอุตสาหกรรม แบคทีเรียมีความสำคัญต่อการบำบัดน้ำเสียและการย่อยสลายคราบน้ำมันรั่วไหล, การผลิตชีสและโยเกิร์ตด้วยการหมัก, การนำทอง พัลลาเดียม ทองแดง และโลหะอื่น ๆ กลับมาใช้ใหม่ในอุตสาหกรรมเหมืองแร่[15]และเทคโนโลยีชีวภาพ, และการผลิตยาปฏิชีวนะกับสารเคมีอื่น ๆ[16]
ปัจจุบันแบคทีเรียถูกจัดเป็นโพรแคริโอต จากแต่เดิมที่ถือว่าเป็นพืชที่อยู่ในชั้น Schizomycetes (เห็ดราที่แบ่งตัวแบบฟิชชัน) แบคทีเรียไม่มีนิวเคลียส น้อยนักที่จะพบออร์แกเนลล์ที่มีเยื่อหุ้ม ซึ่งแตกต่างจากสัตว์และยูแคริโอตอื่น ๆ แม้เดิมคำว่า แบคทีเรีย จะหมายถึงโพรแคริโอตทุกชนิด การจำแนกชั้นทางวิทยาศาสตร์ก็ได้เปลี่ยนไปนับตั้งแต่การค้นพบในทศวรรษ 1990 ว่าโพรแคริโอตประกอบไปด้วยสองกลุ่มสิ่งมีชีวิตที่มีชื่อเรียกโดเมนว่าแบคทีเรีย และอาร์เคีย ซึ่งแตกต่างกันมาก แต่วิวัฒน์มาจากบรรพบุรุษเดียวกัน[1]
ศัพทมูลวิทยา
[แก้]คำว่า bacteria เป็นรูปพหูพจน์ของ bacterium จากภาษาละตินสมัยใหม่ ซึ่งเป็นการแปลง βακτήριον (bakterion)[17] ในภาษากรีกให้เป็นภาษาละติน ซึ่ง βακτήριον เป็นตัวบอกความเล็ก (diminutive) ของ βακτηρία (bakteria) อันแปลว่า "คทา, ไม้เท้า"[18] เนื่องจากแบคทีเรียชนิดแรกที่ถูกค้นพบมีรูปร่างเป็นแท่ง[19][20]
ต้นกำเนิดและวิวัฒนาการในช่วงแรก
[แก้]บรรพบุรุษของแบคทีเรียสมัยใหม่คือจุลชีพเซลล์เดียวที่เป็นรูปแบบแรกของชีวิตบนโลก เมื่อประมาณ 4 พันล้านปีที่แล้ว เป็นเวลากว่า 3 พันล้านปีที่สิ่งมีชีวิตส่วนใหญ่มีขนาดเล็กระดับที่มองด้วยตาเปล่าไม่เห็น และแบคทีเรียกับอาร์เคียเป็นรูปแบบเด่นของชีวิต[21][22] แม้ว่าจะมีซากดึกดำบรรพ์ของแบคทีเรีย เช่น สโตรมาโทไลต์อยู่ก็ตาม ก็ยังขาดสัณฐานวิทยาที่เด่นชัดพอสำหรับการตรวจสอบประวัติศาสตร์วิวัฒนาการของแบคทีเรีย หรือเพื่อการระบุเวลาถือกำเนิดของแบคที่เรียบางสปีชีส์ อย่างไรก็ตาม สามารถใช้การหาลำดับยีน (gene sequencing) เพื่อสร้างสายวิวัฒนาการชาติพันธุ์ของแบคทีเรียได้ ซึ่งทำให้ทราบว่าแบคทีเรียแตกออกมาจากเชื้อสายของอาร์เคีย/แบคทีเรียเป็นลำดับแรก[23] บรรพบุรุษร่วมล่าสุดของแบคทีเรียและอาร์เคียอาจเป็นไฮเพอร์เทอร์โมไฟล์ที่มีชีวิตอยู่เมื่อประมาณ 2.5 พันล้าน–พันล้านปีที่แล้ว[24][25] ชีวิตที่เก่าแก่ที่สุดบนผืนดินอาจเป็นแบคทีเรียเมื่อ 3.22 พันล้านปีที่แล้ว[26]
แบคทีเรียยังมีส่วนเกี่ยวข้องกับการแตกสายวิวัฒนาการใหญ่ครั้งที่สอง ซึ่งแบ่งแยกอาร์เคียและยูแคริโอตออกจากกัน ในเหตุการณ์นี้ ยูแคริโอตเกิดขึ้นมาจากการที่แบคทีเรียโบราณเข้าไปมีความสัมพันธ์แบบเอนโดซิมไบโอติกกับบรรพบุรุษของเซลล์ยูแคริโอต ซึ่งมีความเป็นไปได้ที่บรรพบุรุษของยูแคริโอตจะมีความสัมพันธ์กับอาร์เคีย[27][28] เหตุการณ์นี้ยังเกี่ยวข้องกับการกลืนกินอัลฟาโพรทีโอแบคทีเรียร่วมอาศัยของเซลล์ยูแคริโอตแรกเริ่ม (proto-eukaryotic cell) เพื่อพัฒนาเป็นไมโทคอนเดรียหรือไฮโดรเจโนโซม ซึ่งยังคงพบในยูแคริโอตทุกชนิด (บางครั้งอาจพบว่าลดรูปไปอย่างมาก เช่นที่พบในแบคทีเรียโบราณที่ขาดไมโทคอนเดรีย; amitocondrial protozoa) ในเวลาต่อมา ยูแคริโอตบางชนิดที่มีไมโทคอนเดรียอยู่แล้วได้กลืนกินสิ่งมีชีวิตคล้ายไซยาโนแบคทีเรียเข้าไป นำไปสู่กำเนิดของคลอโรพลาสต์ในสาหร่ายและพืช เหตุการณ์นี้เป็นที่รู้จักกันในชื่อเอนโดซิมไบโอซิสปฐมภูมิ (primary endosymbiosis)[29][30]
สัณฐานวิทยา
[แก้]
แบคทีเรียแสดงให้เห็นถึงความหลากหลายอย่างยิ่งของรูปร่างและขนาด เรียกว่า พหุสัณฐาน (morphologies) เซลล์ของแบคทีเรียมีขนาดประมาณหนึ่งในสิบของเซลล์ยูแคริโอต และมีความยาวประมาณ 0.5–5.0 ไมโครเมตร อย่างไรก็ตาม บางสปีชีส์มีขนาดใหญ่จนสามารถมองเห็นด้วยตาเปล่า เช่น Thiomargarita namibiensis ที่มีความยาวประมาณครึ่งมิลลิเมตร[31] และ Epulopiscium fishelsoni ที่ยาวถึง 0.7 มิลลิเมตร[32] หนึ่งในแบคทีเรียที่ขนาดเล็กที่สุดคือแบคทีเรียในสกุล Mycoplasma ซึ่งมีความยาวเพียง 0.3 ไมโครเมตร หรือประมาณไวรัสที่มีขนาดใหญ่ที่สุด[33] บางชนิดอาจมีขนาดเล็กกว่านี้ได้ เรียกว่า ไมโครแบคทีเรียขนาดเล็กยิ่งยวด (ultramicrobacteria) แต่ว่ายังไม่ได้รับการศึกษามากนัก[34]
สปีชีส์เกือบทั้งหมดของแบคทีเรียมีรูปทรงเป็นทั้งทรงกลม เรียกว่า ค็อกไซ (เอกพจน์: ค็อกคัส; จากภาษากรีก kókkos เมล็ดธัญพืช, เมล็ด), หรือรูปทรงท่อน เรียกว่า บาซิลไล (เอกพจน์: บาซิลลัส; จากภาษาละติน baculus ไม้ถือ)[35] แบคทีเรียบางชนิดที่เรียกว่า ไวบริโอ รูปร่างคล้ายแท่งไม้ที่มีความโค้งเล็กน้อย หรือรูปร่างเป็นเครื่องหมายจุลภาค บางชนิดมีรูปร่างเป็นเกลียว เรียกว่า สไปริลา, หรือมีการขดตัวในระดับสูง เรียกว่า สไปโรคีตส์ มีแบคทีเรียที่มีรูปร่างวิกลจำหนึ่งที่ได้รับการอธิบาย เช่นแบคทีเรียรูปดาว[36] การมีรูปทรงหลากหลายเช่นนี้ถูกกำหนดด้วยผนังเซลล์และไซโทสเกเลทอนของตัวแบคทีเรีย ซึ่งมีความสำคัญเนื่องจากการมีรูปร่างที่หลากหลายจะช่วยเสริมความสามารถของแบคทีเรียในการได้มาซึ่งสารอาหาร, การยึดติดกับพื้นผิว, การว่ายผ่านของเหลว และการหลบหนีผู้ล่า[37][38]

แบคทีเรียหลายสปีชีส์ดำรงชีวิตในรูปแบบเซลล์โดดเดี่ยว บางสปีชีส์อาศัยอยู่รวมกันเป็นแบบแผนที่มีลักษณะเฉพาะ เช่น Neisseria ที่อยู่เป็นดิพลอยด์ (คู่), Streptococcus อยู่รวมกันเป็นสายยาว, และ Staphylococcus เกาะกลุ่มกันเป็นกระจุกคล้ายพวงองุ่น แบคทีเรียยังสามารถรวมกันเพื่อสร้างโครงสร้างหลายเซลล์ที่มีขนาดใหญ่ขึ้นได้ ดังการต่อสายฟิลาเมนต์ของ Actinobacteria, การเกาะกลุ่มของ Myxobacteria, และเส้นใยไฮฟาที่ซับซ้อนของ Streptomyces[39] โครงสร้างที่ประกอบขึ้นจากหลายเซลล์เช่นนี้สามารถพบได้ในบางสภาวะ ตัวอย่างเช่น เมื่อขาดกรดอะมิโน Myxobacteria จะตรวจหาเซลล์ที่อยู่โดยรอบด้วยกระบวนการที่เรียกว่า ควอรัมเซนซิง (quorum sensing) จากนั้นจะเคลื่อนย้ายเข้ามาหากันและรวมกลุ่มกันเป็นฟรุตติงบอดี (fruiting body) ที่มีความยาวได้ถึง 500 ไมโครเมตรและประกอบขึ้นจากแบคทีเรียประมาณ 100,000 ตัว[40] ในฟรุตติงบอดี แบคทีเรียจะทำหน้าที่ต่าง ๆ แยกกัน ตัวอย่าง เซลล์ประมาณหนึ่งในสิบจะขึ้นไปสู่ยอดของฟรุตติงบอดีและมีการเปลี่ยนแปลงหน้าที่ของเซลล์ (differentiation) ไปสู่สถานะพักตัวที่เรียกว่า มิกโซสปอร์ (myxospore) ซึ่งมีความทนทานต่อการขาดน้ำและสิ่งแวดล้อมที่เป็นอันตรายอื่น ๆ สูงกว่าสถานะปกติ[41]
แบคทีเรียมักจะเกาะตัวอยู่บนพื้นผิวและเกาะเป็นกลุ่มหนาแน่นที่เรียกว่า ฟิล์มชีวภาพ (biofilm) และกลุ่มที่ใหญ่กว่าเรียกว่า พรมจุลชีพ (microbial mat) ฟิล์มชีวภาพและพรมจุลชีพมีความหนาตั้งแต่ไม่กี่ไมโครเมตรไปจนถึงครึ่งเมตร และอาจมีแบคทีเรีย, โพรทิสต์ และอาร์เคียอาศัยอยู่หลายสปีชีส์ แบคทีเรียที่อาศัยอยู่ในฟิล์มชีวภาพแสดงการจัดเรียงเซลล์และองค์ประกอบนอกเซลล์ที่มีความซับซ้อน จนกลายเป็นโครงสร้างขั้นทุติยภูมิ ดังเช่นไมโครคอลอนี (microcolony) อันปรากฏโครงข่ายของช่องเปิด เพื่อให้การแพร่สารอาหารดียิ่งขึ้น[42][43] ในสิ่งแวดล้อมตามธรรมชาติ ดังในดินหรือบนพื้นผิวของพืช แบคทีเรียส่วนใหญ่เกาะกลุ่มกันบนพืนผิวในรูปของฟิล์มชีวภาพ[44] ฟิล์มชีวภาพ ยังมีความสำคัญทางแพทยศาสตร์ เนื่องจากโครงสร้างเช่นนี้มักปรากฏในช่วงที่เกิดการติดเชื้อแบคทีเรียเรื้อรัง (chronic bacterial infection) หรือการติดเชื้อในอุปกรณ์ทางการแพทย์ที่ปลูกถ่ายเข้าไป และแบคทีเรียที่ได้รับการปกป้องจากฟิล์มชีวภาพจะกำจัดได้ยากกว่าแบคทีเรียที่อยู่โดดเดี่ยว[45]
โครงสร้างระดับเซลล์
[แก้]
โครงสร้างภายในเซลล์
[แก้]เซลล์ของแบคทีเรียถูกล้อมรอบด้วยเยื่อหุ้มเซลล์ ซึ่งประกอบด้วยฟอสโฟลิพิดเป็นหลัก เยื่อหุ้มเซลล์ห่อหุ้มสารต่าง ๆ ที่อยู่ภายในเซลล์และทำหน้าที่เป็นแนวกั้นสำหรับกักสารอาหาร โปรตีน และองค์ประกอบอื่นที่จำเป็นของไซโทพลาซึมเอาไว้ในเซลล์[46] ต่างจากเซลล์ยูแคริโอต ไซโทพลาซึมของแบคทีเรียมักขาดโครงสร้างขนาดใหญ่ที่มีเยื่อหุ้ม เช่น นิวเคลียส ไมโทคอนเดรีย คลอโรพลาสต์ และออร์แกเนลล์อื่นที่ปรากฏในเซลล์ยูแคริโอต[47] อย่างไรก็ตาม แบคทีเรียบางชนิดมีออร์แกเนลล์ที่มีโปรตีนหุ้ม (protein-bound organelle) อยู่ในไซโทพลาซึม เช่นคาร์บอกซิโซม (carboxysome)[48] ซึ่งทำให้เกิดการจัดส่วนการทำงาน (compartmentalisation) สำหรับกระบวนการเมแทบอลิซึมของแบคทีเรีย[49][50] นอกจากนี้แบคทีเรียยังมีไซโทสเกเลทอนที่มีองค์ประกอบหลายชนิด เพื่อควบคุมการจัดตำแหน่ง (localisation) ของโปรตีนและกรดนิวคลิอิกภายในเซลล์ และเพื่อจัดการกระบวนการแบ่งเซลล์[51][52][53]
ปฏิกิริยาชีวเคมีที่สำคัญ เช่นการสร้างพลังงาน เกิดขึ้นจากความลดหลั่นในความเข้มข้นระหว่างสองฝั่งของเยื่อหุ้ม ทำใหเกิดความต่างศักย์ในที่คล้ายคลึงกับแบตเตอรี การขาดเยื่อหุ้มภายใน ซึ่งเป็นปกติของแบคทีเรีย หมายความว่าปฏิกิริยาดังเช่นการขนส่งอิเล็กตรอน เกิดขึ้นที่เยื่อหุ้มเซลล์ ระหว่างไซโทพลาซึมกับภายนอกเซลล์หรือเพอริพลาซึม (periplasm)[54] อย่างไรก็ตาม แบคทีเรียที่สามารถสังเคราะห์ด้วยแสงได้หลายชนิดมีเยื่อหุ้มเซลล์ที่พับทบไปมาหลายครั้ง และกินพื้นที่ส่วนใหญ่ของเซลล์ด้วยเยื่อสำหรับรวบรวมแสง (light-gathering membrane)[55] ซึ่งโครงสร้างรวบรวมแสงนี้อาจก่อตัวเป็นโครงสร้างหุ้มด้วยลิพิดที่เรียกว่า คลอโรโซม (chlorosome) ในแบคทีเรียกำมะถันสีเขียว[56]
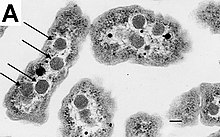
แบคทีเรียไม่มีนิวเคลียสที่มีเยื่อหุ้ม และสารพันธุกรรมมักเป็นโครโมโซมแบบวงกลมของดีเอ็นเอเพียงหนึ่งวงอยู่ภายในไซโทพลาซึมที่มีรูปร่างไม่แน่นอน เรียกว่า นิวคลีออยด์ (nucleoid)[57] นิวคลีออยด์บรรจุโครโมโซมที่มีโปรตีนมาเกาะ และอาร์เอ็นเอ ไว้ภายใน เช่นเดียวกับสิ่งมีชีวิตอื่น แบคทีเรียมีไรโบโซมสำหรับการผลิตโปรตีน แต่โครงสร้างของไรโบโซมในแบคทีเรียแตกต่างจากของยูแคริโอตและอาร์เคีย[58]
แบคทีเรียบางชนิดสร้างแกรนูลลเพื่อกักเก็บสารอาหารไว้ภายในเซลล์ เช่น ไกลโคเจน[59], โพลิฟอสเฟต[60], ซัลเฟอร์[61], หรือโพลิไฮดรอกซีอัลคาโนเอต[62] บางชนิด เช่นไซยาโนแบคทีเรียที่สามารถสังเคราะห์ด้วยแสงได้ สามารถสร้างแวคิวโอลแก๊สสำหรับควบคุมการลอยตัว ทำให้แบคทีเรียสามารถเคลื่อนที่ขึ้นหรือลงไปที่ระดับความลึกต่าง ๆ ของแหล่งน้ำ ซึ่งมีความเข้มแสงและความเข้มข้นของสารอาหารแตกต่างกันไป[63]
โครงสร้างภายนอกเซลล์
[แก้]ถัดจากเยื่อหุ้มเซลล์ออกมาคือผนังเซลล์ อันประกอบขึ้นจากเปปทิโดไกลแคน (เรียกอีกอย่างว่ามูรีน; peptidoglycan, murein) ซึ่งประกอบด้วยสายพอลิแซ็กคาไรด์ที่เชื่อมกันด้วยเพปไทด์ที่มีกรดอะมิโนแบบเด็กซ์โทร[64] ผนังเซลล์ของแบคทีเรียต่างจากของพืชและเห็ดรา ซึ่งสร้างขึ้นจากเซลลูโลสและไคทินตามลำดับ[65] นอกจากนี้ยังมีความแตกต่างจากผนังเซลล์ของอาร์เคีย ซึ่งไม่มีเพปทิโดไกลแคน ผนังเซลล์มีความสำคัญต่อการอยู่รอดของแบคทีเรียหลายชนิด ยาปฏิชีวนะเพนิซิลิน (สร้างโดยเห็ดราทีเรียกว่า Penicillium) สามารถฆ่าแบคทีเรียด้วยการยับยั้งขั้นตอนหนึ่งของการสังเคราะห์เพปทิโดไกลแคน[65]
แบคทีเรียมีผนังเซลล์สองประเภทคร่าว ๆ ซึ่งจำแนกแบคทีเรียออกเป็นแบคทีเรียแกรมบวก (Gram-positive bacteria) และแบคทีเรียแกรมลบ (Gram-negative bacteria) โดยต้นกำเนิดของชื่อมาจากปฏิกิริยาของเซลล์ที่มีต่อการย้อมสีแกรม (Gram stain) อันเป็นการทดสอบเพื่อจำแนกสปีชีส์ของแบคทีเรียที่ปฏิบัติกันมาอย่างยาวนาน[66]
แบคทีเรียแกรมบวกมีมีผนังเซลล์ที่หนา อันประกอบเพปทิโดไกลแคนและกรดเทโคอิกหลายชั้น ในทางตรงกันข้าม แบคทีเรียแกรมลบมีผนังเซลล์ที่ค่อนข้างบาง ประกอบด้วยชั้นเพปทิโดไกลแคนไม่กี่ชั้นล้อมรอบด้วยเยื่อลิพิดชั้นที่สองที่มีลิโพพอลิแซกคาไรด์และลิโพโปรตีน แบคทีเรียส่วนมากมีผนังเซลล์แบบแกรมลบ และมีเพียงแบคทีเรียในไฟลัม Firmicutes และ Actinobacteria (ซึ่งก่อนหน้านี้รู้จักกันในชื่อแบคทีเรียแกรมบวกที่มี C+G ต่ำ และ C+G สูง ตามลำดับ) ที่การจัดเรียงผนังเซลล์ผิดไปจากแบคทีเรียแกรมบวกชนิดอื่น[67] การที่แบคทีเรียมีโครงสร้างผนังเซลล์ที่หลากหลายทำให้แต่ละชนิดมีความไวต่อต่อยาปฏิชีวนะแตกต่างกัน ตัวอย่างเช่น แวนโคมัยซินสามารถฆ่าได้เพียงแบคทีเรียแกรมบวก และไม่มีประสิทธิภาพต่อเชื้อแบคทีเรียแกรมลบเช่น Haemophilus influenzae หรือ Pseudomonas aeruginosa[68] แบคทีเรียบางชนิดมีผนังเซลล์ที่ไม่สามารถจัดจำแนกได้ว่าเป็นแบบแกรมบวกหรือแบบแกรมลบ กลุ่มนี้มีแบคทีเรียที่มีความสำคัญทางคลินิกรวมอยู่ด้วย เช่น Mycobacteria ที่มีผนังเพปทิโดไกลแคนที่หนา แต่ก็มีเยื่อลิพิดที่สองมาหุ้มอีกชั้นหนึ่ง[69]
แบคทีเรียหลายชนิดมีชั้นเอส (S-layer, surface layer) เป็นโมเลกุลเป็นโปรตีนที่เรียงตัวกันอย่างแน่นหนามาปกคลุมด้านนอกเซลล์[70] ชั้นนี้ช่วยป้องกันพื้นผิวของเวลล์จากปัจจัยภายนอกเชิงกายภาพและเคมี และยังสามารถทำหน้าที่เป็นฉนวนป้องกันการแพร่ของมหโมเลกุล ชั้นเอสนี้มีหน้าที่ที่หลากหลาย เป็นต้นว่าทำหน้าที่เป็นปัจจัยก่อ่โรคใน Campylobacter และบรรจุเอนไซม์พื้นผิวใน Bacillus stearothermophilus แต่ส่วนใหญ่ยังไม่ได้รับการศึกษาอย่างเพียงพอ[71]

แฟลเจลลาเป็นโครงสร้างโปรตีนแข็งเกร็ง มีเส้นผ่านศูนย์กลาง 20 นาโนเมตร และยาวได้ถึง 20 ไมโครเมตร ใช้สำหรับการเคลื่อนที่ แฟลเจลลาถูกขับเคลื่อนโดยพลังงานที่ถูกปลดปล่อยออกมาจากการแลกเปลี่ยนไอออนไปตามระดับศักย์ไฟฟ้าเคมีระหว่างเยื่อหุ้มเซลล์[72]
ฟิมเบรีย (fimbriae) หรือ "พิไลยึดเกาะ (attachment pili)" เป็นเส้นใยละเอียดของโปรตีน มักมีเส้นผ่านศูนย์กลางประมาณ 2–10 นาโนเมตร และมีความยาวได้หลายนาโนเมตร ฟิมเบรียมีกระจายอยู่ทั่วพื้นผิวของเซลล์ และมีลักษณะคล้ายเส้นขนละเอียดเมื่อนำไปส่องดูใต้กล้องจุลทรรศน์อิเล็กตรอน เชื่อกันว่าฟิมเบรียมีส่วนเกี่ยวข้องต่อการยึดเกาะกับพื้นผิวแข็งหรือกับเซลล์อื่น และมีส่วนสำคัญต่อความรุนแรงของแบคทีเรียก่อโรคบางชนิด[73] พิไล (pili; พหูพจน์ pilus) เป็นรยางค์ในระดับเซลล์ มีขนาดใหญ่กว่าฟิมเบรียเล็กน้อย สามารถใช้เพื่อขนส่งสารพันธุกรรมระหว่างเซลล์แบคทีเรียระหว่างกระบวนที่เรียกว่าคอนจูเกชัน (conjugation) โดยมีชื่อเรียกว่า คอนจูเกชันพิไล หรือเซ็กส์พิไล (ดูที่หัวข้อพันธุศาสตร์แบคทีเรียด้านล่าง)[74] นอกจากนี้ยังสามารถทำให้เกิดการเคลื่อนไหว ซึ่งพิไลชนิดนี้จะเรียกว่า พิไลชนิด 4 (type IV pili)[75]
แบคทีเรียหลายชนิดสร้างไกลโคแคลิกซ์ขึ้นมาล้อมรอบเซลล์ ซึ่งมีความซับซ้อนของโครงสร้างแตกต่างกันไป มีตั้งแต่ชั้นเมือกของอิกซ์ตราเซลลูลาร์พอลิเมอริกซับสแตนซ์ (extracellular polymeric substance) ที่ไร้ระเบียบ ไปจนถึงแคปซูลที่มีโครงสร้างจัดตัวเป็นระเบียบ โครงสร้างเหล่านี้ช่วยปกป้องเซลล์จากการถูกเซลล์ยูแคริโอต เช่น แมโครฟาจ (ส่วนหนึ่งของระบบภูมิคุ้มกัน)[76] กลืนกิน นอกจากนี้ยังสามารถทำหน้าที่เป็นแอนติเจน (antigen), เกี่ยวข้องกับการรู้จำของเซลล์, ช่วยในการยึดเกาะกับพื้นผิว ไปจนถึงการสร้างฟิล์มชีวภาพ[77]
การประกอบหน่วยต่าง ๆ โครงสร้างภายนอกเซลล์ขึ้นอยู่กับระบบการหลั่งสารของแบคทีเรียที่มีอยู่หลายระบบ ระบบเหล่านี้ขนส่งโปรตีนจากไซโทพลาซึมออกไปยังเพอริพลาซึม หรือออกไปยังสิ่งแวดล้อมรอบเซลล์ ระบบการหลั่งหลายประเภทเป็นที่รู้จักและมักมีความสำคัญต่อศักยภาพก่อโรคของเชื้อ จึงมีการศึกษากันอย่างเข้มข้น[78]
เอนโดสปอร์
[แก้]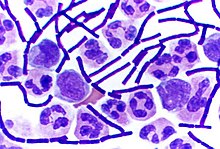
แบคทีเรียแกรมบวกบางสกุลเช่น Bacillus, Clostridium, Sporohalobacter, Anaerobacter, และ Heliobacterium สามารถสร้างโครงสร้างสำหรับพักตัวที่มีความทนทานสูง เรียกว่า เอนโดสปอร์ (endospore)[79] โดยพัฒนาขึ้นอยู่ภายในไซโทพลาซึมของเซลล์[80] ปกติหนึ่งสปอร์ต่อหนึ่งเซลล์ แต่ละเอนโดสปอร์มีแกนกลางเป็นดีเอ็นเอและไรโบโซม ล้อมรอบด้วยชั้นคอร์เทกซ์ (cortex layer) ซึ่งมีเปลือกอันประกอบขึ้นจากเพปทิโดไกลแคนและโปรตีนหลายชนิดมาหุ้มอีกชั้นหนึ่ง[80]
เอนโดสปอร์ไม่แสดงกระบวนการเมแทบอลิซึมที่สามารถตรวจพบได้ และสามารถเอาชีวิตรอดจากสิ่งกดดันทางเคมีและฟิสิกส์ในระดับสุดขั้วได้ เช่นรังสียูวีความเข้มข้นสูง, การแผ่รังสีแกมมา, สารซักฟอก, สารฆ่าเชื้อ, ความร้อน, การแช่แข็ง, ความดัน, และการทำแห้งสนิท[81] ในสภาพจำศีลเช่นนี้ แบคทีเรียสามารถมีชีวิตได้ถึงหลายล้านปี[82][83][84] เอนโดสปอร์ยังทำให้แบคทีเรียมีชีวิตรอดจากสภาวะสุญญากาศและรังสีในอวกาศ เป็นไปได้ว่าแบคทีเรียกระจายไปทั่วเอกภพด้วยฝุ่นอวกาศ, สะเก็ดดาว, ดาวเคราะห์น้อย, ดาวหาง, วัตถุคล้ายดาวเคราะห์ (planetoid), หรือผ่านกระบวนการแพนสเปอร์เมียแบบมีการกำกับ (directed panspermia)[85][86] แบคทีเรียที่สร้างเอนโดสปอร์สามารถทำให้เกิดโรคได้ ตัวอย่างเช่น แอนแทรกซ์ซึ่งเกิดจากการหายใจเอาเอนโดสปอร์ของ Bacillus anthracis เข้าสู่ร่างกาย, และบาดทะยักที่เกิดจากบาดแผลถูกแทงปนเปื้อนเอนโดสปอร์ของ Clostridium tetani[87]
เมแทบอลิซึม
[แก้]แบคทีเรียมีประเภทของวิถีเมแทบอลิซึมที่มีความหลากหลายอย่างยิ่ง[88] มีการใช้การกระจายลักษณะ (trait) ทางเมแทบอลิซึมที่พบในแบคทีเรียกลุ่มต่าง ๆ มากำหนดอนุกรมวิธานให้กับแบคทีเรียมาอย่างยาวนาน แต่ลักษณะเหล่านี้อาจไม่ตรงกับผลที่ได้จากการจัดจำแนกทางพันธุศาสตร์สมัยใหม่[89] เมแทบอลิซึมของแบคทีเรียจำแนกตามกลุ่มโภชนาการ ซึ่งตั้งอยู่บนหลักเกณฑ์สำคัญสามประการ ได้แก่ แหล่งของพลังงาน, ตัวให้อิเล็กตรอน, และแหล่งของคาร์บอนที่ใช้ในการเจริญเติบโต[90]
แบคทีเรียสามารถรับพลังงานได้จากแสงอาทิตย์ผ่านการสังเคราะห์ด้วยแสง (โฟโตทรอฟี; phototrophy) หรือจากการสลายสารประกอบด้วยกระบวนการออกซิเดชัน (เคโมทรอฟี; chemotrophy)[91] แบคทีเรียประเภทหลังใช้สารประกอบเป็นแหล่งพลังงานด้วยการถ่ายทอดอิเล็กตรอนจากตัวให้อิเล็กตรอนไปยังตัวรับอิเล็กตรอนตัวสุดท้ายในปฏิกิริยารีดอกซ์ โดยปฏิกิริยานี้จะปลดปล่อยพลังงานที่ใช้สำหรับขับเคลื่อนกระบวนการเมแทบอลิซึม แบคทีเรียเคโมทรอพยังแบ่งออกตามประเภทของสารประกอบที่ใช้ถ่ายทอดอิเล็กตรอน ซึ่งแบคทีเรียที่ใช้สารประกอบอนินทรีย์ เช่น ไฮโดรเจน, คาร์บอนมอนอกไซด์, หรือแอมโมเนียเป็นแหล่งของอิเล็กตรอน จะถูกเรียกว่า ลิโททรอพ (lithotroph) และที่ใช้สารประกอบอินทรีย์จะถูกเรียกว่า ออร์แกโนทรอพ (organotroph)[91] นอกจากนี้ยังสามารถใช้สารประกอบที่นำมารับอิเล็กตรอนมาจำแนกแบคทีเรียได้อีกด้วย โดยแบ่งเป็นแบคทีเรียที่หายใจแบบใช้ออกซิเจน (aerobic bacteria) ซึ่งใช้ออกซิเจนเป็นตัวรับอิเล็กตรอนตัวสุดท้าย และแบคทีเรียที่หายใจแบบไม่ใช้ออกซิเจน (anaerobic bacteria) ซึ่งใช้สารประกอบอื่น เช่น ไนเตรต, ซัลเฟต, หรือคาร์บอนไดออกไซด์ เป็นตัวรับอิเล็กตรอนตัวสุดท้าย[91]
แบคทีเรียจำนวนมากได้รับคาร์บอนจากแหล่งคาร์บอนอินทรีย์ (เฮเทอโรทรอฟี; heterotrophy) แบคทีเรียอื่น ๆ เช่น ไซยาโนแบคทีเรียและแบคทีเรียสีม่วงบางชนิดเป็นออโตทรอพ ซึ่งหมายความว่ารับคาร์บอนเข้ามาในเซลล์ด้วยการตรึงคาร์บอนไดออกไซด์[92] ในสถานการณ์ที่ไม่ปกติ แบคทีเรียเมทาโนทรอพ (methanotroph) สามารถใช้แก๊สมีเทนเป็นทั้งแหล่งอิเล็กตรอนและสารตั้งต้นสำหรับกระบวนการแอแนบอลิซึมของคาร์บอน[93]
| กลุ่ม | แหล่งพลังงาน | แหล่งคาร์บอน | ตัวอย่าง |
|---|---|---|---|
| โฟโตทรอพ | แสงอาทิตย์ | สารประกอบอินทรีย์ (photoheterotrophs) หรือใช้การตรึงคาร์บอน (photoautotrophs) | Cyanobacteria, Green sulfur bacteria, Chloroflexi, หรือ Purple bacteria |
| ลิโททรอพ | สารประกอบอนินทรีย์ | สารประกอบอินทรีย์ (lithoheterotrophs) หรือใช้การตรึงคาร์บอน (lithoautotrophs) | Thermodesulfobacteria, Hydrogenophilaceae, หรือ Nitrospirae |
| ออร์แกโนทรอพ | สารประกอบอินทรีย์ | สารประกอบอินทรีย์ (chemoheterotrophs) หรือใช้การตรึงคาร์บอน (chemoautotrophs) | Bacillus, Clostridium หรือ Enterobacteriaceae |
เมแทบอลิซึมของแบคทีเรียทำให้เกิดลักษณะที่เป็นประโยชน์ต่อเสถียรภาพของระบบนิเวศและสังคมมนุษย์ได้หลากหลายวิธี ตัวอย่างเช่นแบคทีเรียที่สามารถตรึงแก๊สไนโตรเจนได้โดยใช้เอนไซม์ไนโตรเจนีส ลักษณะที่มีความสำคัญต่อระบบนิเวศเช่นนี้สามารถพบได้ในแบคทีเรียในกลุ่มที่กล่าวไว้ข้างต้นเกือบทุกกลุ่ม[94] ทำให้เกิดกระบวนการที่สำคัญ คือ ดีไนตริฟิเคชัน, การรีดิวซ์ซัลเฟต, และการสังเคราะห์อะซีโตน ตามลำดับ[95][96] กระบวนการทางเมแทบอลิซึมของแบคทีเรียยังมีความสำคัญในการตอบสนองทางชีวภาพต่อมลพิษ ตัวอย่างเช่น แบคทีเรียรีดิวซ์ซัลเฟตที่มีส่วนสำคัญต่อการสร้างฟอร์มที่มีความเป็นพิษสูงของปรอท (methyl- และ dimethylmercury) ในสิ่งแวดล้อม[97] แบคทีเรียที่หายใจแบบไม่ใช้ออกซิเจนใช้การหมักเพื่อสร้างพลังงานและกำลังในการรีดิวซ์ และขับผลพลอยได้จากกระบวนการเมเแทบอซึม (เช่นเอทานอลในการกลั่นเหล้า) ออกมาเป็นของเสีย แบคทีเรียที่เจริญได้ทั้งที่มีและไม่มีอากาศ (facultative anaerobe) สามารถสลับไปมาระหว่างการหมักและตัวรับอิเล็กตรอนตัวสุดท้ายตัวอื่น ขึ้นอยู่กับสภาวะทางสิ่งแวดล้อมที่มันประสบ[98]
การเติบโตและการสืบพันธุ์
[แก้]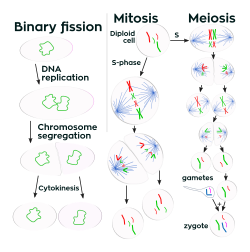
ในสิ่งมีชีวิตเซลล์เดียว การเพิ่มขนาดของเซลล์ (กล่าวคือการเจริญเติบโตของเซลล์) มีความเชื่อมโยงกับการสืบพันธุ์ด้วยการแบ่งเซลล์ ซึ่งต่างจากสิ่งมีชีวิตหลายเซลล์ แบคทีเรียจะเติบโตจนถึงขนาดที่ตายตัวขนาดหนึ่ง จากนั้นจะสืบพันธุ์ด้วยการแบ่งตัวออกเป็นสอง ซึ่งเป็นการสืบพันธุ์แบบไม่อาศัยเพศรูปแบบหนึ่ง[99] แบคทีเรียสามารถเติบโตและแบ่งตัวได้อย่างรวดเร็วหากว่าอยู่ใต้เงื่อนไขที่เหมาะสม และจำนวนประชากรอาจเพิ่มเป็นทวีคูณทุก ๆ 9.8 นาที[100] ซึ่งในการแบ่งเซลล์จะได้ผลเป็นเซลล์ลูกสองเซลล์ที่เหมือนกันทุกประการ แบคทีเรียบางชนิดแม้จะสืบพันธุ์แบบไม่อาศัยเพศ แต่ก็สร้างโครงสร้างสำหรับการสืบพันธุ์ที่มีความซับซ้อน ซึ่งช่วยกระจายเซลล์ที่สร้างขึ้นมาออกไป ตัวอย่างเช่นการสร้างฟรุตติงบอดีของ Myxobacteria และการสร้างเส้นใยไฮฟาที่ชี้ขึ้นสู่อากาศของ Streptomyces, หรือการแตกหน่อ ซึ่งเป็นการที่เซลล์ยื่นส่วนหนึ่งออกมาและหลุดเป็นเซลล์ลูก[101]

ในห้องปฏิบัติการเลี้ยงแบคทีเรียโดยใช้อาหารเลี้ยงเชื้อแบบหรือแบบเหลว อาหารแบบแข็งเช่นเพลทวุ้น (agar plate) ใช้เพื่อแยกเชื้อให้บริสุทธิ์ อาหารเลี้ยงเชื้อแบบเหลวใช้เมื่อต้องการวัดการเจริญเติบโตหรือเมื่อต้องการเพาะเชื้อในปริมาณมาก แบคทีเรียที่เพาะในอาหารเลี้ยงเชื้อเหลวที่มีการคน (stirred liquid media) จะเจริญเติบโตในรูปแบบสารแขวนลอยที่กระจายตัวทั่วภาชนะ ทำให้ง่ายต่อการแบ่งและย้ายเชื้อที่เพาะเลี้ยง อย่างไรก็ตามการแยกเชื้อแบคทีเรียจากอาหารเลี้ยงเชื้อแบบเหลวถือว่าทำได้ยาก อาหารสำหรับคัดแยกเชื้อ (selective media; อาหารเลี้ยงเชื้อที่เติมหรือปราศจากสารอาหารบางอย่าง หรือเติมยาปฏิชีวนะลงไป) สามารถใช้ระบุชนิดของแบคทีเรียได้[103]
เทคนิคส่วนใหญ่ที่ใช้เพาะเลี้ยงแบคทีเรียในห้องปฏิบัติการใช้สารอาหารในปริมาณมากเพื่อให้ได้เซลล์ในปริมาณมากในเวลาอันสั้นและประหยัดค่าใช้จ่าย อย่างไรก็ตาม สารอาหารมีจำกัดในสภาพแวดล้อมตามธรรมชาติ ทำให้แบคทีเรียไม่สามารถเพิ่มจำนวนได้อย่างไม่สิ้นสุด สารอาหารที่มีจำกัดเป็นตัวชี้นำกลยุทธ์วิวัฒนาการของแบคทีเรีย (โปรดดู ทฤษฎีการคัดเลือก r/K) บางชนิดสามารถเติบโตได้อย่างรวดเร็วเมื่อมีสารอาหาร เช่นปรากฏการณ์สาหร่ายสะพรั่ง (algal bloom) ที่มักเกิดขึ้นในทะเลสาบช่วงฤดูร้อน[104] บางชนิดปรับตัวให้ทนต่อสภาพแวดล้อมที่รุนแรง เช่น Streptomyces ที่ผลิตสารปฏิชีวนะหลายชนิดออกมายับยั้งการเจริญเติบโตของจุลชีพคู่แข่ง[105] ในธรรมชาติ จุลชีพหลายชนิดอยู่ร่วมกันแบบกลุ่มสังคม (เช่น ฟิล์มชีวภาพ) ที่ทำให้จุลชีพหาสารอาหารได้มากขึ้น และป้องกันจุลชีพจากสิ่งกดดันในสิ่งแวดล้อม (environmental stress)[44] ความสัมพันธ์ในลักษณะนี้อาจเป็นสิ่งจำเป็นสำหรับการเจริญเติบโตของสิ่งมีชีวิตหรือกลุ่มสิ่งมีชีวิตบางชนิด (syntrophy)[106]
การเจริญเติบโตของแบคทีเรียดำเนินผ่านสี่ระยะ เมื่อประชากรของแบคทีเรียเข้าสู่สิ่งแวดล้อมที่มีสารอาหารสูงเอื้อต่อการเจริญเติบโต แบคทีเรียจำเป็นต้องปรับตัวต่อสิ่งแวดล้อมดังกล่าว ระยะแรกคือระยะแล็ก (lag phase) ซึ่งเป็นระยะที่เกิดการเจริญเติบโตอย่างค่อยเป็นค่อยไปในขณะที่เซลล์ของแบคทีเรียกำลังปรับตัวในสิ่งแวดล้อมที่มีสารอาหารสูงและเตรียมพร้อมสำหรับการเจริญเติบโตอย่างรวดเร็ว ระยะแล็กมีอัตราชีวสังเคราะห์ (biosynthesis) สูง ซึ่งมีการผลิตโปรตีนที่จำเป็นสำหรับการเจริญเติบโต[107][108] ระยะที่สองของการเจริญเติบโตคือระยะลอการิทึม (logarithmic phase) หรือเรียกอีกชื่อว่าระยะเอกซ์โพเนนเชียล (exponential phase) ซึ่งเป็นระยะที่มีการเพิ่มจำนวนแบบเอกซ์โพเนนเชียล อัตราที่เซลล์เจริญในระยะนี้เรียกว่าอัตราการเจริญเติบโต (growth rate, k) และระยะเวลาที่เซลล์ใช้แบ่งตัวเรียกว่าระยะเวลาชั่วอายุ (generation time, g) ในระยะนี้แบคทีเรียจะเมตาบอไลส์สารอาหารอย่างรวดเร็วจนกระทั่งสารอาหารชนิดหนึ่งหมดไปและเริ่มจำกัดการเจริญเติบโตของแบคทีเรีย ระยะที่สามคือระยะคงที่ (stationary phase) ซึ่งเกิดจากการใช้สารอาหารจนหมด ระยะนี้เซลล์จะลดกิจกรรมทางเมตาบอลิสมและเผาผลาญโปรตีนภายในเซลล์ที่ไม่จำเป็น ระยะนี้เป็นระยะเปลี่ยนผ่านจากการเจริญเติบโตอย่างรวดเร็วไปยังการตอบสนองต่อสิ่งกดดัน และมีการแสดงออกของยีนที่เกี่ยวข้องกับการซ่อมแซมดีเอ็นเอ เมตาบอลิสมของสารต้านอนุมูลอิสระ และการขนส่งสารอาหารมากขึ้น[109] ระยะสุดท้ายคือระยะเซลล์ตาย (death phase) ซึ่งเป็นระยะที่แบคทีเรียขาดสารอาหารและตายลง[110]
พันธุศาสตร์
[แก้]แบคทีเรียส่วนมากมีโครโมโซมแบบวงกลมหนึ่งวง มีขนาดตั้งแต่ 160,000 คู่เบสในแบคทีเรียเอนโดซิมไบโอติก Carsonella ruddii[111] ไปจนถึงกว่า 12,200,000 คู่เบส (12.2 Mbp) ในแบคทีเรีย Sorangium cellulosum ที่อาศัยอยู่ในดิน[112] แต่กระนั้นก็ยังมีข้อยกเว้นบางประการ อาทิ แบคทีเรียสกุล Streptomyces และ Borrelia บางสปีชีส์มีโครโมโซมแบบเส้นหนึ่งชุด[113][114] และ Vibrio บางสปีชีส์มีโครโมโซมมากกว่าหนึ่งชุด[115] นอกจากนี้แบคทีเรียยังมีพลาสมิด ซึ่งเป็นโมเลกุลดีเอ็นเอนอกโครโมโซม (extra-chromosomal molecule of DNA) ขนาดเล็กที่สามารถบรรจุยีนสำหรับความสามารถบางประการ เช่น ความดื้อต่อยา ความสามารถเกี่ยวกับกระบวนการเมแทบอลิซึม หรือกระทั่งศักยภาพก่อโรค[116]
โดยปกติจีโนมของแบคทีเรียเข้ารหัสยีนตั้งแต่ไม่กี่ร้อยไปจนถึงไม่กี่พันยีน โดยยีนในจีโนมมักเป็นสายดีเอ็นเอต่อเนื่องกันเป็นเส้นเดียว แม้ว่าจะมีการค้นพบอินทรอน (intron) หลายชนิดในแบคทีเรีย แต่ก็พบได้ยากกว่าในยูแคริโอตมาก[117]
แบคทีเรียซึ่งเป็นสิ่งมีชีวิตไม่มีเพศได้รับสำเนาจีโนมที่เหมือนกันทุกประการกับจีโนมของเซลล์แม่ และถือเป็นตัวโคลน อย่างไรก็ตามแบคทีเรียสามารถวิวัฒน์ได้จากการคัดเลือกการเปลี่ยนแปลงที่เกิดกับสารพันธุกรรมดีเอ็นเอ ซึ่งอาจเกิดจากการรวมกันใหม่ของยีนหรือการกลายพันธ์ การกลายพันธุ์เกิดจากความผิดพลาดที่เกิดขึ้นระหว่างกระบวนการจำลองดีเอ็นเอ หรือเกิดจากการได้รับสารก่อกลายพันธุ์ (mutagen) อัตราการกลายพันธุ์ต่างกันไปในแบคทีเรียแต่ละสปีชีส์ และกระทั่งตัวโคลนของแบคทีเรียสปีชีส์เดียวกันก็มีอัตราการกลายพันธุ์ต่างกัน[118] การเปลี่ยนแปลงพันธุกรรมในจีโนมของแบคทีเรียเกิดขึ้นทั้งจากการกลายพันธุ์แบบสุ่มที่เกิดขึ้นในช่วงกระบวนการจำลองดีเอ็นเอหรือจากการกลายพันธุ์ที่มีความเครียดกำกับ (stress-directed mutation) ที่ยีนที่เกี่ยวข้องกับกระบวนการจำกัดการเจริญเติบโตบางอย่างมีอัตราการกลายพันธุ์ที่เพิ่มขึ้น[119]
แบคทีเรียบางชนิดสามารถถ่ายทอดสารพันธุกรรมข้ามเซลล์ได้ ซึ่งเกิดได้สามวิธี วิธีแรกแบคทีเรียจะเก็บดีเอ็นเอภายนอก (exogenous DNA) จากสิ่งแวดล้อมในกระบวนการทรานส์ฟอร์เมชัน (transformation)[120] แบคทีเรียหลายชนิดสามารถรับดีเอ็นเอจากสิ่งแวดล้อมได้ตามธรรมชาติ บางชนิดต้องทำให้เกิดการเปลี่ยนแปลงทางเคมีเสียก่อนเพื่อเหนี่ยวนำให้รับดีเอ็นเอเข้าไป[121] พัฒนาการของความสามารถในการรับดีเอ็นเอจากภายนอกมักสัมพันธ์กับปัจจัยกดดันทางสิ่งแวดล้อม และอาจเป็นการปรับตัวเพื่อช่วยซ่อมแซมความเสียหายในดีเอ็นเอของเซลล์ที่รับเข้าไป[122] วิธีที่สองที่แบคทีเรียจะส่งผ่านสารพันธุกรรมคือทรานส์ดักชัน (transduction) ซึ่งเกิดขึ้นเมื่อแบคเทอริโอเฟจ (bacteriophage) แทรกดีเอ็นเอแปลกปลอมเข้าสู่โครโมโซมของแบคทีเรีย แบคเทอริโอเฟจมีหลายชนิด บางชนิดเพียงทำให้ติดเชื้อและทำให้เซลล์แบคทีเรียโฮสต์แตก (lyses) และชนิดที่แทรกตัวเข้าไปในโครโมโซมของโฮสต์[123] แบคทีเรียต้านทานการติดเฟจด้วยระบบตัดจำเพาะและดัดแปลง (restriction modification system) ที่ย่อยสลายดีเอ็นเอแปลกปลอม[124] และระบบที่ใช้ลำดับคริสเปอร์ (CRISPR) เพื่อเก็บรักษาชิ้นส่วนจีโนมของเฟจที่แบคทีเรียเคยพบมาก่อน ทำให้แบคทีเรียสามารถป้องกันการเพิ่มจำนวนของแบคทีเรียผ่านกระบวนการยับยั้งอาร์เอ็นเอ (RNA interference)[125][126] วิธีที่สามคือกระบวนการคอนจูเกชัน (conjugation) ที่มีการส่งผ่านดีเอ็นเอผ่านการสัมผัสเซลล์โดยตรง โดยปกติแล้วทรานส์ดักชัน คอนจูเกชัน และทรานส์ฟอร์เมชันเกี่ยวข้องกับการถ่ายทอดสารพันธุกรรมระหว่างแบคทีเรียที่อยู่ในสปีชีส์เดียวกัน แต่บางครั้งก็เกิดการถ่ายทอดระหว่างแบคทีเรียต่างสปีชีส์ และอาจมีผลพวงที่มีนัยยะสำคัญ เช่น การถ่ายทอดความสามารถดื้อยา[127][128] ในกรณีนี้ การได้รับยีนมาจากแบคทีเรียอื่นหรือจากธรรมชาติเรียกว่าการถ่ายทอดยีนในแนวราบ (horizontal gene transfer) และอาจเกิดขึ้นเป็นปกติตามสภาพธรรมชาติ[129]
พฤติกรรม
[แก้]การเคลื่อนที่
[แก้]
แบคทีเรียหลายชนิดสามารถเคลื่อนที่ได้ด้วยตัวเอง (motile) โดยใช้กลไกหลากหลายชนิด แฟลเจลลาเป็นกลไกหนึ่งที่มีการศึกษาไว้เป็นอย่างดี แฟลเจลลาเป็นเส้นใยสายยาวที่มีมอเตอร์อยู่ที่ฐานคอยหมุนให้เกิดการเคลื่อนไหวคล้ายใบพัด[130] แฟลเจลลาของแบคทีเรียประกอบด้วยโปรตีน 20 ชนิด และมีโปรตีนอีกประมาณ 30 ที่จำเป็นสำหรับการควบคุมและการประกอบแฟลเจลลา[130] แฟลเจลลาเป็นโครงสร้างที่สามารถหมุนได้ ขับเคลื่อนโดยมอเตอร์เปลี่ยนทิศทางได้ที่อยู่ตรงฐาน มอเตอร์นี้ใช้พลังงานจากเกรเดียนต์ของไฟฟ้าเคมีระหว่างเยื่อหุ้มเซลล์[131]

แบคทีเรียสามารถใช้แฟลเจลลาได้หลายวิธีเพื่อทำให้เกิดการเคลื่อนที่ในลักษณะที่แตกต่างกัน แบคทีเรียหลายชนิด (เช่น E. coli) มีการเคลื่อนที่สองรูปแบบที่แตกต่างกัน ได้แก่ การเคลื่อนที่ไปข้างหน้า (swimming) และการตีลังกา (tumbling) การตีลังกาทำให้แบคทีเรียดังกล่าวจัดทิศทางใหม่ได้ และทำให้การเคลื่อนที่มีลักษณะเป็นการเดินสุ่มแบบสามมิติ[132] แบคทีเรียแต่ละสปีชีส์มีจำนวนและการจัดเรียงแฟลเจลลาบนผิวเซลล์แตกต่างกัน บางชนิดมีแฟลเจลลาเส้นเดียว (monotrichous), บางชนิดมีแฟลเจลลาหนึ่งเส้นที่ปลายแต่ละด้าน (amphitrichous), บางชนิดมีแฟลเจลลาเป็นกระจุกที่ขั้วของเซลล์ (lophotrichous), และบางชนิดมีแฟลเจลลากระจายอยู่ทั่วทั้งพื้นผิวของเซลล์ (peritrichous) แฟลเจลลาของสไปโรคีท ซึ่งเป็นแบคทีเรียพิเศษกลุ่มหนึ่ง อยู่ในพื้นที่ระหว่างเยื่อหุ้มเซลล์ทั้งสอง (periplasmic space) และสไปโรคีทยังมีลักษณะเฉพาะคือรูปร่างเป็นเกลียว ซึ่งจะหมุนไปพร้อมกับการเคลื่อนที่ของสไปโรคีท[130]
ปฏิสัมพันธ์กับสิ่งมีชีวิตอื่น
[แก้]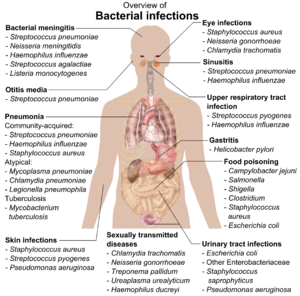
แม้แบคทีเรียจะมีลักษณะภายนอกที่เรียบง่าย แต่ก็สามารถสร้างรูปแบบความสัมพันธ์ที่ซับซ้อนกับสิ่งมีชีวิตอื่นได้ ภาวะที่แบคทีเรียอาศัยอยู่ร่วมกับสิ่งมีชีวิตอื่นแบ่งออกเป็นสามประเภท ได้แก่ ภาวะปรสิต ภาวะพึ่งพา ภาวะอิงอาศัย แบคทีเรียที่ดำรงชีวิตแบบอิงอาศัยมีขนาดเล็ก จึงมีจำนวนมหาศาลและสามารถเจริญเติบโตบนตัวสัตว์ พืช และบนพื้นผิวต่าง ๆ นอกจากนี้ แบคทีเรียยังสามารถเติบโตได้ดีขึ้นเมื่อได้รับความอบอุ่นและเหงื่อ ซึ่งในมนุษย์ หากบนผิวมีประชากรแบคทีเรียสูงจะทำให้เกิดกลิ่นกาย[134]
ผู้ล่า
[แก้]แบคทีเรียบางสปีชีส์สามารถฆ่าและกินจุลชีพอื่นได้ กลุ่มสปีชีส์นี้เรียกว่า แบคทีเรียล่าเหยื่อ[135] ตัวอย่างเช่น Myxococcus xanthus ซึ่งจับกลุ่มกันฆ่าและย่อยแบคทีเรียใดก็ตามที่พบ[136] แบคทีเรียล่าเหยื่อชนิดอื่นใช้การเกาะติดอยู่กับเหยื่อเพื่อที่จะย่อยและดูดซึมสารอาหาร เช่น Vampirovibrio chlorellavorus[137] หรือรุกรานเซลล์อื่นและเพิ่มจำนวนในไซโทซอล เช่น Daptobacter[138] เชื่อว่าแบคทีเรียล่าเหยื่อวิวัฒนาการมาจากสิ่งมีชีวิตอาศัยซากที่บริโภคจุลชีพที่ตายแล้ว จนสามารถดักจับและฆ่าสิ่งมีชีวิตอื่นได้[139]
เชื้อก่อโรค
[แก้]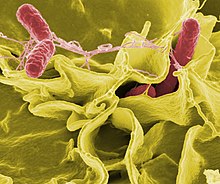
หากแบคทีเรียมีความสัมพันธ์ในลักษณะปรสิตกับสิ่งมีชีวิตอื่น ก็จะถูกจัดเป็นเชื้อก่อโรค แบคทีเรียก่อโรคเป็นสาเหตุสำคัญของโรคและการเสียชีวิตในมนุษย์ และก่อโรคติดเชื้อ เช่น บาดทะยัก (เกิดจาก Clostridium tetani), ไข้ไทฟอยด์, โรคคอตีบ, ซิฟิลิส, อหิวาตกโรค, อาหารเป็นพิษ, เรื้อน (เกิดจาก Micobacterium leprae) และวัณโรค (เกิดจาก Mycobacterium tuberculosis) เชื้อที่เป็นสาเหตุของโรคหนึ่งอาจได้รับการค้นพบในอีกหลายปีให้หลังก็ได้ ดังในกรณีของ Helicobacter pylori กับแผลหลุมในกระเพาะอาหาร นอกจากนี้โรคที่เกิดจากแบคทีเรียยังมีความสำคัญในด้านการเกษตร ดังเห็นได้จากแบคทีเรียที่ก่อโรคใบจุด โรคใบไหม้ และโรคเหี่ยวในพืช รวมถึงโรคโจนส์ โรคเต้านมอักเสบ การปนเปื้อนเชื้อซัลโมเนลลาและแอนแทรกซ์ในปศุสัตว์[140]
เชื้อก่อโรคแต่ละสปีชีส์มีช่วงลักษณะปฏิสัมพันธ์กับโฮสต์ที่เป็นมนุษย์ประจำสปีชีส์ แบคทีเรียบางชนิด เช่น Staphylococcus หรือ Streptococcus สามารถทำให้เกิดการติดเชื้อที่ผิวหนัง, ปอดอักเสบ (pneumonia), เยื่อหุ้มสมองอักเสบ และการติดเชื้อในกระแสเลือด การอักเสบตอบสนองทั่วร่างกายที่ทำให้เกิดภาวะช็อก หลอดเลือดขยายทั่วร่างกาย และอาจทำให้เสียชีวิตได้[141] กระนั้นแบคทีเรียเหล่านี้ก็ยังเป็นส่วนหนึ่งของจุลชีพประจำถิ่นของมนุษย์และมักจะอาศัยอยู่บนผิวหนังหรือในจมูกโดยที่ไม่ก่อให้เกิดโรคแต่อย่างใด แบคทีเรียบางชนิดก่อโรคได้อย่าง invariably เช่น Rickettsia ซึ่งเป็นปรสิตที่ต้องอาศัยอยู่ในเซลล์ของสิ่งมีชีวิตอื่นเพื่อเติบโตและสืบพันธ์ุ (obligate intracellular parasite) สปีชีส์หนึ่งของ Rickettsia ก่อไข้รากสาดใหญ่ และอีกชนิดก่อโรคไข้พุพองเทือกเขาร็อกกี (Rocky Mountain spotted fever) Chlamydia ซึ่งแบคทีเรียปรสิตในเซลล์อีกไฟลัมหนึ่ง ประกอบด้วยสปีชีส์ที่สามารถก่อโรคปอดอักเสบหรือการติดเชื้อในระบบทางเดินปัสสาวะได้ และอาจเกี่ยวข้องกับโรคหลอดเลือดเลี้ยงหัวใจด้วย[142] บางสปีชีส์ เช่น Pseudomonas aeruginosa, Burkholderia cenocepacia และ Mycobacterium avium เป็นเชื้อฉวยโอกาสและก่อโรคในผู้ที่มีภาวะกดภูมิคุ้มกันหรือซิสติก ไฟโบรซิส[143][144]
การติดเชื้อแบคทีเรียอาาจรักษาได้ด้วยยาปฏิชีวนะ ซึ่งแบ่งได้เป็นยาฆ่าแบคทีเรีย หากเป็นยาที่มีฤทธิ์ฆ่าแบคทีเรีย และยายับยั้งแบคทีเรีย หากว่ามีฤทธิ์เพียงป้องกันการเจริญเติบโตของแบคทีเรีย ยาปฏิชีวนะมีหลายชนิด และแต่ละกลุ่มจะยับยั้งกระบวนการของเชื้อก่อโรคที่ต่างออกไปจากที่พบในโฮสต์ ตัวอย่างเช่น คลอแรมเฟนิคอลและพูโรมัยซินที่ทำให้เกิดความเป็นพิษต่อเพียงเชื้อก่อโรคด้วยการยับยั้งไรโบโซมของแบคทีเรีย ซึ่งมีโครงสร้างต่างจากไรโบโซมของยูแคริโอต[145] มีการใช้ยาปฏิชีวะทั้งในการรักษาโรคในมนุษย์และการเกษตรแบบมุ่งเน้น (intensive farming) เพื่อเร่งการเจริญเติบโตของปศุสัตว์ ซึ่งอาจมีส่วนเร่งให้เกิดการพัฒนาการดื้อยาในประชากรแบคทีเรียอย่างรวดเร็ว[146] โรคติดเชื้อสามารถป้องกันได้ด้วยมาตรการระงับเชื้อ เช่น การทำไร้เชื้อผิวหนังก่อนทำหัตถการที่ใช้เข็มเจาะเข้าร่างกาย และการดูแลสายสวนชนิดที่ต้องเสียบคาไว้อย่างเหมาะสม นอกจากนี้เครื่องมือทางศัลยกรรมและทันตกรรมต้องไร้เชื้อเพื่อป้องกันการปนเปื้อนแบคทีเรีย มีการนำสารฆ่าเชื้อ (disinfectant) เช่น น้ำยาฟอกขาว มาฆ่าแบคทีเรียหรือเชื้อก่อโรคอื่นบนพื้นผิวของสิ่งไม่มีชีวิตเพื่อป้องกันการปนเปื้อนและลดความเสี่ยงที่จะติดเชื้อโรคลงไปอีก[147]
ความสำคัญทางเทคโนโลยีและอุตสาหกรรม
[แก้]มนุษย์นำแบคทีเรีย ซึ่งมักเป็นแบคทีเรียที่สร้างกรดแลกติก เช่น Lactobacillus และ Lactococcus มาใช้ร่วมกับยีสต์และเชื้อราเพื่อเตรียมอาหารหมักดองมากว่าหลายพันปี เช่น ชีส ผักดอง ซีอิ๊ว น้ำส้มสายชู ไวน์ เซาเออร์เคราท์[148][149]
แบคทีเรียมีคุณสมบัติโดดเด่นคือสามารถย่อยสลายสารประกอบอินทรีย์ได้หลายชนิด มนุษย์นำความสามารถนี้มาใช้ในการจัดการขยะและการบำบัดสารมลพิษด้วยวิธีชีวภาพ แบคทีเรียสามารถย่อยไฮโดรคาร์บอนในปิโตรเลียมได้และถูกนำมาใช้ทำความสะอาดคราบน้ำมันรั่วไหล[150] ที่อ่าวปรินซ์วิลเลียม (Prince William Sound) มีการเติมปุ๋ยลงบนชายหาดบางแห่งเพื่อเอื้อการเจริญเติบโตของแบคทีเรียประเภทนี้หลังจากเหตุการณ์น้ำมันรั่วไหลเอ็กซอน วัลเดซปี 1989 ซึ่งได้ผลในชายหาดที่น้ำมันปกคลุมไม่หนามากนัก นอกจากนี้ยังมีการใช้แบคทีเรียในการบำบัดขยะพิษจากอุตสาหกรรม[151] ในทางอุตสาหกรรมเคมี แบคทีเรียมีความสำคัญอย่างยิ่งในการผลิตสารที่บริสุทธิ์ทางอีแนนทิโอเมอร์สำหรับใช้ในทางเภสัชกรรมและเคมีเกษตร[152]
แบคทีเรียยังสามารถนำมาใช้แทนยาฆ่าแมลงในการควบคุมสัตว์รบกวนด้วยวิธีทางชีวภาพ (biological pest control) ซึ่งมักใช้แบคทีเรีย Bacillus thuringiensis (หรือเรียกว่า BT) ซึ่งเป็นแบคทีเรียแกรมบวกที่อาศัยอยู่ในดิน มีการสปีชีส์ย่อยของแบคทีเรียนี้เป็นสารฆ่าแมลงที่จำเพาะต่อแมลงในอันดับผีเสื้อภายใต้ชื่อทางการค้าเช่น ไดเพล (Dipel) และทูริไซด์ (Thuricide)[153] การใช้แบคทีเรียเป็นสารกำจัดสัตว์รังควาญมีความจำเพาะ จึงถือว่าเป็นมิตรต่อสิ่งแวดล้อม โดยมีผลกระทบต่อมนุษย์ สัตว์ป่า สัตว์ผสมเกสร และแมลงมีประโยชน์ส่วนใหญ่ในระดับน้อยหรือไม่มีผลกระทบ[154][155]
แบคทีเรียสามารถเจริญเติบโตได้อย่างรวดเร็วและค่อนข้างสะดวกต่อการจัดการควบคุม แบคทีเรียจึงกลายเป็นเครื่องมือสำหรับปฏิบัติงานทางชีววิทยาโมเลกุล พันธุศาสตร์ และชีวเคมี นักวิทยาศาสตร์สามารถระบุหน้าที่ของยีน เอนไซม์ และวิถีเมแทบอลิซึมของแบคทีเรียด้วยการทำให้ดีเอ็นเอของแบคทีเรียเกิดการกลายพันธ์ุและตรวจสอบผลฟีโนไทป์ที่ได้ จากนั้นจึงนำองค์ความรู้ที่ได้มาประยุกต์ใช้กับสิ่งมีชีวิตที่ซับซ้อนกว่า[156] ความมุ่งหมายในการทำความเข้าใจชีวเคมีของเซลล์มาถึงระดับที่ซับซ้อนที่สุด คือการสังเคราะห์ข้อมูลเกี่ยวกับการแสดงออกของยีนและจลนศาสตร์ของเอนไซม์จำนวนมากให้กลายเป็นแบบจำลองทางคณิตศาสตร์ของสิ่งมีชีวิตทั้งตัว ซึ่งอาจกระทำได้กับแบคทีเรียที่มีผู้ศึกษาวิจัยไว้อย่างดีแล้ว ดังเช่นในปัจจุบันที่มีผู้สร้างและทดสอบแบบจำลองเมแทบอลิซึมของ Escherichia coli[157][158] ความเข้าใจในเมแทบอลิซึมและพันธุกรรมของแบคทีเรียทำให้มนุษย์สามารถนำเทคโนโลยีชีวภาพมาปรับแต่งแบคทีเรียเพื่อผลิตโปรตีนรักษาโรค เช่น อินซูลิน โกรทแฟกเตอร์ หรือแอนติบอดี[159][160]
เนื่องจากแบคทีเรียมีความสำคัญต่อวงการการวิจัยโดยรวม จึงมีการคัดแยกและเก็บรักษาตัวอย่างสายพันธุ์แบคทีเรียไว้ที่ธนาคารเก็บตัวอย่างทางชีวภาพ (biorepository)[161]
ประวัติศาสตร์ของวิทยาแบคทีเรีย
[แก้]
อันโตนี ฟัน เลเวินฮุก นักจุลทรรศน์วิทยาชาวฮอลแลนด์ เป็นผู้สังเกตเห็นแบคทีเรียเป็นคนแรก โดยใช้กล้องจุลทรรศน์เลนส์เดี่ยวที่ออกแบบขึ้นเอง[162] เลเวินฮุกประกาศการค้นพบผ่านทางชุดจดหมายที่ส่งไปยังราชสมาคมแห่งลอนดอน[163][164][165] แบคทีเรียเป็นการค้นพบทางจุลทรรศน์ที่โดดเด่นที่สุดของเลเวินฮุก แบคทีเรียมีขนาดเล็กเสียจนเกือบเกินขีดจำกัดของกล้องจุลทรรศน์ของเขา และไม่มีใครสังเกตเห็นอีกเลยเป็นเวลากว่าศตวรรษ[166] ซึ่งถือเป็นการหยุดชะงักใหญ่ครั้งหนึ่งในประวัติศาสตร์ของวิทยาศาสตร์ นอกจากนี้เลเวินฮุกยังสังเกตเห็นโปรโตซัว ซึ่งเขาเรียกว่า "แอนิมอลกุล (animalcule)" สิ่งที่เลเวินฮุกค้นพบกลับมามีผู้ทำการศึกษาอีกครั้งเนื่องจากการค้นพบทางทฤษฎีเซลล์ในสมัยใหม่[167]
คริสทีอัน ก็อทฟรีท เอเรินแบร์คเป็นผู้เริ่มใช้คำว่า "bacterium" เมื่อ ค.ศ. 1828[168] แต่ความจริงแล้วคำว่า Bacterium ของเอเรินแบร์คคือสกุลที่ประกอบด้วยแบคทีเรียรูปท่อนที่ไม่สร้างสปอร์[169] ตรงกันข้ามกับ Bacillus ซึ่งเป็นแบคทีเรียรูปท่อนสร้างสปอร์ ที่เอเรินแบร์คได้นิยามไว้ใน ค.ศ. 1835[170]
ใน ค.ศ. 1859 หลุยส์ ปาสเตอร์สาธิตว่าการเจริญเติบโตของจุลชีพทำให้เกิดกระบวนการหมัก และการเจริญเติบโตนี้ไม่ได้เกิดขึ้นมาเองจากสิ่งไร้ชีวิต (ยีสต์และราที่เกี่ยวข้องกับกระบวนการหมักไม่ใช่แบคทีเรียแต่เป็นฟังไจ) ปาสเตอร์เป็นบุคคลแรก ๆ ที่สนับสนุนทฤษฎีเชื้อของโรค เช่นเดียวกับโรแบร์ท ค็อค นายแพทย์ร่วมสมัยเดียวกัน[171]
โรแบร์ท ค็อคทำการศึกษาอหิวาตกโรค แอนแทรกซ์ วัณโรค และเป็นผู้บุกเบิกวิชาจุลชีววิทยาการแพทย์ เขาได้พิสูจน์ทฤษฎีเชื้อโรคในระหว่างการศึกษาวัณโรคและได้รับรางวัลโนเบลใน ค.ศ. 1905 จากการพิสูจน์นี้[172] เขาเป็นผู้ตั้งสมมติฐานของค็อคที่ซึ่งมีเกณฑ์สำหรับพิสูจน์ว่าสิ่งมีชีวิตที่ต้องการศึกษาเป็นสาเหตุของโรคหนึ่ง ๆ หรือไม่ สมมติฐานของค็อคยังเป็นที่ใช้กันมาจนถึงปัจจุบัน[173]
กล่าวกันว่าแฟร์ดีนันท์ โคห์นเป็นผู้ก่อตั้งวิชาวิทยาแบคทีเรีย โดยเขาได้ศึกษามาตั้งแต่ ค.ศ. 1870 เขาเป็นบุคคลแรกที่จำแนกแบคทีเรียตามลักษณะสัณฐาน[174][175]
ถึงแม้จะเป็นที่ทราบกันในคริสต์ศตวรรษที่ 19 ว่าแบคทีเรียเป็นสาเหตุของโรคหลายชนิดแต่ก็ไม่มีวิธีการรักษาที่มีประสิทธิภาพพอในสมัยนั้น[176] ใน ค.ศ. 1910 เพาล์ แอร์ลิชพัฒนายาปฏิชีวนะตัวแรกขึ้นมาโดยเปลี่ยนสีที่ใช้ย้อม Treponema pallidum ซึ่งเป็นแบคทีเรียสไปโรคีทที่ทำให้เกิดโรคซิฟิลิส เป็นสารประกอบที่ทำลายเฉพาะเชื้อดังกล่าว[177] แอร์ลิชได้รับรางวัลโนเบลสำหรับการศึกษาทางด้านภูมิคุ้มกันวิทยาใน ค.ศ. 1908 และริเริ่มการใช้สีย้อมเพื่อตรวจหาและวินิจฉัยแบคทีเรีย การศึกษาของเขาเป็นพื้นฐานสำหรับสีย้อมแกรมและสีย้อมซีห์ล–นีลเซน[178]
การศึกษาแบคทีเรียได้ก้าวหน้าไปอีกขั้นหนึ่งเมื่อคาร์ล โวซระบุได้ว่าอาร์เคียมีสายวิวัฒนาการแยกต่างหากจากแบคทีเรีย[3] การจัดสายวิวัฒนาการนี้เกิดขึ้นจากการหาลำดับเบสไรโบโซมัลอาร์เอ็นเอขนาด 16s และทำให้โพรแคริโอตถูกแบ่งออกเป็นสองโดเมน โดยเป็นส่วนหนึ่งของระบบสามโดเมน[1]
อ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 Woese CR, Kandler O, Wheelis ML (June 1990). "Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya". Proceedings of the National Academy of Sciences of the United States of America. 87 (12): 4576–79. Bibcode:1990PNAS...87.4576W. doi:10.1073/pnas.87.12.4576. PMC 54159. PMID 2112744.
- ↑ Pavan ME, และคณะ (May 2018). "Proposal for a new classification of a deep branching bacterial phylogenetic lineage: transfer of Coprothermobacter proteolyticus and Coprothermobacter platensis to Coprothermobacteraceae fam. nov., within Coprothermobacterales ord. nov., Coprothermobacteria classis nov. and Coprothermobacterota phyl. nov. and emended description of the family Thermodesulfobiaceae". Int. J. Syst. Evol. Microbiol. 68 (5): 1627–32. doi:10.1099/ijsem.0.002720. PMID 29595416. S2CID 4470260.
- ↑ 3.0 3.1 Woese CR, Fox GE (November 1977). "Phylogenetic structure of the prokaryotic domain: the primary kingdoms". Proceedings of the National Academy of Sciences of the United States of America. 74 (11): 5088–90. Bibcode:1977PNAS...74.5088W. doi:10.1073/pnas.74.11.5088. PMC 432104. PMID 270744.
- ↑ Fredrickson JK, Zachara JM, Balkwill DL, Kennedy D, Li SM, Kostandarithes HM, Daly MJ, Romine MF, Brockman FJ (July 2004). "Geomicrobiology of high-level nuclear waste-contaminated vadose sediments at the Hanford site, Washington state". Applied and Environmental Microbiology. 70 (7): 4230–41. doi:10.1128/AEM.70.7.4230-4241.2004. PMC 444790. PMID 15240306.
- ↑ Dudek NK, Sun CL, Burstein D (2017). "Novel Microbial Diversity and Functional Potential in the Marine Mammal Oral Microbiome" (PDF). Current Biology. 27 (24): 3752–3762. doi:10.1016/j.cub.2017.10.040. PMID 29153320. S2CID 43864355.
- ↑ Fang H, Kang J, Zhang D (January 2017). "12: a review and future perspectives". Microbial Cell Factories. 16 (1): 15. doi:10.1186/s12934-017-0631-y. PMC 5282855. PMID 28137297.
- ↑ Moore SJ, Warren MJ (June 2012). "The anaerobic biosynthesis of vitamin B12". Biochemical Society Transactions. 40 (3): 581–6. doi:10.1042/BST20120066. PMID 22616870.
- ↑ Graham RM, Deery E, Warren MJ (2009). "18: Vitamin B12: Biosynthesis of the Corrin Ring". ใน Warren MJ, Smith AG (บ.ก.). Tetrapyrroles Birth, Life and Death. New York, NY: Springer-Verlag. p. 286. doi:10.1007/978-0-387-78518-9_18. ISBN 978-0-387-78518-9.
- ↑ Miller A, Korem M, Almog R, Galboiz Y (June 2005). "Vitamin B12, demyelination, remyelination and repair in multiple sclerosis". Journal of the Neurological Sciences. 233 (1–2): 93–7. doi:10.1016/j.jns.2005.03.009. PMID 15896807. S2CID 6269094.
- ↑ Whitman WB, Coleman DC, Wiebe WJ (June 1998). "Prokaryotes: the unseen majority". Proceedings of the National Academy of Sciences of the United States of America. 95 (12): 6578–83. Bibcode:1998PNAS...95.6578W. doi:10.1073/pnas.95.12.6578. PMC 33863. PMID 9618454.
- ↑ Bar-On YM, Phillips R, Milo R (June 2018). "The biomass distribution on Earth" (PDF). Proceedings of the National Academy of Sciences of the United States of America. 115 (25): 6506–6511. doi:10.1073/pnas.1711842115. PMC 6016768. PMID 29784790.
- ↑ Forbes SL (2008). "Decomposition Chemistry in a Burial Environment". ใน Tibbett M, Carter DO (บ.ก.). Soil Analysis in Forensic Taphonomy. CRC Press. pp. 203–223. ISBN 978-1-4200-6991-4.
- ↑ Sears CL (October 2005). "A dynamic partnership: celebrating our gut flora". Anaerobe. 11 (5): 247–51. doi:10.1016/j.anaerobe.2005.05.001. PMID 16701579.
- ↑ "2002 WHO mortality data". เก็บจากแหล่งเดิมเมื่อ 23 ตุลาคม 2013. สืบค้นเมื่อ 20 มกราคม 2007.
- ↑ "Metal-Mining Bacteria Are Green Chemists". Science Daily. 2 กันยายน 2010. เก็บจากแหล่งเดิมเมื่อ 31 สิงหาคม 2017.
- ↑ Ishige T, Honda K, Shimizu S (April 2005). "Whole organism biocatalysis". Current Opinion in Chemical Biology. 9 (2): 174–80. doi:10.1016/j.cbpa.2005.02.001. PMID 15811802.
- ↑ βακτήριον. Liddell, Henry George; Scott, Robert; A Greek–English Lexicon at Perseus Project.
- ↑ βακτηρία in Liddell and Scott.
- ↑ bacterium เก็บถาวร 27 มกราคม 2011 ที่ เวย์แบ็กแมชชีน, on Oxford Dictionaries.
- ↑ Harper, Douglas. "bacteria". Online Etymology Dictionary.
- ↑ Schopf JW (July 1994). "Disparate rates, differing fates: tempo and mode of evolution changed from the Precambrian to the Phanerozoic". Proceedings of the National Academy of Sciences of the United States of America. 91 (15): 6735–42. Bibcode:1994PNAS...91.6735S. doi:10.1073/pnas.91.15.6735. PMC 44277. PMID 8041691.
- ↑ DeLong EF, Pace NR (August 2001). "Environmental diversity of bacteria and archaea". Systematic Biology. 50 (4): 470–78. CiteSeerX 10.1.1.321.8828. doi:10.1080/106351501750435040. PMID 12116647.
- ↑ Brown JR, Doolittle WF (December 1997). "Archaea and the prokaryote-to-eukaryote transition". Microbiology and Molecular Biology Reviews. 61 (4): 456–502. doi:10.1128/.61.4.456-502.1997. PMC 232621. PMID 9409149.
- ↑ Di Giulio M (December 2003). "The universal ancestor and the ancestor of bacteria were hyperthermophiles". Journal of Molecular Evolution. 57 (6): 721–30. Bibcode:2003JMolE..57..721D. doi:10.1007/s00239-003-2522-6. PMID 14745541. S2CID 7041325.
- ↑ Battistuzzi FU, Feijao A, Hedges SB (November 2004). "A genomic timescale of prokaryote evolution: insights into the origin of methanogenesis, phototrophy, and the colonization of land". BMC Evolutionary Biology. 4: 44. doi:10.1186/1471-2148-4-44. PMC 533871. PMID 15535883.
- ↑ Homann, Martin; และคณะ (23 July 2018). "Microbial life and biogeochemical cycling on land 3,220 million years ago" (PDF). Nature Geoscience. 11 (9): 665–671. Bibcode:2018NatGe..11..665H. doi:10.1038/s41561-018-0190-9. S2CID 134935568.
- ↑ Poole AM, Penny D (January 2007). "Evaluating hypotheses for the origin of eukaryotes". BioEssays. 29 (1): 74–84. doi:10.1002/bies.20516. PMID 17187354.
- ↑ Dyall SD, Brown MT, Johnson PJ (April 2004). "Ancient invasions: from endosymbionts to organelles". Science. 304 (5668): 253–7. Bibcode:2004Sci...304..253D. doi:10.1126/science.1094884. PMID 15073369. S2CID 19424594.
- ↑ Lang BF, Gray MW, Burger G (1999). "Mitochondrial genome evolution and the origin of eukaryotes". Annual Review of Genetics. 33: 351–97. doi:10.1146/annurev.genet.33.1.351. PMID 10690412.
- ↑ McFadden GI (December 1999). "Endosymbiosis and evolution of the plant cell". Current Opinion in Plant Biology. 2 (6): 513–19. doi:10.1016/S1369-5266(99)00025-4. PMID 10607659.
- ↑ Schulz HN, Jorgensen BB (2001). "Big bacteria". Annual Review of Microbiology. 55: 105–37. doi:10.1146/annurev.micro.55.1.105. PMID 11544351. S2CID 18168018.
- ↑ Williams C (2011). "Who are you calling simple?". New Scientist. 211 (2821): 38–41. doi:10.1016/S0262-4079(11)61709-0.
- ↑ Robertson J, Gomersall M, Gill P (November 1975). "Mycoplasma hominis: growth, reproduction, and isolation of small viable cells". Journal of Bacteriology. 124 (2): 1007–18. doi:10.1128/JB.124.2.1007-1018.1975. PMC 235991. PMID 1102522.
- ↑ Velimirov B (2001). "Nanobacteria, Ultramicrobacteria and Starvation Forms: A Search for the Smallest Metabolizing Bacterium". Microbes and Environments. 16 (2): 67–77. doi:10.1264/jsme2.2001.67.
- ↑ Dusenbery, David B (2009). Living at Micro Scale, pp. 20–25. Harvard University Press, Cambridge, Massachusetts ISBN 978-0-674-03116-6.
- ↑ Yang DC, Blair KM, Salama NR (March 2016). "Staying in Shape: the Impact of Cell Shape on Bacterial Survival in Diverse Environments". Microbiology and Molecular Biology Reviews. 80 (1): 187–203. doi:10.1128/MMBR.00031-15. PMC 4771367. PMID 26864431.
- ↑ Cabeen MT, Jacobs-Wagner C (August 2005). "Bacterial cell shape". Nature Reviews. Microbiology. 3 (8): 601–10. doi:10.1038/nrmicro1205. PMID 16012516. S2CID 23938989.
- ↑ Young KD (September 2006). "The selective value of bacterial shape". Microbiology and Molecular Biology Reviews. 70 (3): 660–703. doi:10.1128/MMBR.00001-06. PMC 1594593. PMID 16959965.
- ↑ Claessen D, Rozen DE, Kuipers OP, Søgaard-Andersen L, van Wezel GP (February 2014). "Bacterial solutions to multicellularity: a tale of biofilms, filaments and fruiting bodies". Nature Reviews. Microbiology. 12 (2): 115–24. doi:10.1038/nrmicro3178. PMID 24384602. S2CID 20154495.
- ↑ Shimkets LJ (1999). "Intercellular signaling during fruiting-body development of Myxococcus xanthus". Annual Review of Microbiology. 53: 525–49. doi:10.1146/annurev.micro.53.1.525. PMID 10547700.
- ↑ Kaiser D (2004). "Signaling in myxobacteria". Annual Review of Microbiology. 58: 75–98. doi:10.1146/annurev.micro.58.030603.123620. PMID 15487930.
- ↑ Donlan RM (September 2002). "Biofilms: microbial life on surfaces". Emerging Infectious Diseases. 8 (9): 881–90. doi:10.3201/eid0809.020063. PMC 2732559. PMID 12194761.
- ↑ Branda SS, Vik S, Friedman L, Kolter R (January 2005). "Biofilms: the matrix revisited". Trends in Microbiology. 13 (1): 20–26. doi:10.1016/j.tim.2004.11.006. PMID 15639628.
- ↑ 44.0 44.1 Davey ME, O'toole GA (December 2000). "Microbial biofilms: from ecology to molecular genetics". Microbiology and Molecular Biology Reviews. 64 (4): 847–67. doi:10.1128/MMBR.64.4.847-867.2000. PMC 99016. PMID 11104821.
- ↑ Donlan RM, Costerton JW (April 2002). "Biofilms: survival mechanisms of clinically relevant microorganisms". Clinical Microbiology Reviews. 15 (2): 167–93. doi:10.1128/CMR.15.2.167-193.2002. PMC 118068. PMID 11932229.
- ↑ Slonczewski JL, Foster JW (2013). Microbiology : an Evolving Science (Third ed.). New York: W W Norton. p. 82. ISBN 978-0393123678.
- ↑ Lodish H, Berk A, Kaiser CA, Krieger M, Bretscher A, Ploegh H, Amon A, Scott MP (2013). Molecular Cell Biology (7th ed.). WH Freeman. p. 13. ISBN 978-1429234139.
- ↑ Kerfeld CA, Sawaya MR, Tanaka S, Nguyen CV, Phillips M, Beeby M, Yeates TO (August 2005). "Protein structures forming the shell of primitive bacterial organelles". Science. 309 (5736): 936–38. Bibcode:2005Sci...309..936K. CiteSeerX 10.1.1.1026.896. doi:10.1126/science.1113397. PMID 16081736. S2CID 24561197.
- ↑ Bobik TA (May 2006). "Polyhedral organelles compartmenting bacterial metabolic processes". Applied Microbiology and Biotechnology. 70 (5): 517–25. doi:10.1007/s00253-005-0295-0. PMID 16525780. S2CID 8202321.
- ↑ Yeates TO, Kerfeld CA, Heinhorst S, Cannon GC, Shively JM (September 2008). "Protein-based organelles in bacteria: carboxysomes and related microcompartments". Nature Reviews. Microbiology. 6 (9): 681–91. doi:10.1038/nrmicro1913. PMID 18679172. S2CID 22666203.
- ↑ Gitai Z (March 2005). "The new bacterial cell biology: moving parts and subcellular architecture". Cell. 120 (5): 577–86. doi:10.1016/j.cell.2005.02.026. PMID 15766522. S2CID 8894304.
- ↑ Shih YL, Rothfield L (September 2006). "The bacterial cytoskeleton". Microbiology and Molecular Biology Reviews. 70 (3): 729–54. doi:10.1128/MMBR.00017-06. PMC 1594594. PMID 16959967.
- ↑ Norris V, den Blaauwen T, Cabin-Flaman A, Doi RH, Harshey R, Janniere L, Jimenez-Sanchez A, Jin DJ, Levin PA, Mileykovskaya E, Minsky A, Saier M, Skarstad K (March 2007). "Functional taxonomy of bacterial hyperstructures". Microbiology and Molecular Biology Reviews. 71 (1): 230–53. doi:10.1128/MMBR.00035-06. PMC 1847379. PMID 17347523.
- ↑ Harold FM (June 1972). "Conservation and transformation of energy by bacterial membranes". Bacteriological Reviews. 36 (2): 172–230. doi:10.1128/MMBR.36.2.172-230.1972. PMC 408323. PMID 4261111.
- ↑ Bryant DA, Frigaard NU (November 2006). "Prokaryotic photosynthesis and phototrophy illuminated". Trends in Microbiology. 14 (11): 488–96. doi:10.1016/j.tim.2006.09.001. PMID 16997562.
- ↑ Psencík J, Ikonen TP, Laurinmäki P, Merckel MC, Butcher SJ, Serimaa RE, Tuma R (August 2004). "Lamellar organization of pigments in chlorosomes, the light harvesting complexes of green photosynthetic bacteria". Biophysical Journal. 87 (2): 1165–72. Bibcode:2004BpJ....87.1165P. doi:10.1529/biophysj.104.040956. PMC 1304455. PMID 15298919.
- ↑ Thanbichler M, Wang SC, Shapiro L (October 2005). "The bacterial nucleoid: a highly organized and dynamic structure". Journal of Cellular Biochemistry. 96 (3): 506–21. doi:10.1002/jcb.20519. PMID 15988757. S2CID 25355087.
- ↑ Poehlsgaard J, Douthwaite S (November 2005). "The bacterial ribosome as a target for antibiotics". Nature Reviews. Microbiology. 3 (11): 870–81. doi:10.1038/nrmicro1265. PMID 16261170. S2CID 7521924.
- ↑ Yeo M, Chater K (มีนาคม 2005). "The interplay of glycogen metabolism and differentiation provides an insight into the developmental biology of Streptomyces coelicolor". Microbiology. 151 (Pt 3): 855–61. doi:10.1099/mic.0.27428-0. PMID 15758231. เก็บจากแหล่งเดิมเมื่อ 29 กันยายน 2007.
- ↑ Shiba T, Tsutsumi K, Ishige K, Noguchi T (มีนาคม 2000). "Inorganic polyphosphate and polyphosphate kinase: their novel biological functions and applications". Biochemistry. Biokhimiia. 65 (3): 315–23. PMID 10739474. เก็บจากแหล่งเดิมเมื่อ 25 กันยายน 2006.
- ↑ Brune DC (June 1995). "Isolation and characterization of sulfur globule proteins from Chromatium vinosum and Thiocapsa roseopersicina". Archives of Microbiology. 163 (6): 391–99. doi:10.1007/BF00272127. PMID 7575095. S2CID 22279133.
- ↑ Kadouri D, Jurkevitch E, Okon Y, Castro-Sowinski S (2005). "Ecological and agricultural significance of bacterial polyhydroxyalkanoates". Critical Reviews in Microbiology. 31 (2): 55–67. doi:10.1080/10408410590899228. PMID 15986831. S2CID 4098268.
- ↑ Walsby AE (March 1994). "Gas vesicles". Microbiological Reviews. 58 (1): 94–144. doi:10.1128/MMBR.58.1.94-144.1994. PMC 372955. PMID 8177173.
- ↑ van Heijenoort J (March 2001). "Formation of the glycan chains in the synthesis of bacterial peptidoglycan". Glycobiology. 11 (3): 25R–36R. doi:10.1093/glycob/11.3.25R. PMID 11320055. S2CID 46066256.
- ↑ 65.0 65.1 Koch AL (October 2003). "Bacterial wall as target for attack: past, present, and future research". Clinical Microbiology Reviews. 16 (4): 673–87. doi:10.1128/CMR.16.4.673-687.2003. PMC 207114. PMID 14557293.
- ↑ Gram, HC (1884). "Über die isolierte Färbung der Schizomyceten in Schnitt- und Trockenpräparaten". Fortschr. Med. 2: 185–89.
- ↑ Hugenholtz P (2002). "Exploring prokaryotic diversity in the genomic era". Genome Biology. 3 (2): REVIEWS0003. doi:10.1186/gb-2002-3-2-reviews0003. PMC 139013. PMID 11864374.
- ↑ Walsh FM, Amyes SG (October 2004). "Microbiology and drug resistance mechanisms of fully resistant pathogens" (PDF). Current Opinion in Microbiology. 7 (5): 439–44. doi:10.1016/j.mib.2004.08.007. PMID 15451497.
- ↑ Alderwick LJ, Harrison J, Lloyd GS, Birch HL (March 2015). "The Mycobacterial Cell Wall – Peptidoglycan and Arabinogalactan". Cold Spring Harbor Perspectives in Medicine. 5 (8): a021113. doi:10.1101/cshperspect.a021113. PMC 4526729. PMID 25818664.
- ↑ Engelhardt H, Peters J (December 1998). "Structural research on surface layers: a focus on stability, surface layer homology domains, and surface layer-cell wall interactions". Journal of Structural Biology. 124 (2–3): 276–302. doi:10.1006/jsbi.1998.4070. PMID 10049812.
- ↑ Beveridge TJ, Pouwels PH, Sára M, Kotiranta A, Lounatmaa K, Kari K, Kerosuo E, Haapasalo M, Egelseer EM, Schocher I, Sleytr UB, Morelli L, Callegari ML, Nomellini JF, Bingle WH, Smit J, Leibovitz E, Lemaire M, Miras I, Salamitou S, Béguin P, Ohayon H, Gounon P, Matuschek M, Koval SF (June 1997). "Functions of S-layers". FEMS Microbiology Reviews. 20 (1–2): 99–149. doi:10.1016/S0168-6445(97)00043-0. PMID 9276929.
- ↑ Kojima S, Blair DF (2004). The bacterial flagellar motor: structure and function of a complex molecular machine. International Review of Cytology. Vol. 233. pp. 93–134. doi:10.1016/S0074-7696(04)33003-2. ISBN 978-0-12-364637-8. PMID 15037363.
- ↑ Beachey EH (March 1981). "Bacterial adherence: adhesin-receptor interactions mediating the attachment of bacteria to mucosal surface". The Journal of Infectious Diseases. 143 (3): 325–45. doi:10.1093/infdis/143.3.325. PMID 7014727.
- ↑ Silverman PM (February 1997). "Towards a structural biology of bacterial conjugation". Molecular Microbiology. 23 (3): 423–29. doi:10.1046/j.1365-2958.1997.2411604.x. PMID 9044277. S2CID 24126399.
- ↑ Costa TR, Felisberto-Rodrigues C, Meir A, Prevost MS, Redzej A, Trokter M, Waksman G (June 2015). "Secretion systems in Gram-negative bacteria: structural and mechanistic insights". Nature Reviews. Microbiology. 13 (6): 343–59. doi:10.1038/nrmicro3456. PMID 25978706. S2CID 8664247.
- ↑ Stokes RW, Norris-Jones R, Brooks DE, Beveridge TJ, Doxsee D, Thorson LM (October 2004). "The glycan-rich outer layer of the cell wall of Mycobacterium tuberculosis acts as an antiphagocytic capsule limiting the association of the bacterium with macrophages". Infection and Immunity. 72 (10): 5676–86. doi:10.1128/IAI.72.10.5676-5686.2004. PMC 517526. PMID 15385466.
- ↑ Daffé M, Etienne G (1999). "The capsule of Mycobacterium tuberculosis and its implications for pathogenicity". Tubercle and Lung Disease. 79 (3): 153–69. doi:10.1054/tuld.1998.0200. PMID 10656114.
- ↑ Finlay BB, Falkow S (June 1997). "Common themes in microbial pathogenicity revisited". Microbiology and Molecular Biology Reviews. 61 (2): 136–69. doi:10.1128/.61.2.136-169.1997. PMC 232605. PMID 9184008.
- ↑ Nicholson WL, Munakata N, Horneck G, Melosh HJ, Setlow P (September 2000). "Resistance of Bacillus endospores to extreme terrestrial and extraterrestrial environments". Microbiology and Molecular Biology Reviews. 64 (3): 548–72. doi:10.1128/MMBR.64.3.548-572.2000. PMC 99004. PMID 10974126.
- ↑ 80.0 80.1 McKenney PT, Driks A, Eichenberger P (January 2013). "The Bacillus subtilis endospore: assembly and functions of the multilayered coat". Nature Reviews. Microbiology. 11 (1): 33–44. doi:10.1038/nrmicro2921. PMID 23202530. S2CID 205498395.
- ↑ Nicholson WL, Fajardo-Cavazos P, Rebeil R, Slieman TA, Riesenman PJ, Law JF, Xue Y (August 2002). "Bacterial endospores and their significance in stress resistance". Antonie van Leeuwenhoek. 81 (1–4): 27–32. doi:10.1023/A:1020561122764. PMID 12448702. S2CID 30639022.
- ↑ Vreeland RH, Rosenzweig WD, Powers DW (October 2000). "Isolation of a 250 million-year-old halotolerant bacterium from a primary salt crystal". Nature. 407 (6806): 897–900. Bibcode:2000Natur.407..897V. doi:10.1038/35038060. PMID 11057666. S2CID 9879073.
- ↑ Cano RJ, Borucki MK (May 1995). "Revival and identification of bacterial spores in 25- to 40-million-year-old Dominican amber". Science. 268 (5213): 1060–64. Bibcode:1995Sci...268.1060C. doi:10.1126/science.7538699. PMID 7538699.
- ↑ "Row over ancient bacteria". BBC News (ภาษาอังกฤษแบบบริติช). 2001-06-07. สืบค้นเมื่อ 2020-04-26.
- ↑ Nicholson WL, Schuerger AC, Setlow P (April 2005). "The solar UV environment and bacterial spore UV resistance: considerations for Earth-to-Mars transport by natural processes and human spaceflight". Mutation Research. 571 (1–2): 249–64. doi:10.1016/j.mrfmmm.2004.10.012. PMID 15748651.
- ↑ "Colonising the galaxy is hard. Why not send bacteria instead?". The Economist. 2018-04-12. ISSN 0013-0613. สืบค้นเมื่อ 2020-04-26.
- ↑ Hatheway CL (January 1990). "Toxigenic clostridia". Clinical Microbiology Reviews. 3 (1): 66–98. doi:10.1128/CMR.3.1.66. PMC 358141. PMID 2404569.
- ↑ Nealson KH (January 1999). "Post-Viking microbiology: new approaches, new data, new insights". Origins of Life and Evolution of the Biosphere. 29 (1): 73–93. Bibcode:1999OLEB...29...73N. doi:10.1023/A:1006515817767. PMID 11536899. S2CID 12289639.
- ↑ Xu J (June 2006). "Microbial ecology in the age of genomics and metagenomics: concepts, tools, and recent advances". Molecular Ecology. 15 (7): 1713–31. doi:10.1111/j.1365-294X.2006.02882.x. PMID 16689892. S2CID 16374800.
- ↑ Zillig W (December 1991). "Comparative biochemistry of Archaea and Bacteria". Current Opinion in Genetics & Development. 1 (4): 544–51. doi:10.1016/S0959-437X(05)80206-0. PMID 1822288.
- ↑ 91.0 91.1 91.2 Slonczewski JL, Foster JW. Microbiology: An Evolving Science (3 ed.). WW Norton & Company. pp. 491–44.
- ↑ Hellingwerf KJ, Crielaard W, Hoff WD, Matthijs HC, Mur LR, van Rotterdam BJ (1994). "Photobiology of bacteria". Antonie van Leeuwenhoek (Submitted manuscript). 65 (4): 331–47. doi:10.1007/BF00872217. PMID 7832590. S2CID 23438926.
- ↑ Dalton H (June 2005). "The Leeuwenhoek Lecture 2000 the natural and unnatural history of methane-oxidizing bacteria". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 360 (1458): 1207–22. doi:10.1098/rstb.2005.1657. PMC 1569495. PMID 16147517.
- ↑ Zehr JP, Jenkins BD, Short SM, Steward GF (July 2003). "Nitrogenase gene diversity and microbial community structure: a cross-system comparison". Environmental Microbiology. 5 (7): 539–54. doi:10.1046/j.1462-2920.2003.00451.x. PMID 12823187.
- ↑ Zumft WG (December 1997). "Cell biology and molecular basis of denitrification". Microbiology and Molecular Biology Reviews. 61 (4): 533–616. doi:10.1128/.61.4.533-616.1997. PMC 232623. PMID 9409151.
- ↑ Drake HL, Daniel SL, Küsel K, Matthies C, Kuhner C, Braus-Stromeyer S (1997). "Acetogenic bacteria: what are the in situ consequences of their diverse metabolic versatilities?". BioFactors. 6 (1): 13–24. doi:10.1002/biof.5520060103. PMID 9233536. S2CID 25886552.
- ↑ Morel FM, Kraepiel AM, Amyot M (1998). "The chemical cycle and bioaccumulation of mercury". Annual Review of Ecology and Systematics. 29: 543–66. doi:10.1146/annurev.ecolsys.29.1.543. S2CID 86336987.
- ↑ Ślesak I, Kula M, Ślesak H, Miszalski Z, Strzałka K (August 2019). "How to define obligatory anaerobiosis? An evolutionary view on the antioxidant response system and the early stages of the evolution of life on Earth". Free Radical Biology & Medicine. 140: 61–73. doi:10.1016/j.freeradbiomed.2019.03.004. PMID 30862543.
- ↑ Koch AL (2002). "Control of the bacterial cell cycle by cytoplasmic growth". Critical Reviews in Microbiology. 28 (1): 61–77. doi:10.1080/1040-840291046696. PMID 12003041. S2CID 11624182.
- ↑ Eagon RG (April 1962). "Pseudomonas natriegens, a marine bacterium with a generation time of less than 10 minutes". Journal of Bacteriology. 83 (4): 736–37. doi:10.1128/jb.83.4.736-737.1962. PMC 279347. PMID 13888946.
- ↑ Pommerville p. 557
- ↑ Stewart EJ, Madden R, Paul G, Taddei F (February 2005). "Aging and death in an organism that reproduces by morphologically symmetric division". PLOS Biology. 3 (2): e45. doi:10.1371/journal.pbio.0030045. PMC 546039. PMID 15685293.
- ↑ Thomson RB, Bertram H (December 2001). "Laboratory diagnosis of central nervous system infections". Infectious Disease Clinics of North America. 15 (4): 1047–71. doi:10.1016/S0891-5520(05)70186-0. PMID 11780267.
- ↑ Paerl HW, Fulton RS, Moisander PH, Dyble J (April 2001). "Harmful freshwater algal blooms, with an emphasis on cyanobacteria". TheScientificWorldJournal. 1: 76–113. doi:10.1100/tsw.2001.16. PMC 6083932. PMID 12805693.
- ↑ Challis GL, Hopwood DA (November 2003). "Synergy and contingency as driving forces for the evolution of multiple secondary metabolite production by Streptomyces species". Proceedings of the National Academy of Sciences of the United States of America. 100 Suppl 2 (90002): 14555–61. Bibcode:2003PNAS..10014555C. doi:10.1073/pnas.1934677100. PMC 304118. PMID 12970466.
- ↑ Kooijman SA, Auger P, Poggiale JC, Kooi BW (August 2003). "Quantitative steps in symbiogenesis and the evolution of homeostasis". Biological Reviews of the Cambridge Philosophical Society. 78 (3): 435–63. doi:10.1017/S1464793102006127. PMID 14558592. S2CID 41072709.
- ↑ Bertrand RL (2019). "Lag Phase is a Dynamic, Organized, Adaptive, and Evolvable Period that Prepares Bacteria for Cell Division". Journal of Bacteriology. 201 (7): e00697-18. doi:10.1128/JB.00697-18. PMC 6416914. PMID 30642990.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Prats C, López D, Giró A, Ferrer J, Valls J (August 2006). "Individual-based modelling of bacterial cultures to study the microscopic causes of the lag phase". Journal of Theoretical Biology. 241 (4): 939–53. doi:10.1016/j.jtbi.2006.01.029. PMID 16524598.
- ↑ Hecker M, Völker U (2001). General stress response of Bacillus subtilis and other bacteria. Advances in Microbial Physiology. Vol. 44. pp. 35–91. doi:10.1016/S0065-2911(01)44011-2. ISBN 978-0-12-027744-5. PMID 11407115.
- ↑ Slonczewski JL, Foster JW. Microbiology: An Evolving Science (3 ed.). WW Norton & Company. p. 143.
- ↑ Nakabachi A, Yamashita A, Toh H, Ishikawa H, Dunbar HE, Moran NA, Hattori M (October 2006). "The 160-kilobase genome of the bacterial endosymbiont Carsonella". Science. 314 (5797): 267. doi:10.1126/science.1134196. PMID 17038615. S2CID 44570539.
- ↑ Pradella S, Hans A, Spröer C, Reichenbach H, Gerth K, Beyer S (December 2002). "Characterisation, genome size and genetic manipulation of the myxobacterium Sorangium cellulosum So ce56". Archives of Microbiology. 178 (6): 484–92. doi:10.1007/s00203-002-0479-2. PMID 12420170. S2CID 21023021.
- ↑ Hinnebusch J, Tilly K (December 1993). "Linear plasmids and chromosomes in bacteria". Molecular Microbiology. 10 (5): 917–22. doi:10.1111/j.1365-2958.1993.tb00963.x. PMID 7934868. S2CID 23852021.
- ↑ Lin YS, Kieser HM, Hopwood DA, Chen CW (December 1993). "The chromosomal DNA of Streptomyces lividans 66 is linear". Molecular Microbiology. 10 (5): 923–33. doi:10.1111/j.1365-2958.1993.tb00964.x. PMID 7934869. S2CID 8536066.
- ↑ Val ME, Soler-Bistué A, Bland MJ, Mazel D (December 2014). "Management of multipartite genomes: the Vibrio cholerae model". Current Opinion in Microbiology. 22: 120–26. doi:10.1016/j.mib.2014.10.003. PMID 25460805.
- ↑ Kado CI (October 2014). Historical Events That Spawned the Field of Plasmid Biology. Microbiology Spectrum. Vol. 2. p. 3. doi:10.1128/microbiolspec.PLAS-0019-2013. ISBN 9781555818975. PMID 26104369.
- ↑ Belfort M, Reaban ME, Coetzee T, Dalgaard JZ (July 1995). "Prokaryotic introns and inteins: a panoply of form and function". Journal of Bacteriology. 177 (14): 3897–903. doi:10.1128/jb.177.14.3897-3903.1995. PMC 177115. PMID 7608058.
- ↑ Denamur E, Matic I (May 2006). "Evolution of mutation rates in bacteria". Molecular Microbiology. 60 (4): 820–27. doi:10.1111/j.1365-2958.2006.05150.x. PMID 16677295. S2CID 20713095.
- ↑ Wright BE (May 2004). "Stress-directed adaptive mutations and evolution". Molecular Microbiology. 52 (3): 643–50. doi:10.1111/j.1365-2958.2004.04012.x. PMID 15101972. S2CID 1071308.
- ↑ Chen I, Dubnau D (March 2004). "DNA uptake during bacterial transformation". Nature Reviews. Microbiology. 2 (3): 241–49. doi:10.1038/nrmicro844. PMID 15083159. S2CID 205499369.
- ↑ Johnsborg O, Eldholm V, Håvarstein LS (December 2007). "Natural genetic transformation: prevalence, mechanisms and function". Research in Microbiology. 158 (10): 767–78. doi:10.1016/j.resmic.2007.09.004. PMID 17997281.
- ↑ Bernstein H, Bernstein C, Michod RE (2012). "DNA repair as the primary adaptive function of sex in bacteria and eukaryotes". Chapter 1: pp. 1–49 in: DNA Repair: New Research, Sakura Kimura and Sora Shimizu (eds.). Nova Sci. Publ., Hauppauge, NY ISBN 978-1-62100-808-8.
- ↑ Brüssow H, Canchaya C, Hardt WD (September 2004). "Phages and the evolution of bacterial pathogens: from genomic rearrangements to lysogenic conversion". Microbiology and Molecular Biology Reviews. 68 (3): 560–602, table of contents. doi:10.1128/MMBR.68.3.560-602.2004. PMC 515249. PMID 15353570.
- ↑ Bickle TA, Krüger DH (June 1993). "Biology of DNA restriction". Microbiological Reviews. 57 (2): 434–50. doi:10.1128/MMBR.57.2.434-450.1993. PMC 372918. PMID 8336674.
- ↑ Barrangou R, Fremaux C, Deveau H, Richards M, Boyaval P, Moineau S, Romero DA, Horvath P (March 2007). "CRISPR provides acquired resistance against viruses in prokaryotes". Science. 315 (5819): 1709–12. Bibcode:2007Sci...315.1709B. doi:10.1126/science.1138140. hdl:20.500.11794/38902. PMID 17379808. S2CID 3888761.
- ↑ Brouns SJ, Jore MM, Lundgren M, Westra ER, Slijkhuis RJ, Snijders AP, Dickman MJ, Makarova KS, Koonin EV, van der Oost J (August 2008). "Small CRISPR RNAs guide antiviral defense in prokaryotes". Science. 321 (5891): 960–64. Bibcode:2008Sci...321..960B. doi:10.1126/science.1159689. PMC 5898235. PMID 18703739.
- ↑ Michod RE, Bernstein H, Nedelcu AM (พฤษภาคม 2008). "Adaptive value of sex in microbial pathogens" (PDF). Infection, Genetics and Evolution. 8 (3): 267–85. doi:10.1016/j.meegid.2008.01.002. PMID 18295550. เก็บ (PDF)จากแหล่งเดิมเมื่อ 30 ธันวาคม 2016.
- ↑ Hastings PJ, Rosenberg SM, Slack A (September 2004). "Antibiotic-induced lateral transfer of antibiotic resistance". Trends in Microbiology. 12 (9): 401–14. doi:10.1016/j.tim.2004.07.003. PMID 15337159.
- ↑ Davison J (September 1999). "Genetic exchange between bacteria in the environment". Plasmid. 42 (2): 73–91. doi:10.1006/plas.1999.1421. PMID 10489325.
- ↑ 130.0 130.1 130.2 Bardy SL, Ng SY, Jarrell KF (February 2003). "Prokaryotic motility structures". Microbiology. 149 (Pt 2): 295–304. doi:10.1099/mic.0.25948-0. PMID 12624192.
- ↑ Macnab RM (December 1999). "The bacterial flagellum: reversible rotary propellor and type III export apparatus". Journal of Bacteriology. 181 (23): 7149–53. doi:10.1128/JB.181.23.7149-7153.1999. PMC 103673. PMID 10572114.
- ↑ Wu M, Roberts JW, Kim S, Koch DL, DeLisa MP (July 2006). "Collective bacterial dynamics revealed using a three-dimensional population-scale defocused particle tracking technique". Applied and Environmental Microbiology. 72 (7): 4987–94. doi:10.1128/AEM.00158-06. PMC 1489374. PMID 16820497.
- ↑ Fisher B, Harvey RP, Champe PC (2007). "Chapter 33". Lippincott's Illustrated Reviews: Microbiology (Lippincott's Illustrated Reviews Series). Hagerstwon, MD: Lippincott Williams & Wilkins. pp. 367–92. ISBN 978-0-7817-8215-9.
- ↑ Callewaert C, Lambert J, Van de Wiele T (May 2017). "Towards a bacterial treatment for armpit malodour". Experimental Dermatology. 26 (5): 388–391. doi:10.1111/exd.13259. PMID 27892611.
- ↑ Martin MO (September 2002). "Predatory prokaryotes: an emerging research opportunity". Journal of Molecular Microbiology and Biotechnology. 4 (5): 467–77. PMID 12432957.
- ↑ Velicer GJ, Stredwick KL (August 2002). "Experimental social evolution with Myxococcus xanthus". Antonie van Leeuwenhoek. 81 (1–4): 155–64. doi:10.1023/A:1020546130033. PMID 12448714. S2CID 20018104.
- ↑ Gromov BV (1972). "Electron Microscope Study of Parasitism by Bdellovibrio Chorellavorus Bacteria on Cells of the Green Alga Chorella Vulgaris". Tsitologiya. 14 (2): 256–60.
- ↑ Guerrero R, Pedros-Alio C, Esteve I, Mas J, Chase D, Margulis L (April 1986). "Predatory prokaryotes: predation and primary consumption evolved in bacteria". Proceedings of the National Academy of Sciences of the United States of America. 83 (7): 2138–42. Bibcode:1986PNAS...83.2138G. doi:10.1073/pnas.83.7.2138. PMC 323246. PMID 11542073.
- ↑ Velicer GJ, Mendes-Soares H (January 2009). "Bacterial predators". Current Biology. 19 (2): R55–56. doi:10.1016/j.cub.2008.10.043. PMID 19174136. S2CID 5432036.
- ↑ Schwarz S, Enne VI, van Duijkeren E (October 2016). "40 years of veterinary papers in JAC - what have we learnt?". The Journal of Antimicrobial Chemotherapy. 71 (10): 2681–90. doi:10.1093/jac/dkw363. PMID 27660260.
- ↑ Fish DN (February 2002). "Optimal antimicrobial therapy for sepsis". American Journal of Health-System Pharmacy. 59 Suppl 1: S13–19. doi:10.1093/ajhp/59.suppl_1.S13. PMID 11885408.
- ↑ Belland RJ, Ouellette SP, Gieffers J, Byrne GI (February 2004). "Chlamydia pneumoniae and atherosclerosis". Cellular Microbiology. 6 (2): 117–27. doi:10.1046/j.1462-5822.2003.00352.x. PMID 14706098. S2CID 45218449.
- ↑ Heise ER (February 1982). "Diseases associated with immunosuppression". Environmental Health Perspectives. 43: 9–19. doi:10.2307/3429162. JSTOR 3429162. PMC 1568899. PMID 7037390.
- ↑ Saiman L (2004). "Microbiology of early CF lung disease". Paediatric Respiratory Reviews. 5 Suppl A: S367–69. doi:10.1016/S1526-0542(04)90065-6. PMID 14980298.
- ↑ Yonath A, Bashan A (2004). "Ribosomal crystallography: initiation, peptide bond formation, and amino acid polymerization are hampered by antibiotics". Annual Review of Microbiology. 58: 233–51. doi:10.1146/annurev.micro.58.030603.123822. PMID 15487937.
- ↑ Khachatourians GG (November 1998). "Agricultural use of antibiotics and the evolution and transfer of antibiotic-resistant bacteria". CMAJ. 159 (9): 1129–36. PMC 1229782. PMID 9835883.
- ↑ Kuo J (October 2017). "Disinfection Processes". Water Environment Research. 89 (10): 1206–1244. doi:10.2175/106143017X15023776270278. PMID 28954657.
- ↑ Johnson ME, Lucey JA (April 2006). "Major technological advances and trends in cheese". Journal of Dairy Science. 89 (4): 1174–78. doi:10.3168/jds.S0022-0302(06)72186-5. PMID 16537950.
- ↑ Hagedorn S, Kaphammer B (1994). "Microbial biocatalysis in the generation of flavor and fragrance chemicals". Annual Review of Microbiology. 48: 773–800. doi:10.1146/annurev.mi.48.100194.004013. PMID 7826026.
- ↑ Cohen Y (December 2002). "Bioremediation of oil by marine microbial mats". International Microbiology. 5 (4): 189–93. doi:10.1007/s10123-002-0089-5. PMID 12497184. S2CID 26039323.
- ↑ Neves LC, Miyamura TT, Moraes DA, Penna TC, Converti A (2006). "Biofiltration methods for the removal of phenolic residues". Applied Biochemistry and Biotechnology. 129–132 (1–3): 130–52. doi:10.1385/ABAB:129:1:130. PMID 16915636. S2CID 189905816.
- ↑ Liese A, Filho MV (December 1999). "Production of fine chemicals using biocatalysis". Current Opinion in Biotechnology. 10 (6): 595–603. doi:10.1016/S0958-1669(99)00040-3. PMID 10600695.
- ↑ Aronson AI, Shai Y (February 2001). "Why Bacillus thuringiensis insecticidal toxins are so effective: unique features of their mode of action". FEMS Microbiology Letters. 195 (1): 1–8. doi:10.1111/j.1574-6968.2001.tb10489.x. PMID 11166987.
- ↑ Bozsik A (July 2006). "Susceptibility of adult Coccinella septempunctata (Coleoptera: Coccinellidae) to insecticides with different modes of action". Pest Management Science. 62 (7): 651–54. doi:10.1002/ps.1221. PMID 16649191.
- ↑ Chattopadhyay A, Bhatnagar NB, Bhatnagar R (2004). "Bacterial insecticidal toxins". Critical Reviews in Microbiology. 30 (1): 33–54. doi:10.1080/10408410490270712. PMID 15116762. S2CID 1580984.
- ↑ Serres MH, Gopal S, Nahum LA, Liang P, Gaasterland T, Riley M (2001). "A functional update of the Escherichia coli K-12 genome". Genome Biology. 2 (9): RESEARCH0035. doi:10.1186/gb-2001-2-9-research0035. PMC 56896. PMID 11574054.
- ↑ Almaas E, Kovács B, Vicsek T, Oltvai ZN, Barabási AL (February 2004). "Global organization of metabolic fluxes in the bacterium Escherichia coli". Nature. 427 (6977): 839–43. arXiv:q-bio/0403001. Bibcode:2004Natur.427..839A. doi:10.1038/nature02289. PMID 14985762. S2CID 715721.
- ↑ Reed JL, Vo TD, Schilling CH, Palsson BO (2003). "An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR)". Genome Biology. 4 (9): R54. doi:10.1186/gb-2003-4-9-r54. PMC 193654. PMID 12952533.
- ↑ Walsh G (April 2005). "Therapeutic insulins and their large-scale manufacture". Applied Microbiology and Biotechnology. 67 (2): 151–59. doi:10.1007/s00253-004-1809-x. PMID 15580495. S2CID 5986035.
- ↑ Graumann K, Premstaller A (February 2006). "Manufacturing of recombinant therapeutic proteins in microbial systems". Biotechnology Journal. 1 (2): 164–86. doi:10.1002/biot.200500051. PMID 16892246. S2CID 24702839.
- ↑ Rabsch W, Helm RA, Eisenstark A (February 2004). "Diversity of phage types among archived cultures of the Demerec collection of Salmonella enterica serovar Typhimurium strains". Applied and Environmental Microbiology. 70 (2): 664–9. doi:10.1128/aem.70.2.664-669.2004. PMC 348941. PMID 14766539.
- ↑ Porter JR (June 1976). "Antony van Leeuwenhoek: tercentenary of his discovery of bacteria". Bacteriological Reviews. 40 (2): 260–69. doi:10.1128/mmbr.40.2.260-269.1976. PMC 413956. PMID 786250.
- ↑ van Leeuwenhoek A (1684). "An abstract of a letter from Mr. Anthony Leevvenhoek at Delft, dated Sep. 17, 1683, Containing Some Microscopical Observations, about Animals in the Scurf of the Teeth, the Substance Call'd Worms in the Nose, the Cuticula Consisting of Scales". Philosophical Transactions. 14 (155–166): 568–74. Bibcode:1684RSPT...14..568L. doi:10.1098/rstl.1684.0030.
- ↑ van Leeuwenhoek A (1700). "Part of a Letter from Mr Antony van Leeuwenhoek, concerning the Worms in Sheeps Livers, Gnats, and Animalcula in the Excrements of Frogs". Philosophical Transactions. 22 (260–276): 509–18. Bibcode:1700RSPT...22..509V. doi:10.1098/rstl.1700.0013.
- ↑ van Leeuwenhoek A (1702). "Part of a Letter from Mr Antony van Leeuwenhoek, F.R.S. concerning Green Weeds Growing in Water, and Some Animalcula Found about Them". Philosophical Transactions. 23 (277–288): 1304–11. Bibcode:1702RSPT...23.1304V. doi:10.1098/rstl.1702.0042. S2CID 186209549.
- ↑ Asimov I (1982). Asimov's Biographical Encyclopedia of Science and Technology (2nd ed.). Garden City, NY: Doubleday and Company. p. 143.
- ↑ Pommerville p.7
- ↑ Ehrenberg CG (1828). Symbolae Physioe. Animalia evertebrata. Berlin: Decas prima.
- ↑ Breed RS, Conn HJ (May 1936). "The Status of the Generic Term Bacterium Ehrenberg 1828". Journal of Bacteriology. 31 (5): 517–18. doi:10.1128/jb.31.5.517-518.1936. PMC 543738. PMID 16559906.
- ↑ Ehrenberg CG (1835). Dritter Beitrag zur Erkenntniss grosser Organisation in der Richtung des kleinsten Raumes [Third contribution to the knowledge of great organization in the direction of the smallest space] (ภาษาเยอรมัน). Berlin: Physikalische Abhandlungen der Koeniglichen Akademie der Wissenschaften. pp. 143–336.
- ↑ "Pasteur's Papers on the Germ Theory". LSU Law Center's Medical and Public Health Law Site, Historic Public Health Articles. เก็บจากแหล่งเดิมเมื่อ 18 December 2006. สืบค้นเมื่อ 23 November 2006.
- ↑ "The Nobel Prize in Physiology or Medicine 1905". Nobelprize.org. เก็บจากแหล่งเดิมเมื่อ 10 December 2006. สืบค้นเมื่อ 22 November 2006.
- ↑ O'Brien SJ, Goedert JJ (October 1996). "HIV causes AIDS: Koch's postulates fulfilled". Current Opinion in Immunology. 8 (5): 613–18. doi:10.1016/S0952-7915(96)80075-6. PMID 8902385.
- ↑ Chung K. "Ferdinand Julius Cohn (1828–1898): Pioneer of Bacteriology" (PDF). Department of Microbiology and Molecular Cell Sciences, The University of Memphis. เก็บ (PDF)จากแหล่งเดิมเมื่อ 27 กรกฎาคม 2011.
- ↑ Drews, Gerhart (1999). "Ferdinand Cohn, a founder of modern microbiology" (PDF). ASM News. 65 (8): 547–52. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 13 กรกฎาคม 2017.
- ↑ Thurston AJ (December 2000). "Of blood, inflammation and gunshot wounds: the history of the control of sepsis". The Australian and New Zealand Journal of Surgery. 70 (12): 855–61. doi:10.1046/j.1440-1622.2000.01983.x. PMID 11167573.
- ↑ Schwartz RS (March 2004). "Paul Ehrlich's magic bullets". The New England Journal of Medicine. 350 (11): 1079–80. doi:10.1056/NEJMp048021. PMID 15014180.
- ↑ "Biography of Paul Ehrlich". Nobelprize.org. เก็บจากแหล่งเดิมเมื่อ 28 November 2006. สืบค้นเมื่อ 26 November 2006.
