CYP3A4
| cytochrome P450 family 3 subfamily A member 4 | |||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Identifiers | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Aliases | 1,8-cineole 2-exo-monooxygenase1.14.13.32cytochrome P450 3A3albendazole monooxygenase (sulfoxide-forming)1.14.13.157quinine 3-monooxygenasecytochrome P450subfamily IIIA (niphedipine oxidase)polypeptide 3cytochrome P450 NF-25cytochrome P450family 3subfamily Apolypeptide 4P450-IIIsteroid inducibleglucocorticoid-inducible P450cytochrome P450 HLpCYPIIIA41.14.13.67cytochrome P450subfamily IIIA (niphedipine oxidase)polypeptide 4nifedipine oxidasecytochrome P450-PCN1cytochrome P450 3A4albendazole sulfoxidaseCYPIIIA3CYP3A41.14.14.1cholesterol 25-hydroxylasealbendazole monooxygenasetaurochenodeoxycholate 6-alpha-hydroxylase1.14.13.97 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| External IDs | GeneCards: [2] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wikidata | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
ไซโทโครม P450 3A4 (อังกฤษ: Cytochrome P450 3A4; ชื่อย่อ: CYP3A4; EC 1.14.13.97) เป็นเอนไซม์ชนิดหนึ่งที่มีความสำคัญยิ่งต่อร่างกายมนุษย์ ส่วนใหญ่พบได้ที่ตับและลำไส้ โดยเอนไซม์นี้จะทำหน้าที่ออกซิไดซ์โมเลกุลอินทรีย์แปลกปลอมขนาดเล็ก (ซีโนไบโอติค) เช่น สารพิษ หรือยา เพื่อให้ร่างกายสามารถกำจัดสารแปลกปลอมเหล่านี้ออกไปได้ ยารักษาโรคส่วนใหญ่มักถูกทำให้หมดฤทธิ์ได้โดยเอนไซม์ CYP3A4 แต่ในทางตรงกันข้าม กลับมียาบางชนิดที่ถูกทำให้มีฤทธิ์ในการรักษาได้ด้วยเอนไซม์นี้ อย่างไรก็ตาม สารบางอย่าง เช่น น้ำเกรปฟรูต และยาบางชนิดอาจมีฤทธิ์รบกวนการทำงานของเอนไซม์ CYP3A4 ได้ โดยผลที่เกิดขึ้นจากอันตรกิริยาระหว่างสารเหล่านี้กับเอนไซม์ CYP3A4 อาจเพิ่มหรือลดประสิทธิภาพการรักษาของยาที่จำเป็นต้องมีการเปลี่ยนแปลงโครงสร้างด้วยเอนไซม์ CYP3A4 ได้
CYP3A4 เป็นเอนไซม์ในกลุ่มออกซิไดซิงเอนไซม์ตระกูลไซโตโครม P450 ซึ่งเอนไซม์สมาชิกอื่นในกลุ่มเอนไซม์นี้ล้วนมีส่วนสำคัญยิ่งในกระบวนการเปลี่ยนแปลงยาหลายชนิดที่แตกต่างกันออกไป แต่ CYP3A4 เป็นเอนไซม์มีส่วนเกี่ยวเนื่องกับการเปลี่ยนแปลงยาได้หลากหลายชนิดมากที่สุด CYP3A4 เป็นเอนไซม์ที่เป็นสารฮีโมโปรตีนเช่นเดียวกันกับเอนไซม์อื่นในตระกูลนี้ กล่าวคือ เป็นโปรตีนที่มีกลุ่มของฮีมซึ่งมีอะตอมของธาตุเหล็กเป็นส่วนประกอบ ในมนุษย์ โปรตีน CYP3A4 จะถูกเข้ารหัสโดยยีน CYP3A4[1] ซึ่งยีนนี้เป็นส่วนหนึ่งของกลุ่มยีน cytochrome P450 บน โครโมโซมคู่ที่ 7 โลคัส 7q21.1[2]
หน้าที่
[แก้]CYP3A4 เป็นเอนไซม์ในมหาสกุลไซโทโครม P450 ซึ่งโปรตีนในมหาสกุลนี้จัดเป็นเอนไซม์ประเภทมอนอออกซีจีเนส ซึ่งมีส่วนสำคัญในการกระตุ้นการเกิดเมแทบอลิซึมของยาต่างๆมากมาย รวมไปถึง การสังเคราะห์คอเลสเตอรอล สเตอรอยด์ และสารประกอบจำพวกไขมันต่างๆอีกหลายชนิด
การทำงานโปรตีน CYP3A4 นั้น จะทำงานได้เมื่อเคลื่อนที่ไปยังร่างแหเอนโดพลาซึมและได้รับการกระตุ้นจากกลูโคคอร์ติคอยด์และสารทางเภสัชเคมีบางชนิด โดยยาที่ใช้ในการป้องกันหรือบำบัดรักษาโรคในปัจจุบันประมาณร้อยละ 60 นั้นถูกเมแทบอลิซึมโดยกลุ่มเอนไซม์ในไซโทโครม P450 ในจำนวนนี้มากกว่าร้อยละ 50 ถูกเมแทบอลิซึมโดย CYP3A4[3] ตัวอย่างซับสเตรตของ CYP3A4 ได้แก่ พาราเซตามอล โคดีอีน ไซโคลสปอริน ไดแอซิแพม และอิริโทรมัยซิน เป็นต้น นอกจากนี้เอนไซม์นี้ยังทำหน้าที่เมแทบอไลซ์สเตอรอยด์และสารก่อมะเร็งบางชนิดได้ด้วย[4] ยาโดยส่วนมากเมื่อถูกเมแทบอไลซ์โดย CYP3A4 มักหมดฤทธิ์ลง ซึ่งจะถูกกำจัดออกจากร่างกายต่อไปทั้งทางตรงและการอาศัยตัวนำ อย่างไรก็ตาม ยาบางชนิดกลับถูกทำให้อยู่ในรูปที่ออกฤทธิ์ (active compound) เมื่อถูกเมแทบอไลซ์โดย CYP3A4 ซึ่งสารออกฤทธิ์ที่เกิดขึ้นนี้อาจเป็นประโยชน์ในการบำบัดรักษาโรค หรือเป็นพิษต่อร่างกายก็ได้ อย่างใดอย่างหนึ่ง (ตัวอย่างสารเหล่านี้ดังแสดงในตารางด้านล่าง)
นอกจากนี้ CYP3A4 ยังมีออกฤทธิ์เป็นอีพ็อกซิเนสที่ทำหน้าที่เปลี่ยนแปลงกรดอะราคิโดนิกไปเป็นกรดอีพ็อกซีไอโคซาไทรอีโนอิก (EETs) เช่น กรด (±) -8,9-, (±) -11,12-, และ (±) -14,15-อีพ็อกซีไอโคซาไทรอีโนอิก[5] ซึ่ง EET นี้มีผลต่อระบบต่างๆของร่างกายมากมาย ซึ่งรวมไปถึงการส่งเสริมการเติบโตของเซลล์มะเร็งในผู้ป่วยมะเร็งด้วย (ดูเพิ่มที่ กรดอีพ็อกซีไอโคซาไทรอีโนอิก) การศึกษาในเซลล์สายพันธุ์ของเซลล์มะเร็งที่พบในมนุษย์พบว่า CYP3A4 จะสร้างกรด (±) -14,15-อีพ็อกซีไอโคซาไทรอีโนอิกออกมา ซึ่งกรดดังกล่าวจะออกฤทธิ์กระตุ้นให้เกิดการเจริญเติบโตของเซลล์สายพันธุ์มะเร็งตัวอย่างมากขึ้นกว่าปกติ[6] ทั้งนี้ มีรายงานพบว่าไซโทโครม P450ยังแสดงฤทธิ์เป็นมอนอออกซีจีเนสของกรดไขมัน ซึ่งจะเมแทบอไลซ์กรดอะราคิโดนิกไปเป็น กรด20-ไฮดรอกซีไอโคซาเททราอีโนอิก (20-HETE)[7] โดย 20-HETE ที่เกิดขึ้นนี้ก็มีฤทธิ์ที่คล้ายคลึงกับ EET ซึ่งรวมไปถึงความสามารถในการกระตุ้นให้เกิดการเจริญเติบโตของเซลล์มะเร็ง โดยเฉพาะอย่างยิ่ง มะเร็งเต้านม (ดูเพิ่มที่ กรด 12-ไฮดรอกซีไอโคซาเททราอีโนอิก)
วิวัฒนาการ
[แก้]เมื่อเปรียบเทียบกับยีนพาราลอกของ CYP3A4 แล้วพบว่ายีน CYP3A4 มีการแสดงออกของส่วนควบคุม (regulatory region) ที่ซับซ้อนมากกว่าเป็นอย่างมาก[8] การที่ยีน CYP3A4 มีการแสดงออกที่ซับซ้อนเพิ่มมากขึ้นนี้ทำให้ยีน CYP3A4 มีความไวต่อลิแกนด์ชนิด PXR และ CAR ทั้งจากภายในและภายนอกมากขึ้น ซึ่งต่างจากยีนทั่วไปที่จะมีความจำเพาะของการแสดงออกที่กว้างมากขึ้นได้ก็ต่อเมื่อมีความหลากหลายของชนิดยีนที่มากขึ้น[8] CYP3A4 ของชิมแปนซีและมนุษย์นั้นมีความจำเป็นอย่างยิ่งในการเมแทบอไลซ์ลิแกนด์ชนิดต่างๆ โดยการแสดงออกของยีน CYP3A4 ในชิมแปนซีนั้นมีสัดส่วนคิดเป็นเพียงร้อยละ 50 เท่านั้นเมื่อเปรียบเทียบกับมนุษย์ อย่างไรก็ตาม การวิเคราะห์จลศาสตร์ของยีน CYP3A4 ในทั้งสองสายพันธุ์เปรียบเทียบกัน พบว่าไม่มีความแตกต่างกันแต่อย่างใด แต่การทดลองในห้องปฏิบัติการพบว่า CYP3A4 ของมนุษย์กระตุ้นให้เกิดปฏิกิริยาดีเบนซิเลชันของ 7-BFC ได้มากกว่าชิมแปนซีถึง 5 เท่า ในสภาวะที่มีกรดน้ำดีลิโทคลอริคทุติยภูมิที่เป็นพิษต่อตับ[9] ความแตกต่างของการแสดงออกของยีนข้างต้นนี้ทำให้มนุษย์มีความต้านทานต่อการเกิดท่อน้ำดีตีบตันได้มากขึ้นเมื่อเปรียบเทียบกับชิมแปนซี[9]
การกระจายในเนื้อเยื่อ
[แก้]ตัวอ่อนมนุษย์ในระยะฟีตัสนั้นจะไม่มีแสดงออกของ CYP3A4 ในเนื้อเยื่อตับ[โปรดขยายความ] หากแต่จะมีการทำงานของCYP3A7 (EC 1.14.14.1) ขึ้นมาแทน ซึ่ง CYP3A7 นี้เป็นเอนไซม์ที่มีสารซับสเตรตเช่นเดียวกันกับ CYP3A4 แต่หลังจากมารกมีอายุประมาณ 5 เดือน จะมีการแสดงออกของ CYP3A4 ประมาณร้อยละ 40 และเพิ่มเป็นร้อยละ 72 เมื่อมีอายุ 12 เดือน[10][11]
ถึงแม้ว่า CYP3A4 จะเป็นเอนไซม์ที่พบได้ในเนื้อเยื่อตับเป็นหลัก แต่ก็สามารถพบเอนไซม์ดังกล่าวในอวัยวะหรือเนื้อเยื่ออื่นได้เช่นกัน โดยเอนไซม์ที่พบนอกเหนือจากบริเวณตับนี้ก็ล้วนแล้วแต่มีหน้าที่ที่เกี่ยวเนื่องกับการเมแทบอไลซ์โมเลกุลอินทรีย์แปลกปลอมเพื่อขับออกจากร่างกายทั้งสิ้น เช่น CYP3A4 ที่พบในลำไส้จะมีบทบาทสำคัญในการเปลี่ยนแปลงยาต่างๆที่ได้รับการบริหารยาโดยการรับประทาน บ่อยครั้งที่ CYP3A4 ที่พบในลำไส้นี้จะเปลี่ยนยาในรูปแบบที่เป็นโปรดรักให้อยู่ในรูปที่ออกฤทธิ์และถูกดูดซึมผ่านผนังลำไส้เล็กเข้าสู่กระแสเลือดต่อไป ตัวอย่างยาที่ถูกเปลี่ยนให้อยู่ในรูปที่ออกฤทธิ์โดยเอนไซม์ CYP3A4 ที่ลำไส้เล็ก ได้แก่ เทอร์เฟนาดีน – ยาต้านฮิสตามีนที่ตัวรับ H1
นอกจากนี้ ยังมีการจำแนกเอนไซม์ CYP3A4 ได้จากเนื้อเยื่อสมอง แต่บทบาทของเอนไซม์นี้ต่อระบบประสาทส่วนกลางนั้นยังไม่อาจทราบได้แน่ชัด[12]
กลไกการทำงาน
[แก้]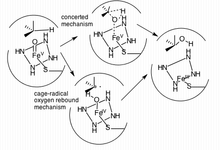
กลุ่มเอนไซม์ไซโทโครม P450จะทำงานร่วมกันเพื่อเปลี่ยนแปลงโครงสร้างของโมเลกุลแปลกปลอมโดยใช้ลิแกนด์ที่แตกต่างกันออกไปในการเกิดปฏิกิริยา ด้วยการที่เอนไซม์เหล่านี้มีตำแหน่งกัมมันต์ขนาดใหญ่และมีความสามารถในการเข้าจับกับซับสเตรตได้มากกว่า 1 ชนิดในเวลาเดียวกัน ทำให้การเมแทบอไลซ์สารเคมีทั้งที่มีแหล่งที่มาจากภายนอกและภายในร่างกายของเอนไซม์เหล่านี้มีความซับซ้อนเป็นอย่างมาก ซึ่งรวมไปถึงการเกิดไฮดรอกซิเลชัน, อีพ็อกซิเดชันของโอเลฟิน (olefin), การเกิดออกซิเดชันของสารประกอบแอโรมาติด สารประกอบอัลดีไฮด์และเฮเทอโรอะตอม , การเกิดปฏิกิริยา N- และ O- ดีอัลคิเลชัน, ปฏิกิริยาดีไฮโดรจีเนชัน และการทำงานของเอนไซม์แอโรมาเทส[13][14]
การเกิดไฮดรอกซิเลชันของพันธะ sp3 C-H เป็นหนึ่งในกลไกที่ CYP3A4 (และไซโทโครม P450 ออกซีจีเนสอื่น) เข้าทำปฏิกิริยากับลิแกนด์[15] แต่โดยส่วนมากแล้ว หลังการเกิดไฮดรอกซิเลชันบางครั้ง จะเกิดปฏิกิริยาดีไฮโดรจีเนชันตามมาภายหลัง ทำให้สารเมแทบอไลท์ที่ได้มีความซับซ้อนมากยิ่งขึ้น[14] ตัวอย่างสารที่เกิดเมแทบอลิซึมด้วย CYP3A4 มากกว่า 1 ปฏิกิริยา ได้แก่ ทาม็อกซิเฟน ซึ่งเมื่อเกิดไฮดรอกซิเลชันแล้วจะได้สารเมแทบอไลต์แรกเป็น 4-ไฮดรอกซี-ทาม็อกซิเฟน จากนั้นจะถูกดีไฮโดรจีเนตจนได้เป็นสารเมแทบอไลต์ชนิดที่ 2 คือ 4-ไฮดรอกซี-ทาม็อกซิเฟน ควิโนนมีไทด์ (4-hydroxy-tamoxifen quinone methide)[14] โดยกลไกที่คาดว่าเป็นกลไกการเกิดไฮดรอกซิเลชันของเอนไซม์ในไซโทโครม P450 ได้แก่ cage-controlled radical method ("oxygen rebound") และ concerted mechanism ซึ่งไม่ต้องอาศัยสารอนุมูลมัธยันตร์ (radical intermediate) ในการเกิดปฏิกิริยา แต่สามารถเข้าเมแทบอไลซ์ซับสเตรตได้อย่างรวดเร็วผ่านสารประกอบพวก "radical clock"[15]
ความผันแปรในกลุ่มประชากร
[แก้]การศึกษาพบว่า มีซิงเกิลนิวคลีโอไทด์โพลีมอร์ฟิซึมมากกว่า 28 SNPs ในยีนของ CYP3A4 แต่อัลลีลเหล่านี้ไม่ได้ถูกแปรรหัสออกมาจนนำสู่การเกิดความแปรผันทางพันธุกรรมระหว่างบุคคลได้จนถึงระดับที่มีนัยสำคัญ โดยคาดว่าความผันแปรนี้เป็นผลมาจากการเหนี่ยวนำ CYP3A4 ด้วยสารซับสเตรต นอกจากนี้ยังมีรายงานว่าอัลลีลของ CYP3A4 อย่าง CYP3A4*6 (A17776 insertion) และ CYP3A4*17 (F189S) นั้นมีหน้าที่เพียงเล็กน้อยเท่านั้นเมื่อเปรียบเทียบกับอัลลีลชนิด wild-type โดย SNPs ทั้งสองนี้จะทำให้ความสามารถในการเร่งการเกิดปฏิกิริยาเคมีกับลิแกนด์ต่างๆของเอนไซม์ CYP3A4 ลดน้อยลง โดยเฉพาะอย่างย่ิ่ง เทสโทสเตอโรน และไนเฟดิปีน เมื่อเปรียบเทียบกับการเกิดเมแทบอลิซึมโดยอัลลีลชนิด wild-type ของลิแกนด์เหล่านั้น[16]
ความผันแปรของการทำงานของ CYP3A4 สามารถอธิบายได้โดยการทดสอบแบบไม่รุกล้ำที่เรียกว่า erythromycin breath test (ERMBT) ซึ่งการทดสอบนี้จะประมาณการการทำหน้าที่ของ CYP3A4 ในมนุษย์ (in vivo) โดยวัดจากปริมาณคาร์บอนไดออกไซด์ที่มีการติดป้ายกัมมันตรังสีจากลมหายใจออก หลังจากได้รับการบริหาร (14C-N-methyl)-erythromycin ด้วยการฉีดเข้าหลอดเลือดดำ[17]
อันตรกิริยา
[แก้]น้ำเกรปฟรูต
[แก้]
ช่วงปี ค.ศ. 1998 นักวิจัยหลายคนค้นพบว่า น้ำเกรปฟรูตมีผลยับยั้งการทำงานของเอนไซม์ CYP3A4 อย่างแรง ซึ่งส่งผลกระทบต่อการเมแทบอลิซึมยาต่างๆหลายชนิด โดยการยับยั้งการทำงานของเอนไซม์นี้ทำให้ชีวปริมาณออกฤทธิ์ของยาเหล่านั้นเพิ่มสูงขึ้นเป็นอย่างมาก[18][19][20][21][22] ในบางกรณี เช่น ผู้ที่อยู่ระหว่างการใช้ยาแอสเทมมีโซล หรือเทอร์เฟนาดีน การเกิดอันตรกิริยาระหว่างยาเหล่านี้กับน้ำเกรปฟรูตอาจนำไปสู่อันตรายถึงแก่ชีวิตได้[19] ทั้งนี้ ผลของน้ำเกรปฟรูตต่อการดูดซึมยานั้นถูกค้นพบเป็นครั้งแรกเมื่อปี ค.ศ. 1989 และมีรายงานการเกิดอันตรกิริยาระหว่างยากับน้ำเกรปฟรูตปรากฏเป็นครั้งแรกในเดอะแลนซิตเมื่อ ค.ศ. 1991 ซึ่งเป็นการเกิดอันตรกิริยากับฟิโลดิปีนและไนเฟดิปีน และยังถือเป็นรายงานทางคลินิกรายงานแรกที่ค้นพบการเกิดอันตรกิริยาระหว่างยากับอาหาร โดยผลจากการยับยั้ง CYP3A4 ของน้ำเกรปฟรูตจะอยู่ได้นานประมาณ 3–7 วันหลังการรับประทาน และการเกิดอันตรกิริยาระหว่างยากับน้ำเกรปฟรูตจะเกิดขึ้นได้รุนแรงมากที่สุดเมื่อดื่มน้ำเกรปฟรูตหลังจากการบริหารยาไปแล้วประมาณหนึ่งชั่วโมง[23]
นอกจากเกรปฟรูตแล้ว ยังมีผลไม้อีกหลายชนิดที่ก่อให้เกิดผลไปในทิศทางนี้ อาทิ ลูกยอ (Morinda citrifolia) และน้ำทับทิม ซึ่งมีการนำมาผลิตเป็นผลิตภัณฑ์เสริมอาหาร หรือน้ำผลไม้ ก็มีฤทธิ์ยับยั้งการทำงานของเอนไซม์ CYP3A4 ได้เช่นกัน[24][25]
สารเหนี่ยวนำ
[แก้]การทำงานของ CYP3A4 สามารถถูกเหนี่ยวนำให้เพิ่มมากขึ้นได้โดยลิแกนด์หลายชนิด โดยลิแกนด์เหล่านี้จะเข้าจับกับตัวรับเพรกแนนเอกซ์ (PXR) สารประกอบเชิงซ้อน PXR ที่ได้รับการประตุ้นนี้จะเข้าจับตัวรับเรตินอยด์เอกซ์ (RXR) เพื่อสร้างสารเฮเทอโรไดเมอร์ (heterodimer) ที่จะเข้าจับกับส่วน XREM ซึ่งเป็นส่วนควบคุม (regulatory region) ของยีน CYP3A4 และการเข้าจับนี้เป็นผลทำให้เกิดปฏิกิริยากับส่วนโปรโมเตอร์ด้านใกล้ (proximal promoter) ของยีน ซึ่งจะทำให้เกิดการถอดรหัสและการแสดงออกของ CYP3A4 มากขึ้น กล่าวโดยสรุปคือ การกระตุ้นสารเฮเทอโรไดเมอร์ PXR/RXR จะทำให้มีการถอดรหัสของส่วนโปรโมเตอร์ด้านใกล้และยีนของ CYP3A4 เพิ่มมากขึ้นกว่าปกติ ทั้งนี้ลิแกนด์เหนี่ยวนำจะเข้าจับกับได้มากขึ้นก็ต่อเมื่อมีการนำเสนอของลิแกนด์ CYP3A4 เช่น ในกรณีการนำเสนอของอะฟลาทอกซิน B1, M1, และ G1 แต่โดยแท้จริงแล้ว การที่เอนไซม์ CYP3A4 มีขนาดใหญ่และมีตำแหน่งกัมมันต์ที่บิดไปมาได้ ทำให้มีความเป็นไปได้ว่าเอนไซม์นี้จะสามารถเข้าจับกับลิแกนด์ต่างๆได้มากกว่าหนึ่งชนิดในเวลาเดียวกัน ส่งผลให้มีความเสี่ยงที่จะเกิดอาการไม่พึงประสงค์ที่มีอันตรายร้ายแรงได้[26]
การเหนี่ยวนำการทำงานของ CYP3A4 ในมนุษย์นั้นมีความแตกต่างกับขึ้นตามเพศสภาพ โดยมีหลักฐานเชิงประจักษ์ที่พบว่า ในเพศหญิงจะมีอัตราการกำจัดยาที่เป็นซับสเตรตของ CYP3A4 ที่มากกว่าเพศชายไม่ว่าในช่วงน้ำหนักตัวใดๆ นอกจากนี้การศึกษาของ Wolbold และคณะที่ดำเนินการใน ค.ศ. 2003 พบว่า ระดับ CYP3A4 เฉลี่ยที่วัดได้จากตัวอย่างเนื้อเยื่อตับที่ผ่าตัดออกมาจากเพศหญิงนั้นมีค่าสูงกว่าที่วัดได้ในเพศชายประมาณร้อยละ 129 รวมไปถึงผลการเปรียบเทียบระดับเอ็มอาร์เอ็นเอของ CYP3A4 ในทั้งสองเพศก็มีสัดส่วนไปในทิศทางเดียวกัน ซึ่งอาจเป็นข้อมูลที่พอจะช่วยให้อนุมานได้ว่า กระบวนการก่อนการแปรรหัสของยีน CYP3A4 เป็นสาเหตุที่ทำให้เพศหญิงมีระดับ CYP3A4 ที่มากกว่าเพศชาย อย่างไรก็ดี สาเหตุที่แท้จริงที่ทำให้เกิดการเพิ่มระดับของเอนไซม์นี้ในเพศหญิงนั้นยังไม่อาจทราบได้แน่ชัดมากเท่าใดนัก แต่ก็มีการศึกษาอีกหลายการศึกษาที่พยายามจะอธิบายกลไกอื่นที่สัมพันธ์กับการเกิดปรากฏการณ์ในทำนองเดียวกันที่ส่งผลให้เกิดความแตกต่างในการกำจัดยาออกจากร่างกายระหว่างเพศชายและเพศหญิง (เช่น ปรากฏการณ์ที่มีการเพิ่มขึ้นของ CYP3A5 หรือ CYP3A7 เพื่อชดเชยการที่มี CYP3A4 ลดต่ำลง)[27]
ซับสเตรตที่กระตุ้นการทำงานของ CYP3A4 ในสิ่งมีชีวิตชนิดต่างๆ นั้นมีความหลากหลายแตกต่างกันไปในแต่ละสายพันธุ์ โดยลิแกนด์บางชนิดที่กระตุ้น PXR ของมนุษย์นั้นจะส่งผลให้มีการถอดรหัสของ CYP3A4 เพิ่มมากขึ้น แต่อาจไม่มีผลต่อกระบวนการดังกล่าวในสัตว์ชนิดอื่น ตัวอย่างเช่น PXR ของหนูจะไม่ถูกกระตุ้นด้วยไรแฟมพิซิน ในทำนองเดียวกัน PXR ของมนุษย์จะไม่ถูกเหนี่ยวนำโดย pregnenalone 16α-carbonitrile เหมือนที่พบในหนู[28] เพื่อให้การศึกษาการเหนี่ยวนำการทำงานของเอนไซม์โดยลิแกนด์ในห้องปฏิบัติการเป็นไปได้โดยง่าย จะมีการนำยีนของหนูมาทำการตกแต่งด้วยยีนทรานส์เพื่อให้ผลิต null/human CYP3A4 และ PXR อย่างไรก็ตาม ถึงแม้ว่าการดำเนินการดังกล่าวจะประสบผลสำเร็จในการเหนี่ยวนำให้มีการแสดงออกของเอนไซม์ humanized hCYP3A4 ในทางเดินของหนูได้สำเร็จ แต่ก็พบว่าระดับของ hCYP3A4 ในเนื้อเยื่อตับของหนูทดลองนั้นอยู่ในระดับที่ค่อนข้างต่ำ[28] ซึ่งคาดว่าเป็นผลมาจากการควบคุมระดับ CYP3A4 โดยการส่งต่อสัญญาณระดับเซลล์ (signal transduction) ของโกรทฮอร์โมน [28] นอกจากจะมีการใช้การศึกษารูปแบบดังกล่าวในมนุษย์ (in vivo) แล้ว ยังมีการใช้หนู CYP3A4 ที่ได้รับการตัดแต่งพันธุกรรมให้ผลิต humanized (hCYP3A4) เพื่อศึกษาถึงระดับการทำงานที่แตกต่างกันของ CYP3A4 ในเพศชายและหญิงอีกด้วย[28]
นอกจากนี้ยังพบว่าระดับการทำงานของ CYP3A4 มีความสัมพันธ์กับปัจจัยด้านอาหารและสิ่งแวดล้อมด้วย เช่น ระยะเวลาที่สัมผัสกับสารซีโนไบโอติค เป็นต้น[29] และเนื่องจากเอนไซม์นี้มีอยู่เป็นปริมาณมากในเซลล์เยื่อบุผนังลำไส้เล็ก ทำให้เอนไซม์นี้มีความไวต่อการอดอาหารเป็นอย่างมาก นอกจากนี้ ในสภาวะที่ร่างกายมีการป้องกันตัวจากการเกิดอาการไม่พึงประสงค์จากยาก็จะมีการแสดงออกของ CYP3A4 ที่เพิ่มมากขึ้นด้วย การศึกษาสัตว์สายพันธุ์อื่น อย่างปลา Fathead minnow พบว่าปลาเพศเมียที่ไม่ได้รับอาหารจะมีการแสดงออกของ PXR และ CYP3A4 ที่มากขึ้น และมีการแสดงให้เห็นถึงการตอบสนองที่มากขึ้นต่อสารซีโนไบโอติคหลังจากที่อดอาหารเป็นระยะเวลานานหลายวัน[29] จากผลการศึกษาในสัตว์ทดลองนี้ ทำให้เห็นถึงความแตกต่างโดยธรรมชาติในการกระตุ้นการทำงานของเอนไซม์ CYP3A4 ส่งผลให้ผู้วิจัยสามารถคาดการณ์ถึงการการเมแทบอลิซึมของยาและการเกิดอาการไม่พึงประสงค์จากยาดังกล่าวในมนุษย์ผ่านการศึกษาการทำงานของ CYP3A4 ได้ดีขึ้น
การหมุนเวียน
[แก้]มีการคาดการณ์กันไว้ว่าอัตราการหมุนเวียนของ CYP3A4 ในอวัยวะต่างๆ ของมนุษย์นั้นมีความแตกต่างกันอย่างมาก สำหรับ CYP3A4 ในเนื้อเยื่อตับนั้น เมื่อทำการประมาณผลลัพธ์ด้วยวิธี in cncnx พบว่าโดยส่วนใหญ่แล้วเอนไซม์ดังกล่าวมีครึ่งชีวิตระหว่าง 70–140 ชั่วโมง ขณะที่การศึกษาในหลอดลดทอง (in vitro) ให้ผลลัพธ์ประมาณ 26–79 ชั่วโมง[30] การหมุนเวียนของ CYP3A4 ในทางเดินอาหารนั้นดูเหมือนว่าจะขึ้นอยู่กับอัตราการผลัดเปลี่ยนของวัฏจักรของเซลล์เอนเทอโรไซต์ ส่วนระยะเวลาที่ใช้ในการฟื้นตัวหลังจากถูกยับยั้งโดยน้ำเกรปฟรูตจะอยู่ที่ประมาณ 12–33-ชั่วโมง[30]
เทคโนโลยี
[แก้]เนื่องจากการเข้าจับกันระหว่าง CYP3A4 กับเนื่อเยื่อมีแนวโน้มเป็นไปได้ในทางธรรมชาติของการเข้าจับกันของสารต่างๆในร่างกาย ซึ่งในอดีตเป็นการยากมากที่จะทำการศึกษาการเข้าจับกับเนื้อเยื่อของยาทั้งแบบเชิงลึกและแบบผิวเผิน และการทำให้เกิดการตกผลึกร่วมกันระหว่างเอนไซม์และสารซับสเตรตนั้นเป็นสิ่งที่เกิดขึ้นได้ยาก เนื่องจากสารซับสเตรตนั้นมักมีค่า Kd น้อย (ระหว่าง 5-150 μM) และสามารถละลายในสารละลายได้น้อย[31] วิธีการที่ประสบความสำเร็จในการแยกเอนไซม์จับอยู่กับซับสเตรตคือ การทำให้หมู่ฟังก์ชันของ monomeric CYP3A4 มีความคงตัวด้วยอนุภาคนาโนของเงินที่สร้างได้จากวิธีนาโนสเฟียร์ ลิโทกราฟี (nanosphere lithography) จากนั้นทำการวิเคราะห์ด้วยวิธี Localized surface plasmon resonance spectroscopy (LSPR)[32] การวิเคราะห์นี้สามารถนำมาใช้เป็นการทดสอบความไวสูงเพื่อตรวจวัดการเข้าจับของยา และอาจกลายเป็นส่วนสำคัญของเทคโนโลยีสมัยใหม่ที่สามารถตรวจคัดหาสารเคมีที่น่าจะมีศักยภาพในการพัฒนาเป็นยาใหม่ได้พร้อมกันในปริมาณมาก (high-throughput screening) นอกจาก LSPR แล้ว ยังพบว่า CYP3A4-Nanodisc complexe เป็นประโยชน์ในการใช้งานอื่นๆ อีกหลายด้าน ซึ่งรวมถึง โซลิดสเตทนิวเคลียร์แมกเนติกเรโซแนนซ์ (solid-state NMR), การวัดศักย์ไฟฟ้ารีด็อกซ์ (redox potentiometry), และการศึกษาจลศาสตร์ของเอนไซม์ที่สถานะคงตัว (steady-state enzyme kinetics) ด้วย[32]
ลิแกนด์ของ CYP3A4
[แก้]ลิแกนด์ต่างๆของ CYP3A4 นั้นมีหลายชนิด โดยจะแบ่งออกเป็นซับสเตรต, สารเหนี่ยวนำ และสารยับยั้งการทำงานของ CYP3A4 รายชื่อลิแกนด์เหล่านี้ดังแสดงในตารางด้านล่าง ซึ่งในบางกลุ่มอาจมีข้อยกเว้นบางประการ ทั้งนี้ สารยับยั้งการทำงานของ CYP3A4 นั้นสามารถจำแนกออกเป็นกลุ่มย่อยได้อีก 3 กลุ่มตามความแรงของการยับยั้งเอนไซม์ดังกล่าว ได้แก่
- สารยับยั้งอย่างแรง (Strong inhibitor) คือ สารที่เมื่อยับยั้งการทำงานของเอนไซม์แล้วทำให้ค่า AUC ในกระแสเลือดของซับสเตรตเพิ่มขึ้นอย่างน้อย 5 เท่าจากปกติ หรือลดการกำจัดซับสเตรตออกจากร่างกายได้มากกว่าร้อยละ 80[33]
- สารยับยั้งปานกลาง (Moderate inhibitor) คือ สารที่เมื่อยับยั้งการทำงานของเอนไซม์แล้วทำให้ค่า AUC ในกระแสเลือดของซับสเตรตเพิ่มขึ้นอย่างน้อย 2 เท่าจากปกติ หรือลดการกำจัดซับสเตรตออกจากร่างกายได้ร้อยละ 50–80[33]
- สารยับยั้งอย่างอ่อน (Weak inhibitor) คือ สารที่เมื่อยับยั้งการทำงานของเอนไซม์แล้วทำให้ค่า AUC ในกระแสเลือดของซับสเตรตเพิ่มขึ้นอย่างน้อย 1.25 เท่าจากปกติ แต่น้อยกว่า 2 เท่า หรือลดการกำจัดซับสเตรตออกจากร่างกายได้ร้อยละ 20–50[33]
แผนผังปฏิสัมพันธ์
[แก้]คลิกเลือกบนชื่อสีดำของยีน, โปรตีน หรือสารเมแทบอไลต์ด้านล่าง เพื่อเชื่อมต่อไปยังบทความที่เกี่ยวเนื่อง [§ 1]
- ↑ สามารถแก้ไขรายละเอียดในแผนภาพปฏิสัมพันธ์นี้ได้ที่ WikiPathways: "IrinotecanPathway_WP46359".
ดูเพิ่ม
[แก้]อ้างอิง
[แก้]- ↑ Hashimoto H, Toide K, Kitamura R, Fujita M, Tagawa S, Itoh S, Kamataki T (December 1993). "Gene structure of CYP3A4, an adult-specific form of cytochrome P450 in human livers, and its transcriptional control". European Journal of Biochemistry / FEBS. 218 (2): 585–95. doi:10.1111/j.1432-1033.1993.tb18412.x. PMID 8269949.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Inoue K, Inazawa J, Nakagawa H, Shimada T, Yamazaki H, Guengerich FP, Abe T (June 1992). "Assignment of the human cytochrome P-450 nifedipine oxidase gene (CYP3A4) to chromosome 7 at band q22.1 by fluorescence in situ hybridization". The Japanese Journal of Human Genetics. 37 (2): 133–8. doi:10.1007/BF01899734. PMID 1391968.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Cytochrome P450 enzymes in drug metabolism: Regulation of gene expression, enzyme activities, and impact of genetic variation". Pharmacology & Therapeutics. 138: 103–141. doi:10.1016/j.pharmthera.2012.12.007.
- ↑ EntrezGene 1576
- ↑ Bishop-Bailey D, Thomson S, Askari A, Faulkner A, Wheeler-Jones C (2014). "Lipid-metabolizing CYPs in the regulation and dysregulation of metabolism". Annual Review of Nutrition. 34: 261–79. doi:10.1146/annurev-nutr-071813-105747. PMID 24819323.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Fleming I (October 2014). "The pharmacology of the cytochrome P450 epoxygenase/soluble epoxide hydrolase axis in the vasculature and cardiovascular disease". Pharmacological Reviews. 66 (4): 1106–40. doi:10.1124/pr.113.007781. PMID 25244930.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Miyata N, Taniguchi K, Seki T, Ishimoto T, Sato-Watanabe M, Yasuda Y, Doi M, Kametani S, Tomishima Y, Ueki T, Sato M, Kameo K (June 2001). "HET0016, a potent and selective inhibitor of 20-HETE synthesizing enzyme". British Journal of Pharmacology. 133 (3): 325–9. doi:10.1038/sj.bjp.0704101. PMC 1572803. PMID 11375247.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 8.0 8.1 Qiu H, Mathäs M, Nestler S, Bengel C, Nem D, Gödtel-Armbrust U, Lang T, Taudien S, Burk O, Wojnowski L (March 2010). "The unique complexity of the CYP3A4 upstream region suggests a nongenetic explanation of its expression variability". Pharmacogenetics and Genomics. 20 (3): 167–78. doi:10.1097/FPC.0b013e328336bbeb. PMID 20147837.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 9.0 9.1 Kumar S, Qiu H, Oezguen N, Herlyn H, Halpert JR, Wojnowski L (June 2009). "Ligand diversity of human and chimpanzee CYP3A4: activation of human CYP3A4 by lithocholic acid results from positive selection". Drug Metabolism and Disposition. 37 (6): 1328–33. doi:10.1124/dmd.108.024372. PMC 2683693. PMID 19299527.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Johnson TN, Rostami-Hodjegan A, Tucker GT (2006). "Prediction of the clearance of eleven drugs and associated variability in neonates, infants and children". Clinical Pharmacokinetics. 45 (9): 931–56. doi:10.2165/00003088-200645090-00005. PMID 16928154.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Johnson TN, Tucker GT, Rostami-Hodjegan A (May 2008). "Development of CYP2D6 and CYP3A4 in the first year of life". Clinical Pharmacology and Therapeutics. 83 (5): 670–1. doi:10.1038/sj.clpt.6100327. PMID 18043691.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Robertson GR, Field J, Goodwin B, Bierach S, Tran M, Lehnert A, Liddle C (July 2003). "Transgenic mouse models of human CYP3A4 gene regulation". Molecular Pharmacology. 64 (1): 42–50. doi:10.1124/mol.64.1.42. PMID 12815159.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Schmiedlin-Ren P, Edwards DJ, Fitzsimmons ME, He K, Lown KS, Woster PM, Rahman A, Thummel KE, Fisher JM, Hollenberg PF, Watkins PB (November 1997). "Mechanisms of enhanced oral availability of CYP3A4 substrates by grapefruit constituents. Decreased enterocyte CYP3A4 concentration and mechanism-based inactivation by furanocoumarins". Drug Metabolism and Disposition. 25 (11): 1228–33. PMID 9351897.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 14.0 14.1 14.2 Shahrokh K, Cheatham TE, Yost GS (October 2012). "Conformational dynamics of CYP3A4 demonstrate the important role of Arg212 coupled with the opening of ingress, egress and solvent channels to dehydrogenation of 4-hydroxy-tamoxifen". Biochimica et Biophysica Acta. 1820 (10): 1605–17. doi:10.1016/j.bbagen.2012.05.011. PMC 3404218. PMID 22677141.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 15.0 15.1 Meunier B, de Visser SP, Shaik S (September 2004). "Mechanism of oxidation reactions catalyzed by cytochrome p450 enzymes". Chemical Reviews. 104 (9): 3947–80. doi:10.1021/cr020443g. PMID 15352783.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Lee SJ, Goldstein JA (June 2005). "Functionally defective or altered CYP3A4 and CYP3A5 single nucleotide polymorphisms and their detection with genotyping tests". Pharmacogenomics. 6 (4): 357–71. doi:10.1517/14622416.6.4.357. PMID 16004554.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Watkins PB (August 1994). "Noninvasive tests of CYP3A enzymes". Pharmacogenetics. 4 (4): 171–84. doi:10.1097/00008571-199408000-00001. PMID 7987401.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ He K, Iyer KR, Hayes RN, Sinz MW, Woolf TF, Hollenberg PF (April 1998). "Inactivation of cytochrome P450 3A4 by bergamottin, a component of grapefruit juice". Chemical Research in Toxicology. 11 (4): 252–9. doi:10.1021/tx970192k. PMID 9548795.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 19.0 19.1 Bailey DG, Malcolm J, Arnold O, Spence JD (August 1998). "Grapefruit juice-drug interactions". British Journal of Clinical Pharmacology. 46 (2): 101–10. doi:10.1046/j.1365-2125.1998.00764.x. PMC 1873672. PMID 9723817.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Garg SK, Kumar N, Bhargava VK, Prabhakar SK (September 1998). "Effect of grapefruit juice on carbamazepine bioavailability in patients with epilepsy". Clinical Pharmacology and Therapeutics. 64 (3): 286–8. doi:10.1016/S0009-9236(98)90177-1. PMID 9757152.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Bailey DG, Dresser GK (2004). "Interactions between grapefruit juice and cardiovascular drugs". American Journal of Cardiovascular Drugs. 4 (5): 281–97. doi:10.2165/00129784-200404050-00002. PMID 15449971.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Bressler R (November 2006). "Grapefruit juice and drug interactions. Exploring mechanisms of this interaction and potential toxicity for certain drugs". Geriatrics. 61 (11): 12–8. PMID 17112309.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Lilja JJ, Kivistö KT, Neuvonen PJ (October 2000). "Duration of effect of grapefruit juice on the pharmacokinetics of the CYP3A4 substrate simvastatin". Clinical Pharmacology and Therapeutics. 68 (4): 384–90. doi:10.1067/mcp.2000.110216. PMID 11061578.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Integrative Medicine, Noni". Memorial Sloan-Kettering Cancer Center. สืบค้นเมื่อ 2013-06-27.
- ↑ Hidaka M, Okumura M, Fujita K, Ogikubo T, Yamasaki K, Iwakiri T, Setoguchi N, Arimori K (May 2005). "Effects of pomegranate juice on human cytochrome p450 3A (CYP3A) and carbamazepine pharmacokinetics in rats". Drug Metabolism and Disposition. 33 (5): 644–8. doi:10.1124/dmd.104.002824. PMID 15673597.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Ratajewski M, Walczak-Drzewiecka A, Sałkowska A, Dastych J (August 2011). "Aflatoxins upregulate CYP3A4 mRNA expression in a process that involves the PXR transcription factor". Toxicology Letters. 205 (2): 146–53. doi:10.1016/j.toxlet.2011.05.1034. PMID 21641981.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Wolbold R, Klein K, Burk O, Nüssler AK, Neuhaus P, Eichelbaum M, Schwab M, Zanger UM (October 2003). "Sex is a major determinant of CYP3A4 expression in human liver". Hepatology. 38 (4): 978–88. doi:10.1053/jhep.2003.50393. PMID 14512885.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 28.0 28.1 28.2 28.3 Gonzalez FJ (2007). "CYP3A4 and pregnane X receptor humanized mice". Journal of Biochemical and Molecular Toxicology. 21 (4): 158–62. doi:10.1002/jbt.20173. PMID 17936928.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 29.0 29.1 Crago J, Klaper RD (September 2011). "Influence of gender, feeding regimen, and exposure duration on gene expression associated with xenobiotic metabolism in fathead minnows (Pimephales promelas)". Comparative Biochemistry and Physiology. Toxicology & Pharmacology. 154 (3): 208–12. doi:10.1016/j.cbpc.2011.05.016. PMID 21664292.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 30.0 30.1 Yang J, Liao M, Shou M, Jamei M, Yeo KR, Tucker GT, Rostami-Hodjegan A (June 2008). "Cytochrome p450 turnover: regulation of synthesis and degradation, methods for determining rates, and implications for the prediction of drug interactions". Current Drug Metabolism. 9 (5): 384–94. doi:10.2174/138920008784746382. PMID 18537575.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Sevrioukova IF, Poulos TL (January 2012). "Structural and mechanistic insights into the interaction of cytochrome P4503A4 with bromoergocryptine, a type I ligand". The Journal of Biological Chemistry. 287 (5): 3510–7. doi:10.1074/jbc.M111.317081. PMC 3271004. PMID 22157006.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 32.0 32.1 Das A, Zhao J, Schatz GC, Sligar SG, Van Duyne RP (May 2009). "Screening of type I and II drug binding to human cytochrome P450-3A4 in nanodiscs by localized surface plasmon resonance spectroscopy". Analytical Chemistry. 81 (10): 3754–9. doi:10.1021/ac802612z. PMC 4757437. PMID 19364136.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 33.000 33.001 33.002 33.003 33.004 33.005 33.006 33.007 33.008 33.009 33.010 33.011 33.012 33.013 33.014 33.015 33.016 33.017 33.018 33.019 33.020 33.021 33.022 33.023 33.024 33.025 33.026 33.027 33.028 33.029 33.030 33.031 33.032 33.033 33.034 33.035 33.036 33.037 33.038 33.039 33.040 33.041 33.042 33.043 33.044 33.045 33.046 33.047 33.048 33.049 33.050 33.051 33.052 33.053 33.054 33.055 33.056 33.057 33.058 33.059 33.060 33.061 33.062 33.063 33.064 33.065 33.066 33.067 33.068 33.069 33.070 33.071 33.072 33.073 33.074 33.075 33.076 33.077 33.078 33.079 33.080 33.081 33.082 33.083 33.084 33.085 33.086 33.087 33.088 33.089 33.090 33.091 33.092 33.093 33.094 33.095 33.096 33.097 33.098 33.099 33.100 33.101 33.102 33.103 33.104 33.105 33.106 33.107 33.108 33.109 33.110 33.111 33.112 33.113 33.114 33.115 33.116 33.117 33.118 33.119 33.120 Flockhart DA (2007). "Drug Interactions: Cytochrome P450 Drug Interaction Table". Indiana University School of Medicine. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-10-10. สืบค้นเมื่อ 2018-04-10. Retrieved on December 25, 2008.
- ↑ Where classes of agents are listed, there may be exceptions within the class
- ↑ 35.00 35.01 35.02 35.03 35.04 35.05 35.06 35.07 35.08 35.09 35.10 35.11 35.12 35.13 35.14 35.15 35.16 35.17 35.18 35.19 35.20 35.21 35.22 35.23 35.24 35.25 35.26 35.27 35.28 35.29 35.30 35.31 35.32 35.33 35.34 35.35 35.36 35.37 35.38 35.39 35.40 35.41 35.42 35.43 35.44 35.45 35.46 35.47 35.48 35.49 35.50 35.51 35.52 35.53 35.54 35.55 35.56 35.57 35.58 35.59 35.60 35.61 35.62 35.63 35.64 35.65 35.66 35.67 35.68 FASS (drug formulary): Swedish environmental classification of pharmaceuticals Facts for prescribers (Fakta för förskrivare). Retrieved July 2011
- ↑ "Erlotinib".
Metabolized primarily by CYP3A4 and, to a lesser degree, by CYP1A2 and the extrahepatic isoform CYP1A1
- ↑ "Cyclobenzaprine". DrugBank.
- ↑ Moody DE, Fang WB, Lin SN, Weyant DM, Strom SC, Omiecinski CJ (December 2009). "Effect of rifampin and nelfinavir on the metabolism of methadone and buprenorphine in primary cultures of human hepatocytes". Drug Metabolism and Disposition. 37 (12): 2323–9. doi:10.1124/dmd.109.028605. PMC 2784702. PMID 19773542.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Hutchinson MR, Menelaou A, Foster DJ, Coller JK, Somogyi AA (Mar 2004). "CYP2D6 and CYP3A4 involvement in the primary oxidative metabolism of hydrocodone by human liver microsomes". British Journal of Clinical Pharmacology. 57: 287–97. doi:10.1046/j.1365-2125.2003.02002.x. PMC 1884456. PMID 14998425.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Druglib.com เก็บถาวร 2018-05-09 ที่ เวย์แบ็กแมชชีน[ต้องการอ้างอิงเต็มรูปแบบ]
- ↑ Cockshott ID (2004). "Bicalutamide: clinical pharmacokinetics and metabolism". Clinical Pharmacokinetics. 43 (13): 855–78. doi:10.2165/00003088-200443130-00003. PMID 15509184.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Matsumoto S, Yamazoe Y (February 2001). "Involvement of multiple human cytochromes P450 in the liver microsomal metabolism of astemizole and a comparison with terfenadine". British Journal of Clinical Pharmacology. 51 (2): 133–42. doi:10.1046/j.1365-2125.2001.01292.x. PMC 2014443. PMID 11259984.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Enzyme 1.14.13.32 at KEGG
- ↑ "Showing Protein Cytochrome P450 3A4 (HMDBP01018)". Human Metabolome Database. สืบค้นเมื่อ 2017-08-05.
- ↑ Daly AK, King BP (May 2003). "Pharmacogenetics of oral anticoagulants". Pharmacogenetics. 13 (5): 247–52. doi:10.1097/00008571-200305000-00002. PMID 12724615.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Lau WC, Waskell LA, Watkins PB, Neer CJ, Horowitz K, Hopp AS, Tait AR, Carville DG, Guyer KE, Bates ER (January 2003). "Atorvastatin reduces the ability of clopidogrel to inhibit platelet aggregation: a new drug-drug interaction". Circulation. 107 (1): 32–7. doi:10.1161/01.CIR.0000047060.60595.CC. PMID 12515739.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Meyer MR, Bach M, Welter J, Bovens M, Turcant A, Maurer HH (July 2013). "Ketamine-derived designer drug methoxetamine: metabolism including isoenzyme kinetics and toxicological detectability using GC-MS and LC-(HR-)MSn". Analytical and Bioanalytical Chemistry. 405 (19): 6307–21. doi:10.1007/s00216-013-7051-6. PMID 23774830.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 48.0 48.1 48.2 48.3 48.4 48.5 Rod Flower; Humphrey P. Rang; Maureen M. Dale; Ritter, James M. (2007). Rang & Dale's pharmacology. Edinburgh: Churchill Livingstone. ISBN 0-443-06911-5.[ต้องการเลขหน้า]
- ↑ Park JY, Kim KA, Kim SL (November 2003). "Chloramphenicol is a potent inhibitor of cytochrome P450 isoforms CYP2C19 and CYP3A4 in human liver microsomes". Antimicrobial Agents and Chemotherapy. 47 (11): 3464–9. doi:10.1128/AAC.47.11.3464-3469.2003. PMC 253795. PMID 14576103.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "สำเนาที่เก็บถาวร". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-01-16. สืบค้นเมื่อ 2018-04-10.[ต้องการอ้างอิงเต็มรูปแบบ]
- ↑ Zhang W, Ramamoorthy Y, Tyndale RF, Sellers EM (June 2003). "Interaction of buprenorphine and its metabolite norbuprenorphine with cytochromes p450 in vitro". Drug Metabolism and Disposition. 31 (6): 768–72. doi:10.1124/dmd.31.6.768. PMID 12756210.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ http://www.aapsj.org/abstracts/AM_2009/AAPS2009-001235.PDF[ต้องการอ้างอิงเต็มรูปแบบ] เก็บถาวร กรกฎาคม 21, 2011 ที่ เวย์แบ็กแมชชีน
- ↑ Wen X, Wang JS, Kivistö KT, Neuvonen PJ, Backman JT. "In vitro evaluation of valproic acid as an inhibitor of human cytochrome P450 isoforms: preferential inhibition of cytochrome P450 2C9 (CYP2C9)". Br J Clin Pharmacol. 52: 547–53. doi:10.1046/j.0306-5251.2001.01474.x. PMC 2014611. PMID 11736863.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ [1] Potent inhibition of human cytochrome P450 3A isoforms by cannabidiol: Role of phenolic hydroxyl groups in the resorcinol moiety
- ↑ 55.0 55.1 Non-nucleoside reverse transcriptase inhibitors have been shown to both induce and inhibit CYP3A4.
- ↑ Hidaka M, Fujita K, Ogikubo T, Yamasaki K, Iwakiri T, Okumura M, Kodama H, Arimori K (June 2004). "Potent inhibition by star fruit of human cytochrome P450 3A (CYP3A) activity". Drug Metabolism and Disposition. 32 (6): 581–3. doi:10.1124/dmd.32.6.581. PMID 15155547.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ HCVadvocate.org เก็บถาวร 2010-03-05 ที่ เวย์แบ็กแมชชีน[ต้องการอ้างอิงเต็มรูปแบบ]
- ↑ Gaudineau C, Auclair K (May 2004). "Inhibition of human P450 enzymes by nicotinic acid and nicotinamide". Biochemical and Biophysical Research Communications. 317 (3): 950–6. doi:10.1016/j.bbrc.2004.03.137. PMID 15081432.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Kimura Y, Ito H, Ohnishi R, Hatano T (January 2010). "Inhibitory effects of polyphenols on human cytochrome P450 3A4 and 2C9 activity". Food and Chemical Toxicology. 48 (1): 429–35. doi:10.1016/j.fct.2009.10.041. PMID 19883715.
Ginko Biloba has been shown to contain the potent inhibitor amentoflavone
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Bhardwaj RK, Glaeser H, Becquemont L, Klotz U, Gupta SK, Fromm MF (August 2002). "Piperine, a major constituent of black pepper, inhibits human P-glycoprotein and CYP3A4". The Journal of Pharmacology and Experimental Therapeutics. 302 (2): 645–50. doi:10.1124/jpet.102.034728. PMID 12130727.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Wen X, Wang JS, Neuvonen PJ, Backman JT (January 2002). "Isoniazid is a mechanism-based inhibitor of cytochrome P450 1A2, 2A6, 2C19 and 3A4 isoforms in human liver microsomes". European Journal of Clinical Pharmacology. 57 (11): 799–804. doi:10.1007/s00228-001-0396-3. PMID 11868802.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Savai J, Varghese A, Pandita N, Chintamaneni M (May 2015). "Investigation of CYP3A4 and CYP2D6 Interactions of Withania somnifera and Centella asiatica in Human Liver Microsomes". Phytotherapy Research. 29 (5): 785–90. doi:10.1002/ptr.5308. PMID 25684704.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ https://www.accessdata.fda.gov/drugsatfda_docs/label/2012/203415lbl.pdf
- ↑ Nallani, Srikanth C.; Glauser, Tracy A.; Hariparsad, Niresh; Setchell, Kenneth; Buckley, Donna J.; Buckley, Arthur R.; Desai, Pankaj B. (2003-12-01). "Dose-dependent induction of cytochrome P450 (CYP) 3A4 and activation of pregnane X receptor by topiramate". Epilepsia. 44 (12): 1521–1528. doi:10.1111/j.0013-9580.2003.06203.x. ISSN 0013-9580. PMID 14636322.
- ↑ Chae YJ, Cho KH, Yoon IS, Noh CK, Lee HJ, Park Y, Ji E, Seo MD, Maeng HJ (January 2016). "Vitamin D Receptor-Mediated Upregulation of CYP3A4 and MDR1 by Quercetin in Caco-2 cells". Planta Medica. 82 (1–2): 121–30. doi:10.1055/s-0035-1557898. PMID 26366751.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Han EH, Kim HG, Choi JH, Jang YJ, Lee SS, Kwon KI, Kim E, Noh K, Jeong TC, Hwang YP, Chung YC, Kang W, Jeong HG (May 2012). "Capsaicin induces CYP3A4 expression via pregnane X receptor and CCAAT/enhancer-binding protein β activation". Molecular Nutrition & Food Research. 56 (5): 797–809. doi:10.1002/mnfr.201100697. PMID 22648626.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์)
แหล่งข้อมูลอื่น
[แก้]- PharmGKB: Annotated PGx Gene Information for CYP3A4 เก็บถาวร 2010-04-15 ที่ เวย์แบ็กแมชชีน
- CYP3A4 substrate prediction เก็บถาวร 2011-02-15 ที่ เวย์แบ็กแมชชีน
- ตำแหน่งจีโนม CYP3A4 ของมนุษย์ และหน้าเพจแสดงข้อมูลเกี่ยวกับยีน CYP3A4 ใน UCSC Genome Browser
บทความนี้รวบรวมข้อมูลจากหอสมุดแพทยศาสตร์แห่งชาติอเมริกัน ซึ่งจัดเป็นสาธารณสมบัติ







