อโลหะ
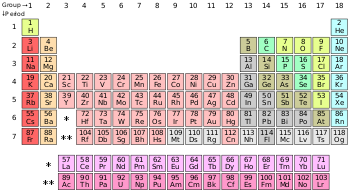
นอกเหนือจากไฮโดรเจน อโลหะอยู่ในบล็อก-p ธาตุฮีเลียมแม้เป็นธาตุบล็อก-s แต่ปกติวางอยู่เหนือนีออน (ในบล็อก-p) เนื่องจากคุณสมบัติแก๊สมีสกุลของมัน
ในวิชาเคมี อโลหะเป็นธาตุเคมีซึ่งส่วนมากขาดคุณสมบัติของโลหะ ทางกายภาพ อโลหะมักกลายเป็นไอ (ระเหย) ง่าย มีความยืดหยุ่นต่ำ และเป็นฉนวนความร้อนและฉนวนไฟฟ้าที่ดี ในทางเคมี ธาตุเหล่านี้มักมีพลังงานไอออไนเซชันและค่าอิเล็กโตรเนกาทิวิตี (electronegativity) สูง และให้หรือได้อิเล็กตรอนเมื่อทำปฏิกิริยากับธาตุหรือสารประกอบอื่น มีสิบเจ็ดธาตุที่จัดเป็นอโลหะโดยทั่วไป ส่วนมากเป็นแก๊ส (ไฮโดรเจน ฮีเลียม ไนโตรเจน ออกซิเจน ฟลูออรีน นีออน คลอรีน อาร์กอน คริปทอน ซีนอน และเรดอน) หนึ่งธาตุเป็นของเหลว (โบรมีน) และส่วนน้อยเป็นของแข็ง (คาร์บอน ฟอสฟอรัส กำมะถัน เซเลเนียมและไอโอดีน)
ธาตุอโลหะมีโครงสร้างซึ่งมีเลขโคออร์ดิเนชัน (อะตอมเพื่อนบ้านใกล้ที่สุด) น้อยลงเรื่อย ๆ เมื่อเลื่อนไปทางขวามือของตารางธาตุแบบมาตรฐาน อโลหะหลายอะตอมมีโครงสร้างที่มีอะตอมเพื่อนบ้านใกล้ที่สุดสามอะตอม เช่นในกรณีของคาร์บอน (ในสถานะมาตรฐานกราฟีน) หรือสองอะตอม เช่นในกรณีของกำมะถัน อโลหะสองอะตอม เช่น ไฮโดรเจน มีอะตอมเพื่อนบ้านใกล้ที่สุดหนึ่งอะตอม และแก๊สมีสกุลอะตอมเดียว เช่น ฮีเลียม ไม่มีอะตอมเพื่อนบ้านใกล้ที่สุด ยิ่งมีจำนวนอะตอมเพื่อนบ้านใกล้ที่สุดน้อยลงเท่าใดยิ่งสัมพันธ์กับการลดลงของความเป็นโลหะและเพิ่มความเป็นอโลหะมากขึ้นเท่านั้น แต่ข้อแตกต่างระหว่างอโลหะสามหมวดในแง่ของความเป็นโลหะที่ลดนั้นไม่สัมบูรณ์ มีขอบเขตทับซ้อนกันเมื่อธาตุรอบนอกในแต่ละหมวดแสดง (หรือเริ่มแสดง) คุณสมบัติที่ต่างกันน้อย คล้ายลูกผสมหรือไม่ตรงแบบ
แม้ว่าธาตุโลหะมีมากกว่าอโลหะห้าเท่า แต่ธาตุอโลหะสองธาตุ ไฮโดรเจนและฮีเลียม ประกอบเป็นร้อยละ 99 ของเอกภพที่สังเกตได้ และหนึ่งธาตุ ออกซิเจน ประกอบเป็นเกือบครึ่งหนึ่งของเปลือกโลก มหาสมุทรและบรรยากาศของโลก สิ่งมีชีวิตยังประกอบด้วยอโลหะแทบทั้งหมด และธาตุอโลหะก่อสารประกอบมากกว่าโลหะมาก
บทนิยามและคุณสมบัติ
[แก้]ไม่มีบทนิยามของอโลหะที่เคร่งครัด อโลหะมีคุณสมบัติหลากหลายกว่าเมื่อเทียบกับโลหะ ต่อไปนี้เป็นคุณลักษณะสำคัญบางประการของอโลหะ ทางกายภาพ ส่วนใหญ่อยู่เป็นแก๊สอะตอมเดียว โดยส่วนน้อยมีรูปสองอะตอมหรือหลายอะตอม หากเป็นของแข็ง โดยทั่วไปมีคุณสมบัติมัว และเปราะ ตรงข้ามกับโลหะ ซึ่งวาว ตีขึ้นรูปหรือยืดเป็นเส้นได้ ปกติมีความหนาแน่นต่ำกว่าโลหะ เป็นตัวนำความร้อนและไฟฟ้าที่เลวเมื่อเทียบกับโลหะ และมีจุดหลอมเหลวและจุดเดือดต่ำกว่าของโลหะมาก (ยกเว้นคาร์บอน) ทางเคมี อโลหะมีพลังงานไอออไนเซชันและค่าอิเล็กโตรเนกาทิวิตีสูง ปกติมีเป็นแอนไอออนหรืออ็อกซีแอนไอออนในสารละลายน้ำ โดยทั่วไปก่อสารประกอบไอออนิกหรือแทรกเมื่อผสมกับโลหะ ซึ่งไม่เหมือนกับโลหะซึ่งก่อโลหะเจือ (อัลลอยด์) และมีออกไซด์กรดขณะที่ออกไซด์ทั่วไปของโลหะเป็นเบส
ธาตุซึ่งจำแนกเป็นอโลหะโดยทั่วไปมีหนึ่งธาตุในหมู่ 1 (ไฮโดรเจน) หนึ่งธาตุในหมู่ 14 (คาร์บอน) สองธาตุในหมู่ 15 (ไนโตรเจนและฟอสฟอรัส) สามธาตุในหมู่ 16 (ออกซิเจน กำมะถันและเซเลเนียม) ธาตุส่วนใหญ่ในหมู่ 17 (ฟลูออรีน คลอรีน โบรมีนและไอโอดีน) และทุกธาตุในกลุ่ม 18 (อาจยกเว้นออกาเนสซอน)
ข้อแตกต่างระหว่างอโลหะและโลหะไม่ชัดเจนทุกประการ ผลคือ มีธาตุคาบเส้นบางธาตุที่ไม่มีคุณสมบัติอโลหะหรือโลหะมากกว่ากันที่จำแนกเป็นกึ่งโลหะ และบางธาตุที่จำแนกเป็นอโลหะบางทีจำแนกเป็นกึ่งโลหะ หรือกลับกันก็มี ตัวอย่างเช่น เซเลเนียม (Se) ธาตุอโลหะ ซึ่งบางทีจำแนกเป็นกึ่งโลหะ โดยเฉพาะอย่างยิ่งในวิชาเคมีสิ่งแวดล้อม และแอสทาซีน (At) ซึ่งเป็นกึ่งโลหะและแฮโลเจน บางทีจำแนกเป็นอโลหะ
หมวดหมู่
[แก้]อโลหะมีโครงสร้างซึ่งแต่ละอะตอมปกติก่อ (8 − N) พันธะกับอะตอมเพื่อนบ้านที่ใกล้ที่สุด (8 − N) อะตอม โดยที่ N เป็นจำนวนเวเลนซ์อิเล็กตรอน (อิเล็กตรอนวงนอกสุด) ฉะนั้น แต่ละอะตอมจึงสามารถเติมระดับชั้นอิเล็กตรอนให้เต็มและมีโครงแบบแก๊สมีสกุลที่เสถียร ข้อยกเว้นของกฎ (8 − N) คือ ไฮโดรเจน (ซึ่งต้องการพันธะเดียวเพื่อเติมชั้นอิเล็กตรอนให้เต็ม) คาร์บอน ไนโตรเจนและออกซิเจน อะตอมของสามธาตุหลังนี้เล็กพอที่สามารถก่อโครงสร้างพันธะอื่น (ที่เสถียรกว่า) ได้ โดยมีอะตอมเพื่อนบ้านที่ใกล้ที่สุดน้อยกว่า ฉะนั้น คาร์บอนจึงสามารถก่อโครงสร้างกราฟีนเป็นชั้นได้ และไนโตรเจนและออกซิเจนสามารถก่อโมเลกุลสองอะตอมโดยมีพันธะสามและพันธะคู่ตามลำดับ ธาตุอโลหะที่มิใช่แก๊สมีสกุลที่มีขนาดใหญ่กว่าที่เหลือทำให้ไม่ค่อยสามารถก่อหลายพันธะได้ แต่ต้องก่อสองพันธะหรือพันธะเดียวกับอะตอมตั้งแต่สองอะตอมขึ้นไปแทน ตัวอย่างเช่น กำมะถัน ก่อโมเลกุลแปดอะตอมซึ่งมีการจัดเรียงอะตอมเป็นวงแหวน โดยแต่ละอะตอมก่อสองพันธะเดี่ยวกับอะตอมอื่น
ธาตุมีความเป็นโลหะลดลงจากซ้ายไปขวาตามตารางธาตุแบบมาตรฐาน ฉะนั้น อโลหะจึงมีโครงสร้สางที่แสดงการลดของจำนวนอะตอมเพื่อนบ้านที่ใกล้ที่สุด สามหรือสองอะตอมสำหรับอโลหะหลายอะตอม เหลือหนึ่งสำหรับอโลหะสองอะตอม และศูนย์สำหรับแก๊สมีสกุลอะตอมเดียว เกิดรูปแบบคล้ายกันมากกว่า ในระดับทั้งตารางธาตุ โดยเปรียบเทียบระหว่างโลหะและอโลหะ มีการเปลี่ยนแปลงจากพันธะโลหะในหมู่โลหะที่อยู่ฝั่งซ้ายของตาราง ไปเป็นพันธะโคเวเลนต์หรือพันธะวันเดอร์วาลส์ (ไฟฟ้าสถิต) ในหมู่อโลหะที่อยู่ฝั่งขวามือของตาราง พันธะโลหะมักเกี่ยวข้องกับโครงสร้างสมมาตรศูนย์กลางอัดแน่น (close-packed centrosymmetric) โดยมีอะตอมเพื่อนบ้านใกล้ที่สุดจำนวนมาก โลหะหลังทรานซิชันและกึ่งโลหะที่อยู่ระหว่างโลหะแท้และอโลหะ มักมีโครงสร้างซับซ้อนกว่าโดยมีจำนวนอะตอมเพื่อนบ้านใกล้ที่สุดปานกลาง พันธะอโลหะที่อยู่ฝั่งขวามือของตาราง มีโครงสร้างมีทิศทางไม่อัดแน่นหรือไม่เป็นระเบียบโดยมีอะตอมเพื่อนบ้านใกล้ที่สุดน้อยกว่าโลหะหรือไม่มีเลย ดังที่กล่าวมาข้างต้น การลดจำนวนอะตอมเพื่อนบ้านใกล้ที่สุดอย่างคงที่นี้ ดังที่ความเป็นโลหะลดและความเป็นอโลหะเพิ่ม สะท้อนอยู่ในหมู่อโลหะ เป็นโครงสร้างที่ค่อย ๆ เปลี่ยนจากหลายอะตอม เป็นสองอะตอม เป็นอะตอมเดียว
