ไฮโดรเจนโบรไมด์
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |
| |||
| |||
| ชื่อ | |||
|---|---|---|---|
| IUPAC name
Hydrogen bromide
| |||
| Preferred IUPAC name
Bromane [1] | |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| 3587158 | |||
| ChEBI | |||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.030.090 | ||
| EC Number |
| ||
| KEGG | |||
| MeSH | Hydrobromic+Acid | ||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1048 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
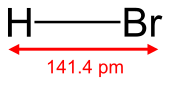
| HBr | |||
| มวลโมเลกุล | 80.91 g/mol | ||
| ลักษณะทางกายภาพ | แก๊สไม่มีสี | ||
| กลิ่น | ฉุน | ||
| ความหนาแน่น | 3.307 g/mL (25 °C)[2] | ||
| จุดหลอมเหลว | −86.9 องศาเซลเซียส (−124.4 องศาฟาเรนไฮต์; 186.2 เคลวิน) | ||
| จุดเดือด | −66.8 องศาเซลเซียส (−88.2 องศาฟาเรนไฮต์; 206.3 เคลวิน) | ||
| 221 g/100 mL (0 °C) 204 g/100 mL (15 °C) 193 g/100 mL (20 °C) 130 g/100 mL (100 °C) | |||
| ความสามารถละลายได้ | ละลายได้ในแอลกอฮอล์ ตัวทำละลายอินทรีย์ | ||
| ความดันไอ | 2.308 MPa (at 21 °C) | ||
| pKa | −8.8 (±0.8);[3] ~−9[4] | ||
| Basicity (pKb) | ~23 | ||
| กรด | Bromonium | ||
| เบส | Bromide | ||
ดัชนีหักเหแสง (nD)
|
1.325[ต้องการอ้างอิง] | ||
| โครงสร้าง | |||
| เส้นตรง | |||
| 820 mD | |||
| อุณหเคมี | |||
ความจุความร้อน (C)
|
350.7 mJ/(K·g) | ||
Std molar
entropy (S⦵298) |
198.696–198.704 J/(K·mol)[5] | ||
Std enthalpy of
formation (ΔfH⦵298) |
−36.45...−36.13 kJ/mol[5] | ||
| ความอันตราย | |||
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |||
อันตรายหลัก
|
มีฤทธิ์กัดกร่อนสูง | ||
| GHS labelling: | |||
 
| |||
| อันตราย | |||
| H314, H335 | |||
| P261, P280, P305+P351+P338, P310 | |||
| NFPA 704 (fire diamond) | |||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LC50 (median concentration)
|
2858 ppm (rat, 1 h) 814 ppm (mouse, 1 h)[7] | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
TWA 3 ppm (10 mg/m3)[6] | ||
REL (Recommended)
|
TWA 3 ppm (10 mg/m3)[6] | ||
IDLH (Immediate danger)
|
30 ppm[6] | ||
| เอกสารข้อมูลความปลอดภัย (SDS) | hazard.com | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
สารประกอบที่เกี่ยวข้อง
|
ไฮโดรเจนฟลูออไรด์ ไฮโดรเจนคลอไรด์ ไฮโดรเจนไอโอไดด์ ไฮโดรเจนแอสทาไทด์ | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
ไฮโดรเจนโบรไมด์ (อังกฤษ: hydrogen bromide) มีสูตรเคมีว่า HBr เป็นสารประกอบอนินทรีย์ชนิดหนึ่ง ซึ่งโมเลกุลประกอบขึ้นจากธาตุสองตัว ได้แก่ ไฮโดรเจน และโบรมีน ไฮโดรเจนโบรไมด์มีสถานะเป็นแก๊สที่ภาวะมาตรฐาน และเมื่อนำไปผสมน้ำจะได้เป็นกรดไฮโดรโบรมิก ในทางกลับกันเราสามารถสกัดเอาไฮโดรเจนโบรไมด์ออกจากสารละลายดังกล่าวได้ โดยการเติมตัวดูดความชื้น (dehydration agent) เพื่อไล่น้ำออก แต่ไม่สามารถแยกได้โดยการกลั่น ถือได้ว่าไฮโดรเจนโบรไมด์และกรดไฮโดรโบมิกมีความสัมพันธ์กัน แต่ไม่ใช่สารชนิดเดียวกัน ซึ่งในบางครั้งนักเคมีอาจใช้สูตร "HBr" แทนกรดไฮโดรโบมิก พร้อมทั้งเป็นที่เข้าใจกันในหมู่นักเคมีส่วนใหญ่ แต่อาจทำให้บุคคลทั่วไปเกิดความเข้าใจผิดหรือสับสนระหว่างสารสองชนิดนี้ได้
ประวัติ
[แก้]นักเคมีชาวฝรั่งเศส อ็องตวน เฌโรม บาลาร์ (Antoine-Jérôme Balard) ผู้ค้นพบธาตุโบรมีนในดินโป่งใกล้เมืองมงเปอลีเย เคยทำการศึกษาไฮโดรเจนโบรไมด์และสังเคราะห์ได้สำเร็จ
คุณสมบัติ
[แก้]ที่อุณหภูมิห้อง ไฮโดรเจนโบรไมด์มีสถานะเป็นแก๊สไม่ไวไฟ มีกลิ่นฉุน มีความเสถียร เมื่อกระจายในอากาศชื้นจะกลายเป็นควันเนื่องจากทำปฏิกิริยากับไอน้ำกลายเป็นกรดไฮโดรโบรมิก ไฮโดรเจนโบรไมด์ละลายได้ดีในน้ำ ซึ่งได้ผลิตภัณฑ์เป็นกรดไฮโดรโบรมิก โดยสารละลายจะอิ่มตัวเมื่อมีปริมาณ HBr ในน้ำที่ 68.85% ที่อุณหภูมิห้อง นอกจากนี้ไฮโดรเจนโบรไมด์ยังมีฤทธิ์กัดกร่อน สารที่ควรหลีกเลี่ยงได้แก่ สารออกซิไดซ์ โลหะ และอัลคาไล[8]
ประโยชน์
[แก้]ใช้ในการวิเคราะห์ธาตุปรอท ใช้ในการผลิตสารซีเซียม[8] ใช้ในการสังเคราะห์สารประกอบอินทรีย์และโบรไมด์ ใช้ละลายแร่ และเร่งปฏิกิริยาแอลคิลเลชัน (alkylation)[9]
การสังเคราะห์สาร
[แก้]ในกระบวนการสังเคราะห์สารเคมี ไฮโดรเจนโบรไมด์มีประโยชน์ในหลายด้าน ตัวอย่างเช่น
ใช้ทำปฏิกิริยากับแอลกอฮอล์เพื่อให้ได้ผลิตภัณฑ์เป็นแอลคิลโบรไมด์ ดังสมการ
ใช้ทำปฏิกิริยากับแอลคีน ได้ผลิตภัณฑ์เป็นโบรโมแอลแคน
ใช้ทำปฏิกิริยากับแอลไคน์ ได้ผลิตภัณฑ์เป็นโบรโมแอลคีน
ใช้ทำปฏิกิริยากับแฮโลแอลคีน ได้ผลิตภัณฑ์เป็นไดแฮโลแอลเคนแบบ geminal ซึ่งปฏิกิริยานี้เป็นไปตามกฎของมาร์คอฟนิคอฟ (Markovnikov's rule) มีสมการดังนี้
นอกจากนี้แล้ว ไฮโดรเจนโบรไมด์ยังเป็นตัวเร่งให้กับปฏิกิริยาของสารอินทรีย์อีกมากมาย[10][11][12][13]
การเตรียม
[แก้]ในภาคอุตสาหกรรม
[แก้]ไฮโดรเจนโบรไมด์ (เช่นเดียวกับกรดไฮโดรโบรมิก) ถูกผลิตขึ้นในปริมาณน้อยกว่ามากเมื่อเทียบกับไฮโดรเจนคลอไรด์ (และกรดไฮโดรคลอริก) สำหรับการเตรียมขั้นต้น ไฮโดรเจนและโบรมีนจะรวมตัวเป็นไฮโดรเจนโบรไมด์ ที่อุณหภูมิระหว่าง 200–400 °C และมักใช้ธาตุแพลตินัมหรือแร่ใยหินเป็นตัวเร่งปฏิกิริยา[11][14]
ในห้องปฏิบัติการ
[แก้]เราสามารถสังเคราะห์ไฮโดรเจนโบรไมด์ได้หลายวิธีในห้องทดลอง เช่น โดยการกลั่นสารละลายโซเดียมโบรไมด์หรือโพแทสเซียมโบรไมด์ กับกรดฟอสฟอริกหรือกรดซัลฟิวริกเจือจาง[15] ดังสมการ
แต่ถ้าใช้กรดซัลฟิวริกเข้มข้น จะไม่เกิดผลิตภัณฑ์เป็นไฮโดรเจนโบรไมด์ เนื่องจากสารดังกล่าวจะถูกออกซิไดซ์กลายเป็นแก๊สโบรมีนแทน ดังสมการ
การสังเคราะห์ด้วยวิธีอื่น ๆ เช่น นำโบรมีนทำปฏิกิริยากับฟอสฟอรัสและน้ำ หรือโบรมีนทำปฏิกิริยากับกำมะถันและน้ำก็ได้เช่นเดียวกัน[16] ดังสมการ
หรืออาจเตรียมได้โดยให้เตตระลิน (1,2,3,4-เตตระไฮโดรแนฟทาลีน) เกิดปฏิกิริยาโบรมิเนชัน (bromination, ปฏิกิริยาแทนที่ด้วยโบรมีน)[17] ดังสมการ
นอกจากเตตระลินแล้ว ยังสามารถนำโทลูอีนมาทำให้เกิดปฏิกิริยาโบรมิเนชันได้อีกด้วย ซึ่งจะได้ผลิตภัณฑ์เป็นเบนซิลโบรไมด์และไฮโดรเจนโบรไมด์ ดังนี้
หรือ ทำให้โบรมีนถูกรีดิวซ์ด้วยกรดฟอสฟอรัส[11] ดังสมการ
ไฮโดรเจนโบรไมด์ที่ผลิตได้จากปฏิกิริยาข้างต้นทั้งหมดอาจมี Br2 ปนเปื้อนได้ ซึ่งสามารถแยกออกได้โดยนำแก๊สไฮโดรเจนโบรไมด์ผ่านตัวกลึงทองแดง (Copper turnings) หรือผ่านฟีนอล[14]
อันตรายต่อสุขภาพ
[แก้]เมื่อหายใจเอาแก๊สไฮโดรเจนโบรไมด์เข้าไป ไอระเหยของสารจะทำให้เกิดอาการระคายเคืองอย่างรุนแรง อาจเป็นสาเหตุทำให้ระบบทางเดินหายใจและปอดถูกทำลาย เมื่อสัมผัสทางผิวหนัง จะทำให้เกิดแผลไหม้อย่างรุนแรง เมื่อสัมผัสดวงตา จะทำให้เกิดการระคายเคืองตา ตาแดง และทำให้การมองเห็นไม่ชัดเจน ไฮโดรเจนโบรไมด์ไม่เป็นสารก่อมะเร็งตามบัญชีรายชื่อของ IARC, NTP และ OSHA[8]
- การปฐมพยาบาล
ถ้าหายใจเข้าไปให้เคลื่อนย้ายผู้ป่วยออกไปที่ที่มีอากาศบริสุทธิ์ ถ้าผู้ป่วยหยุดหายใจ ให้ช่วยผายปอด แล้วนำไปพบแพทย์ หากรับประทานเข้าไป อย่ากระตุ้นทำให้เกิดการอาเจียน หากสัมผัสผิวหนังหรือดวงตา ให้ล้างผิวหนังหรือดวงตาด้วยน้ำปริมาณมาก ๆ อย่างน้อย 15 นาที
อ้างอิง
[แก้]- ↑ Favre, Henri A.; Powell, Warren H., บ.ก. (2014). Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013. Cambridge: The Royal Society of Chemistry. p. 131. ISBN 9781849733069.
- ↑ Lide, David R., บ.ก. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A; Leito, Ivo (2016). "Acidity of Strong Acids in Water and Dimethyl Sulfoxide". The Journal of Physical Chemistry A. 120 (20): 3663–9. Bibcode:2016JPCA..120.3663T. doi:10.1021/acs.jpca.6b02253. PMID 27115918. S2CID 29697201.
- ↑ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ↑ 5.0 5.1 Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 978-0-618-94690-7.
- ↑ 6.0 6.1 6.2 NIOSH Pocket Guide to Chemical Hazards. "#0331". National Institute for Occupational Safety and Health (NIOSH).
- ↑ "Hydrogen bromide". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ 8.0 8.1 8.2 ศูนย์ข้อมูลวัตถุอันตรายและเคมีภัณฑ์ เก็บถาวร 2009-02-15 ที่ เวย์แบ็กแมชชีน, กรมควบคุมมลพิษ
- ↑ ฐานข้อมูลโรคที่เกี่ยวข้องกับการทำงานและสารเคมี[ลิงก์เสีย], ฐานความรู้เรื่องความปลอดภัยด้านสารเคมี
- ↑ Hercouet, A.;LeCorre, M. (1988) Triphenylphosphonium bromide: A convenient and quantitative source of gaseous hydrogen bromide. Synthesis, 157-158.
- ↑ 11.0 11.1 11.2 Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford, Great Britain; 1997; pp. 809-812.
- ↑ Carlin, William W. U.S. Patent 4,147,601, April 3, 1979
- ↑ Vollhardt, K. P. C.; Schore, N. E. Organic Chemistry: Structure and Function; 4th Ed.; W. H. Freeman and Company: New York, NY; 2003.
- ↑ 14.0 14.1 Ruhoff, J. R.; Burnett, R. E.; Reid, E. E. "Hydrogen Bromide (Anhydrous)" Organic Syntheses, Vol. 15, p.35 (Coll. Vol. 2, p.338).
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ WebElements: Hydrogen Bromide













