ไฮโดรเจนไซยาไนด์
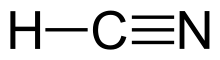
| |||
| |||
| ชื่อ | |||
|---|---|---|---|
| IUPAC name | |||
ชื่ออื่น
| |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| 3DMet | |||
| ChEBI | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.000.747 | ||
| EC Number |
| ||
| KEGG | |||
| MeSH | Hydrogen+Cyanide | ||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1051 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| HCN | |||
| มวลโมเลกุล | 27.0253 g/mol | ||
| ลักษณะทางกายภาพ | ของเหลวใสหรือก๊าซไม่มีสี | ||
| กลิ่น | คล้ายอัลมอนด์[ต้องการอ้างอิง] | ||
| ความหนาแน่น | 0.6876 g/cm3[3] | ||
| จุดหลอมเหลว | −13.29 องศาเซลเซียส (8.08 องศาฟาเรนไฮต์; 259.86 เคลวิน)[3] | ||
| จุดเดือด | 26 องศาเซลเซียส (79 องศาฟาเรนไฮต์; 299 เคลวิน)[3]: 4.67 | ||
| ผสมเข้ากันได้ | |||
| ความสามารถละลายได้ ใน เอทานอล | ผสมเข้ากันได้ | ||
| ความดันไอ | 100 kPa (25 °C)[3]: 6.94 | ||
| 75 μmol Pa−1 kg−1 | |||
| pKa | 9.21 (ในน้ำ),
12.9 (ใน DMSO)[4] | ||
| Basicity (pKb) | 4.79 (ไซยาไนดประจุลบ) | ||
| กรด | Hydrocyanonium | ||
| เบส | ไซยาไนด์ | ||
ดัชนีหักเหแสง (nD)
|
1.2675[5] | ||
| ความหนืด | 0.183 mPa·s (25 °C)[3]: 6.231 | ||
| โครงสร้าง | |||
| C∞v | |||
| เส้นตรง | |||
| 2.98 D | |||
| อุณหเคมี | |||
ความจุความร้อน (C)
|
35.9 J K−1 mol−1 (gas)[3]: 5.19 | ||
Std molar
entropy (S⦵298) |
201.8 J K−1 mol−1 | ||
Std enthalpy of
formation (ΔfH⦵298) |
135.1 kJ mol−1 | ||
| ความอันตราย | |||
| GHS labelling: | |||
   
| |||
| อันตราย | |||
| H225, H300, H310, H319, H330, H336, H370, H410 | |||
| P210, P261, P305+P351+P338 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | −17.8 องศาเซลเซียส (0.0 องศาฟาเรนไฮต์; 255.3 เคลวิน) | ||
| 538 องศาเซลเซียส (1,000 องศาฟาเรนไฮต์; 811 เคลวิน) | |||
| ขีดจำกัดการระเบิด | 5.6% – 40.0%[6] | ||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LC50 (median concentration)
|
501 ppm (rat, 5 นาที) 323 ppm (mouse, 5 นาที) 275 ppm (rat, 15 นาที) 170 ppm (rat, 30 นาที) 160 ppm (rat, 30 นาที) 323 ppm (rat, 5 นาที)[7] | ||
LCLo (lowest published)
|
200 ppm (สัตว์เลี้ยงลูกด้วยนม, 5 นาที) 36 ppm (สัตว์เลี้ยงลูกด้วยนม, 2 ชั่วโมง) 107 ppm (มนุษย์, 10 นาที) 759 ppm (กระต่าย, 1 นาที) 759 ppm (แมว, 1 นาที) 357 ppm (มนุษย์, 2 นาที) 179 ppm (มนุษย์, 1 ชั่วโมง)[7] | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
TWA 10 ppm (11 mg/m3) [ผิวหนัง][6] | ||
REL (Recommended)
|
ST 4.7 ppm (5 mg/m3) [ผิวหนัง][6] | ||
IDLH (Immediate danger)
|
50 ppm[6] | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
แอลเคนไนทรีลที่เกี่ยวข้อง
|
|||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
ไฮโดรเจนไซยาไนด์ (อังกฤษ: Hydrogen cyanide, สูตรเคมี HCN) เป็นก๊าซซึ่งก่อให้เกิดอาการไอ มีเสมหะ และหลอดลมอักเสบเรื้อรัง ปวดศีรษะ เวียนศีรษะ และคลื่นไส้อาเจียน เป็นก๊าซพิษที่ใช้ในสงคราม นอกจากนี้สารไนเทรตในบุหรี่ทำให้เกิดไฮโดรเจนไซยาไนด์ สารนี้เป็นตัวสกัดกั้นเอนไซม์ที่เกี่ยวกับการหายใจหลายตัว ทำให้เกิดความผิดปกติของการเผาผลาญพลังงานที่กล้ามเนื้อหัวใจและที่ผนังหลอดเลือด
คุณสมบัติทางเคมี[แก้]
ไฮโดรเจนไซยาไนด์จะทำปฏิกิริยากับแอลคีนด้วยการเร่งปฏิกิริยาของสารประกอบนิกเกิล ปฏิกิริยานี้มีชื่อเรียกว่า hydrocyanation[8]
- RCH=CH2 + HCN → RCH2-CH2-CN
โมเลกุล HCN สี่อันจะผ่านการ tetramerize เป็นdiaminomaleonitrile ซึ่งสามารถแปลงเป็นพิวรีนได้หลายชนิด[9]
อ้างอิง[แก้]
- ↑ "Hydrogen Cyanide – Compound Summary". PubChem Compound. United States: National Center for Biotechnology Information. 16 September 2004. Identification. สืบค้นเมื่อ 2012-06-04.
- ↑ "hydrogen cyanide (CHEBI:18407)". Chemical Entities of Biological Interest. UK: European Bioinformatics Institute. 18 October 2009. Main. สืบค้นเมื่อ 2012-06-04.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 Haynes, William M., บ.ก. (2011). CRC Handbook of Chemistry and Physics (92nd ed.). CRC Press. ISBN 978-1439855119.
- ↑ Evans DA. "pKa's of Inorganic and Oxo-Acids" (PDF). เก็บ (PDF)จากแหล่งเดิมเมื่อ 2022-10-09. สืบค้นเมื่อ June 19, 2020.
- ↑ Patnaik P (2002). Handbook of Inorganic Chemicals. McGraw-Hill. ISBN 978-0070494398.
- ↑ 6.0 6.1 6.2 6.3 NIOSH Pocket Guide to Chemical Hazards. "#0333". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 7.0 7.1 "Hydrogen cyanide". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ Leeuwen, P. W. N. M. van (2004). Homogeneous catalysis : understanding the art. Dordrecht: Kluwer Academic Publishers. ISBN 1402019998. OCLC 54966334.
- ↑ Bray, D; Robbins, P (1967). "Mechanism of ε15 conversion studied with bacteriophage mutants". Journal of Molecular Biology. Elsevier BV. 30 (2): 457–475. doi:10.1016/s0022-2836(67)80037-8. ISSN 0022-2836.
แหล่งข้อมูลอื่น[แก้]
- Institut national de recherche et de sécurité (1997). "Cyanure d'hydrogène et solutions aqueuses". Fiche toxicologique n° 4, Paris:INRS, 5pp. (PDF file, in French)
- International Chemical Safety Card 0492
- Hydrogen cyanide and cyanides (CICAD 61)
- National Pollutant Inventory: Cyanide compounds fact sheet
- NIOSH Pocket Guide to Chemical Hazards
- Department of health review
- Density of Hydrogen Cyanide gas
| เกลือและอนุพันธ์โคเวเลนต์ของไซยาไนด์ไอออน | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| HCN | He | ||||||||||||||||||
| LiCN | Be(CN)2 | B | C | NH4CN | OCN−, -NCO |
FCN | Ne | ||||||||||||
| NaCN | Mg(CN)2 | Al(CN)3 | SiCN | P(CN)3 | SCN−, -NCS, (SCN)2, S(CN)2 |
ClCN | Ar | ||||||||||||
| KCN | Ca(CN)2 | Sc(CN)3 | Ti(CN)4 | VO(CN)3 | Cr(CN)3 | Mn(CN)2 | Fe(CN)3, Fe(CN)64+, Fe(CN)63+ |
Co(CN)2, Co(CN)3 |
Ni(CN)2 Ni(CN)42− |
CuCN | Zn(CN)2 | Ga(CN)3 | Ge | As(CN)3 | SeCN− (SeCN)2 Se(CN)2 |
BrCN | Kr | ||
| RbCN | Sr(CN)2 | Y(CN)3 | Zr(CN)4 | Nb | Mo | Tc | Ru | Rh | Pd(CN)2 | AgCN | Cd(CN)2 | In(CN)3 | Sn | Sb | Te(CN)2, Te(CN)4 |
ICN | XeCN | ||
| CsCN | Ba(CN)2 | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg2(CN)2, Hg(CN)2 |
TlCN | Pb(CN)2 | Bi(CN)3 | Po | At | Rn | |||
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| La | Ce(CN)3, Ce(CN)4 |
Pr | Nd | Pm | Sm | Eu | Gd(CN)3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Th | Pa | UO2(CN)2 | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | |||||
หมวดหมู่:
- บทความที่ไม่มีแหล่งที่มาของ InChI
- Articles with changed EBI identifier
- Articles with changed ChemSpider identifier
- Articles with changed KEGG identifier
- Articles with changed InChI identifier
- บทความที่ขาดแหล่งอ้างอิงเฉพาะส่วนตั้งแต่October 2022
- Chembox having GHS data
- ไซยาไนด์
- สารประกอบอนินทรีย์
- ก๊าซ
- สารประกอบไฮโดรเจน
- บทความเกี่ยวกับ เคมี ที่ยังไม่สมบูรณ์



