โทลูอีน
| |||

| |||
| ชื่อ | |||
|---|---|---|---|
| Preferred IUPAC name
Toluene[2] | |||
| Systematic IUPAC name
Methylbenzene | |||
| ชื่ออื่น | |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| ตัวย่อ | PhMe MePh BnH Tol | ||
| ChEBI | |||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ดรักแบงก์ | |||
| ECHA InfoCard | 100.003.297 | ||
| KEGG | |||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| C7H8 | |||
| มวลโมเลกุล | 92.141 g·mol−1 | ||
| ลักษณะทางกายภาพ | ของเหลวไม่มีสี[3] | ||
| กลิ่น | หวาน ฉุน เหมือนเบนซีน[4] | ||
| ความหนาแน่น | 0.8623 g/mL (25 °C)[1] | ||
| จุดหลอมเหลว | −95.0 องศาเซลเซียส (−139.0 องศาฟาเรนไฮต์; 178.2 เคลวิน)[1] | ||
| จุดเดือด | 110.60 องศาเซลเซียส (231.08 องศาฟาเรนไฮต์; 383.75 เคลวิน)[1] | ||
| 0.54 g/L (5 °C) 0.519 g/L (25 °C) 0.63 g/L (45 °C) 1.2 g/L (90 °C)[5] | |||
| log P | 2.73[6] | ||
| ความดันไอ | 2.8 kPa (20 °C)[4] | ||
| −66.1·10−6 cm3/mol[7] | |||
| การนำความร้อน | 0.1310 W/(m·K) (25 °C)[8] | ||
ดัชนีหักเหแสง (nD)
|
1.4941 (25 °C)[1] | ||
| ความหนืด | 0.560 mPa·s (25 °C)[9] | ||
| โครงสร้าง | |||
| 0.375 D[10] | |||
| อุณหเคมี[11] | |||
ความจุความร้อน (C)
|
157.3 J/(mol·K) | ||
Std enthalpy of
formation (ΔfH⦵298) |
12.4 kJ/mol | ||
Std enthalpy of
combustion (ΔcH⦵298) |
3.910 MJ/mol | ||
| ความอันตราย | |||
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |||
อันตรายหลัก
|
ไวไฟสูง | ||
| GHS labelling: | |||
  
| |||
| อันตราย | |||
| H225, H304, H315, H336, H361d, H373 | |||
| P210, P240, P301+P310, P302+P352, P308+P313, P314, P403+P233 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | 4 องศาเซลเซียส (39 องศาฟาเรนไฮต์; 277 เคลวิน)[12] | ||
| 480[12] องศาเซลเซียส (896 องศาฟาเรนไฮต์; 753 เคลวิน) | |||
| ขีดจำกัดการระเบิด | 1.1–7.1%[12] | ||
ค่าขีดจำกัดเกณฑ์ (TLV)
|
50 mL/m3, 190 mg/m3 | ||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LC50 (median concentration)
|
>26700 ppm (rat, 1 h) 400 ppm (mouse, 24 h)[13] | ||
LCLo (lowest published)
|
55,000 ppm (rabbit, 40 min)[13] | ||
| NIOSH (US health exposure limits): | |||
PEL (Permissible)
|
TWA 200 ppm C 300 ppm 500 ppm (10-minute maximum peak)[4] | ||
REL (Recommended)
|
TWA 100 ppm (375 mg/m3) ST 150 ppm (560 mg/m3)[4] | ||
IDLH (Immediate danger)
|
500 ppm[4] | ||
| เอกสารข้อมูลความปลอดภัย (SDS) | SIRI.org | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
แอโรมาติกไฮโดรคาร์บอนที่เกี่ยวข้อง
|
เบนซีน ไซลีน แนฟทาลีน | ||
สารประกอบที่เกี่ยวข้อง
|
เมทิลไซโคเฮกเซน | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
โทลูอีน หรือที่รู้จักกันในชื่อ เมทิลเบนซีน หรือ ฟีนิลมีเทน เป็นของเหลวที่ไม่ละลายในน้ำ กลิ่นคล้ายสีทาบ้าน เป็นสารประกอบอะโรมาติกที่นิยมใช้ในอุตสาหกรรมเป็นสารตั้งต้นและเป็นตัวทำละลาย เช่นเดียวกับตัวทำละลายอื่นๆ โทลูลีนเป็นสารระเหยที่มีคนสูดดมและเกิดอาการเสพติดได้[15][16]
คุณสมบัติทางเคมี
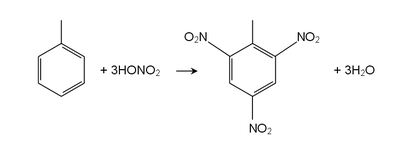
[แก้]ปฏิกิริยาของโทลูอีนเป็นเช่นเดียวกับอะโรมาติกไฮโดรคาร์บอนทั่วไป คือการแทนที่ที่วงอะโรมาติก[17][18][19] หมู่เมทธิลทำให้โทลูอีนว่องไวต่อปฏิกิริยามากกว่าเบนซีนถึง 25 เท่า ในปฏิกิริยาแบบเดียวกัน เกิดปฏิกิริยา sulfonation ได้เป็น p-toluenesulfonic acid และ chlorination โดย Cl2เมื่อมี FeCl3 ได้เป็นไอโซเมอร์ชนิดพาราและออร์โธของ chlorotoluene เกิดปฏิกิริยาnitration ได้พาราและออร์โธ- nitrotoluene แต่ถ้าได้รับความร้อนจะกลายเป็นdinitrotoluene และสารที่ใช้ทำระเบิด trinitrotoluene (TNT).
หมู่เมทธิลของโทลูอีนทำปฏิกิริยากับสารอื่นได้หลายตัว เช่นเกิดปฏิกิริยาออกซิเดชันกับ potassium permanganate และกรดเจือจาง (เช่น sulfuric acid) หรือ potassium permanganate กับกรดซัลฟูริกเข้มข้น ทำให้เกิด กรดเบนโซอิกซึ่งเมื่อทำปฏิกิริยาต่อกับ chromyl chloride จะได้ benzaldehyde (Étard reaction). เกิดปฏิกิริยา Halogenation ในสภาวะที่มีอนุมูลอิสระ ตัวอย่างเช่น N-bromosuccinimide (NBS) เมื่อให้ความร้อนกับโทลูอีนและมี AIBN ทำให้ได้ benzyl bromide โทลูอีนสามารถทำปฏิกิริยากับธาตุโบรมีน เมื่อมีแสงยูวี (จากแสงแดดโดยตรง) ได้ benzyl bromide โทลูอีนสามารถทำปฏิกิริยากับ HBr และ H2O2 เมื่อมีแสงสว่าง[20].
ความเป็นพิษและเมทาบอลิซึม
[แก้]ไม่ควรสูดดมไอระเหยของโทลูอีนเพราะส่งผลต่อสุขภาพ ระดับต่ำถึงปานกลางทำให้เหนื่อย สับสน อ่อนเพลีย อาการคล้ายเมาเหล้า เสียความทรงจำ คลื่นเหียน เบื่ออาหาร สูญเสียการได้ยินและการมองเห็นสี อาการเหล่านี้จะหายไปเมื่อหยุดสัมผัส การหายใจเอาไอระเหยเข้าไปในระดับสูงในเวลาสั้น คลื่นเหียน ล้ม หนือหมดสติ อาจถึงตายได้[21][22]
โทลูอีนมีความเป็นพิษน้อยกว่าเบนซีน จึงถูกนำมาใช้แทนที่ในฐานะตัวทำละลายอะโรมาติกในการเตรียมสารเคมี ตัวอย่างเช่น เบนซีนเป็นสารก่อมะเร็ง แต่โทลูอีนมีฤทธิ์เป็นสารก่อมะเร็งน้อยกว่า[23]
อ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 1.3 1.4 Haynes, p. 3.514
- ↑ Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. p. 139. doi:10.1039/9781849733069-00130. ISBN 978-0-85404-182-4.
Toluene and xylene are preferred IUPAC names, but are not freely substitutable; toluene is substitutable under certain conditions, but only for general nomenclature (see P-15.1.8 for a general substitution rules for retained names).
- ↑ Record in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ↑ 4.0 4.1 4.2 4.3 4.4 NIOSH Pocket Guide to Chemical Hazards. "#0619". National Institute for Occupational Safety and Health (NIOSH).
- ↑ Haynes, p. 5.164
- ↑ Haynes, p. 5.176
- ↑ Haynes, p. 3.579
- ↑ Haynes, p. 6.258
- ↑ Haynes, p. 6.246
- ↑ Haynes, p. 9.66
- ↑ Haynes, pp. 5.39, 5.67
- ↑ 12.0 12.1 12.2 Haynes, p. 16.30
- ↑ 13.0 13.1 "Toluene". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ↑ "NFPA Chemicals". New Environment, Inc. เก็บจากแหล่งเดิมเมื่อ 2021-11-14. สืบค้นเมื่อ 2015-03-13.
- ↑ Streicher HZ, Gabow PA, Moss AH, Kono D, Kaehny WD (1981). "Syndromes of toluene sniffing in adults". Ann. Intern. Med. 94 (6): 758–62. PMID 7235417.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Devathasan G, Low D, Teoh PC, Wan SH, Wong PK (1984). "Complications of chronic glue (toluene) abuse in adolescents". Aust N Z J Med. 14 (1): 39–43. PMID 6087782.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ B. S. Furnell et al., Vogel's Textbook of Practical Organic Chemistry, 5th edition, Longman/Wiley, New York, 1989
- ↑ L. G. Wade, Organic Chemistry, 5th ed., p. 871, Prentice Hall, Upper Saddle RIver, New Jersey, 2003
- ↑ J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992
- ↑ Free radical bromination by the H2O2–HBr system on water Ajda Podgorsˇek Stojan Stavber, Marko Zupana, and Jernej Iskraa Tetrahedron Letters 47 (2006) 7245–7247 doi:10.1016/j.tetlet.2006.07.109
- ↑ "Health Effects of Toluene", Canadian Centre for Occupational Health and Safety.
- ↑ "Toluene Toxicity Physiologic Effects", Agency for Toxic Substances and Disease Registry.
- ↑ Dees, C (Dec 1996). "Carcinogenic potential of benzene and toluene when evaluated using cyclin-dependent kinase activation and p53-DNA binding". Environmental Health Perspectictives. 104 (6). PMID 9118908.
{{cite journal}}: ไม่รู้จักพารามิเตอร์|coauthors=ถูกละเว้น แนะนำ (|author=) (help)