โรคปอดอุดกั้นเรื้อรัง
| โรคปอดอุดกั้นเรื้อรัง (chronic obstructive pulmonary disease) | |
|---|---|
| ชื่ออื่น | chronic obstructive lung disease (COLD), chronic obstructive airway disease (COAD) |
 | |
| Section of a lung showing centrilobular emphysema, with enlarged airspaces in the centre of a lobule usually caused by smoking and a major feature of COPD | |
| สาขาวิชา | Pulmonology |
| อาการ | Shortness of breath, chronic cough[1] |
| ภาวะแทรกซ้อน | Anxiety, depression, pulmonary heart disease, pneumothorax[2][1] |
| การตั้งต้น | มากกว่า 35 ปี[1] |
| ระยะดำเนินโรค | ระยะยาว[1] |
| สาเหตุ | Tobacco smoking, air pollution, genetics[3] |
| วิธีวินิจฉัย | Spirometry[4] |
| โรคอื่นที่คล้ายกัน | Asthma, congestive heart failure, bronchiectasis, tuberculosis, obliterative bronchiolitis, diffuse panbronchiolitis[5] |
| การป้องกัน | Stopping smoking, improving indoor and outdoor air quality, tobacco control measures[3][6] |
| การรักษา | Pulmonary rehabilitation, long-term oxygen therapy, lung volume reduction[6] |
| ยา | Inhaled bronchodilators and steroids[6] |
| ความชุก | 174.5 ล้าน (2015)[7] |
| การเสียชีวิต | 3.2 ล้าน (2019)[3] |
โรคปอดอุดกั้นเรื้อรัง (อังกฤษ: chronic obstructive pulmonary disease, COPD, chronic obstructive lung disease, COLD, chronic obstructive airway disease, COAD) เป็นโรคปอดอุดกั้นที่มีลักษณะเฉพาะคือความบกพร่องอย่างเรื้อรังในการไหลผ่านของอากาศของระบบทางเดินหายใจ และมักจะแย่ลงเมื่อเวลาผ่านไป อาการที่พบบ่อยได้แก่ เหนื่อย ไอ และ มีเสมหะ[8] ผู้ป่วยหลอดลมอักเสบเรื้อรังส่วนใหญ่จะมี COPD ด้วย[9]
สาเหตุพบบ่อยที่สุดของ COPD คือการสูบบุหรี่ สาเหตุอื่นๆ ที่มีบทบาทบ้างแต่น้อยกว่าการสูบบุหรี่ได้แก่ มลพิษทางอากาศ และ พันธุกรรม เป็นต้น[10] สาเหตุของมลพิษทางอากาศที่พบบ่อยในประเทศที่กำลังพัฒนาอีกอย่างหนึ่งได้แก่ อากาศเสียจากการทำอาหารหรือควันไฟ การสัมผัสสิ่งระคายเคืองเหล่านี้ต่อเนื่องกันเป็นเวลานานจะกระตุ้นให้เกิดปฏิกิริยาการอักเสบขึ้นในเนื้อปอด ทำให้หลอดลมฝอยตีบลงและการแตกตัวของเนื้อเยื้อปอด เรียกว่า ถุงลมโป่งพอง อังกฤษ:emphysema[11] การวินิจฉัยนั้นใช้พื้นฐานของความสามารถในการไหลผ่านของอากาศด้วยการตรวจวัดโดย การทดสอบการทำงานของปอด[12] โดยมีความแตกต่างจากโรคหอบหืด คือ การลดลงของปริมาณอากาศที่ไหลผ่านด้วยการให้ยานั้นไม่ดีขึ้นอย่างมีนัยสำคัญ
COPD สามารถป้องกันได้โดยการลดปัจจัยเสี่ยงของสาเหตุของโรคที่ทราบ ซึ่งรวมถึงการลดปริมาณการสูบบุหรี่และการปรับปรุงคุณภาพของอากาศทั้งภายในและภายนอก การรักษา COPD ได้แก่: การเลิกสูบบุหรี่ การฉีดวัคซีน การฟื้นฟูสภาพ และการพ่นสูดยาขยายหลอดลมบ่อยๆ และการใช้ยาสเตียรอยด์ บางคนอาจได้รับประโยชน์จากการบำบัดด้วยออกซิเจนระยะยาวหรือการปลูกถ่ายปอด [11] ในกลุ่มผู้ที่มีการทรุดลงอย่างเฉียบพลันช่วงหนึ่ง การเพิ่มยาที่ใช้รักษาและการเข้าพักรักษาตัวในโรงพยาบาลอาจเป็นสิ่งจำเป็น
ในทั่วโลกมีผู้ที่ป่วยด้วย COPD จำนวน 329 ล้านคนหรือเกือบ 5% ของจำนวนประชากร ในปี ค.ศ. 2012 โรคนี้เป็นโรคอันดับที่สามที่เป็นสาเหตุของการเสียชีวิต ซึ่งคร่าชีวิตผู้คนจำนวนกว่า 3 ล้านคน [13] จำนวนของผู้เสียชีวิตนั้นประมาณว่าจะมีจำนวนเพิ่มมากขึ้นเนื่องจากอัตราการสูบบุหรี่ที่เพิ่มขึ้นและอายุของประชากรในหลายๆ ประเทศ[14] ซึ่งมีการประมาณว่าจะส่งผลที่เป็นค่าใช้จ่ายทางเศรษฐกิจจำนวน $2.1 พันล้านในปี ค.ศ. 2010[15]
อาการแสดงและอาการของโรค
[แก้]อาการของ COPD ที่พบมากที่สุดคือ มีเสมหะ เหนื่อย และไอ [16] อาการเหล่านี้จะเกิดขึ้นเป็นเวลานาน [9] และโดยมากจะแย่ลงเรื่อยๆ เมื่อเวลาผ่านไป[11] ทั้งนี้ยังไม่มีความชัดเจนว่า COPD มีหลายประเภทหรือไม่[10] ทั้งนี้ในอดีตมีการแบ่งประเภทออกเป็น โรคถุงลมโป่งพอง และ โรคหลอดลมอักเสบเรื้อรัง โรคถุงลมโป่งพองนั้นเป็นเพียงการอธิบายของการเปลี่ยนแปลงของปอดมากกว่าของโรค และโรคหลอดลมอักเสบเรื้อรังนั้นเป็นเพียงคำอธิบายของอาการที่อาจเกิดกับ COPD หรือไม่ก็ได้[8]
การไอ
[แก้]การไอเรื้อรังนั้นมักเป็นอาการแรกที่เกิดขึ้น เมื่อเกิดอาการนี้เป็นเวลามากกว่าสามเดือนในหนึ่งปี หรือมากกว่าสองปี ร่วมกับมีเสมหะและโดยไม่มีสาเหตุอื่น ก็จะถูกจัดว่าเป็นโรคหลอดลมอักเสบเรื้อรัง สภาวะนี้อาจเกิดขึ้นก่อนที่ COPD จะเกิดขึ้นอย่างเต็มตัว ปริมาณของเสมหะที่เกิด อาจเปลี่ยนแปลงภายในไม่กี่ชั่วโมงหรือไม่กี่วัน ในบางกรณีอาจไม่มีอาการไอหรืออาจมีเป็นบางครั้งคราว และอาจไม่มีเลยก็ได้ ผู้เป็น COPD บางรายอาจแสดงอาการของ "การไอของผู้สูบบุหรี่" เสมหะนั้นอาจถูกกลืนหรือถูกถ่มออก ทั้งนี้มักขึ้นกับปัจจัยทางสังคมและวัฒนธรรม ความรุนแรงของการไออาจนำไปสู่การหักร้าวของกระดูกซี่โครง หรือ การหมดสติชั่วครู่ ผู้ที่เป็น COPD มักมีประวัติของการเป็น "ไข้หวัดธรรมดา" เป็นเวลานาน[16]
อาการเหนื่อย
[แก้]อาการเหนื่อยมักเป็นอาการที่ก่อความกังวลในผู้ป่วยส่วนใหญ่[17] ซึ่งโดยทั่วไปได้รับการอธิบายว่าเป็น: "ฉันต้องใช้ความพยายามในการหายใจ" "ฉันรู้สึกหายใจไม่ออก" หรือ "ฉันไม่สามารถสูดอากาศได้มากพอ"[18] อย่างไรก็ตาม อาจมีการใช้คำอธิบายอื่นๆ ที่แตกต่างกันไปตามวัฒนธรรมที่ต่างกัน[16] โดยทั่วไปอาการเหนื่อยนั้นจะแย่ลงเมื่อมีการใช้แรง ซึ่งได้เกิดขึ้นเป็นเวลานานและมีอาการทรุดลงเมื่อเวลาผ่านไป[16] ในระยะลุกลาม อาการอาจเกิดขึ้นในระหว่างพักและอาจเกิดขึ้นตลอดเวลา[19][20] โดยมีที่มาจากทั้งความวิตกกังวลและคุณภาพชีวิตที่แย่ของผู้ที่ป่วยด้วย COPD[16] ผู้ป่วยส่วนใหญ่ที่เป็น COPD ขั้นลุกลาม หายใจโดยการห่อริมฝีปาก และการกระทำนี้อาจกลายเป็นอาการเหนื่อยได้ในผู้ป่วยบางราย[21][22]
ลักษณะอื่นๆ
[แก้]ในผู้ป่วย COPD นั้นอาจต้องใช้เวลาในการหายใจออกนานกว่าการหายใจเข้า[23] อาจมีอาการแน่นหน้าอก[16] แต่ไม่ใช่อาการปกติและอาจเกิดจากปัญหาอื่น[17] ผู้ที่มีการอุดกั้นของทางเดินหายใจอาจมีการหายใจมีเสียงวี้ด หรือมีเสียงลดลงขณะที่สูดหายใจเข้า เวลาที่ตรวจหน้าอกด้วยหูฟังของแพทย์ [23] ภาวะอกโอ่ง ที่ทรวงอกมีขนาดใหญ่กว่าปกติเนื่องจากมีลมค้างอยู่ในปอดมาก ก็เป็นสัญญาณที่เป็นลักษณะเฉพาะของ COPD แต่ทั้งนี้พบได้น้อยมาก[23] ท่าขาหยั่งสามขา ที่เป็นการนั่งตัวตรงเอนไปข้างหน้าโดยวางแขนทั้งสองไว้บนเข่า อาจเกิดขึ้นเมื่ออาการของโรคทรุดลง[9]
COPD ขั้นลุกลามสามารถก่อให้เกิดความดันโลหิตในหลอดเลือดปอดสูง ซึ่งเป็นสายพันธ์ของหัวใจห้องล่างด้านขวา [11][24][25] สถานการณ์นี้อาจกล่าวว่าเป็นโรคหัวใจเพราะปอด และนำไปสู่อาการแสดงของ ขาบวม[16] และเส้นเลือดที่คอโป่งพอง [11] COPD นั้นพบได้มากกว่าโรคปอดอื่นๆ เนื่องจากสาเหตุของโรคหัวใจเพราะปอด[24] โรคหัวใจเพราะปอดได้กลายเป็นโรคที่พบได้น้อย นับตั้งแต่มีการใช้ออกซิเจนเสริม[9]
COPD มักพบร่วมกับสภาวะอื่นๆ จำนวนหนึ่ง ส่วนหนึ่งเนื่องจากการมีปัจจัยเสียงร่วม[10] สภาวะเหล่านี้ ได้แก่: โรคหัวใจขาดเลือด ความดันโลหิตสูง โรคเบาหวาน การสูญเสียกล้ามเนื้อ ภาวะกระดูกพรุน มะเร็งปอด โรคประสาทกังวล และ ภาวะซึมเศร้า[10] ในผู้ป่วยที่มีอาการของโรคขั้นรุนแรง การรู้สึกว่ามีความเหนื่อยอยู่ตลอดเวลานั้นเป็นสิ่งปกติ[16] การโป่งของเล็บนิ้วนั้นไม่ใช่อาการเฉพาะของ COPD และควรต้องทำการตรวจการแฝงตัวของมะเร็งปอดทันที[26]
การกำเริบของโรค
[แก้]การกำเริบเฉียบพลันของ COPD นั้นมีการนิยามว่าเป็นการเพิ่มขึ้นของอาการเหนื่อย การมีเสมหะมากขึ้น การเปลี่ยนสีของเสมหะจากใสเป็นเขียวหรือเหลือง หรือการไอเพิ่มขึ้นในผู้ที่มี COPD บางราย[23] โดยอาจมีการแสดงร่วมกับสัญญาณของการทำงานเพิ่มขึ้นในการหายใจ การหายใจอย่างเร็ว อัตราการเต้นของหัวใจสูง เหงื่อออก การทำงานหนักของ กล้ามเนื้อคอ จ้ำสีเขียวบนผิว และ การสับสน หรือพฤติกรรมชอบต่อสู้ในการกำเริบของโรคขั้นรุนแรง[23][27] อาจได้ยินเสียงประทุในระหว่างการตรวจปอดด้วยหูฟังของแพทย์[28]
สาเหตุ
[แก้]สาเหตุหลักของ COPD คือการสูบบุหรี่ ร่วมกับการได้รับสัมผัสทางอาชีพ และมลพิษทางอากาศจากเพลิงไหม้ภายในสถานที่ เป็นสาเหตุสำคัญในบางประเทศ[8] โดยทั่วไปการได้รับสัมผัสเหล่านี้ต้องเกิดขึ้นเป็นเวลาหลายสิบปีก่อนที่อาการเหล่านี้จะเกิดขึ้น[8] พันธุกรรมของบุคคลก็มีผลกะทบต่อความเสี่ยงเช่นกัน[8]
การสูบบุหรี่
[แก้]ปัจจัยเสี่ยงสำคัญสำหรับ COPD ในทั่วโลกคือการสูบบุหรี่[8] ประมาณ 20% ของผู้ที่สูบบุหรี่จะเป็น COPD[30] และจำนวนครึ่งหนึ่งของผู้ที่สูบบุหรี่เป็นเวลานานเกือบชั่วชีวิตจะเป็น COPD[31] ในประเทศสหรัฐอเมริกาและสหราชอาณาจักร 80-95% ของผู้ที่เป็น COPD นั้นเป็นผู้ที่สูบบุหรี่ในปัจจุบันหรือเคยสูบบุหรี่[30][32][33] แนวโน้มในการพัฒนาโรคของ COPD เพิ่มขึ้นจากการได้รับสัมผัสจากการสูบบุหรี่ทั้งหมด [34] นอกจากนี้แล้ว เพศหญิงยังมีความไวต่อผลกระทบที่เป็นอันตรายของการสูบบุหรี่สูงกว่าเพศชาย[33] ในผู้ที่ไม่สูบบุหรี่ การอยู่ใกล้ชิดผู้ที่สูบบุหรี่คือกรณีที่เป็นสาเหตุของโรคประมาณ 20%[32] การสูบประเภทอื่นๆ อาทิเช่น การสูบกัญชา ซิการ์ และไปป์น้ำ ก็ถือเป็นปัจจัยเสี่ยงเช่นกัน[8] หญิงที่สูบบุหรี่ในระหว่างการตั้งครรภ์อาจเพิ่มความเสี่ยงของ COPD ในเด็กได้[8]
มลพิษทางอากาศ
[แก้]การถ่ายเทที่ไม่ดีของควันไฟจากการทำอาหาร ซึ่งส่วนมากใช้เชื้อเพลิงจากถ่านหินหรือเชื้อเพลิงมวลชีวภาพ เช่น ไม้ และมูลสัตว์ ที่ส่งผลต่อมลพิษทางอากาศภายในอาคารและเป็นหนึ่งในสาเหตุหลักของ COPD ในประเทศที่กำลังพัฒนา[35] ควันไฟจากรูปแบบของการทำอาหารและการทำความร้อนเหล่านี้ส่งผลให้ผู้คนจำนวนเกือบ 3 พันล้านคนได้รับผลกระทบทางสุขภาพมากขึ้น โดยส่วนใหญ่เป็นเพศหญิงเนื่องจากการได้รับสัมผัสที่สูงกว่า[8][35] เชื้อเพลิงเหล่านี้ถูกใช้เป็นแหล่งเชื้อเพลิงหลักของพลังงานในครัวเรือน ซึ่งคิดเป็น 80% ในประเทศอินเดีย จีนและแอฟริกาใต้สะฮารา[36]
ประชากรที่อาศัยอยู่ในเมืองใหญ่มีอัตราของ COPD สูงกว่าเมื่อเทียบกับประชากรที่อาศัยอยู่ในชนบทห่างไกล[37] ขณะที่มลพิษทางอากาศในชนบทมีปัจจัยที่ส่งผลเป็นการกำเริบของโรค บทบาทโดยรวมของมลพิษทางอากาศที่เป็นสาเหตุของ COPD นั้นยังไม่ทราบอย่างชัดเจน[8] โดยทั่วไปพื้นที่ต่างๆ ที่มีคุณภาพอากาศภายนอกอาคารที่ไม่ดี รวมถึงจากควันไอเสียนั้นมีอัตราของ COPD ที่สูงกว่า[36] อย่างไรก็ตาม ผลกระทบโดยรวมในส่วนที่เกี่ยวข้องกับการสูบบุหรี่นั้นเชื่อว่ามีเพียงเล็กน้อยเท่านั้น[8]
การได้รับสัมผัสทางอาชีพ
[แก้]การได้รับสัมผัสของฝุ่น สารเคมี และควันในสถานที่ทำงานในขนาดเข้มข้นและเป็นเวลานานนั้นทำให้ทั้งผู้ที่สูบบุหรี่และผู้ที่ไม่สูบบุหรี่มีความเสี่ยงของ COPD มากขึ้น[38] โดยเชื่อว่าการได้รับสัมผัสทางอาชีพนั้นเป็นสาเหตุของการป่วยที่คิดเป็น 10-20%[39] ในสหรัฐอเมริกา คนที่นั่นเชื่อว่ามีความเกี่ยวข้องกับการป่วยที่คิดเป็น 30% ของกลุ่มผู้ที่ไม่เคยสูบบุหรี่และอาจแสดงความเสี่ยงที่สูงกว่าในประเทศที่ไม่มีระเบียบข้อบังคับที่มีประสิทธิภาพ[8]
จำนวนของอุตสาหกรรมและแหล่งที่มาก็มีส่วนเกี่ยวข้อง รวมถึง[36] ระดับความเข้มข้นสูงของฝุ่นในการทำเหมืองถ่านหิน การทำเหมืองทองและอุตสาหกรรมสิ่งทอจากฝ้าย อาชีพที่เกี่ยวข้องกับแคดเมียมและไอโซไซยาเนต และควันจากการเชื่อมโลหะ[38] Working in agriculture is also a risk.[36] ในบางอาชีพความเสี่ยงนี้มีการประมาณว่าเท่ากับการสูบบุหรี่จำนวนครึ่งซองถึงสองซองต่อวัน[40] การได้รับสัมผัสฝุ่นจากซิลิกาก็สามารถส่งผลเป็น COPD ได้เช่นกัน อนึ่งความเสี่ยงนี้ไม่เกี่ยวข้องกับโรคฝุ่นหินจับปอด[41] ผลกระทบเชิงลบของการได้รับสัมผัสฝุ่นและการสูบบุหรี่คือการเสพติดหรืออาจยิ่งกว่าการเสพติด[40]
พันธุกรรม
[แก้]พันธุกรรมมีบทบาทในการพัฒนาของ COPD[8] ซึ่งโดยทั่วไปพบในกลุ่มญาติของผู้ที่เป็น COPD ซึ่งเป็นผู้ที่สูบบุหรี่มากกว่าผู้ที่ไม่เกี่ยวข้องกับการสูบบุหรี่[8] ในปัจจุบัน ปัจจัยเสี่ยงที่สามารถสืบทอดได้ที่แน่ชัดนั้นคือการพร่องอัลฟ่า วัน-แอนติทริพซิน (AAT) เท่านั้น[42] ความเสี่ยงนี้มีระดับสูงก็ต่อเมื่อบุคคลนั้นพร่องอัลฟ่า วัน-แอนติทริพซิน พร้อมกับการสูบบุหรี่[42] สาเหตุนี้คิดเป็นประมาณ 1-5% ของผู้ป่วย[42][43] และสภาวะนี้คิดเป็นประมาณ 3-4 คนจากจำนวน 10,000 คน[9] ปัจจัยทางพันธุกรรมอื่นๆ นั้นอยู่ในระหว่างการศึกษาวิจัย[42] ซึ่งมีแนวโน้มว่าจะมีจำนวนมาก[36]
อื่นๆ
[แก้]จำนวนของปัจจัยอื่นๆ นั้นมีความเกี่ยวข้องกับ COPD น้อยกว่า ความเสี่ยงนี้เพิ่มสูงขึ้นในกลุ่มคนจน ถึงแม้ว่าจะไม่เป็นที่ชัดเจนว่าเนื่องมาจากความยากจนหรือปัจจัยเสี่ยงอื่นที่เกี่ยวข้องกับความยากจน อาทิเช่น มลพิษทางอากาศและทุพโภชนาการ[8] มีหลักฐานที่อาจเป็นไปได้ว่ากลุ่มผู้ที่เป็นโรคหอบหืดและภาวะระบบทางเดินหายใจตอบสนองไวเกินนั้นมีความเสี่ยงของ COPD เพิ่มมากขึ้น[8] ปัจจัยจากการเกิด เช่น น้ำหนักน้อยเมื่อคลอด อาจมีบทบาทต่อการเป็นโรคติดเชื้อบางอย่างเช่นกัน รวมถึงเอชไอวี /เอดส์และวัณโรค[8] การติดเชื้อของระบบหายใจ เช่น ปอดบวมนั้นไม่แสดงว่าเป็นปัจจัยความเสี่ยงที่เพิ่มขึ้นของ COPD อย่างน้อยก็ในผู้ใหญ่[9]
การกำเริบของโรค
[แก้]การกำเริบของโรคอย่างเฉียบพลัน(อาการทรุดลงอย่างรวดเร็ว)[44] นั้นโดยมากมีสาเหตุมาจากการติดเชื้อหรือมลพิษจากสิ่งแวดล้อม หรือบางครั้งโดยปัจจัยอื่น เช่น การใช้ยาอย่างไม่ถูกต้อง[45] การติดเชื้อซึ่งดูเหมือนจะเป็นสาเหตุนั้นคิดเป็น 75% ของผู้ป่วย[45][46] โดยเชื้อแบคทีเรียคิดเป็น 25% เชื้อไวรัส 25% และทั้งสองเชื้อ 25%[47] มลพิษจากสิ่งแวดล้อมนี้ ได้แก่ คุณภาพของอากาศทั้งภายในและภายนอกอาคาร[45] การได้รับสัมผัสโดยการสูบบุหรี่ของบุคคลนั้นและการอยู่ใกล้ชิดผู้ที่สูบบุหรี่นั้นเป็นการเพิ่มความเสี่ยง[36] อากาศเย็นอาจมีบทบาทด้วยเช่นกัน โดยการกำเริบของโรคส่วนใหญ่เกิดขึ้นในฤดูหนาว[48] กลุ่มผู้ที่มีโรคร้ายแรงกว่าแอบแฝง จะมีการกำเริบของโรคบ่อยครั้งกว่า: ในโรคเล็กน้อยคิดเป็น 1.8 ครั้งต่อปี ขั้นปานกลาง 2 ถึง 3 ครั้งต่อปีและขั้นรุนแรงคือ 3.4 ครั้งต่อปี[49] กลุ่มผู้ที่มีการกำเริบของโรคหลายครั้งมีอัตราการเสื่อมสภาพของการทำงานของปอดที่สูงกว่า[50] ในผู้ป่วยที่เคยเป็น COPD มาก่อนสิ่งหลุดอุดหลอดเลือด (เลือดอุดกั้นในปอด) อาจทำให้อาการทรุดลงได้[10]
พยาธิสรีรวิทยา
[แก้]
COPD เป็นโรคปอดอุดกั้นประเภทหนึ่งในกลุ่มความบกพร่องของระบบทางเดินหายใจ (การจำกัดของระบบทางเดินหายใจ) ที่ไม่สามารถรักษาให้หายขาดได้ และไม่สามารถหายใจออกได้อย่างเต็มที่ (การมีลมค้างในปอด) [10] ความบกพร่องในการไหลผ่านของอากาศเป็นผลมาจากการแตกตัวของเนื้อเยื้อปอด (ที่รู้จักกันว่าโรคถุงลมโป่งพอง) และโรคหลอดลมฝอยอักเสบ ที่รู้จักกันว่าโรคการอุดกั้นของหลอดลมฝอย ผลที่เกี่ยวข้องกับปัจจัยทั้งสองนี้จะแตกต่างกันไปตามตัวบุคคล[8] หลอดลมฝอยที่ถูกทำลายอย่างรุนแรงอาจกลายเป็นการขยายใหญ่ขึ้นของลมที่ตกค้าง—ที่เรียกว่าเม็ดพุพอง—ที่ขึ้นมาแทนที่เนื้อเยื่อปอด โรครูปแบบนี้เรียกกันว่าถุงลมโป่งพองแบบเม็ดพุพอง[51]
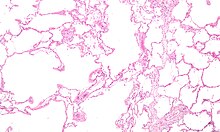
COPD ที่พัฒนาเป็นการอักเสบอย่างมีนัยสำคัญและเรื้อรังซึ่งตอบสนองต่อสารระคายเคืองที่ได้รับการสูดดมเข้าสู่ร่างกาย[8] การติดเชื้อแบคทีเรียแบบเรื้อรังก็อาจส่งผลต่อระดับความรุนแรงของการอักเสบนี้ได้[50] การอักเสบของเซลล์นั้นเกี่ยวข้องกับเซลล์เม็ดเลือดสองชนิดคือแกรนูโลไซต์ นิวโตรฟิล และ แมโครฟาจ นอกจากนี้ในกลุ่มผู้ที่สูบบุหรี่ยังมีความเกี่ยวข้องกับTc1 ลิมโฟไซต์ และผู้ป่วย COPD บางรายมีความเกี่ยวข้องกับอีโอซิโนฟิลที่คล้ายกับผู้ที่เป็นโรคหอบหืด ส่วนของเซลล์เหล่านี้เป็นผลมาจากตอบสนองต่อสารตัวกลางของการอักเสบ อาทิเช่น ปัจจัยที่เป็นปฏิกิริยาชักนำทางเคมี การดำเนินการอื่นๆ ที่เกี่ยวข้องกับการทำลายปอด ได้แก่ภาวะเครียดออกซิเดชัน ที่เกิดจากอนุมูลอิสระที่มีระดับความเข้มข้นสูงจากการสูบบุหรี่และถูกปลดปล่อยจากการอักเสบของเซลล์ และการแตกตัวของเนื้อเยื่อยึดต่อของปอดโดยโปรตีเอส ที่มีประสิทธิภาพในการยับยั้งโดยตัวยับยั้งโปรตีเอส การถูกทำลายของเนื้อเยื่อยึดต่อของปอดคือการกลายเป็นโรคถุงลมโป่งพอง ซึ่งหลังจากนั้นก็เป็นการบกพร่องของระบบทางเดินหายใจ และท้ายสุดก็คือความบกพร่องในการดูดซึมและการปล่อยก๊าซในระบบทางเดินหายใจ[8] การสูญเสียกล้ามเนื้อทั่วไปที่มักเกิดขึ้นในผู้ป่วย COPD นั้นส่วนหนึ่งอาจเนื่องมาจากสารตัวกลางของการอักเสบที่ปอดปล่อยออกสู่เลือด [8]
การตีบแคบของทางเดินหายใจนั้นเกิดขึ้นเนื่องจากการอักเสบและแผลเป็นภายในทางเดินหายใจ การตีบแคบนี้ทำให้ไม่สามารถหายใจออกได้อย่างเต็มที่ ระดับการหายใจที่ลดลงอย่างมากนั้นเกิดขึ้นเมื่อหายใจออก จากความดันในหน้าอกที่กดดันทางเดินหายใจในขณะนั้น [52] สิ่งนี้อาจส่งผลต่อการหายใจมากยิ่งขึ้นเนื่องจากอากาศที่คั่งค้างอยู่ในปอดจากการหายใจครั้งก่อนหน้า เมื่อการหายใจครั้งถัดไปเริ่มขึ้น จึงส่งผลให้ปริมาณทั้งหมดของอากาศในปอดเพิ่มขึ้นในขณะนั้น สิ่งนี้มีชื่อว่าปอดขยายตัวสูงเกินหรือการค้างของอากาศ[52][53] ภาวะปอดขยายตัวสูงเกินจากการออกกำลังนั้นเกี่ยวพันกับอาการเหนื่อยในผู้ป่วย COPD เนื่องจากความไม่สะดวกในการหายใจเข้าเนื่องจากมีอากาศบางส่วนค้างอยู่ในปอด[54]
ผู้ป่วยบางรายมีภาวะหลอดลมไวต่อสิ่งกระตุ้นผิดปกติ ในระดับหนึ่งต่อสิ่งกระตุ้นที่คล้ายกับที่พบในกลุ่มผู้ป่วยที่เป็นโรคหอบหืด[9]
ระดับออกซิเจนต่ำ และในที่สุดอาจเกิดระดับคาร์บอนไดออกไซด์ในเลือดสูงจากการแลกเปลี่ยนก๊าซ เนื่องจากการลดลงของการถ่ายเทอากาศจากการอุดกั้นของทางเดินอากาศ การขยายตัวมากเกินไปของปอด และการลดลงของการหายใจที่ต้องการ[8] ในระหว่างที่โรคกำเริบนั้น การอักเสบของทางเดินหายใจก็เพิ่มขึ้นด้วยเช่นกัน ส่งผลให้ปอดมีการขยายตัวมากเกินไป อากาศที่ผ่านเข้าออกระบบทางเดินหายใจลดลง และความถดถอยของการถ่ายเทก๊าซ อีกทั้งยังสามารถนำไปสู่ความไม่เพียงพอในการถ่ายเทอากาศ และในที่สุดก็ส่งผลทำให้ระดับออกซิเจนในเลือดต่ำ[11] หากอาการนี้ปรากฏเป็นเวลานาน ระดับออกซิเจนในเลือดต่ำก็สามารถส่งผลทำให้มีการตีบแคบของหลอดเลือด ในปอด ขณะเดียวกันโรคถุงลมโป่งพองสามารถส่งผลให้หลอดเลือดฝอยในปอดแตกตัว การเปลี่ยนแปลงทั้งสองนี้ส่งผลทำให้ความดันเลือดในหลอดเลือดแดงพัลโมนารี สูงขึ้น ซึ่งอาจเป็นสาเหตุของโรคหัวใจเพราะปอด[8]
การวินิจฉัย
[แก้]
การวินิจฉัย COPD นั้นควรพิจารณาดำเนินการในผู้ที่มีอายุตั้งแต่ 35 ถึง 40 ปีขึ้นไปที่มีอาการเหนื่อย การไอเรื้อรัง มีเสมหะ หรือเป็นไข้หวัดบ่อยในฤดูหนาว และมีประวัติของการได้รับสัมผัสกับปัจจัยเสี่ยงของโรค[16][17] จากนั้นจึงใช้การวัดปริมาตรอากาศหายใจเพื่อยืนยันการวินิจฉัยนั้น[16][55]
การวัดปริมาตรอากาศหายใจ
[แก้]การวัดปริมาตรอากาศหายใจเป็นการวัดปริมาณการอุดกั้นของระบบทางเดินหายใจในปัจจุบันและโดยทั่วไปเป็นการดำเนินการหลังจากการใช้ยาขยายหลอดลม ซึ่งเป็นยาที่ช่วยเปิดทางเดินหายใจ[55] องค์ประกอบหลักสองข้อที่จะมีการตรวจวัดเพื่อการวินิจฉัยโรค คือ ปริมาตรการหายใจออกที่ทำอย่างเต็มกำลังในหนึ่งวินาที (FEV1)ซึ่งเป็นปริมาตรสูงสุดของอากาศที่สามารถหายใจออกมาได้ในวินาทีแรกของการหายใจออก และปริมาตรอากาศที่วัดได้เมื่อหายใจเต็มกำลัง (FVC) ซึ่งเป็นปริมาตรสูงสุดของอากาศที่สามารถหายใจออกมาได้ในการหายใจอย่างเต็มที่หนึ่งครั้ง[56] โดยทั่วไป 75-80% ของค่า FVC จะได้จากวินาทีแรก [56] และค่า FEV1/อัตรา FVC ที่ต่ำกว่า 70% ในผู้ที่มีอาการแสดงของ COPD ได้รับการนิยามว่าคือผู้ที่เป็นโรคดังกล่าว[55] ตามพื้นฐานของการตรวจวัดเหล่านี้ การวัดปริมาตรอากาศหายใจอาจนำไปสู่ความผิดพลาดในการวินิจฉัย COPD ในผู้สูงอายุได้[55] นอกจากนี้ เกณฑ์ของสถาบันแห่งชาติเพื่อความเป็นเลิศด้านการแพทย์ได้กำหนดให้ค่า FEV1 ต้องต่ำกว่า 80% ของค่าคาดคะเน[17]
หลักฐานสำหรับการใช้การวัดปริมาตรอากาศหายใจในกลุ่มผู้ที่ไม่มีอาการแสดงเพื่อการวินิจฉัยอาการแต่เนิ่นๆ นั้นให้ผลที่ไม่แน่นอน และด้วยเหตุนี้จึงไม่แนะนำในปัจจุบัน[16][55] ระดับสูงสุดของอากาศที่หายใจออก (อัตราสูงสุดของการหายใจออก) ซึ่งโดยทั่วไปใช้ในผู้ป่วยโรคหอบหืดนั้นไม่มีประสิทธิภาพมากพอสำหรับการการวินิจฉัย COPD[17]
ความรุนแรง
[แก้]| คะแนน | กิจกรรมที่ส่งผลกระทบ |
|---|---|
| 1 | เฉพาะกิจกรรมที่ต้องออกแรงเท่านั้น |
| 2 | เมื่อเดินเร็วๆ |
| 3 | เมื่อเดินตามปกติ |
| 4 | หลังจากการเดินเพียงไม่กี่นาที |
| 5 | เมื่อเปลี่ยนเสื้อผ้า |
| ความรุนแรง | FEV1 % ที่คาดคะเน |
|---|---|
| เล็กน้อย (GOLD 1) | ≥80 |
| ปานกลาง (GOLD 2) | 50–79 |
| รุนแรง (GOLD 3) | 30–49 |
| รุนแรงมาก (GOLD 4) | <30 หรือ ความล้มเหลวของระบบทางเดินหายใจแบบเรื้อรัง |
มีวิธีการอยู่หลายวิธีในการระบุระดับผลกระทบของ COPD ในแต่ละบุคคล[16] แบบทดสอบBritish Medical Research Councilฉบับที่ได้รับการแก้ไข (mMRC) หรือแบบประเมินการทดสอบ COPD (CAT) นั้นเป็นแบบสอบถามง่ายๆ ที่อาจจะใช้เพื่อระบุความรุนแรงของอาการ [16] คะแนนจากแบบประเมิน CAT อยู่ระหว่าง 0–40 โดยหากคะแนนยิ่งสูง ความรุนแรงของโรคก็ยิ่งสูง [57] การตรวจสมรรถภาพปอดด้วยการวัดปริมาตรอากาศหายใจอาจช่วยระบุความรุนแรงของการมีลมค้างในปอดได้[16] โดยทั่วไปนั้นใช้พื้นฐานของ FEV1 ที่มีการแสดงไว้ในอัตราร้อยละ สำหรับอาการ "ปกติ" ที่มีการคาดหมายตามอายุ เพศ ความสูงและน้ำหนักของแต่ละบุคคล [16] แนวปฏิบัติของทั้งอเมริกาและยุโรปได้แนะนำให้เป็นส่วนหนึ่งของพื้นฐานการรักษาสำหรับ FEV1[55] แนวปฏิบัติ GOLD แนะนำการแบ่งผู้ป่วยออกเป็นสี่กลุ่มตามพื้นฐานของการประเมินอาการและการมีลมค้างในปอด[16] และควรนำการลดลงของน้ำหนักและความอ่อนแอของกล้ามเนื้อ ตลอดจนการแสดงของโรคอื่นๆ มาใช้ในการพิจารณาด้วย[16]
การทดสอบอื่นๆ
[แก้]การตรวจเอกซเรย์ทรวงอกและการตรวจนับเม็ดเลือดอย่างสมบรูณ์อาจเป็นประโยชน์สำหรับการแยกอาการอื่นๆ ออกในเวลาที่ทำการวินิจฉัย [58] สัญญาณที่เป็นลักษณะเฉพาะจากการเอกซเรย์คือปอดที่โตผิดปกติหรือกะบังลมที่แฟบแบน พื้นที่ของอากาศหลังกระดูกอกเพิ่มขึ้น และตุ่มพุพอง ขณะเดียวกันมันก็ยังสามารถช่วยในการแยกโรคปอดอื่นๆ ออกได้ เช่น ปอดบวม ปอดบวมน้ำ หรือภาวะโพรงเยื่อหุ้มปอดมีอากาศ[59] การสแกนทรวงอกโดยใช้ความละเอียดสูงด้วยการถ่ายภาพส่วนตัดอาศัยคอมพิวเตอร์อาจแสดงผลของโรคถุงลมโป่งพองทั่วทั้งปอดได้และอาจเป็นประโยชน์ในการแยกโรคปอดอื่นๆ ออก[9] อย่างไรก็ตามภาวะเหล่านี้จะไม่ส่งกระทบต่อการจัดการโรค เว้นแต่ว่าได้มีการวางแผนการผ่าตัดไว้[9] การวิเคราะห์ก๊าซในหลอดเลือดแดงถูกใช้เพื่อระบุความต้องการของออกซิเจน สิ่งนี้เป็นข้อแนะนำสำหรับผู้ป่วยที่มี FEV1 ต่ำกว่า 35% จากที่คาดหมายไว้ ผู้ที่มีความอิ่มตัวของออกซิเจนส่วนปลายต่ำกว่า 92% และผู้ที่มีอาการแสดงของโรคเลือดคั่ง[16] ในพื้นที่ที่การพร่องอัลฟ่า วัน-แอนติทริพซินนั้นเป็นภาวะปกติ ผู้ที่เป็นโรค COPD (โดยเฉพาะอย่างยิ่งผู้ที่มีอายุต่ำกว่า 45 ปีและปอดส่วนล่างได้รับผลกระทบจากโรคถุงลมโป่งพอง) ควรได้รับการพิจารณาให้ได้รับการทดสอบนี้[16]
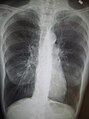
-
Chest X-ray demonstrating severe COPD. Note the small heart size in comparison to the lungs.
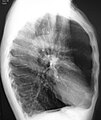
-
A lateral chest x-ray of a person with emphysema. Note the barrel chest and flat diaphragm.
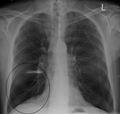
-
Lung bulla as seen on CXR in a person with severe COPD
-
A severe case of bullous emphysema
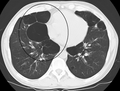
-
Axial CT image of the lung of a person with end-stage bullous emphysema.
ความแตกต่างในการวินิจฉัย
[แก้]COPD อาจจำเป็นต้องมีการวินิจฉัยที่แตกต่างจากสาเหตุอื่นๆ ของความเหนื่อย อาทิเช่น โรคหัวใจเลือดคั่ง สิ่งหลุดอุดหลอดเลือดของปอด ปอดบวม หรือภาวะโพรงเยื่อหุ้มปอดมีอากาศ ผู้ที่มี COPD หลายคนเข้าใจผิดคิดว่าตนเป็นโรคหอบหืด[23] ความแตกต่างระหว่างโรคหอบหืดและ COPD นั้น คือพื้นฐานของอาการ ประวัติการสูบบุหรี่และการมีลมค้างในปอดซึ่งสามารถแก้อาการได้ด้วยยาขยายหลอดลมโดยการวัดปริมาตรอากาศหายใจ [60] นอกจากนี้อาการของโรควัณโรคยังอาจมีการแสดงออกของการไอเรื้อรังและควรพิจารณาเรื่องสถานที่ว่าเป็นสถานที่ที่พบโรคนี้ได้ทั่วไปหรือไม่ด้วย[16] อาการที่พบไม่บ่อยที่อาจเกิดขึ้นซึ่งเป็นอาการที่คล้ายกันก็คือการเจริญผิดปกติของหลอดลมและเนื้อปอดและหลอดลมฝอยอักเสบจากการถูกทำลาย [58] การอักเสบเรื้อรังของหลอดลมอาจเกิดขึ้นได้พร้อมกับการไหลของอากาศที่ปกติและในสถานการณ์นี้อาจไม่ถูกจัดว่าเป็น COPD[9]
การป้องกัน
[แก้]COPD หลายกรณีนั้นสามารถป้องกันได้โดยการลดสัมผัสจากบุหรี่และการปรับปรุงคุณภาพของอากาศ[36] การฉีดวัคซีนป้องกันไข้หวัดใหญ่ประจำปีแก่ผู้ที่เป็นโรค COPD ก็สามารถลดการกำเริบของโรค การต้องเข้าพักรักษาตัวในโรงพยาบาลและการเสียชีวิตได้[61][62] การฉีดวัคซีนป้องกันเชื้อปอดบวมก็อาจเป็นประโยชน์เช่นกัน[61]
การหยุดสูบบุหรี่
[แก้]การป้องกันมิให้ผู้คนเริ่มสูบบุหรี่นั้นเป็นหลักสำคัญของการป้องกัน COPD[63] นโยบายของรัฐบาล หน่วยงานสาธารณสุขและองค์กรต่อต้านการสูบบุหรี่ สามารถลดอัตราการสูบบุหรี่โดยการกีดกันมิให้ผู้คนริเริ่มการสูบบุหรี่และส่งเสริมการหยุดสูบบุหรี่[64] การห้ามสูบบุหรี่ในพื้นที่สาธารณะและสถานที่ทำงานนั้นเป็นมาตรการที่สำคัญในการลดการสัมผัสของบุหรี่จากการอยู่ใกล้ชิดผู้ที่สูบบุหรี่และขณะเดียวกันก็ขอแนะนำให้หลายๆ สถานที่จัดตั้งการห้ามให้มากขึ้น[36]
ในกลุ่มผู้สูบบุหรี่ การหยุดสูบบุหรี่นั้นเป็นมาตรการเดียวเท่านั้นที่แสดงถึงการชะลอการทรุดลงของโรค COPD[65] แม้ว่าจะเป็นระยะท้ายๆ ของโรคก็ตาม การหยุดสูบบุหรี่ก็สามารถลดอัตราของการแย่ลงของการทำงานของปอดและชะลอการเริ่มต้นของความทุพพลภาพและการเสียชีวิตได้[66] การหยุดสูบบุหรี่เริ่มจากการตัดสินใจหยุดสูบบุหรี่ และจากนั้นจึงเป็นการพยายามที่จะหยุดสูบบุหรี่ โดยส่วนใหญ่นั้นจำเป็นต้องมีการพยายามหลายครั้งก่อนที่จะประสบความสำเร็จของการงดเว้นในระยะยาว[64] ในคนจำนวนเกือบ 40% การพยายามเป็นเวลามากกว่า 5 ปีนั้นจะส่งผลที่เป็นความสำเร็จ[67]
ในผู้สูบบุหรี่บางรายนั้นสามารถบรรลุความสำเร็จของการหยุดสูบบุหรี่ในระยะยาวได้ด้วยพลังจากความตั้งใจเท่านั้น อย่างไรก็ตาม การสูบบุหรี่นั้นเป็นสิ่งเสพติดที่เลิกได้ยาก[68] และผู้สูบบุหรี่หลายรายต้องการการสนับสนุนด้านอื่นๆ โอกาสของการหยุดสูบบุหรี่นั้นสามารถเพิ่มขึ้นได้ด้วยการสนับสนุนจากสังคม การเข้าร่วมในโครงการการหยุดสูบบุหรี่และการใช้ยา อาทิ การบำบัดด้วยการทดแทนนิโคติน ยา bupropion หรือ varenicline[64][67]
อาชีวอนามัย
[แก้]ได้มีการใช้มาตรการจำนวนหนึ่งเพื่อลดแนวโน้มในการสูบบุหรี่ของผู้ทำงานในอุตสาหกรรมที่มีความเสี่ยงสูง เช่น การทำเหมืองถ่านหิน การก่อสร้างและการก่อสร้างอิฐ ที่สามารถก่อโรค COPD[36] ตัวอย่างของมาตรการเหล่านี้ได้แก่: การจัดตั้งนโยบายสาธารณะ[36] การให้ความรู้แก่พนักงานและฝ่ายบริหารเรื่องความเสี่ยง การส่งเสริมการหยุดสูบบุหรี่ การตรวจสอบในกลุ่มพนักงาน เพื่อสำรวจสัญญาณเริ่มแรกของ COPD โดยใช้เครื่องช่วยหายใจและการควบคุมฝุ่น[69][70] การควบคุมฝุ่นที่มีประสิทธิภาพสามารถทำได้โดยการปรับปรุงระบบระบายอากาศ โดยใช้การพ่นน้ำและโดยการใช้เทคนิคการทำเหมืองที่ลดการก่อฝุ่น[71] หากพนักงานมีการพัฒนาโรค COPD การหยุดยั้งไม่ให้ปอดถูกทำลายเพิ่มมากขึ้นสามารถทำได้ด้วยการหลีกเลี่ยงการสัมผัสฝุ่นอย่างต่อเนื่อง ตัวอย่างเช่น การเปลี่ยนแปลงหน้าที่ของพนักงาน[72]
มลพิษทางอากาศ
[แก้]คุณภาพของอากาศทั้งภายในและภายนอกสามารถปรับปรุงให้ดีขึ้นได้ ซึ่งสิ่งนี้อาจป้องกัน COPD หรือชะลอการทรุดลงของโรคที่เป็นอยู่ได้[36] สิ่งนี้อาจบรรลุความสำเร็จได้จากนโยบายของสาธารณะ การเปลี่ยนแปลงทางวัฒนธรรม และการมีส่วนร่วมโดยส่วนตัว[73]
ประเทศที่กำลังพัฒนาหลายประเทศประสบความสำเร็จในการปรับปรุงคุณภาพของอากาศภายนอกโดยใช้ระเบียบข้อบังคับ ซึ่งการนี้ได้ส่งผลที่เป็นการเสริมสร้างการทำงานของปอดของประชากรของประเทศเหล่านี้[36] ผู้ที่เป็นโรค COPD อาจเกิดอาการน้อยลงหากพวกเขาได้อยู่ภายในสถานที่ในวันที่อากาศภายนอกมีคุณภาพไม่ดี[11]
ความพยายามสำคัญข้อหนึ่งคือการลดการได้รับสัมผัสของควันจากการประกอบอาหารและเชื้อเพลิงที่มีความร้อนด้วยการปรับปรุงระบบระบายอากาศของบ้านและเตาทำอาหารและเตาผิงให้ดีขึ้น[73] เตาทำอาหารที่เหมาะสมนั้นอาจเป็นการปรับปรุงคุณภาพของอากาศภายในได้ถึง 85% การใช้แหล่งพลังงานที่เป็นทางเลือก เช่น เตาอบแสงอาทิตย์ และเครื่องทำความร้อนไฟฟ้านั้นเป็นวิธีการที่มีประสิทธิภาพ เนื่องจากวิธีเหล่านี้เป็นการใช้เชื้อเพลิง เช่น น้ำมันก๊าดหรือถ่านหินแทนการใช้เชื้อเพลิงมวลชีวภาพ[36]
การจัดการโรค
[แก้]โรค COPD นั้นไม่มีการรักษาที่เป็นที่ทราบ แต่อาการของโรคนั้นสามารถรักษาได้และสามารถชะลอความก้าวหน้าของโรคได้[63] เป้าหมายหลักของการจัดการโรคคือการลดปัจจัยเสี่ยง จัดการความคงที่ของ COPD ป้องกันการกำเริบของโรคแบบเฉียบพลันและจัดการความเจ็บป่วยที่เกี่ยวข้อง[11] มาตรการที่ได้แสดงถึงการลดการเสียชีวิตคือการหยุดสูบบุหรี่และการใช้ออกซิเจนเสริมเท่านั้น[74] การหยุดสูบบุหรี่นั้นเป็นการลดความเสี่ยงของการเสียชีวิตได้ 18%[10] ข้อแนะนำอื่นๆ นั้นได้แก่: การฉีดวัคซีนป้องกันไข้หวัดใหญ่ปีละครั้ง การฉีดวัคซีนป้องกันเชื้อปอดบวมทุกๆ 5 ปี และการลดการสัมผัสจากสภาพแวดล้อมที่มีมลพิษทางอากาศ[10] ในกลุ่มผู้ที่เป็นโรคขั้นลุกลาม การรักษาบรรเทาอาจช่วยลดอาการต่างๆ ได้ พร้อมกับการช่วยให้ความรู้สึกเนื่องจากความเหนื่อยดีขึ้นด้วยมอร์ฟีน[75] การใช้เครื่องช่วยหายใจแบบไม่มีการเจาะผ่าอาจใช้เพื่อสนับสนุนการหายใจได้[75]
การออกกำลังกาย
[แก้]การฟื้นฟูผู้ป่วยโรคทางปอดคือโครงการที่เป็นการประสานร่วมกันของการออกกำลังกาย การจัดการโรคและการให้คำปรึกษา เพื่อประโยชน์ของบุคคลนั้นๆ[76] ในกลุ่มผู้ที่มีการกำเริบของโรคเมื่อไม่นานมานี้ การฟื้นฟูผู้ป่วยโรคทางปอดนั้นดูเหมือนจะเป็นการปรับปรุงคุณภาพชีวิตโดยรวมและความสามารถในการออกกำลังกาย และการเสียชีวิตได้[77] โครงการนี้ยังได้แสดงให้เห็นถึงการพัฒนาความตระหนักในการควบคุมของบุคคลเกี่ยวกับโรคของตน ตลอดจนอารมณ์ความรู้สึกของพวกเขา[78] การฝึกฝนการหายใจเข้าและออกด้วยตนเองนั้นดูเหมือนจะมีข้อจำกัด[22]
การมีน้ำหนักน้อยหรือมากเกินไปสามารถส่งผลต่ออาการต่างๆ ระดับความพิการและการพยากรณ์โรค COPD ได้ ผู้ที่เป็น COPD ซึ่งมีน้ำหนักน้อยเกินไปสามารถปรับปรุงความแข็งแรงของกล้ามเนื้อการหายใจของตนได้โดยการเพิ่มปริมาณแคลอรี่ที่บริโภค[11] เมื่อร่วมกับการออกกำลังกายอย่างสม่ำเสมอหรือโครงการฟื้นฟูผู้ป่วยโรคทางปอด ก็สามารถส่งผลที่เป็นการปรับปรุงอาการของ COPD ให้ดีขึ้นได้ การรับประทานอาหารเสริมอาจมีประโยชน์สำหรับผู้ที่มีภาวะขาดอาหาร[79]
ยาขยายหลอดลม
[แก้]ยาขยายหลอดลมชนิดพ่นนั้นเป็นการรักษาหลักที่ใช้[10] และส่งผลที่เป็นประโยชน์โดยรวมเล็กน้อย[80] กลุ่มยาชนิดหลักๆ มีสองชนิดคือ β2 agonists และ แอนติโคลิเนอร์จิก ซึ่งมีทั้งชนิดออกฤทธิ์ระยะยาวและออกฤทธิ์ระยะสั้น ยาเหล่านี้สามารถลดความเหนื่อย การหายใจมีเสียงวี้ดและขีดจำกัดในการออกกำลังกายได้ ซึ่งส่งผลให้คุณภาพชีวิตดีขึ้น[81] ทั้งนี้ไม่เป็นที่ชัดเจนว่ายาเหล่านี้สามารถเปลี่ยนแปลงการกำเริบของโรคพื้นเดิมได้หรือไม่[10]
ในผู้ป่วยที่เป็นโรคระยะเบื้องต้น แนะนำให้ใช้ยาชนิดออกฤทธิ์สั้นเมื่อจำเป็น[10] ส่วนในผู้ป่วยที่มีโรคในขั้นที่รุนแรงกว่านั้น แนะนำให้ใช้ยาชนิดออกฤทธิ์นาน[10] หากยาขยายหลอดลมชนิดออกฤทธิ์นานไม่มีประสิทธิภาพเพียงพอ โดยส่วนใหญ่จะมีการเสริมด้วยยาคอร์ติโคสเตียรอยด์ชนิดสูดพ่น[10] ในส่วนของยาชนิดออกฤทธิ์นานนั้น ยังไม่มีข้อมูลที่ชัดเจนว่ายา tiotropium (แอนติโคลิเนอร์จิกชนิดออกฤทธิ์นาน) หรือ ตัวต่อต้านบีต้า (LABAs) นั้นดีกว่าหรือไม่ และการทดลองใช้ยาแต่ละตัวอาจจะมีประโยชน์ จากนั้นจึงใช้เฉพาะยาตัวที่ได้ผลดีที่สุดอย่างต่อเนื่องต่อไป[82] ยาทั้งสองประเภทนี้แสดงผลที่เป็นการลดความเสี่ยงของการกำเริบของโรคแบบเฉียบพลันได้ 15-25%[10] ขณะที่การใช้ยาทั้งสองตัวในเวลาเดียวกันนั้นอาจมีประโยชน์ แต่ทั้งนี้ประโยชน์ที่อาจได้รับนี้ เป็นสิ่งสำคัญที่ยังคงเป็นข้อสงสัย[83]
กลุ่มยาที่เป็นตัวต่อต้าน β2 ชนิดออกฤทธิ์สั้นมีอยู่หลายตัวด้วยกัน ได้แก่ salbutamol (Ventolin) และ terbutaline[84] ยาเหล่านี้สามารถบรรเทาอาการบางอย่างได้เป็นเวลาสี่ถึงหกชั่วโมง[84] ส่วนยาที่เป็นตัวต่อต้าน β2 ชนิดออกฤทธิ์นาน เช่น salmeterol และ formoterol นั้นมักใช้เป็นการรักษาเพื่อจัดการโรค ผู้ป่วยบางรายไม่รู้สึกว่าได้รับประโยชน์ที่ชัดเจนจากยาเหล่านี้[85] แต่ขณะเดียวกันผู้ป่วยอื่นๆ สามารถเห็นประโยชน์ที่ชัดเจน[86][87] การใช้ยาเหล่านี้ผู้ป่วย COPD ในระยะยาวนั้นดูเหมือนมีความปลอดภัย[88] รวมทั้งอาการไม่พึงประสงค์ต่างๆ ได้แก่ ความสั่น และ อัตราการเต้นของหัวใจเร็วหรือไม่สม่ำเสมอ[10] เมื่อมีการใช้ร่วมกับสเตียรอยด์ชนิดสูดพ่นยาเหล่านี้จะเพิ่มความเสี่ยงของโรคปอดบวม[10] ขณะที่สเตียรอยด์และ LABA อาจให้ผลดีกว่าเมื่อใช้ร่วมกัน[85] แต่ยังไม่ทราบแน่ชัดว่าประโยชน์เล็กน้อยนี้มีความสำคัญมากกว่าความเสี่ยงที่เพิ่มขึ้นหรือไม่[89]
มียากลุ่มแอนติโคลิเนอร์จิกหลักๆ สองตัวที่ใช้ใน COPD คือ ipratropium และ tiotropium ยา Ipratropium เป็นยาชนิดออกฤทธิ์สั้น ส่วนยา tiotropium เป็นยาชนิดออกฤทธิ์นาน ยา Tiotropium นั้นมีความเกี่ยวข้องกับการลดลงของการกำเริบของโรคและคุณภาพชีวิตที่ดีขึ้น[83] และยา tiotropium นั้นให้ผลที่ดีกว่ายา ipratropium[90] แต่ทั้งนี้ไม่ดูเหมือนว่าจะส่งผลต่ออัตราการเสียชีวิตหรือการเข้าพักรักษาตัวในโรงพยาบาลโดยรวม[91] แอนติโคลิเนอร์จิกอาจเป็นสาเหตุของอาการปากแห้งและกลุ่มอาการของทางเดินปัสสาวะ[10] นอกจากนี้ ยาเหล่านี้ยังเกี่ยวข้องกับความเสี่ยงที่เพิ่มขึ้นของโรคหัวใจและการอุดตันของเส้นโลหิตที่ไปเลี้ยงสมอง[92][93] ยา Aclidinium ซึ่งเป็นยาชนิดออกฤทธิ์นานอีกตัวหนึ่งที่มีการนำออกสู่ตลาดเมื่อปี 2012 ได้รับการใช้เป็นอีกทางเลือกหนึ่งที่นอกเหนือจากยา tiotropium[94][95]
คอร์ติโคสเตียรอยด์
[แก้]คอร์ติโคสเตียรอยด์มักใช้ในรูปแบบสูดพ่นแต่อาจจะมีการใช้ในรูปแบบเม็ดเพื่อรักษาและป้องกันการกำเริบของโรคแบบเฉียบพลัน แม้ว่าคอร์ติโคสเตียรอยด์ชนิดสูดพ่น (ICS) ไม่แสดงถึงประโยชน์สำหรับผู้ที่เป็นโรค COPD ในระยะเบื้องต้น แต่ก็สามารถลดการกำเริบของโรคแบบเฉียบพลันในผู้ป่วยที่เป็นโรคระยะปานกลางและระยะรุนแรงได้[96] เมื่อใช้ร่วมกับ LABA ยาเหล่านี้ลดการเสียชีวิตได้มากกว่าการใช้ยา ICS หรือ LABA เพียงตัวเดียว[97] โดยตัวของมันเองแล้วยาเหล่านี้ไม่มีผลต่อการเสียชีวิตโดยรวมในหนึ่งปีแต่เกี่ยวข้องกับอัตราที่เพิ่มขึ้นของโรคปอดบวม [74] ไม่เป็นที่แน่ชัดว่ายาเหล่านี้ส่งผลต่อการก้าวหน้าของโรคหรือไม่[10] การรักษาระยะยาวด้วยยาสเตียรอยด์ชนิดเม็ดนั้นมีความเกี่ยวข้องกับผลข้างเคียงที่มีนัยสำคัญต่างๆ[84]
ยาอื่นๆ
[แก้]การใช้ยายาปฏิชีวนะในระยะยาว โดยเฉพาะอย่างยิ่งยาในกลุ่ม macrolide เช่น erythromycin สามารถลดความถี่ของการกำเริบของโรคในผู้ที่มีการกำเริบของโรคตั้งแต่สองครั้งต่อปีขึ้นไป[98][99] รูปแบบการรักษานี้อาจมีความคุ้มค่าสำหรับในบางพื้นที่ของโลก[100] ข้อกังวลต่างๆ เช่น การดื้อต่อยาปฏิชีวนะ และปัญหาของการได้ยินจากยาอะซิโธรมัยซิน[99] Methylxanthines อาทิเช่น theophylline โดยทั่วไปเป็นโทษมากกว่าเป็นประโยชน์ และดังนั้นจึงไม่แนะนำ [101] แต่อาจใช้เป็นยาสำรองในกลุ่มผู้ป่วยที่มีการควบคุมโดยมาตรการอื่นๆ [11] ยา Mucolytic อาจมีประโยชน์ในผู้ป่วยบางรายที่มีเสมหะชนิดข้นหนืด แต่โดยทั่วไปนั้นไม่จำเป็น[61] ทั้งนี้ไม่แนะนำให้ใช้ยาแก้ไอ[84]
ออกซิเจน
[แก้]การใช้ออกซิเจนเสริมเป็นสิ่งที่แนะนำสำหรับผู้ป่วยที่มีระดับออกซิเจนต่ำขณะพัก (ความดันของออกซิเจนบางส่วนในระดับที่ต่ำกว่า 50–55 mmHg หรือความเข้มข้นของออกซิเจนต่ำกว่า 88%)[84][102] ในคนกลุ่มนี้ การบำบัดนี้จะเพิ่มความเสี่ยงของภาวะหัวใจล้มเหลวและการเสียชีวิตได้หากใช้เป็นเวลา 15 ชั่วโมงต่อวัน[84][102] แต่อาจเพิ่มความสามารถในการออกกำลังของบุคคลนั้นได้[103] ในกลุ่มของผู้ที่มีระดับออกซิเจนปกติหรือต่ำเล็กน้อย การใช้ออกซิเจนเสริมอาจช่วยบรรเทาอาการเหนื่อยได้[104] ทั้งนี้มีความเสี่ยงของไฟไหม้และประโยชน์เพียงเล็กน้อยเมื่อผู้ที่ใช้ออกซิเจนยังคงสูบบุหรี่อยู่[105] ในระดับความเข้มข้นนี้ มีบางคำแนะนำที่ต่อต้านการใช้การบำบัดนี้[106] ในระหว่างการกำเริบของโรคแบบเฉียบพลัน การบำบัดด้วยออกซิเจนเป็นสิ่งจำเป็นสำหรับหลายคน การใช้ออกซิเจนเข้มข้นโดยไม่คำนึงถึงระดับความเข้มข้นของบุคคลนั้น อาจนำไปสู่การเพิ่มขึ้นของระดับคาร์บอนไดออกไซด์และผลที่เลวร้ายกว่าได้[107][108] ในผู้ที่มีความเสี่ยงของการมีระดับคาร์บอนไดออกไซด์สูงนั้น แนะนำให้ใช้ความเข้มข้นของออกซิเจนที่ 88–92% ส่วนผู้ที่ไม่มีความสี่ยง ระดับที่แนะนำคือ 94-98%[108]
การผ่าตัด
[แก้]สำหรับผู้ป่วยที่เป็นโรคระยะร้ายแรง บางครั้งการผ่าตัดก็เป็นประโยชน์และอาจรวมถึงการปลูกถ่ายปอดหรือการผ่าตัดเพื่อลดปริมาตรของปอด[10] การผ่าตัดเพื่อลดปริมาตรของปอดเป็นการตัดเนื้อปอดบางส่วนที่ถูกทำลายโดยโรคถุงลมโป่งพอง เพื่อให้เนื้อเยื่อปอดส่วนที่ยังสามารถทำงานได้ขยายตัวและทำงานได้ดีขึ้น[84] การปลูกถ่ายปอดนั้นบางครั้งมีการดำเนินการสำหรับผู้ที่เป็นโรค COPD ขั้นรุนแรงมาก โดยเฉพาะอย่างยิ่งในผู้ที่อายุน้อย[84]
การกำเริบของโรค
[แก้]การกำเริบของโรคแบบเฉียบพลันนั้นโดยทั่วไปมีการรักษาโดยการเพิ่มการใช้ยาขยายหลอดลมชนิดออกฤทธิ์สั้น[10] ซึ่งเป็นการรักษาทั่วไป รวมถึงการรักษาร่วมกับตัวต่อต้านบีต้าชนิดสูดพ่นและแอนติโคลิเนอร์จิก[44] ยาเหล่านี้สามารถให้โดยใช้กระบอกพ่นละอองยาสำเร็จรูปพร้อมกับกระบอกช่วยสูด หรือด้วยเครื่องพ่นละออง เนื่องจากทั้งสอบรูปแบบนี้แสดงประสิทธิภาพที่เท่าเทียมกัน[44] ทั้งนี้เครื่องพ่นละอองอาจจะใช้งานได้ง่ายกว่าสำหรับผู้ที่สุขภาพไม่ดี[44]
ยาคอร์ติโคสเตียรอยด์ชนิดรับประทาน สามารถเพิ่มโอกาสของการฟื้นตัวและลดระยะเวลาของการเกิดของอาการโดยรวมได้[10][44] ในผู้ที่มีการกำเริบของโรคขั้นรุนแรง ยาปฏิชีวนะสามารถบรรเทาผลได้[109] ยาปฏิชีวนะต่างๆ จำนวนหนึ่งที่มีการใช้ ได้แก่: อะม็อกซีซิลลิน ด็อกซีซัยคลิน หรือ อะซิโทรมัยซิน ทั้งนี้ไม่เป็นที่ทราบแน่ชัดว่ายาตัวหนึ่งตัวใดตัวหนึ่งดีกว่าตัวอื่นๆ หรือไม่[61] และไม่มีหลักฐานที่ชัดเจนสำหรับผู้ที่มีอาการของโรคที่รุนแรงน้อยกว่า[109]
การใช้เครื่องช่วยหายใจเพื่อปรับความดันแบบไม่มีการเจาะผ่าในผู้ที่มีระดับ CO2 สูงขึ้นอย่างเฉียบพลัน (ภาวะการหายใจล้มเหลวชนิดที่ 2) สามารถลดความเป็นไปได้ของการเสียชีวิตหรือความจำเป็นต้องเข้าพักรักษาตัวด้วยเครื่องช่วยหายใจในหน่วยอภิบาล[10] นอกจากนั้น ยาธีโอฟิลลีนอาจส่งผลในการรักษาในผู้ที่ไม่ตอบสนองต่อมาตรการอื่นๆ[10] การกำเริบของโรคที่จำเป็นต้องเข้าพักรักษาตัวในโรงพยาบาลนั้นมีจำนวนต่ำกว่า 20% [44] ในกลุ่มผู้ที่ไม่มีภาวะกรดสาเหตุจากการหายใจล้มเหลว การรักษาพยาบาลที่บ้าน ("โรงพยาบาลที่บ้าน") อาจช่วยหลีกเลี่ยงการต้องเข้าพักรักษาตัวได้[44][110]
พยากรณ์โรค
[แก้]
no data ≤110 110–220 220–330 330–440 440–550 550–660 | 660–770 770–880 880–990 990–1100 1100–1350 ≥1350 |
COPD มักค่อยๆ มีอาการแย่ลงเรื่อยๆ เมื่อเวลาผ่านไปและในที่สุดอาจส่งผลที่เป็นการเสียชีวิตได้ มีการคาดการณ์ว่าประมาณ 3% ของความพิการทั้งหมดนั้นเกี่ยวข้องกับ COPD[112] สัดส่วนของความพิการจาก COPD ในทั่วโลกได้ลดลงนับตั้งแต่ปี ค.ศ. 1990 ถึง 2010 เนื่องจากการพัฒนาคุณภาพของอากาศภายในสถานที่ โดยเริ่มจากในเอเชีย[112] อย่างไรก็ตาม จำนวนของปีโดยรวมที่ต้องใช้ชีวิตโดยมีความพิการเนื่องจาก COPD นั้นได้เพิ่มขึ้น[113]
อัตราการแย่ลงของ COPD นั้นแตกต่างกันไปตามการปรากฏของปัจจัยต่างๆ ที่สามารถพยากรณ์ผลเชิงลบได้ ได้แก่: การอุดกั้นทางเดินหายใจขั้นรุนแรง ความสามารถในการออกกำลังกายต่ำ อาการเหนื่อย ความผอมหรืออ้วนที่สำคัญ โรคหัวใจเลือดคั่ง การยังคงสูบบุหรี่อยู่และความถี่ของการกำเริบของโรค[11] ผลระยะยาวใน COPD นั้นสามารถคาดการณ์ได้โดยการใช้ BODE index ซึ่งแสดงผลคะแนนจากศูนย์ถึงสิบ โดยขึ้นอยู่กับ FEV1 ดัชนีมวลกาย ระยะทางที่เดินได้ใน 6 นาที และแบบประเมิน modified MRC dyspnea scale[114] ความผอมที่สำคัญนั้นเป็นสัญญาณที่ไม่ดี [9] ผลการตรวจสมรรถภาพปอดด้วยการวัดปริมาตรอากาศหายใจก็เป็นเครื่องพยากรณ์ความก้าวหน้าของโรคในอนาคตที่ดีเช่นกัน แต่ไม่ดีเท่า BODE index[9][17]
วิทยาการระบาด
[แก้]ตั้งแต่ปี ค.ศ. 2010 มีประชากรที่เป็นโรค COPD ประมาณ 329 ล้านคนทั่วโลก (4.8% ของของประชากร) และพบในเพศชายมากกว่าเพศหญิงเล็กน้อย[113] นี่เป็นการเปรียบเทียบของผู้ที่เป็นโรคจำนวน 64 ล้านคนในปี ค.ศ. 2004[115] การเพิ่มขึ้นในประเทศที่กำลังพัฒนาระหว่างปี ค.ศ. 1970 ถึง 2010 นั้นเชื่อว่าเกี่ยวข้องกับการเพิ่มขึ้นของอัตราการสูบบุหรี่ในภูมิภาคนี้ และการเพิ่มขึ้นของจำนวนประชากรและการมีอายุยืนยาวขึ้นของประชากร เนื่องจากการลดลงของการเสียชีวิตจากสาเหตุอื่นๆ เช่นโรคติดเชื้อ[10] ความชุกของ COPD ในประเทศที่กำลังพัฒนาบางประเทศพบว่ามีอัตราเพิ่มขึ้น โดยบางประเทศมีอัตราคงที่และบางประเทศมีอัตราลดลง[10] จำนวนโดยรวมทั่วโลกนั้นคาดว่าจะยังคงเพิ่มขึ้นอย่างต่อเนื่อง เนื่องจากปัจจัยเสี่ยงต่างๆ นั้นยังคงพบได้ทั่วไปเช่นเดิมและประชากรยังคงมีอายุยืนยาวขึ้นเรื่อยๆ[63]
ระหว่างปี ค.ศ. 1990 ถึง 2010 จำนวนการเสียชีวิตจาก COPD ได้ลดลงเล็กน้อย จาก 3.1 ล้านคน เป็น 2.9 ล้านคน[116] โดยรวมแล้ว โรคนี้จัดเป็นอันดับสี่ของสาเหตุการเสียชีวิต[10] ในบางประเทศ อัตราการเสียชีวิตได้ลดลงในเพศชายแต่เพิ่มขึ้นในเพศหญิง[117] แนวโน้มที่เป็นไปได้มากที่สุดของเรื่องนี้เนื่องมาจากอัตราการสูบบุหรี่ในเพศหญิงและชายนั้นมีจำนวนเท่าๆ กัน[9] COPD นั้นพบได้ทั่วไปในผู้สูงอายุ[8] โรคนี้เกิดขึ้นในคนจำนวน 34-200 จากจำนวน 1000 คน ของผู้ที่มีอายุมากกว่า 65 ปี ทั้งนี้ขึ้นอยู่กับประชากรที่สำรวจ[8][59]
ในประเทศอังกฤษ ประมาณว่ามีคนจำนวน 0.84 ล้านคน (จาก 50 ล้านคน) ได้รับการวินิจฉัยว่าเป็น COPD หรือกล่าวได้อีกอย่างหนึ่งว่า ประมาณหนึ่งคนจาก 59 คนได้รับการวินิจฉัยว่าเป็น COPD ที่ช่วงใดช่วงหนึ่งในชีวิตของพวกเขา ในพื้นที่ของประเทศที่มีความขาดแคลนทางเศรษฐกิจมากที่สุด ประชากรหนึ่งคนใน 32 คนได้รับการวินิจฉัยว่าเป็น COPD เมื่อเปรียบเทียบกับหนึ่งใน 98 คนในพื้นที่ที่มั่งคั่งที่สุด[118] ในสหรัฐอเมริกา คิดเป็นประมาณ 6.3% ของประชากรผู้ใหญ่ และจำนวนรวมทั้งหมดประมาณ 15 ล้านคน ที่ได้รับการวินิจฉัยว่าเป็น COPD[119] ประชากรจำนวน 25 ล้านคน อาจมี COPD หากรวมถึงกรณีที่ยังไม่ได้การวินิจฉัยสาเหตุในปัจจุบัน[120] ในปี ค.ศ. 2011 มีผู้ป่วยประมาณ 730,000 คนเข้ารับการพักรักษาตัวในโรงพยาบาลในสหรัฐอเมริกาเนื่องจากโรค COPD[121]
ประวัติ
[แก้]
คำว่า "emphysema" (โรคถุงลมโป่งพอง) ถูกผันมาจากคำว่า emphysan ในกรีก ἐμφυσᾶν ซึ่งแปลว่า"พองลม" ซึ่งเป็นคำที่ประกอบด้วยคำว่า ἐν en ซึ่งแปลว่า "ใน" และ φυσᾶν physan ซึ่งแปลว่า "หายใจ, ระเบิด"[122] คำว่าการอักเสบเรื้อรังของหลอดลมได้เริ่มใช้ในปี ค.ศ. 1808[123] ส่วนคำว่า COPD นั้นเชื่อว่าถูกใช้ครั้งแรกเมื่อปี ค.ศ. 1965[124] ในอดีต โรคนี้มีชื่อต่างๆ กันมากมายหลายชื่อ ได้แก่: โรคปอดอุดกั้นเรื้อรังบรองโคพัลโมนารี (chronic obstructive bronchopulmonary), โรคระบบการเดินหายใจอุดกั้นเรื้อรัง (chronic obstructive respiratory disease), โรคทางเดินหายใจอุดกั้นเรื้อรัง (chronic airflow obstruction disease), การจำกัดของทางเดินหายใจ (chronic airflow limitation), โรคปอดอุดกั้นเรื้อรัง (chronic obstructive lung disease), โรคปอดเรื้อรังที่ไม่เฉพาะเจาะจง (nonspecific chronic pulmonary disease), และกลุ่มอาการปอดอุดกั้นแพร่กระจาย (diffuse obstructive pulmonary syndrome) คำว่าโรคหลอดลมอักเสบเรื้อรังและถุงลมโป่งพองนั้นได้รับการจำกัดความอย่างเป็นทางการในปี ค.ศ. 1959 ที่การประชุมสัมมนาของ CIBA และในปี ค.ศ. 1962 ที่การประชุมคณะกรรมการเรื่องมาตรฐานการวินิจฉัยโรคของ American Thoracic Society[124]
การอธิบายในช่วงเริ่มแรกของโรคที่อาจเป็นโรคถุงลมโป่งพอง ได้แก่: ในปี ค.ศ. 1679 โดย T. Bonet ว่าเป็นสภาวะของ "ปอดมีขนาดใหญ่" และในปี ค.ศ. 1769 โดย Giovanni Morgagni ว่าปอดนั้นมี "การบวมที่มีสาเหตุเนื่องจากอากาศโดยเฉพาะ"[124][125] ในปี ค.ศ. 1721 ภาพวาดภาพแรกของโรคถุงลมโป่งพองสร้างขึ้นโดย Ruysh[125] แล้วตามด้วยรูปภาพโดย Matthew Baillie ในปี ค.ศ. 1789 และคำอธิบายของลักษณะของสภาวะซึ่งเป็นการทำลาย ในปี ค.ศ. 1814 Charles Badham ได้ใช้คำว่า "เยื่อเมือกอักเสบ" เพื่ออธิบายการไอและเสหะที่มากผิดปกติในโรคหลอดลมอักเสบเรื้อรัง René Laennec ซึ่งเป็นแพทย์ผู้ประดิษฐ์หูฟังของแพทย์ได้ใช้คำว่า "โรคถุงลมโป่งพอง" ในหนังสือของเขาที่ชื่อว่า A Treatise on the Diseases of the Chest and of Mediate Auscultation (1837) เพื่ออธิบายสภาวะของปอดที่ไม่ยุบตัวเมื่อเขาผ่าหน้าอกในระหว่างการชันสูตรศพ เขาได้บันทึกว่าถุงลมเหล่านี้ไม่ยุบตัวตามปกติเนื่องจากเต็มไปด้วยอากาศและทางเดินหายใจนั้นเต็มไปด้วยเสมหะ ในปี 1842 John Hutchinson ได้ประดิษฐ์ เครื่องวัดปริมาตรอากาศหายใจ ซึ่งให้ความสามารถในการตรวจวัดความจุชีพของปอด อย่างไรก็ตาม เครื่องวัดปริมาตรอากาศหายใจของเขาสามารถวัดได้เพียงปริมาตร ไม่ใช่การไหลของอากาศ ในปี ค.ศ. 1947 Tiffeneau และ Pinelli ได้ทำการระบุรายละเอียดหลักการในการวัดการไหลของอากาศ[124]
ในปี ค.ศ. 1953 นายแพทย์ George L. Waldbott แพทย์ผู้เชี่ยวชาญด้านโรคภูมิแพ้ชาวอเมริกัน เป็นบุคคลแรกที่ได้อธิบายถึงโรคใหม่ที่เขาตั้งชื่อว่า "smoker's respiratory syndrome" (กลุ่มอาการระบบทางเดินหายใจของผู้สูบบุหรี่) ในวารสารของสมาคมแพทย์แห่งอเมริกา ปี ค.ศ. 1953 ซึ่งเป็นการรวมระหว่างการสูบบุหรี่กับโรคทางเดินหายใจเรื้อรังไว้ด้วยกันเป็นครั้งแรก[126]
การรักษาในระยะแรก ที่นอกเหนือจากสิ่งอื่นๆ แล้ว ยังมีการใช้ กระเทียม อบเชย และอีเพ็คค่า อีกด้วย[123] การรักษาแผนใหม่ได้รับการพัฒนาขึ้นในระหว่างครึ่งหลังของศตวรรษที่ 20 หลักฐานสนับสนุนของการใช้สเตียรอยด์ใน COPD ได้รับการตีพิมพ์ในช่วงปี 1955-60 ในปี ค.ศ. 1960-70 ได้เริ่มมีการใช้ยาขยายหลอดลม หลังจากการศึกษาวิจัยยาไอโซพรีนาลีนที่มีความหวัง ต่อจากนั้นยาขยายหลอดลมอื่นๆ เช่น salbutamol จึงได้รับการพัฒนาขึ้นในปี ค.ศ. 1970-80 และการใช้ยาในกลุ่ม LABA ได้เริ่มต้นเมื่อช่วงกลางระหว่างปี ค.ศ. 1990-2000[127]
สังคมและวัฒนธรรม
[แก้]COPD ได้รับการอ้างอิงว่าเป็น "ปอดของผู้สูบบุหรี่"[128] ผู้ที่เป็นโรคถุงลมโป่งพองได้รับการขนานนามว่า "pink puffers" (ผู้สูบสีชมพู) หรือ "ประเภท A" เนื่องจากลักษณะผิวสีชมพูที่เกิดขึ้นบ่อยครั้ง อัตราการหายใจเร็วและการหายใจโดยห่อริมฝีปาก[129][130] และผู้ที่เป็นโรคหลอดลมอักเสบเรื้อรังได้รับการขนานนามว่า "blue bloaters" (ผู้พองบวมสีน้ำเงิน) หรือ "ประเภท B" เนื่องจากมักมีผิวและริมฝีปากมีสีคล้ำเขียว เนื่องจากระดับออกซิเจนต่ำและข้อเท้าบวม[130][131] คำจำกัดเหล่านี้ไม่ได้รับการยอมรับว่ามีประโยชน์อีกต่อไปเนื่องจากผู้ที่เป็นโรค COPD ส่วนใหญ่นั้นมีภาวะร่วมของทั้งสองภาวะดังกล่าว[9][130]
ระบบสุขภาพหลายระบบประสบความยากลำบากในการรับรองคำจำกัดความ การวินิจฉัยและการพยาบาลที่เหมาะสมสำหรับผู้ป่วย COPD กระทรวงสาธารณะสุขของสหราชอาณาจักรได้ระบุว่าสิ่งนี้เป็นปัญหาหลักของ National Health Service และได้นำเสนอกลยุทธ์ที่เฉพาะเจาะจงในการรับมือกับปัญหาเหล่านี้[132]
สภาพเศรษฐกิจ
[แก้]ในทั่วโลก นับตั้งแต่ปี ค.ศ. 2010 โรค COPD ได้รับการคาดว่าส่งผลต่อค่าใช้จ่ายทางเศรษฐกิจเป็นเงิน $2.1 ล้านล้าน ซึ่งครึ่งหนึ่งเกิดขึ้นในประเทศที่กำลังพัฒนา[15] จากยอดรวมนี้คาดว่าเงินจำนวน $1.9 ล้านล้านนั้นเป็นค่าใช้จ่ายโดยตรง เช่น การรักษาทางการแพทย์ และอีก $0.2 ล้านล้านเป็นค่าใช้จ่ายโดยอ้อม เช่น การขาดงาน[133] มีการคาดหมายว่าจะเพิ่มขึ้นมากกว่าสองเท่าในอีก 20 ปีข้างหน้า[15] ในยุโรป COPD มีสัดส่วนคิดเป็น 3% ของค่าใช้จ่ายในการรักษาพยาบาลด้านสุขภาพ[8] ในสหรัฐอเมริกา ค่าใช้จ่ายของโรคนี้นั้นคาดว่าอยู่ที่ $50 พันล้าน ส่วนใหญ่นั้นเป็นค่าใช้จ่ายเนื่องจากการกำเริบของโรค[8] COPD นั้นเป็นโรคโรคหนึ่งในกลุ่มโรคที่มีค่าใช้จ่ายสูงที่สุดที่พบในโรงพยาบาลในอเมริกาในปี ค.ศ. 2011 โดยค่าใช้จ่ายรวมทั้งหมดนั้นประมาณ $5.7 พันล้าน[121]
การวิจัย
[แก้]ยา Infliximab เป็นแอนติบอดีกดภูมิคุ้มกัน ที่ได้รับการทดสอบใน COPD แต่ไม่มีหลักฐานของความเป็นประโยชน์ และมีความเป็นไปได้ของความเป็นโทษ[134] ยา Roflumilast แสดงถึงการลดอัตราการกำเริบของโรคที่มีความหวัง แต่ไม่แสดงถึงการเปลี่ยนแปลงของคุณภาพชีวิต[10] ยาชนิดออกฤทธิ์นานจำนวนหนึ่งนั้นอยู่ในระหว่างการพัฒนา[10] และการรักษาด้วยเซลล์ต้นกำเนิดนั้นกำลังได้รับการศึกษาวิจัย[135] ขณะที่ความปลอดภัยโดยทั่วไปและข้อมูลของการศึกษาวิจัยในสัตว์นั้นให้ความหวัง แต่ข้อมูลของการใช้ในมนุษย์ ณ ปี ค.ศ. 2014 นั้นมีน้อยมาก[136]
สัตว์อื่นๆ
[แก้]โรคปอดอุดกั้นเรื้อรังอาจเกิดขึ้นในสัตว์อื่นๆ จำนวนหนึ่งได้ และอาจเกิดจากการได้รับสัมผัสจากบุหรี่[137][138] อย่างไรก็ตาม โรคส่วนใหญ่นั้นมีระดับแค่เล็กน้อย[139] ในม้าซึ่งเป็นที่ทราบทั่วไปว่าเป็นการอุดกั้นทางเดินหายใจที่กลับเป็นซ้ำ และโดยทั่วไปเกิดขึ้นเนื่องจากปฏิกิริยาภูมิแพ้จากฟางที่มีเชื้อรา[140] COPD พบได้ทั่วไปในสุนัขแก่[141]
อ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 1.3 "Chronic obstructive pulmonary disease". NICE. สืบค้นเมื่อ 5 July 2021.
- ↑ "Chronic obstructive pulmonary disease (COPD) - Complications | BMJ Best Practice". bestpractice.bmj.com. สืบค้นเมื่อ 11 July 2021.
- ↑ 3.0 3.1 3.2 "Chronic obstructive pulmonary disease (COPD)". Fact Sheets (ภาษาอังกฤษ). World Health Organization. สืบค้นเมื่อ 1 July 2021.
- ↑ Gold Report 2021, pp. 20–23, Chapter 2: Diagnosis and initial assessment.
- ↑ Gold Report 2021, pp. 33–35, Chapter 2: Diagnosis and initial assessment.
- ↑ 6.0 6.1 6.2 Gold Report 2021, pp. 40–46, Chapter 3: Evidence supporting prevention and maintenance therapy.
- ↑ GBD 2015 Disease and Injury Incidence and Prevalence Collaborators (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ↑ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 8.11 8.12 8.13 8.14 8.15 8.16 8.17 8.18 8.19 8.20 8.21 8.22 8.23 8.24 8.25 8.26 Vestbo, Jørgen (2013). "Definition and Overview" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 1–7. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ 2015-08-18.
- ↑ 9.00 9.01 9.02 9.03 9.04 9.05 9.06 9.07 9.08 9.09 9.10 9.11 9.12 9.13 Reilly, John J.; Silverman, Edwin K.; Shapiro, Steven D. (2011). "Chronic Obstructive Pulmonary Disease". ใน Longo, Dan; Fauci, Anthony; Kasper, Dennis; Hauser, Stephen; Jameson, J.; Loscalzo, Joseph (บ.ก.). Harrison's Principles of Internal Medicine (18th ed.). McGraw Hill. pp. 2151–9. ISBN 978-0-07-174889-6.
- ↑ 10.00 10.01 10.02 10.03 10.04 10.05 10.06 10.07 10.08 10.09 10.10 10.11 10.12 10.13 10.14 10.15 10.16 10.17 10.18 10.19 10.20 10.21 10.22 10.23 10.24 10.25 10.26 10.27 Decramer M, Janssens W, Miravitlles M (April 2012). "Chronic obstructive pulmonary disease". Lancet. 379 (9823): 1341–51. doi:10.1016/S0140-6736(11)60968-9. PMID 22314182.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 11.00 11.01 11.02 11.03 11.04 11.05 11.06 11.07 11.08 11.09 11.10 Rabe KF, Hurd S, Anzueto A, Barnes PJ, Buist SA, Calverley P, Fukuchi Y, Jenkins C, Rodriguez-Roisin R, van Weel C, Zielinski J (September 2007). "Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: GOLD executive summary". Am. J. Respir. Crit. Care Med. 176 (6): 532–55. doi:10.1164/rccm.200703-456SO. PMID 17507545.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Nathell L, Nathell M, Malmberg P, Larsson K (2007). "COPD diagnosis related to different guidelines and spirometry techniques". Respir. Res. 8 (1): 89. doi:10.1186/1465-9921-8-89. PMC 2217523. PMID 18053200.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "The 10 leading causes of death in the world, 2000 and 2011". World Health Organization. July 2013. สืบค้นเมื่อ November 29, 2013.
- ↑ Mathers CD, Loncar D (November 2006). "Projections of Global Mortality and Burden of Disease from 2002 to 2030". PLoS Med. 3 (11): e442. doi:10.1371/journal.pmed.0030442. PMC 1664601. PMID 17132052.
- ↑ 15.0 15.1 15.2 Lomborg, Bjørn (2013). Global problems, local solutions : costs and benefits. Cambridge University Pres. p. 143. ISBN 978-1-107-03959-9.
- ↑ 16.00 16.01 16.02 16.03 16.04 16.05 16.06 16.07 16.08 16.09 16.10 16.11 16.12 16.13 16.14 16.15 16.16 16.17 16.18 16.19 16.20 Vestbo, Jørgen (2013). "Diagnosis and Assessment" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 9–17. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ 2015-08-18.
- ↑ 17.0 17.1 17.2 17.3 17.4 17.5 17.6 National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- ↑ Mahler DA (2006). "Mechanisms and measurement of dyspnea in chronic obstructive pulmonary disease". Proceedings of the American Thoracic Society. 3 (3): 234–8. doi:10.1513/pats.200509-103SF. PMID 16636091.
- ↑ "What Are the Signs and Symptoms of COPD?". National Heart, Lung, and Blood Institute. July 31, 2013. สืบค้นเมื่อ November 29, 2013.
- ↑ MedlinePlus Encyclopedia Chronic obstructive pulmonary disease
- ↑ Morrison, Nathan E. Goldstein, R. Sean (2013). Evidence-based practice of palliative medicine. Philadelphia: Elsevier/Saunders. p. 124. ISBN 978-1-4377-3796-7.
- ↑ 22.0 22.1 Holland AE, Hill CJ, Jones AY, McDonald CF (2012). Holland, Anne E (บ.ก.). "Breathing exercises for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 10: CD008250. doi:10.1002/14651858.CD008250.pub2. PMID 23076942.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 23.0 23.1 23.2 23.3 23.4 23.5 Gruber, Phillip (November 2008). "The Acute Presentation of Chronic Obstructive Pulmonary Disease In the Emergency Department: A Challenging Oxymoron". Emergency Medicine Practice. 10 (11).
- ↑ 24.0 24.1 Weitzenblum E, Chaouat A (2009). "Cor pulmonale". Chron Respir Dis. 6 (3): 177–85. doi:10.1177/1479972309104664. PMID 19643833.
- ↑ "Cor pulmonale". Professional guide to diseases (9th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. 2009. pp. 120–2. ISBN 978-0-7817-7899-2.
- ↑ Mandell, James K. Stoller, Franklin A. Michota, Jr., Brian F. (2009). The Cleveland Clinic Foundation intensive review of internal medicine (5th ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 419. ISBN 978-0-7817-9079-6.
- ↑ Brulotte CA, Lang ES (May 2012). "Acute exacerbations of chronic obstructive pulmonary disease in the emergency department". Emerg. Med. Clin. North Am. 30 (2): 223–47, vii. doi:10.1016/j.emc.2011.10.005. PMID 22487106.
- ↑ Spiro, Stephen (2012). Clinical respiratory medicine expert consult (4th ed.). Philadelphia, PA: Saunders. p. Chapter 43. ISBN 978-1-4557-2329-4.
- ↑ World Health Organization (2008). WHO Report on the Global Tobacco Epidemic 2008: The MPOWER Package (PDF). Geneva: World Health Organization. pp. 268–309. ISBN 92-4-159628-7.
- ↑ 30.0 30.1 Ward, Helen (2012). Oxford Handbook of Epidemiology for Clinicians. Oxford University Press. pp. 289–290. ISBN 978-0-19-165478-7.
- ↑ Laniado-Laborín, R (January 2009). "Smoking and chronic obstructive pulmonary disease (COPD). Parallel epidemics of the 21st century". International journal of environmental research and public health. 6 (1): 209–24. doi:10.3390/ijerph6010209. PMC 2672326. PMID 19440278.
- ↑ 32.0 32.1 Rennard, Stephen (2013). Clinical management of chronic obstructive pulmonary disease (2nd ed.). New York: Informa Healthcare. p. 23. ISBN 978-0-8493-7588-0.
- ↑ 33.0 33.1 Anita Sharma ; with a contribution by David Pitchforth ; forewords by Gail Richards; Barclay, Joyce (2010). COPD in primary care. Oxford: Radcliffe Pub. p. 9. ISBN 978-1-84619-316-3.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Goldman, Lee (2012). Goldman's Cecil medicine (24th ed.). Philadelphia: Elsevier/Saunders. p. 537. ISBN 978-1-4377-1604-7.
- ↑ 35.0 35.1 Kennedy SM, Chambers R, Du W, Dimich-Ward H (December 2007). "Environmental and occupational exposures: do they affect chronic obstructive pulmonary disease differently in women and men?". Proceedings of the American Thoracic Society. 4 (8): 692–4. doi:10.1513/pats.200707-094SD. PMID 18073405.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 36.00 36.01 36.02 36.03 36.04 36.05 36.06 36.07 36.08 36.09 36.10 36.11 36.12 Pirozzi C, Scholand MB (July 2012). "Smoking cessation and environmental hygiene". Med. Clin. North Am. 96 (4): 849–67. doi:10.1016/j.mcna.2012.04.014. PMID 22793948.
- ↑ Halbert RJ, Natoli JL, Gano A, Badamgarav E, Buist AS, Mannino DM (September 2006). "Global burden of COPD: systematic review and meta-analysis". Eur. Respir. J. 28 (3): 523–32. doi:10.1183/09031936.06.00124605. PMID 16611654.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 38.0 38.1 Devereux, Graham (2006). "Definition, epidemiology and risk factors". BMJ. 332 (7550): 1142–4. doi:10.1136/bmj.332.7550.1142. PMC 1459603. PMID 16690673.
- ↑ Laine, Christine (2009). In the Clinic: Practical Information about Common Health Problems. ACP Press. p. 226. ISBN 978-1-934465-64-6.
- ↑ 40.0 40.1 Barnes, Peter J.; Drazen, Jeffrey M.; Rennard, Stephen I.; Thomson, Neil C., บ.ก. (2009). "Relationship between cigarette smoking and occupational exposures". Asthma and COPD: Basic Mechanisms and Clinical Management. Amsterdam: Academic. p. 464. ISBN 978-0-12-374001-4.
- ↑ Rushton, Lesley (2007). "Chronic Obstructive Pulmonary Disease and Occupational Exposure to Silica". Reviews on Environmental Health. 22 (4): 255–72. doi:10.1515/REVEH.2007.22.4.255. PMID 18351226.
- ↑ 42.0 42.1 42.2 42.3 Foreman MG, Campos M, Celedón JC (July 2012). "Genes and chronic obstructive pulmonary disease". Med. Clin. North Am. 96 (4): 699–711. doi:10.1016/j.mcna.2012.02.006. PMC 3399759. PMID 22793939.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Brode SK, Ling SC, Chapman KR (September 2012). "Alpha-1 antitrypsin deficiency: a commonly overlooked cause of lung disease". CMAJ. 184 (12): 1365–71. doi:10.1503/cmaj.111749. PMC 3447047. PMID 22761482.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 44.0 44.1 44.2 44.3 44.4 44.5 44.6 Vestbo, Jørgen (2013). "Management of Exacerbations" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 39–45. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ 2015-08-18.
- ↑ 45.0 45.1 45.2 Dhar, Raja (2011). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. p. 1056. ISBN 978-93-5025-073-0.
- ↑ Palange, Paolo (2013). ERS Handbook of Respiratory Medicine. European Respiratory Society. p. 194. ISBN 978-1-84984-041-5.
- ↑ Lötvall, Jan (2011). Advances in combination therapy for asthma and COPD. Chichester, West Sussex: John Wiley & Sons. p. 251. ISBN 978-1-119-97846-6.
- ↑ Barnes, Peter (2009). Asthma and COPD : basic mechanisms and clinical management (2nd ed.). Amsterdam: Academic. p. 837. ISBN 978-0-12-374001-4.
- ↑ Hanania, Nicola (2010-12-09). COPD a Guide to Diagnosis and Clinical Management (1st ed.). Totowa, NJ: Springer Science+Business Media, LLC. p. 197. ISBN 978-1-59745-357-8.
- ↑ 50.0 50.1 Beasley, V; Joshi, PV; Singanayagam, A; Molyneaux, PL; Johnston, SL; Mallia, P (2012). "Lung microbiology and exacerbations in COPD". International journal of chronic obstructive pulmonary disease. 7: 555–69. doi:10.2147/COPD.S28286. PMC 3437812. PMID 22969296.
- ↑ Murphy DMF, Fishman AP (2008). "Chapter 53". Fishman's Pulmonary Diseases and Disorders (4th ed.). McGraw-Hill. p. 913. ISBN 0-07-145739-9.
- ↑ 52.0 52.1 Calverley PM, Koulouris NG (2005). "Flow limitation and dynamic hyperinflation: key concepts in modern respiratory physiology". Eur Respir J. 25 (1): 186–199. doi:10.1183/09031936.04.00113204. PMID 15640341.
- ↑ Currie, Graeme P. (2010). ABC of COPD (2nd ed.). Chichester, West Sussex, UK: Wiley-Blackwell, BMJ Books. p. 32. ISBN 978-1-4443-2948-3.
- ↑ O'Donnell DE (2006). "Hyperinflation, Dyspnea, and Exercise Intolerance in Chronic Obstructive Pulmonary Disease". The Proceedings of the American Thoracic Society. 3 (2): 180–4. doi:10.1513/pats.200508-093DO. PMID 16565429.
- ↑ 55.0 55.1 55.2 55.3 55.4 55.5 Qaseem A, Wilt TJ, Weinberger SE, Hanania NA, Criner G, van der Molen T, Marciniuk DD, Denberg T, Schünemann H, Wedzicha W, MacDonald R, Shekelle P (August 2011). "Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society". Ann. Intern. Med. 155 (3): 179–91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 56.0 56.1 Young, Vincent B. (2010). Blueprints medicine (5th ed.). Philadelphia: Wolters Kluwer Health/Lippincott William & Wilkins. p. 69. ISBN 978-0-7817-8870-0.
- ↑ "COPD Assessment Test (CAT)". American Thoracic Society. สืบค้นเมื่อ November 29, 2013.
- ↑ 58.0 58.1 National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- ↑ 59.0 59.1 Torres M, Moayedi S (May 2007). "Evaluation of the acutely dyspneic elderly patient". Clin. Geriatr. Med. 23 (2): 307–25, vi. doi:10.1016/j.cger.2007.01.007. PMID 17462519.
- ↑ BTS COPD Consortium (2005). "Spirometry in practice - a practical guide to using spirometry in primary care". pp. 8–9. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-08-26. สืบค้นเมื่อ 25 August 2014.
- ↑ 61.0 61.1 61.2 61.3 Mackay AJ, Hurst JR (July 2012). "COPD exacerbations: causes, prevention, and treatment". Med. Clin. North Am. 96 (4): 789–809. doi:10.1016/j.mcna.2012.02.008. PMID 22793945.
- ↑ Poole PJ, Chacko E, Wood-Baker RW, Cates CJ (2006). Poole, Phillippa (บ.ก.). "Influenza vaccine for patients with chronic obstructive pulmonary disease". Cochrane Database Syst Rev (1): CD002733. doi:10.1002/14651858.CD002733.pub2. PMID 16437444.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 63.0 63.1 63.2 Vestbo, Jørgen (2013). "Introduction". Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (PDF). Global Initiative for Chronic Obstructive Lung Disease. xiii–xv. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ 2015-08-18.
- ↑ 64.0 64.1 64.2 Policy Recommendations for Smoking Cessation and Treatment of Tobacco Dependence. World Health Organization. pp. 15–40. ISBN 978-92-4-156240-9.
- ↑ Jiménez-Ruiz CA, Fagerström KO (March 2013). "Smoking cessation treatment for COPD smokers: the role of counselling". Monaldi Arch Chest Dis. 79 (1): 33–7. PMID 23741944.
- ↑ Kumar P, Clark M (2005). Clinical Medicine (6th ed.). Elsevier Saunders. pp. 900–1. ISBN 0-7020-2763-4.
- ↑ 67.0 67.1 Tønnesen P (March 2013). "Smoking cessation and COPD". Eur Respir Rev. 22 (127): 37–43. doi:10.1183/09059180.00007212. PMID 23457163.
- ↑ "Why is smoking addictive?". NHS Choices. December 29, 2011. สืบค้นเมื่อ November 29, 2013.
- ↑ Smith, Barbara K. Timby, Nancy E. (2005). Essentials of nursing : care of adults and children. Philadelphia: Lippincott Williams & Wilkins. p. 338. ISBN 978-0-7817-5098-1.
- ↑ Rom, William N.; Markowitz, Steven B., บ.ก. (2007). Environmental and occupational medicine (4th ed.). Philadelphia: Wolters Kluwer/Lippincott Williams & Wilkins. pp. 521–2. ISBN 978-0-7817-6299-1.
- ↑ "Wet cutting". Health and Safety Executive. สืบค้นเมื่อ November 29, 2013.
- ↑ George, Ronald B. (2005). Chest medicine : essentials of pulmonary and critical care medicine (5th ed.). Philadelphia, PA: Lippincott Williams & Wilkins. p. 172. ISBN 978-0-7817-5273-2.
- ↑ 73.0 73.1 Vestbo, Jørgen (2013). "Management of Stable COPD". Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease (PDF). Global Initiative for Chronic Obstructive Lung Disease. pp. 31–8. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ 2015-08-18.
- ↑ 74.0 74.1 Drummond MB, Dasenbrook EC, Pitz MW, Murphy DJ, Fan E (November 2008). "Inhaled corticosteroids in patients with stable chronic obstructive pulmonary disease: a systematic review and meta-analysis". JAMA. 300 (20): 2407–16. doi:10.1001/jama.2008.717. PMID 19033591.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 75.0 75.1 Carlucci A, Guerrieri A, Nava S (December 2012). "Palliative care in COPD patients: is it only an end-of-life issue?". Eur Respir Rev. 21 (126): 347–54. doi:10.1183/09059180.00001512. PMID 23204123.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "COPD — Treatment". U.S. National Heart Lung and Blood Institute. สืบค้นเมื่อ 2013-07-23.
- ↑ Puhan MA, Gimeno-Santos E, Scharplatz M, Troosters T, Walters EH, Steurer J (2011). Puhan, Milo A (บ.ก.). "Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev (10): CD005305. doi:10.1002/14651858.CD005305.pub3. PMID 21975749.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lacasse Y, Goldstein R, Lasserson TJ, Martin S (2006). Lacasse, Yves (บ.ก.). "Pulmonary rehabilitation for chronic obstructive pulmonary disease". Cochrane Database Syst Rev (4): CD003793. doi:10.1002/14651858.CD003793.pub2. PMID 17054186.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ferreira IM, Brooks D, White J, Goldstein R (2012). Ferreira, Ivone M (บ.ก.). "Nutritional supplementation for stable chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 12: CD000998. doi:10.1002/14651858.CD000998.pub3. PMID 23235577.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ van Dijk WD, van den Bemt L, van Weel C (2013). "Megatrials for bronchodilators in chronic obstructive pulmonary disease (COPD) treatment: time to reflect". J Am Board Fam Med. 26 (2): 221–4. doi:10.3122/jabfm.2013.02.110342. PMID 23471939.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Liesker JJ, Wijkstra PJ, Ten Hacken NH, Koëter GH, Postma DS, Kerstjens HA (February 2002). "A systematic review of the effects of bronchodilators on exercise capacity in patients with COPD". Chest. 121 (2): 597–608. doi:10.1378/chest.121.2.597. PMID 11834677.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Chong J, Karner C, Poole P (2012). Chong, Jimmy (บ.ก.). "Tiotropium versus long-acting beta-agonists for stable chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 9: CD009157. doi:10.1002/14651858.CD009157.pub2. PMID 22972134.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 83.0 83.1 Karner C, Cates CJ (2012). Karner, Charlotta (บ.ก.). "Long-acting beta(2)-agonist in addition to tiotropium versus either tiotropium or long-acting beta(2)-agonist alone for chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 4: CD008989. doi:10.1002/14651858.CD008989.pub2. PMID 22513969.
- ↑ 84.0 84.1 84.2 84.3 84.4 84.5 84.6 84.7 Vestbo, Jørgen (2013). "Therapeutic Options" (PDF). Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease. Global Initiative for Chronic Obstructive Lung Disease. pp. 19–30. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ 2015-08-18.
- ↑ 85.0 85.1 Cave, AC.; Hurst, MM. (May 2011). "The use of long acting β₂-agonists, alone or in combination with inhaled corticosteroids, in chronic obstructive pulmonary disease (COPD): a risk-benefit analysis". Pharmacol Ther. 130 (2): 114–43. doi:10.1016/j.pharmthera.2010.12.008. PMID 21276815.
- ↑ Spencer, S; Karner, C; Cates, CJ; Evans, DJ (Dec 7, 2011). Spencer, Sally (บ.ก.). "Inhaled corticosteroids versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews (12): CD007033. doi:10.1002/14651858.CD007033.pub3. PMID 22161409.
- ↑ Wang, J; Nie, B; Xiong, W; Xu, Y (April 2012). "Effect of long-acting beta-agonists on the frequency of COPD exacerbations: a meta-analysis". Journal of clinical pharmacy and therapeutics. 37 (2): 204–11. doi:10.1111/j.1365-2710.2011.01285.x. PMID 21740451.
- ↑ Decramer ML, Hanania NA, Lötvall JO, Yawn BP (2013). "The safety of long-acting β2-agonists in the treatment of stable chronic obstructive pulmonary disease". Int J Chron Obstruct Pulmon Dis. 8: 53–64. doi:10.2147/COPD.S39018. PMC 3558319. PMID 23378756.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Nannini, LJ; Lasserson, TJ; Poole, P (Sep 12, 2012). Nannini, Luis Javier (บ.ก.). "Combined corticosteroid and long-acting beta(2)-agonist in one inhaler versus long-acting beta(2)-agonists for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 9: CD006829. doi:10.1002/14651858.CD006829.pub2. PMID 22972099.
- ↑ Cheyne L, Irvin-Sellers MJ, White J (Sep 16, 2013). Cheyne, Leanne (บ.ก.). "Tiotropium versus ipratropium bromide for chronic obstructive pulmonary disease". Cochrane Database of Systematic Reviews. 9 (9): CD009552. doi:10.1002/14651858.CD009552.pub2. PMID 24043433.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Karner, C; Chong, J; Poole, P (Jul 11, 2012). Karner, Charlotta (บ.ก.). "Tiotropium versus placebo for chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 7: CD009285. doi:10.1002/14651858.CD009285.pub2. PMID 22786525.
- ↑ Singh S, Loke YK, Furberg CD (September 2008). "Inhaled anticholinergics and risk of major adverse cardiovascular events in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis". JAMA. 300 (12): 1439–50. doi:10.1001/jama.300.12.1439. PMID 18812535.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Singh S, Loke YK, Enright P, Furberg CD (January 2013). "Pro-arrhythmic and pro-ischaemic effects of inhaled anticholinergic medications". Thorax. 68 (1): 114–6. doi:10.1136/thoraxjnl-2011-201275. PMID 22764216.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Jones, P (Apr 2013). "Aclidinium bromide twice daily for the treatment of chronic obstructive pulmonary disease: a review". Advances in therapy. 30 (4): 354–68. doi:10.1007/s12325-013-0019-2. PMID 23553509.
- ↑ Cazzola, M; Page, CP; Matera, MG (Jun 2013). "Aclidinium bromide for the treatment of chronic obstructive pulmonary disease". Expert opinion on pharmacotherapy. 14 (9): 1205–14. doi:10.1517/14656566.2013.789021. PMID 23566013.
- ↑ Gartlehner G, Hansen RA, Carson SS, Lohr KN (2006). "Efficacy and Safety of Inhaled Corticosteroids in Patients With COPD: A Systematic Review and Meta-Analysis of Health Outcomes". Ann Fam Med. 4 (3): 253–62. doi:10.1370/afm.517. PMC 1479432. PMID 16735528.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Shafazand S (June 2013). "ACP Journal Club. Review: inhaled medications vary substantively in their effects on mortality in COPD". Ann. Intern. Med. 158 (12): JC2. doi:10.7326/0003-4819-158-12-201306180-02002. PMID 23778926.
- ↑ Mammen MJ, Sethi S (2012). "Macrolide therapy for the prevention of acute exacerbations in chronic obstructive pulmonary disease". Pol. Arch. Med. Wewn. 122 (1–2): 54–9. PMID 22353707.
- ↑ 99.0 99.1 Herath, SC; Poole, P (Nov 28, 2013). "Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD)". The Cochrane database of systematic reviews. 11: CD009764. doi:10.1002/14651858.CD009764.pub2. PMID 24288145.
- ↑ Simoens, S; Laekeman, G; Decramer, M (May 2013). "Preventing COPD exacerbations with macrolides: a review and budget impact analysis". Respiratory medicine. 107 (5): 637–48. doi:10.1016/j.rmed.2012.12.019. PMID 23352223.
- ↑ Barr RG, Rowe BH, Camargo CA (2003). Barr, R Graham (บ.ก.). "Methylxanthines for exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev (2): CD002168. doi:10.1002/14651858.CD002168. PMID 12804425.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 102.0 102.1 COPD Working, Group (2012). "Long-term oxygen therapy for patients with chronic obstructive pulmonary disease (COPD): an evidence-based analysis". Ontario health technology assessment series. 12 (7): 1–64. PMC 3384376. PMID 23074435.
- ↑ Bradley JM, O'Neill B (2005). Bradley, Judy M (บ.ก.). "Short-term ambulatory oxygen for chronic obstructive pulmonary disease". Cochrane Database Syst Rev (4): CD004356. doi:10.1002/14651858.CD004356.pub3. PMID 16235359.
- ↑ Uronis H, McCrory DC, Samsa G, Currow D, Abernethy A (2011). Abernethy, Amy (บ.ก.). "Symptomatic oxygen for non-hypoxaemic chronic obstructive pulmonary disease". Cochrane Database Syst Rev (6): CD006429. doi:10.1002/14651858.CD006429.pub2. PMID 21678356.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Chapman, Stephen (2009). Oxford handbook of respiratory medicine (2nd ed.). Oxford: Oxford University Press. p. 707. ISBN 978-0-19-954516-2.
- ↑ Blackler, Laura (2007). Managing chronic obstructive pulmonary disease. Chichester, England: John Wiley & Sons. p. 49. ISBN 978-0-470-51798-7.
- ↑ Jindal, Surinder K (2013). Chronic Obstructive Pulmonary Disease. Jaypee Brothers Medical. p. 139. ISBN 978-93-5090-353-7.
- ↑ 108.0 108.1 O'Driscoll, BR; Howard, LS; Davison, AG; British Thoracic, Society (October 2008). "BTS guideline for emergency oxygen use in adult patients". Thorax. 63 (Suppl 6): vi1–68. doi:10.1136/thx.2008.102947. PMID 18838559.
- ↑ 109.0 109.1 Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA (2012). Vollenweider, Daniela J (บ.ก.). "Antibiotics for exacerbations of chronic obstructive pulmonary disease". Cochrane Database Syst Rev. 12: CD010257. doi:10.1002/14651858.CD010257. PMID 23235687.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Jeppesen, E; Brurberg, KG; Vist, GE; Wedzicha, JA; Wright, JJ; Greenstone, M; Walters, JA (May 16, 2012). "Hospital at home for acute exacerbations of chronic obstructive pulmonary disease". The Cochrane database of systematic reviews. 5: CD003573. doi:10.1002/14651858.CD003573.pub2. PMID 22592692.
- ↑ "WHO Disease and injury country estimates". World Health Organization. 2009. สืบค้นเมื่อ Nov 11, 2009.
- ↑ 112.0 112.1 Murray CJ, Vos T, Lozano R, Naghavi M, Flaxman AD, Michaud C, Ezzati M, Shibuya K, Salomon JA; และคณะ (December 2012). "Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2197–223. doi:10.1016/S0140-6736(12)61689-4. PMID 23245608.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 113.0 113.1 Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, Shibuya K, Salomon JA, Abdalla S, Aboyans V; และคณะ (December 2012). "Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990–2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2163–96. doi:10.1016/S0140-6736(12)61729-2. PMID 23245607.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Medicine, prepared by the Department of Medicine, Washington University School of (2009). The Washington manual general internal medicine subspecialty consult (2nd ed.). Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 96. ISBN 978-0-7817-9155-7.
- ↑ "Chronic obstructive pulmonary disease (COPD) Fact sheet N°315". WHO. November 2012.
- ↑ Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, Abraham J, Adair T, Aggarwal R; และคณะ (December 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rycroft CE, Heyes A, Lanza L, Becker K (2012). "Epidemiology of chronic obstructive pulmonary disease: a literature review". Int J Chron Obstruct Pulmon Dis. 7: 457–94. doi:10.2147/COPD.S32330. PMC 3422122. PMID 22927753.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Simpson CR, Hippisley-Cox J, Sheikh A (2010). "Trends in the epidemiology of chronic obstructive pulmonary disease in England: a national study of 51 804 patients". Brit J Gen Pract. 60 (576): 483–8. doi:10.3399/bjgp10X514729. PMC 2894402. PMID 20594429.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Centers for Disease Control and Prevention (Nov 23, 2012). "Chronic Obstructive Pulmonary Disease Among Adults — United States, 2011". Morbidity and Mortality Weekly Report. 61 (46): 938–43. PMID 23169314.
- ↑ "Morbidity & Mortality: 2009 Chart Book on Cardiovascular, Lung, and Blood Diseases" (PDF). National Heart, Lung, and Blood Institute.
- ↑ 121.0 121.1 Torio CM, Andrews RM (2006). "National Inpatient Hospital Costs: The Most Expensive Conditions by Payer, 2011: Statistical Brief #160". Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. Agency for Health Care Policy and Research. PMID 24199255. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2017-03-14. สืบค้นเมื่อ 2015-08-18.
- ↑ "Emphysema". Dictionary.com. สืบค้นเมื่อ 21 November 2013.
- ↑ 123.0 123.1 Ziment, Irwin (1991). "History of the Treatment of Chronic Bronchitis". Respiration. 58 (Suppl 1): 37–42. doi:10.1159/000195969. PMID 1925077.
- ↑ 124.0 124.1 124.2 124.3 Petty TL (2006). "The history of COPD". Int J Chron Obstruct Pulmon Dis. 1 (1): 3–14. doi:10.2147/copd.2006.1.1.3. PMC 2706597. PMID 18046898.
- ↑ 125.0 125.1 Wright, Joanne L.; Churg, Andrew (2008). "Pathologic Features of Chronic Obstructive Pulmonary Disease: Diagnostic Criteria and Differential Diagnosis" (PDF). ใน Fishman, Alfred; Elias, Jack; Fishman, Jay; Grippi, Michael; Senior, Robert; Pack, Allan (บ.ก.). Fishman's Pulmonary Diseases and Disorders (4th ed.). New York: McGraw-Hill. pp. 693–705. ISBN 978-0-07-164109-8. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2016-03-03. สืบค้นเมื่อ 2015-08-18.
- ↑ George L. Waldbott (1965). A struggle with Titans. Carlton Press. p. 6.
- ↑ Fishman AP (May 2005). "One hundred years of chronic obstructive pulmonary disease". Am. J. Respir. Crit. Care Med. 171 (9): 941–8. doi:10.1164/rccm.200412-1685OE. PMID 15849329.
- ↑ Yuh-Chin, T. Huang (2012-10-28). A clinical guide to occupational and environmental lung diseases. [New York]: Humana Press. p. 266. ISBN 978-1-62703-149-3.
- ↑ "Pink Puffer - definition of Pink Puffer in the Medical dictionary - by the Free Online Medical Dictionary, Thesaurus and Encyclopedia". Medical-dictionary.thefreedictionary.com. สืบค้นเมื่อ 2013-07-23.
- ↑ 130.0 130.1 130.2 Weinberger, Steven E. (2013-05-08). Principles of pulmonary medicine (6th ed.). Philadelphia: Elsevier/Saunders. p. 165. ISBN 978-1-62703-149-3.
- ↑ Des Jardins, Terry (2013). Clinical Manifestations & Assessment of Respiratory Disease (6th ed.). Elsevier Health Sciences. p. 176. ISBN 978-0-323-27749-5.
- ↑ An outcomes strategy for people with chronic obstructive pulmonary disease (COPD) and asthma in England (PDF). Department of Health. 18 July 2011. p. 5. สืบค้นเมื่อ 27 November 2013.
- ↑ Bloom, D (2011). The Global Economic Burden of Noncommunicable Diseases (PDF). World Economic Forum. p. 24.
- ↑ Nici, Linda (2011). Chronic Obstructive Pulmonary Disease: Co-Morbidities and Systemic Consequences. Springer. p. 78. ISBN 978-1-60761-673-3.
- ↑ Inamdar, AC; Inamdar, AA (Oct 2013). "Mesenchymal stem cell therapy in lung disorders: pathogenesis of lung diseases and mechanism of action of mesenchymal stem cell". Experimental lung research. 39 (8): 315–27. doi:10.3109/01902148.2013.816803. PMID 23992090.
- ↑ Conese, M; Piro, D; Carbone, A; Castellani, S; Di Gioia, S (2014). "Hematopoietic and mesenchymal stem cells for the treatment of chronic respiratory diseases: role of plasticity and heterogeneity". TheScientificWorldJournal. 2014: 859817. doi:10.1155/2014/859817. PMC 3916026. PMID 24563632.
- ↑ Akers, R. Michael; Denbow, D. Michael (2008). Anatomy and Physiology of Domestic Animals. Arnes, AI: Wiley. p. 852. ISBN 978-1-118-70115-7.
- ↑ Wright, JL; Churg, A (December 2002). "Animal models of cigarette smoke-induced COPD". Chest. 122 (6 Suppl): 301S–6S. doi:10.1378/chest.122.6_suppl.301S. PMID 12475805.
- ↑ Churg, A; Wright, JL (2007). "Animal models of cigarette smoke-induced chronic obstructive lung disease". Contributions to microbiology. Contributions to Microbiology. 14: 113–25. doi:10.1159/000107058. ISBN 3-8055-8332-X. PMID 17684336.
- ↑ Marinkovic D, Aleksic-Kovacevic S, Plamenac P (2007). "Cellular basis of chronic obstructive pulmonary disease in horses". Int. Rev. Cytol. International Review of Cytology. 257: 213–47. doi:10.1016/S0074-7696(07)57006-3. ISBN 978-0-12-373701-4. PMID 17280899.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Miller MS, Tilley LP, Smith FW (January 1989). "Cardiopulmonary disease in the geriatric dog and cat". Vet. Clin. North Am. Small Anim. Pract. 19 (1): 87–102. PMID 2646821.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
แหล่งข้อมูลอื่น
[แก้]- "Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Updated 2013" (PDF). Global Initiative for Chronic Obstructive Lung Disease. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-10-04. สืบค้นเมื่อ November 29, 2013.
- National Institute for Health and Clinical Excellence. Clinical guideline 101: Chronic Obstructive Pulmonary Disease. London, June 2010.
- Qaseem, Amir; Wilt, TJ; Weinberger, SE; Hanania, NA; Criner, G; Van Der Molen, T; Marciniuk, DD; Denberg, T; Schünemann, H; Wedzicha, W; MacDonald, R; Shekelle, P; American College Of, Physicians; American College of Chest Physicians; American Thoracic, Society; European Respiratory, Society (2011). "Diagnosis and Management of Stable Chronic Obstructive Pulmonary Disease: A Clinical Practice Guideline Update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society". Annals of Internal Medicine. 155 (3): 179–91. doi:10.7326/0003-4819-155-3-201108020-00008. PMID 21810710.
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |