หลอดลมฝอยอักเสบทั่วแบบกระจาย
| หลอดลมฝอยอักเสบทั่วแบบกระจาย (Diffuse panbronchiolitis) | |
|---|---|
| ชื่ออื่น | หลอดลมฝอยอักเสบ |
 | |
| ภาพเอกซเรย์คอมพิวเตอร์ความละเอียดสูงของทรวงอกของผู้ป่วยชายอายุ 16 ปี ที่ป่วยเป็นหลอดลมฝอยอักเสบทั่วแบบแพร่กระจาย | |
| สาขาวิชา | วิทยาปอด |
| อาการ | โพรงอากาศอักเสบเรื้อรัง, หายใจมีเสียงหวีด, เสียงเปรี๊ยะ, ไอมีเสมหะมาก, หายใจลำบาก |
| ภาวะแทรกซ้อน | หลอดลมโป่งพอง, การหายใจล้มเหลว, ความดันเลือดแดงในปอดสูง, โรคหัวใจจากความดันเลือดในปอดสูง |
| การตั้งต้น | อายุประมาณ 40 ปี |
| ระยะดำเนินโรค | เรื้อรังและกลับเป็นซ้ำได้ |
| สาเหตุ | ไม่ทราบสาเหตุ |
| วิธีวินิจฉัย | การตรวจชิ้นเนื้อปอด, การเอกซเรย์คอมพิวเตอร์ความละเอียดสูง |
| โรคอื่นที่คล้ายกัน | โรคหืด, หลอดลมอักเสบเรื้อรัง, ถุงลมโป่งพอง, ซิสติกไฟโบรซิส, หลอดลมฝอยอักเสบอุดกั้น |
| การรักษา | ยาปฏิชีวนะ, รักษาตามอาการ (ยังไม่มีวิธีรักษาให้หายขาด) |
| ยา | อีริโทรมัยซิน, คลาริโทรมัยซิน, รอกซิโทรมัยซิน |
| พยากรณ์โรค | อัตรารอดชีวิตห้าปี 62.1%, สามารถกลับเป็นซ้ำได้ |
| ความชุก | พบบ่อยในประเทศญี่ปุ่น (11 ต่อ 100,000 ประชากร) |
หลอดลมฝอยอักเสบทั่วแบบกระจาย (อังกฤษ: diffuse panbronchiolitis) หรือ DPB เป็นโรคของปอดชนิดหนึ่งที่ยังไม่ทราบสาเหตุ โดยหลอดลมฝอยของผู้ป่วยจะมีการอักเสบที่รุนแรงและเป็นมากขึ้นเรื่อย ๆ โดยคำว่า "กระจาย" (diffuse) ในที่นี้ หมายถึงการที่ผู้ป่วยจะมีรอยโรคเกิดขึ้นทั่วทั้งบริเวณของปอดทั้งสองข้าง และ "อักเสบทั่ว" (pan) ในที่นี้ หมายถึงเกิดการอักเสบที่ทุกชั้นของหลอดลมฝอย โรคนี้สามารถทำให้เกิดการอักเสบรุนแรงและมีรอยโรคเป็นปุ่มที่หลอดลมฝอยส่วนปลาย เกิดโพรงอากาศอักเสบเรื้อรัง และไอมีเสมหะมากได้
สาเหตุของโรคเชื่อว่าสัมพันธ์กับการที่ร่างกายของผู้ป่วยมีความไวหรือขาดภูมิต้านทานต่อการติดเชื้อแบคทีเรียหรือเชื้อไวรัสที่กระตุ้นให้เกิด DPB จากความผิดปกติทางพันธุกรรมที่พบได้บ่อยในเชื้อชาติเอเชียตะวันออก โดยโรคนี้พบมากที่สุดในคนญี่ปุ่น รองลงมาคือคนเกาหลี ภาวะนี้พบได้ในผู้ชายบ่อยกว่าในผู้หญิง ผู้ป่วยมักเริ่มแสดงอาการที่อายุประมาณ 40 ปี เป็นโรคใหม่ที่เพิ่งเป็นที่รู้จักในช่วงคริสต์ทศวรรษ 1960 และได้รับการตั้งชื่ออย่างเป็นทางการเมื่อ ค.ศ. 1969
หากไม่ได้รับการรักษาอาจมีการดำเนินโรคไปจนเกิดหลอดลมโป่งพองได้ ภาวะนี้จะทำให้หลอดลมและหลอดลมฝอยของผู้ป่วยเสียหายอย่างถาวรและขยายขนาดขึ้น เกิดมีเมือกเสมหะขังอยู่ในหลอดลมฝอยได้ การรักษาด้วยยาปฏิชีวนะในกลุ่มแมโครไลด์อย่างอีริโทรมัยซินทุกวันอย่างต่อเนื่องสามารถบรรเทาอาการและเพิ่มระยะเวลารอดชีวิตได้ แต่ยังไม่มีวิธีรักษาให้หายขาด ในระยะสุดท้ายผู้ป่วยโรคนี้อาจมีการหายใจล้มเหลวและโรคหัวใจได้
การจำแนกประเภท
[แก้]หลอดลมฝอยอักเสบโดยทั่วไปแล้วจะหมายถึงภาวะที่มีการอักเสบเกิดขึ้นที่หลอดลมฝอย[1] โดย DPB ถือเป็นหลอดลมฝอยอักเสบชนิดหนึ่ง และจัดเป็นหลอดลมฝอยอักเสบแบบปฐมภูมิ (primary) หมายความว่าสาเหตุที่ทำให้เกิดหลอดลมฝอยอักเสบนั้นเกิดขึ้นจากตัวหลอดลมฝอยเอง หรือเป็นอยู่เฉพาะที่หลอดลมฝอยเป็นหลัก[2][3] โรคหลอดลมฝอยอักเสบปฐมภูมิชนิดอื่น ๆ เช่น หลอดลมฝอยอักเสบอุดกั้น หลอดลมฝอยอักเสบฟอลลิคูลาร์ หลอดลมฝอยอักเสบจากการหายใจ หลอดลมฝอยอักเสบจากฝุ่นแร่ และอื่น ๆ[2] ส่วนโรคหลอดลมฝอยอักเสบที่ไม่ถือเป็นหลอดลมฝอยอักเสบปฐมภูมิอื่นก็คือโรคหลอดลมฝอยอักเสบที่มีโรคเกิดขึ้นที่ทางหายใจขนาดใหญ่ร่วมด้วย เช่น หลอดลมอักเสบเรื้อรัง เป็นต้น[2][3]
อาการและอาการแสดง
[แก้]อาการของผู้ป่วย DPB ได้แก่ โพรงอากาศอักเสบเรื้อรัง หายใจมีเสียงหวีด หายใจมีเสียงเปรี๊ยะ (crackles) จากเสมหะในปอด หายใจลำบาก ไอรุนแรงและมีเสมหะปริมาณมาก อาจพบหนองในเสมหะ โดยอาจพบร่วมกับอาการไข้ อาการแสดงของ DPB ได้แก่ การโป่งพองของหลอดลมฝอย และออกซิเจนในเลือดต่ำ หากไม่ได้รับการรักษาอาจเกิดหลอดลมโป่งพองตามมาได้ ผู้ป่วยจะมีการโป่งพองและหนาตัวของหลอดลมและหลอดลมฝอย เกิดการอักเสบและความเสียหายต่อหลอดลมฝอยทั้งส่วนทางหายใจและส่วนปลาย และมีเสมหะคั่งค้างในปอด[4][5] นอกจากนี้แล้ว DPB ยังสัมพันธ์กับการเกิดการหายใจล้มเหลวที่เป็นมากขึ้นเรื่อย ๆ คาร์บอนไดออกไซด์คั่งในเลือด และอาจนำไปสู่ภาวะความดันเลือดในปอดสูง และเกิดภาวะหัวใจวายจากโรคปอดได้[6][7]
สาเหตุ
[แก้]
DPB เป็นโรคที่ยังไม่ทราบสาเหตุ กล่าวคือ ยังไม่พบกลไกทางสรีรวิทยา ปัจจัยทางสิ่งแวดล้อม หรือเชื้อก่อโรคที่ทำให้เกิดโรคนี้ อย่างไรก็ดี มีปัจจัยหลายอย่างที่พบว่าน่าจะมีความสัมพันธ์กับพยาธิกำเนิดของโรคนี้[4]
ในสายพันธุกรรมของมนุษย์จะมีส่วนหนึ่งของสายพันธุกรรมที่เรียกว่า MHC ซึ่งนอกจากจะพบได้ในมนุษย์แล้วยังพบในสัตว์มีกระดูกสันหลังอีกหลายชนิด บริเวณนี้ทำหน้าที่เกี่ยวกับภูมิคุ้มกัน โดยในมนุษย์จะพบอยู่บนโครโมโซมคู่ที่ 6 หน่วยย่อยของ MHC ที่เรียกว่า HLA ทำหน้าที่ควบคุมระบบนำเสนอแอนติเจนต่อเซลล์ภูมิคุ้มกัน ซึ่งเป็นกลไกส่วนหนึ่งของระบบภูมิคุ้มกันแบบปรับตัวเพื่อป้องกันร่างกายจากเชื้อไวรัสและเชื้อแบคทีเรีย เมื่อเซลล์ถูกรุกรานโดยเชื้อก่อโรคเหล่านี้ บางเซลล์จะสามารถนำชิ้นส่วนโปรตีนของเชื้อก่อโรคไปนำเสนอไว้บนผิวเซลล์ เรียกว่า การนำเสนอแอนติเจน เซลล์ที่ติดเชื้อนี้จะแสดงตัวเป็นเป้าหมายของเซลล์ทีคิลเลอร์ ซึ่งจะทำลายเซลล์ที่ติดเชื้อเพื่อกำจัดเชื้อออกจากร่างกาย[8]
ความผิดปกติทางพันธุกรรมที่สร้างความเสี่ยงในการเกิด DPB ถูกค้นพบว่าเป็นแฮโพลไทป์ ของ HLA สองแฮโพลไทป์ด้วยกัน ซึ่งสองแฮโพลไทป์นี้พบได้บ่อยในคนเชื้อสายเอเชียตะวันออก ได้แก่ HLA-B54 ซึ่งสัมพันธ์กับการเกิด DPB ในชาวญี่ปุ่น และ HLA-A11 ซึ่งสัมพันธ์กับการเกิด DPB ในชาวเกาหลี[9] สารพันธุกรรมหลายตัวของ HLA class มีส่วนเกี่ยวข้องกับ DPB โดยทำให้มีความเสี่ยงในการเกิดโรคเพิ่มขึ้น[7][10] การค้นหาสารพันธุกรรม DPB ใน HLA ที่มีพันธุกรรมคล้ายคลึงกันในผู้ป่วยชาวเกาหลีและชาวญี่ปุ่น พบว่าการกลายพันธุ์ของยีนที่คาดว่าสร้างความเสี่ยงในการเกิดโรคอยู่ระหว่าง HLA-B[11] และ HLA-A[12] เกิดขึ้นบนโครโมโซมที่มีทั้ง HLA-B54 และ HLA-A11 นอกจากนี้การรวมกันใหม่ของยีนจำนวนมากรอบ ๆ ตำแหน่งของโรค อาจส่งผลให้เกิดโรคที่เกี่ยวข้องกับ HLA-B54 และ HLA-A11 ขึ้นได้ จากการศึกษาเพิ่มเติม สรุปได้ว่ายีนที่สร้างความเสี่ยงในการเกิด DPB มีตำแหน่งใกล้กับตำแหน่งของ HLA-B บนโครโมโซมคู่ที่ 6 (6p21.3) ภายในบริเวณนี้ยังมีการค้นหาสาเหตุทางพันธุกรรมของโรคนี้ต่อไป[9][10]
เนื่องจากยีนจำนวนมากที่เกี่ยวข้องกับ HLA ยังคงไม่สามารถระบุได้ การโคลนตำแหน่ง (วิธีการที่ใช้ในการระบุยีน เมื่อทราบตำแหน่งบนโครโมโซม) จึงถูกนำมาใช้เพื่อระบุว่ายีนที่คล้ายมิวซิน มีความเกี่ยวข้องกับ DPB มีการตรวจสอบโรคที่เกิดจากยีน HLA ที่เสี่ยงต่อ DPB พบว่ากลุ่มอาการของโรคลิมโฟไซต์เปลือย I (BLS I) มีความคล้ายกับ DPB รวมถึงไซนัสอักเสบเรื้อรัง หลอดลมอักเสบและการมีอยู่ของ H. influenzae เช่นเดียวกับ DPB BLS I ตอบสนองได้ดีเมื่อได้รับการรักษาด้วยอีริโทรมัยซิน เนื่องจากโรคทั้งสอง (DPB และ BLS I) มีความคล้ายคลึงกัน จึงใช้วิธีรักษาแบบเดียวกันได้ และพบว่ายีนที่เกี่ยวข้องกับ BLS I อยู่ในบริเวณที่ก่อให้เกิด DPB ของ HLA ทำให้ยีนที่เกี่ยวข้องกับ DPB แคบลง[9] ปัจจัยด้านสิ่งแวดล้อม เช่น การสูดดมควันพิษและการสูบบุหรี่ ไม่ถูกเชื่อว่ามีผลต่อการเกิด DPB และปัจจัยอื่น ๆ ที่ไม่ใช่ทางพันธุกรรม เช่น แบคทีเรียหรือไวรัส ยังคงไม่ถูกตัดออกจากการตั้งข้อสังเกต[4][6][7]
ซิสติกไฟโบรซิส (CF) ซึ่งเป็นโรคปอดที่ส่งผลต่อระบบอื่น ๆ ด้วย ถูกตั้งข้อสังเกตว่าเป็นสาเหตุทางพันธุกรรมของ DPB ด้วยเหตุผลหลายประการ เนื่องจากอาการของโรค CF คล้ายกันกับ DPB เช่น ทำให้เกิดการอักเสบของปอดอย่างรุนแรง การผลิตเมือกออกมามาก การติดเชื้อ และมีความเด่นทางพันธุกรรมในกลุ่มคนผิวขาว ในขณะที่ DPB พบในหมู่ชาวเอเชียตะวันออก CF ส่งผลกระทบต่อผู้คนเชื้อสายยุโรปเป็นส่วนใหญ่ แม้ว่าจะไม่มียีนใดที่เกี่ยวข้องกับเป็นสาเหตุของ DPB แต่การกลายพันธุ์ในยีนเฉพาะ ซึ่งทำให้เกิด CF มีแนวโน้มที่จะเกิดขึ้นในชาวยุโรปมากกว่า การกลายพันธุ์ในยีนที่ก่อให้เกิด CF ไม่ใช่ปัจจัยใน DPB แต่การกลายพันธุ์ที่มีลักษณะเฉพาะในยีนนี้เกิดขึ้นในชาวเอเชียจำนวนมาก โดยไม่จำเป็นต้องได้รับผลกระทบจากโรคใดโรคหนึ่ง ซึ่งอยู่ระหว่างการตรวจสอบว่าการกลายพันธุ์ใด ๆ ของยีนนี้ส่งผลต่อ DPB ได้หรือไม่[4][9]
พยาธิสรีรวิทยา
[แก้]การอักเสบเป็นกลไกปกติของระบบภูมิคุ้มกัน โดยทำให้เกิดการสะสมของเม็ดเลือดขาวชนิดต่าง ๆ เช่น นิวโทรฟิล และสารคีโมไคน์ (สารโปรตีนที่หลั่งจากเซลล์บางชนิดเพื่อกระตุ้นการตอบสนองบางประการของเซลล์อื่น) ในบริเวณใด ๆ ของร่างกายที่เกิดการติดเชื้อแบคทีเรียหรือการติดเชื้อไวรัส การอักเสบจะขัดขวางกิจกรรมของแบคทีเรียและไวรัส และช่วยในการกำจัดเชื้อก่อโรคเหล่านี้ให้หมดไปจากร่างกาย ในผู้ป่วย DPB อาจมีการติดเชื้อแบคทีเรีย เช่น Haemophilus influenzae หรือ Pseudomonas aeruginosa ทำให้เกิดการเพิ่มจำนวนของเซลล์อักเสบในเนื้อเยื่อหลอดลมฝอย แต่เมื่อแบคทีเรียเหล่านี้ไม่มีอยู่แล้ว การอักเสบกลับยังคงดำเนินต่อไปเรื่อย ๆ โดยไม่ทราบสาเหตุ[4][5] การอักเสบใน DPB อาจรุนแรงถึงขนาดที่ปุ่ม (nodule) ที่มีเซลล์อักเสบก่อตัวขึ้นในผนังของหลอดลม[4][13] การที่มีการอักเสบและการติดเชื้อในระบบทางเดินหายใจยังส่งผลให้เกิดการผลิตเมือกส่วนเกิน ซึ่งทำให้มีการไอแบบมีเสมหะ[4][6] ใน DPB การอักเสบ การแพร่กระจายของก้อนเนื้อ การติดเชื้อ เมือก และอาการไอบ่อย ๆ ทำให้เกิดอาการหายใจลำบาก[4][5]
ความจริงที่ว่าการอักเสบใน DPB ขึ้นอยู่กับการมีอยู่ของ P. aeruginosa และ H. influenzae หรือไม่ ก่อให้เกิดการตรวจสอบกลไกต่าง ๆ ของการเกิดโรค DPB[5] ลิวโคไตรอีน เป็นเอโคซานอยด์ ซึ่งเป็นโมเลกุลส่งสัญญาณที่สร้างขึ้นมาจากกรดไขมันจำเป็น มีผลในโรคปอดหลายชนิด โดยทำให้เกิดการแพร่กระจายของเซลล์อักเสบและการผลิตเมือกส่วนเกินในทางเดินหายใจ[14] สารตัวกลางที่เด่นชัดของการอักเสบที่เกี่ยวข้องกับนิวโทรฟิล คือ leukotriene B4 ซึ่งมีความเชี่ยวชาญในการเพิ่มจำนวนนิวโทรฟิลผ่านปฏิกิริยาชักนำทางเคมี (การเคลื่อนที่ของเซลล์บางชนิดเข้าหรือออกจากอีกเซลล์)[4][9]
การอักเสบใน DPB ยังเกิดจากคีโมไคน์ MIP-1alpha และเกี่ยวข้องกับเซลล์ที CD8+ เบต้าดีเฟนซิน ซึ่งเป็นกลุ่มของเปปไทด์ต้านจุลชีพที่พบในทางเดินหายใจ ทำให้เกิดการอักเสบเพิ่มเติมใน DPB เมื่อมีเชื้อโรค เช่น P. aeruginosa ใน DPB หากมีไวรัส T-cell lymphotropic ชนิดที่ 1 ของมนุษย์ (เชื้อรีโทรไวรัส) การเกิดโรค DPB จะเปลี่ยนไปเป็นการติดเชื้อที่เซลล์ทีเฮลเปอร์และเปลี่ยนแปลงประสิทธิภาพในการรับรู้ถึงเชื้อโรคที่เกี่ยวข้องกับ DPB[4][9]
การวินิจฉัย
[แก้]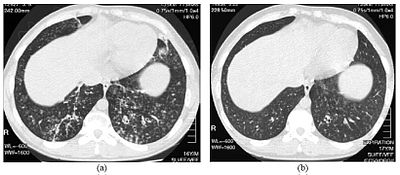
การวินิจฉัย DPB จำเป็นต้องมีการวิเคราะห์เนื้อเยื่อปอดและหลอดลมฝอย ซึ่งจะทำได้ด้วยการตัดชิ้นเนื้อปอดออกตรวจ หรือการทำเอกซเรย์คอมพิวเตอร์ความละเอียดสูง (HRCT) ของปอด[7] เกณฑ์การวินิจฉัย DPB คือต้องพบการอักเสบรุนแรงในทุกชั้นของหลอดลมฝอยส่วนทางหายใจ และมีรอยโรคในเนื้อปอดซึ่งปรากฏเป็นปุ่ม (nodule) ในหลอดลมฝอยส่วนปลายและส่วนทางหายใจของปอดทั้งสองข้าง[4] ปุ่มดังกล่าวจะปรากฏเป็นก้อนทึบแสงเมื่อดูจากภาพถ่ายรังสีและอาจทำให้เกิดภาวะอุดกั้นทางเดินหายใจได้เมื่อประเมินด้วยการทดสอบการทำงานของปอด (PFT)[6]
ผลตรวจภาพถ่ายรังสีของปอดยังอาจแสดงให้เห็นถึงการขยายของหลอดลม ซึ่งเป็นอาการแสดงอีกอย่างหนึ่งของ DPB ในขณะที่ภาพสแกน HRCT มักแสดงให้เห็นความผิดปกติแบบ tree-in-bud ซึ่งเกิดจากการอุดตันของเมือกในหลอดลม[7]
ภาวะพร่องออกซิเจนในเลือดซึ่งเป็นอาการแสดงอย่างหนึ่งของการหายใจลำบากจะสามารถบอกได้จากปริมาณออกซิเจนและคาร์บอนไดออกไซด์ในเลือด โดยใช้การตรวจเลือดที่เรียกว่าการตรวจก๊าซจากหลอดเลือดแดง
ผลตรวจอย่างอื่นที่พบได้ในผู้ป่วย DPB ได้แก่ การเพิ่มจำนวนของเม็ดเลือดขาวชนิดลิมโฟไซต์ นิวโทรฟิล และโฟมีฮิสติโอไซต์ (แมโครฟาจที่อยู่ในเนื้อเยื่อ) ที่ผิวเยื่อบุในปอด โดยสามารถตรวจพบจำนวนเม็ดเลือดขาวที่เพิ่มขึ้นได้จากการตรวจเลือดเพื่อนับจำนวนเม็ดเลือด (CBC) อาจตรวจพบเชื้อแบคทีเรีย H. influenzae หรือ P. aeruginosa ได้ โดยเมื่อโรคดำเนินไปมากขึ้นเชื้อที่พบมักจะเป็น P. aeruginosa มากกว่า[4][5] อาจตรวจพบว่ามีระดับของอิมมูโนกลอบูลินจี อิมมูโนกลอบูลินเอ (สารภูมิต้านทานอิมมูโนกลอบูลินบางชนิด) และรูมาตอยด์แฟกเตอร์ (สารบ่งชี้ภาวะภูมิต้านตนเองชนิดหนึ่ง) เพิ่มสูงขึ้นได้ อาจตรวจพบเม็ดเลือดแดงจับตัวเป็นกลุ่ม (hemagglutination) ไวกว่าปกติจากปฏิกิริยาภูมิคุ้มกันได้
การตรวจด้วยการสวนล้างหลอดลมและถุงลม (bronchoalveolar lavage) สามารถตรวจพบเม็ดเลือดขาว เบต้าดีเฟนซิน ลิวโครไทรอีน และคีโมไคน์ได้เช่นกัน[4][9]
การวินิจฉัยแยกโรค
[แก้]ในการวินิจฉัยแยกโรค (differential diagnosis; การค้นหาการวินิจฉัยที่ถูกต้องระหว่างโรคที่มีลักษณะทับซ้อนกัน) ของโรคปอดอุดกั้นบางชนิด อาการของ DPB หลายประการมีความคล้ายคลึงกับอาการที่พบในโรคปอดอุดกั้นอื่น ๆ เช่น โรคหอบหืด หลอดลมอักเสบเรื้อรัง และถุงลมโป่งพอง อาการหายใจมีเสียงหวีด ไอมีเสมหะ และหายใจถี่เป็นอาการที่พบบ่อยในโรคดังกล่าว และพบความผิดปกติของระบบทางเดินหายใจอุดกั้นในการทดสอบการทำงานของปอด[6] ซิสติกไฟโบรซิสมีอาการของโรคคล้ายกันกับ DPB ทำให้เกิดการอักเสบของปอดอย่างรุนแรง การผลิตเมือกออกมามาก การติดเชื้อ แต่ DPB ไม่รบกวนการทำงานของตับอ่อนหรืออิเล็กโทรไลต์ ในขณะที่ CF ส่งผลต่อการทำงาน ดังนั้นโรคทั้งสองจึงแตกต่างกันและอาจไม่เกี่ยวข้องกัน[4][9] โดยที่ DPB มีรอยโรคที่ปรากฏบนภาพถ่ายรังสีเป็นปุ่มในหลอดลมของปอดทั้งสอง มีการอักเสบในเนื้อเยื่อทุกชั้นของหลอดลมทางเดินหายใจ และมีความชุกที่สูงขึ้นในหมู่ชาวเอเชียตะวันออก[4]
DPB และหลอดลมฝอยอักเสบอุดกั้น (OB) เป็นสองรูปแบบหลักของหลอดลมอักเสบ[2] อาการของโรคที่ทับซ้อนกัน ได้แก่ อาการไอรุนแรงและมีเสมหะจำนวนมาก ก้อนที่ปรากฏให้เห็นในภาพถ่ายรังสีบริเวณหลอดลม และไซนัสอักเสบเรื้อรัง ใน DPB ปุ่มส่วนใหญ่จะกำจัดอยู่ในบริเวณหลอดลมทางเดินหายใจ ในขณะที่ OB มักพบในเยื่อหุ้มหลอดลม (ตั้งแต่ส่วนที่ไม่ใช่กระดูกอ่อนจนถึงหลอดลมตติยภูมิ) ไปจนถึงหลอดลมทุติยภูมิ OB เป็นโรคเกี่ยวกับหลอดลมที่มีความชุกทั่วโลก ในขณะที่ DPB มีความชุกเฉพาะที่มากกว่า โดยส่วนใหญ่พบในประเทศญี่ปุ่น[2][6] ในช่วงไม่กี่ปีที่ผ่านมา ก่อนที่จะมีการรับรู้ถึงอาการของโรค DPB มักได้รับการวินิจฉัยผิดพลาดว่าเป็นโรคหลอดลมโป่งพอง โรคปอดอุดกั้นเรื้อรัง โรคปอดเป็นพังผืดไม่ทราบสาเหตุ (IPF) วัณโรคปอดชนิดแพร่กระจาย โรคซาร์คอยด์ หรือโรคมะเร็งปอด[15]
การรักษา
[แก้]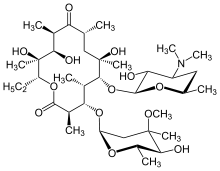
ยาปฏิชีวนะในกลุ่มแมโครไลด์ เช่น อีริโทรมัยซิน สามารถใช้รักษา DPB ได้ โดยต้องใช้ยาเป็นระยะเวลานานอย่างต่อเนื่อง[16][17][18] ยาอื่นที่ใช้บ่อย ได้แก่ คลาริโทรมัยซิน หรือ รอกซิโทรมัยซิน[19] ผลลัพธ์ที่ประสบความสำเร็จของการใช้แมโครไลด์ใน DPB และโรคปอดที่คล้ายคลึงกันนั้นเกิดจากการจัดการอาการบางอย่างผ่านการปรับการตอบสนองของภูมิคุ้มกัน[17] ซึ่งสามารถทำได้โดยการใช้ยาปฏิชีวนะในปริมาณต่ำ การรักษาด้วยอีริโทรมัยซิน[7]เป็นเวลา 2–3 ปี สามารถรักษาผลกระทบจากโรค DPB ได้อย่างมาก มีการตรวจนับนิวโทรฟิวในของเหลว BAL และการตรวจก๊าซจากหลอดเลือดแดงของผู้ป่วย DPB ที่ได้รับการรักษาตามมาตรฐาน พบว่านิวโทรฟิลและค่าออกซิเจนในเลือดอยู่ในเกณฑ์ปกติ[16][17][20] ในกรณีของผู้ป่วยเหล่านี้ได้รับการเสนอให้เว้นระยะชั่วคราวจากการรักษาด้วยอีริโทรมัยซิน เพื่อลดการก่อตัวของ P. aeruginosa ที่ดื้อต่อแมโครไลด์[16] อย่างไรก็ตาม อาการของโรค DPB มักกลับมาอีกครั้ง และกลับมาเริ่มการรักษาใหม่ แม้ว่าจะมีประสิทธิภาพสูง แต่อีริโทรมัยซินอาจไม่ประสบผลสำเร็จในผู้ป่วยทุกรายที่เป็นโรคนี้ โดยเฉพาะอย่างยิ่งถ้าหากมี P. aeruginosa ที่ดื้อต่อแมโครไลด์ หรือไม่ได้รับการรักษาก่อนหน้านี้และมีการแพร่กระจายจนทำให้ระบบทางเดินหายใจล้มเหลว[17][20]
การรักษาด้วยอีริโทรมัยซินใน DPB ทำให้การอักเสบและความเสียหายของหลอดลมลดลงอย่างมาก ไม่เพียงแต่ยับยั้งการเพิ่มจำนวนนิวโทรฟิลเท่านั้น แต่ยังลดกิจกรรมของลิมโฟไซต์ ลดการอุดกั้นของเมือก และลดการหลั่งสารคัดหลั่งในทางเดินหายใจ[16] ผลของยาปฏิชีวนะอื่นในกลุ่มแมคโครไลด์ไม่เกี่ยวข้องต่อการลดการอักเสบใน DPB[20] เนื่องจากปริมาณการรักษาต่ำเกินไปที่จะจัดการกับการติดเชื้อในกรณี DPB ที่มี P. aeruginosa ที่ดื้อต่อแมโครไลด์ แต่การรักษาด้วยอีริโทรมัยซินยังคงช่วยลดการอักเสบได้[16]
มีหลายปัจจัยที่เกี่ยวข้องกับการยับยั้งการอักเสบโดยอีริโทรมัยซินและแมคโครไลด์อื่น ๆ ซึ่งมีประสิทธิภาพในการยับยั้งการแพร่กระจายของนิวโทรฟิล โดยลดความสามารถของอินเตอร์ลิวคิน 8 และ leukotriene B4 ในการดึงดูดนิวโทรฟิล[21] แมคโครไลด์ยังลดประสิทธิภาพของโมเลกุลการยึดเกาะที่ทำให้นิวโทรฟิลเกาะติดกับเยื่อบุเนื้อเยื่อหลอดลม การผลิตเมือกในทางเดินหายใจเป็นตัวการสำคัญที่ก่อให้เกิดอาการเจ็บป่วยและการเสียชีวิตด้วยโรค DPB และโรคทางเดินหายใจอื่น ๆ การลดลงอย่างมีนัยสำคัญของการอักเสบใน DPB ที่เกิดจากการบำบัดด้วยอีริโทรมัยซินยังช่วยยับยั้งการผลิตเมือกส่วนเกินด้วย[21]
พยากรณ์โรค
[แก้]ผู้ป่วย DPB หากไม่ได้รับการรักษา จะมีอาการทรุดลงจนเกิดหลอดลมโป่งพอง การหายใจล้มเหลว และเสียชีวิตได้ รายงานจากวารสารปี ค.ศ. 1983 ระบุว่าผู้ป่วย DPB ที่ไม่ได้รับการรักษามีอัตราการรอดชีวิต 5 ปีอยู่ที่ 62.1% ในขณะที่อัตราการรอดชีวิต 10 ปีอยู่ที่ 33.2%[6] การรักษาด้วยอิริโทรมัยซินทำให้ผู้ป่วยมีอายุขัยเพิ่มขึ้น เนื่องจากทำให้จัดการกับอาการได้ดีขึ้น การลุกลามช้าลง และป้องกันการติดเชื้อที่เกี่ยวข้อง เช่น P. aeruginosa[20] อัตราการรักษาผู้ป่วย DPB ที่มีชีวิตรอด 10 ปีอยู่ที่ประมาณ 90%[4] ในกรณีที่การรักษาส่งผลดีขึ้นอย่างมีนัยสำคัญ ผู้ป่วย DPB จะได้รับการอนุญาตให้หยุดการรักษาได้ ซึ่งบางครั้งเกิดหลังจากผ่านไปประมาณสองปี อย่างไรก็ตามผู้ป่วยที่ได้รับอนุญาตให้หยุดการรักษาจะได้รับการดูแลอย่างใกล้ชิด เนื่องจาก DPB ได้รับการพิสูจน์แล้วว่าสามารถเกิดขึ้นซ้ำได้อีก ต้องกลับมารักษาด้วยอิริโทรมัยซินทันทีเมื่ออาการของโรคปรากฏขึ้นอีกครั้ง แม้ว่าอาการของโรคจะดีขึ้นทันทีที่ได้รับการรักษา แต่ในปัจจุบัน DPB ยังไม่มีวิธีรักษาให้หายขาดได้[4][9]
วิทยาการระบาด
[แก้]DPB พบได้บ่อยที่สุดในคนญี่ปุ่น คือมีความชุกอยู่ที่ 11 ต่อ 100,000 ประชากร[4] นอกจากนี้ยังมีรายงานการพบผู้ป่วยโรคในคนเชื้อชาติอื่น ๆ เช่น เกาหลี[22] จีน[23] และไทย[24] มีการตั้งข้อสังเกตว่าเป็นความบกพร่องจากกรรมพันธุ์ในหมู่ชาวเอเชียตะวันออก โรคนี้พบมากในเพศชาย[25] โดยมีอัตราส่วนเพศชายต่อเพศหญิงอยู่ที่ 1.4–2.1 (ประมาณเพศชาย 5 คนต่อเพศหญิง 3 คน)[4] โดยเฉลี่ยอาการของโรคเริ่มแสดงเมื่ออายุราว ๆ 40 ปี และสองในสามของผู้ป่วยไม่ได้สูบบุหรี่ อย่างไรก็ตามการสูบบุหรี่ไม่ได้ถูกเชื่อว่าเป็นสาเหตุของโรคนี้[7] การมี HLA-Bw54 (แอนติเจน BW54 ในเม็ดเลือดขาว) เพิ่มความเสี่ยงของ DPB ถึง 13.3 เท่า[26]
ในฝั่งทวีปยุโรปและทวีปอเมริกามีจำนวนผู้ป่วย DPB ค่อนข้างน้อยซึ่งเป็นผู้อพยพและผู้อยู่อาศัยชาวเอเชีย[27][28][29] ในประเทศแถบตะวันตกมีการวินิจฉัยโรคผิดพลาดเนื่องจากมีการรับรู้โรคนี้น้อยกว่าในประเทศแถบเอเชีย เมื่อเทียบจำนวนชาวเอเชียที่อาศัยอยู่ทางตะวันตกซึ่งมีจำนวนมากกับผู้ป่วย DPB ชาวเอเชียซึ่งมีจำนวนน้อย พบว่าสาเหตุของโรคนี้อาจมาจากสาเหตุอื่นที่ไม่ใช่สาเหตุทางพันธุกรรม และการที่โรคนี้พบได้ยากในชาวเอเชียที่อาศัยอยู่ทางตะวันตกบางส่วนอาจมาจากการที่วินิจฉัยโรคผิดพลาดด้วย[7][30]
ประวัติศาสตร์
[แก้]ในช่วงต้นคริสต์ทศวรรษ 1960 แพทย์ในญี่ปุ่นเริ่มสังเกตพบโรคปอดเรื้อรังชนิดใหม่โรคหนึ่ง ต่อมาในปี ค.ศ. 1969 เริ่มมีการใช้ชื่อ diffuse panbronchiolitis เพื่อระบุถึงโรคนี้แยกต่างหากออกมาจากหลอดลมอักเสบเรื้อรัง ถุงลมโป่งพอง ถุงลมอักเสบ และโรคปอดอุดกั้นโรคอื่น ๆ ที่มีการอักเสบ[31] ในระหว่างปี ค.ศ. 1978 ถึง 1980 กระทรวงสาธารณสุขและสวัสดิการของญี่ปุ่นเปิดเผยว่ามีจำนวนผู้ป่วยที่คาดว่าเป็น DPB มากกว่า 1,000 ราย โดยได้รับการยืนยันทางจุลพยาธิวิทยา 82 ราย ในช่วงคริสต์ทศวรรษที่ 1980 โรคนี้ได้รับการยอมรับในระดับสากลว่าเป็นโรคจำเพาะของปอด[4][6]
ก่อนคริสต์ทศวรรษ 1980 การพยากรณ์โรคของ DPB ไม่ค่อยดี โดยเฉพาะอย่างยิ่งในกรณีที่มีการติดเชื้อสำทับ จาก P. aeruginosa[13] ผู้ป่วย DPB ยังคงมีอัตราการเสียชีวิตที่สูงมากขึ้น ก่อนที่การรักษาด้วยยาปฏิชีวนะทั่วไปและการรักษาด้วยออกซิเจนจะเริ่มใช้เป็นประจำเพื่อรักษาอาการของโรค ราว ๆ ปี ค.ศ. 1985 การพยากรณ์โรคก็ดีขึ้นอย่างมีนัยสำคัญหลังจากที่การรักษาระยะยาวด้วยอิริโทรมัยซินกลายเป็นการรักษาที่ใช้กันทั่วไปเป็นมาตรฐานสำหรับ DPB[20] และในปี ค.ศ. 1990 ได้มีการยืนยันความเกี่ยวข้องระหว่าง DPB กับ HLA[9]
อ้างอิง
[แก้]- ↑ Visscher DW, Myers JL (2006). "Bronchiolitis: the pathologist's perspective". Proceedings of the American Thoracic Society. 3 (1): 41–7. doi:10.1513/pats.200512-124JH. PMID 16493150. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (Free full text)เมื่อ 2010-04-16. สืบค้นเมื่อ 2022-07-19.
- ↑ 2.0 2.1 2.2 2.3 2.4 Ryu JH, Myers JL, Swensen SJ (December 2003). "Bronchiolar disorders". American Journal of Respiratory and Critical Care Medicine. 168 (11): 1277–92. doi:10.1164/rccm.200301-053SO. PMID 14644923. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (Free full text)เมื่อ 2009-12-02. สืบค้นเมื่อ 2022-07-19.
- ↑ 3.0 3.1 Ryu JH (March 2006). "Classification and approach to bronchiolar diseases". Current Opinion in Pulmonary Medicine. 12 (2): 145–51. doi:10.1097/01.mcp.0000208455.80725.2a. PMID 16456385. S2CID 23668839.
- ↑ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.18 4.19 Poletti V, Casoni G, Chilosi M, Zompatori M (October 2006). "Diffuse panbronchiolitis". The European Respiratory Journal. 28 (4): 862–71. doi:10.1183/09031936.06.00131805. PMID 17012632.
- ↑ 5.0 5.1 5.2 5.3 5.4 Yanagihara K, Kadoto J, Kohno S (2001). "Diffuse panbronchiolitis--pathophysiology and treatment mechanisms". International Journal of Antimicrobial Agents. 18 (Suppl 1): S83–7. doi:10.1016/s0924-8579(01)00403-4. PMID 11574201.
- ↑ 6.0 6.1 6.2 6.3 6.4 6.5 6.6 6.7 Homma H, Yamanaka A, Tanimoto S, Tamura M, Chijimatsu Y, Kira S, Izumi T (January 1983). "Diffuse panbronchiolitis. A disease of the transitional zone of the lung". Chest. 83 (1): 63–9. doi:10.1378/chest.83.1.63. PMID 6848335.
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5 7.6 7.7 Anthony M, Singham S, Soans B, Tyler G (October 2009). "Diffuse panbronchiolitis: not just an Asian disease: Australian case series and review of the literature". Biomedical Imaging and Intervention Journal. 5 (4): e19. doi:10.2349/biij.5.4.e19. PMC 3097723. PMID 21610988.
- ↑ Morris AG, Hewitt C, Young S (1994). The major histocompatibility complex: its genes and their roles in antigen presentation. Vol. 15. Pergamon.
- ↑ 9.00 9.01 9.02 9.03 9.04 9.05 9.06 9.07 9.08 9.09 Keicho N, Hijikata M (May 2011). "Genetic predisposition to diffuse panbronchiolitis". Respirology. 16 (4): 581–8. doi:10.1111/j.1440-1843.2011.01946.x. PMID 21303426.
- ↑ 10.0 10.1 Online 'Mendelian Inheritance in Man' (OMIM) Panbronchiolitis, Diffuse -604809 Retrieved 11 November 2011. "Routine treatments include erythromycin, clarithromycin, and roxithromycin. Azithromycin has also been studied and found to be similarly effective, with a minority of patients described as "cured" and a majority reporting reduced symptoms."
- ↑ Online 'Mendelian Inheritance in Man' (OMIM) Human Leukocyte Antigen B -142830 Retrieved 21 September 2011.
- ↑ Online 'Mendelian Inheritance in Man' (OMIM) Human Leukocyte Antigen A -142800 Retrieved 21 September 2011.
- ↑ 13.0 13.1 Azuma A, Kudoh S (May 2006). "Diffuse panbronchiolitis in East Asia". Respirology. 11 (3): 249–61. doi:10.1111/j.1440-1843.2006.00845.x. PMID 16635082. S2CID 24559334.
- ↑ Busse WW (June 1998). "Leukotrienes and inflammation". American Journal of Respiratory and Critical Care Medicine. 157 (6 Pt 1): S210-3. doi:10.1164/ajrccm.157.6.mar-1. PMID 9620941. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (Free full text)เมื่อ 2007-05-10. สืบค้นเมื่อ 2022-07-19.
- ↑ Li H, Zhou Y, Fan F, Zhang Y, Li X, Yu H, และคณะ (August 2011). "Effect of azithromycin on patients with diffuse panbronchiolitis: retrospective study of 51 cases". Internal Medicine. 50 (16): 1663–9. doi:10.2169/internalmedicine.50.4727. PMID 21841323.
- ↑ 16.0 16.1 16.2 16.3 16.4 Kanoh S, Rubin BK (July 2010). "Mechanisms of action and clinical application of macrolides as immunomodulatory medications". Clinical Microbiology Reviews (Free full text). 23 (3): 590–615. doi:10.1128/CMR.00078-09. PMC 2901655. PMID 20610825.
- ↑ 17.0 17.1 17.2 17.3 López-Boado YS, Rubin BK (June 2008). "Macrolides as immunomodulatory medications for the therapy of chronic lung diseases". Current Opinion in Pharmacology. 8 (3): 286–91. doi:10.1016/j.coph.2008.01.010. PMID 18339582.
- ↑ Lin X, Lu J, Yang M, Dong BR, Wu HM (January 2015). "Macrolides for diffuse panbronchiolitis". The Cochrane Database of Systematic Reviews. 1 (1): CD007716. doi:10.1002/14651858.CD007716.pub4. PMC 6464977. PMID 25618845.
- ↑ Keicho N, Kudoh S (2002). "Diffuse panbronchiolitis: role of macrolides in therapy". American Journal of Respiratory Medicine. 1 (2): 119–31. doi:10.1007/BF03256601. PMID 14720066. S2CID 39880028.
- ↑ 20.0 20.1 20.2 20.3 20.4 Schultz MJ (July 2004). "Macrolide activities beyond their antimicrobial effects: macrolides in diffuse panbronchiolitis and cystic fibrosis" (Free full text). The Journal of Antimicrobial Chemotherapy. 54 (1): 21–8. doi:10.1093/jac/dkh309. PMID 15190022.
- ↑ 21.0 21.1 Tamaoki J, Kadota J, Takizawa H (November 2004). "Clinical implications of the immunomodulatory effects of macrolides". The American Journal of Medicine. 117 (9, Supplement 1): 5S–11S. doi:10.1016/j.amjmed.2004.07.023. PMID 15586558.
- ↑ Kim YW, Han SK, Shim YS, Kim KY, Han YC, Seo JW, Im JG (May 1992). "The first report of diffuse panbronchiolitis in Korea: five case reports". Internal Medicine. 31 (5): 695–701. doi:10.2169/internalmedicine.31.695. PMID 1504438.
- ↑ Chen Y, Kang J, Li S (January 2005). "Diffuse panbronchiolitis in China". Respirology. 10 (1): 70–5. doi:10.1111/j.1440-1843.2005.00622.x. PMID 15691241. S2CID 37365518.
- ↑ Chantarotorn S, Palwatwichai A, Vattanathum A, Tantamacharik D (August 1999). "Diffuse panbronchiolitis, the first case reports in Thailand". Journal of the Medical Association of Thailand = Chotmaihet Thangphaet. 82 (8): 833–8. PMID 10511794.
- ↑ Høiby N (June 1994). "Diffuse panbronchiolitis and cystic fibrosis: East meets West". Thorax. 49 (6): 531–2. doi:10.1136/thx.49.6.531. PMC 474936. PMID 8016786.
- ↑ Lazarus SC (2005). Murray and Nadel's Textbook of Respiratory Medicine (4th ed.). WB Saunders. p. 1300. ISBN 978-0-7216-0327-8.
- ↑ Fitzgerald JE, King TE, Lynch DA, Tuder RM, Schwarz MI (August 1996). "Diffuse panbronchiolitis in the United States". American Journal of Respiratory and Critical Care Medicine. 154 (2 Pt 1): 497–503. doi:10.1164/ajrccm.154.2.8756828. PMID 8756828.
- ↑ Martinez JA, Guimarães SM, Ferreira RG, Pereira CA (March 2000). "Diffuse panbronchiolitis in Latin America". The American Journal of the Medical Sciences. 319 (3): 183–5. doi:10.1097/00000441-200003000-00008. PMID 10746829.
- ↑ Sandrini A, Balter MS, Chapman KR (2003). "Diffuse panbronchiolitis in a Caucasian man in Canada". Canadian Respiratory Journal. 10 (8): 449–51. doi:10.1155/2003/786531. PMID 14679410.
- ↑ Brugiere O, Milleron B, Antoine M, Carette MF, Philippe C, Mayaud C (October 1996). "Diffuse panbronchiolitis in an Asian immigrant". Thorax. 51 (10): 1065–7. doi:10.1136/thx.51.10.1065. PMC 472677. PMID 8977613.
- ↑ Yamanaka A, Saiki S, Tamura S, Saito K (March 1969). "[Problems in chronic obstructive bronchial diseases, with special reference to diffuse panbronchiolitis]". Naika. Internal Medicine (ภาษาญี่ปุ่น). 23 (3): 442–51. PMID 5783341.
แหล่งข้อมูลอื่น
[แก้] วิกิมีเดียคอมมอนส์มีสื่อเกี่ยวกับ Diffuse panbronchiolitis
วิกิมีเดียคอมมอนส์มีสื่อเกี่ยวกับ Diffuse panbronchiolitis
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |
