เมแทบอลิซึม
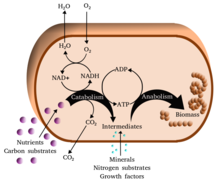
กระบวนการสร้างและสลาย หรือ เมแทบอลิซึม[1] (อังกฤษ: metabolism) มาจากภาษากรีก μεταβολή ("metabolē") มีความหมายว่า "เปลี่ยนแปลง" เป็นกลุ่มปฏิกิริยาเคมีที่เกิดขึ้นในเซลล์สิ่งมีชีวิตเพื่อค้ำจุนชีวิต วัตถุประสงค์หลักสามประการของเมแทบอลิซึม ได้แก่ การเปลี่ยนอาหารและเชื้อเพลิงให้เป็นพลังงานในการดำเนินกระบวนการของเซลล์ การเปลี่ยนอาหารและเชื้อเพลิงเป็นหน่วยย่อยของโปรตีน ลิพิด กรดนิวคลิอิกและคาร์โบไฮเดรตบางชนิด และการขจัดของเสียไนโตรเจน ปฏิกิริยาเหล่านี้มีเอนไซม์เป็นตัวเร่งปฏิกิริยา เพื่อให้สิ่งมีชีวิตเติบโตและเจริญพันธุ์ คงไว้ซึ่งโครงสร้างและตอบสนองต่อสิ่งแวดล้อม "เมแทบอลิซึม" ยังสามารถหมายถึง ผลรวมของปฏิกิริยาเคมีทั้งหมดที่เกิดในสิ่งมีชีวิต รวมทั้งการย่อยและการขนส่งสสารเข้าสู่เซลล์และระหว่างเซลล์ กลุ่มปฏิกิริยาเหล่านี้เรียกว่า เมแทบอลิซึมสารอินเทอร์มีเดียต (intermediary หรือ intermediate metabolism)
โดยปกติ เมแทบอลิซึมแบ่งได้เป็นสองประเภท คือ แคแทบอลิซึม (catabolism) ที่เป็นการสลายสารโมเลกุลขนาดใหญ่เป็นสารโมเลกุลขนาดเล็ก การสลายสารอินทรีย์ ตัวอย่างเช่น การสลายกลูโคสให้เป็นไพรูเวต เพื่อให้ได้พลังงานในการหายใจระดับเซลล์ และแอแนบอลิซึม (anabolism) ที่หมายถึงการสร้างหรือสังเคราะห์สารโมเลกุลขนาดเล็กเป็นสารโมเลกุลขนาดใหญ่ในแมทาบอลิซึม[2] เช่นการสร้างส่วนประกอบของเซลล์ โปรตีนและกรดนิวคลีอิก ทั้งนี้ การเกิดแคแทบอลิซึมส่วนใหญ่มักมีการปลดปล่อยพลังงานออกมา ส่วนการเกิดแอแนบอลิซึมนั้นจะมีการใช้พลังงานเพื่อเกิดปฏิกิริยา
ปฏิกิริยาเคมีของเมแทบอลิซึมถูกจัดอยู่ในวิถีเมแทบอลิซึม (metabolic pathway) ซึ่งสารเคมีชนิดหนึ่ง ๆ จะถูกเปลี่ยนแปลงหลายขั้นตอนจนกลายเป็นสารชนิดอื่น โดยอาศัยการเข้าทำปฏิกิริยาของใช้เอนไซม์หลายชนิด ทั้งนี้ เอนไซม์ชนิดต่าง ๆ นั้นมีความสำคัญอย่างยิ่งต่อการเกิดเมแทบอลิซึม เพราะเอนไซม์จะเป็นตัวกระตุ้นการเกิดปฏิกิริยาเคมีเหล่านั้น โดยการเข้าจับกับปฏิกิริยาที่เกิดเองได้ (spontaneous process) อยู่แล้วในร่างกาย และหลังการเกิดปฏิกิริยาจะมีปลดปล่อยพลังงานออกมา พลังงานที่เกิดขึ้นนี้จะถูกนำไปใช้ในปฏิกิริยาเคมีอื่นของสิ่งมีชีวิตที่ไม่อาจเกิดขึ้นได้เองหากปราศจากพลังงาน จึงอาจกล่าวได้ว่า เอนไซม์ทำหน้าที่เป็นตัวเร่งปฏิกิริยา ทำให้ปฏิกิริยาเคมีต่าง ๆ ของร่างกายดำเนินไปอย่างรวดเร็วและมีประสิทธิภาพ นอกจากนี้ เอนไซม์ยังทำหน้าที่ควบคุมวิถีเมแทบอลิซึมในกระบวนการการตอบสนองต่อการเปลี่ยนแปลงในสิ่งแวดล้อมของเซลล์หรือสัญญาณจากเซลล์อื่น
ระบบเมแทบอลิซึมของสิ่งมีชีวิตจะเป็นตัวกำหนดว่า สารใดที่มีคุณค่าทางโภชนาการและเป็นพิษสำหรับสิ่งมีชีวิตนั้น ๆ ตัวอย่างเช่น โปรคาริโอตบางชนิดใช้ไฮโดรเจนซัลไฟด์เป็นสารอาหาร ทว่าแก๊สดังกล่าวกลับเป็นสารที่ก่อให้เกิดพิษแก่สัตว์[3] ทั้งนี้ ความเร็วของเมแทบอลิซึม หรืออัตราเมแทบอลิกนั้น ส่งผลต่อปริมาณอาหารที่สิ่งมีชีวิตต้องการ รวมไปถึงวิธีที่สิ่งมีชีวิตนั้นจะได้อาหารมาด้วย
คุณลักษณะที่โดดเด่นของเมแทบอลิซึม คือ ความคล้ายคลึงกันของวิถีเมแทบอลิซึมและส่วนประกอบพื้นฐาน แม้จะในสปีชีส์ที่ต่างกันมากก็ตาม[4] ตัวอย่างเช่น กลุ่มกรดคาร์บอกซิลิกที่ทราบกันดีว่าเป็นสารตัวกลางในวัฏจักรเครปส์นั้นพบได้ในสิ่งมีชีวิตทุกชนิดที่มีการศึกษาในปัจจุบัน ตั้งแต่สิ่งมีชีวิตเซลล์เดียวอย่างแบคทีเรีย Escherichia coli ไปจนถึงสิ่งมีชีวิตหลายเซลล์ขนาดใหญ่อย่างช้าง[5] ความคล้ายคลึงกันอย่างน่าประหลาดใจของวิถีเมแทบอลิซึมเหล่านี้เป็นไปได้ว่าอาจเป็นผลเนื่องมาจากวิถีเมแทบอลิซึมที่ปรากฏขึ้นในช่วงแรกของประวัติศาสตร์วิวัฒนาการ และสืบมาจนถึงปัจจุบันเพราะประสิทธิผลของกระบวนการนี้[6][7]
สารชีวเคมีหลัก[แก้]
โครงสร้างส่วนใหญ่ที่ประกอบขึ้นเป็นสัตว์ พืชและจุลชีพมาจากโมเลกุลพื้นฐานสามกลุ่มหลัก ได้แก่ กรดอะมิโน คาร์โบไฮเดรตและลิพิด (หรือมักเรียกลิพิดว่า ไขมัน) เนื่องจากโมเลกุลเหล่านี้สำคัญต่อชีวิต ปฏิกิริยาเมแทบอลิกสนใจการสร้างโมเลกุลเหล่านี้ระหว่างการสร้างเซลล์และเนื้อเยื่อ หรือสลายและใช้เป็นแหล่งพลังงานโดยการย่อยสลาย สารชีวเคมีเหล่านี้สามารถรวมกันสร้างเป็นพอลิเมอร์อย่างเช่นดีเอ็นเอและโปรตีน ซึ่งเป็นโมเลกุลใหญ่จำเป็นต่อชีวิต
| ประเภทของโมเลกุล | ชื่อของรูปมอนอเมอร์ | ชื่อของรูปพอลิเมอร์ | ตัวอย่างรูปพอลิเมอร์ |
|---|---|---|---|
| กรดอะมิโน | กรดอะมิโน | โปรตีน (ประกอบขึ้นจากพอลิเพปไทด์) | โปรตีนเส้นใยและโปรตีนรูปทรงกลม |
| คาร์โบไฮเดรต | โมโนแซ็กคาไรด์ | พอลิแซ็กคาไรด์ | แป้ง, ไกลโคเจน และเซลลูโลส |
| กรดนิวคลิอิก | นิวคลีโอไทด์ | พอลินิวคลีโอไทด์ | ดีเอ็นเอ และอาร์เอ็นเอ |
เส้นเดี่ยว: วิถีที่พบทั่วไปในสิ่งมีชีวิตส่วนใหญ่ เส้นคู่: วิถีที่ไม่พบในมนุษย์ (เช่น พบในพืช เห็ดราหรือโปรแคริโอต) |
กรดอะมิโนและโปรตีน[แก้]
โปรตีนประกอบขึ้นจากกรดอะมิโนเรียงตัวกันเป็นโซ่เส้นตรงเชื่อมด้วยพันธะเพปไทด์[8] โปรตีนหลายตัวเป็นเอ็นไซม์ซึ่งเร่งปฏิกิริยาเคมีในเมแทบอลิซึม โปรตีนตัวอื่นมีหน้าที่เชิงโครงสร้างหรือกลไก เช่น โปรตีนที่ประกอบขึ้นเป็นไซโทสเกลิทัน ระบบโครงค้ำจุนรูปทรงของเซลล์[9] โปรตีนยังมีความสำคัญในการส่งสัญญาณของเซลล์ ระบบภูมิคุ้มกัน การยึดติดของเซลล์ การลำเลียงแบบใช้พลังงานข้ามเยื่อ และวัฏจักรเซลล์[10] กรดอะมิโนยังมีผลต่อเมแทบอลิซึมพลังงานของเซลล์โดยการให้แหล่งคาร์บอนสำหรับเข้าสู่วัฏจักรกรดซิตริก (วัฏจักรกรดไตรคาร์บอกซิลิก หรือ วัฏจักรเครบส์)[11] โดยเฉพาะเมื่อแหล่งพลังงานหลักอย่างกลูโคสหาได้ยาก หรือเมื่อเซลล์มีความเครียดเมแทบอลิก[12]
ลิพิด[แก้]
ลิพิดเป็นกลุ่มชีวเคมีที่หลากหลายที่สุด ประโยชน์เชิงโครงสร้างหลักของลิพิดคือเป็นส่วนหนึ่งของเยื่อชีวภาพทั้งภายในและภายนอก เช่น เยื่อหุ้มเซลล์ หรือเป็นแหล่งพลังงาน[10] โดยทั่วไปนิยามลิพิดว่าเป็นโมเลกุลชีวภาพไม่ชอบน้ำหรือมีทั้งส่วนชอบน้ำและไม่ชอบน้ำ แต่จะละลายในตัวทำละลายอินทรีย์อย่างเบนซีนหรือคลอโรฟอร์ม[13] ไขมันเป็นสารประกอบกลุ่มใหญ่ที่ประกอบด้วยกรดไขมันและกลีเซอรอล โมเลกุลกลีเซอรอลที่เชื่อมติดกับกรดไขมันเอสเทอร์สามตัวเรียก ไตรกลีเซอไรด์[14] มีโครงสร้างพื้นฐานนี้หลายชนิด รวมทั้งแกนกลางตัวอื่นอย่างสฟิงโกซีน (sphingosine) ในสฟิงโกลิพิด และกลุ่มชอบน้ำอย่างฟอสเฟตในฟอสโฟลิพิด สเตอรอยด์อย่างเช่นคอเลสเตอรอลก็เป็นลิพิดประเภทหลักประเภทหนึ่ง[15]
คาร์โบไฮเดรต[แก้]
คาร์โบไฮเดรตเป็นอัลดีไฮด์หรือคีโตน โดยมีหมู่ไฮดร็อกซิลหลายหมู่ติดอยู่ สามารถมีได้ทั้งในรูปโซ่ตรงหรือวงแหวน คาร์โบไฮเดรตเป็นโมเลกุลชีวภาพที่มีมากที่สุด และมีหลายบทบาทตั้งแต่เก็บและขนส่งพลังงาน (แป้ง, ไกลโคเจน) และองค์ประกอบโครงสร้าง (เซลลูโลสในพืช ไคตินในสัตว์)[10] หน่วยคาร์โบไฮเดรตพื้นฐานเรียกมอนอแซกคาได์และมีกาแลคโตส ฟรุกโตสและที่สำคัญที่สุดกลูโคส มอนอแซกคาไรด์สามารถเชื่อมเข้าด้วยกันเป็นพอลิแซกคาไรด์ด้วยวิธีต่าง ๆ ได้แทบไม่สิ้นสุด[16]
นิวคลีโอไทด์[แก้]
กรดนิวคลิอิกสองชนิด ดีเอ็นเอและอาร์เอ็นเอเป็นพอลิเมอร์ของนิวคลีโอไทด์ แต่ละนิวคลีโอไทด์ประกอบด้วยฟอสเฟตติดกับหมู่น้ำตาลไรโบสหรือดีอ็อกซีไรโบสซึ่งติดกับไนโตรจีนัสเบส กรดนิวคลีอิกสำคัญต่อการเก็บและใช้สารสนเทศพันธุกรรม และการตีความผ่านกระบวนการถอดรหัสและชีวสังเคราะห์โปรตีน[10] สารสนเทศนี้มีกลไกการซ่อมแซมดีเอ็นเอป้องกันและแพร่ขยายผ่านการถ่ายแบบดีเอ็นเอ ไวรัสหลายชนิดมีจีโนมอาร์เอ็นเอ เช่น เอชไอวี ซึ่งใช้การถ่ายแบบย้อนกลับเพื่อสร้างแม่แบบดีเอ็นเอจากจีโนมอาร์เอ็นเอ[17] อาร์เอ็นเอในไรโบไซม์อย่างสไปลซีโอโซมและไรโบโซมคล้ายกับเอ็นไซม์ที่สามารถเร่งปฏิกิริยาเคมีได้ นิวคลีโอไซด์เดี่ยว ๆ สร้างขึ้นจากการติดนิวคลีโอเบสกับน้ำตาลไรโบส ฐานาเหล่านี้เป็นวงแหวนเฮเทอโรไซคลิกประกอบด้วยไนโตรเจน จำแนกเป็นพิวรีนหรือไพริมีดีน นิวคลีโอไทด์ยังทำหน้าที่เป็นโคเอ็นไซม์ในปฏิกิริยาย้ายหมู่เมแทบอลิก[18]
โคเอ็นไซม์[แก้]
เมแทบอลิซึมเกี่ยวข้องกับปฏิกิริยาเคมีหลากหลาย แต่ส่วนใหญ่จัดอยู่ในปฏิกิริยาชนิดพื้นฐานไม่กี่ชนิดที่เกี่ยวข้องกับการย้ายหมู่ฟังก์ชันอะตอมและพันธะในโมเลกุล[19] ปฏิกิริยาเคมีทั่วไปนี้ทำให้เซลล์ใช้สารตัวกลางเมแทบอลิกชุดเล็ก ๆ พาหมู่เคมีระหว่างปฏิกิริยาต่าง ๆ[18] สารตัวกลางย้ายหมู่เหล่านี้เรียก โคเอ็นไซม์ ปฏิกิริยาย้ายกลุ่มแต่ละกลุ่มดำเนินโดยโคเอ็นไซม์เฉพาะ ซึ่งเป็นสารตั้งต้นสำหรับชุดเอ็นไซม์ที่ผลิตโคเอ็นไซม์นั้น และชุดของเอ็นไซม์ที่ใช้โคเอ็นไซม์ดังกล่าว ฉะนั้นโคเอ็นไซม์เหล่านี้จึงมีการผลิต ใช้และนำกลับมาใช้ใหม่อย่างต่อเนื่อง[20]
โคเอ็นไซม์กลางหนึ่งคือ อะดีโนซีนไตรฟอสเฟต (ATP) ซึ่งเป็นแหล่งพลังงานสากลของเซลล์ นิวคลีโอไทด์นี้ใช้โอนพลังงานเคมีระหว่างปฏิกิริยาเคมีต่าง ๆ มี ATP ปริมาณน้อยในเซลล์ แต่เนื่องจากสามารถฟื้นฟูได้เรื่อย ๆ ร่างกายมนุษย์จึงสามารถใช้ ATP ได้เท่ากับน้ำหนักตัวต่อวัน[20] ATP เป็นเสมือนสะพานระหว่างแคแทบอลิซึมและแอแนบอลิซึม แคแทบอลิซึมเป็นการสลายโมเลกุล และแอแนบอลิซึมสร้างโมเลกุล ปฏิกิริยาแคแทบอลิกสร้าง ATP และปฏิกิริยาแอนาบอลิกใช้สารดังกล่าว นอกจากนี้ยังเป็นตัวพาหมู่ฟอสเฟตในปฏิกิริยาฟอสโฟรีเลชัน
วิตามินเป็นสารประกอบอินทรีย์ที่จำเป็นปริมาณน้อยที่ไม่สามารถสร้างขึ้นได้ในเซลล์ ในโภชนาการมนุษย์วิตามินส่วนใหญ่ทำหน้าที่เป็นโคเอ็นไซม์หลังเปลี่ยนรูปแล้ว ตัวอย่างเช่น วิตามินละลายในน้ำได้ทุกชนิดมีการเติมหมู่ฟอสเฟตหรือจับกับนิวคลีโอไทด์เมื่อใช้ในเซลล์[21] นิโคตินาไมด์อะดีนีนไดนิวคลีโอไทด์ (NAD+) ซึ่งเป็นอนุพันธ์ของวิตามินบี3 (ไนอะซิน) เป็นโคเอ็นไซม์สำคัญซึ่งทำหน้าที่เป็นตัวรับไฮโดรเจน มีดีไฮโดรจีเนสหลายร้อยชนิดซึ่งนำอิเล็กตรอนออกจากสารตั้งต้นและรีดิวซ์ NAD+ เป็น NADH รูปรีดิวซ์นี้เป็นสารตั้งต้นของรีดักเตสในเซลล์ที่จำเป็นต่อการรีดิวซ์สารตั้งต้น[22] นิโคตินาไมด์อะดีนีนไดนิวคลีโอไทด์ในสองรูปที่สัมพันธ์กันในเซลล์ NADH และ NADPH; รูป NAD+/NADH มีความสำคัญกว่าในปฏิกิริยาแคแทบอลิก ส่วนรูป NADP+/NADPH ใช้ในปฏิกิริยาแอแนบอลิก
แร่ธาตุและโคแฟกเตอร์[แก้]
ธาตุอนินทรีย์มีบทบาทสำคัญในเมแทบอลิซึม บางธาตุมีมาก (เช่น โซเดียมและโพแทสเซียม) ส่วนบางธาตุทำหน้าที่ได้ที่ความเข้มข้นน้อยมาก ประมาณร้อยละ 99 ของมวลสัตว์เลี้ยงลูกด้วยนมประกอบขึ้นจากธาตุคาร์บอน ไนโตรเจน แคลเซียม โซเดียม คลอรีน โพแทสเซียม ไฮโดรเจน ฟอสฟอรัส ออกซิเจนและซัลเฟอร์[23] คาร์บอนและไนโตรเจนส่วนใหญ่อยู่ในสารประกอบอินทรีย์ (โปรตีน ลิพิดและคาร์โบไฮเดรต) ออกซิเจนและไฮโดรเจนส่วนใหญ่อยู่ในรูปน้ำ[23]
ธาตุอนินทรีย์ที่พบมากเป็นอิเล็กโทรไลต์ไอออน ไอออนที่สำคัญที่สุดได้แก่ โซเดียม โพแทสเซียม แคลเซียม แม็กนีเซียม คลอรีน ฟอสเฟตและไอออนอินทรีย์ไบคาร์บอเนต การบำรุงรักษาความแตกต่างของไอออนที่แน่ชัดขามเยื่อหุ้มเซลล์รักษาความดันออสโมซิสและ pH[24] ไอออนยังมีความสำคัญต่อการทำหน้าที่ของประสาทและกล้ามเนื้อ โดยศักยะงาน (action potential) ในเนื้อเยื่อเหล่านี้ผลิตจากการแลกเปลี่ยนอิเล็กโทรไลต์ระหว่างของเหลวนอกเซลล์และไซโทซอล ของเหลวของเซลล์[25] อิเล็กโทรไลต์เข้าและออกจากเซลล์ผ่านโปรตีนในเยื่อหุ้มเซลล์ที่เรียก ช่องไอออน (ion channel) ตัวอย่างเช่น การหดตัวของกล้ามเนื้อขึ้นอยู่กับการไหลของแคลเซียม โซเดียมและโพแทสเซียมผ่านช่องไอออนในเยื่อหุ้มเซลล์และทีทิวบูล[26]
ปกติโลหะทรานซิชันอยู่ในสิ่งมีชีวิตเป็นธาตุปริมาณน้อยมาก โดยสังกะสีและเหล็กเป็นธาตุที่พบมากที่สุด[27][28] โลหะเหล่านี้ใช้เป็นโคแฟกเตอร์ในโปรตีนบางตัว และมีความสำคัญต่อกัมมันตภาพของเอ็นไซม์อย่างคะแทเลสและโปรตีนพาออกซิเจนอย่างฮีโมโกลบิน[29] โคแฟกเตอร์โลหะจับกับจุดจำเพาะในโปรตีนอย่างแน่น แม้โคแฟกเตอร์เอ็นไซม์สามารถดัดแปรได้ระหว่างคะแทไลสิส โคแฟกเตอร์เหล่านี้จะกลับสู่สถานะเดิมเสมอเมื่อสิ้นสุดปฏิกิริยาที่เกิดคะแทไลสิสแล้ว สารอาหารรองโลหะรับเข้าสู่สิ่งมีชีวิตโดยตัวพาจำเพาะและจับกับโปรตีนเก็บอย่างเฟอร์ริตินหรือเมทัลโลไธโอนีนเมื่อไม่ใช้[30][31]
แคแทบอลิซึม[แก้]
แคแทบอลิซึมเป็นกลุ่มกระบวนการเมแทบอลิกที่สลายโมเลกุลขนาดใหญ่ ซึ่งรวมไปถึงการสลายและการออกซิไดซ์ (oxidize) โมเลกุลอาหาร จุดประสงค์ของปฏิกิริยาแคแทบอลิซึมคือ ให้พลังงานและส่วนประกอบที่จำเป็นแก่ปฏิกิริยาแอแนบอลิซึม ลักษณะที่แน่ชัดของปฏิกิริยาแคแทบอลิซึมเหล่านี้แตกต่างกันไปตามสิ่งมีชีวิต และสิ่งมีชีวิตสามารถถูกจำแนกประเภทได้ตามแหล่งพลังงานและคาร์บอน (ซึ่งเป็นหมู่อาหารหลัก) ได้ดังตารางข้างล่าง
| แหล่งพลังงาน | แสงอาทิตย์ | โฟโต- | -โทรฟ | ||
| โมเลกุลที่ก่อขึ้นก่อน (preformed molecule) |
คีโม- | ||||
| ตัวให้อิเล็กตรอน | สารอินทรีย์ | ออร์แกโน- | |||
| สารอนินทรีย์ | ลิโธ- | ||||
| แหล่งคาร์บอน | สารอินทรีย์ | เฮเทอโร- | |||
| สารอนินทรีย์ | ออโต- | ||||
ออร์แกโนโทรฟ (organotroph) ใช้สารอินทรีย์เป็นแหล่งพลังงาน ขณะที่ลิโทโทรฟ (lithotroph) ใช้สารอนินทรีย์ และโปรโตโทรฟ (phototroph) ใช้แสงอาทิตย์เป็นพลังงานเคมี อย่างไรก็ดี เมแทบอลิซึมที่ต่างรูปแบบกันทั้งหมดนี้ขึ้นอยู่กับปฏิกิริยารีดอกซ์ที่เกี่ยวข้องกับการย้ายอิเล็กตรอนจากโมเลกุลตัวให้อิเล็กตรอน (donor molecule) ในรูปรีดิวซ์ (reduced) เช่น สารอินทรีย์ น้ำ แอมโมเนีย ไฮโดรเจนซัลไฟด์หรือเฟอร์รัสไอออนไปให้โมเลกุลตัวรับอิเล็กตรอน (acceptor molecule) เช่น ออกซิเจน ไนเตรตหรือซัลเฟต[32] ปฏิกิริยารีด็อกซ์ในสัตว์เกี่ยวข้องกับการสลายสารอินทรีย์ที่ซับซ้อนให้เป็นโมเลกุลที่เล็กกว่า เช่น คาร์บอนไดออกไซด์และน้ำ ในสิ่งมีชีวิตที่สังเคราะห์ด้วยแสงได้ เช่น พืชและไซยาโนแบคทีเรีย (สาหร่ายสีเขียวแกมน้ำเงิน) ปฏิกิริยาย้ายอิเล็กตรอนเหล่านี้มิได้ให้พลังงานออกมา แต่ถูกใช้เป็นวิถีการเก็บสะสมพลังงานที่ดูดซึมมาจากแสงอาทิตย์[10]
กลุ่มปฏิกิริยาแคแทบอลิซึมที่พบมากที่สุดในสัตว์สามารถแบ่งได้เป็นสามขั้นหลัก ขั้นแรก สารอินทรีย์ขนาดใหญ่ เช่น โปรตีน พอลิแซ็กคาไรด์หรือลิพิดถูกย่อยเป็นส่วนประกอบที่เล็กกว่านอกเซลล์ ขั้นต่อมา โมเลกุลที่ถูกย่อยเหล่านี้ถูกเซลล์รับเข้าไปและแปลงเป็นโมเลกุลที่เล็กกว่า มักเป็นอะซิติลโคเอนไซม์ เอ (acetyl coenzyme A หรือ acetyl-CoA) ซึ่งให้พลังงานออกมาบ้าง ขั้นสุดท้าย หมู่เอซิลบนโคเอถูกออกซิไดซ์เป็นน้ำและคาร์บอนไดออกไซด์ในวัฏจักรเครปส์และลูกโซ่ของการขนส่งอิเล็กตรอน (electron transport chain) ซึ่งปลดปล่อยพลังงานที่ถูกกักไว้โดยการรีดิวซ์ (reduce) โคเอนไซม์ นิโคทินาไมด์อะดีนีนไดนิวคลีโอไทด์ (NAD+) เป็น NADH
การย่อย[แก้]
เซลล์ไม่สามารถรับมหโมเลกุล อาทิ แป้ง เซลลูโลสหรือโปรตีนไปใช้ได้อย่างรวดเร็ว จำต้องสลายเป็นหน่วยที่เล็กกว่าเสียก่อนจึงจะนำไปใช้ในเมแทบอลิซึมของเซลล์ได้ เอนไซม์หลายคลาสทำหน้าที่ย่อยพอลิเมอร์เหล่านี้ เช่น protease ย่อยโปรตีนเป็นกรดอะมิโน, glycoside hydrolase ย่อยพอลิแซ็กคาไรด์เป็นมอโนแซ็กคาไรด์
จุลินทรีย์หลั่งเอนไซม์ย่อยออกสู่สิ่งแวดล้อม[33][34] แต่สัตว์หลั่งเอนไซม์จากเซลล์ที่ทำหน้าที่พิเศษเฉพาะในทางเดินอาหารเท่านั้น[35] จากนั้นกรดอะมิโนหรือน้ำตาลที่ถูกปล่อยออกจากเอนไซม์นอกเซลล์เหล่านี้จะถูกโปรตีนที่เจาะจงปั๊มเข้าสู่เซลล์ด้วยวิธีการลำเลียงแบบใช้พลังงาน (active transport)[36][37]

พลังงานจากสารอินทรีย์[แก้]
แคแทบอลิซึมของคาร์โบไฮเดรตเป็นการสลายคาร์โบไฮเดรตเป็นหน่วยที่เล็กกว่า โดยปกติ คาร์โบไฮเดรตจะถูกนำเข้าสู่เซลล์เมื่อถูกย่อยเป็นมอโนแซ็คคาไรด์แล้ว[38] เมื่อเข้ามาในเซลล์ วิถีหลักในการสลายคือ ไกลโคไลสิส (glycolysis) ซึ่งน้ำตาลอย่างกลูโคสและฟรุกโทสถูกเปลี่ยนเป็นไพรูเวตและได้ ATP ออกมาจำนวนหนึ่ง[39] ไพรูเวตเป็นสารตัวกลางในวิถีเมแทบอลิซึมจำนวนมาก แต่ส่วนมากจะถูกแปลงเป็นอะซีติลโค เอ และป้อนเข้าสู่วัฏจักรเครปส์ แม้ว่า จะมีการสร้าง ATP ออกมาในวัฏจักรเครปส์ แต่ผลิตภัณฑ์ที่สำคัญที่สุดคือ NADH ซึ่งสร้างมาจาก NAD+ เมื่ออะซีติลโค เอ ถูกออกซิไดซ์ ปฏิกิริยานี้ปล่อยคาร์บอนไดออกไซด์ออกมาเป็นผลิตภัณฑ์ของเสีย ในสภาวะขาดออกซิเจน ไกลโคไลสิสจะสร้างแลกเตต ผ่านเอนไซม์ lactate dehydrogenase ซึ่งออกซิไดซ์ NADH ให้กลับไปเป็น NAD+ เพื่อนำไปใช้ใหม่ในไกลโคไลสิส การสลายกลูโคสอีกวิถีหนึ่ง คือ วิถีเพนโตสฟอสเฟต (pentose phosphate pathway) ซึ่งรีดิวซ์โคเอนไซม์ NADPH และสร้างน้ำตาลเพนโตส เช่น ไรโบส ซึ่งเป็นน้ำตาลองค์ประกอบของกรดนิวคลีอิก
ปฏิกิริยาการสลายด้วยน้ำ (hydrolysis) สลายไขมันเป็นกรดไขมันอิสระและกลีเซอรอล กลีเซอรอลเข้าสู่กระบวนการไกลโคไลสิสและกรดไขมันถูกสลายด้วยกระบวนการเบตาออกซิเดชัน (beta oxidation) เพื่อให้ได้อะซีติลโค เอ ซึ่งจะถูกป้อนเข้าสู่วัฏจักรเครปส์ กรดไขมันปลดปล่อยพลังงานเมื่อสลายออกมามากกว่าคาร์โบไฮเดรต เพราะคาร์โบไฮเดรตมีออกซิเจนในโครงสร้างมากกว่า
กรดอะมิโนสามารถถูกใช้ได้ทั้งเพื่อสังเคราะห์โปรตีนและโมเลกุลชีวภาพอื่น ๆ หรือถูกออกซิไดซ์ให้เป็นยูเรียและคาร์บอนไดออกไซด์เป็นแหล่งพลังงาน[40] วิถีออกซิเดชันเริ่มต้นด้วยการนำหมู่อะมิโนออกด้วยเอนไซม์ transaminase หมู่อะมิโนจะถูกป้อนเข้าสู่วัฏจักรยูเรีย (urea cycle) เหลือแกนคาร์บอนที่ปราศจากหมู่อะมิโนในรูปของกรดคีโต ซึ่งกรดคีโตเหล่านี้จำนวนมากเป็นสารตัวกลางในวัฏจักรเครปส์ ตัวอย่างเช่น การย้ายหมู่อะมิโนจากกลูตาเมตเกิดเป็นแอลฟา-คีโตกลูตาเรต (α-ketoglutarate)[41] กรดอะมิโนกลูโคจีนิก (glucogenic amino acid) สามารถถูกเปลี่ยนเป็นกลูโคสได้ ผ่านกระบวนการการสร้างกลูโคส (gluconeogenesis)[42]
การเปลี่ยนรูปพลังงาน[แก้]
ออกซิเดทีฟฟอสฟอริเลชัน[แก้]
ในออกซิเดทีฟฟอสฟอริเลชัน (oxidative phosphorylation) อิเล็กตรอนที่ถูกดึงออกจากสารอินทรีย์ในบางบริเวณ เช่น protagon acid cycle ถูกแปลงเป็นออกซิเจนและพลังงานที่ได้ออกมานำไปใช้สร้าง ATP ปฏิกิริยาดังกล่าวเกิดในยูคาริโอตโดยกลุ่มโปรตีนในเยื่อหุ้มของไมโทคอนเดรีย เรียกว่า ลูกโซ่ของการขนส่งอิเล็กตรอน ในโปรคาริโอต โปรตีนเหล่านี้พบในเยื่อหุ้มชั้นในของเซลล์[43] โปรตีนเหล่านี้ใช้พลังงานที่ปล่อยมาจากการส่งอิเล็กตรอนจากโมเลกุลในรูปรีดิวซ์อย่าง NADH ไปให้ออกซิเจนเพื่อปั๊มโปรตอนข้ามเยื่อหุ้ม[44]
การปั๊มโปรตอนออกจากไมโทคอนเดรียทำให้ความเข้มข้นโปรตอนระหว่างเยื่อหุ้มต่างกันและเกิดความแตกต่างทางศักย์ไฟฟ้าเคมี (electrochemical gradient)[45] แรงนี้ขับโปรตอนกลับเข้าไปในไมโทคอนเดรียผ่านฐานของเอนไซม์ ATP synthase การไหลของโปรตอนทำให้หน่วยย่อยที่มีลักษณะเป็นก้านหมุน ทำให้บริเวณเร่งของมันเปลี่ยนรูปร่าง และเติมหมู่ฟอสเฟต (phosphorylase) ให้อะดีโนซีนไดฟอสเฟต ได้เป็น ATP[20]
พลังงานจากสารอนินทรีย์[แก้]
คีโมลิโธโทรฟ (chemolithotrophy) เป็นเมแทบอลิซึมประเภทที่พบในโปรคารีโอตที่พลังงานได้มาจากปฏิกิริยาออกซิเดชันของสารอนินทรีย์ สิ่งมีชีวิตเหล่านี้สามารถใช้ไฮโดรเจน[46] สารประกอบซัลเฟอร์ในรูปรีดิวซ์ (เช่น ซัลไฟด์ ไฮโดรเจนซัลไฟด์และไทโอซัลเฟต)[3] เฟอร์รัสไอออน[47] หรือแอมโมเนีย[48] เป็นแหล่งกำลังรีดิวซ์ สิ่งมีชีวิตเหล่านี้ได้พลังงานจากปฏิกิริยาออกซิเดชันของสารประกอบเหล่านี้โดยตัวรับอิเล็กตรอน เช่น ออกซิเจนหรือไนเตรต[49] กระบวนการของจุลินทรีย์เหล่านี้มีความสำคัญในวัฏจักรชีวธรณีเคมี (biogeochemical) ของโลก เช่น การสร้างกรด (acetogenesis) ไนตริฟิเคชัน (nitrification) และกระบวนการเปลี่ยนไนเตรตเป็นไนโตรเจน (denitrification) ทั้งยังสำคัญต่อความอุดมสมบูรณ์ของดิน[50][51]
พลังงานจากแสง[แก้]
พลังงานในแสงอาทิตย์ถูกพืช ไซยาโนแบคทีเรีย แบคทีเรียสีม่วง แบคทีเรียซัลเฟอร์สีเขียวและโพรทิสต์บางชนิดจับไว้ กระบวนการนี้มักนับรวมกับการเปลี่ยนคาร์บอนไดออกไซด์เป็นสารอินทรีย์ ซึ่งเป็นส่วนหนึ่งของการสังเคราะห์ด้วยแสง อย่างไรก็ดี พลังงานที่ถูกจับและระบบการตรึงคาร์บอนสามารถแยกกันทำงานได้ในโปรคารีโอต เช่น แบคทีเรียสีม่วงและแบคทีเรียซัลเฟอร์สีเขียวสามารถใช้แสงอาทิตย์เป็นแหล่งพลังงาน ขณะที่เปลี่ยนระหว่างการตรึงคาร์บอนกับการหมักสารอินทรีย์[52][53]
ในสิ่งมีชีวิตหลายชนิด การจับพลังงานจากดวงอาทิตย์มีหลักการคล้ายคลึงกับออกซิเดทีฟฟอสโฟรีเลชัน เพราะเกี่ยวข้องกับพลังงานที่ถูกเก็บไว้ในรูปความแตกต่างของความเข้มข้นโปรตอน จากนั้น แรงขับโปรตอนนี้จะกระตุ้นการสังเคราะห์ ATP[20] อิเล็กตรอนที่จำเป็นสำหรับการกระตุ้นลูกโซ่ของการขนส่งอิเล็กตรอนมาจากโปรตีนรวบรวมแสง ชื่อว่า ศูนย์กลางปฏิกิริยาการสังเคราะห์ด้วยแสงหรือโรดอปซิน (rhodopsin) ศูนย์กลางปฏิกิริยาแบ่งออกได้เป็นสองประเภทขึ้นอยู่กับชนิดของสารสีการสังเคราะห์ด้วยแสงที่ปรากฏ ซึ่งแบคทีเรียที่สังเคราะห์ด้วยแสงได้ส่วนมากมีชนิดเดียว แต่พืชและไซยาโนแบคทีเรียมีสองชนิด[54]
ในพืช สาหร่ายและไซยาโนแบคทีเรีย ระบบแสง 2 ใช้พลังงานแสงเพื่อดึงอิเล็กตรอนออกจากน้ำ และได้ออกซิเจนออกมาเป็นผลิตภัณฑ์ของเสีย จากนั้น อิเล็กตรอนจะไหลไปยังไซโทโครม บี6เอฟ คอมเพล็กซ์ (cytochrome b6f complex) ซึ่งใช้พลังงานปั๊มโปรตอนข้ามเยื่อหุ้มไทลาคอยด์ในคลอโรพลาสต์[10] โปรตอนเหล่านี้เคลื่อนกลับผ่านเยื่อหุ้มขณะที่ขับเคลื่อนเอทีพีซินเทส จากนั้น อิเล็กตรอนจะไหลผ่านระบบแสง 1 และสามารถถูกใช้เพื่อรีดิวซ์โคเอนไซม์ NADP+ เพื่อใช้ในวัฏจักรคัลวิน (Calvin cycle) หรือรีไซเคิลเพื่อนำกลับไปผลิต ATP เพิ่ม[55]
แอแนบอลิซึม[แก้]
แอแนบอลิซึมเป็นกลุ่มกระบวนการเมแทบอลิซึมที่เกี่ยวกับการสร้าง โดยพลังงานที่ปล่อยออกมาจากแคแทบอลิซึมถูกใช้เพื่อสังเคราะห์โมเลกุลที่ซับซ้อน โดยทั่วไป โมเลกุลที่ซับซ้อนซึ่งประกอบขึ้นเป็นโครงสร้างของเซลล์นั้นถูกสร้างทีละขั้นจากสารตั้งต้นขนาดเล็กและสามัญ แอแนบอลิซึมเกี่ยวข้องกับสามขั้นพื้นฐาน ขั้นแรก การผลิตสารตั้งต้น เช่น กรดอะมิโน มอโนแซ็คคาไรด์ ไอโซพรีนอยด์และนิวคลีโอไทด์ อย่างที่สอง การกระตุ้นสารตั้งต้นให้อยู่ในรูปที่เกิดปฏิกิริยาได้โดยใช้พลังงานจาก ATP และขั้นที่สาม การรวมสารตั้งต้นเหล่านี้เป็นโมเลกุลที่ซับซ้อน เช่น โปรตีน พอลิแซ็กคาไรด์ ลิพิดและกรดนิวคลีอิก
สิ่งมีชีวิตมีจำนวนโมเลกุลที่สร้างได้ในเซลล์ด้วยตนเองต่างกัน ออโตโทรฟ เช่น พืช สามารถสร้างสารอินทรีย์ที่ซับซ้อนได้ในเซลล์ อาทิ พอลิแซ็กคาไรด์และโปรตีนจากโมเลกุลสามัญอย่างคาร์บอนไดออกไซด์และน้ำ แต่เฮเทอโรโทรฟต้องอาศัยแหล่งสสารที่ซับซ้อนกว่า เช่น มอโนแซ็คคาไรด์และกรดอะมิโนเพื่อผลิตโมเลกุลที่ซับซ้อนเหล่านี้ สิ่งมีชีวิตสามารถจำแนกได้อีกจากแหล่งพลังงานสุดท้าย โฟโตออโตโทรฟและโฟโตเฮเทอโรโทรฟดึงพลังงานจากแสง ขณะที่คีโมออโตโทรฟและคีโมเฮเทอโรโทรฟดึงพลังงานจากปฏิกิริยาออกซิเดชันอนินทรีย์
การตรึงคาร์บอน[แก้]
การสังเคราะห์ด้วยแสงเป็นการสังเคราะห์คาร์โบไฮเดรตจากแสงอาทิตย์และคาร์บอนไดออกไซด์ ในพืช ไซยาโนแบคทีเรียและสาหร่าย การสังเคราะห์ด้วยแสงที่มีออกซิเจนเกิดขึ้น (oxygenic photosynthesis) ได้น้ำ และได้ออกซิเจนออกมาเป็นผลิตภัณฑ์ของเสีย กระบวนการนี้ใช้ ATP และ NADPH ที่ผลิตจากศูนย์กลางปฏิกิริยาการสังเคราะห์ด้วยแสง ดังที่อธิบายข้างต้น เปลี่ยนคาร์บอนไดออกไซด์เป็นกลีเซอเรต 3-ฟอสเฟต ซึ่งจากนั้น สามารถถูกเปลี่ยนเป็นกลูโคส ปฏิกิริยาการตรึงคาร์บอนนี้ดำเนินโดยเอนไซม์รูบิสโก (RuBisCO) อันเป็นส่วนหนึ่งของวัฏจักรคัลวิน-เบนสัน[56] การสังเคราะห์ด้วยแสงในพืชมีสามประเภท ได้แก่ การตรึงคาร์บอนซี 3, ซี 4 และการสังเคราะห์ด้วยแสงซีเอเอ็ม เหล่านี้แตกต่างกันตรงเส้นทางที่คาร์บอนไดออกไซด์เข้าสู่วัฏจักรคัลวิน โดยพืชซี 3 ตรึงคาร์บอนไดออกไซด์โดยตรง ขณะที่ซี 4 และการสังเคราะห์ด้วยแสงซีเอเอ็มรวมคาร์บอนไดออกไซด์เข้ากับสารอื่นก่อน อันเป็นการปรับตัวเพื่อเข้ากับแสงอาทิตย์ที่เข้มข้นและสภาวะแห้ง[57]
ในโปรคารีโอตที่สังเคราะห์ด้วแสงได้ กลไกการตรึงคาร์บอนนี้มีความหลากหลายมากกว่า คาร์บอนไดออกไซด์สามารถถูกตรึงโดยวัฏจักรคัลวิน-เบนสัน, วัฏจักรเครปส์ย้อนกลับ (reversed Krebs cycle)[58] หรือการเติมหมู่คาร์บอกซิล (carboxylation) ของอะซีติลโค เอ[59][60] คีโมออโตโทรฟโปรคารีโอตยังตรึงคาร์บอนไดออกไซด์ผ่านวัฏจักรคัลวิน-เบนสัน แต่ใช้พลังงานจากสารอนินทรีย์ในการขับเคลื่อนปฏิกิริยา[61]
คาร์โบไฮเดรตและไกลแคน[แก้]
ในแอแนบอลิซึมของคาร์โบไฮเดรต กรดอินทรีย์สามัญสามารถถูกแปลงเป็นมอโนแซ็คคาไรด์ เช่น กลูโคส และจากนั้นถูกใช้เพื่อประกอบพอลิแซ็กคาไรด์ เช่น แป้ง การสร้างกลูโคสจากสารประกอบอย่างไพรูเวต แลคเตต กลีเซอรอล กลีเซอเรต 3-ฟอสเฟตและกรดอะมิโน เรียกว่า การสร้างกลูโคส (gluconeogenesis) กระบวนการการสร้างกลูโคสเปลี่ยนไพรูเวตเป็นกลูโคส-6-ฟอสเฟตผ่านตัวกลางหลายตัว ซึ่งตัวกลางจำนวนมากเป็นตัวเดียวกับในไกลโคไลสิส[39] อย่างไรก็ดี วิถีนี้มิใช่ปฏิกิริยาย้อนกลับของไกลโคไลสิส เพราะปฏิกิริยาหลายขั้นถูกเร่งด้วยเอนไซม์ที่มิได้มีอยู่ในไกลโคไลสิส ซึ่งเป็นสิ่งสำคัญเพราะจะทำให้การสร้างและการสลายกลูโคสถูกควบคุมแยกจากกัน และกันมิให้วิถีทั้งสองดำเนินไปพร้อมกันเป็นวัฏจักรที่สูญเปล่า (futile cycle)[62][63]
แม้ว่าไขมันจะเป็นวิธีการเก็บพลังงานที่สามัญ แต่ในสัตว์มีกระดูกสันหลังอย่างมนุษย์ กรดไขมันที่ถูกเก็บสะสมไว้ไม่สามารถถูกเปลี่ยนให้เป็นกลูโคสได้ผ่านการสร้างกลูโคส เพราะสิ่งมีชีวิตเหล่านี้ไม่สามารถเปลี่ยนอะซีติลโค เอ ให้เป็นไพรูเวตได้ พืชมีระบบเอนไซม์จำเป็น (necessary enzymatic machinery) ขณะที่สัตว์ไม่มี[64] ผลคือ หลังการอดอาหารเป็นเวลานาน สัตว์มีกระดูกสันหลังจำต้องสร้างคีโตนบอดีส์ (ketone bodies) จากกรดไขมันเพื่อทดแทนกลูโคสในเนื้อเยื่อ เช่น สมอง ซึ่งไม่สามารถสันดาป (metabolize) กรดไขมันได้[65] สิ่งมีชีวิตอื่นอย่างพืชและแบคทีเรียแก้ปัญหาเมแทบอลิซึมข้อนี้โดยวัฏจักรกลีออกซีเลต (glyoxylate cycle) ซึ่งข้ามขั้นตอนการกำจัดหมู่คาร์บอกซิล (decarboxylation) ในวัฏจักรเครปส์ ซึ่งให้อะซีติลโค เอแปลงเป็นออกซาโลอะซีเตต ซึ่งสามารถนำไปผลิตกลูโคสได้[64][66]
พอลิแซ็กคาไรด์และไกลแคนสร้างขึ้นจากการเพิ่มมอโนแซ็คคาไรด์ต่อเนื่องกันโดยเอนไซม์ glycosyltransferase จากตัวให้น้ำตาลฟอสเฟตที่เกิดปฏิกิริยาได้ เช่น ยูรีดีนไดฟอสเฟตกลูโคส (UDP-glucose) ให้กับหมู่ไฮดรอกซิลตัวรับบนพอลิแซ็กคาไรด์ที่กำลังเพิ่มขนาดขึ้นนั้น ด้วยหมู่ไฮดรอกซิลใด ๆ บนวงแหวนของสารตั้งต้นสามารถเป็นตัวรับได้ พอลิแซ็กคาไรด์ที่ถูกผลิตขึ้นนั้นจึงอาจมีโครงสร้างสายตรงหรือแตกกิ่งก็ได้[67] พอลิแซ็กคาไรด์ที่ถูกผลิตขึ้นนั้นอาจมีหน้าที่โครงสร้างหรือเมแทบอลิซึมของมันเอง[68] หรือไปรวมกับลิพิดและโปรตีนโดยเอนไซม์ oligosaccharyltransferase[69][70]
กรดไขมัน ไอโซพรีนอยด์ และสเตอรอยด์[แก้]
กรดไขมันสร้างขึ้นจากเอนไซม์ fatty acid synthase ซึ่งเกิดเป็นพอลิเมอร์ (polymerize) และจากนั้นรีดิวซ์หน่วยอะซีติลโค เอ โซ่เอซิลในกรดไขมันถูกขยายโดยวัฏจักรปฏิกิริยาที่เติมหมู่เอซิล, รีดิวซ์เป็นแอลกอฮอล์, ขจัดน้ำออก (dehydrate) ไปเป็นหมู่แอลคีน และจากนั้นรีดิวซ์อีกครั้งหนึ่งเป็นหมู่แอลเคน เอนไซม์ของชีวสังเคราะห์กรดไขมันแบ่งได้เป็นสองกลุ่ม ในสัตว์และฟังไจ ปฏกิริยาการสังเคราะห์กรดไขมันทั้งหมดเหล่านี้ดำเนินโดยโปรตีนไทป์ 1 หลายหน้าที่ตัวเดียว ขณะที่ในพลาสติดพืชและแบคทีเรียแยกเอนไซม์ไทป์ 2 ไว้ดำเนินการแต่ละขั้นในวิถี
เทอร์พีนและไอโซพรีนอยด์เป็นลิพิดกลุ่มใหญ่ที่รวมไปถึงแคโรทีนอยด์ และเป็นผลิตภัณฑ์ธรรมชาติจากพืชกลุ่มใหญ่ที่สุด[71] สารประกอบเหล่านี้สร้างโดยการรวมและการเปลี่ยนหน่วยไอโซพรีนที่ได้จากสารตั้งต้นที่เกิดปฏิกิริยาได้ ไอโซเพนทีนิลไพโรฟอสเฟต (isopentenyl pyrophosphate) และไดเมทิลอัลลิลไพโรฟอสเฟต (dimethylallyl pyrophosphate)[72] สารตั้งต้นเหล่านี้สามารถใช้ได้ในวิถีต่าง ๆ ในสัตว์และอาร์เคีย วิถีเมวาโลเนต (mevalonate pathway) ผลิตสารประกอบจากอะซีติลโค เอ[73] ขณะที่ในพืชและแบคทีเรีย วิถีนอนเมวาโลเนต (non-mevalonate pathway) ใช้ไพรูเวตและกลีเซอรอลดีไฮด์ 3-ฟอสเฟตเป็นสารตั้งต้น[72][74] ปฏิกิริยาที่สำคัญหนึ่งที่ใช้ตัวให้ไอโซพรีนกัมมันต์เหล่านี้ คือ ชีวสังเคราะห์สเตอรอยด์ ซึ่งหน่วยไอโซพรีนถูกเชื่อมเข้าด้วยกันและสร้างเป็นสควอลีน (squalene) และจากนั้น จะพับและเกิดเป็นกลุ่มวงแหวนเพื่อสร้างลาโนสเตอรอล (lanosterol)[75] ลาโนเสอรอลจากนั้นสามารถถูกเปลี่ยนให้เป็นสเตอรอลชนิดอื่นได้ อย่างคอเลสเตอรอลและเออร์โกสเตอรอล (ergosterol)[75][76]
โปรตีน[แก้]
สิ่งมีชีวิตมีความสามารถในการสังเคราะห์กรดอะมิโนสามัญ 20 ชนิดแตกต่างกัน แบคทีเรียและพชส่วนมากสามารถสังเคราะห์ได้ครบทั้งหมด แต่ในสัตว์เลี้ยงลูกด้วยน้ำนมสามารถสังเคราะห์ได้เพียงกรดอะมิโนไม่จำเป็นสิบเอ็ดชนิด ดังนั้น กรดอะมิโนจำเป็นอีกเก้าชนิดจึงต้องได้รับจากอาหาร[10] ปรสิตสามัญบางชนิด เช่น แบคทีเรีย Mycoplasma pneumoniae ขาดการสังเคราะห์กรดอะมิโนทั้งหมด และรับกรดอะมิโนจากโฮสต์ไปใช้โดยตรง[77] กรดอะมิโนทั้งหมดถูกสังเคราะห์จากสารตัวกลางในไกลโคไลสิส วัฏจักรเครปส์ หรือวิถีเพนโตสฟอสเฟต กลูตาเมตและกลูตามีนเป็นตัวให้ไนโตรเจน การสังเคราะห์กรดอะมิโนขึ้นอยู่กับรูปแบบของหมู่แอลฟาคีโตที่เหมาะสม ซึ่งจากนั้นจะถูกเติมหมู่อะมิโน (transaminate) เพื่อสร้างเป็นกรดอะมิโน[78]
กรดอะมิโนถูกสร้างเป็นโปรตีนโดยการเชื่อมต่อกันในสายโซ่ด้วยพันธะเปปไทด์ โปรตีนแต่ละตัวมีลำดับหน่วยย่อยกรดอะมิโนแตกต่างกัน นี่คือโครงสร้างปฐมภูมิ กรดอะมิโนสามารถเชื่อมกันในลำดับต่าง ๆ เพื่อสร้างเป็นโปรตีนหลากชนิด โปรตีนถูกสร้างจากกรดอะมิโนซึ่งถูกกระตุ้นโดยการยึดกับโมเลกุลอาร์เอ็นเอถ่ายโอน (transfer RNA) ด้วยพันธะเอสเทอร์ สารตั้งต้นอะมิโนเอซิล-ทีอาร์เอ็นเอ (aminoacyl-tRNA) นี้ถูกสร้างขึ้นในปฏิกิริยาที่อาศัย ATP ซึ่งดำเนินโดยเอนไซม์ aminoacyl tRNA synthetase[79] อะมิโนเอซิล-ทีอาร์เอ็นเอนี้จะเป็นสารตั้งต้นแก่ไรโบโซม ซึ่งเชื่อมกรดอะมิโนเข้ากับสายโปรตีนที่กำลังยืด โดยใช้ลำดับข้อมูลในอาร์เอ็นเอนำรหัส (messenger RNA) ต่อไป[80]
การสังเคราะห์นิวคลีโอไทด์และการกู้คืน[แก้]
นิวคลีโอไทด์สร้างมาจากกรดอะมิโน คาร์บอนไดออกไซด์และกรดฟอร์มิกในวิถีซึ่งต้องการพลังงานเมแทบอลิกปริมาณมาก[81] ดังนั้น สิ่งมีชีวิตส่วนมากมีระบบที่มีประสิทธิภาพในการกู้คืน (salvage) นิวคลีโอไทด์ที่ก่อรูปแล้ว[81][82] พิวรีนถูกสังเคราะห์เป็นนิวคลีโอไซด์ (เบสต่อกับไรโบส) ทั้งอะดีนีนและกวานีนล้วนสร้างมาจากนิวคลีโอไซด์สารตั้งต้น อินโนซีนมอโนฟอสเฟต (inosine monophosphate) ซึ่งถูกสังเคราะห์โดยใช้อะตอมจากกรดอะมิโน ไกลซีน กลูตามีนและกรดแอสปาติก เช่นเดียวกับฟอร์เมตที่ถูกย้ายมาจากโคเอนไซม์เตตระไฮโดรโฟเลต (tetrahydrofolate) ขณะที่ไพริมิดีนสังเคราะห์จากเบสโอโรเตต (orotate) ซึ่งสร้างจากกลูตามีนและแอสปาเตต[83]
สารแปลกปลอมและปฏิกิริยารีด็อกซ์[แก้]
สิ่งมีชีวตทุกชนิดได้รับสารประกอบที่ไม่สามารถใช้เป็นอาหารได้อยู่ตลอดเวลาและอาจเกิดอันตรายได้หากสารนั้นสะสมอยู่ในเซลล์ เพราะไม่มีหน้าที่ทางเมแทบอลิซึม สารประกอบที่อาจเป็นอันตรายนี้เรียก สารแปลกปลอม (xenobiotics)[84] สารแปลกปลอมอย่างเช่นยาสังเคราะห์ พิษตามธรรมชาติและยาปฏิชีวนะมีการขจัดพิษโดยเอ็นไซม์เมแทบอไลซ์สารแปลกปลอมชุดหนึ่ง ในมนุษย์เอ็นไซม์เหล่านี้ได้แก่ ไซโทโครม พี450 ออกซิเดส[85] ยูดีพี-กลูคูโรโนซิลทรานสเฟอเรส[86] และกลูตาไธโอน เอส-ทรานสเฟอเรส[87] ระบบเอ็นไซม์นี้ทำหน้าที่เป็นสามขั้น ขั้นแรกออกซิไดซ์สารแปลกปลอมแล้วขั้นที่สองคอนจูเกตหมู่ละลายน้ำได้บนโมเลกุล สารแปลกปลอมที่ถูกดัดแปลงให้ละลายน้ำได้สามารถถูกขับออกจากเซลล์และในสิ่งมีชีวิตหลายเซลล์อาจมีเมแทบอลิซึมเพิ่มเติมก่อนถูกขับออก (ขั้นที่สาม) ในนิเวศวิทยา ปฏิกิริยาเหล่านี้มีความสำคัญเป็นพิเศษในการย่อยสลายสารมลพิษทางชีวภาพของจุลชีพและมลพิษชีวบำบัด (bioremediation) ซึ่งดินที่ปนเปื้อนและการรั่วไหลของน้ำมัน[88] ปฏิกิริยาของจุลชีพเหล่านี้หลายชนิดมีความคล้ายกับสิ่งมีชีวิตหลายเซลล์ แต่เนื่องจากมีจุลชีพหลายชนิดกว่ามาก สิ่งมีชีวิตเหล่านี้สามารถรับมือกับสารแปลกปลอมได้มากมายกว่าสิ่งมีชีวิตหลายเซลล์ และสามารถย่อยสลายแม้แต่สารมลิพษที่คงทนอย่างสารประกอบออร์กาโนคลอรีน[89]
ปัญหาที่สัมพันธ์สำหรับสิ่งมีชีวิตใช้ออกซิเจนคือความเครียดออกซิเดชัน (oxidative stress)[90] กระบวนการรวมถึงปฏิกิริยาออกซิเดทีฟฟอสโฟรีเลชันและการสร้างพันธะไดซัลไฟด์ระหว่างการพับโปรตีนทำให้เกิดสารอนุมูลอิสระอย่างไฮโดรเจนเปอร์ออกไซด์[91] เมแทบอไลต์ต้านอนุมูลอิสระ เช่น กลูตาไธโอน และเอ็นไซม์อย่างแคตะเลสและเปอร์ออกซิเดสกำจัดสารออกซิเจนเป็นอันตรายเหล่านี้[92][93]
อุณหพลศาสตร์ของสิ่งมีชีวิต[แก้]
สิ่งมีชีวิตต้องอยู่ภายใต้กฎของอุณหพลศาสตร์ ซึ่งอธิบายการถ่ายทอดความร้อนและงาน กฎข้อที่สองของอุณหพลศาสตร์ระบุว่าในระบบปิดใด ๆ ปริมาณของเอนโทรปีจะไม่มีทางลดลง แม้ความซับซ้อนที่น่าทึ่งของสิ่งมีชีวิตดูเหมือนขัดต่อกฎนี้ แต่ชีวิตเกิดขึ้นได้เพราะสิ่งมีชีวิตเป็นระบบเปิดที่แลกเปลี่ยนสสารและพลังงานกับสิ่งแวดล้อม ฉะนั้นสิ่งมีชีวิตจึงไม่อยู่ในสมดุล แต่เป็นระบบกระจาย (dissipative system) ที่ธำรงสถานะความซับซ้อนสูงโดยทำให้เพิ่มเอนโทรปีในสิ่งแวดล้อมแทน[94] เมแทบอลิซึมของเซลล์ทำให้เกิดกระบวนการนี้ได้โดยรวมกระบวนการแคแทบอลิซึมที่เกิดเองกับกระบวนการแอแนบอลิซึมที่ไม่เกิดเอง[95]
การกำกับและควบคุม[แก้]
เนื่องจากสิ่งแวดล้อมของสิ่งมีชีวิตส่วนใหญ่มีการเปลี่ยนแปลงตลอดเวลา ปฏิกิริยาเมแทบอลิซึมต้องมีการกำกับอย่างละเอียดเพื่อธำรงภาวะต่าง ๆ ภายในเซลล์ในคงที่ เรียก ภาวะธำรงดุล[96][97] การกำกับเมแทบอลิกยังทำให้สิ่งมีชีวิตตอบสนองต่อสัญญาณและมีอันตรกิริยาต่อสิ่งแวดล้อม[98] มีมโนทัศน์ที่เชื่อมโยงกันใกล้ชิดสองอย่างที่สำคัญต่อการทำความเข้าใจการควบคุมวิถีเมแทบอลิก อย่างแรกคือการกำกับเอ็นไซม์ในวิถีเป็นวิธีที่เอ็นไซม์เพิ่มหรือลดการตอบสนองต่อสัญญาณ อย่างที่สองคือการควบคุมจากเอนไซม์นี้เป็นฤทธิ์ที่การเปลี่ยนแปลงกัมมันตภาพของเอ็นไซม์มีผลต่ออัตราเร็วโดยรวมของวิถี (ฟลักซ์ผ่านวิถี)[99] ตัวอย่างเช่น เอ็นไซม์อาจมีการเปลี่ยนแปลงกัมมันติภาพสูง (คือมีการกำกับสูง) แต่ถ้าการเปลี่ยนแปลงเหล่านี้มีผลเล็กน้อยต่อฟลักซ์ของวิถีเมแทบอลิก หมายความว่าเอ็นไซม์นั้นจะไม่เกี่ยวข้องในการควบคุมวิถี[100]
มีการควบคุมเมแทบอลิกหลายระดับ ในการกำกับภายใน วิถีเมแทบอลิกกำกับตัวเองในการตอบสนองต่อการเปลี่ยนแปลงสารตั้งต้นหรือผลิตภัณฑ์ ตัวอย่างเช่น การลดปริมาณของผลิตภัณฑ์สามารถเพิ่มฟลักซ์ผ่านวิถีเพื่อชดเชย[99] การกำกะบประเภทนี้มักเกี่ยวข้องกับการกำกับอัลโลสเตอริก (allosteric) ของกัมมันตภาพของเอ็นไซม์หลายตัวในวิถี[101] การควบคุมภายนอกเกี่ยวข้องกับเซลล์ในสิ่งมีชีวิตหลายเซลล์เปลี่ยนแปลงเมแทบอลิซึมของมันเพื่อตอบสนองต่อสัญญาณจากเซลล์อื่น สัญญาฯ้หล่านี้ปกติอยู่ในรูปสารละลายน้ำได้อย่างฮอร์โมนหรือโกรทแฟกเตอร์ และตรวจจับโดยใช้ตัวรับจำเพาะบนผิวเซลล์[102] สัญญาณเหล่านี้มีการส่งผ่านภายในเซลล์โดยระบบสารส่งสัญญาณที่สองซึ่งเกี่ยวข้องกับการเติมหมู่ฟอสเฟตของโปรตีน[103]
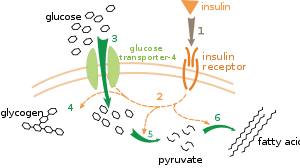
ตัวอย่างที่มีความเข้าใจดีมากของการควบคุมภายนอกหนึ่งคือการควบคุมเมแทบอลิซึมของกลูโคสโดยฮอร์โมนอินซูลิน[104] มีการผลิตอินซูลินเพื่อตอบสนองต่อการเพิ่มระดับกลูโคสในเลือด การจับของฮอร์โมนกับตัวรับอินซูลินบนผิวเซลล์จะปลุกฤทธิ์ลำดับของโปรตีนไคเนสซึ่งจพทำให้เซลล์รับกลูโคสเข้าไปและแปลงเป็นโมเลกุลสะสมอย่างกรดไขมันและไกลโคเจน[105] กัมมันตภาพของฟอสโฟรีเลสและไกลโคเจนซินเทสควบคุมเมแทบอลิซึมของไกลโคเจน ซึ่งทำหน้าที่ย่อยสลายไกลโคเจนและสร้างไกลโคเจนตามลำดับ เอ็นไซม์ดังกล่าวมีการกำกับแบบย้อนกลับ โดยเมื่อเอ็นไซม์เหล่านี้เติมหมู่ฟอสเฟตแล้วจะยับยั้งไกลโคเจนซินเทสแต่ปลุกฤทธิ์ฟอสโฟรีเลส อินซูลินทำให้เกิดการสังเคราะห์ไกลโคเจนโดยปลุกฤทธิ์โปรตีนฟอสฟาเตสและทำให้เกิดการผลิตรูปเติมฟอสเฟตของเอ็นไซม์เหล่านี้ลดลง[106]
วิวัฒนาการ[แก้]

วิถีเมแทบอลิซึมกลางดังอธิบายไว้ข้างต้น เช่น ไกลโคไลซิสและวัฏจักรกรดซิตริก มีอยู่ในสิ่งมีชีวิตทั้งสามโดเมน และมีอยู่ในบรรพบุรุษร่วมที่ใกล้กันที่สุดของสิ่งมีชีวิตบนโลก[5][107] เซลล์บรรพบุรุษร่วมที่ใกล้กันที่สุดนี้เป็นโพรแคริโอต และอาจเป็นเมทาโนเจนซึ่งมีเมแทบอลิซึมของกรดอะมิโน นิวคลีโอไทด์และลิพิดอย่างกว้างขวาง[108][109] การคงวิถีโบราณดังนี้ระหว่างวิวัฒนาการในเวลาต่อมาอาจเป็นผลจากปฏิกิริยาเหล่านี้เป็นทางแก้ที่เหมาะที่สุดสำหรับปัญหาเมแทบอลิกจำเพาะของสิ่งมีชีวิต โดยวิถีอย่างไกลโคไลซิสและวัฏจักรกรดซิตริกที่ผลิตผลิตภัณฑ์สุดท้ายมีประสิทธิภาพสูงและใช้ขั้นตอนน้อยที่สุด[6][7] วิถีแรก ๆ ของเมแทบอลิซึมที่ใช้เอ็นไซม์อาจเป็นส่วนหนึ่งของเมแทบอลิซึมของนิวคลีโอไทด์พิวรีน ส่วนวิถีเมแทบอลิกก่อนหน้านี้เป็นส่วนหนึ่งของโลกอาร์เอ็นเอโบราณ[110]
มีการเสนอแบบจำลองหลายอย่างเพื่ออธิบายกลไกที่วิถีเมแทบอลิกใหม่ ๆ วิวัฒน์ขึ้น ซึ่งรวมการเพิ่มโดยลำดับของเอ็นไซม์ใหม่ในวิถีโบราณสั้น การทำเป็นคู่แล้วเบนออกของทั้งวิถีตลอดจนการระดมเอ็นไซม์ที่มีอยู่เดิมและการประกอบเข้าเป็นวิถีปฏิกิริยาใหม่[111] ความสำคัญสัมพัทธ์ของกลไกเหล่านี้ยังไม่ชัดเจน แต่การศึกษาจีโนมได้แสดงว่าเอ็นไซม์ในวิถีหนึ่งน่าจะมีบรรพบุรุษร่วมกัน แนะว่าวิถีหลายวิถีวิวัฒน์แบบทีละขั้นโดยมีการสร้างหน้าที่ใหม่จากขั้นตอนเดิมในวิถีนั้น[112] อีกแบบจำลองหนึ่งมาจากการศึกษาซึ่งสืบย้อนวิวัฒนาการของโครงสร้างโปรตีนในเครือข่ายเมแทบอลิก ซึ่งเสนอว่ามีการระดมเอ็นไซม์มาใช้อย่างแพร่หลาย ยืมเอ็นไซม์เพื่อทำหน้าที่คล้ายกันในวิถีเมแทบอลิกอื่น (ดังหลักฐานในฐานข้อมูลมาเน็ต)[113] กระบวนการระดมทำให้เกิดโมเสกเอ็นไซม์วิวัฒนาการ[114] ความน่าจะเป็นที่สามคือเมแทบอลิซึมบางส่วนอาจมีอยู่เป็น "มอดูล" ที่สามารถใช้ใหม่ได้ในวิถีต่าง ๆ และดำเนินหน้าที่คล้ายกันต่อโมเลกุลอื่น[115]
เช่นเดียวกับวิวัฒนาการของวิถีเมแทบอลิกใหม่ วิวัฒนาการยังก่อให้เกิดการเสียหน้าที่เมแทบอลิก ตัวอย่างเช่น ในกระบวนการเมแทบอลิกปรสิตบางชนิดที่ไม่จำเป็นต่อการดำรงชีพเสียไปและกรดอะมิโน นิวคลีโอไทด์และคาร์โบไฮเดรตที่สร้างไว้แล้วอาจถูกขับออกจากโฮสต์แทน[116] ขีดความสามารถเมทแบอลิกที่ลดลงคล้ายกันพบในสิ่งมีชีวิตสมชีพภายใน (endosymbiotic)[117]
การชันสูตรและการดัดแปลง[แก้]

แต่เดิมการศึกษาเมแทบอลิซึมเป็นแบบแนวทางลดทอนซึ่งมุ่งสนใจวิถีเมแทบอลิกเดี่ยว ๆ การศึกษาที่มีประโชน์อย่างยิ่งได้แก่การใช้สารกัมมันตรังสีตามรอยกับสิ่งมีชีวิตทั้งตัว ระดับเนื้อเยื่อและเซลล์ ซึ่งนิยามวิถีจากสารตั้งต้นจนถึงผลิตภัณฑ์สุดท้ายโดยการระบุสารตัวกลางและผลิตภะณฑ์ที่มีฉลากกัมมันตรังสี[118] เอ็นไซม์ที่เร่งปฏิกิริยาเคมีเหล่านี้สามารถทำให้บริสุทธิ์ได้และมีการชันสูตรจลนสาสตร์และการตอบสนองต่อตัวยับยั้ง แนวทางขนานเป็นการระบุโมเลกุลขนาดเล็กในเซลล์หรือเนื่อเยื่อ ชุดสมบูรณ์ของโมเลกุลเหล่านี้เรียก เมทาโบโลม (metabolome) โดยรวม การศึกษาเหล่านี้ให้มุมมองที่ดีของโครงสร้างและการทำหน้าที่ของวิถีเมแทบอลิกอย่างง่าย แต่ไม่เพียงพอเมื่อใช้กับระบบที่ซับซ้อนมากขึ้นอย่างเช่นเมแทบอลิซึมของเซลล์สมบูรณ์[119]
ความคิดความซับซ้อนของเครือข่ายเมแทบอลิกในเซลล์ซึ่งบรรจุเอ็นไซม์หลายพันเอนไซม์สามารถดูได้จากรูปแสดงอันตรกิริยาระหว่างโปรตีน 43 ตัวและเมแทบอไลต์ 40 ตัวด้านขวามือ ลำดับของจีโนมให้รายการแสดงยีนได้มากสุด 45,000 ยีน[120] ทว่า การใช้ข้อมูลจีโนมเพื่อสร้างใหม่ซึ่งเครือข่ายปฏิกิริยาชีวเคมีอย่างสมบูรณ์เป็นไปได้และผลิตแบบจำลองคณิตศาสตร์แบบองค์รวมยิ่งขึ้นซึ่งอาจอธิบายและพยากรณ์พฤติกรรมของพวกมันได้[121] แบบจำลองเหล่านี้ทรงพลังเป็นพิเศษเมื่อใช้รวมข้อมูลวิถีและเมแทบอไลต์ที่ได้มาผ่านวิธีการคลาสสิกกับข้อมูลการแสดงออกของยีนจากการศึกษาโปรตีโอมิกส์ (preteomic) และดีเอ็นไอไมโครอะเรย์ (DNA microarray)[122] ปัจจุบันมีการใช้เทคนิคเหล่านี้ผลิตแบบจำลองเมแทบอลิซึมของมนุษย์ ซึ่งจะชี้นำการค้นพบยาและการวิจัยชีวเคมีในอนาคต[123] ปัจจุบันแบบจำลองเหล่านี้ใช้ในการวิเคราะห์เครือข่ายเพื่อจำแนกหมวดโรคของมนุษย์เป็นกลุ่มที่มีโปรตีนหรือเมแทบอไลต์ร่วมกัน[124][125]
เครือข่ายเมแทบอลิกของแบคทีเรียเป็นตัวอย่างที่สะดุดตาของการจัดระเบียบแบบ "หูกระต่าย" (bow-tie)[126][127][128] ซึ่งเป็นสถาปัตยกรรมที่สามารถรับสารอาหารเข้าได้หลากหลายและผลิตผลิตภัณฑ์และสารโมเลกุลใหญ่ซับซ้อนได้โดยใช้การหมุนเวียนร่วมตัวกลางค่อนข้างน้อย
การใช้สารสนเทศนี้ทางเทคโนโลยีที่สำคัญ คือ วิศวกรรมเมแทบอลิก ที่นี่สิ่งมีชีวิตอย่างยีสต์ พืชหรอแบคทีเรียมีการดัดแปรพันธุกรรมเพื่อทำให้พวกมันมีประโยชน์ในเทคโนโลยีชีวภาพมากขึ้นและช่วยการผลิตยาอย่างยาปฏิชีวนะและสารเคมีอุตสาหกรรมอย่าง 1,3-โพรพาเนไดออล (1,3-propanediol) และกรดชิคิมิก[129] การดัดแปรพันธุกรรมเหล่านี้ปกติมีเป้าหมายเพื่อลดปริมาณพลังงานที่ใช้ผลิตผลิตภัณฑ์ เพิ่มผลผลิตและลดการผลิตของเสีย[130]
ประวัติศาสตร์[แก้]
ส่วนต่าง ๆ ของสัตว์ (The Parts of Animals) ของอาริสโตเติลบันทึกรายละเอียดของทัศนะของเขาต่อเมแทบอลิซึมพอให้สร้างแบบจำลองการไหลเปิดได้ เขาเชื่อว่าในกระบวนการแต่ละขั้น มีการแปลงวัสดุจากอาหาร โดยมีการปลดปล่อยความร้อนเป็นธาตุไฟคลาสสิก และวัสดุที่เหลือถูกขับออกในรูปปัสสาวะ น้ำดีหรืออุจจาระ[131]
อิบน์ อัล-นะฟิส (Ibn al-Nafis) อธิบายเมแทบอลิซึมในงานชื่อ الرسالة الكاملية في السيرة النبوية (ศาสตร์นิพนธ์กะมิลว่าด้วยชีวประวัติของศาสดา) ซึ่งมีวลีต่อไปนี้ "ทั้งร่างกายและส่วนประกอบของมันอยู่ในสถานะสลายและได้รับการบำรุงต่อเนื่อง ฉะนั้นจึงต้องเปลี่ยนแปลงถาวรอย่างเลี่ยงไม่ได้"[132] ประวัติศาสตร์การศึกษาทางวิทยาศาสตร์ของเมแทบอลิซึมกินเวลาหลายศตวรรษและเปลี่ยนจากการตรวจสอบสัตว์ทั้งตัวในการศึกษาแรก ๆ มาเป็นการศึกษาปฏิกิริยาเมแทบอลิกเดี่ยว ๆ ในชีวเคมีสมัยใหม่ การทดลองเรื่องเมแทบอลิซึมของมนุษย์ที่มีการควบคุมครั้งแรกมีการจัดพิมพ์โดยซันโตรีโอ ซันโตรีโอในหนังสืออาส์เดสตาตีกาเมดีซีนา (Ars de statica medicina) ค.ศ. 1614[133] เขาอธิบายน้ำหนักของเขาก่อนและหลังการกิน นอน ทำงาน ร่วมเพศ อดอาหาร ดื่มและขับถ่าย เขาพบว่าอาหารส่วนใหญ่ที่เขารับประทานเสียไปกับสิ่งที่เรียก "การออกเหงื่อสัมผัสไม่ได้"
ในการศึกษาแรก ๆ เหล่านี้ ไม่มีการระบุกลไกกระบวนการเมแทบอลิกเหล่านี้และคิดกันว่าพลังชีพเป็นสิ่งที่ทำให้เนื้อเยื่อสิ่งมีชีวิตมีชีวิต[134] ในคริสต์ศตวรรษที่ 19 ขณะกำลังศึกษาการหมักน้ำตาลเป็นแอลกอฮอล์ของยีสต์ หลุยส์ ปาสเตอร์สรุปว่า การหมักถูกเร่งปฏิกิริยาโดยสารที่อยู่ในเซลล์ยีสต์ซึ่งเขาเรียกว่า "เอ็นไซม์" (ferments) เขาเขียนว่า "การหมักแอลกอฮอล์เป็นการกระทำที่ต้องกันกับชีวิตและการจัดระเบียบของเซลล์ยีสต์ ไม่ใช่กับความตายหรือการเน่าสลายของเซลล์"[135] การค้นพบนี้ ร่วมกับการจัดพิมพ์ของฟรีดริช เวอเลอร์ใน ค.ศ. 1828 ของเอกสารว่าด้วยการสังเคราะห์เคมียูเรีย[136] และมีความสำคัญที่เป็นสารประกอบอินทรีย์แรกที่เตรียรมขึ้นจากสารตั้งต้นอนินทรีย์ทั้งหมด อันเป็นการพิสูจน์ว่าสารประกอบอินทรีย์และปฏิกิริยาเคมีที่พบในเซลล์ไม่มีความแตกต่างในหลักการกับเคมีส่วนอื่น
การค้นพบเอ็นไซม์ (enzyme) ในช่วงต้นคริสต์ศตวรรษที่ 20 โดยเอดูอาร์ด บุชเนอร์เป็นการแยกการศึกษาปฏิกิริยาเคมีเมแทบอลิซึมจากการศึกษาทางชีวภาพของเซลล์ และเป็นจุดเริ่มต้นของวิชาชีวเคมี[137] ปริมาณความรู้ด้านชีวเคมีเพิ่มขึ้นอย่างรวดเร็วตลอดต้นคริสต์ศตวรรษที่ 20 นักชีวเคมีสมัยใหม่ที่สำคัญที่สุดคนหนึ่ง คือ ฮันส์ เครบส์ ซึ่งเป็นส่วนสำคัญต่อการศึกษาเมแทบอลิซึม[138] เขาค้นพบวัฏจักรยูเรียและต่อมารวมถึงวัฏจักรกรดซิตริกและวัฏจักรไกลออกซีเลต[139][66] โดยทำงานร่วมกับฮันส์ คอร์นเบิร์ก การวิจัยชีวเคมีสมัยใหม่ได้รับการช่วยเหลืออย่างมากจากการพัฒนาเทคนิคใหม่อย่างโครมาโทกราฟี การเลี้ยวเบนของรังสีเอกซ์ เอ็นเอ็มอาร์สเปกโตรสโคปี การติดฉลากไอโซโทปกัมมันตรังสี กล้องจุลทรรศน์อิเล็กตรอน และแบบจำลองพลวัตโมเลกุล เทคนิคเหล่านี้ทำให้เกิดการค้นพบและดารวิเคราะห์ในรายละเอียดของหลายโมเลกุลและวิถีเมแทบอลิกในเซลล์
ดูเพิ่ม[แก้]
อ้างอิง[แก้]
- ↑ ศัพท์บัญญัติราชบัณฑิตยสถาน สาขาพฤกษศาสตร์ ๑๘ ก.พ. ๒๕๔๕
- ↑ "สำเนาที่เก็บถาวร". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-08-21. สืบค้นเมื่อ 2018-08-26.
- ↑ 3.0 3.1 Friedrich C (1998). "Physiology and genetics of sulfur-oxidizing bacteria". Adv Microb Physiol. Advances in Microbial Physiology. 39: 235–89. doi:10.1016/S0065-2911(08)60018-1. ISBN 9780120277391. PMID 9328649.
- ↑ Pace NR (Jan 2001). "The universal nature of biochemistry". Proc. Natl. Acad. Sci. U.S.A. 98 (3): 805–8. Bibcode:2001PNAS...98..805P. doi:10.1073/pnas.98.3.805. PMC 33372. PMID 11158550.
- ↑ 5.0 5.1 Smith E, Morowitz H (2004). "Universality in intermediary metabolism". Proc Natl Acad Sci USA. 101 (36): 13168–73. Bibcode:2004PNAS..10113168S. doi:10.1073/pnas.0404922101. PMC 516543. PMID 15340153.
- ↑ 6.0 6.1 Ebenhöh O, Heinrich R (2001). "Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems". Bull Math Biol. 63 (1): 21–55. doi:10.1006/bulm.2000.0197. PMID 11146883.
- ↑ 7.0 7.1 Meléndez-Hevia E, Waddell T, Cascante M (1996). "The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution". J Mol Evol. 43 (3): 293–303. doi:10.1007/BF02338838. PMID 8703096.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ https://th.m.wikipedia.org/wiki/พันธะเพปไทด์
- ↑ Michie K, Löwe J (2006). "Dynamic filaments of the bacterial cytoskeleton". Annu Rev Biochem. 75: 467–92. doi:10.1146/annurev.biochem.75.103004.142452. PMID 16756499.
- ↑ 10.0 10.1 10.2 10.3 10.4 10.5 10.6 Nelson, David L.; Michael M. Cox (2005). Lehninger Principles of Biochemistry. New York: W. H. Freeman and company. p. 841. ISBN 0-7167-4339-6.
- ↑ Kelleher J, Bryan 3rd, B, Mallet R, Holleran A, Murphy A, and Fiskum G (1987). "Analysis of tricarboxylic acid-cycle metabolism of hepatoma cells by comparison of 14CO2 ratios". Biochem J. 246 (3): 633–639. doi:10.1042/bj2460633. PMC 1148327. PMID 3120698.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Hothersall, J & Ahmed, A (2013). "Metabolic fate of the increased yeast amino acid uptake subsequent to catabolite derepression". J Amino Acids. 2013: e461901. doi:10.1155/2013/461901. PMC 3575661. PMID 23431419.
- ↑ Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E (2005). "A comprehensive classification system for lipids". J Lipid Res. 46 (5): 839–61. doi:10.1194/jlr.E400004-JLR200. PMID 15722563. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-08-24. สืบค้นเมื่อ 2018-04-18.
- ↑ "Nomenclature of Lipids". IUPAC-IUB Commission on Biochemical Nomenclature (CBN). สืบค้นเมื่อ 2007-03-08.
- ↑ Hegardt F (1999). "Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis". Biochem J. 338 (Pt 3): 569–82. doi:10.1042/0264-6021:3380569. PMC 1220089. PMID 10051425.
- ↑ Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R (2005). "Glycomics: an integrated systems approach to structure-function relationships of glycans". Nat Methods. 2 (11): 817–24. doi:10.1038/nmeth807. PMID 16278650.
- ↑ Sierra S, Kupfer B, Kaiser R (2005). "Basics of the virology of HIV-1 and its replication". J Clin Virol. 34 (4): 233–44. doi:10.1016/j.jcv.2005.09.004. PMID 16198625.
- ↑ 18.0 18.1 Wimmer M, Rose I (1978). "Mechanisms of enzyme-catalyzed group transfer reactions". Annu Rev Biochem. 47: 1031–78. doi:10.1146/annurev.bi.47.070178.005123. PMID 354490.
- ↑ Mitchell P (1979). "The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems". Eur J Biochem. 95 (1): 1–20. doi:10.1111/j.1432-1033.1979.tb12934.x. PMID 378655.
- ↑ 20.0 20.1 20.2 20.3 Dimroth P, von Ballmoos C, Meier T (March 2006). "Catalytic and mechanical cycles in F-ATP synthases: Fourth in the Cycles Review Series". EMBO Rep. 7 (3): 276–82. doi:10.1038/sj.embor.7400646. PMC 1456893. PMID 16607397.
- ↑ Coulston, Ann; Kerner, John; Hattner, JoAnn; Srivastava, Ashini (2006). "Nutrition Principles and Clinical Nutrition". Stanford School of Medicine Nutrition Courses. SUMMIT.
- ↑ Pollak N, Dölle C, Ziegler M (2007). "The power to reduce: pyridine nucleotides – small molecules with a multitude of functions". Biochem J. 402 (2): 205–18. doi:10.1042/BJ20061638. PMC 1798440. PMID 17295611.
- ↑ 23.0 23.1 Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R (1991). "Chemical and elemental analysis of humans in vivo using improved body composition models". Am J Physiol. 261 (2 Pt 1): E190–8. PMID 1872381.
- ↑ Sychrová H (2004). "Yeast as a model organism to study transport and homeostasis of alkali metal cations" (PDF). Physiol Res. 53 Suppl 1: S91–8. PMID 15119939.
- ↑ Levitan I (1988). "Modulation of ion channels in neurons and other cells". Annu Rev Neurosci. 11: 119–36. doi:10.1146/annurev.ne.11.030188.001003. PMID 2452594.
- ↑ Dulhunty A (2006). "Excitation-contraction coupling from the 1950s into the new millennium". Clin Exp Pharmacol Physiol. 33 (9): 763–72. doi:10.1111/j.1440-1681.2006.04441.x. PMID 16922804.
- ↑ Mahan D, Shields R (1998). "Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight" (PDF). J Anim Sci. 76 (2): 506–12. PMID 9498359.
- ↑ Husted S, Mikkelsen B, Jensen J, Nielsen N (2004). "Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics". Anal Bioanal Chem. 378 (1): 171–82. doi:10.1007/s00216-003-2219-0. PMID 14551660.
- ↑ Finney L, O'Halloran T (2003). "Transition metal speciation in the cell: insights from the chemistry of metal ion receptors". Science. 300 (5621): 931–6. Bibcode:2003Sci...300..931F. doi:10.1126/science.1085049. PMID 12738850.
- ↑ Cousins R, Liuzzi J, Lichten L (2006). "Mammalian zinc transport, trafficking, and signals". J Biol Chem. 281 (34): 24085–9. doi:10.1074/jbc.R600011200. PMID 16793761. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-11-05. สืบค้นเมื่อ 2018-04-19.
- ↑ Dunn L, Rahmanto Y, Richardson D (2007). "Iron uptake and metabolism in the new millennium". Trends Cell Biol. 17 (2): 93–100. doi:10.1016/j.tcb.2006.12.003. PMID 17194590.
- ↑ Nealson K, Conrad P (1999). "Life: past, present and future". Philos Trans R Soc Lond B Biol Sci. 354 (1392): 1923–39. doi:10.1098/rstb.1999.0532. PMC 1692713. PMID 10670014.
- ↑ Häse C, Finkelstein R (Dec 1993). "Bacterial extracellular zinc-containing metalloproteases". Microbiol Rev. 57 (4): 823–37. PMC 372940. PMID 8302217.
- ↑ Gupta R, Gupta N, Rathi P (2004). "Bacterial lipases: an overview of production, purification and biochemical properties". Appl Microbiol Biotechnol. 64 (6): 763–81. doi:10.1007/s00253-004-1568-8. PMID 14966663.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Hoyle T (1997). "The digestive system: linking theory and practice". Br J Nurs. 6 (22): 1285–91. PMID 9470654.
- ↑ Souba W, Pacitti A (1992). "How amino acids get into cells: mechanisms, models, menus, and mediators". JPEN J Parenter Enteral Nutr. 16 (6): 569–78. doi:10.1177/0148607192016006569. PMID 1494216.
- ↑ Barrett M, Walmsley A, Gould G (1999). "Structure and function of facilitative sugar transporters". Curr Opin Cell Biol. 11 (4): 496–502. doi:10.1016/S0955-0674(99)80072-6. PMID 10449337.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bell G, Burant C, Takeda J, Gould G (1993). "Structure and function of mammalian facilitative sugar transporters". J Biol Chem. 268 (26): 19161–4. PMID 8366068.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 39.0 39.1 Bouché C, Serdy S, Kahn C, Goldfine A (2004). "The cellular fate of glucose and its relevance in type 2 diabetes". Endocr Rev. 25 (5): 807–30. doi:10.1210/er.2003-0026. PMID 15466941. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-12-04. สืบค้นเมื่อ 2012-07-27.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sakami W, Harrington H (1963). "Amino acid metabolism". Annu Rev Biochem. 32: 355–98. doi:10.1146/annurev.bi.32.070163.002035. PMID 14144484.
- ↑ Brosnan J (2000). "Glutamate, at the interface between amino acid and carbohydrate metabolism". J Nutr. 130 (4S Suppl): 988S–90S. PMID 10736367.
- ↑ Young V, Ajami A (2001). "Glutamine: the emperor or his clothes?". J Nutr. 131 (9 Suppl): 2449S–59S, discussion 2486S–7S. PMID 11533293.
- ↑ Hosler J, Ferguson-Miller S, Mills D (2006). "Energy Transduction: Proton Transfer Through the Respiratory Complexes". Annu Rev Biochem. 75: 165–87. doi:10.1146/annurev.biochem.75.062003.101730. PMC 2659341. PMID 16756489.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Schultz B, Chan S (2001). "Structures and proton-pumping strategies of mitochondrial respiratory enzymes". Annu Rev Biophys Biomol Struct. 30: 23–65. doi:10.1146/annurev.biophys.30.1.23. PMID 11340051.
- ↑ Capaldi R, Aggeler R (2002). "Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor". Trends Biochem Sci. 27 (3): 154–60. doi:10.1016/S0968-0004(01)02051-5. PMID 11893513.
- ↑ Friedrich B, Schwartz E (1993). "Molecular biology of hydrogen utilization in aerobic chemolithotrophs". Annu Rev Microbiol. 47: 351–83. doi:10.1146/annurev.mi.47.100193.002031. PMID 8257102.
- ↑ Weber K, Achenbach L, Coates J (2006). "Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction". Nat Rev Microbiol. 4 (10): 752–64. doi:10.1038/nrmicro1490. PMID 16980937.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J (1998). "The anaerobic oxidation of ammonium". FEMS Microbiol Rev. 22 (5): 421–37. doi:10.1111/j.1574-6976.1998.tb00379.x. PMID 9990725.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Simon J (2002). "Enzymology and bioenergetics of respiratory nitrite ammonification". FEMS Microbiol Rev. 26 (3): 285–309. doi:10.1111/j.1574-6976.2002.tb00616.x. PMID 12165429.
- ↑ Conrad R (1996). "Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO)". Microbiol Rev. 60 (4): 609–40. PMC 239458. PMID 8987358.
- ↑ Barea J, Pozo M, Azcón R, Azcón-Aguilar C (2005). "Microbial co-operation in the rhizosphere". J Exp Bot. 56 (417): 1761–78. doi:10.1093/jxb/eri197. PMID 15911555.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ van der Meer MT, Schouten S, Bateson MM, Nübel U, Wieland A, Kühl M, และคณะ (July 2005). "Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park". Applied and Environmental Microbiology. 71 (7): 3978–86. Bibcode:2005ApEnM..71.3978V. doi:10.1128/AEM.71.7.3978-3986.2005. PMC 1168979. PMID 16000812.
- ↑ Tichi M, Tabita F (2001). "Interactive Control of Rhodobacter capsulatus Redox-Balancing Systems during Phototrophic Metabolism". J Bacteriol. 183 (21): 6344–54. doi:10.1128/JB.183.21.6344-6354.2001. PMC 100130. PMID 11591679.
- ↑ Allen J, Williams J (1998). "Photosynthetic reaction centers". FEBS Lett. 438 (1–2): 5–9. doi:10.1016/S0014-5793(98)01245-9. PMID 9821949.
- ↑ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T (2004). "Cyclic electron flow around photosystem I is essential for photosynthesis". Nature. 429 (6991): 579–82. Bibcode:2004Natur.429..579M. doi:10.1038/nature02598. PMID 15175756.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Miziorko H, Lorimer G (1983). "Ribulose-1,5-bisphosphate carboxylase-oxygenase". Annu Rev Biochem. 52: 507–35. doi:10.1146/annurev.bi.52.070183.002451. PMID 6351728.
- ↑ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K (2002). "Crassulacean acid metabolism: plastic, fantastic". J Exp Bot. 53 (369): 569–80. doi:10.1093/jexbot/53.369.569. PMID 11886877. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-01-25. สืบค้นเมื่อ 2012-07-27.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S (May 2005). "Evidence for Autotrophic CO2 Fixation via the Reductive Tricarboxylic Acid Cycle by Members of the ɛ Subdivision of Proteobacteria". J Bacteriol. 187 (9): 3020–7. doi:10.1128/JB.187.9.3020-3027.2005. PMC 1082812. PMID 15838028.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Strauss G, Fuchs G (1993). "Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle". Eur J Biochem. 215 (3): 633–43. doi:10.1111/j.1432-1033.1993.tb18074.x. PMID 8354269.
- ↑ Wood H (1991). "Life with CO or CO2 and H2 as a source of carbon and energy". FASEB J. 5 (2): 156–63. PMID 1900793.
- ↑ Shively J, van Keulen G, Meijer W (1998). "Something from almost nothing: carbon dioxide fixation in chemoautotrophs". Annu Rev Microbiol. 52: 191–230. doi:10.1146/annurev.micro.52.1.191. PMID 9891798.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Boiteux A, Hess B (1981). "Design of glycolysis". Philos Trans R Soc Lond B Biol Sci. 293 (1063): 5–22. Bibcode:1981RSPTB.293....5B. doi:10.1098/rstb.1981.0056. PMID 6115423.
- ↑ Pilkis S, el-Maghrabi M, Claus T (1990). "Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics". Diabetes Care. 13 (6): 582–99. doi:10.2337/diacare.13.6.582. PMID 2162755.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 64.0 64.1 Ensign S (2006). "Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation". Mol Microbiol. 61 (2): 274–6. doi:10.1111/j.1365-2958.2006.05247.x. PMID 16856935.
- ↑ Finn P, Dice J (2006). "Proteolytic and lipolytic responses to starvation". Nutrition. 22 (7–8): 830–44. doi:10.1016/j.nut.2006.04.008. PMID 16815497.
- ↑ 66.0 66.1 Kornberg H, Krebs H (1957). "Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle". Nature. 179 (4568): 988–91. Bibcode:1957Natur.179..988K. doi:10.1038/179988a0. PMID 13430766.
- ↑ Rademacher T, Parekh R, Dwek R (1988). "Glycobiology". Annu Rev Biochem. 57: 785–838. doi:10.1146/annurev.bi.57.070188.004033. PMID 3052290.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rademacher T, Parekh R, Dwek R (1988). "Glycobiology". Annu Rev Biochem. 57: 785–838. doi:10.1146/annurev.bi.57.070188.004033. PMID 3052290.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Opdenakker G, Rudd P, Ponting C, Dwek R (1993). "Concepts and principles of glycobiology". FASEB J. 7 (14): 1330–7. PMID 8224606.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ McConville M, Menon A (2000). "Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review)". Mol Membr Biol. 17 (1): 1–16. doi:10.1080/096876800294443. PMID 10824734.
- ↑ Dubey V, Bhalla R, Luthra R (2003). "An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants" (PDF). J Biosci. 28 (5): 637–46. doi:10.1007/BF02703339. PMID 14517367.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 72.0 72.1 Kuzuyama T, Seto H (2003). "Diversity of the biosynthesis of the isoprene units". Nat Prod Rep. 20 (2): 171–83. doi:10.1039/b109860h. PMID 12735695.
- ↑ Grochowski L, Xu H, White R (May 2006). "Methanocaldococcus jannaschii Uses a Modified Mevalonate Pathway for Biosynthesis of Isopentenyl Diphosphate". J Bacteriol. 188 (9): 3192–8. doi:10.1128/JB.188.9.3192-3198.2006. PMC 1447442. PMID 16621811.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lichtenthaler H (1999). "The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants". Annu Rev Plant Physiol Plant Mol Biol. 50: 47–65. doi:10.1146/annurev.arplant.50.1.47. PMID 15012203.
- ↑ 75.0 75.1 Schroepfer G (1981). "Sterol biosynthesis". Annu Rev Biochem. 50: 585–621. doi:10.1146/annurev.bi.50.070181.003101. PMID 7023367.
- ↑ Lees N, Skaggs B, Kirsch D, Bard M (1995). "Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review". Lipids. 30 (3): 221–6. doi:10.1007/BF02537824. PMID 7791529.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Himmelreich R, Hilbert H, Plagens H, Pirkl E, Li BC, Herrmann R (Nov 1996). "Complete sequence analysis of the genome of the bacterium Mycoplasma pneumoniae". Nucleic Acids Res. 24 (22): 4420–49. doi:10.1093/nar/24.22.4420. PMC 146264. PMID 8948633.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Guyton, Arthur C.; Hall, John E. (2006). Textbook of Medical Physiology. Philadelphia: Elsevier. pp. 855–6. ISBN 0-7216-0240-1.
- ↑ Ibba M, Söll D (2001). "The renaissance of aminoacyl-tRNA synthesis". EMBO Rep. 2 (5): 382–7. doi:10.1093/embo-reports/kve095. PMC 1083889. PMID 11375928.
- ↑ Lengyel P, Söll D (1969). "Mechanism of protein biosynthesis". Bacteriol Rev. 33 (2): 264–301. PMC 378322. PMID 4896351.
- ↑ 81.0 81.1 Rudolph F (1994). "The biochemistry and physiology of nucleotides". J Nutr. 124 (1 Suppl): 124S–127S. PMID 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R (2006). "Pyrimidine and purine biosynthesis and degradation in plants". Annu Rev Plant Biol. 57: 805–36. doi:10.1146/annurev.arplant.57.032905.105421. PMID 16669783.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Stasolla C, Katahira R, Thorpe T, Ashihara H (2003). "Purine and pyrimidine nucleotide metabolism in higher plants". J Plant Physiol. 160 (11): 1271–95. doi:10.1078/0176-1617-01169. PMID 14658380.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Smith J (1995). "Enzymes of nucleotide synthesis". Curr Opin Struct Biol. 5 (6): 752–7. doi:10.1016/0959-440X(95)80007-7. PMID 8749362.
- ↑ Testa B, Krämer S (2006). "The biochemistry of drug metabolism—an introduction: part 1. Principles and overview". Chem Biodivers. 3 (10): 1053–101. doi:10.1002/cbdv.200690111. PMID 17193224.
- ↑ Danielson P (2002). "The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans". Curr Drug Metab. 3 (6): 561–97. doi:10.2174/1389200023337054. PMID 12369887.
- ↑ King C, Rios G, Green M, Tephly T (2000). "UDP-glucuronosyltransferases". Curr Drug Metab. 1 (2): 143–61. doi:10.2174/1389200003339171. PMID 11465080.
- ↑ Sheehan D, Meade G, Foley V, Dowd C (November 2001). "Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily". Biochem J. 360 (Pt 1): 1–16. doi:10.1042/0264-6021:3600001. PMC 1222196. PMID 11695986.
- ↑ Galvão T, Mohn W, de Lorenzo V (2005). "Exploring the microbial biodegradation and biotransformation gene pool". Trends Biotechnol. 23 (10): 497–506. doi:10.1016/j.tibtech.2005.08.002. PMID 16125262.
- ↑ Janssen D, Dinkla I, Poelarends G, Terpstra P (2005). "Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities". Environ Microbiol. 7 (12): 1868–82. doi:10.1111/j.1462-2920.2005.00966.x. PMID 16309386.
- ↑ Davies K (1995). "Oxidative stress: the paradox of aerobic life". Biochem Soc Symp. 61: 1–31. doi:10.1042/bss0610001. PMID 8660387.
- ↑ Tu B, Weissman J (2004). "Oxidative protein folding in eukaryotes: mechanisms and consequences". J Cell Biol. 164 (3): 341–6. doi:10.1083/jcb.200311055. PMC 2172237. PMID 14757749.
- ↑ Sies H (1997). "Oxidative stress: oxidants and antioxidants" (PDF). Exp Physiol. 82 (2): 291–5. doi:10.1113/expphysiol.1997.sp004024. PMID 9129943.
- ↑ Vertuani S, Angusti A, Manfredini S (2004). "The antioxidants and pro-antioxidants network: an overview". Curr Pharm Des. 10 (14): 1677–94. doi:10.2174/1381612043384655. PMID 15134565.
- ↑ von Stockar U, Liu J (1999). "Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth". Biochim Biophys Acta. 1412 (3): 191–211. doi:10.1016/S0005-2728(99)00065-1. PMID 10482783.
- ↑ Demirel Y, Sandler S (2002). "Thermodynamics and bioenergetics". Biophys Chem. 97 (2–3): 87–111. doi:10.1016/S0301-4622(02)00069-8. PMID 12050002.
- ↑ Albert R (2005). "Scale-free networks in cell biology". J Cell Sci. 118 (Pt 21): 4947–57. doi:10.1242/jcs.02714. PMID 16254242.
- ↑ Brand M (1997). "Regulation analysis of energy metabolism". J Exp Biol. 200 (Pt 2): 193–202. PMID 9050227.
- ↑ Soyer O, Salathé M, Bonhoeffer S (2006). "Signal transduction networks: topology, response and biochemical processes". J Theor Biol. 238 (2): 416–25. doi:10.1016/j.jtbi.2005.05.030. PMID 16045939.
- ↑ 99.0 99.1 Salter M, Knowles R, Pogson C (1994). "Metabolic control". Essays Biochem. 28: 1–12. PMID 7925313.
- ↑ Westerhoff H, Groen A, Wanders R (1984). "Modern theories of metabolic control and their applications (review)". Biosci Rep. 4 (1): 1–22. doi:10.1007/BF01120819. PMID 6365197.
- ↑ Fell D, Thomas S (1995). "Physiological control of metabolic flux: the requirement for multisite modulation". Biochem J. 311 (Pt 1): 35–9. PMC 1136115. PMID 7575476.
- ↑ Hendrickson W (2005). "Transduction of biochemical signals across cell membranes". Q Rev Biophys. 38 (4): 321–30. doi:10.1017/S0033583506004136. PMID 16600054.
- ↑ Cohen P (2000). "The regulation of protein function by multisite phosphorylation—a 25 year update". Trends Biochem Sci. 25 (12): 596–601. doi:10.1016/S0968-0004(00)01712-6. PMID 11116185.
- ↑ Lienhard G, Slot J, James D, Mueckler M (1992). "How cells absorb glucose". Sci Am. 266 (1): 86–91. doi:10.1038/scientificamerican0192-86. PMID 1734513.
- ↑ Roach P (2002). "Glycogen and its metabolism". Curr Mol Med. 2 (2): 101–20. doi:10.2174/1566524024605761. PMID 11949930.
- ↑ Newgard C, Brady M, O'Doherty R, Saltiel A (2000). "Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1" (PDF). Diabetes. 49 (12): 1967–77. doi:10.2337/diabetes.49.12.1967. PMID 11117996.
- ↑ Romano A, Conway T (1996). "Evolution of carbohydrate metabolic pathways". Res Microbiol. 147 (6–7): 448–55. doi:10.1016/0923-2508(96)83998-2. PMID 9084754.
- ↑ Koch A (1998). "How did bacteria come to be?". Adv Microb Physiol. Advances in Microbial Physiology. 40: 353–99. doi:10.1016/S0065-2911(08)60135-6. ISBN 978-0-12-027740-7. PMID 9889982.
- ↑ Ouzounis C, Kyrpides N (1996). "The emergence of major cellular processes in evolution". FEBS Lett. 390 (2): 119–23. doi:10.1016/0014-5793(96)00631-X. PMID 8706840.
- ↑ Caetano-Anolles G, Kim HS, Mittenthal JE (2007). "The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture". Proc Natl Acad Sci USA. 104 (22): 9358–63. Bibcode:2007PNAS..104.9358C. doi:10.1073/pnas.0701214104. PMC 1890499. PMID 17517598.
- ↑ Schmidt S, Sunyaev S, Bork P, Dandekar T (2003). "Metabolites: a helping hand for pathway evolution?". Trends Biochem Sci. 28 (6): 336–41. doi:10.1016/S0968-0004(03)00114-2. PMID 12826406.
- ↑ Light S, Kraulis P (2004). "Network analysis of metabolic enzyme evolution in Escherichia coli". BMC Bioinformatics. 5: 15. doi:10.1186/1471-2105-5-15. PMC 394313. PMID 15113413. Alves R, Chaleil R, Sternberg M (2002). "Evolution of enzymes in metabolism: a network perspective". J Mol Biol. 320 (4): 751–70. doi:10.1016/S0022-2836(02)00546-6. PMID 12095253.
- ↑ Kim HS, Mittenthal JE, Caetano-Anolles G (2006). "MANET: tracing evolution of protein architecture in metabolic networks". BMC Bioinformatics. 7: 351. doi:10.1186/1471-2105-7-351. PMC 1559654. PMID 16854231.
- ↑ Teichmann SA, Rison SC, Thornton JM, Riley M, Gough J, Chothia C (2001). "Small-molecule metabolsim: an enzyme mosaic". Trends Biotechnol. 19 (12): 482–6. doi:10.1016/S0167-7799(01)01813-3. PMID 11711174.
- ↑ Spirin V, Gelfand M, Mironov A, Mirny L (June 2006). "A metabolic network in the evolutionary context: Multiscale structure and modularity". Proc Natl Acad Sci USA. 103 (23): 8774–9. Bibcode:2006PNAS..103.8774S. doi:10.1073/pnas.0510258103. PMC 1482654. PMID 16731630.
- ↑ Lawrence J (2005). "Common themes in the genome strategies of pathogens". Curr Opin Genet Dev. 15 (6): 584–8. doi:10.1016/j.gde.2005.09.007. PMID 16188434. Wernegreen J (2005). "For better or worse: genomic consequences of intracellular mutualism and parasitism". Curr Opin Genet Dev. 15 (6): 572–83. doi:10.1016/j.gde.2005.09.013. PMID 16230003.
- ↑ Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L (2006). "Chance and necessity in the evolution of minimal metabolic networks". Nature. 440 (7084): 667–70. Bibcode:2006Natur.440..667P. doi:10.1038/nature04568. PMID 16572170.
- ↑ Rennie M (1999). "An introduction to the use of tracers in nutrition and metabolism". Proc Nutr Soc. 58 (4): 935–44. doi:10.1017/S002966519900124X. PMID 10817161.
- ↑ Phair R (1997). "Development of kinetic models in the nonlinear world of molecular cell biology". Metabolism. 46 (12): 1489–95. doi:10.1016/S0026-0495(97)90154-2. PMID 9439549.
- ↑ Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y (2007). "How many genes are there in plants (... and why are they there)?". Curr Opin Plant Biol. 10 (2): 199–203. doi:10.1016/j.pbi.2007.01.004. PMID 17289424.
- ↑ Borodina I, Nielsen J (2005). "From genomes to in silico cells via metabolic networks". Curr Opin Biotechnol. 16 (3): 350–5. doi:10.1016/j.copbio.2005.04.008. PMID 15961036.
- ↑ Gianchandani E, Brautigan D, Papin J (2006). "Systems analyses characterize integrated functions of biochemical networks". Trends Biochem Sci. 31 (5): 284–91. doi:10.1016/j.tibs.2006.03.007. PMID 16616498.
- ↑ Duarte NC, Becker SA, Jamshidi N, และคณะ (February 2007). "Global reconstruction of the human metabolic network based on genomic and bibliomic data". Proc. Natl. Acad. Sci. U.S.A. 104 (6): 1777–82. Bibcode:2007PNAS..104.1777D. doi:10.1073/pnas.0610772104. PMC 1794290. PMID 17267599.
- ↑ Goh KI, Cusick ME, Valle D, Childs B, Vidal M, Barabási AL (May 2007). "The human disease network". Proc. Natl. Acad. Sci. U.S.A. 104 (21): 8685–90. Bibcode:2007PNAS..104.8685G. doi:10.1073/pnas.0701361104. PMC 1885563. PMID 17502601.
- ↑ Lee DS, Park J, Kay KA, Christakis NA, Oltvai ZN, Barabási AL (July 2008). "The implications of human metabolic network topology for disease comorbidity". Proc. Natl. Acad. Sci. U.S.A. 105 (29): 9880–9885. Bibcode:2008PNAS..105.9880L. doi:10.1073/pnas.0802208105. PMC 2481357. PMID 18599447.
- ↑ Csete M, Doyle J (2004). "Bow ties, metabolism and disease". Trends Biotechnol. 22 (9): 446–50. doi:10.1016/j.tibtech.2004.07.007. PMID 15331224.
- ↑ Ma HW, Zeng AP (2003). "The connectivity structure, giant strong component and centrality of metabolic networks". Bioinformatics. 19 (11): 1423–30. CiteSeerX 10.1.1.605.8964. doi:10.1093/bioinformatics/btg177. PMID 12874056.
- ↑ Zhao J, Yu H, Luo JH, Cao ZW, Li YX (2006). "Hierarchical modularity of nested bow-ties in metabolic networks". BMC Bioinformatics. 7: 386. doi:10.1186/1471-2105-7-386. PMC 1560398. PMID 16916470.
- ↑ Thykaer J, Nielsen J (2003). "Metabolic engineering of beta-lactam production". Metab Eng. 5 (1): 56–69. doi:10.1016/S1096-7176(03)00003-X. PMID 12749845. González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P (2005). "Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol". Metab Eng. 7 (5–6): 329–36. doi:10.1016/j.ymben.2005.06.001. PMID 16095939. Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L (2003). "Metabolic engineering for microbial production of shikimic acid". Metab Eng. 5 (4): 277–83. doi:10.1016/j.ymben.2003.09.001. PMID 14642355.
- ↑ Koffas M, Roberge C, Lee K, Stephanopoulos G (1999). "Metabolic engineering". Annu Rev Biomed Eng. 1: 535–57. doi:10.1146/annurev.bioeng.1.1.535. PMID 11701499.
- ↑ Leroi, Armand Marie (2014). The Lagoon: How Aristotle Invented Science. Bloomsbury. pp. 400–401. ISBN 978-1-4088-3622-4.
- ↑ Dr. Abu Shadi Al-Roubi (1982), "Ibn Al-Nafis as a philosopher", Symposium on Ibn al-Nafis, Second International Conference on Islamic Medicine: Islamic Medical Organization, Kuwait (cf. Ibn al-Nafis As a Philosopher, Encyclopedia of Islamic World [1])
- ↑ Eknoyan G (1999). "Santorio Sanctorius (1561–1636) – founding father of metabolic balance studies". Am J Nephrol. 19 (2): 226–33. doi:10.1159/000013455. PMID 10213823.
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) Retrieved on 2007-03-26
- ↑ Dubos J. (1951). "Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822–1895)—chance and the prepared mind". Trends Biotechnol. 13 (12): 511–515. doi:10.1016/S0167-7799(00)89014-9. PMID 8595136.
- ↑ Kinne-Saffran E, Kinne R (1999). "Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs". Am J Nephrol. 19 (2): 290–4. doi:10.1159/000013463. PMID 10213830.
- ↑ Eduard Buchner's 1907 Nobel lecture at http://nobelprize.org Accessed 2007-03-20
- ↑ Kornberg H (2000). "Krebs and his trinity of cycles". Nat Rev Mol Cell Biol. 1 (3): 225–8. doi:10.1038/35043073. PMID 11252898.
- ↑ Krebs HA, Henseleit K (1932). "Untersuchungen über die Harnstoffbildung im tierkorper". Z. Physiol. Chem. 210: 33–66. doi:10.1515/bchm2.1932.210.1-2.33.
Krebs H, Johnson W (April 1937). "Metabolism of ketonic acids in animal tissues". Biochem J. 31 (4): 645–60. doi:10.1042/bj0310645. PMC 1266984. PMID 16746382.
แหล่งข้อมูลอื่น[แก้]
- Interactive Flow Chart of the Major Metabolic Pathways เก็บถาวร 2006-02-18 ที่ เวย์แบ็กแมชชีน
- Metabolism, Cellular Respiration and Photosynthesis - The Virtual Library of Biochemistry and Cell Biology เก็บถาวร 2005-03-16 ที่ เวย์แบ็กแมชชีน
- The Biochemistry of Metabolism at Rensselaer Polytechnic Institute เก็บถาวร 2013-11-22 ที่ เวย์แบ็กแมชชีน
- Flow Chart of Metabolic Pathways at ExPASy
- Santorio Santorio's experiments