การสร้างภาพประสาท

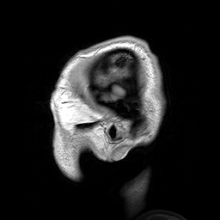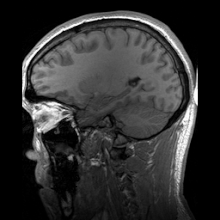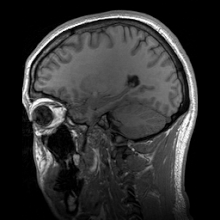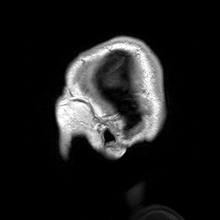
การสร้างภาพประสาท หรือ การสร้างภาพสมอง (อังกฤษ: Neuroimaging, brain imaging) เป็นการสร้างภาพทางการแพทย์ชนิดหนึ่ง คือการใช้เทคนิคต่าง ๆ เพื่อสร้างภาพทั้งโดยตรงหรือโดยอ้อมของโครงสร้าง หน้าที่ หรือการทำงานทางเภสัชวิทยา ของระบบประสาท เป็นศาสตร์ใหม่ที่ใช้ในการแพทย์ ประสาทวิทยา และจิตวิทยา[1] แพทย์ที่ชำนาญเฉพาะในการสร้างและตีความภาพสมองในสถานพยาบาลเรียกตามภาษาอังกฤษว่า neuroradiologist (ประสาทรังสีแพทย์) การสร้างภาพวิธีต่าง ๆ ตกอยู่ในหมวดกว้าง ๆ 2 หมวดคือ
- การสร้างภาพโครงสร้างของระบบประสาทและการวินิจฉัยโรคแบบคร่าว ๆ เช่น เนื้องอก และความบาดเจ็บในกะโหลกศีรษะ
- การสร้างภาพสมองโดยกิจ (Functional neuroimaging) เช่น fMRI ซึ่งใช้วินิจฉัยโรคทางเมแทบอลิซึมและรอยโรคในสมองที่ละเอียดยิ่งขึ้น (เช่น โรคอัลไซเมอร์) ใช้เพื่องานวิจัยทางประสาทวิทยาและทางจิตวิทยาประชาน และใช้สร้างส่วนต่อประสานระหว่างสมอง-คอมพิวเตอร์ (brain-computer interface) ยกตัวอย่างเช่น ใช้เพื่อแสดงภาพกระบวนการประมวลข้อมูลในสมองได้โดยตรง การประมวลเช่นนี้จะเพิ่มเมแทบอลิซึมในบริเวณต่าง ๆ ของสมอง ซึ่งเน้นเป็นสีต่าง ๆ ในภาพขึ้นอยู่กับระดับเมแทบอลิซึม
ส่วนการใช้ศาสตร์นี้โดยสร้างความขัดแย้งมากที่สุดก็คืองานวิจัยในการกำหนดความคิดหรืออ่านใจคน
ประวัติ
[แก้]ประวัติสร้างภาพสมองบทแรกสุดเริ่มที่นักประสาทวิทยาชาวอิตาลี ศ. แอนเจโล มอสโซ ผู้ประดิษฐ์ "ความสมดุลของการไหลเวียนในมนุษย์" (human circulation balance) ซึ่งสามารถวัดการปรับกระจายของเลือดเมื่อเกิดอารมณ์หรือเมื่อกำลังคิด[2] แม้ว่า นักจิตวิทยาทรงอิทธิพลชาวอเมริกัน นพ. วิลเลียม เจมส์ จะกล่าวถึงสิ่งประดิษฐ์นี้อย่างสั้น ๆ ในปี พ.ศ. 2433 รายละเอียดเกี่ยวกับความสมดุลที่ว่าและการทดลองที่ ศ. มอสโซได้ทำ เป็นเรื่องไม่ปรากฏจนกระทั่งได้ค้นพบเครื่องมือดั้งเดิมและรายงานของ ศ. มอสโซเองในปี พ.ศ. 2556[3]
ในปี 2461 ประสาทศัลยแพทย์ชาวอเมริกันวอลเตอร์ แดนดี้ ประดิษฐ์เทคนิคการถ่ายภาพรังสีโพรงสมอง (ventriculography) การสร้างภาพระบบโพรงสมองด้วยเอกซ์เรย์ทำได้โดยฉีดอากาศกรองโดยตรงเข้าไปในโพรงสมองข้าง (lateral ventricle) โพรงหนึ่งหรือทั้งสองโพรง นพ. แดนดี้ได้สังเกตว่า อากาศที่ใส่เข้าในช่องใต้เยื่อหุ้มสมองชั้นกลาง (subarachnoid) ผ่านการเจาะไขสันหลังที่เอวสามารถเข้าไปในโพรงสมอง และสามารถแสดงช่องน้ำในท่อสมองไขสันหลัง (cerebrospinal fluid compartment) ที่อยู่ใกล้ ๆ ฐานและผิวสมอง เทคนิคนี้ต่อมาเรียกว่า การถ่ายภาพรังสีโพรงสมองหลังฉีดอากาศ (pneumoencephalography) ต่อมาในปี 2470 ศาสตราจารย์ประสาทวิทยาชาวโปรตุเกสได้ประดิษฐ์การบันทึกภาพรังสีหลอดเลือดหรือหลอดน้ำเหลืองในสมอง (cerebral angiography) ที่หลอดเลือดทั้งปกติและไม่ปกติในสมองและรอบ ๆ สมองสามารถมองเห็นได้อย่างแม่นยำ
ต่อมาในต้นคริสต์ทศวรรษ 1970 นักฟิสิกส์ชาวอเมริกันเชื้อสายแอฟริกาใต้และวิศวกรไฟฟ้าชาวอังกฤษได้ประดิษฐ์การถ่ายภาพรังสีส่วนตัดอาศัยคอมพิวเตอร์ (CT scan หรือ CAT) จึงสามารถสร้างภาพกายวิภาคของสมองเพื่อการวินิจฉัยทางการแพทย์และเพื่องานวิจัย นักประดิษฐ์คู่นี่ต่อมาได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ปี 2522 เพราะงานนี้ หลังจากการเริ่มใช้ CAT ไม่นานในต้นคริสต์ทศวรรษ 1980 การพัฒนาลิแกนด์กัมมันตรังสี (radioligand) ทำให้สามารถสร้างภาพสมองโดยเทคนิค single photon emission computed tomography (SPECT) และการถ่ายภาพรังสีระนาบด้วยการปล่อยโพซิตรอน (PET) และในช่วงเวลาเดียวกัน นักเคมีชาวอเมริกันและนักฟิสิกส์ชาวอังกฤษก็ได้พัฒนาการสร้างภาพด้วยเรโซแนนซ์แม่เหล็ก (MRI) แล้วจึงได้รับรางวัลโนเบลสาขาสรีรวิทยาหรือการแพทย์ปี 2546
ในต้นคริสต์ทศวรรษ 1980 MRI ก็เริ่มใช้เพื่อการรักษา และในช่วงทศวรรษนี้ การเพิ่มเทคนิคสร้างภาพอย่างละเอียดและการวินิจฉัยทางการแพทย์จำนวนมากที่ใช้ MRI ก็ได้ประทุขึ้น เมื่อนักวิทยาศาสตร์รู้ว่า การเปลี่ยนการไหลเวียนของเลือดในระดับสูงที่วัดโดยใช้ PET สามารถสร้างภาพได้โดยใช้ MRI เทคนิคการสร้างภาพโดยกิจด้วยเรโซแนนท์แม่เหล็ก (fMRI) ก็เกิดขึ้น และตั้งแต่คริสต์ทศวรรษ 1990 fMRI ได้กลายมาเป็นเครื่องมือหลักในการสร้างแผนที่ในสมอง เพราะไม่ต้องอาศัยการเจาะการผ่า ไม่ใช้การแผ่รังสี และมีใช้ค่อนข้างแพร่หลาย
ในต้นคริสต์ทศวรรษ 2000 เทคโนโลยีได้ถึงระดับที่สามารถประยุกต์ใช้การสร้างภาพสมองโดยกิจ (functional brain imaging) ในชีวิตประจำวันในระดับจำกัด โดยการประยุกต์ใช้หลักก็คือส่วนต่อประสานระหว่างสมอง-คอมพิวเตอร์ (brain-computer interface) ในรูปแบบหยาบ ๆ
ข้อบ่งชี้
[แก้]ถ้าแพทย์พบเหตุที่ควรจะตรวจคนไข้มากขึ้นว่ามีความผิดปกติทางประสาทหรือไม่ ก็อาจจะสั่งให้สร้างภาพสมอง ความผิดปกติสามัญอย่างหนึ่งก็คือ คนไข้หมดสติชั่วคราว (syncope)[4][5] ในกรณีที่หมดสติโดยไม่มีประวัติที่แสดงว่าอาจมีอาการทางประสาท วิธีวินิจฉัยก็คือตรวจประสาท (neurological examination) แต่การสร้างภาพยังไม่จำเป็นเพราะว่าโอกาสพบเหตุในระบบประสาทกลางน้อยมากและคนไข้ไม่น่าจะได้ประโยชน์จากเทคนิค[5]
การสร้างภาพสมองไม่จำเป็นสำหรับคนไข้ที่ปวดหัวแบบเสถียร ซึ่งจะวินิจฉัยว่าเป็นไมเกรน[6] เพราะว่า งานวิจัยแสดงว่า การมีไมเกรนไม่ได้เพิ่มความเสี่ยงต่อโรคในกะโหลกศีรษะ[6] ดังนั้น การวินิจฉัยไมเกรนที่ไม่มีปัญหาอย่างอื่น ๆ เช่น จานประสาทตาบวม (papilledema) ไม่บ่งชี้ว่าควรสร้างภาพสมอง[6] เมื่อตรวจคนไข้อย่างละเอียดและระมัดระวัง แพทย์จะพิจารณาว่าการปวดหัวอาจมีเหตุนอกจากไมเกรน ซึ่งควรจะต้องสร้างภาพสมองหรือไม่[6]
ข้อบ่งชี้ในการสร้างภาพสมองอีกอย่างก็คือศัลยกรรมแบบ stereotactic หรือรังสีศัลยกรรม (radiosurgery) โดยใช้ภาพ CT, MRI หรือ PET เพื่อรักษาเนื้องอกในกะโหลกศีรษะ, รูปผิดปกติของหลอดเลือดแดงและดำ (arteriovenous malformation) และโรคอื่น ๆ ที่สามารถผ่าตัดได้[7][8][9][10]
เทคนิคการสร้างภาพสมอง
[แก้]Computed axial tomography (CT Scan)
[แก้]เทคนิคที่เรียกว่าการถ่ายภาพรังสีส่วนตัดอาศัยคอมพิวเตอร์ (Computed tomography ตัวย่อ CT) หรือ Computed Axial Tomography (CAT) ใช้ชุดภาพเอกซ์เรย์ของศีรษะที่ถ่ายจากมุมต่าง ๆ ปกติใช้เพื่อดูความบาดเจ็บในสมองอย่างเร็ว ๆ CT ใช้โปรแกรมคอมพิวเตอร์เพื่อคำนวณเลขโดยปริพันธ์ (คือ inverse Radon transform) ของข้อมูลที่ได้ทางเอกซ์เรย์เพื่อประมาณว่า ปริมาตรเล็ก ๆ ในสมองดูดซึมแสงเอกซ์เรย์แค่ไหน แล้วก็จะแสดงข้อมูลเป็นชุดภาพตัดขวางของสมอง[11]

Diffuse optical imaging (DOI)
[แก้]Diffuse optical imaging (DOI) หรือ diffuse optical tomography (DOT) เป็นการสร้างภาพทางการแพทย์โดยใช้รังสีใกล้อินฟราเรดเพื่อสร้างภาพของร่างกาย เทคนิคนี้วัดการดูดซึมแสงของโปรตีนเฮโมโกลบิน และอาศัยการดูดซึมแสงที่ต่างโดยสถานะของการเติมออกซิเจน (oxygenation) ในโปรตีน ส่วนการสร้างภาพแบบ High-density diffuse optical tomography (HD-DOT) ยังมีปัญหาเพราะความคมชัดที่จำกัด แม้ว่าดูจะมีอนาคตดีในขั้นเบื้องต้น แต่ว่าการเปรียบและการแสดงความสมเหตุสมผลเทียบกับ fMRI แบบมาตรฐานยังไม่ค่อยมี แต่ถ้าใช้ได้ HD-DOT จะมีคุณภาพที่ใช้แทนภาพ fMRI ได้[12]
Event-related optical signal (EROS)
[แก้]Event-related optical signal (EROS) เป็นเทคนิคสร้างภาพสมองซึ่งใช้รังสีอินฟราเรดผ่านเส้นใยนำแสงเพื่อวัดความเปลี่ยนแปลงทางคุณลักษณะแสงของเปลือกสมองที่กำลังทำงานอยู่ เทียบกับเทคนิคเช่น diffuse optical imaging (DOT) และ near infrared spectroscopy (NIRS) ที่วัดการดูดซึมแสงของเฮโมโกลบิน และดังนั้นจึงขึ้นอยู่กับการไหลเวียนของเลือด EROS ใช้การกระเจิงแสงของเซลล์ประสาทโดยตรง และดังนั้น จึงวัดการทำงานของเซลล์ได้โดยตรงกว่า EROS สามารถหาตำแหน่งการทำงานในสมองได้ในระดับมิลลิเมตร (โดยพื้นที่) และในระดับมิลลิวินาที (โดยเวลา) ข้อเสียที่ใหญ่ที่สุดก็คือมันไม่สามารถตรวจจับการทำงานที่ลึกเกินกว่า 2-3 ซม. EROS เป็นเทคนิคใหม่ มีค่าใช้จ่ายค่อนข้างน้อย ไม่ต้องผ่าไม่ต้องเจาะสัตว์หรือมนุษย์ที่เป็นตัวทดลอง และพัฒนาขึ้นที่มหาวิทยาลัยอิลลินอยส์ เออร์แบนา-แชมเปญจน์

Magnetic resonance imaging (MRI)
[แก้]การสร้างภาพด้วยเรโซแนนซ์แม่เหล็ก (MRI) ใช้สนามแม่เหล็กและคลื่นวิทยุเพื่อสร้างภาพสองหรือสามมิติมีคุณภาพสูงของโครงสร้างทางสมองโดยไม่ต้องใช้รังสีที่เป็นไอออน เช่น เอกซ์เรย์ และไม่ต้องใช้สารกัมมันตรังสีตามรอย (radioactive tracer)
Functional magnetic resonance imaging (fMRI)
[แก้]ส่วนการสร้างภาพโดยกิจด้วยเรโซแนนท์แม่เหล็ก (fMRI) และเทคนิค arterial spin labeling (ASL) อาศัยคุณสมบัติพาราแมกเนติกของเฮโมโกลบินที่เติมออกซิเจนหรือขาดออกซิเจนเพื่อแสดงความเปลี่ยนแปลงของการไหลเวียนของเลือดในสมองที่สัมพันธ์กับการทำงานของระบบประสาท ทำให้สามารถสร้างภาพแสดงว่า โครงสร้างทางสมองไหนกำลังทำงานแค่ไหนเมื่อผู้รับการสแกนทำงานต่าง ๆ หรืออยู่เฉย ๆ ตามสมมติฐานการเติมออกซิเจน (oxygenation hypothesis) ความเปลี่ยนแปลงของการใช้ออกซิเจนในเลือดของบริเวณสมองในช่วงที่มีกิจกรรมทางการรู้คิดหรือพฤติกรรม อาจสัมพันธ์กับเซลล์ประสาทในเขตที่สัมพันธ์โดยตรงกับงานที่กำลังทำอยู่ เครื่อง fMRI โดยมากมีที่ให้แสดงภาพ เสียง และความรู้สึกสัมผัสต่าง ๆ แก่คนที่อยู่ในเครื่อง แล้วให้ทำการตอบสนองเช่นกดปุ่มหรือขยับก้านควบคุม และดังนั้น fMRI จึงสามารถใช้แสดงโครงสร้างและกระบวนการทางสมองที่สัมพันธ์กับการรับรู้ ความคิด และการกระทำ
ความคมชัดของ fMRI อยู่ที่ 2-3 มม. ในปัจจุบัน จำกัดโดยการกระจายพื้นที่ของการตอบสนองทางเลือดเมื่อระบบประสาททำงาน เป็นเทคนิคที่ใช้แทน PET โดยมากเพื่อศึกษารูปแบบการทำงานของสมอง แต่ว่า PET ก็ยังพิเศษเพราะสามารถระบุตัวรับ (receptor) โดยเฉพาะของสมอง (หรือแม้แต่โปรตีนขนส่งโมโนอะมีน) ที่สัมพันธ์กับสารสื่อประสาทโดยเฉพาะ เพราะสามารถสร้างภาพลิแกนด์ติดป้ายกัมมันตรังสีสำหรับตัวรับ โดยลิแกนด์ของตัวรับก็คือสารเคมีอะไรก็ได้ที่เข้ายึดกับตัวรับ
นอกจากจะใช้ในงานวิจัยในคนปกติ fMRI ยังเริ่มใช้เพิ่มขึ้นเรื่อย ๆ เพื่อวินิจฉัยโรค เพราะว่า fMRI ไวเป็นพิเศษต่อการใช้ออกซิเจนในเลือด จึงไวต่อความเปลี่ยนแปลงของสมองระยะต้น ๆ ที่เป็นผลจากการขาดเลือดเฉพาะที่ (ischemia) เช่นความเปลี่ยนแปลงที่เกิดขึ้นตามโรคหลอดเลือดสมอง การวินิจฉัยโรคหลอดเลือดสมองบางชนิดได้เร็วสำคัญขึ้นเรื่อย ๆ เพราะว่าสารละลายลิ่มเลือดต้องใช้ภายใน 2-3 ชม. แรกหลังจากโรคบางชนิดได้เกิดขึ้น เพราะอันตรายถ้าใช้หลังจากนั้น ความเปลี่ยนแปลงที่เห็นในภาพ fMRI สามารถช่วยตัดสินใจว่า ควรจะรักษาด้วยสารเหล่านั้นหรือไม่ โดยมีความแม่นยำในอัตรา 72-90% เทียบกับสุ่มทำที่จะแม่นยำเพียงแค่ 0.8%[13]
เทคนิค fMRI ยังสามารถบอกได้ว่าผู้รับสแกนกำลังดูรูปอะไรในบรรดารูปจำกัดที่มีข้อมูลอยู่แล้ว[14]

Magnetoencephalography (MEG)
[แก้]Magnetoencephalography (MEG) เป็นเทคนิคการสร้างภาพที่วัดสนามแม่เหล็กที่เกิดจากการทำงานทางไฟฟ้าของสมอง ผ่านอุปกรณ์วัดที่ไวมากเช่น superconducting quantum interference device (SQUID) MEG ช่วยให้สามารถวัดการทำงานทางไฟฟ้าของเซลล์ประสาทโดยตรง (เทียบกับ fMRI ซึ่งวัดออกซิเจนในเลือด) โดยมีความคมชัดทางกาลเวลาที่สูงมาก แต่มีความคมชัดทางพื้นที่ค่อนข้างต่ำ ข้อดีของการวัดสนามแม่เหล็กที่เกิดจาการทำงานของเซลล์ประสาทก็คือสัญญาณมักจะบิดเบือนโดยเนื้อเยื่อรอบ ๆ (โดยเฉพาะกะโหลกและหนังศีรษะ) น้อยกว่า เทียบกับการวัดสนามไฟฟ้าที่วัดโดยการบันทึกคลื่นไฟฟ้าสมอง (EEG)
โดยเฉพาะก็คือ แสดงได้ว่าสนามแม่เหล็กที่เกิดจากการทำงานทางไฟฟ้าไม่ได้รับผลจากเนื้อเยื่อรอบ ๆ ศีรษะ ถ้าสร้างแบบจำลองของศีรษะว่าเป็นเซตของลูกบอลกลม ๆ เซตหนึ่ง โดยแต่ละลูกเป็นตัวนำไฟแบบเท่ากันทุกทิศทาง (isotropic homogeneous conductor) แต่ว่า ศีรษะไม่ใช่รูปวงกลมจริง ๆ และมีการนำไฟแบบไม่เท่ากัน (แอนไอโซทรอปิก) โดยมาก โดยเฉพาะเนื้อขาวและกะโหลก แม้ว่า การนำไฟแบบแอนไอโซทรอปิกของกะโหลกจะมีผลที่มองข้ามได้สำหรับ MEG (ซึ่งไม่เหมือน EEG) การนำไฟแบบแอนไอโซทรอปิกของเนื้อขาวมีผลต่อการใช้ MEG วัดจุดที่อยู่ลึก[15] แต่ว่า ให้สังเกตว่างานศึกษานี้สมมุติว่า กะโหลกเป็นตัวนำแบบแอนไอโซทรอปิกอย่างเท่ากันทุก ๆ ที่ ซึ่งไม่เป็นจริง คือ ทั้งความหนาสัมบูรณ์และความหนาสัมพัทธ์ของชั้น diploë และกระดูกเนื้อแน่นต่าง ๆ กันทั้งภายในกระดูกะโหลกชิ้นเดียวกันและต่าง ๆ กัน ซึ่งทำให้ความเป็นแอนไอโซทรอปีของกะโหลกน่าจะมีผลต่อ MEG[16] แม้ว่าอาจจะไม่ใช่ในระดับเดียวกันต่อ EEG
MEG มีประโยชน์หลายอย่าง รวมทั้งช่วยศัลยแพทย์ในการระบุจุดของโรค ช่วยนักวิจัยกำหนดหน้าที่ของส่วนต่าง ๆ ในสมอง ให้ข้อมูลป้อนกลับเกี่ยวกับสมองเพื่อฝึกสมอง และอื่น ๆ

Positron emission tomography (PET)
[แก้]การถ่ายภาพรังสีระนาบด้วยการปล่อยโพซิตรอน (PET) วัดการปล่อยรังสีจากสารเคมีออกฤทธิ์ในช่วงเมแทบอลิซึม ซึ่งเป็นสารที่ได้ป้ายกัมมันตรังสี แล้วฉีดเข้าไปในเลือด คอมพิวเตอร์จะประมวลข้อมูลการปล่อยรังสี แล้วสร้างภาพสองหรือสามมิติแสดงการกระจายสารเคมีทั่วสมอง[17]
เทคนิคต้องใช้เครื่องไซโคลทรอนทำไอโซโทปกัมมันตรังสีที่ปล่อยโพซิตรอน ซึ่งใช้ติดป้ายสารประกอบที่ต้องการ สารประกอบที่ติดป้ายเรียกว่า radiotracer (สารกัมมันตรังสีตามรอย) จะฉีดเข้าไปในเลือดแล้วในที่สุดก็จะเข้าไปในสมอง เครื่องรับรู้ทั่วเครื่อง PET จะตรวจจับกัมมันตภาพรังสีของสารประกอบที่สะสมอยู่ในเขตต่าง ๆ ของสมอง แล้วคอมพิวเตอร์ก็จะใช้ข้อมูลที่ได้จากเครื่องรับรู้เพื่อสร้างภาพสองหรือสามมิติที่แสดงส่วนสมองที่สารประกอบกำลังออกฤทธิ์
ที่มีประโยชน์มากก็คือ มีลิแกนด์มากมายหลายหลากที่สามารถเลือกใช้สร้างแผนที่การทำงานของสารสื่อประสาทในด้านต่าง ๆ โดยสารกัมมันตรังสีตามรอยที่ใช้อย่างสามัญที่สุด ก็คือกลูโคสติดป้าย เช่น Fludeoxyglucose (18F) ประโยชน์ที่ดีที่สุดของ PET ก็คือสารประกอบสามารถแสดงการไหลเวียนของเลือด ออกซิเจน และเมแทบอลิซึมของกลูโคสในเนื้อเยื่อสมองที่กำลังทำงาน ค่าวัดเหล่านี้สะท้อนระดับการทำงานของสมองในเขตต่าง ๆ และช่วยให้สามารถเรียนรู้การทำงานของสมอง และเมื่อเริ่มใช้ตอนแรก PET ดีกว่าวิธีการสร้างภาพโดยเมแทบอลิซึมอื่น ๆ ทั้งหมดในเรื่องความคมชัดและความเร็วในการสร้างภาพ (อาจน้อยเพียงแค่ 30 วินาที) ความคมชัดที่ดีขึ้นช่วยให้สามารถทำงานศึกษาที่มีคุณภาพดีขึ้นว่า เขตไหนของสมองทำงานเมื่อผู้รับสแกนทำกิจกรรมต่าง ๆ ข้อเสียใหญ่ที่สุดก็คือ เพราะว่า กัมมันตภาพรังสีเสื่อมเร็ว จึงสามารถใช้ตรวจดูกิจกรรมสั้น ๆ เท่านั้น[18]
ก่อน fMRI เทคนิค PET เป็นวิธีที่นิยมที่สุดสำหรับการสร้างภาพสมองโดยกิจ (เทียบกับการสร้างภาพโดยโครงสร้าง) และปัจจุบันก็ยังเป็นเทคนิคที่ช่วยสร้างความก้าวหน้าในประสาทวิทยาศาสตร์
PET ยังสามารถใช้วินิจฉัยโรคสมองอีกด้วย โดยเฉพาะเนื้องอกในสมอง โรคหลอดเลือดสมอง และโรคที่ทำลายเซลล์ประสาทอันเป็นเหตุของภาวะสมองเสื่อม เช่น โรคอัลไซเมอร์ เพราะล้วนแต่เป็นโรคที่เปลี่ยนเมแทบอลิซึมในสมองอย่างมาก ซึ่งทำให้ PET สามารถตรวจจับได้ เทคนิคน่าจะมีประโยชน์มากที่สุดในภาวะสมองเสื่อมระยะต้น ๆ บางโรค (โดยตัวอย่างคลาสสิกก็คือโรคอัลไซเมอร์ และ Pick's disease) ที่ความเสียหายในเบื้องต้นกระจายแพร่ไปทั่วซึ่งไม่ได้เปลี่ยนปริมาตรสมองหรือโครงสร้างใหญ่ ๆ ของสมองอย่างสำคัญที่จะเห็นได้โดยเทคนิค CT หรือ MRI ทั่วไปอย่างเชื่อถือได้ว่า แตกต่างจากสมองฝ่อปกติที่เกิดจากวัยที่สูงขึ้น ซึ่งเป็นภาวะที่ไม่เป็นเหตุของภาวะสมองเสื่อม (dementia)
Single-photon emission computed tomography (SPECT)
[แก้]Single-photon emission computed tomography (SPECT) คล้ายกับ PET แต่ใช้ไอโซโทปกัมมันตรังสีที่ปล่อยรังสีแกมมา แล้วใช้กล้องถ่ายรังสีแกมมาเพื่อบันทึกข้อมูลที่คอมพิวเตอร์ใช้เพื่อสร้างภาพสองหรือสามมิติของบริเวณสมองที่กำลังทำงาน[19] SPECT อาศัยการฉีดสารกัมมันตรังสีตามรอยที่เรียกว่า SPECT agent ซึ่งเข้าไปในสมองอย่างรวดเร็วแต่ไม่กระจายไปที่อื่น การดูดซึม SPECT agent เสร็จ 100% ภายใน 30-60 วินาที ขึ้นอยู่กับการเดินเลือดในสมอง (cerebral blood flow) เมื่อฉีดสาร คุณสมบัติเยี่ยงนี้ทำให้เหมาะเป็นพิเศษในการสร้างภาพสำหรับโรคลมชัก ซึ่งปกติเป็นปัญหาที่ยากเนื่องจากการเคลื่อนไหวของคนไข้และรูปแบบการชักต่าง ๆ SPECT แสดงภาพถ่ายในขณะหนึ่งของการเดินเลือดในสมอง เพราะการสร้างภาพสามารถทำหลังจากที่การชักหยุดแล้ว ตราบเท่าที่ฉีดสารเข้าเมื่อกำลังชัก ข้อจำกัดสำคัญของ SPECT ก็คือมีความคมชัดต่ำ (ประมาณ 1 ซม.) เทียบกับ MRI
ปัจจุบัน เครื่อง SPECT มักใช้กับหัวตรวจจับคู่ แม้ว่าจะมีเครื่องที่มากับหัวตรวจจับสามตัววางขายในตลาด การสร้างภาพกราดตัดขวางใหม่ (Tomographic reconstruction) ซึ่งโดยหลักใช้เพื่อแสดงภาพการทำงานในขณะหนึ่งของสมอง ต้องใช้ข้อมูลจากหัวตรวจจับหลายรอบเมื่อหมุนไปรอบ ๆ ศีรษะ ดังนั้น นักวิจัยบางท่านจึงได้สร้างเครื่อง SPECT ที่มีหัวตรวจจับ 6-11 ตัวเพื่อลดเวลาในการสร้างภาพและให้ความคมชัดที่สูงกว่า[20][21]
โดยเหมือนกับ PET การสร้างภาพแบบ SPECT สามารถใช้จำแนกการดำเนินของโรคต่าง ๆ ที่เป็นส่วนของภาวะสมองเสื่อม และการใช้เพื่อจุดประสงค์นี้ก็เพิ่มขึ้นเรื่อย ๆ PET มีข้อเสียอย่างหนึ่งที่ต้องใช้สารตามรอยที่มีระยะครึ่งชีวิตอย่างมากที่สุด 110 นาที เช่น fludeoxyglucose (18F) ซึ่งต้องผลิตในไซโคลตอน มีราคาแพง หรือแม้แต่ไม่มีให้ใช้ถ้าเวลาขนส่งยาวนานกว่าระยะครึ่งชีวิตมากกว่า 2-3 เท่า แต่ว่า SPECT สามารถใช้สารตามรอยที่มีระยะครึ่งชีวิตนานกว่า เช่น เทคนีเชียม-99m โดยผลที่ตามก็คือ หาสารตามรอยได้ง่ายกว่า
อัลตราซาวนด์ที่กะโหลก
[แก้]อัลตราซาวนด์ที่กะโหลก (Cranial ultrasound) ปกติจะใช้กับทารกเท่านั้น เพราะว่ากระหม่อมที่เปิดเป็นหน้าต่างให้เสียงเข้า ทำให้สร้างภาพสมองด้วยคลื่นเสียงความถี่สูงได้ ข้อได้เปรียบรวมทั้งไม่ต้องใช้สารกัมมันตภาพรังสีและสามารถทำข้าง ๆ เตียงได้ แต่ว่าการขาดรายละเอียดกับเนื้อเยื่อที่อ่อนหมายความว่า ในบางกรณี การใช้ MRI อาจจะดีกว่า
เปรียบเทียบวิธีต่าง ๆ
[แก้]MRI อาศัยการทำงานของสนามแม่เหล็กในสมองและไม่ได้ใช้เอกซ์เรย์ ดังนั้น จึงพิจารณาว่าปลอดภัยกว่าเทคนิคที่ใช้เอกซ์เรย์ ส่วน SPECT ใช้รังสีแกมมา ซึ่งปลอดภัยกว่าระบบสร้างภาพอื่น ๆ ที่ใช้รังสีอัลฟาหรือเบต้า[ไม่แน่ใจ ] แต่ว่าทั้งเทคนิค PET และ SPECT ต้องฉีดสารกัมมันตรังสี แม้ว่าระยะครึ่งชีวิตของไอโซโทปที่ใช้ใน SPECT จะสามารถบริหารได้ง่ายกว่า
ข้อขัดแย้งและคำเตือน
[แก้]นักวิทยาศาสตร์บางท่านได้วิพากษ์วิจารณ์ข้ออ้างที่อาศัยภาพสมองที่ลงพิมพ์ในวารสารวิทยาศาสตร์และสื่อมวลชน เช่น อ้างว่าได้ค้นพบ "ส่วนสมองที่เป็นตัวการ" ของเรื่องต่าง ๆ เช่น ความรัก หรือความสามารถทางดนตรี หรือความจำเฉพาะอะไรบางอย่าง เพราะว่า เทคนิคการสร้างแผนที่หลายอย่างมีความคมชัดค่อนข้างต่ำ voxel (ปริมาตรที่เล็กที่สุดที่รวมตัวกันเป็นภาพสามมิติ ย่อมาจาก volume pixel) เดียวสามารถมีเซลล์ประสาทอยู่เป็นพัน ๆ หน้าที่หลายอย่างยังต้องอาศัยเขตต่าง ๆ หลายเขตในสมอง ซึ่งหมายความว่าข้ออ้างเช่นนี้ไม่สามารถตรวจสอบได้ด้วยอุปกรณ์ที่มี และโดยทั่วไปขึ้นอยู่กับข้อสมมุติผิด ๆ ว่า สมองทำหน้าที่แบ่งส่วนกันอย่างไร อาจจะเป็นไปได้ว่า หน้าที่ของสมองจะสามารถบอกได้อย่างถูกต้องก็ต่อเมื่อวัดด้วยวิธีที่ละเอียดกว่านี้ ที่ตรวจสอบไม่ใช่บริเวณใหญ่ ๆ แต่ตรวจสอบวงจรประสาทวงจรเล็ก ๆ เป็นจำนวนมหาศาล
งานศึกษาเหล่านี้มักมีปัญหาทางเทคนิคด้วย เช่น มีขนาดตัวอย่างน้อยหรือมีการปรับเทียบมาตรฐานที่ไม่ดี ซึ่งหมายความว่างานไม่สามารถทำซ้ำได้ อันเป็นประเด็นที่ไม่ค่อยได้รับความสนใจเมื่อพิมพ์บทความวารสารหรือหัวพาดข่าวที่สร้างความฮือฮา ในบางกรณี เทคนิคสร้างแผนที่ในสมองยังเอามาใช้เพื่อการค้า เพื่อตรวจจับการโกหก เพื่อวินิจฉัยทางการแพทย์ที่ยังไม่ตรวจสอบความสมเหตุสมผลทางวิทยาศาสตร์[22]
ดูเพิ่ม
[แก้]เชิงอรรถและอ้างอิง
[แก้]- ↑ Filler, Aaron (July 12, 2009). "The History, Development and Impact of Computed Imaging in Neurological Diagnosis and Neurosurgery: CT, MRI, and DTI". Nature Precedings. doi:10.1038/npre.2009.3267.5.
- ↑ Sandrone, Stefano; และคณะ (2012). "Angelo Mosso". Journal of Neurology. 259: 2513–2514. doi:10.1007/s00415-012-6632-1. PMID 23010944.
- ↑ Sandrone, Stefano; และคณะ (2013). "Weighing brain activity with the balance: Angelo Mosso's original manuscripts come to light". Brain. 137: 621–633. doi:10.1093/brain/awt091. PMID 23687118.
- ↑ Miller, T. H.; Kruse, J. E. (2005). "Evaluation of syncope". American family physician. 72 (8): 1492–1500. PMID 16273816.
- ↑ 5.0 5.1 American College of Physicians (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American College of Physicians, สืบค้นเมื่อ December 10, 2013, which cites
- American College of Radiology; American Society of Neuroradiology (2010), "ACR-ASNR practice guideline for the performance of computed tomography (CT) of the brain", Agency for Healthcare Research and Quality, Reston, VA, USA: American College of Radiology, คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-09-15, สืบค้นเมื่อ 2012-09-09
- Transient loss of consciousness in adults and young people: NICE guideline, National Institute for Health and Clinical Excellence, August 25, 2010, คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-02-02, สืบค้นเมื่อ 2012-09-09
- Moya, A.; European Society of Cardiology (ESC); Sutton, R.; European Heart Rhythm Association (EHRA); Ammirati, F.; and Heart Rhythm Society (HRS); Blanc, J.-J.; Endorsed by the following societies; Brignole, M.; European Society of Emergency Medicine (EuSEM); Moya, J. B.; European Federation of Internal Medicine (EFIM); Sutton, J.-C.; European Union Geriatric Medicine Society (EUGMS); Ammirati, J.; Blanc, K.; European Neurological Society (ENS); Brignole, A.; European Federation of Autonomic Societies (EFAS); Dahm, M.; Deharo, M.; Gajek, T.; Gjesdal, R. R.; Krahn, F.; Massin, A.; Pepi, J. G.; Pezawas, E. P.; Ruiz Granell, W.; Sarasin, H.; Ungar, D. G.; และคณะ (2009). "Guidelines for the diagnosis and management of syncope (version 2009) : The Task Force for the Diagnosis and Management of Syncope of the European Society of Cardiology (ESC)". European Heart Journal. 30 (21): 2631–2671. doi:10.1093/eurheartj/ehp298. PMC 3295536. PMID 19713422.
- ↑ 6.0 6.1 6.2 6.3 American Headache Society (September 2013), "Five Things Physicians and Patients Should Question", Choosing Wisely: an initiative of the ABIM Foundation, American Headache Society, คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-12-03, สืบค้นเมื่อ December 10, 2013, which cites
- Lewis, D. W.; Dorbad, D. (2000). "The utility of neuroimaging in the evaluation of children with migraine or chronic daily headache who have normal neurological examinations". Headache. 40 (8): 629–632. doi:10.1046/j.1526-4610.2000.040008629.x. PMID 10971658.
- Silberstein, S. D. (2000). "Practice parameter: Evidence-based guidelines for migraine headache (an evidence-based review) : Report of the Quality Standards Subcommittee of the American Academy of Neurology". Neurology. 55 (6): 754–762. doi:10.1212/WNL.55.6.754. PMID 10993991.
- Health Quality, O. (2010). "Neuroimaging for the evaluation of chronic headaches: An evidence-based analysis". Ontario health technology assessment series. 10 (26): 1–57. PMC 3377587. PMID 23074404.
- ↑
Thomas, DG; Anderson, RE; du Boulay, GH (January 1984). "CT-guided stereotactic neurosurgery: experience in 24 cases with a new stereotactic system". Journal of Neurology, Neurosurgery & Psychiatry. 47 (1): 9–16. doi:10.1136/jnnp.47.1.9. PMC 1027634. PMID 6363629.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Heilbrun, MP; Sunderland, PM; McDonald, PR Jr; Wells, TH; Cosman, E; Ganz, E (1987). "Brown-Roberts-Wells stereotactic frame modifications to accomplish magnetic resonance imaging guidance in three planes". Applied Neurophysiology. 50 (1–6): 143–152. doi:10.1159/000100700. PMID 3329837.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Leksell, L; Leksell, D; Schwebel, J (January 1985). "Stereotaxis and nuclear magnetic resonance". Journal of Neurology, Neurosurgery & Psychiatry. 48 (1): 14–18. doi:10.1136/jnnp.48.1.14. PMC 1028176. PMID 3882889.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Levivier, M; Massager, N; Wikler, D; Lorenzoni, J; Ruiz, S; Devriendt, D; David, P; Desmedt, F; Simon, S; Van Houtte, P; Brotchi, J; Goldman, S (July 2004). "Use of stereotactic PET images in dosimetry planning of radiosurgery for brain tumors: clinical experience and proposed classification". Journal of Nuclear Medicine. 45 (7): 1146–1154. PMID 15235060.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Jeeves, Malcolm A (1994). Mind Fields: Reflections on the Science of Mind and Brain. Grand Rapids, MI: Baker Books. pp. 21.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Eggebrecht, AT; White, BR; Ferradal, SL; Chen, C; Zhan, Y; Snyder, AZ; Dehghani, H; Culver, JP (July 16, 2012). "A quantitative spatial comparison of high-density diffuse optical tomography and fMRI cortical mapping". NeuroImage. 61 (4): 1120–8. doi:10.1016/j.neuroimage.2012.01.124. PMID 22330315.
- ↑ Smith, Kerri (March 5, 2008). "Mind-reading with a brain scan". Nature News. Nature Publishing Group. สืบค้นเมื่อ 2008-03-05.
- ↑ Keim, Brandon (March 5, 2008). "Brain Scanner Can Tell What You're Looking At". Wired News. CondéNet. สืบค้นเมื่อ 2015-09-16.
- ↑ Wolters, C.H.; Anwander, A.; Tricoche, X.; Weinstein, D.; Koch, M.A.; MacLeod, R.S. (March 31, 2006). "Influence of tissue conductivity anisotropy on EEG/MEG field and return current computation in a realistic head model: A simulation and visualization study using high-resolution finite element modeling". NeuroImage. 30 (3): 813–826. doi:10.1016/j.neuroimage.2005.10.014. PMID 16364662.
- ↑ Ramon, Ceon; Haueisen, Jens; Schimpf, Paul H (January 1, 2006). "Influence of head models on neuromagnetic fields and inverse source localizations". BioMedical Engineering OnLine. 5 (1): 55. doi:10.1186/1475-925X-5-55. PMC 1629018. PMID 17059601.
- ↑ Nilsson, Lars-Goran; Markowitsch, Hans J (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers. pp. 57.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Nilsson, Lars-Goran; Markowitsch, Hans J (1999). Cognitive Neuroscience of Memory. Seattle: Hogrefe & Huber Publishers. pp. 60.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Philip Ball Brain Imaging Explained
- ↑ "SPECT Systems for Brain Imaging". สืบค้นเมื่อ 2014-07-24.
- ↑ "SPECT Brain Imaging". สืบค้นเมื่อ January 12, 2016.
- ↑ Sally Satel; Scott O. Lilienfeld (2015). Brainwashed: The Seductive Appeal of Mindless Neuroscience. Basic Books. ISBN 978-0465062911.
แหล่งข้อมูลอื่น
[แก้]- The Whole Brain Atlas @ Harvard
- The McConnell Brain Imaging Center, McGill University
- The American Society of Neuroimaging (ASN).
- A Neuroimaging portal เก็บถาวร 18 กรกฎาคม 2014 ที่ เวย์แบ็กแมชชีน
- BrainMapping.org, a free BrainMapping community information portal
- Lecture notes on mathematical aspects of neuroimaging by Will Penny, University College London
- "Transcranial Magnetic Stimulation" by Michael Leventon in association with MIT AI Lab.
- NeuroDebian - a complete operating system targeting neuroimaging
