โรคจอตามีสารสี
บทความนี้ต้องการตรวจสอบความถูกต้องจากผู้เชี่ยวชาญในเรื่องนั้น ๆ โปรดเพิ่มพารามิเตอร์ reason หรือ talk ลงในแม่แบบนี้เพื่ออธิบายปัญหาของบทความ |
| โรคจอตามีสารสี (Retinitis pigmentosa) | |
|---|---|
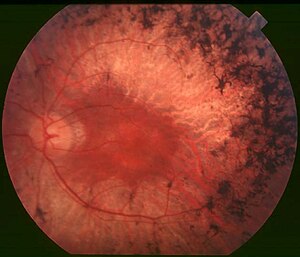 | |
| ด้านหลัง/ก้นตา (Fundus) ของคนไข้โรคอาร์พีระยะกลาง (mid stage) ให้สังเกตสารสี/รอยเปรอะสีดำ (bony spicule) ที่ส่วนรอบ ๆ ตรงกลางที่เกิดกับการเสื่อมของจอตา (retinal atrophy) แม้จุดภาพชัด (macula) จะคงสภาพอยู่แต่ส่วนรอบ ๆ ก็ซีดไป เส้นเลือดในจอตาก็ลีบลงด้วย | |
| สาขาวิชา | จักษุวิทยา |
| อาการ | เห็นไม่ดีต่อกลางคืน เห็นรอบนอก (peripheral vision) ได้แย่ลง[1] |
| การตั้งต้น | ตั้งแต่เด็ก[1] |
| สาเหตุ | กรรมพันธุ์[1] |
| วิธีวินิจฉัย | การตรวจตา[1] |
| การรักษา | อุปกรณ์ช่วยคนที่เห็นได้น้อย ไฟส่องที่พกพาได้ สุนัขนำทาง[1] |
| ยา | Vitamin A palmitate[1] |
| ความชุก | 1 คนใน 4,000 คน[1] |
โรคจอตามีสารสี[2] หรือ โรคอาร์พี[3] (อังกฤษ: Retinitis pigmentosa ตัวย่อ RP) เป็นความผิดปกติทางพันธุกรรมทางตาที่ทำให้เสียสายตา[1] อาการรวมทั้งตาฟางกลางคืน (nyctalopia) และการเสียการเห็นรอบนอก (peripheral vision) คือเห็นข้าง ๆ หรือรอบ ๆ ได้น้อยลง[1] อาการปกติจะค่อย ๆ ปรากฏ[4] เมื่อเห็นรอบนอกได้แย่ลง บางคนอาจลานสายตาแคบลงเหมือนมองผ่านอุโมงค์ (tunnel vision)[1] แต่ตาบอดสนิทจะไม่สามัญ[4]
โรคปกติจะสืบทอดมาจากพ่อแม่[1] โดยมีการกลายพันธุ์ของยีนหนึ่ง ๆ ในบรรดา 50 ยีนที่ได้ระบุแล้วเป็นอย่างน้อย[1] วิถีการดำเนินของโรครวมการค่อย ๆ เสียเซลล์รับแสงรูปแท่งที่ด้านหลังของตา[1] แล้วปกติจะตามด้วยการเสียเซลล์รูปกรวยต่อมา[1] การวินิจฉัยจะทำเมื่อตรวจจอตาแล้วพบสารสี/รอยเปรอะดำ[1] วิธีการตรวจยืนยันอื่น ๆ รวมทั้ง electroretinography, การตรวจลานสายตา และการตรวจยีน[1]
ปัจจุบันยังไม่มีวิธีรักษาโรคนี้[4] วิธีช่วยบรรเทาปัญหาในชีวิตรวมทั้งอุปกรณ์ช่วยการมองเห็น (เช่น แว่นขยาย) ไฟส่องที่พกพาได้ (เช่น ไฟฉาย) และสุนัขนำทาง[1] อาหารเสริมคือ vitamin A palmitate อาจช่วยให้สายตาแย่ช้าลง[1] ตาเทียม (visual prosthesis) อาจเป็นทางเลือกอย่างหนึ่งสำหรับคนที่มีโรครุนแรงมาก[1] ประเมินว่าคน 1 คนใน 4,000 คนมีโรค[1] โรคจะเริ่มตั้งแต่วัยเด็กแต่บางคนอาจไม่ได้รับผลกระทบจนกระทั่งเป็นผู้ใหญ่[1][4]
ผลของโรคเห็นได้ง่ายถ้าเปรียบเทียบกับทีวีหรือจอคอมพิวเตอร์ คือ แสงจากพิกเซลที่สร้างภาพบนจอเหมือนกับเซลล์รับแสงเป็นล้าน ๆ ตัวในจอตา ยิ่งมีพิกเซลน้อยลงเท่าไร ภาพที่เห็นก็ชัดน้อยลงเท่านั้น มีเซลล์รับแสงจำนวนน้อยกว่า 10% ที่สามารถรับภาพสี โดยเป็นแสงสว่างดังที่มีในช่วงกลางวัน เซลล์เหล่านี้อยู่ตรงกลางของจอตา เซลล์รับแสงกว่า 90% ที่เหลือสามารถรับแสงสลัวเป็นภาพขาวดำ ซึ่งใช้ในที่สลัวและในตอนกลางคืน เป็นเซลล์ซึ่งอยู่รอบ ๆ จอตา โรคทำลายเซลล์รับแสงจากนอกเข้ามาส่วนตรงกลาง หรือจากส่วนตรงกลางออกไปส่วนนอก หรือทำลายเป็นย่อม ๆ ที่ทำให้เซลล์ส่วนตรงนั้นมีประสิทธิภาพตรวจจับแสงได้น้อยลง ความเสื่อมจากโรคนี้จะลุกลามโดยยังไม่มีวิธีรักษา
อาการ[แก้]

อาร์พีเป็นโรคที่เกิดอาการเพราะเสียเซลล์รับแสงอันบุอยู่ที่ด้านหลังของดวงตาและทำหน้าที่คล้ายกับฟิลม์ในกล้องถ่ายรูป โดยปกติแล้ว เซลล์รูปแท่งซึ่งมีหน้าที่เกี่ยวกับการเห็นเวลากลางคืน มักจะเสียหายก่อน ซึ่งอธิบายว่า ทำไมความมีตาบอดแสง (nyctalopia) จึงเป็นอาการที่ปรากฏขึ้นก่อน การเห็นเวลากลางวันซึ่งอำนวยโดยเซลล์รูปกรวยจะคงสภาพจนถึงระยะหลัง ๆ ของโรค ความเปรอะเปื้อนของ retinal pigment epithelium ด้วยสีดำ ๆ (เหมือนกระดูกและเข็ม) เป็นอาการทั่ว ๆ ไปของโรค ลักษณะที่เห็นได้ในตาอย่างอื่นคือจานประสาทตา (optic disc) ปรากฏเป็นสีเหลืองซีด และเส้นเลือดเกิดตีบแคบ
อาการเสื่อมของจอตาเบื้องต้นก็คือตาฟางกลางคืน (nyctalopia) และการเสียการเห็นที่ลานสายตารอบนอกถัดเข้ามา (mid-peripheral visual field)[5] เซลล์รับแสงรูปแท่ง ซึ่งทำหน้าที่ในแสงสลัวและมีอยู่โดยมากที่รอบ ๆ จอตา เป็นส่วนที่ได้รับผลก่อนเพื่อนในโรคแบบที่ไม่เกิดร่วมกับความผิดปกติอื่น ๆ (non-syndromic)[6] ตาจะแย่ลงค่อนข้างเร็วโดยขยายไปถึงลานสายตารอบนอกสุด แล้วในที่สุดก็จะเข้ามาถึงส่วนตรงกลางทำให้เห็นเหมือนผ่านอุโมงค์มากขึ้น ความคมชัดและการเห็นเป็นสีอาจแย่ลงเพราะความผิดปกติของเซลล์รูปกรวย ซึ่งมีหน้าที่เกี่ยวกับการเห็นเป็นสี ความคมชัด และการเห็นส่วนตรงกลาง[6] โรคอาจจะดำเนินไปอย่างเท่า ๆ กันทั้งสองข้าง คือตาซ้ายและขวาจะเกิดอาการคล้ายกัน[7] นอกจากผลโดยตรงที่เกิดจากความเสื่อมของเซลล์รูปแท่งและต่อมาเซลล์รูปกรวย ก็ยังมีผลโดยอ้อมอื่น ๆ ซึ่งปรากฏเป็นอาการของโรค ปรากฏการณ์เช่น อาการกลัวแสง (photophobia) คือมองเห็นแสงธรรมดาเป็นแสงจ้ามาก และ photopsia คือมองเห็นแสงกระพริบหรือแสงวาบ (เช่นเหมือนฟ้าแลบ) ภายในลานสายตา บ่อยครั้งจะเกิดในระยะหลัง ๆ ของโรค มีอาการ 3 อย่างที่ก้นตา (fundus) ซึ่งเป็นลักษณะเฉพาะของโรคที่เรียกว่า ophthalamic triad คือ[5][8][9]
- ชั้น retinal pigment epithelium (RPE) ของจอตาจะปรากฏเป็นรอยเปรอะดำเพราะเกิด bony spicule
- จานประสาทตา (optic disc) ปรากฏเป็นสีเหลืองซีดคล้าย ๆ ขี้ผึ้ง
- หลอดเลือดในจอตาจะลีบลงลง
โรคที่ไม่เกิดร่วมกับความผิดปกติอื่น ๆ (Nonsyndromic RP) ปกติจะมีอาการต่าง ๆ ดังต่อไปนี้
- ตาฟางกลางคืน (nyctalopia)
- ลานสายตาแคบลงเหมือนมองผ่านอุโมงค์/การไม่เห็นรอบนอก (tunnel vision)
- Latticework vision
- photopsia คือมองเห็นแสงกระพริบหรือแสงวาบ (เช่น เหมือนฟ้าแลบ) ภายในลานสายตา
- อาการกลัวแสง (photophobia) คือมองเห็นแสงธรรมดาเป็นแสงจ้ามาก
- การเกิดรอยเปรอะดำคือ bony spicule (การสะสมสารสีเป็นรูปโครงมีปลายเหมือนเข็ม) ที่ก้นตา
- การปรับตัวจากที่มืดเป็นที่สว่าง และนัยตรงกันข้ามได้ช้า
- การเห็นมัว
- แยกสีได้ไม่ดี
- การเสียการเห็นตรงกลาง
- ในที่สุดจะจัดว่าบอด
เหตุ[แก้]
โรคอาจจะเป็น
- Nonsyndromic คือเกิดโดยลำพังโดยไม่พบอาการอื่น ๆ
- Syndromic คือพบกับความผิดปกติของการรับความรู้สึกทางประสาทอื่น ๆ, กับความผิดปกติทางพัฒนาการ หรือกับอาการที่ซับซ้อนอื่น ๆ
- เกิดเป็นอาการทุติยภูมิ (secondary) ของโรคทั่วร่างกายอื่น ๆ[10]
อนึ่ง
- อาร์พีเมื่อเกิดกับหูหนวก (ไม่ว่าจะแต่กำเนิดหรือค่อย ๆ เป็น) เรียกว่า Usher syndrome[11]
- กลุ่มอาการอัลพอร์ตที่สัมพันธ์กับอาร์พี เป็นโรคความผิดปกติที่ basement membrane ของ glomerulus ซึ่งทำให้มีอาการไตเสื่อม โรคจะสืบทอดแบบ X-linked dominant
- อาร์พีเมื่อเกิดกับอัมพาตกล้ามเนื้อตา (ophthalmoplegia), การกลืนลำบาก (dysphagia), ภาวะกล้ามเนื้อเสียสหการ (ataxia) และความผิดปกติการนำไฟฟ้าที่หัวใจ จะพบในคนไข้ Kearns-Sayre syndrome หรือ Ragged Red Fiber Myopathy โดยเป็นความผิดปกติทางดีเอ็นเอของไมโทคอนเดรีย
- อาร์พีเมื่อเกิดกับปัญญาอ่อน, โรคเส้นประสาทนอกประสาทกลาง (peripheral neuropathy), acanthotic (spiked) RBCs คือเม็ดเลือดแดงที่มีเยื่อหุ้มเซลล์ยื่นออกเป็นหนาม, steatorrhea คือภาวะไขมันเกินในอุจจาระ และการขาดลิโพโปรตีนหนาแน่นต่ำมาก (VLDL) จะพบในคนไข้ abetalipoproteinemia ซึ่งเป็นภาวะขัดขวางการดูดซึมไขมันและวิตามินที่ละลายในไขมันจากอาหาร[12]
- ในทางคลินิก อาร์พีเกิดกับความผิดปกติของยีนที่มีน้อยหลายอย่าง รวมทั้งโรคกล้ามเนื้อเจริญผิดเพี้ยน (muscular dystrophy) และ chronic granulomatous disease โดยเป็นส่วนของ McLeod syndrome นี่เป็นฟิโนไทป์แบบ X-linked recessive ปรากฏเป็นการขาดโปรตีน XK ที่ผิวเซลล์อย่างสิ้นเชิง และดังนั้น จึงมีการเแสดงออกของแอนติเจนแบบ Kell น้อยมากที่เม็ดเลือดแดง เมื่อต้องถ่ายเลือด คนไข้เหล่านี้จึงมีเลือดที่จัดว่าไม่เข้ากับผู้บริจาคเลือดปกติ และผู้บริจาคเลือด K0/K0 โดยสิ้นเชิง
- โรคที่สัมพันธ์กับการทำงานน้อยผิดปกติของอัณฑะหรือรังไข่ (hypogonadism) ทำให้พัฒนาการอย่างล่าช้า และสืบทอดทางพันธุกรรมแบบทายกรรมลักษณะด้อย (autosomal recessive) จะพบในคนไข้โรค Bardet-Biedl syndrome เป็นความผิดปกติทางพันธุกรรมเกี่ยวกับซีเลียของเซลล์และมีผลต่อระบบต่าง ๆ หลายอย่างในร่างกาย[13]
ภาวะอื่น ๆ ที่อาจมีอาการอาร์พีรวมทั้งซิฟิลิสระบบประสาท (neurosyphilis), โรคติดเชื้อท็อกโซพลาสมา (toxoplasmosis) และโรคติดเชื้ออะแคนตามีบา (Refsum's disease)
พันธุศาสตร์[แก้]
โรคอาร์พีเป็นโรคจอตาเสื่อมอันสืบทอดทางพันธุกรรมซึ่งสามัญที่สุด[7] และปรากฏเป็นความสูญเสียเซลล์รับแสงที่ลุกลาม และอาจจะทำให้ตาบอดได้โดยที่สุด[14]
มียีนหลายยีนที่เมื่อกลายพันธุ์ อาจเป็นเหตุของโรค[15] รูปแบบการสืบทอดทางพันธุกรรมของโรครวมทั้งทายกรรมลักษณะเด่น (autosomal dominant), ทายกรรมลักษณะด้อย (autosomal recessive), X-linked, สืบจากแม่ (โดยไมโทคอนเดรีย) โดยจะขึ้นอยู่กับการกลายพันธุ์ของยีนอาร์พีที่มีในพ่อแม่[16]
ในปี 1989 นักวิจัยได้พบการกลายพันธุ์ของยีนโรด็อปซิน (rhodopsin) ซึ่งเป็นสารสี (pigment) ที่จำเป็นในการถ่ายโอนแสงที่รับทางตาให้เป็นกระแสประสาท (visual transduction cascade) เพื่อให้เห็นในที่สลัว ยีนนี้เข้ารหัสโปรตีนหลักชนิดหนึ่งที่ส่วนนอก (outer segment) ของเซลล์รับแสง การกลายพันธุ์ของยีนที่สามัญที่สุดเป็น missense mutation[A] หรือการพับตัวผิดปกติ (misfolding) ของโปรตีนโรด็อปซิน และปกติจะสืบทอดทางพันธุกรรมในรูปแบบทายกรรมลักษณะเด่น (autosomal dominant) ตั้งแต่ได้ค้นพบยีนนี้ (มีสัญลักษณ์ RHO) ก็ได้ค้นพบการกลายพันธุ์ของยีนถึง 100 รูปแบบ ซึ่งเป็นเหตุของจอตาเสื่อม (retinal degeneration) รูปแบบต่าง ๆ ถึง 15% และเป็นเหตุของอาร์พีที่สืบทอดแบบทายกรรมลักษณะเด่นถึง 25%[7][17]
ในปี 1990 มีการค้นพบการกลายพันธุ์ Pro23His ของยีนอ็อปซิน (opsin) เบสเดียวที่ intradiscal domain ซึ่งสัมพันธ์กับโรคอาร์พี และจนกระทั่งถึงทุกวันนี้ได้มีการระบุการกลายพันธุ์ของยีนกว่า 150 อย่าง การกลายพันธุ์เหล่านี้พบทั่วยีนอ็อปซินโดยกระจายไปตามโดเมน 3 โดเมนของโปรตีน คือ intradiscal domain, transmembrane domain และ cytoplasmic domain เหตุทางชีวเคมีของโรคในกรณีที่ยีนโรด็อปซินกลายพันธุ์ก็คือการพับตัวผิดปกติของโปรตีน (protein misfolding) และการขัดการทำงานของ molecular chaperones ซึ่งช่วยในการพับโปรตีน[B][18]
งานต้นคริสต์ทศวรรษ 2000 ต่อ ๆ มาพบว่า การกลายพันธุ์ที่โคดอน (codon) 23 ในยีนโรด็อปซิน ซึ่งเป็นการเปลี่ยนโปรลีน (proline) เป็นฮิสตาดีน (histidine) เป็นการกลายพันธุ์ของยีนโรด็อปซินซึ่งเกิดบ่อยที่สุดในสหรัฐ งานวิจัยอื่น ๆ ได้รายงานการกลายพันธุ์ที่โคดอนอื่น ๆ ซึ่งสัมพันธ์กับโรคอาร์พีรวมทั้ง Thr58Arg, Pro347Leu, Pro347Ser บวกกกับการหลุดหาย (deletion) ของยีน Ile-255[17][19][20][21][22]
ในปี 2000 การกลายพันธุ์ที่มีน้อยของโคดอน 23 ได้ระบุว่าก่อโรคโดยสืบทอดทางพันธุกรรมแบบทายกรรมลักษณะเด่น และโปรลีนจะเปลี่ยนเป็นอะลานีน (alanine) แต่งานศึกษานี้ก็ได้แสดงว่า ความเสื่อมจอตาที่สัมพันธ์กับกลายพันธุ์นี้ค่อนข้างเบาทั้งโดยอาการและการลุกลาม อนึ่ง แอมพลิจูดที่วัดโดย electroretinography จะดีกว่าที่พบในการกลายพันธุ์ Pro23His ที่มีมากกว่า[23]
การสืบทอดทางพันธุกรรมแบบทายกรรมลักษณะด้อยของโรคได้ระบุแล้วในยีนอย่างน้อย 45 ยีน[16] การสืบทอดเช่นนี้หมายความว่า พ่อแม่ที่เป็นพาหะของยีนกลายพันธุ์ที่ก่อโรคโดยมีสองอัลลีล (diallelic) อาจมีลูกที่เกิดโรค
ส่วนการกลายพันธุ์ของยีนแบบ USH2A รู้ว่าเป็นเหตุของโรคแบบเกิดกับอาการอื่น (syndromic) ที่รู้จักว่า Usher's Syndrome โดยจะสืบทอดแบบทายกรรมลักษณะด้อย[24]
การกลายพันธุ์ของ pre-mRNA splicing factors ถึง 4 แบบรู้แล้วว่าเป็นเหตุของโรคที่สืบทอดแบบทายกรรมลักษณะเด่น การกลายพันธุ์รวมทั้ง PRPF3 (PRPF3 ของมนุษย์ก็คือ HPRPF3 หรือ PRP3), PRPF8, PRPF31 และ PAP1 เพราะแฟกเตอร์มีการแสดงออกอย่างแพร่หลาย จึงเสนอว่าความบกพร่องของแฟกเตอร์ที่แพร่หลาย (คือโปรตีนที่แสดงออกทุกหนทุกแห่ง) เช่นนี้แต่เป็นเหตุของโรคภายในจอตาเท่านั้น เพราะโรด็อปซินในเซลล์รับแสงจำเป็นต้องอาศัยฤทธิ์ของแฟกเตอร์มากกว่าที่อื่น ๆ[25]
การกลายพันธุ์ของยีน 6 ยีนก่อโรคที่สืบทอดแบบ X-linked โดยที่สามัญสุดจะเกิดที่ตำแหน่ง (loci) โดยเฉพาะ ๆ ของยีน RPGR และ RP2[24]
รูปแบบของอาร์พีรวมทั้ง
| OMIM | ยีน | รูปแบบ |
|---|---|---|
| 180100 | RP1 | Retinitis pigmentosa-1 |
| 312600 | RP2 | Retinitis pigmentosa-2 |
| 300029 | RPGR | Retinitis pigmentosa-3 |
| 608133 | PRPH2 | Retinitis pigmentosa-7 |
| 180104 | RP9 | Retinitis pigmentosa-9 |
| 180105 | IMPDH1 | Retinitis pigmentosa-10 |
| 600138 | PRPF31 | Retinitis pigmentosa-11 |
| 600105 | CRB1 | Retinitis pigmentosa-12, ทายกรรมลักษณะด้อย |
| 600059 | PRPF8 | Retinitis pigmentosa-13 |
| 600132 | TULP1 | Retinitis pigmentosa-14 |
| 600852 | CA4 | Retinitis pigmentosa-17 |
| 601414 | HPRPF3 | Retinitis pigmentosa-18 |
| 601718 | ABCA4 | Retinitis pigmentosa-19 |
| 602772 | EYS | Retinitis pigmentosa-25 |
| 608380 | CERKL | Retinitis pigmentosa-26 |
| 607921 | FSCN2 | Retinitis pigmentosa-30 |
| 609923 | TOPORS | Retinitis pigmentosa-31 |
| 610359 | SNRNP200 | Retinitis pigmentosa 33 |
| 610282 | SEMA4A | Retinitis pigmentosa-35 |
| 610599 | PRCD | Retinitis pigmentosa-36 |
| 611131 | NR2E3 | Retinitis pigmentosa-37 |
| 268000 | MERTK | Retinitis pigmentosa-38 |
| 268000 | USH2A | Retinitis pigmentosa-39 |
| 612095 | PROM1 | Retinitis pigmentosa-41 |
| 612943 | KLHL7 | Retinitis pigmentosa-42 |
| 268000 | CNGB1 | Retinitis pigmentosa-45 |
| 613194 | BEST1 | Retinitis pigmentosa-50 |
| 613464 | TTC8 | Retinitis pigmentosa 51 |
| 613428 | C2orf71 | Retinitis pigmentosa 54 |
| 613575 | ARL6 | Retinitis pigmentosa 55 |
| 613617 | ZNF513 | Retinitis pigmentosa 58 |
| 613861 | DHDDS | Retinitis pigmentosa 59 |
| 613194 | BEST1 | Retinitis pigmentosa, concentric |
| 608133 | PRPH2 | Retinitis pigmentosa, digenic |
| 613341 | LRAT | Retinitis pigmentosa, juvenile |
| 268000 | SPATA7 | Retinitis pigmentosa, juvenile, ทายกรรมลักษณะด้อย |
| 268000 | CRX | Retinitis pigmentosa, late-onset dominant |
| 300455 | RPGR | Retinitis pigmentosa, X-linked, and sinorespiratory infections, อาจจหูหนวกหรือไม่ |
พยาธิสรีรภาพ[แก้]

นักวิชาการได้จับคู่การทำงานระดับโมเลกุลที่บกพร่องหลายอย่างกับการกลายพันธุ์ของยีนเกี่ยวกับโรคแล้ว การกลายพันธุ์ของยีนโรด็อปซิน ซึ่งก่อโรคที่สืบทอดแบบทายกรรมลักษณะเด่นโดยมาก จะขัดการทำงานของโปรตีนอ็อปซินของเซลล์รูปแท่งซึ่งจำเป็นในการแปลข้อมูลแสงให้เป็นกระแสประสาท (phototransduction cascade) ของระบบประสาทกลาง ความผิดปกติในการทำงานของโรด็อปซิน ซึ่งเป็นหน่วยรับที่จับคู่กับจีโปรตีน (GPCR) จะจัดเป็นหมู่ ๆ (class) ขึ้นอยู่กับการพับตัวผิดปกติของโปรตีนและวิถีการทำงานที่ผิดปกติของโปรตีน
ฤทธิ์ของโปรตีนกลายพันธุ์หมู่หนึ่ง (Class I) จะเสียไปเพราะการกลายพันธุ์ของเบสนิวคลีโอไทด์ 1 เบส (point mutation) ภายในลำดับกรดอะมิโนที่เข้ารหัสโปรตีน และมีผลต่อการขนส่งโปรตีนเข้าไปที่ส่วนนอก (outer segment) ของเซลล์ ซึ่งเป็นส่วนที่ถ่ายโอนแสงเป็นกระแสประสาท อนึ่ง การพับตัวผิดปกติของโปรตีนกลายพันธุ์หมู่สอง (Class II) จะขัดการประกอบโปรตีนกับ 11-cis-retinal เพื่อสร้างส่วนกำเนิดสี (chromophore) ที่เหมาะสม การกลายพันธุ์อื่น ๆ ในยีนที่เข้ารหัสสารสีนี้จะมีผลต่อเสถียรภาพของโปรตีน, ทำลายบูรณภาพของ mRNA ในระยะ post-translational และมีผลต่ออัตราการก่อกัมมันต์ (activation rate) ของ transducin บวกกับอ็อปซินซึ่งเป็นโปรตีนนำแสง[26]
การทดลองในสัตว์ตัวแบบแสดงว่า เซลล์ชั้น retinal pigment epithelium ของจอตาไม่ทำการฟาโกไซโทซิสต่อจานส่วนนอกของเซลล์รูปแท่ง (outer rod segment disc) ที่หลุดออกแล้ว เป็นการสะสมเศษส่วนนอกที่ละทิ้งแล้วอย่างผิดปกติ ในหนูที่มีการกลายพันธุ์ให้จอตาเสื่อมและสืบทอดแบบ homozygous recessive เซลล์รูปแท่งจะหยุดพัฒนาการแล้วเสื่อมก่อนที่เซลล์จะโตเต็มที่ อนึ่ง ได้พบความบกพร่องของเอนไซม์ cGMP-phosphodiesterase อีกด้วย ซึ่งทำให้ cyclic guanosine monophosphate (cGMP) สะสมในระดับที่เป็นพิษ
การวินิจฉัย[แก้]
การวินิจฉัยโรคที่แม่นยำจะอาศัยประวัติความเสียหายที่แย่ลงอย่างต่อเนื่องของเซลล์รับแสง ซึ่งยืนยันด้วยการตรวจสอบต่าง ๆ รวมทั้งการตรวจลานสายตา (visual field test), การตรวจสายตา (visual acuity test), การถ่ายภาพจอตา, optical coherence imagery และ electroretinography (ERG)[27]
การตรวจลานสายตาและการตรวจสายตาเทียบขนาดลานสายตาและความคมชัดของการเห็นกับค่าวัดของบุคคลที่มีสายตาสมบูรณ์ (20/20 vision) ลักษณะทางคลินิกที่บ่งโรครวมทั้งลานสายตาที่แคบลงและแย่ลง ๆ และสายตาที่มองชัดแย่ลง ๆ[28] อนึ่ง การถ่ายภาพรังสีระนาบ (optical tomography) เช่นภาพ fundus optical coherence และ retinal optical coherence สามารถใช้ช่วยวินิจฉัยโรค การถ่ายภาพจอตาที่ขยายม่านตาแล้วช่วยยืนยันการเกิดรอยเปรอะดำคือ bony spicule ที่ก้นตา ซึ่งจะเกิดในระยะหลัง ๆ ของโรค เมื่อรวมกับภาพส่วนตัดด้วย optical coherence tomography ซึ่งให้ข้อมูลเกี่ยวกับความหนาของเซลล์รับแสง, สัณฐานของชั้นจอตา (retinal layer) และสรีรภาพของ retinal pigment epithelium ภาพถ่ายจอตาก็จะช่วยระบุความเคลื่อนไหวของโรคอาร์พี[29]
แม้การตรวจลานสายตา การตรวจสายตา และภาพจอตาจะสนับสนุนการวินิจฉัยเป็นโรคอาร์พี แต่การทดสอบอื่น ๆ ก็จำเป็นเพื่อยืนยันลักษณะอื่น ๆ ของโรค Electroretinography (ERG) ยืนยันการวินิจฉัยเพราะตรวจสอบการทำงานของสายตาเนื่องกับการเสื่อมของเซลล์รับแสง และสามารถตรวจจับความผิดปกติทางสรีรภาพก่อนที่อาการจะปรากฏ เจ้าหน้าที่จะใช้เลนส์ที่เป็นอิเล็กโทรดเพื่อวัดการตอบสนองของเซลล์รับแสงต่อแสงกะพริบที่ฉายให้ดูในระดับความสว่างต่าง ๆ คนไข้ที่มีฟีโนไทป์ของโรคจะมีการตอบสนองทางไฟฟ้าที่ลดลงหรือช้าลงของเซลล์รูปแท่ง และอาจจะเซลล์รูปกรวยด้วย[30]
เมื่อวินิจฉัย แพทย์อาจพิจารณาประวัติครอบครัวของคนไข้เพราะเป็นโรคที่อาจติดต่อทางกรรมพันธุ์ มียีนอย่างน้อย 35 ตำแหน่ง (locus) ที่เป็นเหตุของโรคแบบ "nonsyndromic" คืออาร์พีที่ไม่ใช่ผลของอีกโรคหนึ่ง หรือเป็นส่วนของกลุ่มอาการอื่น ๆ การกลายพันธุ์ของยีนที่ก่อโรคอาจระบุได้ด้วยการตรวจดีเอ็นเอ (DNA testing) ซึ่งมีใช้ทางคลินิกในบางประเทศ การกลายพันธุ์รวมทั้ง[31]
สำหรับยีนอื่น ๆ (เช่น DHDDS) การตรวจดีเอ็นเอมีใช้ในการวิจัยเท่านั้น
โรคสามารถสืบทอดทางพันธุกรรมแบบทายกรรมลักษณะเด่น (autosomal dominant), ทายกรรมลักษณะด้อย (autosomal recessive) หรือ X-linked แบบ X-linked อาจเป็นแบบด้อย (recessive) ซึ่งโดยหลักมีผลต่อผู้ชายเท่านั้น หรือเป็นแบบเด่น (dominant) ซึ่งมีผลต่อทั้งชายหญิง แม้ชายจะมีอาการเบากว่า รูปแบบโรคที่เกิดจากยีนสองยีน (digenic) และจากไมโทคอนเดรียก็มีด้วย
ในบางประเทศ เจ้าหน้าที่อาจให้คำปรึกษาเกี่ยวกับปัญหาการสืบทอดทางพันธุกรรมในครอบครัว โดยขึ้นอยู่กับการวินิจฉัยที่ทำอย่างแม่นยำ การระบุวิธีสืบทอดทางพันธุกรรม และผลการตรวจดีเอ็นเอ
การรักษา[แก้]
ปัจจุบันยังไม่มีวิธีรักษาโรคให้หาย แม้จะมีการตรวจสอบประสิทธิผลและความปลอดภัยของวิธีการรักษาต่าง ๆ อยู่ ประสิทธิภาพของอาหารเสริมต่าง ๆ เช่น วิตามินเอ, กรดไขมัน docosahexaenoic acid (DHA) และ Lutein เพื่อชะลอโรคยังเป็นเรื่องยังไม่ยุติ แต่ก็เป็นทางเลือกในการรักษา[32][33] การทดลองทางคลินิกที่ตรวจสอบอุปกรณ์ฝังที่จอตา/เรตินาเทียม (optic prosthetic device), การบำบัดด้วยยีน (gene therapy) และการผ่าตัดเปลี่ยนจอตา (retinal sheet transplantation) เป็นเรื่องที่กำลังศึกษาเพื่อคืนการเห็นเป็นบางส่วนให้แก่คนไข้โรคอาร์พี[34]
วิตามิน A ในรูปแบบ Palmitate[แก้]
งานวิจัยปี 1993 ของศาสตราจารย์จักษุวิทยาผู้หนึ่งแห่งมหาวิทยาลัยฮาร์วาร์ดแสดงว่า คนไข้บางพวกสามารถชะลอความเสื่อมของเซลล์รูปแท่งโดยทานวิตามินเอในรูปแบบของ vitamin A palmitate ประมาณ 15,000 หน่วยสากล (เท่ากับ 4.5 มิลลิกรัม) ต่อวัน[35] แม้จะไม่พบปัญหาความปลอดภัยเมื่อใช้วิตามินเอในระดับสูงในช่วงระยะงานวิจัย แต่ความปลอดภัยระยะยาวก็ยังไม่ชัดเจน เพราะการใช้วิตามินเอในระดับนี้อาจมีผลข้างเคียงหลายอย่างและจัดว่า สามารถก่อความผิดปกติทางพัฒนาการ (teratogenic) อนึ่ง บทความปริทัศน์ปี 2004 สรุปว่า
งานวิจัยและข้อแนะนำ (ของศาสตราจารย์ที่ว่า) นั้นยังมีข้อโต้แย้งอยู่ มีการเสนอว่า มีความจำเป็นต้องมีหลักฐานพิสูจน์ว่า มีประโยชน์ที่กว้างขวางยิ่งกว่านี้ ก่อนที่จะแนะนำการใช้วิตามินเอสำหรับอาร์พี[36]
งานวิจัยของศาสตราจารย์คนเดียวกันปี 2007 แสดงว่าการใช้วิตามินเอที่เหมาะสมสำหรับคนไข้ในบางระยะของโรคบางรูปแบบ สามารถชะลอการตาบอดได้ถึง 10 ปี โดยลดความเสียหายที่เกิดขึ้นในอัตรา 10% ต่อปีให้เป็น 8.3% ต่อปี[37]
เรตินาเทียม[แก้]
อุปกรณ์ฝังในตา/เรตินาเทียม Argus II retinal prosthesis เป็นวิธีการรักษาโรคแรกที่ได้รับอนุมัติในเดือนกุมภาพันธ์ 2011 ปัจจุบันมีใช้รักษาในประเทศเยอรมนี ฝรั่งเศส อิตาลี และสหราชอาณาจักร[38] ผลในระหว่างที่ได้จากคนไข้ 30 คนในการทดลองระยะยาวได้เผยแพร่ในปี 2012[39]
ต่อมาปี 2013 องค์การอาหารและยาสหรัฐจึงได้อนุมัติให้ใช้การรักษานี้ในสหรัฐอเมริกา[40] อุปกรณ์อาจช่วยคนไข้โรคอาร์พีผู้ใหญ่ที่เสียการเห็นรูปร่างและการเคลื่อนไหวเพื่อให้สามารถใช้ชีวิตประจำวันและช่วยเหลือตัวเองได้ดีขึ้น แม้คนไข้จะเห็นได้ชัดเจนที่สุดในระดับ 20/1260 เท่านั้น[41] ซึ่งยังจัดว่าบอดอยู่ทั้งโดยองค์การอนามัยโลกและประเทศสหรัฐอเมริกา ในเดือนมิถุนายน 2013 รพ. 12 แห่งในสหรัฐประกาศว่าจะเริ่มรับคนไข้โรคอาร์พีที่สนใจจะใช้อุปกรณ์ที่จะเริ่มวางตลาดในปลายปีนั้น[42] ค่าใช้จ่ายสำหรับอุปกรณ์อยู่ที่ 150,000 ดอลลาร์สหรัฐ (ประมาณ 4.7 ล้านบาท) โดยไม่รวมค่าผ่าตัดหรือค่าฝึกใช้อุปกรณ์[43][44]
ส่วนอุปกรณ์ Alpha-IMS เป็นไมโครชิปบันทึกภาพที่สามารถผ่าตัดฝังใต้รอยบุ๋มจอตา (fovea) แต่เพื่อศึกษาว่าอุปกรณ์สามารถทำให้เห็นดีขึ้นหรือไม่ ผู้ผลิตจำต้องแสดงความปลอดภัยของอุปกรณ์ก่อนทำการทดลองทางคลินิกและอนุมัติให้วางตลาด[45] โดยค่าอุปกรณ์และการผ่าตัดจะอยู่ที่ประมาณ 100,000 ยูโร (ประมาณ 4.1 ล้านบาท)[46]
การบำบัดด้วยยีน (gene therapy)[แก้]
ส่วนเป้าหมายของการศึกษาเรื่องการบำบัดด้วยยีน (gene therapy) ก็คือเพื่อเสริมเซลล์จอตาอันแสดงออกยีนที่กลายพันธุ์ซึ่งสัมพันธ์กับฟีโนไทป์ของโรคด้วยยีนที่ดี เพื่อให้เซลล์รับแสงสามารถซ่อมแซมตนเองและทำงานได้อย่างถูกต้องด้วยข้อมูลที่ได้จากยีนที่ดี การทดลองทางคลินิกที่ใส่ยีน RPE65 ปกติในจอตาที่แสดงออกฟีโนไทป์โรคอาร์พีแบบ LCA2 (Leber's congenital amaurosis) พบว่าทำให้เห็นดีขึ้นได้เล็กน้อย แต่เซลล์รับแสงก็ยังเสื่อมในอัตราปกติของโรค[47] การบำบัดด้วยยีนน่าจะช่วยรักษาเซลล์จอตาที่ยังดีอยู่ แต่ไม่สามารถซ่อมความเสียหายต่อเซลล์รับแสงที่สั่งสมมาก่อน ๆ ได้[34] โดยทฤษฎีแล้ว การตอบสนองรับการบำบัดด้วยยีนน่าจะดีต่อคนไข้วัยเยาว์ที่โรคมีระยะการดำเนินสั้นที่สุด เพราะมีโอกาสช่วยเซลล์ให้พ้นโรคด้วยยีนที่ใส่เข้าไปมากที่สุด[48]
ในปี 2017 องค์การอาหารและยาสหรัฐอนุมัติการบำบัดด้วยีนที่เรียกว่า Luxturna เพื่อรักษาคนไข้ที่จอตาฝ่อ (retinal dystrophy) เนื่องกับการกลายพันธุ์ของยีน RPE65[49] ค่ารักษาอยู่ที่ 850,000 ดอลลาร์สหรัฐ (ประมาณ 27.5 ล้านบาท) สำหรับตาทั้งสองข้างเมื่อต้นปี 2018[50]
พยากรณ์โรค[แก้]
เพราะโรคแย่ลงเรื่อย ๆ และไม่มีวิธีการรักษา คนไข้จึงมีพยากรณ์โรคที่ไม่ค่อยดี แม้ปกติตาจะไม่บอดโดยสิ้นเชิง[51] สายตาและลานสายตาของคนไข้จะแย่ลงเรื่อย ๆ เริ่มจากการเสื่อมของเซลล์รูปแท่งและต่อมาเซลล์รูปกรวย การรักษาที่เป็นไปได้ก็ยังอยู่ในระยะวิจัยหรือการทดลองทางคลินิก อย่างไรก็ดี การรักษาด้วยการคืนสภาพสายตาดูเหมือนจะมีอนาคตที่แจ่มใส
งานศึกษาได้แสดงว่า เด็กที่มีจีโนไทป์ของโรคจะได้ประโยชน์จากการปรึกษากับแพทย์ก่อนจะมีโรค เพื่อเตรียมตัวรับมือปัญหาทางตาและทางสังคมเนื่องกับสายตาที่แย่ลงเรื่อย ๆ แม้ปัญหาทางจิตใจจะดีขึ้นเมื่อทำเช่นนี้[52] แต่ผลทางตาและการแย่ลงของโรคโดยมากจะขึ้นอยู่กับอายุที่อาการเริ่มปรากฏและอัตราการเสื่อมของเซลล์รับแสง ไม่ใช่การมีโอกาสไปหาแพทย์ อุปกรณ์ปรับสายตาและการบำบัดตาที่ปรับให้เหมาะกับตนซึ่งทำกับผู้เชี่ยวชาญในเรื่องการมองเห็นได้น้อย อาจช่วยคนไข้แก้ปัญหาการมองเห็น คือช่วยให้มองด้วยลานสายตาที่เหลืออยู่ได้ดีที่สุด กลุ่มสนับสนุน, ประกันเกี่ยวกับสายตา และการปรับวิถีชีวิต อาจเป็นประโยชน์ในการรับมือกับการเห็นที่ลดลง[27]
วิทยาการระบาด[แก้]
โรคอาร์พีเป็นเหตุชั้นนำของความตาบอดที่สืบทอดทางพันธุกรรม[53] คนประมาณ 1 ใน 4,000 คนจะมีโรคแบบไม่เกิดร่วมกับความผิดปกติอื่น ๆ (non-syndromic) ในช่วงชีวิต[54] ประเมินว่ามีคน 1.5 ล้านคนทั่วโลกที่มีโรค โรคที่เริ่มเกิดเร็วจะเกิดภายในไม่กี่ปีแรกของชีวิตและปกติจะสัมพันธ์กับความผิดปกติอื่น ๆ ในขณะที่โรคที่เริ่มเกิดช้าจะปรากฏในวัยผู้ใหญ่ต้น ๆ จนถึงวัยกลางคน
โรคที่สืบทอดแบบทายกรรมลักษณะเด่นและทายกรรมลักษณะด้อยจะมีทั้งในชายหญิงเท่า ๆ กัน แต่โรคที่สืบทอดแบบ X-linked ซึ่งมีน้อยกว่าจะมีผลต่อชายที่ได้รับยีนกลายพันธุ์ แต่หญิงจะเป็นพาหะของโรคโดยไม่มีอาการ รูปแบบนี้จัดว่ารุนแรง และปกติจะทำให้ตาบอดสนิทในช่วงท้าย ๆ ส่วนในกรณีที่มีน้อย โรคที่สืบทอดแบบ X-linked เป็นลักษณะเด่นจะมีผลต่อทั้งชายหญิงเท่า ๆ กัน[55]
เนื่องจากการสืบทอดทางพันธุกรรมของโรค กลุ่มประชากรที่แยกอยู่ต่างหากจะเกิดโรคบ่อยกว่าหรือมีความชุกโรคที่สูงขึ้นโดยมีการกลายพันธุ์ของยีนโดยเฉพาะ ๆ ที่ก่อโรค การกลายพันธุ์ไม่ว่าจะเป็นแบบที่มีอยู่แล้วหรือเกิดขึ้นใหม่ซึ่งทำให้เซลล์รับแสงรูปแท่งเสื่อมในโรคอาร์พีจะสืบทอดมาตามครอบครัว ดังนั้น จึงทำให้โรคเกิดขึ้นมากในภูมิภาคบางส่วนโดยปรากฏประวัติในครอบครัว มีงานศึกษาหลายงานที่ได้ทำเพื่อระบุความชุกโรคต่าง ๆ ในรัฐเมน (สหรัฐ) เมืองเบอร์มิงแฮม (สหราชอาณาจักร) ประเทศสวิตเซอร์แลนด์ (1 คนใน 7,000 คน) ประเทศเดนมาร์ก (1 คนใน 2,500 คน) และประเทศนอร์เวย์[56] คนพื้นเมืองอเมริกันชาวนาวาโจ (Navajo) มีระดับการสืบทอดโรคที่สูงขึ้นเช่นกัน โดยประเมินว่ามีผลต่อคน 1 คนทุก ๆ 1,878 คน โรคอาร์พีแม้จะสืบทอดตามกรรมพันธุ์ในครอบครัว แต่ก็จัดว่าไม่จำกัดเฉพาะกลุ่มบุคคล ๆ เพราะมีผลต่อประชากรทั่วโลก
งานวิจัย[แก้]
การรักษาในอนาคตอาจรวมการผ่าตัดเปลี่ยนจอตา การใช้จอตาเทียม[57] การบำบัดด้วยยีน (gene therapy) การบำบัดด้วยเซลล์ต้นกำเนิด อาหารเสริม และ/หรือยารักษา
ในปี 2006 นักวิจัยชาวอังกฤษได้ปลูกเซลล์ต้นกำเนิดที่ได้พัฒนาการมาจนถึงระยะสุดท้ายพร้อมที่จะกลายเป็นเซลล์รับแสง เข้าในตาของหนูที่ได้เปลี่ยนพันธุกรรมให้มีอาการเลียนโรคอาร์พีและโรคจุดภาพชัดของจอตาเสื่อมของมนุษย์ แล้วพบว่า เซลล์รับแสงเช่นนี้ได้พัฒนาการแล้วเชื่อมต่อกับเซลล์ประสาทในจอตาของหนู ซึ่งเป็นขั้นตอนสำคัญในการคืนสภาพสายตา เพราะก่อนหน้านี้ได้เชื่อว่า จอตาที่พัฒนาสมบูรณ์แล้วไม่สามารถฟื้นฟูซ่อมแซมได้ งานวิจัยนี้อาจทำให้สามารถปลูกฝังเซลล์เช่นนี้ในมนุษย์ในอนาคตได้[58]
ในปี 2008 นักวิทยาศาสตร์ชาวญี่ปุ่นที่สถาบันชีววิทยาศาสตร์โอซากะ (Osaka Bioscience Institute) ได้ค้นพบโปรตีนที่ตั้งชื่อว่า Pikachurin ซึ่งพวกเขาเชื่อว่าอาจนำไปสู่วิธีการรักษาโรคอาร์พี[59][60]
ในปี 2008 มีความพยายามที่จะเชื่อมการแสดงออกของยีน FAM46A กับโรค[61]
ในปี 2010 การรักษาด้วยยีนวิธีหนึ่งดูเหมือนจะได้ผลในหนู[62]
ในปี 2012 นักวิทยาศาสตร์ที่ศูนย์การแพทย์มหาวิทยาลัยโคลัมเบียได้แสดงกับสัตว์ตัวแบบว่า การรักษาด้วยยีน (gene therapy) และการรักษาด้วยเซลล์ต้นกำเนิดแบบ induced pluripotent stem cell อาจเป็นทางเลือกที่เป็นไปได้เพื่อรักษาโรคในอนาคต[63][64]
ในปี 2012 นักวิทยาศาสตร์ที่สถาบันจักษุแบสคอมปาลเมอร์ (Bascom Palmer Eye Institute) แห่งมหาวิทยาลัยไมแอมี ได้แสดงการป้องกันรักษาเซลล์รับแสงในสัตว์ตัวแบบ เมื่อฉีด mesencephalic astrocyte-derived neurotrophic factor (MANF) เข้าไปในตา[65][66]
ในปี 2014 นักวิจัยที่มหาวิทยาลัยแคลิฟอร์เนีย เบิร์กลีย์ได้คืนสภาพการเห็นของหนูตาบอดโดยใช้ photoswitch ที่เริ่มการทำงานของ retinal ganglion cell ในสัตว์ที่มีเซลล์รับแสง (ทั้งรูปแท่งและรูปกรวย) เสียหาย[67]
งานศึกษาปี 2015 ที่ศูนย์การแพทย์ซีดาร์ส-ซีนาย (Cedars-Sinai Medical Center) ในนครลอสแอนเจลิสแสดงว่า ยีน CRISPR/Cas9 สามารถใช้รักษาหนูที่มีโรคซึ่งสืบทอดแบบทายกรรมลักษณะเด่น[68][69]
ในปี 2016 บริษัท RetroSense Therapeutics มีแผนจะฉีดไวรัสที่มีดีเอ็นเอของสาหร่ายไวแสงเข้าไปในตาของคนตาบอดเนื่องกับโรคอาร์พีหลายคน โดยเป็นโครงการที่ได้รับอนุมัติจากองค์การอาหารและยาสหรัฐ ถ้าประสบความสำเร็จ ก็จะเห็นเป็นขาวดำ[70][71]
ดูเพิ่ม[แก้]
เชิงอรรถ[แก้]
- ↑ missense mutation เป็น point mutation คือนิวคลีโอไทด์อันหนึ่งเปลี่ยนไป มีผลกลายเป็น codon ที่เข้ารหัสสำหรับกรดอะมิโนที่ต่างกัน
- ↑ ในอณูชีววิทยา molecular chaperone เป็นโปรตีนที่ช่วยในการพับ (folding) หรือการคลี่ (unfolding) หรือการประกอบ (assembly) หรือการแยก (disassembly) โครงสร้างมาโครโมเลกุลอื่น ๆ chaperone จะมีในสถานการณ์ที่มาโครโมเลกุลต้องทำกิจทางชีววิทยาของตน ๆ เพื่อให้การพับ/การประกอบทำสำเร็จอย่างถูกต้อง
อ้างอิง[แก้]
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 "Facts About Retinitis Pigmentosa". National Eye Institute (ภาษาอังกฤษ). May 2014. เก็บจากแหล่งเดิมเมื่อ 2019-03-07. สืบค้นเมื่อ 2017-12-02.
- ↑ "Retinitis pigmentosa", ศัพท์บัญญัติอังกฤษ-ไทย, ไทย-อังกฤษ ฉบับราชบัณฑิตยสถาน (คอมพิวเตอร์) รุ่น ๑.๑ ฉบับ ๒๕๔๕,
(แพทยศาสตร์) โรคจอตามีสารสี
- ↑ นพ. สมเกียรติ อธิคมกุลชัย. "โรคอาร์พี". เก็บจากแหล่งเดิมเมื่อ 2018-11-07. สืบค้นเมื่อ 2014-06-03.
- ↑ 4.0 4.1 4.2 4.3 Openshaw, Amanda (Feb 2008). Understanding Retinitis Pigmentosa (PDF). University of Michigan Kellogg Eye Center. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2017-08-29. สืบค้นเมื่อ 2017-12-02.
- ↑ 5.0 5.1 Shintani, Kelly; Shechtman, Diana L.; Gurwood, Andrew S. (2009). "Review and update: Current treatment trends for patients with retinitis pigmentosa". Optometry. 80 (7): 384–401. doi:10.1016/j.optm.2008.01.026. PMID 19545852.
- ↑ 6.0 6.1 Soucy, E; Wang, Y; Nirenberg, S; Nathans, J; Meister, M (1998). "A Novel Signaling Pathway from Rod Photoreceptors to Ganglion Cells in Mammalian Retina". Neuron. 21 (3): 481–93. doi:10.1016/S0896-6273(00)80560-7. PMID 9768836.
- ↑ 7.0 7.1 7.2 Hartong, Dyonne T; Berson, Eliot L; Dryja, Thaddeus P (2006). "Retinitis pigmentosa". The Lancet. 368 (9549): 1795–1809. doi:10.1016/S0140-6736(06)69740-7. PMID 17113430.
- ↑
O'Neal, Teri B; Luther, Euil E (2018-12-20). "Retinitis Pigmentosa". StatPearls Publishing LLC. เก็บจากแหล่งเดิมเมื่อ 2019-04-16.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Lim, Jennifer I; Chow, Clement C; Genead, Mohamed Ali; Akkara, John Davis; Epley, K David; Shah, Vinay A (2019-03-14). "Retinitis Pigmentosa". American Academy of Ophthalmology. เก็บจากแหล่งเดิมเมื่อ 2018-07-30.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Daiger, S P; Sullivan, L S; Bowne, S J (2013). "Genes and mutations causing retinitis pigmentosa". Clinical Genetics. 84 (2): 132–41. doi:10.1111/cge.12203. PMC 3856531. PMID 23701314.
- ↑ "Usher Syndrome". เก็บจากแหล่งเดิมเมื่อ 2016-08-17.
- ↑ "Diseases - MM - Types Of Overview". Muscular Dystrophy Association. 2015-12-18. เก็บจากแหล่งเดิมเมื่อ 2018-01-17.
- ↑ "Bardet-Biedl (Laurence Moon)". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-08-17.
- ↑ Farrar, GJ; Kenna, PF; Humphries, P (March 2002). "On the genetics of retinitis pigmentosa and on mutation-independent approaches to therapeutic intervention". EMBO J. 21 (5): 857–64. doi:10.1093/emboj/21.5.857. PMC 125887. PMID 11867514.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Online 'Mendelian Inheritance in Man' (OMIM) RETINITIS PIGMENTOSA; RP -268000
- ↑ 16.0 16.1 Rivolta, C.; Sharon, D; Deangelis, M. M.; Dryja, T. P. (2002). "Retinitis pigmentosa and allied diseases: Numerous diseases, genes, and inheritance patterns". Human Molecular Genetics. 11 (10): 1219–27. doi:10.1093/hmg/11.10.1219. PMID 12015282.
- ↑ 17.0 17.1 Berson, Eliot L.; Rosner, B; Sandberg, M. A.; Dryja, T. P. (1991). "Ocular Findings in Patients with Autosomal Dominant Retinitis Pigmentosa and a Rhodopsin Gene Defect (Pro-23-His)". Archives of Ophthalmology. 109 (1): 92–101. doi:10.1001/archopht.1991.01080010094039. PMID 1987956.
- ↑ Senin, Ivan I.; Bosch, Laia; Ramon, Eva; Zernii, Evgeni Yu.; Manyosa, Joan; Philippov, Pavel P.; Garriga, Pere (2006). "Ca2+/recoverin dependent regulation of phosphorylation of the rhodopsin mutant R135L associated with retinitis pigmentosa". Biochemical and Biophysical Research Communications. 349 (1): 345–52. doi:10.1016/j.bbrc.2006.08.048. PMID 16934219.
- ↑ Dryja, Thaddeus P.; McGee, Terri L.; Reichel, Elias; Hahn, Lauri B.; Cowley, Glenn S.; Yandell, David W.; Sandberg, Michael A.; Berson, Eliot L. (1990). "A point mutation of the rhodopsin gene in one form of retinitis pigmentosa". Nature. 343 (6256): 364–6. Bibcode:1990Natur.343..364D. doi:10.1038/343364a0. PMID 2137202.
- ↑ Dryja, Thaddeus P.; McGee, Terri L.; Hahn, Lauri B.; Cowley, Glenn S.; Olsson, Jane E.; Reichel, Elias; Sandberg, Michael A.; Berson, Eliot L. (1990). "Mutations within the Rhodopsin Gene in Patients with Autosomal Dominant Retinitis Pigmentosa". New England Journal of Medicine. 323 (19): 1302–7. doi:10.1056/NEJM199011083231903. PMID 2215617.
- ↑ Berson, E. L.; Rosner, B; Sandberg, M. A.; Weigel-Difranco, C; Dryja, T. P. (1991). "Ocular findings in patients with autosomal dominant retinitis pigmentosa and rhodopsin, proline-347-leucine". American Journal of Ophthalmology. 111 (5): 614–23. doi:10.1016/s0002-9394(14)73708-0. PMID 2021172.
- ↑ Inglehearn, C. F.; Bashir, R; Lester, D. H.; Jay, M; Bird, A. C.; Bhattacharya, S. S. (1991). "A 3-bp deletion in the rhodopsin gene in a family with autosomal dominant retinitis pigmentosa". American Journal of Human Genetics. 48 (1): 26–30. PMC 1682750. PMID 1985460.
- ↑ Oh, Kean T.; Weleber, R. G.; Lotery, A; Oh, D. M.; Billingslea, A. M.; Stone, E. M. (2000). "Description of a New Mutation in Rhodopsin, Pro23Ala, and Comparison with Electroretinographic and Clinical Characteristics of the Pro23His Mutation". Archives of Ophthalmology. 118 (9): 1269–76. doi:10.1001/archopht.118.9.1269. PMID 10980774.
- ↑ 24.0 24.1 "Retinitis pigmentosa". NIH, US National Library of Medicine. เก็บจากแหล่งเดิมเมื่อ 2019-02-06. สืบค้นเมื่อ 2019-04-06.
- ↑ Bujakowska, K.; Maubaret, C.; Chakarova, C. F.; Tanimoto, N.; Beck, S. C.; Fahl, E.; Humphries, M. M.; Kenna, P. F.; Makarov, E.; Makarova, O.; Paquet-Durand, F.; Ekstrom, P. A.; Van Veen, T.; Leveillard, T.; Humphries, P.; Seeliger, M. W.; Bhattacharya, S. S. (2009). "Study of Gene-Targeted Mouse Models of Splicing Factor Gene Prpf31 Implicated in Human Autosomal Dominant Retinitis Pigmentosa (RP)". Investigative Ophthalmology & Visual Science. 50 (12): 5927–5933. doi:10.1167/iovs.08-3275. PMID 19578015.
- ↑ Mendes, HF; van der Spuy, J; Chapple, JP; Cheetham, ME (April 2005). "Mechanisms of cell death in rhodopsin retinitis pigmentosa: implications for therapy". Trends in Molecular Medicine. 11 (4): 177–185. doi:10.1016/j.molmed.2005.02.007. PMID 15823756.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 27.0 27.1 "Understanding Retinitis Pigmentosa" (PDF). คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2017-03-29. สืบค้นเมื่อ 2015-03-16.
- ↑ Fahim, Abigail T (1993). "Nonsyndromic Retinitis Pigmentosa Overview". Retinitis Pigmentosa Overview. University of Washington, Seattle.
- ↑ Chang, S; Vaccarella, L; Olatunji, S; Cebulla, C; Christoforidis, J (2011). "Diagnostic Challenges in Retinitis Pigmentosa: Genotypic Multiplicity and Phenotypic Variability". Current Genomics. 12 (4): 267–75. doi:10.2174/138920211795860116. PMC 3131734. PMID 22131872.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Gundogan, Fatih Cakir; Tas, Ahmet; Sobaci, Gungor (2011). Belusic, Gregor (บ.ก.). Electroretinogram in Hereditary Retinal Disorders (PDF). Electroretinograms. Turkey: In Tech. ISBN 978-953-307-383-5. เก็บ (PDF)จากแหล่งเดิมเมื่อ 2017-11-17.
- ↑ "Retinitis Pigmentosa". เก็บจากแหล่งเดิมเมื่อ 2018-12-22.
- ↑
Hartong, DT; Berson, EL; Dryja, TP (November 2006). "Retinitis pigmentosa". The Lancet. 368 (9549): 1795–1809. doi:10.1016/S0140-6736(06)69740-7. PMID 17113430.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Rayapudi, S; Schwartz, SG; Wang, X; Chavis, P (2013). "Vitamin A and fish oils for retinitis pigmentosa". Cochrane Database Syst Rev. 12 (12): CD008428. doi:10.1002/14651858.CD008428.pub2. PMC 4259575. PMID 24357340.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 34.0 34.1 Lok, Corie (2014). "Curing blindness: Vision quest". Nature News & Comment. 513 (7517): 160–162. doi:10.1038/513160a. PMID 25209781.
- ↑ Berson, Eliot L.; Rosner, B; Sandberg, M. A.; Hayes, K. C.; Nicholson, B. W.; Weigel-Difranco, C; Willett, W (1993). "A Randomized Trial of Vitamin a and Vitamin E Supplementation for Retinitis Pigmentosa". Archives of Ophthalmology. 111 (6): 761–72. doi:10.1001/archopht.1993.01090060049022. PMID 8512476.
- ↑ Sharma, Yog Raj; Reddy, P Raja Rami; Singh, Deependra V (2004). "Retinitis Pigmentosa and Allied Disorders (Review Article)" (PDF). JK SCIENCE. 6 (3): 115–120. สืบค้นเมื่อ 5 มิถุนายน 2557.
{{cite journal}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help)CS1 maint: uses authors parameter (ลิงก์) - ↑ Berson, Eliot L. (2007). "Long-term visual prognoses in patients with retinitis pigmentosa: The Ludwig von Sallmann lecture". Experimental Eye Research. 85 (1): 7–14. doi:10.1016/j.exer.2007.03.001. PMC 2892386. PMID 17531222.
- ↑ "Nahrungsergänzungsmittel: ALLES, was du wissen musst!". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-08-19. สืบค้นเมื่อ 2013-08-19. [ต้องการอ้างอิงเต็มรูปแบบ]
- ↑ Humayun, Mark S.; Dorn, Jessy D.; Da Cruz, Lyndon; Dagnelie, Gislin; Sahel, José-Alain; Stanga, Paulo E.; Cideciyan, Artur V.; Duncan, Jacque L.; Eliott, Dean; Filley, Eugene; Ho, Allen C.; Santos, Arturo; Safran, Avinoam B.; Arditi, Aries; Del Priore, Lucian V.; Greenberg, Robert J.; Argus Ii Study, Group (2012). "Interim Results from the International Trial of Second Sight's Visual Prosthesis". Ophthalmology. 119 (4): 779–88. doi:10.1016/j.ophtha.2011.09.028. PMC 3319859. PMID 22244176.
- ↑ "FDA approves first retinal implant for adults with rare genetic eye disease". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-07-27.
- ↑ Fernandes, RA; Diniz, B; Ribeiro, R; Humayun, M (2012-06-25). "Artificial vision through neuronal stimulation". Neuroscience letters. 519 (2): 122–8. PMID 22342306.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "'First Bionic Eye' Retinal Chip for Blind". Science Daily. 2013-06-29. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2019-02-27. สืบค้นเมื่อ 2013-06-30.
- ↑ "The Argus II Retinal Prosthesis ("Bionic Eye") Receives Medicare Approval". Visionware, American Printing House for the Blind. 2013-08-19. เก็บจากแหล่งเดิมเมื่อ 2018-12-31.
- ↑
Belluck, Pam (2013-02-15). "Device Offers Partial Vision for the Blind". New York Times. เก็บจากแหล่งเดิมเมื่อ 2019-04-12.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Stingl, K; Bartz-Schmidt, KU; Besch, D; Braun, A; Bruckmann, A; Gekeler, F; Greppmaier, U; Hipp, S; Hörtdörfer, G; Kernstock, C; Koitschev, A; Kusnyerik, A; Sachs, H; Schatz, A; Stingl, KT; Peters, T; Wilhelm, B; Zrenner, E (2013). "Artificial vision with wirelessly powered subretinal electronic implant alpha-IMS". Proc. Biol. Sci. 280 (1757): 20130077. doi:10.1098/rspb.2013.0077. PMC 3619489. PMID 23427175.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "A Second Artificial Retina Option for the E.U." Technology Review. 2013-07-03.
- ↑ Bainbridge, James W.B.; Smith, Alexander J.; Barker, Susie S.; Robbie, Scott; Henderson, Robert; Balaggan, Kamaljit; Viswanathan, Ananth; Holder, Graham E.; Stockman, Andrew; Tyler, Nick; Petersen-Jones, Simon; Bhattacharya, Shomi S.; Thrasher, Adrian J.; Fitzke, Fred W.; Carter, Barrie J.; Rubin, Gary S.; Moore, Anthony T.; Ali, Robin R. (2008). "Effect of Gene Therapy on Visual Function in Leber's Congenital Amaurosis". New England Journal of Medicine. 358 (21): 2231–9. CiteSeerX 10.1.1.574.4003. doi:10.1056/NEJMoa0802268. PMID 18441371.
- ↑ Maguire, AM; High, KA; Auricchio, A และคณะ (November 2009). "Age-dependent effects of RPE65 gene therapy for Lebers congenital amaurosis: a phase 1 dose-escalation trial". The Lancet. 374 (9701): 1597–1605. doi:10.1016/S0140-6736(09)61836-5. PMC 4492302. PMID 19854499.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Commissioner, Office of the. "Press Announcements - FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss". www.fda.gov (ภาษาอังกฤษ). เก็บจากแหล่งเดิมเมื่อ 2019-03-12. สืบค้นเมื่อ 2019-01-16.
- ↑ "Spark's price for Luxturna blindness gene therapy too high: ICER". Reuters. 2018-01-13. เก็บจากแหล่งเดิมเมื่อ 2018-12-05.
- ↑ "Well". The New York Times.[ลิงก์เสีย]
- ↑ Mezer, E; Babul-Hirji, R; Wise, R; Chipman, M; Dasilva, L; Rowell, M; Thackray, R; Shuman, C. T.; Levin, A. V. (2007). "Attitudes regarding predictive testing for retinitis pigmentosa". Ophthalmic Genet. 28 (1): 9–15. doi:10.1080/13816810701199423. PMID 17454742.
- ↑ Parmeggiani, F (2011). "Clinics, Epidemiology and Genetics of Retinitis Pigmentosa". Current Genomics. 12 (4): 236–7. doi:10.2174/138920211795860080. PMC 3131730. PMID 22131868.
- ↑ Hamel, Christian (2006). "Retinitis pigmentosa". Orphanet Journal of Rare Diseases. 1: 40. doi:10.1186/1750-1172-1-40. PMC 1621055. PMID 17032466.
- ↑ Prokisch, Holger; Hartig, Monika; Hellinger, Rosa; Meitinger, Thomas; Rosenberg, Thomas (2007). "IOVS - A Population-Based Epidemiological and Genetic Study of X-Linked Retinitis Pigmentosa". Investigative Ophthalmology & Visual Science. 48 (9): 4012–8. doi:10.1167/iovs.07-0071. PMID 17724181.
- ↑ Haim, Marianne (2002). "The epidemiology of retinitis pigmentosa in Denmark". Acta Ophthalmologica Scandinavica. 80: 1–34. doi:10.1046/j.1395-3907.2002.00001.x.
- ↑ "Ophthalmologists Implant Five Patients with Artificial Silicon Retina Microchip To Treat Vision Loss from Retinitis Pigmentosa" (Press release). Rush University Medical Center. 2005-01-31. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2005-02-08. สืบค้นเมื่อ 2007-06-16.
- ↑ MacLaren, R. E.; Pearson, R. A.; MacNeil, A.; Douglas, R. H.; Salt, T. E.; Akimoto, M.; Swaroop, A.; Sowden, J. C.; Ali, R. R. (2006). "Retinal repair by transplantation of photoreceptor precursors". Nature. 444 (7116): 203–7. Bibcode:2006Natur.444..203M. doi:10.1038/nature05161. PMID 17093405.
- ↑ Sato, Shigeru; Omori, Yoshihiro; Katoh, Kimiko; Kondo, Mineo; Kanagawa, Motoi; Miyata, Kentaro; Funabiki, Kazuo; Koyasu, Toshiyuki; Kajimura, Naoko; Miyoshi, Tomomitsu; Sawai, Hajime; Kobayashi, Kazuhiro; Tani, Akiko; Toda, Tatsushi; Usukura, Jiro; Tano, Yasuo; Fujikado, Takashi; Furukawa, Takahisa (2008). "Pikachurin, a dystroglycan ligand, is essential for photoreceptor ribbon synapse formation". Nature Neuroscience. 11 (8): 923–31. doi:10.1038/nn.2160. PMID 18641643.
- ↑ Levenstein, Steve (2008-07-24). "Lightning-Fast Vision Protein Named After Pikachu". InventorSpot.com. Halcyon Solutions. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2017-07-11. สืบค้นเมื่อ 2014-06-12.
- ↑ Barragán, L; Borrego, S; Abd El-Aziz, MM; El-Ashry, MF; Antiñolo, G (January 2008). "Genetic analysis of FAM46A in Spanish families with autosomal recessive retinitis pigmentosa: characterisation of novel VNTRs". Annals of Human Genetics. 72 (Pt 1): 26–34. doi:10.1111/j.1469-1809.2007.00393.x. PMID 17803723.
- ↑ Busskamp, V.; Duebel, J.; Balya, D.; Fradot, M.; Viney, T. J.; Siegert, S.; Groner, A. C.; Cabuy, E.; Forster, V.; Seeliger, M.; Biel, M.; Humphries, P.; Paques, M.; Mohand-Said, S.; Trono, D.; Deisseroth, K.; Sahel, J. A.; Picaud, S.; Roska, B. (2010). "Genetic Reactivation of Cone Photoreceptors Restores Visual Responses in Retinitis Pigmentosa" (PDF). Science. 329 (5990): 413–7. Bibcode:2010Sci...329..413B. doi:10.1126/science.1190897. PMID 20576849.
- ↑ "Experiments show retinitis pigmentosa is treatable". Stem Cells Freak. 2012-12-22. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-12-13.
- ↑ "Two Treatments for Retinitis Pigmentosa Move Closer to Clinical Trials" (Press release). Columbia University Medical Center. 2012-12-20. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-06-27. สืบค้นเมื่อ 2016-08-07.
- ↑ Wen, Rong; Luo, Lingyu; Huang, Dequang; Xia, Xin; Wang, Zhengying; Chen, Pingping; Li, Yiwen (March 2012). "Mesencephalic Astrocyte-derived Neurotrophic Factor (MANF) Protects Rod and Cone Photoreceptors from Degeneration in Transgenic Rats Carrying the S334ter Rhodopsin Mutation". Invest. Ophthalmol. Vis. Sci. 53 (14): 2581. สืบค้นเมื่อ 2016-08-07.
- ↑ Wen, Rong; Luo, Lingyu; Huang, Dequang; Xia, Xin; Wang, Zhengying; Chen, Pingping; Li, Yiwen (2012-05-07). Mesencephalic Astrocyte-derived Neurotrophic Factor (MANF) Protects Rod and Cone Photoreceptors from Degeneration in Transgenic Rats Carrying the S334ter Rhodopsin Mutation. ARVO 2012.
- ↑ Tochitsky, Ivan; Polosukhina, Aleksandra; Degtyar, Vadim E.; Gallerani, Nicholas; Smith, Caleb M.; Friedman, Aaron; Van Gelder, Russell N.; Trauner, Dirk; Kaufer, Daniela; Kramer, Richard H. (2014). "Restoring Visual Function to Blind Mice with a Photoswitch that Exploits Electrophysiological Remodeling of Retinal Ganglion Cells". Neuron. 81 (4): 800–13. doi:10.1016/j.neuron.2014.01.003. PMC 3933823. PMID 24559673.
- ↑ Bakondi, Benjamin; Lv, Wenjian; Lu, Bin; Jones, Melissa K.; Tsai, Yuchun; Kim, Kevin J.; Levy, Rachelle; Akhtar, Aslam Abbasi; Breunig, Joshua J.; Svendsen, Clive N.; Wang, Shaomei (2016). "Molecular Therapy - Abstract of article: In Vivo CRISPR/Cas9 Gene Editing Corrects Retinal Dystrophy in the S334ter-3 Rat Model of Autosomal Dominant Retinitis Pigmentosa". Molecular Therapy. 24 (3): 556–563. doi:10.1038/mt.2015.220. PMC 4786918. PMID 26666451.
- ↑ "Gene editing technique improves vision in rats with inherited blindness: Data show the new 'CRISPR/Cas9' system potentially can be used to prevent retinal damage in a type of retinitis pigmentosa". Science Daily. 2016-01-08. สืบค้นเมื่อ 2016-01-15.
- ↑ "FDA approves novel gene therapy to treat patients with a rare form of inherited vision loss". FDA. 2017-12-19. เก็บจากแหล่งเดิมเมื่อ 2019-03-12.
- ↑ Bourzac, Katherine. "A blind woman in Texas is first person to undergo optogenetic therapy, which could let her see again if successful". technologyreview.com.
แหล่งข้อมูลอื่น[แก้]
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |

