โรคจุดภาพชัดของจอตาเสื่อม
| โรคจุดภาพชัดของจอตาเสื่อม (Macular degeneration) | |
|---|---|
| ชื่ออื่น | จุดภาพชัดเสื่อมเนื่องกับอายุ (Age-related macular degeneration) |
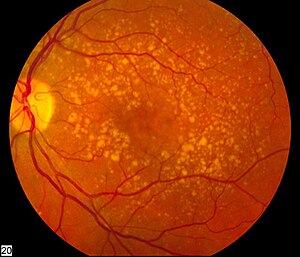 | |
| ภาพจอตาซึ่งแสดงจุดภาพชัดเสื่อมเนื่องกับอายุระยะกลาง | |
| สาขาวิชา | จักษุวิทยา |
| อาการ | มองไม่ชัดหรือมองไม่เห็นที่กลางลานสายตา[1] |
| ภาวะแทรกซ้อน | การเห็นภาพหลอน[1] |
| การตั้งต้น | ผู้มีอายุ[1] |
| ประเภท | ระยะต้น ระยะกลาง ระยะปลาย[1] |
| สาเหตุ | ความเสียหายที่จุดภาพชัด (macula) ในจอตา[1] |
| ปัจจัยเสี่ยง | กรรมพันธุ์ การสูบบุหรี่[1] |
| วิธีวินิจฉัย | การตรวจตา[1] |
| การป้องกัน | ออกกำลังกาย ทานอาหารให้ถูกสุขภาพ ไม่สูบบุหรี่[1] |
| การรักษา | ฉีดยา Anti-VEGF เข้าในตา, ยิงเลเซอร์ (laser coagulation), photodynamic therapy[1] |
| ความชุก | 6.5 ล้านคน (2015)[2] |
โรคจุดภาพชัดของจอตาเสื่อม[3] (อังกฤษ: macular degeneration) หรือ โรคจุดภาพชัดของจอตาเสื่อมในผู้สูงอายุ[3] (อังกฤษ: age-related macular degeneration ตัวย่อ AMD, ARMD) เป็นโรคที่ทำให้มองไม่ชัดหรือมองไม่เห็นที่กลางลานสายตา[1] เริ่มแรกสุดบ่อยครั้งจะไม่มีอาการอะไร ๆ[1] แต่เมื่อเวลาผ่านไป บางคนจะมองเห็นแย่ลงเรื่อย ๆ ที่ตาข้างหนึ่งหรือทั้งสองข้าง[1] แม้จะไม่ทำให้ตาบอดโดยสิ้นเชิง การมองไม่เห็นในส่วนกลางก็จะทำให้กิจกรรมในชีวิตต่าง ๆ ทำได้ยากรวมทั้งจำหน้าคน ขับรถ อ่านหนังสือเป็นต้น[1] การเห็นภาพหลอนอาจเกิดขึ้นโดยไม่ใช่เป็นส่วนของโรคจิต[1]
จุดภาพชัดเสื่อมปกติจะเกิดกับคนสูงอายุ[1] ปัจจัยทางพันธุกรรมและการสูบบุหรี่ก็มีผลด้วย[1] เป็นอาการเนื่องกับความเสียหายต่อจุดภาพชัด (macula) ที่จอตา[1] การวินิจฉัยทำได้ด้วยการตรวจตา[1] ความรุนแรงของอาการจะแบ่งออกเป็นระยะต้น ระยะกลาง และระยะปลาย[1] ระยะปลายยังแบ่งออกเป็นแบบแห้ง (dry) และแบบเปียก (wet) โดยคนไข้ 90% จะเป็นแบบแห้ง[1][4]
การป้องกันรวมทั้งการออกกำลังกาย ทานอาหารให้ถูกสุขภาพ และไม่สูบบุหรี่[1] วิตามินต่อต้านอนุมูลอิสระและแร่ธาตุดูเหมือนจะไม่ช่วยป้องกัน[5] ไม่มีวิธีแก้หรือรักษาการเห็นที่สูญไปแล้ว[1] ในรูปแบบเปียก การฉีดยาแบบ anti-VEGF (Anti-vascular endothelial growth factor) เข้าที่ตา หรือการรักษาอื่น ๆ ที่สามัญน้อยกว่ารวมทั้งการยิงเลเซอร์ (laser coagulation) หรือ photodynamic therapy อาจช่วยให้ตาเสื่อมช้าลง[1] อาหารเสริมรวมทั้งวิตามินและแร่ธาตุสำหรับคนไข้ที่มีโรคอาจช่วยชะลอความเสื่อมด้วย[6]
ในปี 2015 โรคนี้มีผลต่อคนไข้ 6.2 ล้านคนทั่วโลก[2] ในปี 2013 มันเป็นเหตุให้ตาบอดเป็นอันดับสี่หลังต้อกระจก การเกิดก่อนกำหนด และต้อหิน[7] มันเกิดบ่อยที่สุดในผู้มีอายุเกิน 50 ปีในสหรัฐอเมริกา และเป็นเหตุเสียการเห็นซึ่งสามัญที่สุดในคนกลุ่มอายุนี้[1][4] คนประมาณ 0.4% ระหว่างอายุ 50-60 ปีมีโรคนี้ เทียบกับ 0.7% ของคนอายุ 60-70 ปี, 2.3% ของคนอายุ 70-80 ปี, และ 12% ของคนอายุเกิน 80 ปี[4]
พื้นเพ[แก้]
ปัจจุบัน คนราว 285 ล้านคนทั่วโลกมีปัญหาในการมองเห็น โดยร้อยละ 90 อยู่ในประเทศกำลังพัฒนา[8] ซึ่งไม่มีระบบบริการสนับสนุนที่ดีพอจะให้คนเหล่านี้ใช้ชีวิตได้โดยสะดวก เหตุการตาบอดในลำดับต้น ๆ คือโรคทางตา ซึ่งป้องกันและรักษาให้หายได้ก่อนจะลุกลามจนตาบอดสนิท เช่น ต้อกระจก ต้อหิน ภาวะะความผิดปกติของกระจกตา รวมทั้ง โรคจุดภาพชัดของจอตาเสื่อมในผู้สูงอายุแบบมีหลอดเลือดงอกผิดปกติเป็นต้น[3]
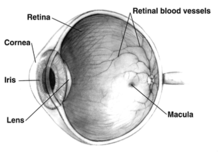
ตามีส่วนรับภาพที่เรียกว่า จอตา ซึ่งรับสัญญาณแสงแล้วส่งผ่านไปยังสมองเพื่อแปลเป็นภาพ บริเวณนี้มีจุดรับภาพซึ่งสำคัญต่อการเห็นชัดที่กลางจอตามากที่สุด ซึ่งเรียกว่า จุดภาพชัดของจอตา (macula) หากมีความผิดปกติเกิดขึ้นแก่จุดภาพชัดจอตา ก็จะทำให้มองภาพส่วนกลางไม่ชัด คล้ายกับมีจุดดำบังอยู่ตรงกลาง หรือเห็นภาพบิดเบี้ยว[3]
โรคจุดภาพชัดจอตาเสื่อมเป็นโรคตาหนึ่งใน 4 อันดับแรกที่ทำให้ประชากรไทยตาบอด ทุกปี ผู้สูงอายุเกือบ 3 หมื่นคนจะมีปัญหาการมองเห็นเพราะโรคจุดภาพชัดเสื่อมแบบมีหลอดเลือดงอกผิดปกติ (neovascular AMD)[9] เมื่อประเทศไทยก้าวเข้าสู่สังคมผู้สูงอายุ พร้อมกับการขยายตัวของโรคไม่ติดต่อแบบเรื้อรัง ก็อาจทำให้ผู้สูงอายุซึ่งเห็นผิดปกติมีมากขึ้น[9]
อาการ[แก้]


อาการของจุดภาพชัดเสื่อมรวมทั้ง
- อาการทางตา
- เห็นบิดเบี้ยวในรูปแบบของ metamorphopsia ที่ตะแกรงเส้นตรงจะปรากฏเป็นรูปคลื่น และบางส่วนของตะแกรงอาจดูเหมือนเปล่า ๆ คนไข้อาจเริ่มสังเกตเห็นเมื่อมองสิ่งต่าง ๆ รวมทั้งม่านตะแกรงหรือเสาเมื่อกำลังขับรถ และก็อาจมีดวงมืด (scotoma) ตรงกลางตาด้วย คือเห็นเป็นเงาหรือมองไม่เห็นเป็นบางส่วน
- ฟื้นเห็นภาพได้ช้ากว่าเมื่อมองแสงสว่าง (photostress test)
- มองเห็นภาพชัดลดลงอย่างชะงัด (2 ระดับหรือมากกว่านั้น) เช่น จาก 20/20 เหลือแค่ 20/80
- เห็นมัวลงหรือไม่ชัด - ผู้ที่มีจุดภาพชัดเสื่อมแบบไม่ไหลซึม (nonexudative)/แบบแห้ง อาจไม่มีอาการหรือเสียการเห็นตรงกลางอย่างค่อยเป็นค่อยไป เทียบกับผู้ที่มีจุดภาพชัดเสื่อมแบบไหลซึม (exudative)/แบบเปียก ผู้จะเสียการเห็นอย่างรวดเร็ว (ซึ่งบ่อยครั้งมีเหตุจากการรั่วของเส้นเลือดที่ผิดปกติ)
- มีปัญหาแยกแยะสี โดยเฉพาะสีเข้มจากสีเข้ม และสีอ่อนจากสีอ่อน
- เสียความไวต่อความเปรียบต่าง
จุดภาพชัดเสื่อมโดยตัวเองจะไม่ทำให้ตาบอดหมด และจริง ๆ แล้ว คนที่บกพร่องทางการเห็นน้อยคนมากที่บอดทั้งหมด ในกรณีเกือบทั้งหมด จะยังมองเห็นเป็นบางส่วน โดยหลักก็คือรอบ ๆ ส่วนกลาง อาจมีภาวะแทรกซ้อนอื่น ๆ ที่ก่ออาการรุนแรง เช่น โรคหลอดเลือดสมองหรือการบาดเจ็บอย่างรุนแรง ต้อหินที่ไม่รักษาเป็นต้น แต่คนไข้จุดภาพชัดเสื่อมน้อยคนจะเสียการเห็นทั้งหมด[10]
พื้นที่ของจุดภาพชัดจะเป็นส่วนเพียงแค่ 2.1% ของจอตา และที่เหลือ 97.9% (คือลานส่วนรอบ) จะไม่มีผลเนื่องจากโรค ถึงกระนั้น แม้จุดภาพชัดจะเป็นเพียงแค่ส่วนเล็ก ๆ ของลานสายตา แต่เปลือกสมองส่วนการเห็นเกือบครึ่งก็อุทิศให้เพื่อประมวลข้อมูลที่มาจากจุดภาพชัด[11] ซึ่งแสดงความสำคัญของจอตาส่วนนี้
การเสียการเห็นตรงกลางสายตาจะมีผลอย่างลึกซึ้งต่อกิจกรรมชีวิตที่ใช้ตา เช่น การอ่านหนังสือโดยไม่เห็นตรงกลางจะยากมาก ดังนั้น รูปที่แสดงการเสียการเห็นตรงกลางเนื่องจากจุดภาพชัดเสื่อมด้วยจุดดำจุดหนึ่ง ความจริงไม่สามารถแสดงความเสียหายอย่างรุนแรงที่เกิดขึ้น ซึ่งสามารถเข้าใจได้โดยเขียนอักษรสูงหกนิ้วบนกระดาษ แล้วพยายามระบุตัวอักษรโดยมองตรงไปข้างหน้าแต่ถือกระดาษเยื้องไปทางข้าง ๆ ซึ่งคนโดยมากบอกว่ายาก
ปัจจัยเสี่ยง[แก้]
- อายุ - อายุมากเป็นตัวพยากรณ์ AMD ได้ดีที่สุด โดยเฉพาะเมื่อเกิน 50 ปี[12]
- ประวัติครอบครัว
สิ่งแวดล้อมและสไตล์ชีวิต[แก้]
- การสูบยา - การสูบบุหรี่เพิ่มความเสี่ยงโรค 2-3 เท่าเทียบกับคนที่ไม่สูบ และอาจเป็นปัจจัยเสี่ยงสำคัญที่สุดซึ่งเปลี่ยนได้เพื่อป้องกันโรค งานทบทวนงานศึกษาต่าง ๆ ได้พบว่า มี "ความสัมพันธ์ที่มีกำลังระหว่างการสูบบุหรี่ในปัจจุบันกับ AMD... การสูบบุหรี่น่าจะมีผลเป็นพิษต่อจอตา"[13]
- ความดันโลหิตสูง - ในงานศึกษา ALIENOR ปี 2013 AMD ระยะต้นและระยะปลายไม่สัมพันธ์กับความดันโลหิตทั้งบนและล่างอย่างสำคัญ หรือกับความดันโลหิตสูง หรือกับการใช้ยาลดความดัน แต่ความดันพัลส์ (pulse pressure คือความต่างระหว่างความดันบนและล่าง) ที่สูงขึ้น สัมพันธ์กับการเพิ่มความเสี่ยงของ AMD ระยะปลาย อย่างสำคัญ[14]
- โรคหลอดเลือดแดงแข็ง
- คอเลสเตอรอลสูง - อาจเพิ่มความเสี่ยง[15]
- โรคอ้วน - โดยเฉพาะที่ท้อง เป็นปัจจัยเสี่ยง โดยเฉพาะสำหรับผู้ชาย[16]
- การทานไขมัน - การบริโภคไขมันบางอย่างเป็นจำนวนมากรวมทั้งไขมันอิ่มตัว ไขมันทรานส์ และกรดไขมันโอเมกา-6 น่าจะมีผลให้เกิด AMD ในขณะที่ไขมันไม่อิ่มตัวมีพันธะคู่เดียว (monounsaturated fat) อาจช่วยป้องกัน[17] โดยเฉพาะก็คือ กรดไขมันโอเมกา-3 อาจช่วยลดความเสี่ยง AMD[18]
- การถูกแดด โดยเฉพาะแสงอาทิตย์ที่มีความยาวคลื่น 400-500 นาโนเมตร แต่หลักฐานก็ไม่ชัดเจนว่า การถูกแดดมีผลต่อการเกิดจุดภาพชัดเสื่อมจริง ๆ หรือไม่ งานปี 2006 ที่มีผู้เข้าร่วม 446 คนพบว่า มันไม่มีผล[19] แต่ก็มีงานวิจัยอื่นที่แสดงว่า แสงในพิสัยที่เห็นได้และมีพลังงานสูงอาจช่วยให้เกิด AMD[20][21]
กรรมพันธุ์[แก้]
พี่น้องของคนไข้ AMD มีโอกาสเกิดโรคสูงถึง 3-6 เท่าเทียบกับกลุ่มประชากรทั่วไป[22] การวิเคราะห์ความเชื่อมโยงของพันธุกรรมได้ระบุยีนต่าง ๆ 5 เซตที่ตำแหน่ง 3 ตำแหน่งในโครโมโซมต่าง ๆ (1, 6 และ 10) ว่าอธิบายความเสี่ยงถึง 50% ยีนเหล่านีมีบทบาทในการควบคุมการตอบสนองของระบบภูมิคุ้มกัน กระบวนการอักเสบ และภาวะธำรงดุลในจอตา เพราะความต่าง ๆ ของยีนเหล่านี้ทำให้เกิดการทำงานผิดปกติแบบต่าง ๆ ในระยะยาว นี่มีผลเป็นการสะสมเศษเหลือของเมแทบอลิซึมทั้งภายในเซลล์และนอกเซลล์ ซึ่งมีผลสร้างตำหนิที่จอตาหรือทำให้เส้นเลือดเสีย
มีการตรวจทางกรรมพันธุ์สำหรับยีนเช่นนี้บางอย่าง แต่ว่า พยาธิกำเนิดของจุดภาพชัดเสื่อม เป็นปฏิสัมพันธ์ที่ซับซ้อนระหว่างพันธุกรรม สิ่งแวดล้อม และการใช้ชีวิต ดังนั้น ปัจจัยทางพันธุกรรมที่ไม่ดีจึงไม่สามารถพยากรณ์อย่างแน่นอนว่าจะมีโรค ตำแหน่ง 3 โลคัสที่ได้ระบุในยีนต่าง ๆ รวมทั้ง
- Complement Factor H (CFH) บนโครโมโซม 1 ที่ตำแหน่ง 1q31.3[23]
- HTRA serine peptidase 1/Age Related Maculopathy Susceptibility 2 (HTRA1/ARMS2) บนโครโมโซม 10 ที่ตำแหน่ง 10q26
- Complement Factor B/Complement Component 2 (CFB/CC2) บนโครโมโซม 6 ที่ตำแหน่ง 6p21.3
ยีนโดยเฉพาะ ๆ[แก้]
- ภาวะพหุสัณฐานของยีนสำหรับโปรตีนใน complement system[A] คือโปรตีน factor H (CFH), factor B (CFB) และ factor 3 (C3) สัมพันธ์กับความเสี่ยงการเกิด AMD อย่างมีกำลัง โดย CFH มีบทบาทยับยั้งการตอบสนองแบบอักเสบ และการกลายพันธุ์ของ CFH (Y402H) จะลดสมรรถภาพการควบคุม complement system ที่ผิวร่างกายส่วนสำคัญ ๆ รวมทั้งจอตา ซึ่งทำให้การตอบสนองแบบอักเสบเพิ่มขึ้นที่จุดภาพชัด ส่วนการไม่มียีน complement factor H-related genes คือ R3 และ R1 จะช่วยป้องกัน AMD[25][26] งานวิจัยสองงานที่เป็นอิสระจากกันในปี 2007 แสดงว่า การกลายพันธุ์อย่างหนึ่งที่สามัญ คือ Arg80Gly ในยีน C3 ซึ่งเป็นโปรตีนหลักของ complement system สัมพันธ์อย่างมีกำลังกับการเกิด AMD[27][28] นักวิจัยของทั้งสองงานมีความเห็นว่า นี่แสดงอิทธิพลของวิถีการทำงานใน complement system ในพยาธิกำเนิดของโรคนี้
- งานวิจัยปี 2006 อีกสองงาน ได้ระบุยีนอีกยีนหนึ่งที่สัมพันธ์กับการเกิดโรค คือ HTRA1 ซึ่งเข้ารหัสเอนไซม์ที่ร่างกายหลั่งคือ serine protease[29][30]
- การกลายพันธุ์ 6 แบบของยีน SERPING1[B] สัมพันธ์กับ AMD การกลายพันธุ์ของยีนนี้ยังสามารถเป็นเหตุให้เกิดโรค hereditary angioedema (การบวมอย่างรุนแรงที่ส่วนต่าง ๆ ของร่างกายเพราะกรรมพันธุ์)[31]
- การกลายพันธุ์ของ Fibulin-5 (FBLN5) เป็นโรคที่มีน้อยซึ่งเกิดจากความบกพร่องทางพันธุกรรมของยีน fibulin-5 ในรูปแบบยีนออโตโซมแบบเด่น งานวิจัยปี 2004 ที่ตรวจคัดคนไข้ AMD 402 คนได้แสดงสหสัมพันธ์ที่สำคัญทางสถิติระหว่างการกลายพันธุ์ของยีน fibulin-5 และการเกิดโรค
ยีนเนื่องกับไมโทคอนเดรีย[แก้]
ภาวะพหุสัณฐานของยีนเนื่องกับไมโทคอนเดรีย เช่นในโมเลกุล MT-ND2 จะเป็นตัวพยากรณ์ AMD แบบเปียก[32][33]
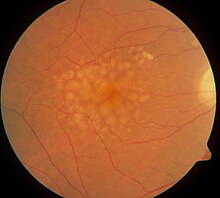
พยาธิสรีรวิทยา[แก้]
พยาธิกำเนิดของจุดภาพชัดเสื่อมเนื่องกับอายุยังไม่ชัดเจน แม้จะมีทฤษฎีต่าง ๆ รวมทั้ง oxidative stress, การทำงานผิดปกติของไมโทคอนเดรีย, และกระบวนการอักเสบต่าง ๆ
ความไม่สมดุลระหว่างการเกิดกับการกำจัดองค์ประกอบของเซลล์ที่เสียหาย ทำให้สะสมผลิตผลที่มีผลลบ เช่น lipofuscin ภายในเซลล์ และ drusen นอกเซลล์ การฝ่อระยะเริ่มต้น (incipient atrophy) จะปรากฏเป็นบริเวณของ Retinal pigment epithelium (RPE) ที่บางลดหรือซีดลง โดยเกิดก่อนการฝ่อแบบ geographic atrophy ในระยะต้น ๆ ของ AMD ในระยะหลัง ๆ ของโรค RPE ที่ฝ่อเป็น geographic atrophy และ/หรือเกิดเส้นเลือดงอกผิดปกติ (neovascularization) จะมีผลให้เซลล์รับแสงตายและให้เสียการเห็นตรงกลาง
ในโรคแบบแห้ง เศษเหลือขององค์ประกอบเซลล์ที่เรียกว่า drusen จะสะสมในชั้นระหว่างจอตากับคอรอยด์ ซึ่งทำให้จอตาฝ่อหรือเกิดตำหนิ (scarring) ในโรคแบบเปียกซึ่งรุนแรงกว่า เส้นเลือดจะงอกขึ้นจากคอรอยด์ (neovascularization) ใต้จอตาซึ่งสามารถรั่วให้น้ำหรือเลือดซึมออก
งานวิจัยต้น ๆ พบตัวสื่อภูมิคุ้มกัน (immune mediator) มากใน drusen[34] complement factor H (CFH) เป็นสารยับยั้งที่สำคัญในลำดับการเกิดการอักเสบ (inflammatory cascade) เช่นนี้ และภาวะพหุสัณฐานที่สัมพันธ์กับโรคในยีน CFH จะสัมพันธ์อย่างมีกำลังกับ AMD[35][36][37][38][39] ดังนั้น จึงมีการเสนอแบบจำลองทางพยาธิสรีรวิทยาเนื่องกับการทำงานของ complement system ในระดับต่ำอย่างเรื้อรัง และการอักเสบในจุดภาพชัด[40][41] ทฤษฎีนี้ได้การยืนยันเมื่อค้นพบภาวะพหุสัณฐานที่สัมพันธ์กับโรคในองค์ประกอบอื่น ๆ ในลำดับการทำงานของ complement system รวมทั้ง complement component 3 (C3)[42]
ตัวพยากรณ์ที่มีกำลังของ AMD พบอยู่ที่โครโมโซมโลคัส 10q26 คือ LOC 387715 ภาวะพหุสัณฐานเนื่องจากการแทรก/การลบที่ตำแหน่งนี้ จะลดการแสดงออกของยีน ARMS2[C] โดยทำให้ mRNA ของมันไม่เสถียรผ่านการลบส่วน polyadenylation signal[43] โปรตีน ARMS2 อาจเกิดในไมโทคอนเดรียและมีบทบาทในเมแทบอลิซึมเกี่ยวกับพลังงาน แม้รายละเอียดการทำงานของมันยังจะไม่ชัดเจน
ยีนส่อความเสี่ยงว่าโรคจะเป็นเพิ่มรวมทั้ง tissue inhibitor of metalloproteinase 3 (TIMP3) ซึ่งอาจแสดงว่า เมแทบอลิซึมของเมทริกซ์นอกเซลล์ (extracellular matrix) มีบทบาทในการก้าวหน้าของโรค[44] ความต่าง ๆ ของยีนที่สร้างหรือสลายคอเลสเตอรอล เช่น hepatic lipase, cholesterol ester transferase, lipoprotein lipase และ ATP-binding cassette A1 จะสัมพันธ์กับการก้าวหน้าของโรค และตัวบ่งโรคระยะต้น คือ drusen ก็สมบูรณ์ไปด้วยคอเลสเตอรอล ซึ่งแสดงความสมเหตุสมผลอย่างเผิน ๆ กับความสัมพันธ์ที่พบในงานศึกษาทั่วทั้งจีโนมต่าง ๆ[45]
ระยะ[แก้]
ใน AMD จะมีการเพิ่มการสะสมของตะกอนสีเหลือง ๆ ซึ่งเป็นโปรตีนและลิพิดนอกเซลล์ เป็นลักษณะเฉพาะของโรค และเรียกว่า drusen ที่จุดภาพชัดซึ่งเป็นส่วนของจอตา ในระหว่าง retinal pigment epithelium กับคอรอยด์ที่อยู่ข้างใต้ ซึ่งเชื่อว่าทำจอตาให้เสียหายในระยะยาว เพปไทด์ของกรดอะมิโน 36-43 ชนิดที่เรียกว่า amyloid beta ซึ่งสะสมอยู่ในสมองของคนไข้โรคอัลไซเมอร์ เป็นโปรตีนอีกอย่างหนึ่งที่สะสมในคนไข้ AMD ซึ่งเป็นเหตุผลหนึ่งที่ AMD บางครั้งเรียกว่า โรคอัลไซเมอร์ของตาหรือของจอตา[46] AMD สามารถแบ่งออกเป็น 3 ระยะคือ ระยะต้น (early) กลาง (intermediate) และปลาย (late) โดยส่วนหนึ่งก็เพราะขนาดและหมายเลขกำหนดของ drusen[1]
พยาธิสภาพของ AMD จะเริ่มด้วยการสะสม drusen สีเหลือง ๆ ในจุดภาพชัด ระหว่าง retinal pigment epithelium กับคอรอยด์ที่อยู่ข้างใต้ คนไข้ไโดยมากที่เริ่มมีอาการเช่นนี้ (ซึ่งเรียกว่า age-related maculopathy) ยังเห็นได้ดีอยู่ คนไข้ที่มี drusen อาจจะเกิดหรือไม่เกิด AMD และจริง ๆ แล้ว คนอายุมากกว่า 60 ปีโดยมากจะมี drusen โดยไม่มีผลเสียอะไร ความเสี่ยงเกิดอาการจะสูงกว่าเมื่อ drusen ใหญ่หรือมีจำนวนมาก และสัมพันธ์กับความผิดปกติของชั้น pigmented cell ใต้จุดภาพชัด drusen ขนาดใหญ่และอ่อนเชื่อว่า สัมพันธ์กับการสะสมคอเลสเตอรอลในระดับสูงขึ้น
ระยะต้น[แก้]
AMD ระยะต้นจะวินิจฉัยอาศัยการมี drusen ขนาดกลาง ซึ่งก็คือเท่ากับความกว้างของผมมนุษย์ (ราว ๆ 30-100 ไมโครเมตร) แต่โรคในระยะนี้ปกติจะไม่มีอาการ[1]
ระยะกลาง[แก้]
AMD ระยะกลางจะวินิจฉัยอาศัยการมี drusen ขนาดใหญ่ และ/หรือการมีสีจอตาที่ผิดปกติ โรคระยะกลางอาจเป็นเหตุให้สูญการเห็น แต่ก็ยังเหมือนกับระยะต้นคือปกติจะไม่มีอาการ[1][47]
ระยะปลาย[แก้]
ในโรคระยะปลาย จอตาเสียหายพอที่จะเสียการเห็นตรงกลางนอกเหนือจากการมี drusen ซึ่งอาจเป็นการฝ่อ หรือการเริ่มมีเส้นเลือดงอกใหม่ AMD ระยะปลายยังแบ่งออกเป็นองกลุ่มย่อย ๆ ขึ้นอยู่กับประเภทความเสียหาย คือ แบบแห้ง (dry/geographic atrophy) และแบบเปียก (wet/neovascular)[47][1]
แบบแห้ง[แก้]
AMD แบบแห้ง (หรือแบบไม่ซึม [nonexudative]) เป็นการระบุโรคอย่างกว้าง ๆ ซึ่งรวมเอารูปแบบทุกอย่างที่ไม่ใช่แบบเปียก รวมทั้ง AMD ระยะต้นและระยะกลาง และระยะปลายแบบ geographic atrophy คนไข้แบบนี้มักจะมีอาการน้อยในระยะก่อน ๆ การเสียการเห็นจะเกิดมากขึ้นถ้าโรคลามจนถึงขั้น geographic atrophy คนไข้ 80-90% จะมีโรคแบบแห้ง และอาการจะลามอย่างช้า ๆ ในกรณี 10-20% โรคจะลามเป็นแบบเปียก
Geographic Atrophy[แก้]
Geographic atrophy หรือ atrophic AMD เป็นรูปแบบระยะหลัง ๆ ของ AMD ที่การเสียเซลล์รับแสงในจอตาซึ่งเป็นไปอย่างต่อเนื่องและแก้คืนไม่ได้ จะทำให้เสียการเห็นเป็นบางส่วน
แบบเปียก[แก้]
AMD แบบเปียก หรือแบบ neovascular (เส้นเลือดงอกผิดปกติ) หรือแบบ exudative (ซึม) เป็นรูปแบบระยะหลัง ๆ ของ AMD ที่ทำให้เสียการเห็นเนื่องจากการเกิดเส้นเลือดงอกผิดปกติ (choroidal neovascularization) ใน choriocapillaris ผ่าน Bruch's membrane ปกติจะมี AMD แบบแห้งเกิดขึ้นก่อน แต่ก็ไม่เสมอไป โดย vascular endothelial growth factor (VEGF) จะกระตุ้นให้เพิ่มจำนวนเส้นลือดที่ไม่ปกติในจอตา แต่โชคไม่ดีว่า เพราะเส้นเลือดเหล่านี้ผิดปกติจึงเปราะบางมาก ซึ่งในที่สุดทำให้เลือดและโปรตีนซึมออกเข้าไปข้างใต้จุดภาพชัด สร้างตำหนิ ในที่สุดทำให้เซลล์รับแสงเสียหายอย่างแก้ไม่ได้ และทำให้เสียการเห็นอย่างรวดเร็วถ้าไม่รักษา
Oxidative stress[แก้]
การสะสมเนื่องกับอายุของเมลานิน ในรูปแบบ oligomer[D] ที่มีมวลโมเลกุลน้อย มีพิษเหตุแสง และโปรโหมตออกซิเดชัน ภายในไลโซโซมของ retinal pigment epithelium (RPE) อาจเป็นเหตุโดยบางส่วนต่อการย่อยสลาย photoreceptor outer rod segments (POS) ของ RPE ในอัตราที่ลดลง ซึ่งแสดงแล้วว่า สัมพันธ์กับการเกิด lipofuscin[E] อันเป็นอาการเฉพาะสำคัญของ AMD[51][52]
ความเป็นเหตุของ oxidative stress ในจอตาต่อ AMD เพราะทำจุดภาพชัดให้อักเสบเพิ่มขึ้น ได้หลักฐานจากอัตราโรคที่สูงขึ้นในผู้สูบบุหรี่และผู้ที่ได้รับรังสีอัลตราไวโอเลต[53][54][55] โดยการทำงานผิดปกติของไมโทคอนเดรียก็อาจมีบทบาทด้วย[56]


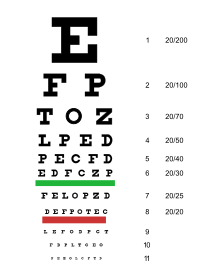

การวินิจฉัย[แก้]
การวินิจฉัยโรคจะขึ้นอยู่กับอาการที่จุดภาพชัด โดยไม่เกี่ยวกับการเห็นได้ชัด (visual acuity) การวินิจฉัยอาจรวมวิธีการดังต่อไปนี้
- การเปลี่ยนรูปแบบจากแห้งเป็นเปียกสามารถเกิดได้อย่างรวดเร็ว และถ้าไม่รักษา ก็อาจทำให้ถึงตาบอดตามกฎหมายโดยอาจเกิดภายใน 6 เดือน เพื่อป้องกันเหตุการณ์เช่นนี้ และเพื่อเริ่มกลยุทธ์ป้องกันในตั้งแต่ระยะต้น ๆ แพทย์อาจทดสอบการปรับตัวเข้ากับที่มืด ซึ่งสามารถตรวจจับ AMD ที่ยังไม่ปรากฏอาการถึง 3 ปีก่อนจะปรากฏในระดับคลินิก[57][58]
- มีการเสียความไวความเปรียบต่าง ทำให้การเห็นรูปร่าง เงา และการเห็นเป็นสีแย่ลง ความเปรียบต่างที่เสียไปสามารถวัดได้อย่างรวดเร็วและง่าย ๆ โดยใช้การทดสอบเช่น Pelli Robson ไม่ว่าจะทำที่บ้านหรือในคลินิก
- เมื่อให้ดู Amsler grid เส้นตรงบางเส้นจะปรากฏเป็นรูปคลื่น และอาจมีบางส่วนที่ดูเหมือนเปล่า ๆ
- เมื่อให้ดู Snellen chart ตาจะเห็นแย่ลงอย่างน้อยสองเส้น
- การเปลี่ยนแปลงของลานสายตาที่วัดโดย Preferential hyperacuity perimetry (สำหรับโรคแบบเปียก)[59][57]
- ในโรคแบบแห้ง ซึ่งเกิดในคนไข้ 85-90% จะสามารถเห็น drusen ในภาพถ่ายก้นตา (fundus photography)
- ในโรคแบบเปียก การบันทึกภาพรังสีหลอดเลือด (angiography) สามารถใช้ตรวจดูการซึมออกของเส้นเลือดหลังจุดภาพชัด ส่วน Fluorescein angiography สามารถใช้ระบุและกำหนดที่ที่เกิดเส้นเลือดที่ผิดปกติ
- ภาพคลื่นไฟฟ้าจอตา (ERG) สามารถใช้หาส่วนจุดภาพชัดที่ตอบสนองน้อยผิดปกติหรือไม่ตอบสนองเทียบกับตาปกติ
- Farnsworth-Munsell 100 hue test และ Maximum Color Contrast Sensitivity test (MCCS) สามารถใช้ตรวจการเห็นสีและความไวความเปรียบต่างของสี
- Optical coherence tomography อาจใช้เพื่อวินิจฉัยและติดตามการรักษาด้วยยายับยั้งกำเนิดเส้นเลือด
เนื้อเยื่อ[แก้]
- การเปลี่ยนสีของจอตา นอกจากจะมีเซลล์มีสารสี (pigmented cell) ที่ม่านตาแล้ว ก็ยังมีเซลล์มีสารสีใต้จอตาอีกด้วย เมื่อเซลล์เหล่านี้สลายและปล่อยสารสี ก็อาจเกิดสีที่จับเป็นก้อน ๆ แล้วต่อมา บริเวณที่ซีดลงก็อาจปรากฏ
- การเปลี่ยนแปลงเนื่องกับการซึม เช่น เลือดออกในตา, สารซึมออกที่จับก้อน, และน้ำใต้จอตา ใต้ RPE หรือในจอตา
- drusen ซึ่งเป็นสารนอกเซลล์ซึ่งสะสมที่จอตา แม้มักจะโทษว่าเป็นเหตุให้เสียการเห็นเพิ่มขึ้น ๆ แต่ก็สามารถมีที่จอตาโดยไม่เสียการเห็น คือคนไข้บางคนที่มี drusen สะสมเป็นจำนวนมากก็ยังเห็นภาพชัดปกติ การรับแสงที่จอตาแล้วส่งข้อมูลภาพยังเป็นไปได้เมื่อมี drusen สะสมอย่างหนาแน่น ดังนั้น แม้จะโทษ drusen ได้ว่าทำให้เสียการเห็น แต่ก็จะต้องมีปัจจัยอย่างอื่นอีกที่เป็นเหตุ
การป้องกัน[แก้]
งานทบทวนวรรณกรรมแบบคอเครนปี 2012 พบว่า การใช้อาหารเสริมเป็นวิตามินและแร่ธาตุในกลุ่มประชากรทั่วไป ไม่มีผลว่าจะเกิด AMD หรือไม่[5]
การรักษา[แก้]
อาหารเสริมที่มี lutein และซีอาแซนทิน อาจช่วยทำให้อาการแย่ช้าลง[6][60] แต่ก็ไม่พบว่าช่วยป้องกันโรค[60] ยังไม่มีหลักฐานพอเพื่อระบุว่ายากลุ่ม statins (มักใช้ลดไขมัน) ช่วยป้องกันหรือทำให้โรคแย่ช้าลงหรือไม่[61] สเตอรอยด์ระงับการเกิดเส้นเลือด เช่น anecortave acetate และ triamcinolone acetonide ไม่มีหลักฐานว่าช่วยป้องกันไม่ให้เสียการเห็นสำหรับคนไข้โรคแบบเปียก (neovascular AMD)[62]
แบบแห้ง[แก้]
ไม่มียาหรือการผ่าตัดรักษาเพื่อโรคแบบนี้
แบบเปียก[แก้]
โรคแบบนี้สามารถรักษาด้วยการยิงเลเซอร์ (laser coagulation) หรือที่สามัญกว่าคือด้วยการฉีดยาระงับและบางครั้งย้อนกลับการเกิดเส้นเลือดใหม่ ๆ[63][64]
งานทดลองแบบสุ่มและมีกลุ่มควบคุมพบว่ายา bevacizumab (เบวะซิซิวแมบ) และ ranibizumab มีประสิทธิผลคล้าย ๆ กัน โดยไม่มีผลลบเพิ่มขึ้นเมื่อใช้เบวะซิซิวแมบ[65] งานทบทวนวรรณกรรมแบบคอเครนพบว่า ความปลอดภัยทั้งระบบของเบวะซิซิวแมบและ ranibizumab คล้ายกันเมื่อใช้รักษาโรคแบบเปียก (neovascular AMD) ยกเว้นในเรื่องปัญหาทางเดินอาหาร (gastrointestinal disorders, MedDRA SOC)[66]
อย่างไรก็ดี องค์การอาหารและยาสหรัฐยังไม่ได้อนุมัติให้ใช้ยาเบวะซิซิวแมบเพื่อรักษาจุดภาพชัดเสื่อม และก็เป็นปัญหาที่ถกเถียงอย่างยังไม่ยุติในสหราชอาณาจักรเรื่องการใช้เบวะซิซิวแมบเพื่อรักษาอย่างไม่ได้อนุมัติ แทน ranibizumab ที่ได้อนุมัติแต่แพงกว่าเป็นสิบ ๆ เท่า[67][68]
- บริษัทยาอ้างว่า แพทย์ที่ใช้ยาซึ่งมีราคาถูกกว่าแต่ปรากฏว่าได้ผลคล้ายกัน แลกความปลอดภัยของคนไข้เพื่อลดค่าใช้จ่าย (โดยเฉพาะของรัฐ) โดยเฉพาะเมื่อมียาที่ได้รับอนุมัติ และเป็นการบ่อนทำลายกระบวนการควบคุมของรัฐเพื่อรักษาความปลอดภัยของผู้บริโภค
- ผู้สนับสนุนอ้างว่า บริษัทไม่ควรมีอำนาจยุติการใช้ยาที่ถูกกว่าเพื่อให้ตัวเองได้กำไรมากที่สุด
ในประเทศไทย ยา ranibizumab ได้ขึ้นทะเบียนยาเพื่อข้อบ่งชี้การรักษาโรคแบบเปียกในปี พ.ศ. 2554 โดยมีราคาประมาณ 54,000 บาทต่อเข็ม และผู้ป่วยบางรายจำเป็นต้องได้รับยาหลายครั้ง ทำให้คนไข้ในระบบบัตรทอง สามารถเข้าถึงการรักษาด้วยการยิงเลเซอร์เพียงอย่างเดียว จนกระทั่งคณะกรรมการพัฒนาบัญชียาหลักได้ขึ้นทะเบียนยาเบวะซิซิวแมบในบัญชียาหลักแห่งชาติ "จ (2)" ซึ่งเป็นบัญชีย่อยที่ควบคุมในระดับสูงสุด ต้องอาศัยความชำนาญเฉพาะโรคหรือเทคโนโลยีขั้นสูง และมีราคาแพงมาก คนไข้จึงมีทางเลือกในการรักษาเพิ่มขึ้น โดยยานี้มีค่าใช้จ่ายประมาณ 1,000 บาทต่อเข็ม เป็นยาที่แบ่งมาจากยาขนาดใหญ่ที่รักษามะเร็ง[3]
ยา ranibizumab เป็นส่วนย่อย คือ Fab fragment ของโมเลกุลยาเบวะซิซิวแมบ และเป็นยาที่ใช้โดยเฉพาะเพื่อฉีดเข้าในตา ยายับยั้งกำเนิดหลอดเลือดอื่น ๆ ที่อนุมัติให้รักษา AMD ชนิดเปียกรวมทั้ง pegaptanib[69] และ aflibercept[70]
แนวทางการรักษาของสถาบันจักษุวิทยาอเมริกัน (American Academy of Ophthalmology) ไม่แนะนำการยิงเลเซอร์ (laser coagulation) เพื่อรักษาจุดภาพชัดเสื่อม แต่ก็กล่าวว่า มันอาจมีประโยชน์สำหรับคนไข้ที่มีเส้นเลือดใหม่ในคอรอยด์ที่อยู่นอกรอยบุ๋มจอตาผู้ไม่ตอบสนองต่อการรักษาด้วยยา[71][72] มีหลักฐานที่มีกำลังว่า การยิงเลเซอร์จะทำให้ drusen หายไป แต่ไม่มีผลต่อการงอกใหม่ของเส้นเลือดในคอรอยด์[73] งานทบทวนแบบคอเครนปี 2007 พบว่า การยิงเลเซอร์สำหรับเส้นเลือดใหม่ในคอรอยด์นอกรอยบุ๋มจอตา มีประสิทธิผลและมีค่าใช้จ่ายน้อย แต่ประโยชน์จะจำกัดต่อเส้นเลือดที่ติดกับหรืออยู่ใต้รอยบุ๋มจอตา[74]
การรักษาแบบ Photodynamic therapy ก็ได้ใช้สำหรับโรคแบบเปียกด้วย[75] โดยให้ยา verteporfin ผ่านหลอดเลือดดำ แล้วฉายแสงซึ่งมีความยาวคลื่นโดยเฉพาะที่เส้นเลือดซึ่งผิดปกติ แล้วทำให้ verteporfin ออกฤทธิ์ทำลายเส้นเลือด
การผ่าตัดรักษาต้อกระจกสามารถทำให้คนไข้ AMD เห็นได้ดีขึ้น แม้จะมีความกังวลว่า การผ่าตัดอาจทำให้ AMD ให้แย่ลง งานทดลองแบบสุ่มและมีกลุ่มควบคุมหนึ่งพบว่า ผู้ที่ผ่าตัดต้อกระจกทันที (ภายในสองอาทิตย์) จะเห็นได้ชัดกว่าและมีคุณภาพชีวิตดีกว่าผู้ที่รอผ่าตัดต้อกระจก (หกเดือน)[76]

อุปกรณ์ช่วยปรับตัว[แก้]
เพราะไม่มีผลต่อการเห็นรอบนอก คนไข้โรค AMD อาจเรียนรู้ใช้การเห็นที่เหลือเพื่อชดเชยการเห็นที่เสียไป[77] มีการให้ความช่วยเหลือในประเทศต่าง ๆ หลายประเทศและในทุก ๆ รัฐในสหรัฐอเมริกา[78] มีการให้การศึกษาเพื่อ "การใช้ชีวิตอย่างเป็นอิสระ" และมีเทคโนโลยีบางอย่างที่สามารถได้จากองค์กรช่วยฟื้นฟูสภาพของรัฐ
อุปกรณ์ช่วยปรับตัวสามารถช่วยให้อ่านหนังสือได้ รวมทั้งแว่นขยาย แว่นตาพิเศษ เครื่องอ่านหนังสือผ่านจอคอมพิวเตอร์ และระบบโทรทัศน์เพื่อขยายสิ่งที่อ่าน
โปรแกรมอ่านหนังสือผ่านจอคอมพิวเตอร์ต่าง ๆ เช่น JAWS หรือ Thunder สามารถใช้กับคอมพิวเตอร์พร้อมระบบวินโดวส์ธรรมดา ๆ และก็มีอุปกรณ์เสริมเพื่อผลิตภัณฑ์จากบริษัทแอปเปิลที่มีคุณสมบัติต่าง ๆ มากมาย รวมทั้งตัวออกเสียงอ่านหนังสือ เครื่องอ่านหนังสือผ่านจอคอมพิวเตอร์ อักษรเบรลล์ เป็นต้น
กล้องวิดีโอสามารถส่งสัญญาณให้กับจอคอมพิวเตอร์ธรรมดาหรือที่สร้างขึ้นโดยเฉพาะ พร้อมขยายภาพได้ ระบบเช่นนี้บ่อยครั้งมีส่วนวางหนังสือที่เลื่อนได้เพื่อขยับสิ่งที่อ่าน
ในประเทศตะวันตก มีหนังสือที่พิมพ์ตัวโตเป็นพิเศษ การพิมพ์ลายแบบต่าง ๆ เพื่อให้ติดตามตัวอักษรได้ง่ายขึ้น หนังสืออ่านออกเสียง และหนังสืออ่าน (DAISY) สำหรับเครื่องเล่นที่แสดงทั้งตัวหนังสือและออกเสียงอ่าน

วิทยาการระบาด[แก้]
จุดภาพชัดเสื่อมเนื่องกับอายุเป็นเหตุของการเสียการเห็นของคนขาว 54% ในสหรัฐอเมริกา คนอเมริกันประมาณ 8 ล้านคนมีโรคในระยะต้น โดยจะมีล้านคนที่เกิดโรคระยะหลัง ๆ ภายใน 5 ปีต่อมา ในสหราชอาณาจักร AMD เป็นเหตุของตาบอด (ตามกฎหมาย) เกือบ 42% ในผู้ที่ตาบอดในช่วงอายุ 65-74 ปี, เกือบ 2/3 ในช่วงอายุ 75-84 ปี, และเกือบ 3/4 สำหรับคนอายุ 85 ปีหรือมากกว่านั้น
คนขาวมีความเสี่ยงมากกว่าคนที่มีเชื้อสายแอฟริกัน[80][81]
ทิศทางงานวิจัย[แก้]
ความสัมพันธ์กับโรคเนื่องด้วยอายุอื่น ๆ[แก้]
งานศึกษาแสดงว่า drusen ที่สัมพันธ์กับ AMD มีองค์ประกอบทางโมเลกุลคล้ายกับคราบตะกอน Beta-Amyloid (βA) ที่พบในโรคเนื่องกับอายุอื่น ๆ เช่น โรคอัลไซเมอร์และโรคหลอดเลือดแดงแข็ง ซึ่งอาจแสดงว่า วิถีการทำงานทางเคมี/ชีวภาพเดียวกันอาจเป็นสมุฏฐานของโรค AMD และโรคเนื่องกับอายุอื่น ๆ[82]
การทดสอบยีน[แก้]
การประยุกต์ใช้ยีนบ่งโรคอย่างหนึ่งก็คือ การพยากรณ์ว่าโรคจะแย่ลงจากระยะต้น ๆ จนเกิดเส้นเลือดงอกผิดปกติ (neovascularization)[44][83] คือกลายเป็นโรคแบบเปียก
การปลูกถ่ายเซลล์ต้นกำเนิด[แก้]
ปัจจุบันกำลังมีการศึกษาเพื่อรักษาในระดับเซลล์โดยอาศัยเซลล์ต้นกำเนิดจากไขกระดูกและการปลูกถ่าย retinal pigment epithelium[84] มีงานทดลองหลายงานที่ทำในมนุษย์ที่มีผลให้ความหวัง[85]
ประเภทอื่น ๆ[แก้]
มีโรคจุดภาพชัดเสื่อมอื่น ๆ ที่มีน้อยและมีอาการคล้ายกันแต่มีเหตุที่ไม่เหมือนกันกับ AMD ไม่ว่าจะแบบแห้งหรือแบบเปียก ซึ่งล้วนเป็นความผิดปกติของยีนที่มีอาการตั้งแต่เด็กหรือในช่วงวัยกลางคน รวมทั้ง
- Best's disease (Vitelliform macular dystrophy) เป็นโรคตาที่มีเหตุจากความผิดปกติทางกรรมพันธุ์แบบออโตโซมแบบเด่น ซึ่งทำให้เสียการเห็นเพิ่มขึ้นเรื่อย ๆ โรคนี้มีผลต่อจอตา โดยเฉพาะต่อเซลล์ในจุดภาพชัด
- Sorsby's fundus dystrophy เป็นโรคจอตาที่เกิดจากความผิดปกติทางกรรมพันธุ์แบบออโตโซมแบบเด่น ที่ทำให้เห็นไม่ชัดอย่างฉับพลัน เนื่องจากการเกิดเส้นเลือดใต้จุดภาพชัด เป็นโรคที่รักษาไม่ได้
- Stargardt's disease (โรคจุดภาพชัดเสื่อมในวัยเด็ก, juvenile macular degeneration, STGD) เป็นโรคจอตาที่เกิดจากความผิดปกติทางกรรมพันธุ์แบบออโตโซมแบบด้อย ที่เกิดการเจริญผิดปกติที่จุดภาพชัด (macular dystrophy) เริ่มในวัยเด็ก เกิดการเปลี่ยนแปลงรอบ ๆ จอตา และการสะสมสิ่งที่คล้าย lipofuscin[E] ใต้จอตา
อาการที่คล้าย ๆ กันแต่มีสมุฏฐานต่างกันมาก และรักษาต่างกัน อาจมีเหตุจาก epiretinal membrane/macular pucker หรือภาวะอื่น ๆ ที่มีผลต่อจุดภาพชัด เช่น central serous retinopathy
คนไข้ดัง[แก้]
เชิงอรรถ[แก้]
- ↑ complement system เป็นส่วนของระบบภูมิคุ้มกันที่เสริม (คือ complement) สมรรถภาพของสารภูมิต้านทานและเซลล์กลืนกิน ในการกำจัดจุลินทรีย์และเซลล์ที่เสียหายจากระบบ โปรโหมตการอักเสบ และโจมตีเยื่อหุ้มเซลล์ของจุลชีพก่อโรค มันเป็นส่วนของ innate immune system[24] ซึ่งไม่สามารถปรับตัวได้และจะไม่เปลี่ยนตลอดชีวิต แต่สามารถให้ออกฤทธิ์ได้โดยระบบภูมิคุ้มกันที่ปรับตัวได้
- ↑ Serpin Peptidase Inhibitor, Clade G (C1 Inhibitor), Member 1
- ↑ Age-related maculopathy susceptibility protein 2 เป็นโปรตีนของไมโทคอนเดรียซึ่งในมนุษย์เข้ารหัสโดยยีน ARMS2
- ↑ ในเคมี โอลิโกเมอร์ (oligomer, /əˈlɪɡəmər/ จากคำว่า oligo- แปลว่า "น้อย" และ -mer "ส่วนประกอบ" ) เป็นคอมเพล็กซ์โมเลกุลที่ประกอบด้วยมอนอเมอร์จำนวนไม่มาก โดยเทียบกับพอลิเมอร์ ซึ่งตามหลักมีมอนอเมอร์อย่างไม่จำกัด[48] ยกตัวอย่างเช่น ไดเมอร์, ทริเมอร์, และเททราเมอร์ เป็นโอลิโกเมอร์ที่ประกอบด้วยมอนอเมอร์ 2 ส่วน 3 ส่วน และ 4 ส่วนตามลำดับ
- ↑ 5.0 5.1 lipofuscin เป็นชื่อของเม็ดเล็ก ๆ สีเหลือง-น้ำตาลที่ประกอบด้วยเรซิดิวที่มีลิพิด เนื่องจากกระบวนการย่อยสลายของไลโซโซม[49][50]
อ้างอิง[แก้]
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11 1.12 1.13 1.14 1.15 1.16 1.17 1.18 1.19 1.20 1.21 1.22 1.23 1.24 1.25 1.26 1.27 "Facts About Age-Related Macular Degeneration". National Eye Institute. 2015. เก็บจากแหล่งเดิมเมื่อ 2015-12-22. สืบค้นเมื่อ 2015-12-21.
- ↑ 2.0 2.1 "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. 2016-10-08. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ↑ 3.0 3.1 3.2 3.3 3.4 ชลัญธร โยธาสมุทร (2014). "ข้อมูลเบื้องต้นเกี่ยวกับโรคจุดภาพชัดของจอตา" (PDF). จุลสารโครงการประเมินเทคโนโลยีและนโยบายด้านสุขภาพ ปีที่ 5 ฉบับที่ 17 กรกฎาคม-กันยายน 2555. โครงการประเมินเทคโนโลยีและนโยบายด้านสุขภาพ กรมอนามัย กระทรวงสาธารณสุข. p. 3. เก็บ (PDF)จากแหล่งเดิมเมื่อ 2018-07-18. สืบค้นเมื่อ 2018-05-28.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 4.0 4.1 4.2 Mehta, S (2015). "Age-Related Macular Degeneration". Primary care. 42 (3): 377–91. doi:10.1016/j.pop.2015.05.009. PMID 26319344.
- ↑ 5.0 5.1 Evans, JR; Lawrenson, JG (2012). Evans, Jennifer R (บ.ก.). "Antioxidant vitamin and mineral supplements for preventing age-related macular degeneration". Cochrane Database Syst Rev. 6: CD000253. doi:10.1002/14651858.CD000253.pub3. PMID 22696317.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 6.0 6.1 Evans, JR; Lawrenson, JG (2012-11-14). "Antioxidant vitamin and mineral supplements for slowing the progression of age-related macular degeneration". The Cochrane Database of Systematic Reviews. 11: CD000254. doi:10.1002/14651858.CD000254.pub3. PMID 23152201.
- ↑ "Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013". Lancet. 386 (9995): 743–800. 2015-08-22. doi:10.1016/s0140-6736(15)60692-4. PMC 4561509. PMID 26063472.
- ↑ ชลัญธร โยธาสมุทร (2014), p. 3 อ้างอิง
- "Blindness and visual impairment". องค์การอนามัยโลก. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-07-07. สืบค้นเมื่อ 2018-07-09.
- ↑ 9.0 9.1 ชลัญธร โยธาสมุทร (2014), โรคที่เกี่ยวกับจุดภาพชัดจอตา, หน้า 4 อ้างอิง
- Jenchitr, W; Ruamviboonsuk, P; Sanmee, A; Pokawattana, N (February 2011). "Prevalence of age-related macular degeneration in Thailand". Ophthalmic Epidemiol. 18 (1): 48–52.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์)
- Jenchitr, W; Ruamviboonsuk, P; Sanmee, A; Pokawattana, N (February 2011). "Prevalence of age-related macular degeneration in Thailand". Ophthalmic Epidemiol. 18 (1): 48–52.
- ↑ Roberts, DL (2006). The First Year - Age Related Macular Degeneration. Marlowe & Company. p. 100.
- ↑ Roberts, DL (2006). "The First Year - Age Related Macular Degeneration". Marlowe & Company: 20.
- ↑ Deangelis, MM; Silveira, AC; Carr, EA; Kim, IK (2011). "Genetics of age-related macular degeneration: current concepts, future directions". Seminars in ophthalmology. 26 (3): 77–93. doi:10.3109/08820538.2011.577129. PMC 4242505. PMID 21609220.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Thornton, J; Edwards, R; Mitchell, P; Harrison, RA; Buchan, I; Kelly, SP (2005). "Smoking and age-related macular degeneration: a review of association". Eye (London, England). 19 (9): 935–44. doi:10.1038/sj.eye.6701978. PMID 16151432.
- ↑ Cougnard-Grégoire, A; และคณะ (2013). "Long-term blood pressure and age-related macular degeneration: the ALIENOR study". Invest Ophthalmol Vis Sci. 54 (3): 1905–1912. doi:10.1167/iovs.12-10192. PMID 23404120.
- ↑ Dasari, Bhanu; Prasanthi, Jaya RP; Marwarha, Gurdeep; Singh, Brij B; Ghribi, Othman (2011-08-18). "Cholesterol-enriched diet causes age-related macular degeneration-like pathology in rabbit retina". BMC Ophthalmology. 11: 22. doi:10.1186/1471-2415-11-22. PMC 3170645. PMID 21851605.
- ↑ Adams, MK; Simpson, JA; Aung, KZ และคณะ (2011-06-01). "Abdominal obesity and age-related macular degeneration". Am J Epidemiol. 173 (11): 1246–55. doi:10.1093/aje/kwr005. PMID 21422060. สืบค้นเมื่อ 2012-07-29.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Parekh, N; Voland, RP; Moeller, SM และคณะ (2009). "Association between dietary fat intake and age-related macular degeneration in the Carotenoids in Age-Related Eye Disease Study (CAREDS) : an ancillary study of the Women's Health Initiative". Arch Ophthalmol. 127 (11): 1483–93. doi:10.1001/archophthalmol.2009.130. PMC 3144752. PMID 19901214.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ SanGiovanni, John Paul; Chew, Emily Y; Clemons, Traci E; Davis, Matthew D; III, Frederick L Ferris; Gensler, Gary R; Kurinij, Natalie; Lindblad, Anne S; Milton, Roy C; Seddon, Johanna M; Sperduto, Robert D (2007-05-05). "The Relationship of Dietary Lipid Intake and Age-Related Macular Degeneration in a Case-Control Study". Archives of Ophthalmology. เก็บจากแหล่งเดิมเมื่อ 2007-05-23.
{{cite web}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Khan, JC; Shahid, H; Thurlby, DA; Bradley, M; Clayton, DG; Moore, AT; Bird, AC; Yates, JR; Study)), ((Genetic Factors in AMD (2006). "Age related macular degeneration and sun exposure, iris colour, and skin sensitivity to sunlight". The British Journal of Ophthalmology. 90 (1): 29–32. doi:10.1136/bjo.2005.073825. PMC 1856929. PMID 16361662.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Glazer-Hockstein, C; Dunaief, JL (2006). "Could blue light-blocking lenses decrease the risk of age-related macular degeneration?". Retina. 26 (1): 1–4. doi:10.1097/00006982-200601000-00001. PMID 16395131.
- ↑
Margrain, TH; Boulton, M; Marshall, J; Sliney, DH (2004). "Do blue light filters confer protection against age-related macular degeneration?". Progress in Retinal and Eye Research. 23 (5): 523–31. doi:10.1016/j.preteyeres.2004.05.001. PMID 15302349.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Maller, J; และคณะ (2006). "Common variation in three genes, including a noncoding variant in CFH, strongly influences risk of age-related macular degeneration". Nat. Genet. 38 (9): 1055–59. doi:10.1038/ng1873. PMID 16936732.
- ↑ Edwards, Albert (2005-04-15). "Complement Factor H Polymorphism and Age-Related Macular Degeneration". Science. 308: 421-424. doi:10.1126/science.1110189.
- ↑ Janeway, CA Jr; Travers, P; Walport, M และคณะ (2001). The complement system and innate immunity. Immunobiology: The Immune System in Health and Disease. New York: Garland Science.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Hughes, Anne E; Orr, Nick; Esfandiary, Hossein; Diaz-Torres, Martha; Goodship, Timothy; Chakravarthy, Usha (2006). "A common CFH haplotype, with deletion of CFHR1 and CFHR3, is associated with lower risk of age-related macular degeneration". Nature Genetics. 38 (10): 1173–77. doi:10.1038/ng1890. PMID 16998489.
- ↑ Fritsche, L. G.; Lauer, N.; Hartmann, A.; Stippa, S.; และคณะ (2010). "An imbalance of human complement regulatory proteins CFHR1, CFHR3 and factor H influences risk for age-related macular degeneration (AMD)". Human Molecular Genetics. 19 (23): 4694–4704. doi:10.1093/hmg/ddq399. PMID 20843825.
- ↑
Yates, JR; Sepp, T; Matharu, BK; Khan, JC; Thurlby, DA; Shahid, H; Clayton, DG; Hayward, C; Morgan, J; Wright, AF; Armbrecht, AM; Dhillon, B; Deary, IJ; Redmond, E; Bird, AC; Moore, AT (2007). "Complement C3 Variant and the Risk of Age-Related Macular Degeneration". N Engl J Med. 357 (6): 553–61. doi:10.1056/NEJMoa072618. PMID 17634448.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Maller, JB; Fagerness, JA; Reynolds, RC; Neale, BM; Daly, MJ; Seddon, JM (2007). "Variation in Complement Factor 3 is Associated with Risk of Age-Related Macular Degeneration". Nature Genetics. 39 (10): 1200–1201. doi:10.1038/ng2131. PMID 17767156.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Yang, Z; Camp, NJ; Sun, H; Tong, Z; Gibbs, D; Cameron, DJ; Chen, H; Zhao, Y; Pearson, E และคณะ (2006). "A variant of the HTRA1 gene increases susceptibility to age-related macular degeneration". Science. 314 (5801): 992–93. doi:10.1126/science.1133811. PMID 17053109.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Dewan, A; Liu, M; Hartman, S และคณะ (2006). "HTRA1 Promoter Polymorphism in Wet Age-Related Macular Degeneration". Science. 314 (5801): 989–92. doi:10.1126/science.1133807. PMID 17053108.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Hirschler, Ben (2008-10-07). "Gene discovery may help hunt for blindness cure". Reuters. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-10-11. สืบค้นเมื่อ 2008-10-07.
- ↑
Udar, N; Atilano, SR; Memarzadeh, M; Boyer, D; Chwa, M; Lu, S (2009). "Mitochondrial DNA Haplogroups Associated with Age-Related Macular Degeneration". Invest Ophthalmol Vis Sci. 50 (6): 2966–74. doi:10.1167/iovs.08-2646. PMID 19151382.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Canter, JA; Olson, LM; Spencer, K; Schnetz-Boutaud, N; Anderson, B; Hauser, MA (2008). Nicholas Weedon, Michael (บ.ก.). "Mitochondrial DNA polymorphism A4917G is independently associated with age-related macular degeneration". PLoS ONE. 3 (5): e2091. doi:10.1371/journal.pone.0002091. PMC 2330085. PMID 18461138.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์)
- ↑ Mullins, RF; Russell, SR; Anderson, DH; Hageman, GS (2000). "Drusen associated with aging and age-related macular degeneration contain proteins common to extracellular deposits associated with atherosclerosis, elastosis, amyloidosis, and dense deposit disease". FASEB J. 14 (7): 835–46. PMID 10783137.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Hageman, GS; Anderson, DH; Johnson, LV; Hancox, LS; Taiber, AJ; Hardisty, LI (2005). "A common haplotype in the complement regulatory gene factor H (HF1/CFH) predisposes individuals to age-related macular degeneration". Proc Natl Acad Sci USA. 102 (20): 7227–32. doi:10.1073/pnas.0501536102. PMC 1088171. PMID 15870199.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Chen, LJ; Liu, DT; Tam, PO; Chan, WM; Liu, K; Chong, KK (2006). "Association of complement factor H polymorphisms with exudative age-related macular degeneration". Mol. Vis. 12: 1536–42. PMID 17167412.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Despriet, DD; Klaver, CC; Witteman, JC; Bergen, AA; Kardys, I; de Maat, MP (2006). "Complement factor H polymorphism, complement activators, and risk of age-related macular degeneration". JAMA. 296 (3): 301–09. doi:10.1001/jama.296.3.301. PMID 16849663.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Li, M; Tmaca-Sonmez, P; Othman, M; Branham, KE; Khanna, R; Wade, MS (2006). "CFH haplotypes without the Y402H coding variant show strong association with susceptibility to age-related macular degeneration". Nature Genetics. 38 (9): 1049–54. doi:10.1038/ng1871. PMC 1941700. PMID 16936733.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Haines, JL; Hauser, MA; Schmidt, S; Scott, WK; Olson, LM; Gallins, P (2005). "Complement factor H variant increases the risk of age-related macular degeneration". Science. 308 (5720): 419–21. doi:10.1126/science.1110359. PMID 15761120.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Rohrer, B; Long, Q; Coughlin, B; Renner, B; Huang, Y; Kunchithapautham, K (2010). "A targeted inhibitor of the complement alternative pathway reduces RPE injury and angiogenesis in models of age-related macular degeneration". Adv Exp Med Biol. Advances in Experimental Medicine and Biology. 703: 137–49. doi:10.1007/978-1-4419-5635-4_10. ISBN 978-1-4419-5634-7. PMID 20711712.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Kunchithapautham, K; Rohrer, B (2011). "Sublytic Membrane-Attack-Complex (MAC) Activation Alters Regulated Rather than Constitutive Vascular Endothelial Growth Factor (VEGF) Secretion in Retinal Pigment Epithelium Monolayers". J Biol Chem. 286 (27): 23717–24. doi:10.1074/jbc.M110.214593. PMC 3129152. PMID 21566137.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Yates, JR; Sepp, T; Matharu, BK; Khan, JC; Thurlby, DA; Shahid, H (2007). "Complement C3 variant and the risk of age-related macular degeneration". NEJM. 357 (6): 553–61. doi:10.1056/NEJMoa072618. PMID 17634448.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Fritsche, LG; Loenhardt, T; Janssen, A; Fisher, SA; Rivera, A; Keilhauer, CN (2008). "Age-related macular degeneration is associated with an unstable ARMS2 (LOC387715) mRNA DNA damage and repair in age-related macular degeneration". Nat. Genet. 40 (7): 892–96. doi:10.1038/ng.170.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 44.0 44.1 Chen, W; Stambolian, D; Edwards, AO; Branham, KE; Othman, M; Jakobsdottir, J (2010). "Genetic variants near TIMP3 and high-density lipoprotein-associated loci influence susceptibility to age-related macular degeneration". Proc Natl Acad Sci USA. 107 (16): 7401–7406. doi:10.1073/pnas.0912702107. PMC 2867722. PMID 20385819.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Neale, BM; Fagerness, J; Reynolds, R; Sobrin, L; Parker, M; Raychaudhuri, S (2010). "Genome-wide association study of advanced age-related macular degeneration identifies a role of the hepatic lipase gene (LIPC)". Proc Natl Acad Sci USA. 107 (16): 7395–400. doi:10.1073/pnas.0912019107. PMC 2867697. PMID 20385826.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Ratnayaka, JA; Serpell, LC; Lotery, AJ (2015). "Dementia of the eye: the role of amyloid beta in retinal degeneration". Eye (Lond). 29: 1013–26. doi:10.1038/eye.2015.100. PMC 4541342. PMID 26088679.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 47.0 47.1 Ferris, Frederick L.; Wilkinson, C.P.; Bird, Alan; Chakravarthy, Usha; Chew, Emily; Csaky, Karl; Sadda, SriniVas R. (2013). "Clinical Classification of Age-related Macular Degeneration". Ophthalmology. 120 (4): 844–851. doi:10.1016/j.ophtha.2012.10.036. ISSN 0161-6420.
- ↑ http://www.pall.com/main/fuels-and-chemicals/green-oil-contaminant-separation-37657.page
- ↑
Alberts, Daniel Albert (2012). Dorland's illustrated medical dictionary (32nd ed.). Philadelphia, PA: Saunders/Elsevier. p. 1062. ISBN 978-1-4160-6257-8.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Medical Definition of LIPOFUSCIN". merriam-webster.
- ↑ "Melanin aggregation and polymerization: possible implications in age related macular degeneration". Ophthalmic Research. 37: 136–41. 2005.
- ↑ "Harvard Medical signs agreement with Merck to develop potential therapy for macular degeneration". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-06-07.
- ↑
Thornton, J; Edwards, R; Mitchell, P; Harrison, RA; Buchan, I; Kelly, SP (2005). "Smoking and age-related macular degeneration: a review of association". Eye. 19 (9): 935–44. doi:10.1038/sj.eye.6701978. PMID 16151432.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Tomany, SC; Cruickshanks, KJ; Klein, R; Klein, BE; Knudtson, MD (2004). "Sunlight and the 10-year incidence of age-related maculopathy: the Beaver Dam Eye Study". Arch Ophthalmol. 122 (5): 750–7. doi:10.1001/archopht.122.5.750. PMID 15136324.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Szaflik, JP; Janik-Papis, K; Synowiec, E; Ksiazek, D; Zaras, M; Wozniak, K (2009). "DNA damage and repair in age-related macular degeneration". Mutat Res. 669 (1–2): 167–76. doi:10.1016/j.mrfmmm.2009.06.008.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Barot, M; Gokulgandhi, MR; Mitra, AK (2011). "Mitochondrial dysfunction in retinal diseases". Current Eye Research. 36 (12): 1069–77. doi:10.3109/02713683.2011.607536. PMC 4516173. PMID 21978133.
- ↑ 57.0 57.1 Owsley, Cynthia; McGwin, Gerald; Clark, Mark E.; Jackson, Gregory R.; Callahan, Michael A.; Kline, Lanning B.; Witherspoon, C. Douglas; Curcio, Christine A. (2016). "Delayed Rod-Mediated Dark Adaptation Is a Functional Biomarker for Incident Early Age-Related Macular Degeneration". Ophthalmology. 123 (2): 344–351. doi:10.1016/j.ophtha.2015.09.041. ISSN 0161-6420.
- ↑ Owsley, Cynthia (2015-10-30). "Delayed Rod-Mediated Dark Adaptation Is a Functional Biomarker for Incident Early Age-Related Macular Degeneration". Ophthalmology. 123: 344–51. doi:10.1016/j.ophtha.2015.09.041.
- ↑ "Preferential Hyperacuity Perimetry (PHP) as an Adjunct Diagnostic Tool to Funduscopy in Age-related Macular Degeneration - Ophthalmology Technology Spotlight". Medcompare. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-07-14. สืบค้นเมื่อ 2011-01-11.
- ↑ 60.0 60.1 Hobbs, RP; Bernstein, PS (2013). "Nutrient Supplementation for Age-related Macular Degeneration, Cataract, and Dry Eye". Journal of ophthalmic & vision research. 9 (4): 487–93. doi:10.4103/2008-322X.150829. PMC 4329711. PMID 25709776.
- ↑ Gehlbach, P; Li, T; Hatef, E (2016). "Statins for age-related macular degeneration". Cochrane Database Syst Rev (8): CD006927. doi:10.1002/14651858.CD006927.pub5. PMC 5029465. PMID 27490232.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Geltzer, A; Turalba, A; Vedula, SS (2013). "Surgical implantation of steroids with antiangiogenic characteristics for treating neovascular age-related macular degeneration". Cochrane Database Syst Rev. 1: CD005022. doi:10.1002/14651858.CD005022.pub3. PMC 4269233. PMID 23440797.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ de Jong, PT (2006). "Age-related macular degeneration". N Engl J Med. 355 (14): 1474–85. doi:10.1056/NEJMra062326. PMID 17021323.
- ↑
Horton, Jonathan C. "25". Disorders of the Eye. Harrison's Principles of Internal Medicine (16th ed.).
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Chakravarthy, U; Harding, SP; Rogers, CA; Downes, SM; Lotery, AJ; Culliford, LA; Reeves, BC; on behalf of the IVAN study, investigators (2013-07-18). "Alternative treatments to inhibit VEGF in age-related choroidal neovascularisation: 2-year findings of the IVAN randomised controlled trial". Lancet. 382 (9900): 1258–67. doi:10.1016/S0140-6736(13)61501-9. PMID 23870813.
- ↑ Moja, L; Lucenteforte, E; Kwag, KH; Bertele, V; Campomori, A; Chakravarthy, U; D'Amico, R; Dickersin, K; Kodjikian, L; Lindsley, K; Loke, Y; Maguire, M; Martin, DF; Mugelli, A; Mühlbauer, B; Püntmann, I; Reeves, B; Rogers, C; Schmucker, C; Subramanian, ML; Virgili, G (2014-09-15). "Systemic safety of bevacizumab versus ranibizumab for neovascular age-related macular degeneration". The Cochrane Database of Systematic Reviews. 9: CD011230. doi:10.1002/14651858.CD011230.pub2. PMC 4262120. PMID 25220133.
- ↑ Copley, Caroline; Hirschler, Ben (2012-04-24). "Novartis challenges UK Avastin use in eye disease". Reuters. เก็บจากแหล่งเดิมเมื่อ 2013-05-22.
- ↑ Mundy, Alicia (2010-06-17). "Medicare Eye Study Finds Untapped Savings". Wall Street Journal. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-09-23. สืบค้นเมื่อ 2018-05-27.
- ↑ "FDA Approves New Drug Treatment for Age-Related Macular Degeneration". FDA.gov. U.S. Food and Drug Administration. เก็บจากแหล่งเดิมเมื่อ 2015-11-20.
- ↑ "FDA approves Eylea for macular degeneration". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-05-28.
- ↑ "Age-Related Macular Degeneration PPP - Updated 2015". American Academy of Ophthalmology Preferred Practice Pattern. 2015-01-29. เก็บจากแหล่งเดิมเมื่อ 2016-10-21. สืบค้นเมื่อ 2016-10-22.
- ↑ Lindsley, K; Li, T; Ssemanda, E; Virgili, G; Dickersin, K (2016). "Interventions for Age-Related Macular Degeneration: Are Practice Guidelines Based on Systematic Reviews?". Ophthalmology. 123 (4): 884–97. doi:10.1016/j.ophtha.2015.12.004. PMID 26804762.
- ↑ Virgili, G; Michelessi, M; Parodi, MB; Bacherini, D; Evans, JR (2015). "Laser treatment of drusen to prevent progression to advanced age-related macular degeneration". Cochrane Database Syst Rev. 10: CD006537. doi:10.1002/14651858.CD006537.pub3. PMC 4733883. PMID 26493180.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Virgili, G; Bini, A (2007-07-18). "Laser photocoagulation for neovascular age-related macular degeneration". The Cochrane Database of Systematic Reviews (3): CD004763. doi:10.1002/14651858.CD004763.pub2. PMID 17636773.
- ↑ Meads, C (2003). "Clinical effectiveness and cost-utility of photodynamic therapy for wet age-related macular degeneration: a systematic review and economic evaluation". Health Technology Assessment. 7 (9). doi:10.3310/hta7090. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-11-07.
- ↑ Casparis, H; Lindsley, K; Kuo, IC; Sikder, S; Bressler, NM (2017). "Surgery for cataracts in people with age-related macular degeneration". Cochrane Database Syst Rev. 2: CD006757. doi:10.1002/14651858.CD006757.pub4. PMID 28206671.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Low Vision Rehabilitation Delivery Model". Mdsupport.org. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-11-07. สืบค้นเมื่อ 2011-01-11.
- ↑ "Agencies, Centers, Organizations, & Societies". Mdsupport.org. 2005-09-01. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-06-11. สืบค้นเมื่อ 2011-01-11.
- ↑ "WHO Disease and injury country estimates". World Health Organization. 2009. เก็บจากแหล่งเดิมเมื่อ 2009-11-11. สืบค้นเมื่อ 2009-11-11.
- ↑ Age-Related Eye Disease Study Research Group (2000). "Risk Factors Associated with Age-Related Macular Degeneration: A Case-control Study in the Age-Related Eye Disease Study: Age-Related Eye Disease Study Report Number 3". Ophthalmology. 107 (12): 2224–32. doi:10.1016/S0161-6420(00)00409-7. PMC 1470467. PMID 11097601.
- ↑
Clemons, TE; Milton, RC; Klein, R; Seddon, JM; Ferris, FL (2005). "Risk Factors for the Incidence of Advanced Age-Related Macular Degeneration in the Age-Related Eye Disease Study (AREDS) AREDS Report No. 19". Ophthalmology. 112 (4): 533–39. doi:10.1016/j.ophtha.2004.10.047. PMC 1513667. PMID 15808240.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Mullins, RF; และคณะ (2000). "Drusen associated with aging and age-related macular degeneration contain proteins common to extracellular deposits associated with atherosclerosis, elastosis, amyloidosis, and dense deposit disease". FASEB J. 14 (7): 835–46. PMID 10783137.
- ↑
Neale, BM; Fagerness, J; Reynolds, R; Sobrin, L; Parker, M; Raychaudhuri, S (2010). "Genome-wide association study of advanced age-related macular degeneration identifies a role of the hepatic lipase gene (LIPC)". Proc Natl Acad Sci USA. 107 (16): 7395–7400. doi:10.1073/pnas.0912019107. PMC 2867697. PMID 20385826.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ John, S และคณะ (2013). "Choice of cell source in cell based therapies for retinal damage due to age related macular degeneration (AMD) : A review". Journal of Ophthalmology. 2013: 1–9. doi:10.1155/2013/465169.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ "Development of human embryonic stem cell therapies for age-related macular degeneration". Trends in Neurosciences. 36: 391, 393.
- ↑ "Judi Dench 'can't read any more due to failing eyesight". The Guardian. 2014-02-23. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-10-19.
แหล่งข้อมูลอื่น[แก้]
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |
- โรคจุดภาพชัดของจอตาเสื่อม ที่เว็บไซต์ Curlie
