การทดลองแบบสุ่มและมีกลุ่มควบคุม
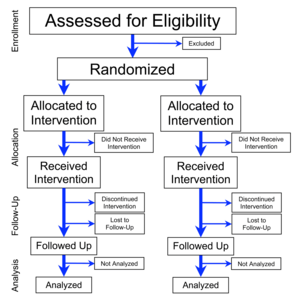
การทดลองแบบสุ่มและมีกลุ่มควบคุม[2] (อังกฤษ: randomized controlled trial; randomised control trial[3] ตัวย่อ RCT) เป็นการทดลองทางวิทยาศาสตร์แบบหนึ่ง ที่ใช้เป็นมาตรฐานทอง (gold standard) ของการทดลองทางคลินิก มักจะใช้เพื่อตรวจสอบประสิทธิผลและประสิทธิภาพของบริการสุขภาพ (เช่นการแพทย์หรือการพยาบาล) หรือเทคโนโลยีสุขภาพ (เช่นยา อุปกรณ์ทางการแพทย์ หรือวิธีการผ่าตัด) โดยทำในกลุ่มคนไข้ที่เป็นตัวแทนประชากรทางสถิติ (statistical population) และใช้เพื่อรวบรวมข้อมูลอื่น ๆ ที่มีประโยชน์เกี่ยวกับผลลบของการรักษาพยาบาล เช่นปฏิกิริยาเชิงลบต่อยา (adverse drug reactions)
ลักษณะเฉพาะของ RCT ที่ทำทั่ว ๆ ไปก็คือ หลังจากที่มีการประเมินคุณสมบัติการรับเลือกของผู้ร่วมการทดลองแต่ก่อนที่จะเริ่มการรักษาพยาบาล (หรือเงื่อนไขอื่น ๆ ถ้าไม่ใช่การทดลองทางการแพทย์) จะมีการจัดผู้ร่วมการทดลองให้อยู่ในกลุ่มสองกลุ่มโดยสุ่ม กลุ่มหนึ่งจะได้รับการรักษาพยาบาล (หรือเงื่อนไข) ที่เป็นประเด็นการศึกษา อีกกลุ่มหนึ่งจะได้รับการรักษาพยาบาล (หรือเงื่อนไข) อีกอย่างหนึ่งที่เป็นตัวควบคุมหรือเป็นตัวเปรียบเทียบ การจัดกลุ่มโดยสุ่มในการทดลองจริง ๆ นั้นซับซ้อน แต่ว่าถ้าคิดอย่างง่าย ๆ จะเป็นกระบวนการเหมือนกับโยนเหรียญที่สมดุล หลังจากการจัดกลุ่มโดยสุ่ม จะมีการปฏิบัติต่อผู้ร่วมการทดลองทั้งสองกลุ่มเหมือน ๆ กันทุกอย่าง ยกเว้นการรักษาพยาบาลที่เป็นประเด็นศึกษา เช่นวิธีการรักษา การตรวจสอบ การรักษาโดยเป็นผู้ป่วยนอก และ/หรือการติดตามผล ข้อดีที่สำคัญที่สุดของการสุ่มที่ทำถูกต้องก็คือ ช่วยลดระดับ allocation bias คือสร้างความสมดุลขององค์พยากรณ์โรค (prognostic factor) ที่มีในคนไข้ ทั้งที่รู้และไม่รู้ ระหว่างกลุ่มต่าง ๆ ที่รับการรักษา[4] กล่าวโดยสาระก็คือ คำว่า "สุ่ม" แสดงถึงกระบวนการจัดผู้ร่วมการทดลองให้อยู่ในกลุ่มการทดลองหรือกลุ่มควบคุมโดยเสี่ยงโชค เพื่อที่จะลดระดับความเอนเอียง
แม้ว่าคำว่า "RCT" และ การทดลองแบบสุ่ม (randomized trial) บางครั้งจะใช้เป็นไวพจน์ซึ่งกันและกัน แต่ระเบียบวิธีที่ดีกว่าก็จะใช้คำว่า "RCT" สำหรับการทดลองที่มีกลุ่มควบคุม (control) ที่ไม่ได้รับการรักษาที่เป็นประเด็นศึกษา (placebo-controlled study) หรือรับการรักษาที่มีการทดสอบมาก่อนแล้ว (positive-control study) เท่านั้น ดังนั้น คำว่า การทดลองแบบสุ่ม (randomized trial) ควรใช้เรียกงานศึกษาเปรียบเทียบกลุ่มการทดลองต่าง ๆ โดยที่ไม่มีกลุ่มควบคุม[5] และเช่นกัน แม้ว่าตัวย่อว่า "RCT" จะสามารถขยายเป็น randomized clinical trial (การทดลองทางคลินิกแบบสุ่ม) หรือ randomized comparative trial (การทดลองเปรียบเทียบแบบสุ่ม) แต่ว่า เพื่อที่จะเลี่ยงความคลุมเครือในสิ่งตีพิมพ์ทางวิทยาศาสตร์ จะเป็นระเบียบวิธีที่ดีกว่าถ้าจะใช้ตัวย่อ "RCT" สำหรับการทดลองที่มีกลุ่มควบคุมเท่านั้น และเพราะว่า การทดลองทางคลินิกแบบสุ่มไม่จำเป็นจะต้องมีกลุ่มควบคุม (และงานบางงานไม่สามารถจะมีได้ เพราะว่าเป็นเรื่องที่ทำได้ยากหรือว่าไม่ถูกจริยธรรม) ดังนั้น คำว่า randomized controlled clinical trials (การทดลองทางคลินิกแบบสุ่มและมีกลุ่มควบคุม) ก็จะเป็นชื่อที่ดีสำหรับงาน RCT ที่เป็นการทดลองทางคลินิก[6][7][8]
ให้สังเกตว่า มีการใช้ RCT ในงานวิจัยสาขาอื่น ๆ อีกด้วย รวมทั้งในสาขาต่าง ๆ ของสังคมศาสตร์ เช่นนิติศาสตร์ การศึกษา และการพัฒนาระหว่างประเทศ (ดูหัวข้อ "ในสังคมศาสตร์")
ประวัติ
[แก้]การทดลองแบบสุ่ม (Randomized experiment) เกิดใช้เป็นครั้งแรกในปี ค.ศ. 1885 ในสาขาจิตวิทยาเชิงทดลองโดยบิดาของปรัชญาปฏิบัตินิยม (pragmatism) ชาวอเมริกัน ชาลส์ แซนเดอร์ส เพียร์ซ[9] และในสาขาการศึกษา[10][11][12] ต่อมาในปี ค.ศ. 1923 การทดลองแบบสุ่มก็เริ่มปรากฏในสาขาเกษตรกรรม ทำโดยนักสถิติชาวโปแลนด์-อเมริกัน Jerzy Neyman[13] และนักสถิติชาวอังกฤษเซอร์โรนัลด์ ฟิชเช่อร์ และเป็นงานวิจัยเชิงทดลองและบทความอื่น ๆ ของฟิชเช่อร์นั่นเอง ที่ได้เริ่มสร้างความนิยมให้กับการทดลองแบบสุ่ม[14]
ส่วน RCT ที่ตีพิมพ์เป็นบทความแรกในปี ค.ศ. 1948 เป็นงานชื่อว่า "Streptomycin treatment of pulmonary tuberculosis (การรักษาวัณโรคปอดด้วยสเตรปโตมัยซิน)" พิมพ์ในประเทศอังกฤษ[15][16][17] ซึ่งผู้เขียนท่านหนึ่งก็คือออสติน แบร็ดฟอร์ด ฮิลล์ ผู้ได้รับเครดิตว่า เป็นคนแรกที่ได้ค้นคิด RCT แบบที่ใช้ในปัจจุบัน[18]
โดยปลายคริสต์ศตวรรษที่ 20 ก็มีการยอมรับแล้วว่า RCT เป็นระเบียบวิธีมาตรฐานสำหรับ "การบำบัดโรคที่สมเหตุผล" (rational therapeutics) ในแพทยศาสตร์[19] โดยปี ค.ศ. 2004 มีผลงาน RCT กว่า 150,000 ชิ้นในระบบ Cochrane Library ขององค์กรความร่วมมือคอเครน[18] เพื่อจะเพิ่มคุณภาพของการรายงาน RCT ในสิ่งตีพิมพ์ทางการแพทย์ นักวิทยาศาสตร์และบรรณาธิการนานาชาติกลุ่มหนึ่งได้พิมพ์บทความแถลงชื่อว่า "Consolidated Standards of Reporting Trials (มาตรฐานรวมในการรายงานการทดลอง)" (CONSORT) ในปี ค.ศ. 1996 2001 และ 2010 ซึ่งได้กลายมาเป็นระเบียบที่ยอมรับกันอย่างกว้างขวาง[1][4]
จริยธรรม
[แก้]มีหลักจริยธรรมที่เรียกว่า "clinical equipoise (ความเสมอภาคทางคลินิก)" ซึ่งก็คือจะเริ่มทำการทดลองได้ก็ต่อเมื่อ "มีความไม่ชัดเจนจริง ๆ ในกลุ่มผู้เชี่ยวชาญทางการแพทย์... เกี่ยวกับการรักษาที่ดีกว่า" เป็นหลักจริยธรรมที่ใช้โดยสามัญในการทดลองทางคลินิก (กล่าวอีกอย่างหนึ่งก็คือจะเริ่มการทดลองได้ก็ต่อเมื่อไม่ปรากฏมติของผู้เชี่ยวชาญว่า การรักษาที่เป็นประเด็นจะดีกว่าสิ่งที่เปรียบเทียบหรือไม่)[20] และแม้ว่าจะเป็นหลักที่มีการนำมาใช้ด้วยใน RCT แต่ว่า จริยธรรมเกี่ยวกับ RCT มีเรื่องที่ต้องพิจารณาเป็นพิเศษ
อย่างแรกก็คือ มีการเสนอว่า ความเสมอภาค (คือไม่รู้ว่าจะมีผลดีกว่าหรือไม่) ไม่เป็นเหตุเพียงพอที่จะเริ่มทำการทดลองแบบ RCT[21] อีกอย่างหนึ่งก็คือ "ความเสมอภาคที่เป็นมติของกลุ่ม" (collective equipoise) อาจจะไม่ตรงกับ "ความเสมอภาคที่เป็นมติของตน" คือ ผู้ทำงานวิจัยเองอาจจะเชื่อว่า การรักษาที่เป็นประเด็นมีผลดีกว่า[22] และอย่างสุดท้ายก็คือ มีการใช้ "Zelen's design" ในการออกแบบ RCT ซึ่งสุ่มจัดผู้ร่วมการทดลองเข้ากลุ่ม ก่อนที่ผู้ร่วมการทดลองจะยินยอมรับเงื่อนไขที่เป็นประเด็นการศึกษา ดังนั้น ผู้ที่อยู่ในกลุ่มควบคุมอาจจะไม่รู้ว่าตนเป็นส่วนของการศึกษา และไม่จำเป็นที่จะต้องให้การยินยอมเพื่อจะรับการปฏิบัติรักษาที่เป็นมาตรฐาน (ที่ใช้เปรียบเทียบกับกลุ่มทดลอง) การสุ่มโดยที่ไม่มีการยินยอมเช่นนี้อาจจะถูกจริยธรรมสำหรับ RCT เกี่ยวกับการตรวจคัดโรค (screening) และการรักษาบางอย่าง แต่อาจจะไม่ถูกจริยธรรม "สำหรับการทดลองวิธีการรักษาพยาบาลโดยมาก"[23][24]
การลงทะเบียนการทดลอง
[แก้]ในปี ค.ศ. 2004 International Committee of Medical Journal Editors (คณะกรรมการบรรณาธิการวารสารแพทย์นานาชาติ; ตัวย่อ ICMJE ; เว็บไซต์) ได้ประกาศว่า การทดลองทั้งหมดที่เริ่มการขึ้นทะเบียน (enrollment) หลังวันที่ 1 กรกฎาคม ค.ศ. 2005 ต้องลงทะเบียนเพื่อที่จะมีสิทธิการตีพิมพ์ในวารสารชั้นนำที่เป็นสมาชิก 12 วารสารซึ่งรวมทั้ง BMJ, JAMA, NEJM และ The Lancet[25] ถึงกระนั้น โดยปี ค.ศ. 2009 และ 2011 ก็ยังมีการทดลองที่ลงทะเบียนช้า หรือไม่ได้ลงทะเบียนเลย[26][27]
ประเภท
[แก้]โดยแบบ
[แก้]การจัดประเภทอย่างหนึ่งก็คือโดยแบบงานศึกษา โดยเรียงลำดับจากแบบที่มีใช้มากที่สุดไปยังที่ใช้น้อยที่สุดในสิ่งตีพิมพ์เกี่ยวกับสุขภาพพยาบาล แบบหลัก ๆ ของ RCT มีดังต่อไปนี้[28]
- Parallel study - มีการจัดผู้ร่วมการทดลองแต่ละคนให้อยู่ในกลุ่มโดยสุ่ม ผู้ร่วมการทดลองทั้งหมดในกลุ่มจะได้รับ (หรือไม่ได้รับ) การรักษาพยาบาลที่เป็นประเด็นศึกษา
- Crossover study (การศึกษาข้ามกลุ่ม) - ในช่วงการศึกษา ผู้ร่วมการทดลองแต่ละคนจะได้รับ (หรือไม่ได้รับ) การรักษาพยาบาลที่เป็นประเด็นการศึกษาตามลำดับสุ่ม[29][30]
- Cluster randomised controlled trial - มีการจัดชุมชนทั้งกลุ่ม (เช่นทั้งหมู่บ้าน หรือทั้งโรงเรียน) โดยสุ่มให้รับการรักษาพยาบาลที่เป็นประเด็นศึกษาหรือไม่ได้รับ
- Factorial experiment - มีการจัดผู้ร่วมการทดลองโดยสุ่มให้อยู่ในกลุ่มที่จะได้รับการรักษาพยาบาลหรือไม่ได้รับ โดยเป็นแบบผสม (เช่น กลุ่ม 1 รับวิตามิน X และวิตามิน Y; กลุ่ม 2 รับวิตามิน X และยาหลอก Y; กลุ่ม 3 รับยาหลอก X และวิตามิน Y; และกลุ่ม 4 รับยาหลอก X และยาหลอก Y)
ในงานวิเคราะห์ RCT 616 งานที่มีการสร้างดัชนีใน PubMed ช่วงเดือนธันวาคม ปี ค.ศ. 2006 พบว่า 78% เป็นแบบ parallel; 16% เป็นแบบ crossover; 2% เป็นแบบ split-body; 2% เป็นแบบ cluster; และ 2% เป็นแบบ factorial[28]
โดยประสิทธิศักย์และประสิทธิผล
[แก้]RCT สามารถจัดให้เป็นประเภท "explanatory" (สำหรับอธิบาย) หรือ "pragmatic" (สำหรับปฏิบัติ)[31] คือ RCT สำหรับอธิบายจะตรวจสอบประสิทธิศักย์ (efficacy) ภายใต้สิ่งแวดล้อมสถานการณ์ที่มีในงานวิจัยและที่มีระดับการควบคุมสูง โดยมีผู้ร่วมการทดลองที่มีการคัดเลือกในระดับสูง[31] ส่วน RCT สำหรับปฏิบัติจะตรวจสอบประสิทธิผล (effectiveness) ในข้อปฏิบัติที่ใช้ในการรักษาพยาบาลตามปกติประจำวัน โดยมีผู้ร่วมการทดลองที่ไม่ได้ทำการคัดเลือก ภายใต้สถานการณ์สิ่งแวดล้อมจริง ๆ ที่ยืดหยุ่นได้ ดังนั้น RCT สำหรับปฏิบัติจะให้ความรู้เพื่อการตัดสินใจในการปฏิบัติจริง ๆ[31]
โดยสมมุติฐานว่าเหนือกว่า ไม่แย่กว่า และเสมอกัน
[แก้]วิธีการจัดประเภทของ RCT อีกประเภทหนึ่งจัดเป็น "superiority trials" (การทดสอบความเหนือกว่า) "noninferiority trials" (การทดสอบความไม่แย่กว่า) และ "equivalence trials" (การทดสอบความเสมอกัน) ซึ่งมีความแตกต่างกันโดยทั้งระเบียบวิธีและโดยการรายงาน[32] RCT โดยมากเป็นการทดสอบความเหนือกว่า ซึ่งมีสมมุติฐานว่า การรักษาพยาบาลที่เป็นประเด็นจะเหนือกว่าการปฏิบัติวิธีอื่นอย่างมีนัยสำคัญทางสถิติ[32] RCT บางส่วนเป็นการทดสอบความไม่แย่กว่า "เพื่อจะกำหนดว่า การรักษาพยาบาลใหม่นั้นไม่แย่กว่าการรักษาพยาบาลที่เป็นตัวเปรียบเทียบ"[32] ส่วน RCT ที่เหลือเป็นการทดสอบความเสมอกัน ที่มีสมมุติฐานว่า ผลของการรักษาพยาบาลทั้งสองไม่สามารถแยกแยะความแตกต่างกันได้[32]
การสุ่ม
[แก้]ข้อดีของการสุ่มที่ถูกต้องใน RCT รวมทั้ง[33]
- "กำจัดความเอนเอียงในการจัด (คนไข้)ให้ได้รับการรักษาพยาบาล (treatment assignment)" โดยเฉพาะก็คือกำจัดความเอนเอียงประเภทความเอนเอียงโดยการคัดเลือก (selection bias) และปัจจัยกวน (confounding)
- "ช่วยอำพรางวิธีการรักษาพยาบาลจากผู้ทำการตรวจสอบ จากผู้ร่วมการทดลอง และจากผู้ประเมินผล"
- "เปิดโอกาสให้ใช้ทฤษฎีความน่าจะเป็นที่จะแสดงค่าความเป็นไปได้ว่า ความแตกต่างของผลที่ได้ในระหว่างกลุ่มการรักษาเป็นเพียงเรื่องบังเอิญ (chance)"
มีขั้นตอนสองขั้นในการจัดกลุ่มคนไข้โดยสุ่ม ขั้นแรกเป็นการเลือกวิธีการสุ่ม (randomization procedure) ที่สร้างลำดับการจัดกลุ่มที่พยากรณ์ไม่ได้ นี่อาจจะเป็นการสุ่มแบบง่าย ๆ โดยจัดให้คนไข้อยู่ในกลุ่มต่าง ๆ โดยมีความน่าจะเป็นเท่า ๆ กัน หรืออาจจะเป็นแบบ "restricted" (จำกัด) หรืออาจะเป็นแบบ "adaptive" (ปรับได้) ขั้นที่สองซึ่งเป็นเรื่องของการปฏิบัติโดยตรงก็คือ การปิดบังการจัดสรร (allocation concealment) ซึ่งหมายถึงการป้องกันอย่างเข้มงวดเพื่อจะให้แน่ใจได้ว่า การจัดกลุ่มคนไข้จะไม่มีการเปิดเผยก่อนขั้นตอนที่จะจัดคนไข้ให้เข้ากลุ่มจริง ๆ (เช่นหลังจากที่คนไข้ได้ยินยอมตกลงเข้าร่วมการทดลองแล้ว) ยกตัวอย่างเช่น วิธีการจัดกลุ่มอย่างเป็นระบบที่ไม่ใช่เป็นการสุ่ม เช่นการสลับให้คนไข้หนึ่งอยู่ในกลุ่มหนึ่ง และคนไข้ต่อไปอยู่ในอีกกลุ่มหนึ่ง อาจทำให้เกิด "โอกาสเกิดความมัวหมองโดยหาประมาณไม่ได้" และเป็นการทำลายการปิดบังการจัดสรร[33]
การเลือกการสุ่ม
[แก้]การสุ่มที่สมบูรณ์จะทำให้สำเร็จจุดมุ่งหมายดังต่อไปนี้คือ[34]
- เพิ่มกำลังทางสถิติ (statistical power) ให้สูงสุด โดยเฉพาะเมื่อมีการวิเคราะห์หารูปแบบในกลุ่มย่อย (Subgroup analysis) คือ โดยทั่ว ๆ ไปแล้ว การมีกลุ่มเท่า ๆ กันจะทำให้มีกำลังทางสถิติในระดับสูงสุด แต่ว่า ในการวิเคราะห์บางชนิด การมีกลุ่มไม่เท่ากันอาจจะมีอานุภาพยิ่งกว่า (เช่น การใช้ Dunnett’s procedure เพื่อเปรียบเทียบการใช้ยาหลอกเทียบกับการใช้ยาทดลองหลาย ๆ ขนาด[35]) และอาจจะจำเป็นเพื่อเหตุผลที่ไม่เกี่ยวกับการวิเคราะห์ (เช่น คนไข้อาจจะสนใจที่จะเข้าร่วมการทดลองมากกว่า ถ้ามีโอกาสสูงกว่าที่จะได้รับการรักษาพยาบาลที่เป็นประเด็น หรือเช่น องค์กรที่มีหน้าที่ควบคุมทางกฎหมายอาจจะมีกฎบังคับให้มีคนไข้อย่างน้อยที่สุดในกลุ่มทดลองที่เป็นประเด็นการศึกษา)[36]
- ลดระดับความเอนเอียงโดยการคัดเลือก (selection bias) ให้ต่ำที่สุด คือ ความเอนเอียงอาจจะเกิดขึ้นถ้าผู้ทำการทดลองเลือกคนไข้เข้ากลุ่มโดยมีความเอนเอียง โดยจะตั้งใจก็ดีหรือโดยเกิดขึ้นใต้จิตสำนึกก็ดี กระบวนการสุ่มที่ดีจะพยากรณ์ไม่ได้ ดังนั้น ผู้ทำการทดลองจะไม่สามารถเดาว่าคนไข้จะจัดเข้ากลุ่มไหนโดยอาศัยการจัดกลุ่มที่เกิดขึ้นครั้งสุดท้าย ความเสี่ยงต่อ selection bias จะมีระดับสูงสุดถ้าผู้ทำการทดลองรู้การจัดการรักษาพยาบาลครั้งสุดท้ายของคนไข้ (เช่นการทดลองที่ไม่ได้อำพราง) หรือสามารถเดาได้ (อาจจะเป็นเพราะยามีผลข้างเคียงที่ไม่เหมือนใคร)
- ลดระดับ allocation bias ให้ต่ำที่สุด (หรือ confounding) คือ ความเอนเอียงนี้อาจเกิดขึ้นได้เมื่อ covariate (ตัวแปรปรวนร่วมเกี่ยว) ที่มีอิทธิพลต่อผล ไม่มีการกระจายตัวอย่างสม่ำเสมอระหว่างกลุ่มต่าง ๆ ดังนั้นผลของการรักษาพยาบาล จึงเกิดความสับสนกับผลของตัวแปรปรวนร่วมเกี่ยว (คือเกิด accidental bias[33][37]) ถ้าการสุ่มทำให้เกิดความไม่สมดุลของตัวแปรปรวนร่วมเกี่ยว ที่มีความสัมพันธ์กับผลที่ได้ในระหว่างกลุ่มการทดลอง ค่าประเมินของผลที่ได้อาจจะมีความเอนเอียงถ้าไม่ได้ปรับผลที่ได้จากตัวแปรปรวนร่วมเกี่ยว (ซึ่งอาจจะเป็นค่าที่ไม่ได้วัดและดังนั้นจึงปรับไม่ได้)
อย่างไรก็ดี ไม่มีวิธีการสุ่มอย่างใดอย่างหนึ่งที่สามารถให้ถึงจุดมุ่งหมายเหล่านี้ได้ในทุก ๆ สถานการณ์ ดังนั้น นักวิจัยจะต้องเลือกวิธีใดวิธีหนึ่งสำหรับงานศึกษา อาศัยการเปรียบเทียบข้อดีและข้อเสียของวิธีการสุ่ม
การสุ่มแบบง่าย ๆ
[แก้]การสุ่มแบบง่าย ๆ (simple randomization) นี้เป็นวิธีที่ใช้โดยสามัญที่สุดและเข้าใจได้ง่ายที่สุด คล้ายกับ การโยนเหรียญที่สมดุลซ้ำ ๆ[33] โดยมีชื่ออื่นว่า การสุ่มสมบูรณ์ (complete randomization) หรือ การสุ่มไม่จำกัด (unrestricted randomization) เป็นการสุ่มที่ทนทานต่อทั้งความเอนเอียงโดยการคัดเลือก (selection bias) และทั้ง accidental bias แต่ว่า จุดอ่อนของวิธีนี้ก็คืออาจจะทำให้กลุ่มต่าง ๆ มีขนาดไม่เท่ากันใน RCT ที่มีขนาดตัวอย่างน้อย ดังนั้น จึงมีการแนะนำให้ใช้สำหรับ RCT ที่มีผู้ร่วมการทดลองมากกว่า 200 คนเท่านั้น[38]
การสุ่มแบบจำกัด
[แก้]เพื่อให้ขนาดกลุ่มต่าง ๆ เท่ากันใน RCT ที่มีตัวอย่างน้อย จึงมีการแนะนำการใช้การสุ่มแบบจำกัด (restricted randomization) วิธีใดวิธีหนึ่ง[38] การสุ่มแบบจำกัดประเภทหลัก ๆ ที่ใช้ใน RCT รวมทั้ง
- Randomized block design หรือ blocked randomization (การสุ่มแบบบล็อก) ที่มีการกำหนด "block size" (ขนาดบล็อก) และ "allocation ratio" (อัตราส่วนการจัดกลุ่ม) โดยที่ผู้ร่วมการทดลองของแต่ละบล็อกจะมีการจัดกลุ่มโดยสุ่ม[33] ยกตัวอย่างเช่น ถ้ามีขนาดบล็อกเท่ากับ 6 และอัตราส่วนการจัดกลุ่มเป็น 2:1 ก็จะมีการจัดกลุ่มโดยสุ่มเป็นคน 4 คนในกลุ่มหนึ่ง และ 2 คนในอีกกลุ่มหนึ่ง การสุ่มประเภทนี้สามารถผสมกับ "stratified randomization" (การสุ่มแบบแบ่งชั้น) เช่นในการทดลองแบบหลายศูนย์ (multicenter trial) แต่ละศูนย์จะมีการสุ่มในกลุ่มของตนเอง "เพื่อจะให้มีความสมดุลของลักษณะผู้ร่วมการทดลองต่าง ๆ ในแต่ละกลุ่ม"[4] กรณีพิเศษของการสุ่มแบบบล็อกก็คือ (random allocation) ที่ตัวอย่างทั้งหมดจะรวมอยู่ในบล็อกเดียว[33] ข้อเสียสำคัญอย่างหนึ่งของการสุ่มโดยวิธีนี้ก็คือ แม้ว่าขนาดของบล็อกจะใหญ่และคนในบล็อกจะมีความต่าง ๆ กันโดยสุ่ม การใช้วิธีนี้ก็ยังอาจจะนำไปสู่ความเอนเอียงโดยการคัดเลือก (selection bias)[34] ข้อเสียอีกอย่างหนึ่งก็คือ การวิเคราะห์ที่สมบูรณ์จะต้องมีการแบ่งส่วนวิเคราะห์โดยบล็อก[38]
- Adaptive biased-coin randomization (การสุ่มแบบมีเหรียญเอนเอียงและปรับได้ โดยมี urn randomization เป็นที่รู้จักกันดีที่สุด) โดยวิธีการสุ่มที่ไม่ค่อยสามัญเช่นนี้ ความน่าจะเป็นที่จะจัดเข้าในกลุ่มหนึ่งจะลดลงถ้ากลุ่มนั้นมีคนมากเกินไป และจะเพิ่มขึ้นถ้ากลุ่มนั้นมีคนน้อยเกินไป[33] วิธีการเช่นนี้เชื่อกันว่า เสี่ยงต่อ ความเอนเอียงโดยการคัดเลือก (selection bias) น้อยกว่าการสุ่มแบบบล็อก[38]
การสุ่มแบบปรับได้
[แก้]มีวิธีการสุ่มแบบปรับได้ (adaptive randomization) สองอย่างที่ใช้ใน RCT แต่ใช้ไม่บ่อยเท่าการสุ่มแบบง่าย ๆ หรือการสุ่มแบบจำกัด คือ
- Covariate-adaptive randomization (การสุ่มแบบปรับตามตัวแปรปรวนร่วมเกี่ยว) ซึ่งวิธีหนึ่งที่ใช้ก็คือ minimization คือความน่าจะเป็นในการจัดเข้ากลุ่มจะมีค่าต่าง ๆ กันเพื่อลดความไม่สมดุลของตัวแปรปรวนร่วมเกี่ยว (covariate) ให้น้อยที่สุด[38] เป็นวิธีที่มีทั้งผู้สนับสนุนและผู้ไม่เห็นด้วย[33] เพราะว่า การจัดกลุ่มของบุคคลแรกในกลุ่มเท่านั้นที่เป็นการสุ่มจริง ๆ ดังนั้น วิธีนี้อาจจะไม่สามารถกำจัดความเอนเอียงขององค์ประกอบ (หรือตัวแปรปรวนร่วมเกี่ยว) ที่ซ่อนเร้นต่าง ๆ[4]
- Response-adaptive randomization (การสุ่มแบบปรับตามผลที่ได้) หรือรู้จักกันว่า outcome-adaptive randomization คือ ความน่าจะเป็นในการจัดเข้ากลุ่มหนึ่ง ๆ จะสูงขึ้น ถ้าคนไข้ก่อน ๆ ในกลุ่มมีการตอบสนองที่เป็นผลบวก[38] แม้ว่าจะมีการอ้างว่า วิธีนี้ถูกจริยธรรมดีกว่าการสุ่มแบบอื่น ๆ ถ้าความน่าจะเป็นของประสิทธิผล ของการรักษาพยาบาลหนึ่ง ๆ มีค่าเพิ่มขึ้นในช่วงการทดลอง แต่ว่า ถึงโดยปี ค.ศ. 1993 นักวิชาการด้านจริยธรรมก็ยังไม่ได้ศึกษาวิเคราะห์วิธีนี้โดยละเอียด[39]
การปิดบังการจัดสรร
[แก้]"Allocation concealment" (การปิดบังการจัดสรร) มีนิยามว่า "วิธีการที่ป้องกันรักษากระบวนการสุ่มเพื่อไม่ให้รู้การรักษาพยาบาลที่จะจัดให้ ก่อนที่คนไข้จะเข้าสู่กระบวนการศึกษา" เป็นเรื่องที่สำคัญใน RCT[40] คือโดยทางปฏิบัติแล้ว เพราะเหตุผลต่าง ๆ เป็นต้นว่าอาจจะมีความเห็นส่วนตัวที่เป็นไปทางใดทางหนึ่งเกี่ยวกับการรักษาพยาบาลที่เป็นประเด็นการศึกษา นักวิจัยทางคลินิกใน RCT อาจจะไม่สามารถรักษาความเป็นกลาง มีเรื่องที่เปิดเผยแบบนิรนามว่า มีนักวิจัยส่องไฟดูซองจดหมายที่ปิดผนึกไว้ หรือว่าเข้าค้นห้องสำนักงานเป็นต้น เพื่อที่จะหาข้อมูลการจัดกลุ่ม เพื่อจะได้มีโอกาสกำหนดการจัดกลุ่มของคนไข้คนต่อไปของตน[41] การกระทำเช่นนี้ทำให้เกิดความเอนเอียงโดยการคัดเลือก (selection bias) และปัจจัยกวน (confounders) ซึ่งจะมีน้อยที่สุดถ้ามีวิธีการปิดบังการจัดสรรที่ได้ผล เป็นการกระทำที่ในที่สุดจะบิดเบือนผลของงานศึกษา[33] วิธีการปิดบังการจัดสรรควรจะซ่อนการจัดกลุ่มจากทั้งคนไข้และทั้งนักวิจัย ไม่ให้สามารถรู้ได้จนกระทั่งถึงเวลาจัดคนไข้เข้ากลุ่มทดลองจริง ๆ เช่นหลังจากคนไข้ได้รับสมัคร และให้คำยินยอมเพื่อการรักษาที่ตนก็ยังไม่รู้คือยอมรับว่าตนอาจจะได้การรักษาของกลุ่มใดกลุ่มหนึ่งก็ได้[33]
ระเบียบวิธีมาตรฐานเพื่อให้มั่นใจว่ามีการปิดบังการจัดสรรที่ได้ผล รวมทั้งการใช้ซองเอกสารที่มีเลขตามลำดับที่ปิดทึบ (SNOSE), การใช้กล่องบรรจุยาที่มีเลขตามลำดับมีขนาดมีน้ำหนักมีป้ายและลักษณะอื่นคล้าย ๆ กัน, มีการจัดสรรที่ควบคุมโดยเภสัช, และมีการจัดสรรที่ทำโดยส่วนกลาง[33] มีการแนะนำว่า วิธีการปิดบังการจัดสรรควรจะรวมอยู่ในเกณฑ์วิธีการทดลองทางคลินิก (clinical trial protocol) และควรจะมีการรายงานอย่างละเอียดในสิ่งตีพิมพ์ที่แสดงผลของ RCT แต่ว่า งานศึกษาในปี ค.ศ. 2005 พบว่า RCT ส่วนมากมีเกณฑ์วิธีที่มีการปิดบังการจัดสรรที่ไม่ชัดเจน หรือไม่กล่าวถึงอย่างชัดเจนในงานที่ตีพิมพ์ หรือทั้งสองอย่าง[42] อย่างไรก็ดี ก็ยังมีงานศึกษาในปี ค.ศ. 2008 ของงาน meta-analysis 146 งานซึ่งสรุปว่า RCT ที่มีการปิดบังการจัดสรร (allocation concealment) ไม่เพียงพอหรือไม่ชัดเจนมักจะมีความเอนเอียงไปทางผลบวกต่อเมื่อผลของ RCT เป็นการวัดผลที่เป็นอัตวิสัย (subjective) แต่จะไม่มีเมื่อเป็นการวัดผลที่เป็นปรวิสัย[43]
ให้สังเกตว่า ในประเด็นการปกปิดการจัดสรร (allocation concealment) มักมีความสับสนในเรื่องหลัก ๆ คือ
- การปกปิดการจัดสรรไม่เหมือนกับการอำพรางการรักษา เพราะการปกปิดการจัดสรรเป็นการปิดไม่ให้รู้กลุ่มหรือการรักษาที่จะสุ่มจัดให้คนไข้ก่อนจะจัดจริง ๆ เท่านั้น เพื่อกันความเอนเอียงโดยการคัดเลือก (selection bias) และปัจจัยกวน (confounders) อื่น ๆ[33]: 614 ส่วนการทดลองแบบอำพรางจะปิดการรักษาแม้ในช่วงการทดลองเพื่อกันความเอนเอียงอื่น ๆ[40]
- การปกปิดการจัดสรรอาจจะหมายถึงการปกปิดการจัดกลุ่มรักษา หรือการปกปิดการรักษาที่ทำไปตามลำดับ
- การสร้างลำดับสุ่มและการปกปิดการจัดสรรเป็นคนละขั้นตอนกัน การสุ่มจัดการรักษาให้คนไข้จะต้องมีทั้งการสร้างลำดับสุ่มที่พยากรณ์ไม่ได้ และทั้งระเบียบวิธีการปกปิดการจัดสรรที่สามารถกันไม่ให้รู้การจัดกลุ่มหรือการจัดการรักษา (treatment assignment)[33]
ขนาดตัวอย่าง
[แก้]จำนวนของผู้ที่รับการรักษาพยาบาล (จะนับโดยจำนวนคนหรือจำนวนกลุ่มก็ดี) ในกลุ่มควบคุมและกลุ่มทดลองจะมีผลต่อความแม่นยำของ RCT ถ้าผลการรักษาพยาบาลนั้นเล็กน้อย จำนวนผู้ที่รับการรักษาในกลุ่มทั้งสองอาจจะไม่เพียงพอที่จะปฏิเสธผลว่าง (null hypothesis) เมื่อทำการตรวจสอบโดยสถิติ และความล้มเหลวในการปฏิเสธผลว่างก็จะหมายความว่า การรักษาพยาบาลนั้นไม่มีผลที่มีนัยสำคัญทางสถิติ "ในการทดลองนั้น ๆ" แต่ว่าถ้ามีขนาดตัวอย่างที่เพิ่มขึ้น RCT เช่นเดียวกันอาจจะสามารถแสดงผลของการรักษาพยาบาลที่มีนัยสำคัญทางสถิติ แม้ว่าจะมีผลเพียงเล็กน้อย[44]
การอำพราง
[แก้]RCT อาจจะเป็นการทดลองแบบอำพราง (blind experiment) คือมี "วิธีการที่ป้องกันผู้ร่วมการทดลอง ผู้ให้ความดูแล หรือผู้ประเมินผล ไม่ให้รู้ว่าผู้ป่วยได้รับการรักษาพยาบาลแบบไหน"[43] โดยที่ไม่เหมือนกับการปิดบังการจัดสรร การอำพรางบางครั้งอาจไม่สมควรหรือว่าเป็นไปไม่ได้ที่จะทำใน RCT ยกตัวอย่างเช่น RCT เกี่ยวกับการรักษาพยาบาลที่ต้องอาศัยความร่วมมือเป็นการร่วมกระทำของคนไข้ (เช่น กายภาพบำบัด) ก็จะไม่สามารถอำพรางการรักษาพยาบาลจากคนไข้ได้
ที่สืบ ๆ กันมา RCT แบบอำพรางมักจะจัดประเภทเป็น "อำพรางฝ่ายเดียว" (single-blind) "อำพรางสองฝ่าย" (double-blind) หรือ "อำพรางสามฝ่าย" (triple-blind) แต่ว่า งานศึกษาในปี ค.ศ. 2001 และ 2006 พบว่า ชื่อเหล่านี้มีความหมายต่างกันสำหรับบุคคลต่าง ๆ[45][46] ดังนั้น คำแถลงความ Consolidated Standards of Reporting Trials (CONSORT) ออกเมื่อปี ค.ศ. 2010 จึงกำหนดว่า นักวิจัยและบรรณาธิการไม่ควรใช้คำว่า อำพรางฝ่ายเดียว อำพรางสองฝ่าย หรืออำพรางสามฝ่าย แต่ให้อธิบาย "ถ้ามีการทำ (การอำพราง) ได้ทำต่อใครหลังจากการจัดให้ได้รับการรักษาพยาบาล (เช่น อำพรางผู้ร่วมการทดลอง อำพรางผู้ที่ดูแลรักษา และ/หรืออำพรางผู้ที่ประเมินผล) และทำอย่างไร"[4]
RCT ที่ไม่มีการอำพรางควรเรียกว่า "ไม่อำพราง" (unblinded)[47] หรือว่า "เปิด" (open)[48] หรือถ้าเป็นการให้ยา "open-label"[49] ในปี ค.ศ. 2008 งานวิจัยหนึ่งสรุปว่า ผลการทดลอง RCT ที่ไม่มีการอำพรางมักจะมีความเอนเอียงไปทางผลบวกถ้าผลนั้นวัดโดยวิธีที่เป็นอัตวิสัย (subjective) ไม่ใช่เป็นการวัดที่เป็นปรวิสัย (objective)[43] ยกตัวอย่างเช่น ใน RCT ที่ตรวจสอบการรักษาโรคปลอกประสาทเสื่อมแข็ง (multiple sclerosis) ประสาทแพทย์ที่ไม่ได้รับการอำพรางมีความรู้สึกว่า การรักษาได้ผล แต่ว่า แพทย์ที่มีการอำพรางไม่คิดว่าได้ผล[50] ใน RCT สำหรับปฏิบัติ (pragmatic) แม้ว่าบ่อยครั้งจะไม่ได้อำพรางผู้ร่วมการทดลองและผู้ให้การดูแลรักษา แต่ว่า "ทั้งน่าปรารถนาด้วยและบ่อยครั้งเป็นไปได้ด้วยที่จะอำพรางผู้ประเมิน (ผล) หรือเก็บหาข้อมูลที่เป็นปรวิสัยเพื่อการประเมินผล"[31]
การวิเคราะห์ข้อมูล
[แก้]วิธีการทางสถิติที่ใช้ใน RCT ขึ้นอยู่กับลักษณะข้อมูล รวมทั้ง
- สำหรับข้อมูลที่ให้ผลเป็นทวิวิภาค คือแบ่งเป็นสองอย่าง สามารถใช้ logistic regression และวิธีอื่น ๆ (ยกตัวอย่างเช่น ใน RCT ที่กำหนดการตอบสนองแบบดำรงอยู่ได้ ของยา peginterferon alfa-2a ต่อไวรัสตับอักเสบชนิดซี[51])
- สำหรับข้อมูลที่ให้ผลแบบต่อเนื่อง analysis of covariance สามารถใช้ตรวจสอบผลของตัวแปรทำนาย (predictor variable) (เช่น เพื่อตรวจความเปลี่ยนแปลงของไขมันในเลือดหลังจากได้ยาอะโทวาสแตติน ภายหลังจากการเกิดกลุ่มภาวะกล้ามเนื้อหัวใจขาดเลือดเฉียบพลัน[52])
- สำหรับข้อมูลที่แสดง time-to-event outcome ที่การวัดข้อมูลอาจไม่สมบูรณ์ (เพราะเหตุ Censoring) การวิเคราะห์โดย survival analysis อาจจะสมควร (เช่นการใช้ Kaplan-Meier estimator และ Cox proportional hazards model ในการวิเคราะห์ช่วงเวลาที่จะเกิดโรคหลอดเลือดหัวใจหลังจากได้รับการบำบัดด้วยการทดแทนฮอร์โมน [hormone replacement therapy] หลังจากหมดระดูแล้ว[53])
ไม่ว่าจะใช้วิธีการทางสถิติใด ๆ เรื่องสำคัญที่ควรพิจารณาเกี่ยวกับการวิเคราะห์ข้อมูลของ RCT รวมทั้ง
- ควรจะหยุดการทดลองก่อนจะเสร็จเพราะข้อมูลที่ได้แล้วหรือไม่ ยกตัวอย่างเช่น อาจควรที่จะหยุด RCT ก่อนเสร็จเพราะว่าการรักษา "ได้ผลดีหรือมีผลเสียเกินกว่าที่คาด" หรือว่า "ผู้ทำการทดลองพบหลักฐานว่าไม่มีผลแตกต่างที่สำคัญระหว่างวิธีการรักษาของกลุ่มทดลองกับของกลุ่มควบคุม"[4]
- ระดับที่กลุ่มการทดลองสามารถวิเคราะห์ได้ตามที่สุ่ม คือถ้าสามารถใช้ intention-to-treat analysis (การวิเคราะห์การรักษาตามที่ตั้งใจ) ได้หรือไม่ เพราะว่า การวิเคราะห์การรักษาตามที่ตั้งใจที่สมบูรณ์ "จะเป็นไปได้ก็ต่อเมื่อได้ข้อมูลผลที่สมบูรณ์" จากผู้ร่วมการทดลองทั้งหมดตามที่สุ่มเท่านั้น[54] แต่ถ้าข้อมูลผลบางอย่างยังขาดเหลืออยู่ อาจจะทำการวิเคราะห์กรณีที่มีข้อมูลสมบูรณ์และข้อมูลที่เติมให้เต็มโดยเทคนิคทางสถิติแบบ Imputation ได้[4] อย่างไรก็ดี ยิ่งมีผู้ร่วมการทดลองในกลุ่มที่จัดโดยสุ่มดั้งเดิมมากเท่าไร โอกาสที่จะเกิดความเอนเอียงก็จะน้อยลงเท่านั้น[4]
- ควรจะใช้เทคนิควิเคราะห์แบบ subgroup analysis (การวิเคราะห์เป็นกลุ่มย่อย) หรือไม่ ซึ่งเป็นวิธีที่ "มักจะแนะนำไม่ให้ทำ" เพราะว่า สามารถเกิดปัญหาทางสถิติที่เรียกว่า multiple comparisons problem ที่แสดงผลบวกที่ไม่จริง (false positive) ทำให้ผลที่พบไม่สามารถจะทำซ้ำได้[4]
การรายงานผลของ RCT
[แก้]บทความแถลง "Consolidated Standards of Reporting Trials (มาตรฐานรวมในการรายงานการทดลอง)" (CONSORT) สำหรับปี ค.ศ. 2010 เป็น "รายการคำแนะนำอย่างต่ำที่สุดในการรายงาน RCT โดยเป็นข้อแนะนำอิงหลักฐาน"[55] CONSORT 2010 มีรายการที่ใช้ตรวจสอบ 25 รายการ (และบางรายการจะมีรายการย่อย ๆ) ที่เน้นใช้ในงานที่มี "การจัดกลุ่มแบบสุ่มที่ทำเป็นรายบุคคล แบ่งเป็นสองกลุ่ม ทำแบบ parallel" ซึ่งเป็น RCT แบบที่ใช้สามัญที่สุด[1] และสำหรับแบบการศึกษาของ RCT อื่น มีบทแถลงความที่เรียกว่า "CONSORT extensions" ซึ่งได้รับการเผยแพร่แล้ว[1]
ข้อดี
[แก้]มีการพิจารณาโดยมากว่า RCT เป็นหลักฐานทางวิทยาศาสตร์ที่น่าเชื่อถือที่สุดในลำดับชั้นหลักฐาน (hierarchy of evidence) ที่มีอิทธิพลต่อนโยบายและวิธีการรักษาพยาบาล เพราะว่า RCT สามารถลดการแสดงเหตุผลที่ไม่เป็นจริงและความเอนเอียงต่าง ๆ ผลของ RCT หลายงานอาจจะมีการรวบรวมในงานปริทัศน์เป็นระบบ (systematic review) ที่มีการใช้เพิ่มขึ้นเรื่อย ๆ เพื่อเป็นแนวทางในเวชปฏิบัติอิงหลักฐาน (evidence-based medicine)
ตัวอย่างองค์กรวิทยาศาสตร์ที่พิจารณา RCT หรืองานปริทัศน์เป็นระบบของ RCT ว่าเป็นหลักฐานที่มีคุณภาพสูงสุดรวมทั้ง
- โดยปี ค.ศ. 1998 องค์กรอิสระ คณะกรรมการงานวิจัยสุขภาพและการแพทย์แห่งชาติ (National Health and Medical Research Council) ของประเทศออสเตรเลียกำหนดระดับ "Level I" สำหรับหลักฐานที่ "ได้มาจากงานปริทัศน์เป็นระบบของ RCT ที่เกี่ยวข้องกับประเด็นศึกษาทั้งหมด" และระดับ "Level II" สำหรับหลักฐานที่ "ได้มาจาก RCT ที่มีการออกแบบที่เหมาะสมอย่างน้อยหนึ่งงาน"[56]
- เริ่มตั้งแต่ปี ค.ศ. 2001 ในการทำคำแนะนำเกี่ยวกับแนวทางการปฏิบัติทางคลินิก คณะทำงานเฉพาะกิจเพื่อการบริการป้องกัน (ทางสุขภาพ) ประเทศสหรัฐอเมริกา (United States Preventive Services Task Force) พิจารณาทั้งการออกแบบและทั้งความสมเหตุสมผล (internal validity) ว่าเป็นตัวบ่งชี้คุณภาพของงานศึกษา[57] และยอมรับว่า "หลักฐานที่ได้มาจากการทดลองแบบสุ่มและมีกลุ่มควบคุม" ที่มีความสมเหตุสมผล (เช่นอย่างน้อยในระดับ "I-good") ว่าเป็นหลักฐานที่มีคุณภาพดีที่สุดที่หาได้[57]
- กลุ่ม GRADE Working Group สรุปในปี ค.ศ. 2008 ว่า "การทดลองแบบสุ่มที่ไม่มีข้อจำกัดที่สำคัญ เป็นหลักฐานที่มีคุณภาพสูง"[58]
- ในประเด็นเกี่ยวกับ "การรักษาบำบัด/การป้องกัน และสมุฏฐานของโรค/ผลเสีย" ศูนย์เวชปฏิบัติอิงหลักฐานออกซฟอร์ด (Oxford Centre for Evidence-based Medicine) โดยปี ค.ศ. 2001 กำหนดหลักฐานระดับ "Level 1a" ว่าเป็นงานปริทัศน์เป็นระบบของ RCT ที่มีผลคล้องจองกัน และกำหนดหลักฐานระดับ "Level 1b" ว่าเป็น "RCT งานหนึ่ง ๆ ที่มีช่วงความเชื่อมั่น (Confidence Interval) ที่แคบ"[59]
ตัวอย่างสำคัญของ RCT ที่มีผลไม่คาดฝัน แล้วช่วยเปลี่ยนวิธีปฏิบัติทางคลินิกรวมทั้ง
- หลังจากที่ได้รับการอนุมัติจากองค์การอาหารและยาสหรัฐอเมริกา ยาป้องกันหัวใจเสียจังหวะ (antiarrhythmic agents) รวมทั้ง flecainide และ encainide ก็เกิดวางตลาดขายในปี ค.ศ. 1986 และ 1987 ตามลำดับ[60] งานศึกษาที่ไม่มีการสุ่มเกี่ยวกับยาเหล่านั้นแสดงผลบวกอย่างน่าพึงใจ[61] และยอดขายของยาก็เพิ่มขึ้นรวมกันนับเป็นใบสั่งยาถึง 165,000 ชุดต่อเดือนในต้นปี ค.ศ. 1989[60] แต่ว่า ในปีนั้นเอง มีรายงานเบื้องต้นของ RCT ที่สรุปว่า ยาทั้งสองเพิ่มอัตราการตายของคนไข้[62] และหลังจากนั้น ยอดขายของยาทั้งสองจึงได้ลดลง[60]
- ก่อนปี ค.ศ. 2002 โดยอาศัยงานศึกษาแบบสังเกต (observational studies) แพทย์โดยปกติจะเริ่มการบำบัดด้วยการทดแทนฮอร์โมน (hormone replacement therapy) สำหรับหญิงที่หมดระดูแล้ว เพื่อป้องกันกล้ามเนื้อหัวใจตายเหตุขาดเลือด (myocardial infarction)[61] แต่ว่าในปี ค.ศ. 2002 และ 2004 มีการตีพิมพ์ผลงาน RCT จาก Women's Health Initiative (โครงการริเริ่มสุขภาพหญิง) ที่อ้างว่า หญิงที่รับการบำบัดด้วยการทดแทนฮอร์โมนเอสโทรเจนกับฮอร์โมน progestin มีอัตรากล้ามเนื้อหัวใจตายเหตุขาดเลือดสูงกว่าหญิงที่ได้ยาหลอก และหญิงที่รับการบำบัดด้วยการทดแทนฮอร์โมนเอสโทรเจนเพียงอย่างเดียวมีอุบัติการณ์ของโรคหัวใจที่ไม่ได้ลดลง[53][63] คำอธิบายความแตกต่างระหว่างผลของงานศึกษาแบบสังเกตและ RCT รวมทั้งความแตกต่างระหว่างระเบียบวิธีที่ใช้ การใช้ฮอร์โมน และกลุ่มประชากรที่ศึกษา[64][65] หลังจากการตีพิมพ์ RCT เหล่านี้ การบำบัดด้วยการทดแทนฮอร์โมนจึงได้ลดลง[66]
ข้อเสีย
[แก้]มีบทความมากมายที่แสดงข้อเสียของ RCT[67][68] ข้อเสียที่กล่าวถึงบ่อยที่สุดจะกล่าวในหัวข้อย่อยดังต่อไปนี้
ความเป็นจริงมีความจำกัดนอกการทดลอง
[แก้]ระดับที่ผลของ RCT สามารถใช้ได้จริง ๆ ในสถานการณ์นอกการทดลองมีความต่าง ๆ กัน ซึ่งก็หมายความว่า ระดับ external validity ของ RCT นั้นอาจจะจำกัด[67][69]
องค์ประกอบที่มีอิทธิพลต่อการใช้ผลของ RCT ได้จริง ๆ รวมทั้ง[69]
- ภูมิภาคที่ทำการทดลอง (คือ การรักษาที่มีผลในประเทศหนึ่งอาจจะใช้ไม่ได้ในอีกประเทศหนึ่ง)
- ลักษณะต่าง ๆ ของคนไข้ (เช่น RCT อาจจะทำในคนไข้ที่มีพยากรณ์โรค [prognosis] ดีกว่าโดยเฉลี่ย หรืออาจจะไม่รวม "ผู้หญิง เด็ก คนแก่ และบุคคลที่มีอาการโรคที่สามัญทั่วไป"[70])
- วิธีดำเนินการของงานศึกษา (เช่น คนไข้ใน RCT อาจจะได้รับวิธีแบบถี่ถ้วนในการตรวจวินิจฉัยและการรักษาพยาบาลต่อ ๆ มา ที่ยากที่จะทำได้ในสถานการณ์จริง ๆ)
- การวัดผล (คือ RCT อาจจะใช้การวัดผลแบบประกอบ [composite measures]) ซึ่งปกติไม่ใช้ในการปฏิบัติทางคลินิก
- การรายงานที่ไม่สมบูรณ์เกี่ยวกับผลร้ายที่เกิดขึ้นโดยการรักษาพยาบาล
ค่าใช้จ่ายสูง
[แก้]ค่าใช้จ่ายของ RCT อาจจะสูงมาก[68] งานวิจัยหนึ่งพบว่า งาน RCT ในขั้น Phase III 28 งานที่ได้รับทุนจาก National Institute of Neurological Disorders and Stroke (สถาบันโรคทางประสาทและโรคหลอดเลือดสมองแห่งชาติสหรัฐอเมริกา ซึ่งเป็นส่วนของสถาบันสุขภาพแห่งชาติ (สหรัฐอเมริกา)) ก่อนปี ค.ศ. 2000 มีค่าใช้จ่ายรวมกันถึง 335 ล้านเหรียญสหรัฐ[71] โดยมีค่าใช้จ่ายเฉลี่ยที่ 12 ล้านเหรียญสหรัฐต่องาน อย่างไรก็ดี ผลตอบแทนการลงทุน (ROI) ของ RCT อาจจะสูง คืองานวิจัยเดียวกันนั้นแหละคาดว่า งาน 28 งานนั้นจะให้ผลกำไรสุทธิต่อสังคมถึง 46 เท่าของเงินทุนภายใน 10 ปี โดยประเมินปีอายุที่เพิ่มขึ้น (quality-adjusted life year) เนื่องจากการใช้ผลการทดลอง ว่ามีมูลค่าเท่ากับ GDP เฉลี่ยต่อคน[71]
ใช้ระยะเวลายาว
[แก้]งาน RCT ใช้เวลาเป็นหลายปีก่อนจะมีการเผยแพร่ และดังนั้นแพทย์จะไม่ได้ข้อมูลเป็นเวลาหลายปี และผลงานอาจจะมีความสำคัญน้อยลงเมื่อพร้อมที่จะเผยแพร่[72]
อาจจะไม่ดีกว่างานศึกษาแบบสังเกต
[แก้]มีงานวิจัย 2 งานในปี ค.ศ. 2000 พิมพ์ในวารสารการแพทย์นิวอิงแลนด์ที่พบว่า งานศึกษาแบบสังเกต (observational studies) และ RCT โดยรวม ๆ แล้วแสดงผลคล้ายคลึงกัน[73][74] ผลงานเหล่านี้สั่นคลอนความเชื่อว่า "งานศึกษาแบบสังเกตไม่ควรใช้กำหนดการรักษาพยาบาลอิงหลักฐาน" และว่า ผลของงาน RCT เป็น "หลักฐานเกรดดีที่สุด"[73][74] แต่ว่า งานวิจัยในปี ค.ศ. 2001 ที่พิมพ์ใน Journal of the American Medical Association (JAMA) สรุปว่า "ความไม่สอดคล้องกันแบบไม่บังเอิญก็สามารถเกิดขึ้นได้ (คือผลบวกลบที่ต่างกันจริง ๆ โดยไม่บังเอิญก็ยังมี) และความแตกต่างของระดับผลประเมินเพราะการรักษาพยาบาลนั้นเป็นเรื่องสามัญ (คือแสดงผลบวกเหมือนกันแต่มีขนาดผลไม่เท่ากัน)"[75]
มีแนวคิดอีกสองอย่างที่ตั้งความสงสัยว่า RCT มีส่วนส่งเสริมความรู้ทางวิทยาศาสตร์อย่างไรที่เหนือจากการศึกษาแบบอื่น ๆ คือ
- ถ้ามีการให้คะแนนโดยโอกาสที่จะมีการค้นพบใหม่ ๆ หลักฐานเชิงบอกเล่า (anecdotal evidence) จะได้คะแนนสูงสุด ตามมาด้วยงานศึกษาแบบสังเกต และตามมาด้วย RCT[76]
- RCT อาจจะไม่จำเป็นสำหรับการรักษาพยาบาลที่มีผลชัดเจนและรวดเร็ว เมื่อเทียบกับอาการของโรคที่ค่อนข้างจะเสถียรหรือค่อย ๆ แย่ลง[67][77] ยกตัวอย่างเช่น การใช้เคมีบำบัดแบบผสม (combination chemotherapy) รวมทั้งการใช้ยา cisplatin ในการรักษามะเร็งอัณฑะที่แพร่กระจายออกไปแล้ว ซึ่งเพิ่มอัตราการรักษาจาก 5% ไปเป็น 60% ในงานศึกษาแบบไม่สุ่มในปี ค.ศ. 1977[77][78]
เหตุการณ์ที่มีน้อยศึกษาได้ยาก
[แก้]วิธีการรักษาพยาบาลที่ป้องกันเหตุการณ์ที่เกิดขึ้นน้อยมาก (เช่น กลุ่มอาการทารกตายกะทันหัน) และผลร้ายที่เกิดขึ้นน้อยมาก (เช่น ผลข้างเคียงที่น้อยมากของยา) อาจจะต้องใช้ RCT ที่มีผู้ร่วมการทดลองเป็นจำนวนมาก และดังนั้นการศึกษาแบบสังเกตอาจจะเป็นวิธีการศึกษาที่ทำได้ง่ายกว่า[67]
ผลในอนาคตไกลศึกษาได้ยาก
[แก้]ค่าใช้จ่ายจะสูงมากถ้าต้องทำ RCT เป็นปี ๆ หรือทศวรรษ ๆ เพื่อจะตรวจสอบผลจากการรักษาพยาบาลในอนาคตไกล ๆ[67][68]
ผลที่ได้สนับสนุนอุตสาหกรรม ถ้าได้ทุนมาจากอุตสาหกรรม
[แก้]งาน RCT บางงานได้ทุนทั้งหมดหรือบางส่วนมาจากอุตสาหกรรมรักษาสุขภาพ (เช่น จากบริษัทยา) เทียบกับจากรัฐบาล องค์กรไม่เก็งผลกำไร หรือแหล่งเงินทุนอื่น ๆ งานปริทัศน์เป็นระบบ (systematic review) ที่พิมพ์ในปี ค.ศ. 2003 พบบทความ 4 บทความพิมพ์ระหว่างปี ค.ศ. 1986-2002 ที่เปรียบเทียบ RCT ที่ได้ทุนมาจากอุตสาหกรรมและจากแหล่งอื่น ๆ และพบว่า ข้อมูลจากทั้งสี่บทความพบสหสัมพันธ์ระหว่างการได้ทุนจากอุตสาหกรรม กับผลบวกที่ได้จากการรักษาพยาบาลที่เป็นประเด็นการศึกษา[79] งานศึกษาปี ค.ศ. 2004 ของ RCT ในช่วงระหว่างปี ค.ศ. 1999-2001 ที่พิมพ์ในวารสารแนวหน้าทางการแพทย์และทางศัลยกรรมพบว่า RCT ที่ได้ทุนจากอุตสาหกรรม "มีโอกาสสูงกว่าที่จะมีผลงานที่พบนัยสำคัญทางสถิติที่สนับสนุนอุตสาหกรรม"[80] เหตุที่เป็นไปได้อย่างหนึ่งที่เกิดผลงานที่สนับสนุนอุตสาหกรรมสำหรับ RCT ที่ได้ทุนจากอุตสาหกรรมก็คือความเอนเอียงในการตีพิมพ์ (publication bias)[80]
ผู้ร่วมการทดลองเข้าใจผิดเกี่ยวกับการรักษา
[แก้]แม้ว่าผู้ร่วมการทดลองจะต้องให้ความยินยอมในการเข้าร่วม RCT แต่ว่า งานวิจัยต่าง ๆ ตั้งแต่ปี ค.ศ. 1982 พบว่า ผู้ร่วมการทดลองเป็นจำนวนมากเชื่อว่า ตนจะได้รับการรักษาพยาบาลที่ดีที่สุดสำหรับสภาพโรคของตนอย่างแน่นอน ซึ่งก็คือ ผู้ร่วมการทดลองไม่เข้าใจความแตกต่างกันระหว่างงานวิจัยกับการรักษาพยาบาล[81][82] ดังนั้น ควรที่จะมีการศึกษาเพิ่มขึ้นเพื่อจะกำหนดความแพร่หลายและวิธีการป้องกันความเข้าใจผิดในเรื่องนี้[82]
เป็นการศึกษาที่มีวงแคบ
[แก้]งานทดลองทางคลินิกแบบสุ่มปกติจะตรวจสอบตัวแปรอย่างหนึ่งหรือเพียงไม่กี่อย่าง ที่ยากที่จะสะท้อนความเป็นจริงในสถานการณ์ทางการแพทย์ที่ซับซ้อนที่มีจริง ๆ เมื่อเทียบกับการรายงานเค้ส (case report) ซึ่งสามารถให้รายละเอียดในด้านต่าง ๆ ของคนไข้ เช่น ประวัติคนไข้ การตรวจร่างกาย การวินิจฉัยทางการแพทย์ สภาพจิตใจที่เกี่ยวเนื่องกับสังคม (psychosocial aspects) และการติดตาม[72]
สามารถมีความผิดพลาดทางสถิติ
[แก้]RCT สามารถมีทั้งความผิดพลาดทางสถิติทั้งแบบที่ 1 (ผลบวกที่ไม่จริง) และแบบที่ 2 (ผลว่างหรือลบที่ไม่จริง) เกี่ยวกับความผิดพลาดแบบที่ 1 RCT ทั่ว ๆ ไปจะใช้ค่าความน่าจะเป็นที่ 0.05 (คือ 1 ใน 20) ที่จะแสดงวิธีการรักษาสองอย่างที่จริง ๆ มีสมรรถภาพเท่าเทียมกัน ว่าแตกต่างกันอย่างสำคัญ[83] (คือมีโอกาส 5% ว่าผลบวกที่พบไม่มีจริง ๆ) เกี่ยวกับความผิดพลาดแบบที่ 2 แม้ว่าจะมีบทความที่ตีพิมพ์ตั้งแต่ปี ค.ศ. 1978 ที่ให้ข้อสังเกตว่า RCT จำนวนมากที่แสดงผลลบ มีขนาดตัวอย่าง (sample size) ที่เล็กเกินไปที่จะสรุปได้อย่างชัดเจนว่า วิธีการรักษาพยาบาลนั้นมีผลลบ (หรือผลว่าง) จริง ๆ[84] และโดยปี ค.ศ. 2005-2006 ก็ยังมี RCT จำนวนหนึ่งที่รายงานการคำนวณขนาดตัวอย่างที่ไม่ตรงหรือไม่สมบูรณ์[85]
มีผลทางวัฒนธรรมที่ยังไม่เข้าใจ
[แก้]วิธีการของ RCT สร้างปรากฏการณ์ทางวัฒนธรรมบางอย่างที่ยังไม่มีความเข้าใจดี[86] ยกตัวอย่างเช่น คนไข้บั้นปลายอาจพยายามเข้าร่วมการทดลองเพื่อใช้เป็นวิธีรักษาสุดท้าย แม้ว่าการรักษาพยาบาลนั้นจะมีโอกาสน้อยที่จะประสบความสำเร็จ
มีอันตรายจากการขัดกันแห่งผลประโยชน์
[แก้]โดยมีจุดมุ่งหมายเพื่อเปิดโปงการขัดกันแห่งผลประโยชน์ของ RCT ที่ใช้เป็นข้อมูลของงานวิเคราะห์อภิมาน (meta-analysis) งานวิจัยในปี ค.ศ. 2011 ทำการปริทัศน์งาน meta-analysis 29 งานแล้วพบว่า การขัดกันแห่งผลประโยชน์ที่มีใน RCT ที่ใช้เป็นข้อมูล แทบไม่มีการเปิดเผย งาน meta-analysis ที่ตรวจสอบ 29 งานรวมทั้ง
- งาน 11 งานจากวารสารการแพทย์ทั่วไป
- งาน 15 งานจากวารสารการแพทย์เฉพาะทาง
- งาน 3 งานจาก Cochrane Database of Systematic Reviews (ฐานข้อมูลงานปริทัศน์เป็นระบบขององค์กรความร่วมมือคอเครน)
งาน meta-analysis 29 งานรวมงาน RCT ทั้งหมด 509 งาน ในบรรดางาน RCT เหล่านั้น 318 งานรายงานแหล่งทุน (62% จากทั้งหมด) โดยมี 219 งานที่ได้ทุนมาจากอุตสาหกรรม (69% จากที่รายงาน) จาก RCT 509 งาน มีงาน 132 งานที่รายงานการขัดกันแห่งผลประโยชน์ทางการเงินของผู้ทำงานวิจัย (26% จากทั้งหมด) โดยมี 91 งานที่รายงานการมีผลประโยชน์ร่วมกับอุตสาหกรรม (69% จากที่รายงาน) แต่ว่า รายงานการขัดกันแห่งผลประโยชน์เหล่านี้แทบไม่มีการกล่าวถึงในงาน meta-analysis คือ มีเพียงแค่ 2 งาน (7% จาก 29 งานทั้งหมด) ที่รายงานแหล่งเงินทุนของ RCT และไม่มีงานไหนเลยที่รายงานการมีผลประโยชน์ร่วมกับอุตสาหกรรมของผู้ทำงานวิจัย ผู้ทำงานวิจัยนี้สรุปว่า
เพราะไม่มีการชี้แจงความขัดกันแห่งผลประโยชน์ เนื่องจากได้รับเงินทุนหรือมีผลประโยชน์ทางการเงินร่วมกับอุตสาหกรรมและธุรกิจ สำหรับงานวิจัยแบบสุ่มและมีกลุ่มควบคุมที่รวมอยู่ใน meta-analysis (ดังนั้น) ความเข้าใจและการประเมินหลักฐานที่ได้มาจาก meta-analysis อาจจะมีความบิดเบือน[87]
ในสังคมศาสตร์
[แก้]การใช้ RCT ในงานวิจัยทางสังคมศาสตร์ยังเป็นเรื่องที่มีการถกเถียงกันอย่างไม่รู้จักจบสิ้น คือพวกที่มีพื้นฐานประสบการณ์ทางการแพทย์หรือการรักษาพยาบาลกลุ่มหนึ่งก็กล่าวว่า งานวิจัยในประเด็นต่าง ๆ เกี่ยวกับสังคมศาสตร์ขาดความน่าเชื่อถือ และควรจะพัฒนาโดยเพิ่มการใช้ RCT[ต้องการอ้างอิง] ในบางประเทศ เรื่องนี้เป็นเรื่องที่มีการถกเถียงกันในระดับสูงในเรื่องการศึกษาทางการขนส่ง คือมีนักวิชาการบางท่านที่เสนอว่า งบประมาณของรัฐที่ใช้ในโครงการที่เนื่องกับการส่งเด็กไปโรงเรียนนั้นไม่สมควร ยกเว้นถ้ามีอิทธิผลที่มีการรับรองโดย RCT[88] มีงานวิจัยในปี ค.ศ. 2011[89] ที่ทำการปริทัศน์งานประเมินวิธีการปฏิบัติทางการขนส่ง 77 งาน และแบ่งงานเหล่านั้นออกเป็น 5 ระดับขึ้นอยู่กับคุณภาพ นักวิจัยสรุปว่า งานโดยมากมีคุณภาพต่ำ แล้วสนับสนุนให้ใช้ RCT ในงานวิจัยทางการขนส่งต่อไปในอนาคต
แต่ก็มีนักวิชาการท่านหนึ่งที่ไม่เห็นด้วยกับข้อสรุปเหล่านี้ โดยกล่าวว่า ข้อดีที่อ้างกันของ RCT ในการกำหนดเหตุและผล และในการป้องกันความเอนเอียงเป็นเรื่องที่กล่าวเกินความจริง แล้วเสนอ "หลัก 8 อย่างที่จะใช้ RCT ในสถานการณ์ที่ข้อปฏิบัติที่เสนอต้องอาศัยการเปลี่ยนพฤติกรรมของประชาชนเพื่อที่จะมีอิทธิผล"[90]
คือ ข้อปฏิบัติที่เสนอต้องมีลักษณะเหล่านี้คือ
- ยังไม่ได้ใช้กับสมาชิกทุกคนในกลุ่มประชากร (เช่น ทุกคนในประเทศ หรือพนักงานทุกคนขององค์กร เป็นต้น)
- จะใช้ในสถานการณ์สิ่งแวดล้อมที่คล้ายกับที่มีในกลุ่มควบคุม
- สามารถแยกออกจากข้อประพฤติปฏิบัติอื่น ๆ และจุดมุ่งหมายงานศึกษาก็เพื่อตรวจสอบผลของข้อปฏิบัติ
- ช่วงเวลาจากการเริ่มใช้ข้อปฏิบัติและการแสดงผลต้องเป็นระยะเวลาสั้น ๆ
และกลไกที่เป็นเหตุต้องมีลักษณะเหล่านี้ คือ
- เป็นกลไกที่นักวิจัยเข้าใจดีแล้ว หรือว่า กลไกที่อาจเป็นเหตุอย่างอื่น ๆ ต้องสามารถตรวจสอบได้
- ไม่มีกลไกการป้อนกลับอย่างมีนัยสำคัญระหว่างกลุ่มทดลอง (ที่จะใช้ข้อปฏิบัติที่เป็นประเด็นการศึกษา) และสิ่งแวดล้อมภายนอก
- มีความสัมพันธ์กับองค์ประกอบภายนอกที่มีเสถียรภาพและสามารถพยากรณ์ได้
- จะต้องทำงานเช่นเดียวกันถ้ากลุ่มควบคุมกับกลุ่มทดลองนั้นกลับกัน
การพัฒนาระหว่างประเทศ
[แก้]ปัจจุบันนี้ มีการใช้ RCT ในการตรวจสอบการช่วยเหลือการพัฒนาระหว่างประเทศ (international development) ทั่วโลก นักเศรษฐศาสตร์การพัฒนาที่องค์กรวิจัยต่าง ๆ รวมทั้ง Abdul Latif Jameel Poverty Action Lab[91][92] และ Innovations for Poverty Action[93] ได้ใช้ RCT เพื่อตรวจสอบอิทธิผลของโปรแกรมแก้ปัญหาความยากจน สุขภาพ และการศึกษาในประเทศกำลังพัฒนา
แม้ว่า RCT อาจจะมีประโยชน์ในการประเมินผลของนโยบาย แต่ก็จำเป็นที่จะตีความผลที่ได้ในงานศึกษาทางสังคมศาสตร์อย่างระมัดระวัง ยกตัวอย่างเช่น ข้อปฏิบัติในการแก้ปัญหาอาจจะทำให้เกิดความเปลี่ยนแปลงทางสังคม-เศรษฐกิจ และทางพฤติกรรม ที่สร้างตัวแปรสับสนในความสัมพันธ์ต่าง ๆ ที่พบ[94]
สำหรับนักเศรษฐศาสตร์การพัฒนาบางพวก ประโยชน์ที่ได้จาก RCT เทียบกับวิธีการศึกษาแบบอื่น ๆ ก็คือ การสุ่มจะป้องกันความเอนเอียงโดยการคัดเลือก (selection bias) ซึ่งเป็นปัญหาในงานวิจัยปัจจุบันเกี่ยวกับนโยบายการพัฒนา ในงานศึกษา RCT ตัวอย่างในปี ค.ศ. 2007 ที่น่าสนใจงานหนึ่งในสาขาเศรษฐศาสตร์การพัฒนา มีการสุ่มหมู่บ้าน 608 หมู่บ้านในประเทศอินโดนีเชียที่จะมีการสร้างถนนออกเป็นกลุ่มหลัก 2 กลุ่ม คือ ไม่มีการสอบบัญชีจากรัฐบาลกลาง และมีการสอบบัญชี และในสองกลุ่มนั้น แต่ละกลุ่มจะมีกลุ่มย่อยอีกสามกลุ่มคือ ไม่มีการเชิญให้ (กลุ่มรากหญ้า) เข้าร่วมประชุมที่แสดงบัญชีการใช้จ่าย, มีการเชิญให้เข้าร่วมประชุม, และมีการเชิญให้เข้าร่วมประชุมโดยใบเชิญมีฟอร์มให้กรอกความเห็นแบบนิรนาม[95] หลังจากทำการประเมิน "งบประมาณที่ขาดหายใป" (คือคอร์รัปชั่น) นักวิจัยสรุปว่า การตรวจสอบโดยรัฐบาลมีประสิทธิผลยิ่งกว่า "การเพิ่มการร่วมมือจากกลุ่มรากหญ้าเพื่อการตรวจสอบ" โดยมีจุดมุ่งหมายที่จะลดคอร์รัปชั่น[95] แต่จริง ๆ แล้ว ข้อสรุปเดียวกันนี้ ก็ยังสามารถได้จากการสร้างแบบจำลองที่สมควร แล้วใช้ข้อมูลที่ได้จากการศึกษาระยะยาว (longitudinal studies) อีกด้วย
เรื่องสำคัญที่สุดโดยรวม ๆ ในการศึกษาทางสังคมศาสตร์ก็คือ ต้องสามารถทำการตรวจสอบหาข้อมูลเกี่ยวกับผลที่คาดหวัง และผลที่ไม่คาดหวัง ที่เกิดขึ้นจากนโยบายปฏิบัติที่เป็นประเด็นการศึกษา
อาชญาวิทยา
[แก้]มีการทำงานศึกษาแบบ RCT เพิ่มขึ้นเรื่อย ๆ ในสาขาอาชญาวิทยา คือ งานปริทัศน์ในปี ค.ศ. 2005 พบงาน RCT 83 งานในสาขาที่พิมพ์ในระหว่างปี ค.ศ. 1982-2004 เทียบกับ 35 งานที่พบในระหว่างปี ค.ศ. 1957-1981[96] ซึ่งจัดประเภทเป็น 5 ประเภท คือ policing (การรักษากฎหมายและความสงบเรียบร้อย) prevention (การป้องกัน) corrections (การลงโทษ) court (ศาล) และ community (ชุมชน)[96] โดยเพ่งความสนใจไปที่โปรแกรมเปลี่ยนพฤติกรรมนักโทษ งานวิจัยในปี ค.ศ. 2008 อ้างว่า RCT อาจจะเป็นเรื่องยากที่จะกระทำ (เช่น ถ้าการดำเนินการ RCT จะต้องมี "การตัดสินลงโทษที่สุ่มนักโทษให้อยู่ในโปรแกรม [ทดลอง] ต่าง ๆ")[97]
การศึกษา
[แก้]มีการใช้ RCT เพื่อประเมินข้อปฏิบัติทางการศึกษาหลายอย่าง เช่น มีงานในปี ค.ศ. 2009 ที่สุ่มห้องเรียนประถมศึกษา 260 ห้องเป็นกลุ่มควบคุมและกลุ่มทดลองที่มีการตรวจคัดพฤติกรรม (behavioral screening) มีข้อปฏิบัติเพื่อป้องกันแทรกแซงในห้องเรียน และมีการฝึกผู้ปกครอง แล้ววัดคะแนนทางพฤติกรรมและการศึกษาของนักเรียน[98] มีงานอีกงานหนึ่งที่พิมพ์ในปี ค.ศ. 2009 ที่สุ่มห้องเรียนของเด็ก ป.1 678 คนเป็นกลุ่มทดลองที่มีข้อปฏิบัติแทรกแซงมีห้องเป็นศูนย์ (classroom-centered) กลุ่มทดลองที่มีผู้ปกครองเป็นศูนย์ (parent-centered) และที่ไม่มีข้อปฏิบัติ (no intervention คือกลุ่มควบคุม)[99]
เชิงอรรถและอ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 1.3 Schulz, KF; Altman, DG; Moher, D (2010). "CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials". Br Med J. 340: c332. doi:10.1136/bmj.c332. PMC 2844940. PMID 20332509.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "ศัพท์บัญญัติอังกฤษ-ไทย, ไทย-อังกฤษ ฉบับราชบัณฑิตสถาน (คอมพิวเตอร์) รุ่น ๑.๑", ให้ความหมายของ trial ว่า "การทดลอง, การทดสอบ"
- ↑ Chalmers, TC; Smith, H Jr; Blackburn, B; Silverman, B; Schroeder, B; Reitman, D; Ambroz, A (1981). "A method for assessing the quality of a randomized control trial". Controlled Clinical Trials. 2 (1): 31–49. doi:10.1016/0197-2456(81)90056-8. PMID 7261638.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8 Moher, D; Hopewell, S; Schulz, KF; Montori, V; Gøtzsche, PC; Devereaux, PJ; Elbourne, D; Egger, M; Altman, DG (2010). "CONSORT 2010 explanation and elaboration: updated guidelines for reporting parallel group randomised trials". Br Med J. 340: c869. doi:10.1136/bmj.c869. PMC 2844943. PMID 20332511.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ranjith G (2005). "Interferon-α-induced depression: when a randomized trial is not a randomized controlled trial". Psychother Psychosom. 74 (6): 387. doi:10.1159/000087787. PMID 16244516.
- ↑ Peto, R; Pike, MC; Armitage, P; Breslow, NE; Cox, DR; Howard, SV; Mantel, N; McPherson, K; Peto, J; Smith, PG (1976). "Design and analysis of randomized clinical trials requiring prolonged observation of each patient. I. Introduction and design". Br J Cancer. 34 (6): 585–612. doi:10.1038/bjc.1976.220. PMC 2025229. PMID 795448.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Peto, R; Pike, MC; Armitage, P; Breslow, NE; Cox, DR; Howard, SV; Mantel, N; McPherson, K; Peto, J; Smith, PG (1977). "Design and analysis of randomized clinical trials requiring prolonged observation of each patient. II. Analysis and examples". Br J Cancer. 35 (1): 1–39. doi:10.1038/bjc.1977.1. PMC 2025310. PMID 831755.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Wollert, KC; Meyer, GP; Lotz, J; Ringes-Lichtenberg, S; Lippolt, P; Breidenbach, C; Fichtner, S; Korte, Tl; Hornig, B; Messinger, D; Arseniev, L; Hertenstein, B; Ganser, A; Drexler, H (2004). "Intracoronary autologous bone-marrow cell transfer after myocardial infarction: the BOOST randomised controlled clinical trial". The Lancet. 364 (9429): 141–8. doi:10.1016/S0140-6736(04)16626-9. PMID 15246726.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Peirce, Charles Sanders; Jastrow, Joseph (1885). "On Small Differences in Sensation". Memoirs of the National Academy of Sciences. 3: 73–83.
- ↑ Hacking, Ian (September 1988). "Telepathy: Origins of Randomization in Experimental Design". Isis. A Special Issue on Artifact and Experiment. 79 (3): 427–451. doi:10.1086/354775. JSTOR 234674. MR 1013489. S2CID 52201011.
- ↑ Stephen M. Stigler (November 1992). "A Historical View of Statistical Concepts in Psychology and Educational Research". American Journal of Education. 101 (1): 60–70. doi:10.1086/444032. S2CID 143685203.
- ↑ Trudy Dehue (December 1997). "Deception, Efficiency, and Random Groups: Psychology and the Gradual Origination of the Random Group Design" (PDF). Isis. 88 (4): 653–673. doi:10.1086/383850. PMID 9519574. S2CID 23526321.
- ↑ Neyman, Jerzy (1923). Trans. Dabrowska, Dorota M.; Speed, Terence P. "On the Application of Probability Theory to AgriculturalExperiments. Essay on Principles. Section 9". Statistical Science. 5 (4): 465–472.
- ↑ ตาม Conniffe (1991, p. 87);
Conniffe, Denis (1990–1991). "R. A. Fisher and the development of statistics—a view in his centenary year". Journal of the Statistical and Social Inquiry Society of Ireland. Vol. XXVI no. 3. Dublin: Statistical and Social Inquiry Society of Ireland. p. 87. hdl:2262/2764. ISSN 0081-4776.Ronald A. Fisher was "interested in application and in the popularization of statistical methods and his early book Statistical Methods for Research Workers; published in 1925; went through many editions and motivated and influenced the practical use of statistics in many fields of study. His Design of Experiments (1935) [promoted] statistical technique and application. In that book he emphasized examples and how to design experiments systematically from a statistical point of view. The mathematical justification of the methods described was not stressed and; indeed; proofs were often barely sketched or omitted altogether ...; a fact which led H. B. Mann to fill the gaps with a rigorous mathematical treatment in his well known treatise; Mann (1949)."
Mann, H. B. (1949). Analysis and design of experiments: Analysis of variance and analysis of variance designs. New York, N. Y.: Dover Publications, Inc. pp. x+195. MR 0032177.
- ↑ Streptomycin in Tuberculosis Trials Committee (1948). "Streptomycin treatment of pulmonary tuberculosis. A Medical Research Council investigation". Br Med J. 2 (4582): 769–82. doi:10.1136/bmj.2.4582.769. PMC 2091872. PMID 18890300.
- ↑ Brown, D (1998-11-02). "Landmark study made research resistant to bias". Washington Post.
- ↑ Shikata, S; Nakayama, T; Noguchi, Y; Taji, Y; Yamagishi, H (2006). "Comparison of effects in randomized controlled trials with observational studies in digestive surgery". Ann Surg. 244 (5): 668–76. doi:10.1097/01.sla.0000225356.04304.bc. PMC 1856609. PMID 17060757.
- ↑ 18.0 18.1 Stolberg, HO; Norman, G; Trop, I (2004). "Randomized controlled trials". Am J Roentgenol. 183 (6): 1539–44. doi:10.2214/ajr.183.6.01831539. PMID 15547188.
- ↑ Meldrum ML (2000). "A brief history of the randomized controlled trial. From oranges and lemons to the gold standard". Hematol Oncol Clin North Am. 14 (4): 745–60, vii. doi:10.1016/S0889-8588(05)70309-9. PMID 10949771.
- ↑ Freedman B (1987). "Equipoise and the ethics of clinical research". N Engl J Med. 317 (3): 141–5. doi:10.1056/NEJM198707163170304. PMID 3600702.
- ↑ Gifford F (1995). "Community-equipoise and the ethics of randomized clinical trials". Bioethics. 9 (2): 127–48. doi:10.1111/j.1467-8519.1995.tb00306.x. PMID 11653056.
- ↑ Edwards SJL; Lilford RJ; Hewison J (1998). "The ethics of randomised controlled trials from the perspectives of patients; the public; and healthcare professionals". Br Med J. 317 (7167): 1209–12. doi:10.1136/bmj.317.7167.1209. PMC 1114158. PMID 9794861.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Zelen, M (1979). "A new design for randomized clinical trials". N Engl J Med. 300 (22): 1242–5. doi:10.1056/NEJM197905313002203. PMID 431682. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2003-02-27. สืบค้นเมื่อ 2015-04-07.
- ↑ Torgerson, DJ; Roland, M (1998). "What is Zelen's design?". Br Med J. 316 (7131): 606. doi:10.1136/bmj.316.7131.606. PMC 1112637. PMID 9518917.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) Full Article@researchgate.net PDF (1.3 MB) - ↑ De Angelis C; Drazen JM; Frizelle FA; และคณะ (September 2004). "Clinical trial registration: a statement from the International Committee of Medical Journal Editors". The New England Journal of Medicine. 351 (12): 1250–1. doi:10.1056/NEJMe048225. PMID 15356289.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Law; MR; Kawasumi; Y; Morgan; SG (2011). "Despite law; fewer than one in eight completed studies of drugs and biologics are reported on time on ClinicalTrials.gov". Health Aff (Millwood). 30 (12): 2338–45. doi:10.1377/hlthaff.2011.0172. PMID 22147862.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Mathieu, S; Boutron, I; Moher, D; Altman, DG; Ravaud, P (2009). "Comparison of registered and published primary outcomes in randomized controlled trials". JAMA. 302 (9): 977–84. doi:10.1001/jama.2009.1242. PMID 19724045.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 28.0 28.1 Hopewell, S; Dutton, S; Yu, LM; Chan, AW; Altman, DG (2010). "The quality of reports of randomised trials in 2000 and 2006: comparative study of articles indexed in PubMed". BMJ. 340: c723. doi:10.1136/bmj.c723. PMC 2844941. PMID 20332510.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Jones, Byron; Kenward; Michael G. (2003). Design and Analysis of Cross-Over Trials (2 ed.). London: Chapman and Hall.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Vonesh, Edward F.; Chinchilli, Vernon G. (1997). "Crossover Experiments". Linear and Nonlinear Models for the Analysis of Repeated Measurements. London: Chapman and Hall. pp. 111–202.
- ↑ 31.0 31.1 31.2 31.3 Zwarenstein, M; Treweek, S; Gagnier, JJ; Altman, DG; Tunis, S; Haynes, B; Oxman, AD; Moher, D; CONSORT group; Pragmatic Trials in Healthcare (Practihc) group (2008). "Improving the reporting of pragmatic trials: an extension of the CONSORT statement". BMJ. 337: a2390. doi:10.1136/bmj.a2390. PMC 3266844. PMID 19001484.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 32.0 32.1 32.2 32.3 Piaggio, G; Elbourne, DR; Altman, Doug; Pocock, Stuart; Evans, SJ; CONSORT Group (2006). "Reporting of noninferiority and equivalence randomized trials: an extension of the CONSORT statement". JAMA. 295 (10): 1152–60. doi:10.1001/jama.295.10.1152. PMID 16522836.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 33.00 33.01 33.02 33.03 33.04 33.05 33.06 33.07 33.08 33.09 33.10 33.11 33.12 Schulz, KF; Grimes, DA (2002). "Generation of allocation sequences in randomised trials: chance; not choice" (PDF). Lancet. 359 (9305): 515–9. doi:10.1016/S0140-6736(02)07683-3. PMID 11853818.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 34.0 34.1 Lachin, JM (1988). "Statistical properties of randomization in clinical trials". Controlled Clinical Trials. 9 (4): 289–311. doi:10.1016/0197-2456(88)90045-1. PMID 3060315.
- ↑ Rosenberger, James. "STAT 503 - Design of Experiments". Pennsylvania State University. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-07-20. สืบค้นเมื่อ 2012-09-24.
- ↑ Avins, AL (1998). ""Can unequal be more fair? Ethics; subject allocation; and randomized clinical trials"". J Med Ethics. 24 (6): 401–408. doi:10.1136/jme.24.6.401.
- ↑ Buyse, ME (1989). "Analysis of clinical trial outcomes: some comments on subgroup analyses". Controlled Clinical Trials. 10 (4 Suppl): 187S–194S. doi:10.1016/0197-2456(89)90057-3. PMID 2605967.
- ↑ 38.0 38.1 38.2 38.3 38.4 38.5 Lachin, JM; Matts, JP; Wei, LJ (1988). "Randomization in clinical trials: conclusions and recommendations". Controlled Clinical Trials. 9 (4): 365–74. doi:10.1016/0197-2456(88)90049-9. PMID 3203526.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rosenberger WF; Lachin JM (1993). "The use of response-adaptive designs in clinical trials". Controlled Clinical Trials. 14 (6): 471–84. doi:10.1016/0197-2456(93)90028-C. PMID 8119063.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 40.0 40.1 Forder, PM; Gebski, VJ; Keech, AC (2005). "Allocation concealment and blinding: when ignorance is bliss". Med J Aust. 182 (2): 87–9. PMID 15651970. เก็บจากแหล่งเดิมเมื่อ 2006-08-28. สืบค้นเมื่อ 2015-04-07.
the procedure for protecting the randomization process so that the treatment to be allocated is not known before the patient is entered into the study
- ↑ Schulz KF, Grimes DA (2002). "Allocation concealment in randomised trials: defending against deciphering" (PDF). Lancet. 359 (9306): 614–8. doi:10.1016/S0140-6736(02)07750-4. PMID 11867132. S2CID 12902486. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ September 11, 2012.
- ↑ Pildal J, Chan AW, Hróbjartsson A, Forfang E, Altman DG, Gøtzsche PC (2005). "Comparison of descriptions of allocation concealment in trial protocols and the published reports: cohort study". BMJ. 330 (7499): 1049. doi:10.1136/bmj.38414.422650.8F. PMC 557221. PMID 15817527.
- ↑ 43.0 43.1 43.2 Wood L, Egger M, Gluud LL, Schulz KF, Jüni P, Altman DG, Gluud C, Martin RM, Wood AJ, Sterne JA (2008). "Empirical evidence of bias in treatment effect estimates in controlled trials with different interventions and outcomes: meta-epidemiological study". BMJ. 336 (7644): 601–5. doi:10.1136/bmj.39465.451748.AD. PMC 2267990. PMID 18316340.
- ↑ Glennerster, Rachel; Takavarasha, Kudzai (2013). Running randomized evaluations: a practical guide. Princeton: Princeton University Press. ISBN 9780691159249.
- ↑ Devereaux, PJ; Manns, BJ; Ghali, WAl; Quan, H; Lacchetti, C; Montori, VM; Bhandari, M; Guyatt, GH (2001). "Physician interpretations and textbook definitions of blinding terminology in randomized controlled trials". J Am Med Assoc. 285 (15): 2000–3. doi:10.1001/jama.285.15.2000. PMID 11308438.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Haahr, MT; Hróbjartsson, A (2006). "Who is blinded in randomized clinical trials? A study of 200 trials and a survey of authors". Clin Trials. 3 (4): 360–5. doi:10.1177/1740774506069153. PMID 17060210. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-05-31. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Marson, AG; Al-Kharusi, AM; Alwaidh, M; Appleton, R; Baker, GA; Chadwick, DW; และคณะ (2007). "The SANAD study of effectiveness of valproate; lamotrigine; or topiramate for generalised and unclassifiable epilepsy: an unblinded randomised controlled trial". The Lancet. 369 (9566): 1016–26. doi:10.1016/S0140-6736(07)60461-9. PMC 2039891. PMID 17382828.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Chan, R; Hemeryck, L; O'Regan, M; Clancy, L; Feely, J (1995). "Oral versus intravenous antibiotics for community acquired lower respiratory tract infection in a general hospital: open; randomised controlled trial". BMJ. 310 (6991): 1360–2. doi:10.1136/bmj.310.6991.1360. PMC 2549744. PMID 7787537.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Fukase, K; Kato, M; Kikuchi, S; Inoue, K; Uemura, N; Okamoto, S; Terao, S; Amagai, K; Hayashi. S, Asaka, M; Japan Gast Study Group (2008). "Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label; randomised controlled trial". Lancet. 372 (9636): 392–7. doi:10.1016/S0140-6736(08)61159-9. PMID 18675689.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Noseworthy, JH; Ebers, GC; Vandervoort, MK; Farquhar, RE; Yetisir, E; Roberts, R (1994). "The impact of blinding on the results of a randomized; placebo-controlled multiple sclerosis clinical trial". Neurology. 44 (1): 16–20. doi:10.1212/wnl.44.1.16. PMID 8290055. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2005-05-10. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Manns, MP; McHutchison, JG; Gordon, SC; Rustgi, VK; Shiffman, M; Reindollar, R; Goodman, ZD; Koury, K; Ling, M; Albrecht, JK (2001). "Peginterferon alfa-2b plus ribavirin compared with interferon alfa-2b plus ribavirin for initial treatment of chronic hepatitis C: a randomised trial". The Lancet. 358 (9286): 958–65. doi:10.1016/S0140-6736(01)06102-5. PMID 11583749.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Schwartz, GG; Olsson, AG; Ezekowitz, MD; Ganz, P; Oliver, MF; Waters, D; Zeiher, A; Chaitman, BR; Leslie, S; Stern, T; Myocardial Ischemia Reduction with Aggressive Cholesterol Lowering (MIRACL) Study Investigators (2001). "Effects of atorvastatin on early recurrent ischemic events in acute coronary syndromes: the MIRACL study: a randomized controlled trial". J Am Med Assoc. 285 (13): 1711–8. doi:10.1001/jama.285.13.1711. PMID 11277825.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 53.0 53.1 Rossouw, JE; Anderson, GL; Prentice, RL; LaCroix, AZ; Kooperberg, C; Stefanick, ML; Jackson, RD; Beresford, SA; Howard, BV; Johnson, KC; Kotchen, JM; Ockene, J; Writing Group for the Women's Health Initiative Investigators (2002). "Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative randomized controlled trial". J Am Med Assoc. 288 (3): 321–33. doi:10.1001/jama.288.3.321. PMID 12117397.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Hollis, S; Campbell, F (1999). "What is meant by intention to treat analysis? Survey of published randomised controlled trials". Br Med J. 319 (7211): 670–4. doi:10.1136/bmj.319.7211.670. PMC 28218. PMID 10480822.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ CONSORT Group. "Welcome to the CONSORT statement Website". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2019-05-09. สืบค้นเมื่อ 2010-03-29.
- ↑ National Health and Medical Research Council (1998-11-16). A guide to the development; implementation and evaluation of clinical practice guidelines (PDF). Canberra: Commonwealth of Australia. p. 56. ISBN 1-86496-048-5. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2017-10-14. สืบค้นเมื่อ 2010-03-28.
- ↑ 57.0 57.1 Harris, RP; Helfand, M; Woolf, SH; Lohr, KN; Mulrow, CD; Teutsch, SM; Atkins, D; Methods Work Group; Third US Preventive Services Task Force (2001). "Current methods of the US Preventive Services Task Force: a review of the process" (PDF). Am J Prev Med. 20 (3 Suppl): 21–35. doi:10.1016/S0749-3797(01)00261-6. PMID 11306229. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2016-12-21. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Guyatt, GH; Oxman, AD; Kunz, R; Vist, GE; Falck-Ytter, Y; Schünemann, HJ; GRADE Working Group (2008). "What is "quality of evidence" and why is it important to clinicians?". BMJ. 336 (7651): 995–8. doi:10.1136/bmj.39490.551019.BE. PMC 2364804. PMID 18456631.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Oxford Centre for Evidence-based Medicine (2011-09-16). "Levels of evidence". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-06-12. สืบค้นเมื่อ 2012-02-15.
- ↑ 60.0 60.1 60.2 Anderson, JL; Pratt, CM; Waldo, AL; Karagounis, LA (1997). "Impact of the Food and Drug Administration approval of flecainide and encainide on coronary artery disease mortality: putting "Deadly Medicine" to the test". Am J Cardiol. 79 (1): 43–7. doi:10.1016/S0002-9149(96)00673-X. PMID 9024734.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 61.0 61.1 Rubin, R (2006-10-16). "In medicine; evidence can be confusing - deluged with studies; doctors try to sort out what works; what doesn't". USA Today. สืบค้นเมื่อ 2010-03-22.
- ↑ The Cardiac Arrhythmia Suppression Trial (CAST) Investigators (1989). "Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction". N Engl J Med. 321 (6): 406–12. doi:10.1056/NEJM198908103210629. PMID 2473403. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-07-04. สืบค้นเมื่อ 2015-04-07.
- ↑ Anderson, GL; Limacher, M; Assaf, AR; Bassford, T; Beresford, SA; Black, H; และคณะ (2004). "Effects of conjugated equine estrogen in postmenopausal women with hysterectomy: the Women's Health Initiative randomized controlled trial". JAMA. 291 (14): 1701–12. doi:10.1001/jama.291.14.1701. PMID 15082697.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Grodstein, F; Clarkson, TB; Manson, JE (2003). "Understanding the divergent data on postmenopausal hormone therapy". N Engl J Med. 348 (7): 645–50. doi:10.1056/NEJMsb022365. PMID 12584376. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-02-27. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Vandenbroucke JP (2009). "The HRT controversy: observational studies and RCTs fall in line". Lancet. 373 (9671): 1233–5. doi:10.1016/S0140-6736(09)60708-X. PMID 19362661. S2CID 44991220.
- ↑ Hsu, A; Card, A; Lin, SX; Mota, S; Carrasquillo, O; Moran, A (2009). "Changes in postmenopausal hormone replacement therapy use among women with high cardiovascular risk". Am J Public Health. 99 (12): 2184–7. doi:10.2105/AJPH.2009.159889. PMC 2775780. PMID 19833984.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 67.0 67.1 67.2 67.3 67.4 Black, N (1996). "Why we need observational studies to evaluate th effectiveness of health care". BMJ. 312 (7040): 1215–8. doi:10.1136/bmj.312.7040.1215. PMC 2350940. PMID 8634569.
- ↑ 68.0 68.1 68.2 Sanson-Fisher, RW; Bonevski, B; Green, LW; D'Este, C (2007). "Limitations of the randomized controlled trial in evaluating population-based health interventions". Am J Prev Med. 33 (2): 155–61. doi:10.1016/j.amepre.2007.04.007. PMID 17673104.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 69.0 69.1 Rothwell, PM (2005). "External validity of randomised controlled trials: "to whom do the results of this trial apply?"" (PDF). Lancet. 365 (9453): 82–93. doi:10.1016/S0140-6736(04)17670-8. PMID 15639683.
- ↑ Van Spall, HG; Toren, A; Kiss, A; Fowler, RA (2007). "Eligibility criteria of randomized controlled trials published in high-impact general medical journals: a systematic sampling review". JAMA. 297 (11): 1233–40. doi:10.1001/jama.297.11.1233. PMID 17374817.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 71.0 71.1 Johnston, SC; Rootenberg, JD; Katrak, S; Smith, WS; Elkins, JS (2006). "Effect of a US National Institutes of Health programme of clinical trials on public health and costs" (PDF). Lancet. 367 (9519): 1319–27. doi:10.1016/S0140-6736(06)68578-4. PMID 16631910. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2011-07-25. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 72.0 72.1 Yitschaky O, Yitschaky M, Zadik Y (May 2011). "Case report on trial: Do you, Doctor, swear to tell the truth, the whole truth and nothing but the truth?" (PDF). J Med Case Rep. 5 (1): 179. doi:10.1186/1752-1947-5-179. PMC 3113995. PMID 21569508.
- ↑ 73.0 73.1 Benson, K; Hartz, AJ (2000). "A comparison of observational studies and randomized; controlled trials". วารสารการแพทย์นิวอิงแลนด์. 342 (25): 1878–86. doi:10.1056/NEJM200006223422506. PMID 10861324. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-02-22. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 74.0 74.1 Concato, J; Shah, N; Horwitz, RI (2000). "Randomized; controlled trials; observational studies; and the hierarchy of research designs". วารสารการแพทย์นิวอิงแลนด์. 342 (25): 1887–92. doi:10.1056/NEJM200006223422507. PMC 1557642. PMID 10861325. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-05-21. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ioannidis, JP; Haidich, AB; Pappa, M; Pantazis, N; Kokori, SI; Tektonidou, MG; Contopoulos-Ioannidis, DG; Lau, J (2001). "Comparison of evidence of treatment effects in randomized and nonrandomized studies". J Am Med Assoc. 286 (7): 821–30. doi:10.1001/jama.286.7.821. PMID 11497536.
discrepancies beyond chance do occur and differences in estimated magnitude of treatment effect are very common
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Vandenbroucke, JP (2008). "Observational research; randomised trials; and two views of medical science". PLoS Med. 5 (3): e67. doi:10.1371/journal.pmed.0050067. PMC 2265762. PMID 18336067.
- ↑ 77.0 77.1 Glasziou, P; Chalmers, I; Rawlins, M; McCulloch, P (2007). "When are randomised trials unnecessary? Picking signal from noise". Br Med J. 334 (7589): 349–51. doi:10.1136/bmj.39070.527986.68. PMC 1800999. PMID 17303884.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Einhorn, LH (2002). "Curing metastatic testicular cancer". Proc Natl Acad Sci USA. 99 (7): 4592–5. doi:10.1073/pnas.072067999. PMC 123692. PMID 11904381.
- ↑ Bekelman, JE; Li, Y; Gross, CP (2003). "Scope and impact of financial conflicts of interest in biomedical research: a systematic review". J Am Med Assoc. 289 (4): 454–65. doi:10.1001/jama.289.4.454. PMID 12533125.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 80.0 80.1 Bhandari, M; Busse, JW; Jackowski, D; Montori, VM; Schünemann, H; Sprague, S; Mears, D; Schemitsch, EH; Heels-Ansdell, D; Devereaux, PJ (2004). "Association between industry funding and statistically significant pro-industry findings in medical and surgical randomized trials". Can Med Assoc J. 170 (4): 477–80. PMC 332713. PMID 14970094. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-08-30. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Appelbaum, PS; Roth, LH; Lidz, C (1982). "The therapeutic misconception: informed consent in psychiatric research". Int J Law Psychiatry. 5 (3–4): 319–29. doi:10.1016/0160-2527(82)90026-7. PMID 6135666.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 82.0 82.1 Henderson, GE; Churchill, LR; Davis, AM; Easter, MM; Grady, C; Joffe, S; Kass, N; King, NM; Lidz, CW; Miller, FG; Nelson, DK; Peppercorn, J; Rothschild, BB; Sankar, P; Wilfond, BS; Zimmer, CR (2007). "Clinical trials and medical care: defining the therapeutic misconception". PLoS Med. 4 (11): e324. doi:10.1371/journal.pmed.0040324. PMC 2082641. PMID 18044980.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Wittes, J (2002). "Sample size calculations for randomized controlled trials". Epidemiol Rev. 24 (1): 39–53. doi:10.1093/epirev/24.1.39. PMID 12119854.
- ↑ Freiman, JA; Chalmers, TC; Smith, H Jr; Kuebler, RR (1978). "The importance of beta; the type II error and sample size in the design and interpretation of the randomized control trial. Survey of 71 "negative" trials". วารสารการแพทย์นิวอิงแลนด์. 299 (13): 690–4. doi:10.1056/NEJM197809282991304. PMID 355881. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2003-02-28. สืบค้นเมื่อ 2015-04-07.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Charles, P; Giraudeau, B; Dechartres, A; Baron, G; Ravaud, P (2009-05-12). "Reporting of sample size calculation in randomised controlled trials: review". Br Med J. 338: b1732. doi:10.1136/bmj.b1732. PMC 2680945. PMID 19435763.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Jain, SL (2010). "The mortality effect: counting the dead in the cancer trial". Public Culture. 21 (1): 89–117. doi:10.1215/08992363-2009-017.
- ↑ "How Well Do Meta-Analyses Disclose Conflicts of Interests in Underlying Research Studies | The Cochrane Collaboration". Cochrane.org. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-12-16. สืบค้นเมื่อ 2012-01-13.
- ↑ Rowland, D.; DiGuiseppi, C.; Gross, M.; Afolabi, E; Roberts, I. (2003). "Randomised controlled trial of site specific advice on school travel patterns". Archives of Disease in Childhood. 88 (1): 8–11. doi:10.1136/adc.88.1.8.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Graham-Rowe, E.; Skippon, S.; Gardner, B. ; Abraham, C. (2011). "Can we reduce car use and; if so; how? A review of available evidence". Transportation Research Part A: Policy and Practice. 44 (5): 401–418.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Melia, S (2015). "Do Randomised Control Trials Offer a Solution to 'low quality' Transport Research?" (PDF). University of the West of England.[ลิงก์เสีย]
- ↑ "Methodology Overview". Abdul Latif Jameel Poverty Action Lab. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-05-21. สืบค้นเมื่อ 2014-04-07.
- ↑ Banerjee, AV; Cole, S; Duflo, E; Linden, L (2007). "Remedying education: evidence from two randomized experiments in India". Quarterly Journal of Economics. 122 (3): 1235–1264. doi:10.1162/qjec.122.3.1235.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Karlan, D; Zinman, J (2010). "Expanding credit access: using randomized supply decisions to estimate the impacts". Review of Financial Studies. 23 (1): 433–464. doi:10.1093/rfs/hhp092.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bhargava, Alok (2008). "Randomized controlled experiments in health and social sciences: Some conceptual issues". Economics and Human Biology. 6: 293–298.
- ↑ 95.0 95.1 Olken, BA (2007). "Monitoring corruption: evidence from a field experiment in Indonesia". Journal of Political Economy. 115 (2): 200–249. doi:10.1086/517935. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-06-13. สืบค้นเมื่อ 2015-04-22.
- ↑ 96.0 96.1 Farrington, DP; Welsh, BC (2005). "Randomized experiments in criminology: What have we learned in the last two decades?". Journal of Experimental Criminology. 1 (1): 9–38. doi:10.1007/s11292-004-6460-0.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Hollin, CR (2008). "Evaluating offending behaviour programmes: does only randomization glister?". Criminology and Criminal Justice. 8 (1): 89–106. doi:10.1177/1748895807085871.
- ↑ Walker, HM; Seeley, JR; Small, J; Severson, HH; Graham, BA; Feil, EG; Serna, L; Golly, AM; Forness, SR (2009). "A randomized controlled trial of the First Step to Success early intervention. Demonstration of program efficacy outcomes in a diverse; urban school district". Journal of Emotional and Behavioral Disorders. 17 (4): 197–212. doi:10.1177/1063426609341645.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bradshaw, CP; Zmuda, JH; Kellam, SG; Ialongo, NS (2009). "Longitudinal impact of two universal preventive interventions in first grade on educational outcomes in high school". Journal of Educational Psychology. 101 (4): 926–937. doi:10.1037/a0016586.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
แหล่งข้อมูลอื่น
[แก้]- Domanski MJ; McKinlay S. Successful randomized trials: a handbook for the 21st century. Philadelphia: Lippincott Williams & Wilkins; 2009. ISBN 978-0-7817-7945-6.
- Jadad AR; Enkin M. Randomized controlled trials: questions; answers; and musings. 2nd ed. Malden; Mass.: Blackwell; 2007. ISBN 978-1-4051-3266-4.
- Matthews JNS. Introduction to randomized controlled clinical trials. 2nd ed. Boca Raton; Fla.: CRC Press; 2006. ISBN 1-58488-624-2.
- Nezu AM; Nezu CM. Evidence-based outcome research: a practical guide to conducting randomized controlled trials for psychosocial interventions. Oxford: Oxford University Press; 2008. ISBN 978-0-19-530463-3.
- Solomon PL; Cavanaugh MM; Draine J. Randomized controlled trials: design and implementation for community-based psychosocial interventions. New York: Oxford University Press; 2009. ISBN 978-0-19-533319-0.
- Torgerson DJ; Torgerson C. Designing randomised trials in health; education and the social sciences: an introduction. Basingstoke; England; and New York: Palgrave Macmillan; 2008. ISBN 978-0-230-53735-4.
- เว็บไซต์
- Bland M. Directory of randomisation software and services. University of York; 2008 March 19.
- Evans I; Thornton H; Chalmers I. Testing treatments: better research for better health care. เก็บถาวร 2010-12-25 ที่ เวย์แบ็กแมชชีน London: Pinter & Martin; 2010. ISBN 978-1-905177-35-6.
- Gelband H. The impact of randomized clinical trials on health policy and medical practice: background paper. เก็บถาวร 2016-03-03 ที่ เวย์แบ็กแมชชีน Washington; DC: U.S. Congress; Office of Technology Assessment; 1983. (Report OTA-BP-H-22.)
- REFLECT (Reporting guidElines For randomized controLled trials for livEstoCk and food safeTy) Statement
- Wathen JK; Cook JD. Power and bias in adaptively randomized clinical trials. M. D. Anderson Cancer Center; University of Texas; 2006 July 12.
- RCTrials.org - An online community forum dedicated to Randomized Controlled Trials. เก็บถาวร 2014-12-18 ที่ เวย์แบ็กแมชชีน
- ResearchTool.org - Specialised RCT consulting and platform. [ลิงก์เสีย]
