พิวรีน

| |

| |

| |
| ชื่อ | |
|---|---|
| IUPAC name
9H-purine
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.004.020 |
| KEGG | |
| MeSH | Purine |
ผับเคม CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| C5H4N4 | |
| มวลโมเลกุล | 120.115 g·mol−1 |
| จุดหลอมเหลว | 214 องศาเซลเซียส (417 องศาฟาเรนไฮต์; 487 เคลวิน) |
| 500 g/L (RT) | |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
พิวรีน (อังกฤษ: purine) เป็นสารประกอบอินทรีย์ประเภทเฮเตอโรไซคลิกและอะโรมาติก ที่มีวงแหวนไพริมิดีน (pyrimidine) เชื่อมกับวงแหวนอิมิดาโซล และให้ชื่อของมันกับกลุ่มโมเลกุลที่เรียกว่า พิวรีน ซึ่งรวมพิวรีนที่มีการแทนที่โครงสร้างและเทาโทเมอร์[A] ต่าง ๆ ของพิวรีน[4] เป็นสารประกอบเฮเตอโรไซคลิกแบบมีไนโตรเจนที่มีมากที่สุดในธรรมชาติ และละลายน้ำได้
พิวรีนพบอย่างเข้มข้นในเนื้อสัตว์และผลิตภัณฑ์เนื้อ โดยเฉพาะเครื่องในรวมทั้งตับไต โดยทั่วไปแล้ว พืชผักจะมีพิวรีนต่ำ[5] ตัวอย่างของอาหารที่มีพิวรีนสูงรวมทั้ง ต่อมไทมัส ตับอ่อน ปลาแอนโชวี่ ปลาซาร์ดีน ตับ ไตของวัวควาย สมอง สารสกัดจากเนื้อ ปลาเฮร์ริง ปลาแมกเคอเรล หอยเชลล์ เนื้อสัตว์ที่ล่าเพื่ออาหารหรือเพื่อการกีฬา เบียร์ (โดยได้จากยีสต์) และน้ำเกรวี อาหารที่มีพิวรีนกลาง ๆ รวมทั้ง เนื้อวัวควาย เนื้อหมู ปลาและอาหารทะเล ผักแอสพารากัส ต้นกะหล่ำดอก ผักโขมจีน เห็ด ถั่วลันเตา ถั่วเล็นทิล ถั่ว ข้าวโอ๊ต รำข้าวสาลี และจมูกข้าวสาลี[6]
พิวรีนและไพริมิดีนเป็นกลุ่มสองกลุ่มของเบสไนโตรเจน (nitrogenous base) และก็เป็นกลุ่มสองกลุ่มของเบสนิวคลีโอไทด์ (nucleotide base/nucleobase) ด้วย deoxyribonucleotide 2 อย่างใน 4 อย่าง คือ deoxyadenosine และ guanosine, ribonucleotide 2 อย่างใน 4 อย่าง คือ adenosine/adenosine monophosphate (AMP) และ guanosine/guanosine monophosphate (GMP) ซึ่งเป็นหน่วยพื้นฐานของดีเอ็นเอและอาร์เอ็นเอตามลำดับ ก็เป็นพิวรีน
เพื่อจะสร้างดีเอ็นเอและอาร์เอ็นเอ เซลล์จำเป็นต้องใช้พิวรีนและไพรมิดีนเป็นจำนวนพอ ๆ กัน ทั้งพิวรีนและไพริมิดีนต่างก็เป็นสารยับยั้งและสารก่อฤทธิ์ต่อพวกตนเอง คือ เมื่อพิวรีนก่อตัวขึ้น มันจะยับยั้งเอนไซม์ที่ใช้สร้างพิวรีนเพิ่ม พร้อมกับก่อฤทธิ์ของเอนไซม์ที่ใช้สร้างไพริมิดีน และไพริมิดีนก็ทั้งยับยั้งตนเองและออกฤทธิ์ให้สร้างพิวรีนในลักษณะเช่นเดียวกัน เพราะเหตุนี้ จึงมีสารทั้งสองอยู่ในเซลล์เกือบเท่า ๆ กันตลอดเวลา[7]
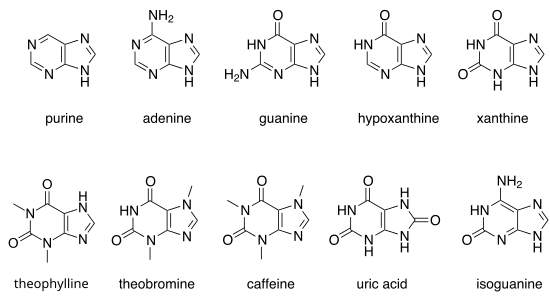
พิวรีนเด่น ๆ
[แก้]มีพิวรีนที่เกิดตามธรรมชาติหลายอย่าง รวมทั้งนิวคลีโอเบส คือ adenine และ guanine ในดีเอ็นเอ เบสเหล่านี้สร้างพันธะไฮโดรเจนกับเบสไพริมิดีนที่คู่กัน ซึ่งก็คือ ไทมีน และ cytosine ตามลำดับ นี่เป็นการจับคู่ของเบสแบบเติมเต็ม (complementary base pairing) ในอาร์เอ็นเอ คู่ของ adenine ก็คือ uracil แทนที่ไทมีน
พิวรีนเด่นอื่น ๆ รวมทั้ง hypoxanthine, xanthine, ธีโอโบรมีน, กาเฟอีน, กรดยูริก และ isoguanine
หน้าที่
[แก้]
พิวรีน (adenine และ guanine) นอกจากจะมีบทบาทสำคัญในดีเอ็นเอและอาร์เอ็นเอแล้ว ยังเป็นองค์ประกอบสำคัญในโมเลกุลชีวภาพที่สำคัญอื่น ๆ เช่น อะดีโนซีนไตรฟอสเฟต (ATP), guanosine triphosphate (GTP), cyclic AMP (cAMP), นิโคตินาไมด์อะดินีนไดนิวคลีโอไทด์ (NADH) และ coenzyme A พิวรีน (1) บริสุทธิ์ยังไม่พบในธรรมชาติ แต่ก็สามารถสังเคราะห์ขึ้นได้
พิวรีนยังอาจทำหน้าที่เป็นสารสื่อประสาทโดยตรง และออกฤทธิ์ต่อหน่วยรับพิวรีน (purinergic receptor) และ adenosine ก็ออกฤทธิ์ต่อหน่วยรับ adenosine
ประวัติ
[แก้]นักเคมีชาวเยอรมัน Hermann Emil Fischer เป็นผู้บัญญัติคำว่า purine ขึ้นในปี ค.ศ. 1884[8][9] จากคำว่า pure urine (ปัสสาวะบริสุทธิ์)[10] แล้วต่อมาจึงสังเคราะห์มันได้เป็นครั้งแรกในปี 1898[9]
สารตั้งต้นสำหรับลำดับปฏิกิริยาก็คือกรดยูริก (8) ซึ่งสกัดได้จากนิ่วไตในปี 1776 โดยนักเคมีชาวเยอรมัน-สวีเดน คาร์ล วิลเฮล์ม เชเลอ[11] คือ กรดยูริก (8) จะสร้างปฏิกิริยากับ phosphorus pentachloride (PCl5) มีผลเป็น 2,6,8-trichloropurine (10) ซึ่งก็จะแปลงเป็น 2,6-diiodopurine (11) ด้วยไฮโดรเจนไอโอไดด์ (HI) และเกลือ Phosphonium (PH4I) ผลที่ได้จะรีดิวซ์เป็นพิวรีน (1) โดยใช้ผงสังกะสี
เมแทบอลิซึม
[แก้]สิ่งมีชีวิตเป็นจำนวนมากมีวิถีเมแทบอลิซึมเพื่อสังเคราะห์และสลายพิวรีน พิวรีนจะสังเคราะห์ทางชีวภาพโดยเป็น nucleoside (คือ เบสที่เชื่อมกับ ribose) การสะสมนิวคลีโอไทด์ที่แปลงไปของพิวรีนจะมีผลเสียต่อกระบวนการในเซลล์ต่าง ๆ โดยเฉพาะที่เกี่ยวกับดีเอ็นเอและอาร์เอ็นเอ เพื่อให้รอดชีวิตได้ สิ่งมีชีวิตก็จะมีเอนไซม์กลุ่ม (deoxy) purine phosphohydrolases เป็นจำนวนหนึ่ง เพื่อใช้แยกสลายสารอนุพันธ์ของพิวรีนเหล่านี้ด้วยน้ำ เป็นการกำจัดพวกมันจากกอง nucleoside triphosphate (NTP) และ deoxynucleoside triphosphate (dNTP) ที่ใช้งานได้ การกำจัดกรดอะมิโนหนึ่ง (deamination) จากเบสพิวรีน อาจมีผลเป็นการสะสมนิวคลีโอไทด์ที่แปลงไปในรูปแบบของ inosine triphosphate (ITP), deoxyinosine triphosphate (dITP), xanthosine triphosphate (XTP) และ deoxyxanthosine triphosphate (dXTP)[12]
ความบกพร่องของเอนไซม์ที่ควบคุมการผลิตและการสลายพิวรีนอาจเปลี่ยนลำดับดีเอ็นเอของเซลล์อย่างรุนแรง ซึ่งเป็นตัวอธิบายว่า ทำไมผู้ที่มีเอนไซม์ต่างจากคนอื่น จึงเสี่ยงเป็นมะเร็งบางชนิดมากกว่า
การบริโภคเนื้อสัตว์และอาหารทะเลมากสัมพันธ์กับความเสี่ยงโรคเกาต์ที่สูงขึ้น เทียบกับการบริโภคผลิตภัณฑ์นมมากจะสัมพันธ์กับความเสี่ยงที่ลดลง การบริโภคพอประมาณซึ่งผักหรือโปรตีนที่สมบูรณ์ด้วยพิวรีน ไม่สัมพันธ์กับความเสี่ยงโรคเกาต์ที่สูงขึ้น[13][14]
การสังเคราะห์ในห้องทดลอง
[แก้]นอกจากร่างกายจะสังเคราะห์พิวรีนผ่านกระบวนการเมแทบอลิซึมของพิวรีนแล้ว ก็ยังสังเคราะห์พิวรีนในห้องทดลองได้ด้วย
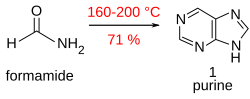
พิวรีน (1) สามารถได้พอสมควรเมื่อเผา formamide ในภาชนะเปิดที่ 170 °C เป็นเวลา 28 ชม.[15]
ปฏิกิริยาที่น่าทึ่งนี้และปฏิกิริยาอื่น ๆ คล้ายกัน จะเกิดขึ้นในบริบทของกำเนิดสิ่งมีชีวิต[16]
งานศึกษาต่าง ๆ ได้แสดงว่า ไฮโดรเจนไซยาไนด์ (HCN) 4 โมเลกุล จะสามารถรวมเป็นโมเลกุลมีสี่ส่วน (tetramer) คือ diaminomaleodinitrile (12) ซึ่งสามารถเปลี่ยนเป็นพิวรีนแบบที่เกิดตามธรรมชาติเกือบทั้งหมด[17][18][19][20] ยกตัวอย่างเช่น โมเลกุล HCN 5 ตัว จะควบแน่นภายในปฏิกิริยาคายความร้อนกลายเป็น adenine โดยเฉพาะเมื่อมีแอมโมเนีย
ส่วนการสังเคราะห์พิวรีนของทรอบ (ค.ศ. 1900) เป็นปฏิกิริยาคลาสสิก (ตั้งชื่อตามนักเคมีชาวเยอรมันวิลเฮล์ม ทรอบ) ระหว่างไพริมิดีนที่ทดแทนกลุ่มอะมีนกับกรดฟอร์มิก[21]
ดูเพิ่ม
[แก้]- โรคเกาต์, เป็นโรคที่มีเมแทบอลิซึมของพิวรีนผิดปกติ
เชิงอรรถ
[แก้]- ↑ เทาโทเมอร์ (tautomer) เป็นไอโซเมอร์โดยโครงสร้าง (structural isomer) ต่าง ๆ ของสารประกอบอินทรีย์ที่สามารถเปลี่ยนเป็นกันและกันได้ง่าย ๆ[1][2][3] ปฏิกิริยาเช่นนี้มักจะมีผลเปลี่ยนตำแหน่งโปรตอนหนึ่ง ๆ แม้จะเป็นไอเดียที่ซับซ้อน แต่ tautomerism ก็สำคัญต่อปฏิกิริยาของกรดอะมิโนและกรดนิวคลีอิก ซึ่งเป็นโครงสร้างพื้นฐานในสิ่งมีชีวิต
อ้างอิง
[แก้]- ↑ Antonov, L (2011). Tautomerism: Methods and Theories (1st ed.). Weinheim: Wiley-VCH. ISBN 978-3-527-33294-6.
- ↑
Smith, MB; March, J (2001). Advanced Organic Chemistry (5th ed.). New York: Wiley Interscience. pp. 1218–1211. ISBN 0-471-58589-0.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑
Katritzky, AR; Elguero, J และคณะ (1971). The Tautomerism of heterocycles. New York: Academic Press. ISBN 0-12-020651-X.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Rosemeyer, Helmut (March 2004). "The Chemodiversity of Purine as a Constituent of Natural Products". Chemistry & Biodiversity. 1 (3): 361–401. doi:10.1002/cbdv.200490033.
- ↑ "Gout: List of Foods High and Low in Purine Content". Dietaryfiberfood.com. April 8, 2016. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ November 12, 2011. สืบค้นเมื่อ 2016-07-16.
- ↑ "Gout Diet: What Foods To Avoid". Healthcastle.com. สืบค้นเมื่อ 2016-07-16.
- ↑ Guyton, Arthur C. (2006). Textbook of Medical Physiology. Philadelphia, PA: Elsevier. p. 37. ISBN 978-0-7216-0240-0.
- ↑
Fischer, Emil (1884). "Ueber die Harnsäure. I." [On uric acid. I.]. Berichte der Deutschen Chemischen Gesellschaft. 17: 328–338. doi:10.1002/cber.18840170196.

From p. 329: "Um eine rationelle Nomenklatur der so entstehenden zahlreichen Substanzen zu ermöglichen, betrachte ich dieselben als Abkömmlinge der noch unbekannten Wasserstoffverbindung CH3.C5N4H3 and nenne die letztere Methylpurin." (In order to make possible a rational nomenclature for the numerous existing substances, I regarded them as derivatives of a still unknown hydrogen compound, CH3.C5N4H3, and call the latter "methylpurine".) - ↑ 9.0 9.1
Fischer, Emil (1898). "Ueber das Purin und seine Methylderivate" [On purine and its methyl derivatives]. Berichte der Deutschen Chemischen Gesellschaft. 31: 2550–2574. doi:10.1002/cber.18980310304.

From p. 2550: "…hielt ich es für zweckmäßig, alle diese Produkte ebenso wie die Harnsäure als Derivate der sauerstofffreien Verbindung C5H4N4 zu betrachten, und wählte für diese den Namen Purin, welcher aus den Wörtern purum und uricum kombiniert war." (…I regarded it as expedient to consider all of these products, just like uric acid, as derivatives of the oxygen-free compound C5H4N4, and chose for them the name "purine", which was formed from the [Latin] words purum and uricum.) - ↑ McGuigan, Hugh (1921). An Introduction To Chemical Pharmacology. P. Blakiston's Sons & Co. p. 283. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-04-16. สืบค้นเมื่อ 2012-07-18.
- ↑ Scheele, C. W. (1776). "Examen chemicum calculi urinari" [A chemical examination of kidney stones]. Opuscula. 2: 73.
- ↑ Davies, O.; Mendes, P.; Smallbone, K.; Malys, N. (2012). "Characterisation of multiple substrate-specific (d)ITP/(d)XTPase and modelling of deaminated purine nucleotide metabolism". BMB Reports. 45 (4): 259–264. doi:10.5483/BMBRep.2012.45.4.259. PMID 22531138.
- ↑ "Purine-Rich Foods, Dairy and Protein Intake, and the Risk of Gout in Men". New England Journal of Medicine. 350: 1093–1103. doi:10.1056/NEJMoa035700. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-02-13. สืบค้นเมื่อ 2016-07-17.
- ↑ "Bone Health". USDA. สืบค้นเมื่อ 2016-07-17.
- ↑ Yamada, H.; Okamoto, T. (1972). "A One-step Synthesis of Purine Ring from Formamide". Chemical & Pharmaceutical Bulletin. 20 (3): 623. doi:10.1248/cpb.20.623. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ May 16, 2016.
- ↑ Saladino, Raffaele; Crestini, Claudia; Ciciriello, Fabiana; Costanzo, Giovanna; Mauro, Ernesto; และคณะ (2006). "About a Formamide-Based Origin of Informational Polymers: Syntheses of Nucleobases and Favourable Thermodynamic Niches for Early Polymers". Origins of Life and Evolution of Biospheres. 36 (5–6): 523–531. Bibcode:2006OLEB...36..523S. doi:10.1007/s11084-006-9053-2. PMID 17136429.
- ↑ Sanchez, R. A.; Ferris, J. P.; Orgel, L. E. (1967). "Studies in prebiotic synthesis. II. Synthesis of purine precursors and amino acids from aqueous hydrogen cyanide". Journal of Molecular Biology. 30 (2): 223–253. doi:10.1016/S0022-2836(67)80037-8. PMID 4297187.
- ↑ Ferris, James P.; Orgel, L. E. (March 1966). "An Unusual Photochemical Rearrangement in the Synthesis of Adenine from Hydrogen Cyanide". Journal of the American Chemical Society. 88 (5): 1074. doi:10.1021/ja00957a050.
- ↑ Ferris, J. P.; Kuder, J. E.; Catalano, O. W. (1969). "Photochemical Reactions and the Chemical Evolution of Purines and Nicotinamide Derivatives". Science. 166 (3906): 765–766. Bibcode:1969Sci...166..765F. doi:10.1126/science.166.3906.765. PMID 4241847.
- ↑ Oro, J.; Kamat, J. S. (1961). "Amino-acid Synthesis from Hydrogen Cyanide under Possible Primitive Earth Conditions". Nature. 190 (4774): 442–443. Bibcode:1961Natur.190..442O. doi:10.1038/190442a0. PMID 13731262.
- ↑ Hassner, Alfred; Stumer, C. (2002). Organic Syntheses Based on Name Reactions (2nd ed.). Elsevier. ISBN 0-08-043259-X.
แหล่งข้อมูลอื่น
[แก้]- Purine Content in Food เก็บถาวร 12 พฤศจิกายน 2011 ที่ เวย์แบ็กแมชชีน