เลือดออกใต้เยื่อหุ้มสมองชั้นกลาง
| เลือดออกใต้เยื่อหุ้มสมองชั้นกลาง (Subarachnoid hemorrhage) | |
|---|---|
| ชื่ออื่น | Subarachnoid haemorrhage |
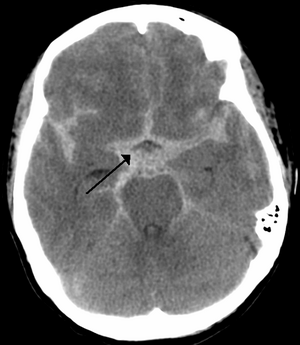 | |
| ภาพซีทีสแกนแสดงให้เห็นเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง เห็นเป็นบริเวณสีขาวมีศรชี้กลางภาพ ซึ่งบ่งบอกว่ามีเลือดออกตรงกลางสมอง ไหลซึมไปยังร่องหยักของสมองทั้งสองข้าง | |
| การออกเสียง | |
| สาขาวิชา | ประสาทศัลยศาสตร์ |
| อาการ | ปวดหัวเฉียบพลันรุนแรง, อาเจียน, ระดับการรู้สึกตัวลดลง[1] |
| ภาวะแทรกซ้อน | เกิดสมองขาดเลือดขึ้นภายหลัง, หลอดเลือดหดตัวในสมอง, ชักs[1] |
| ประเภท | ชนิดเกิดจากการบาดเจ็บ และ ชนิดเกิดขึ้นเอง (จากหลอดเลือดสมองโป่งพอง, จากไม่ใช่หลอดเลือดสมองโป่งพอง, เพริมีเซนเซฟาลิก)[1] |
| สาเหตุ | การบาดเจ็บที่ศีรษะ, หลอดเลือดสมองโป่งพอง[1] |
| ปัจจัยเสี่ยง | ความดันเลือดสูง, การสูบบุหรี่, การดื่มสุรา, การใช้โคเคน[1] |
| วิธีวินิจฉัย | ซีทีสแกน, การตรวจน้ำไขสันหลัง[2] |
| โรคอื่นที่คล้ายกัน | เยื่อหุ้มสมองอักเสบ, ไมเกรน, ลิ่มเลือดอุดตันในหลอดเลือดดำสมอง[3] |
| การรักษา | การผ่าตัดหรือหัตถการอาศัยรังสี[1] |
| ยา | ลาเบทาลอล, ไนโมดิปีน[1] |
| พยากรณ์โรค | อัตราเสียชีวิตที่ 30 วัน อยู่ที่ 45% (ชนิดที่เกิดจากหลอดเลือดสมองโป่งพอง)[1] |
| ความชุก | 1 ใน 10,000 ต่อปี[1] |
เลือดออกใต้เยื่อหุ้มสมองชั้นกลาง (อังกฤษ: subarachnoid hemorrhage, SAH, ออกเสียง: /ˌsʌbəˈræknɔɪd ˈhɛm (ə) rɪdʒ/) คือการมีเลือดออกที่ช่องใต้เยื่อหุ้มสมองชั้นกลางระหว่างเยื่อหุ้มสมองชั้นกลางกับชั้นในซึ่งอยู่รอบ ๆ สมอง อาจเกิดขึ้นได้เอง หรือจากการแตกของหลอดเลือดสมองโป่งพอง หรือเกิดจากอุบัติเหตุกระทบกระเทือนศีรษะก็ได้
อาการของการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางอาจมีเช่นอาการปวดศีรษะรุนแรงเฉียบพลัน คลื่นไส้ อาเจียน สับสน หรือซึมลง บางครั้งอาจชักได้[4] ยืนยันการวินิจฉัยด้วยการใช้การถ่ายภาพรังสีส่วนตัดอาศัยคอมพิวเตอร์หรือบางครั้งอาจทำได้ด้วยการเจาะตรวจน้ำไขสันหลัง การรักษาทำโดยการผ่าตัดอย่างทันท่วงที อาจด้วยการผ่าตัดเปิดกะโหลกศีรษะหรือการใช้รังสีช่วยในกระบวนการรักษา ร่วมกับการใช้ยาและการรักษาอื่น ๆ เพื่อป้องกันการเกิดเลือดออกซ้ำและป้องกันภาวะแทรกซ้อนของการมีเลือดออก เคยมีการรักษาหลอดเลือดโป่งพองด้วยการผ่าตัดในช่วงประมาณหลังปี ค.ศ. 1930 แต่ตั้งแต่ช่วงปี ค.ศ. 1990 เป็นต้นมา การรักษาหลอดเลือดโป่งพองส่วนใหญ่ทำโดยวิธีรักษาที่รุกล้ำร่างกายน้อยกว่าอย่างการใช้ลวดขดซึ่งทำโดยการสอดลวดพิเศษเข้าไปทางหลอดเลือดขนาดใหญ่[4]
การมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางเป็นโรคหลอดเลือดสมองอย่างหนึ่งซึ่งคิดเป็น 1–7% ของโรคหลอดเลือดสมองทั้งหมด[5] ถือเป็นภาวะฉุกเฉินทางการแพทย์ที่อาจทำให้เสียชีวิตหรือทุพพลภาพได้รุนแรงแม้จะได้รับการวินิจฉัยและรักษาตั้งแต่เนิ่น ๆ ก็ตาม ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางเกือบครึ่งนั้นเสียชีวิต และ 10–15% เสียชีวิตก่อนมาถึงโรงพยาบาล[4] ผู้ที่รอดชีวิตนั้นก็มักมีความสูญเสียทางระบบประสาทหรือการรับรู้[6]
อาการและอาการแสดง[แก้]
อาการตามแบบฉบับของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางคือการมีอาการปวดศีรษะรุนแรงเฉียบพลัน เหมือนโดนเตะเข้าที่หัว ("like being kicked in the head") [7] หรือปวดหัวรุนแรงที่สุดเท่าที่เคยประสบมาในชีวิต ("worst ever") ซึ่งเวลาที่เริ่มเป็นถึงเป็นมากที่สุดใช้เวลาเป็นนาทีหรือวินาที อาการปวดศีรษะนี้มักปวดตุ้บ ๆ ตามจังหวะเต้นหัวใจไปยังบริเวณท้ายทอย (occiput) [8] ผู้ป่วยหนึ่งในสามไม่มีอาการอย่างอื่นนอกจากอาการปวดศีรษะลักษณะที่ว่านี้ และผู้ป่วยหนึ่งในสิบมาพบแพทย์ด้วยอาการนี้ซึ่งต่อมาภายหลังจึงได้รับการวินิจฉัยเป็นเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง[4] อาจมีอาการอาเจียน และ 114 มีอาการชัก[4] อาจมีอาการสับสน ซึม หรืออาจถึงขั้นโคม่าได้ รวมทั้งอาจมีอาการคอแข็งเกร็งหรืออาการแสดงของการระคายเคืองเยื่อหุ้มสมองได้[4] อาการคอแข็งมักปรากฏขึ้นประมาณหกชั่วโมงหลังเริ่มมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง[9] การมีรูม่านตาขยายเพียงข้างเดียว (isolated dilation of a pupil) และการไม่มีรีเฟลกซ์รูม่านตาตอบสนองต่อแสง (pupillary light reflex) อาจสะท้อนถึงการมีสมองถูกกดทับ (brain herniation) ซึ่งเป็นผลจากการเพิ่มขึ้นของความดันในกะโหลกศีรษะ (increased intracranial pressure) [4] อาจมีเลือดออกในลูกตา (intraocular hemorrhage) จากการตอบสนองต่อความดันที่ขึ้นสูงอย่างรวดเร็วได้ โดยการมีเลือดออกใต้ชั้นไฮยาลอยด์ (subhyaloid hemorrhage) และเลือดออกในน้ำวุ้นลูกตา (vitreous hemorrhage) อาจตรวจพบได้ด้วยการตรวจส่องตา (fundoscopy) นี้เรียกว่ากลุ่มอาการเทอร์สัน (Terson syndrome) พบในผู้ป่วย 3–13% และพบมากขึ้นตามความรุนแรงของเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง[10]
การทำงานผิดปกติของเส้นประสาทกล้ามเนื้อตา (หนังตาตก ลูกตาอยู่ในตำแหน่งมองค้างไปทางด้านล่างเฉียงออกด้านนอกของใบหน้า) หรืออาการชาอาจบ่งชี้ว่ามีเลือดออกจากหลอดเลือดแดงโพสทีเรียร์คอมมิวนิเคติง[4][8] อาการชักยังเป็นอาการที่พบได้บ่อยหากเลือดนั้นออกมาจากหลอดเลือดโป่งพอง นอกจากนี้แล้วค่อนข้างเป็นการยากที่จะทำนายตำแหน่งที่เลือดออกจากอาการแสดงที่ปรากฏ[4] ภาวะเลือดออกใต้เยื่อหุ้มสมองชั้นกลางในผู้ป่วยที่แข็งแรงดีมาตลอดมักใช้เป็นการวินิจฉัยรูปผิดปกติของหลอดเลือดแดงและดำได้[8]
ผลจากการมีเลือดออกนี้จะทำให้ร่างกายหลั่งอะดรีนาลีนและฮอร์โมนอื่นที่ใกล้เคียงกันออกมาเป็นจำนวนมาก ทำให้มีความดันโลหิตเพิ่มสูง หัวใจทำงานหนัก เกิดมีปอดบวมน้ำเหตุระบบประสาท (neurogenic pulmonary edema) หัวใจเต้นผิดจังหวะ การเปลี่ยนแปลงของคลื่นไฟฟ้าหัวใจ (27%) [11] และภาวะหัวใจหยุด (3%) ได้อย่างรวดเร็วหลังเกิดเลือดออก[4][12]
เลือดออกใต้เยื่อหุ้มสมองชั้นกลางอาจเกิดในผู้ประสบอุบัติเหตุกระทบกระเทือนศีรษะได้ อาการของผู้ป่วยกลุ่มนี้อาจมีเช่น ปวดศีรษะ ซึม อ่อนแรงครึ่งซีก ภาวะเลือดออกใต้เยื่อหุ้มสมองชั้นกลางนี้เกิดขึ้นบ่อยในการบาดเจ็บของสมอง หากมีการเปลี่ยนแปลงของระดับการรู้สึกตัวด้วยจะมีความสัมพันธ์กับการมีพยากรณ์โรคที่แย่[13]
การวินิจฉัย[แก้]


การตรวจภาพถ่ายรังสี[แก้]
การประเมินผู้ป่วยที่สงสัยว่าจะมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางในเบื้องต้นคือการซักประวัติและตรวจร่างกายซึ่งมีจุดประสงค์หลักเพื่อประเมินว่าอาการที่นำผู้ป่วยมาพบแพทย์นั้นเป็นผลจากการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางหรือสาเหตุอื่น อย่างไรก็ดีแพทย์ไม่อาจให้การวินิจฉัยภาวะนี้ได้จากการตรวจทางคลินิกเพียงอย่างเดียวดังนั้นการตรวจภาพรังสีทางการแพทย์จึงมีความจำเป็นไม่เพื่อยืนยันการมีเลือดออกก็เพื่อคัดออก การตรวจที่นิยมเลือกใช้เป็นอันดับต้น ๆ คือการตรวจด้วยการถ่ายภาพรังสีส่วนตัดอาศัยคอมพิวเตอร์ (CT scan) ของสมอง ซึ่งเป็นการตรวจที่มีความไวสูงโดยสามารถตรวจพบภาวะนี้ได้อย่างถูกต้องได้ถึงกว่า 95% โดยเฉพาะหากได้รับการตรวจในวันแรกที่มีเลือดออก การสร้างภาพด้วยเรโซแนนซ์แม่เหล็ก (MRI) อาจเป็นอีกทางเลือกหนึ่งที่มีความไวมากกว่าหากตรวจผู้ป่วยที่มีอาการมาหลายวัน[4] การศึกษาวิจัยชิ้นหนึ่งรายงานว่าหากทำ CT ภายใน 6 ชั่วโมงหลังเริ่มมีอาการ จะมีความไวในการตรวจพบเลือดออกสูง 100%[14]
การเจาะน้ำไขสันหลัง[แก้]
การเจาะน้ำไขสันหลังอาจทำให้พบหลักฐานของการมีเลือดออกได้ในผู้ป่วย 3% ที่ผลตรวจ CT ปกติ ดังนั้นจึงถูกกำหนดให้เป็นการตรวจที่จำเป็นต้องทำในผู้ป่วยที่สงสัยว่าจะมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางแต่ผลภาพสมองปกติ[4] โดยอย่างน้อยต้องเก็บตัวอย่างน้ำไขสันหลังให้ได้ 3 ขวด[9] หากมีจำนวนเม็ดเลือดแดงมากกว่าปกติในทั้ง 3 ขวดจะเป็นการบ่งชี้ว่ามีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง ถ้าจำนวนไม่เท่ากันโดยค่อย ๆ ลดลงในแต่ละขวด จะแสดงว่าเลือดน่าจะมาจากการบาดเจ็บของหลอดเลือดขนาดเล็กระหว่างการทำหัตถการมากกว่า ("traumatic tap") [6] ตัวอย่างน้ำไขสันหลังที่เก็บได้จะถูกนำไปตรวจว่ามี xanthochromia (การมีสีออกเหลือง[15]) หรือการที่น้ำไขสันหลังที่ผ่านการปั่นให้ตกตะกอนแล้วมีสีเป็นสีเหลือง การตรวจที่มีความไวมากกว่าคือการตรวจด้วย spectrophotometry ซึ่งเป็นการตรวจการดูดกลืนคลื่นแสงในความยาวคลื่นต่าง ๆ เพื่อตรวจว่ามีบิลิรูบินซึ่งเป็นผลผลิตจากการย่อยสลายเฮโมโกลบินในเม็ดเลือดแดงหรือไม่[4][16] การตรวจหา xanthochromia และการตรวจด้วย spectrophotometry ยังคงเป็นวิธีที่เชื่อถือได้ในการตรวจหาเลือดออกใต้เยื่อหุ้มสมองชั้นกลางหลังจากเริ่มมีอาการปวดศีรษะมาหลายวัน[16] แต่ต้องทำหลังจากปวดศีรษะอย่างน้อย 12 ชั่วโมง เนื่องจากกว่าที่เฮโมโกลบินในเม็ดเลือดแดงจะถูกเปลี่ยนเป็นบิลิรูบินนั้นต้องใช้เวลาหลายชั่วโมง[4][16]
จากการที่มีผู้ป่วยที่มาห้องฉุกเฉินด้วยอาการปวดศีรษะรุนแรงเฉียบพลันเพียง 10% เท่านั้นที่มีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง จึงต้องมีการคิดถึงสาเหตุอื่น ๆ ไว้ด้วยเสมอ สาเหตุอื่น ๆ เหล่านี้เช่น เยื่อหุ้มสมองอักเสบ ไมเกรน และลิ่มเลือดในหลอดเลือดดำสมอง (cerebral venous sinus thrombosis) [7] ภาวะเลือดออกในสมองใหญ่ (intracerebral hemorrhage) ซึ่งมีเลือดออกในเนื้อสมองนั้นพบบ่อยกว่าถึงสองเท่าและมักได้รับการวินิจฉัยผิดเป็นเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง[17] ไม่บ่อยนักที่จะมีการวินิจฉัยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางผิดไปเป็นไมเกรนหรือการปวดศีรษะจากความเครียด (tension headache) ซึ่งจะทำให้ผู้ป่วยกลุ่มนี้ได้รับการตรวจ CT scan ช้ากว่าที่ควร งานวิจัยปี ค.ศ. 2004 พบว่าเกิดกรณีเช่นนี้สูงถึง 12% ของผู้ป่วย ส่วนใหญ่เกิดกับผู้ป่วยที่มีเลือดออกเป็นบริเวณน้อยและไม่มีการเปลี่ยนแปลงของสภาพจิต การวินิจฉัยล่าช้าจะนำไปสู่ผลการรักษาที่ไม่ดี[18] ผู้ป่วยบางรายอาจหายจากอาการปวดศีรษะได้เองโดยไม่มีอาการอื่นหลงเหลือ อาการปวดศีรษะเช่นนี้ถูกเรียกว่าอาการปวดศีรษะแสดงเบื้องต้น ("sentinel headache") เนื่องจากเชื่อกันว่าเกิดจากการมีเลือดไหลจากหลอดเลือดโป่งพองเป็นปริมาณน้อย ๆ อาการปวดศีรษะแสดงเบื้องต้นเช่นนี้ควรได้รับการตรวจเพิ่มเติมด้วย CT scan และการเจาะหลังเนื่องจากอาจมีเลือดออกเพิ่มเติมได้ในเวลาสามสัปดาห์[6]
การฉีดสีหลอดเลือด[แก้]
เมื่อยืนยันการวินิจฉัยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางแล้วจะต้องหาตำแหน่งที่เกิดเลือดออก หากจากภาพตรวจ CT scan บ่งชี้ว่าเลือดน่าจะออกจากหลอดเลือดโป่งพองแล้วมีทางเลือกระหว่างการฉีดสีหลอดเลือดสมอง (cerebral angiography —ฉีดสารทึบรังสีเข้าหลอดเลือดสมองแล้วถ่ายภาพรังสี) และการฉีดสีหลอดเลือดอาศัยคอมพิวเตอร์ (CT angiography —ฉีดสารทึบรังสีเข้าหลอดเลือดแล้วทำ CT scan) เพื่อหาตำแหน่งของหลอดเลือดโป่งพอง การสอดท่อเพื่อฉีดสีอาจทำให้มีโอกาสใส่ขดลวดรักษาหลอดเลือดโป่งพองไปพร้อมกันได้[4][6]
การตรวจคลื่นไฟฟ้าหัวใจ[แก้]

ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง 40-70% มีการเปลี่ยนแปลงของคลื่นไฟฟ้าหัวใจ โดยอาจตรวจพบช่วง QT ยาวขึ้น, คลื่น Q, หัวใจเต้นผิดจังหวะ และ การยกของช่วง ST ซึ่งอาจคล้ายกับที่พบในภาวะกล้ามเนื้อหัวใจขาดเลือดได้[19]
สาเหตุ[แก้]
สาเหตุของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดขึ้นเอง (spontaneous) 85% เกิดจากการแตกของหลอดเลือดสมองโป่งพอง ส่วนใหญ่จะเกิดขึ้นที่บริเวณของหลอดเลือดสมองที่เรียกว่าวงกลมของวิลลิสและแขนงที่เกี่ยวข้อง แม้การมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางส่วนใหญ่จะเป็นจากการมีเลือดออกจากหลอดเลือดโป่งพองขนาดเล็ก แต่หลอดเลือดโป่งพองขนาดใหญ่ซึ่งพบน้อยกว่าจะมีโอกาสแตกได้มากกว่า[4]
ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดขึ้นเองประมาณ 15–20% ตรวจไม่พบหลอดเลือดโป่งพองในการฉีดสีหลอดเลือดครั้งแรก[20] ในจำนวนนี้ประมาณครึ่งหนึ่งเกิดจากการมีเลือดออกบริเวณรอบ ๆ สมองส่วนกลางโดยไม่มีหลอดเลือดโป่งพอง (non-aneurysmal perimesencephalic hemorrhage) ซึ่งเลือดจะออกอยู่เพียงบริเวณช่องใต้เยื่อหุ้มสมองชั้นกลางบริเวณสมองส่วนกลางเท่านั้น ซึ่งสาเหตุของการมีเลือดออกในผู้ป่วยกลุ่มนี้ยังไม่ชัดเจน[4] ผู้ป่วยส่วนที่เหลือมักมีเลือดออกจากความผิดปกติอื่นของหลอดเลือด (เช่น รูปผิดปกติของหลอดเลือดแดงและดำ) ความผิดปกติของหลอดเลือดในไขสันหลัง และการมีเลือดออกจากเนื้องอกต่าง ๆ [4] สาเหตุอื่น ๆ เช่น การใช้โคเคน ความผิดปกติที่เม็ดเลือดแดงเป็นรูปเคียว (sickle cell disorder) การใช้ยายับยั้งการแข็งตัวของเลือด ความผิดปกติของการแข็งตัวของเลือด และการตกเลือดในสมองที่ต่อมใต้สมอง (pituitary apoplexy) [9][20]
ผู้ป่วยประสบอุบัติเหตุบาดเจ็บที่สมอง 60% จะมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางตรวจพบได้จาก CT scan[21] เลือดออกใต้เยื่อหุ้มสมองชั้นกลางจากการบาดเจ็บ (traumatic SAH) นี้ส่วนใหญ่เกิดขึ้นที่บริเวณใกล้กับตำแหน่งที่เกิดกะโหลกศีรษะร้าวหรือสมองช้ำ[20] ส่วนใหญ่พบร่วมกับการบาดเจ็บแบบอื่น ๆ ของสมองและมักมีพยากรณ์โรคที่ไม่ดี แต่ยังไม่แน่ชัดนักว่าพยากรณ์โรคที่ไม่ดีนั้นเป็นผลจากการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางโดยตรงหรือเป็นจากการบาดเจ็บอื่นที่มีการแสดงออกเป็นเลือดออกใต้เยื่อหุ้มสมองชั้นกลางกันแน่[21]
การจำแนกประเภท[แก้]
มีระบบจัดระดับความรุนแรงของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางอยู่หลายระบบ แบบประเมินความรู้สึกตัวของกลาสโกว (Glasgow Coma Scale) ก็เป็นระบบที่ใช้ประเมินความรู้สึกตัวของผู้ป่วยที่ใช้กันตัวไป นอกจากนี้ยังมีระบบวัดคะแนนที่ออกแบบมาเป็นพิเศษสำหรับการประเมินผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางอยู่สามแบบ แต่ละแบบกำหนดให้ตัวเลขที่มากหมายถึงการมีผลการรักษาไม่ดี[22] แบบประเมินเหล่านี้ถูกออกแบบขึ้นโดยเปรียบเทียบลักษณะอาการของผู้ป่วยกับผลการรักษาย้อนหลัง
แบบประเมินความรุนแรงอันแรกเป็นของ Hunt และ Hess ซึ่งได้อธิบายไว้ในปี ค.ศ. 1968[23]
| ระดับความรุนแรง | อาการและอาการแสดง | อัตรารอดชีวิต |
|---|---|---|
| 1 | ไม่มีอาการ หรือมีอาการปวดศีรษะและคอแข็งเล็กน้อย | 70% |
| 2 | ปวดศีรษะปานกลางถึงรุนแรง คอแข็ง ไม่มีความบกพร่องของระบบประสาทอื่นนอกจากของเส้นประสาทสมอง | 60% |
| 3 | ซึม มีความบกพร่องของระบบประสาทเล็กน้อย | 50% |
| 4 | กึ่งสลบ (stuporous) อ่อนแรงครึ่งซีกปานกลางถึงรุนแรง อาจมีอาการแข็งเกร็งแบบ decerebrate ในช่วงแรกแล้วจึงอ่อนเปลี้ยลง | 20% |
| 5 | โคม่าระดับลึก มีอาการแข็งเกร็งแบบ decerebrate อาการระดับตรีทูต (moribund) | 10% |
ระบบประเมินความรุนแรงของ Fisher แบ่งระดับความรุนแรงตามลักษณะของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่ปรากฏให้เห็นใน CT scan[24] แบบประเมินความรุนแรงนี้ได้รับการดัดแปลงโดย Claassen และคณะ ตามความเสี่ยงที่พบใหม่เกี่ยวกับขนาดของเลือดที่ออกและการมีเลือดออกในโพรงสมอง (intraventricular hemorrhage) ร่วมด้วย[25]
| ระดับความรุนแรง | ลักษณะของเลือดที่ออก |
|---|---|
| 1 | ไม่มีปรากฏให้เห็น |
| 2 | หนาน้อยกว่า 1 มิลลิเมตร |
| 3 | หนาน้อยกว่า 2 มิลลิเมตร |
| 4 | หนาเท่าไรก็ได้ร่วมกับมีเลือดออกในโพรงสมองหรือมีเลือดซึมเข้าในเนื้อสมอง |
ระบบจำแนกประเภทของสหพันธ์ศัลยแพทย์ระบบประสาทแห่งโลก (World Federation of Neurosurgeon, WFNS) ได้ใช้แบบประเมินความรู้สึกตัวของกลาสโกวร่วมกับความบกพร่องทางระบบประสาทเฉพาะที่ (focal neurological deficit) มาใช้ในการประเมินความรุนแรงของอาการ[26]
| ระดับความรุนแรง | คะแนนแบบประเมินกลาสโกว | ความบกพร่องทางระบบประสาทเฉพาะที่ |
|---|---|---|
| 1 | 15 | ไม่มี |
| 2 | 13–14 | ไม่มี |
| 3 | 13–14 | มี |
| 4 | 7–12 | มีหรือไม่มีก็ได้ |
| 5 | <7 | มีหรือไม่มีก็ได้ |
Ogilvy และ Carter ได้เสนอรายละเอียดการจำแนกประเภทแบบครอบคลุมเพื่อใช้ทำนายผลและประเมินคุณภาพการรักษา[27] ระบบนี้มีระดับความรุนแรง 5 ระดับ โดยให้แต่ละคะแนนขึ้นกับการมีหรือไม่มีปัจจัยดังต่อไปนี้: อายุมากกว่า 50, ระดับความรุนแรงตาม Hunt และ Hess ที่ 4 หรือ 5, คะแนนแบบประเมินของ Fisher 3 หรือ 4, ขนาดหลอดเลือดโป่งพองมากกว่า 10 มิลลิเมตร, และการมีหลอดเลือดโป่งพองของระบบไหลเวียนส่วนหลัง (posterior circulation aneurysm) ขนาดตั้งแต่ 25 มิลลิเมตร[27]
การตรวจคัดกรองและการป้องกัน[แก้]
ยังไม่มีการตรวจคัดกรองหลอดเลือดสมองโป่งพองในระดับประชากรเนื่องจากเป็นโรคที่ค่อนข้างพบน้อย ไม่มีความคุ้มทุน เว้นแต่คนที่มีญาติระดับที่หนึ่งไม่ต่ำกว่าสองคนที่มีอาการจากเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดจากการแตกของหลอดเลือดสมองโป่งพองเท่านั้นที่การตรวจคัดกรองอาจมีประโยชน์[4][28]
โรคถุงน้ำจำนวนมากของไต ถ่ายทอดทางออโตโซมลักษณะเด่น (ADPKD) เป็นโรคไตที่ถ่ายทอดทางพันธุกรรมอย่างหนึ่งซึ่งพบว่ามีความสัมพันธ์กับการเกิดโรคหลอดเลือดสมองโป่งพองถึง 8% แต่ส่วนใหญ่หลอดเลือดสมองโป่งพองที่พบร่วมกับโรคนี้จะมีขนาดเล็ก จึงไม่น่าเป็นสาเหตุให้เกิดการแตกได้ ดังนั้นจึงมีคำแนะนำให้ตรวจคัดกรองผู้ป่วย ADPKD ที่มีคนในครอบครัวคนหนึ่งมีอาการของการแตกของหลอดเลือดสมองโป่งพองเท่านั้น[29]
บางครั้งอาจมีการตรวจพบหลอดเลือดสมองโป่งพองโดยบังเอิญจากการตรวจภาพสมองในเหตุอื่น เรื่องนี้ถือเป็นปัญหาที่เป็นที่ถกเถียงปัญหาหนึ่ง เนื่องจากวิธีการรักษาหลอดเลือดสมองโป่งพองแต่ละวิธีนั้นมีโอกาสที่จะเกิดภาวะแทรกซ้อนที่รุนแรง โครงการศึกษาวิจัยนานาชาติว่าด้วยหลอดเลือดโป่งพองในกะโหลกศีรษะที่ยังไม่ปรากฏการแตก (The International Study of Unruptured Aneurysms, ISUIA) ศึกษาข้อมูลพยากรณ์โรคทั้งในกลุ่มผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางและผู้ที่ตรวจพบหลอดเลือดโป่งพองด้วยสาเหตุอื่น ๆ พบว่าผู้ที่มีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางแล้วมีโอกาสสูงที่จะมีเลือดออกจากหลอดเลือดโป่งพองที่อื่น ๆ อีก ในทางกลับกัน ผู้ที่มีหลอดเลือดโป่งพองขนาดเล็กกว่า 10 มิลลิเมตรและไม่เคยมีเลือดออกจากหลอดเลือดโป่งพองมีโอกาสน้อยมากที่จะมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง และมักสามารถรับการรักษาหลอดเลือดโป่งพองนั้นได้โดยไม่มีภาวะแทรกซ้อน[30] จากงานวิจัย ISUIA นี้และงานวิจัยอื่น ๆ ปัจจุบันจึงถือเป็นคำแนะนำโดยทั่วไปว่าผู้ป่วยจะได้รับการพิจารณาเข้ารับการรักษาเพื่อป้องกันล่วงหน้านี้ก็ต่อเมื่อมีประมาณอายุขัยนานพอสมควรและหลอดเลือดโป่งพองนั้นมีโอกาสแตกสูง[28] ในขณะเดียวกันก็ยังมีหลักฐานงานวิจัยเพียงไม่มากที่ยืนยันว่าการรักษาหลอดเลือดโป่งพองที่ยังไม่แตกโดยเทคนิคการสวนหลอดเลือดทำหัตถการนั้นมีประโยชน์อย่างแท้จริง[31]
การรักษา[แก้]
การดูแลรักษาผู้ป่วยประกอบด้วยการรักษาอาการไม่ให้แย่ลงและใช้การตรวจและการรักษาเฉพาะ การดูแลรักษาเหล่านี้รวมถึงการป้องกันไม่ให้มีเลือดออกซ้ำโดยอุดจุดที่ทำให้เลือดออก ป้องกันการหดเกร็งของหลอดเลือด (vasospasm) และการป้องกันและรักษาภาวะแทรกซ้อนที่อาจจะเกิดขึ้น[4]
การดูแลทั่วไป[แก้]
การรักษาอาการผู้ป่วยไม่ให้ทรุดหนักกว่าเดิมมีความสำคัญเป็นอันดับหนึ่ง ผู้ป่วยที่มีการเปลี่ยนแปลงของระดับความรู้สึกตัวอาจต้องได้รับการใส่ท่อช่วยหายใจและช่วยหายใจด้วยเครื่องช่วยหายใจ ต้องมีการวัดระดับความดันโลหิต ชีพจร อัตราการหายใจ และคะแนนแบบประเมินความรู้สึกตัวกลาสโกวเป็นระยะ เมื่อยืนยันการวินิจฉัยแล้วผู้ป่วยอาจจำเป็นต้องย้ายเข้าหออภิบาลผู้ป่วยหนัก (ICU) ส่วนหนึ่งเนื่องจากผู้ป่วย 15% อาจมีเลือดออกเพิ่มเติมได้อีกหลังจากรับเข้าดูแลเป็นผู้ป่วยในแล้ว การให้สารอาหารก็มีความสำคัญเป็นอันดับต้น ๆ โดยควรให้ด้วยการกินทางปากหรือผ่านสายให้อาหารทางจมูกมากกว่าจะให้สารอาหารทางหลอดเลือด (parenteral nutrition) การลดความเจ็บปวดมักทำโดยยาที่มีผลระงับประสาทน้อยอย่างเช่น codeine เนื่องจากการให้ยาระงับประสาทอาจส่งผลต่อระดับความรู้สึกตัวและทำให้ไม่สามารถประเมินการเปลี่ยนแปลงระดับความรู้สึกตัวที่เกิดจากตัวโรคได้ การเกิดลิ่มเลือดในหลอดเลือดดำส่วนลึก (deep vein thrombosis) นั้นป้องกันโดยการให้ใส่ถุงน่องรัด (compression stocking) หรือการกดด้วยแรงดันลมเป็นระยะ (intermittent pneumatic compression) หรือทั้งสองอย่าง[4] มักมีการใส่สายสวนปัสสาวะเพื่อเฝ้าระวังสมดุลของเหลวในร่างกาย อาจมีการให้ยาในกลุ่มเบ็นโซไดอาเซพีน เพื่อลดความกังวลของผู้ป่วย[9] ถ้าผู้ป่วยรู้สึกตัวควรให้ยาต้านอาเจียน (antiemetic) ด้วย[8]
การป้องกันเลือดออกซ้ำ[แก้]

ผู้ป่วยที่ตรวจ CT scan พบมีก้อนเลือด (hematoma) ขนาดใหญ่ ระดับความรู้สึกตัวลดลง มีอาการเฉพาะที่ทางระบบประสาท (focal neurologic symptom) อาจได้ประโยชน์จากการผ่าตัดเอาเลือดออกหรืออุดจุดเลือดออกอย่างทันท่วงที ผู้ป่วยส่วนที่เหลือยังต้องได้รับการดูแลอาการไม่ให้ทรุดลงและตรวจด้วยการฉีดสีหลอดเลือดแดงต้นขา (transfemoral angiogram) หรือเอ็กซเรย์หลอดเลือดด้วยคอมพิวเตอร์ (CT angiogram) ในภายหลัง เป็นการยากที่จะทำนายว่าผู้ป่วยรายใดจะมีเลือดออกซ้ำ ทั้งนี้การมีเลือดออกซ้ำสามารถเกิดขึ้นได้ทุกเมื่อและนำไปสู่พยากรณ์โรคที่แย่ เมื่อเวลาผ่านไป 24 ชั่วโมงแล้วความเสี่ยงของการมีเลือดออกซ้ำจะคงอยู่ที่ประมาณ 40% ไปอีกสี่สัปดาห์ ชี้ให้เห็นว่าการรักษาที่สำคัญคือการลดความเสี่ยงให้เร็วที่สุดเท่าที่จะเป็นไปได้[4]
หากตรวจพบหลอดเลือดสมองโป่งพองจากการฉีดสีหลอดเลือด มีทางเลือกในการรักษาเพื่อลดความเสี่ยงของการมีเลือดออกเพิ่มเติมจากหลอดเลือดโป่งพองที่เดิม คือการใส่คลิป (clipping) [32] และการใส่ขดลวด (coiling) [33] การใส่คลิปนั้นต้องทำด้วยการผ่าตัดเปิดกะโหลกศีรษะ (craniotomy) เพื่อหาตำแหน่งของหลอดเลือดโป่งพอง จากนั้นจึงใส่คลิปหนีบโคนหลอดเลือดโป่งพองเอาไว้ ส่วนการใส่ขดลวดนั้นทำโดยใส่ลวดเข้าไปทางหลอดเลือดขนาดใหญ่ผ่านทางการใส่สายที่หลอดเลือดแดงฟีเมอรัลที่ขาหนีบและเดินสายผ่านหลอดเลือดแดงใหญ่เอออร์ตาไปยังหลอดเลือดแดงคาโรติดและเวอร์ทิบรัลซึ่งเป็นหลอดเลือดที่เลี้ยงสมอง เมื่อระบุตำแหน่งของหลอดเลือดโป่งพองได้แล้วแพทย์จะใส่ขดลวดแพลทินัมเข้าไปเพื่อกระตุ้นให้เกิดลิ่มเลือดขึ้นในหลอดเลือดโป่งพองเพื่ออุดไว้ ส่วนใหญ่การตัดสินใจเลือกวิธีการรักษาทำโดยทีมสหวิชาชีพซึ่งประกอบด้วยประสาทศัลยแพทย์ รังสีแพทย์ระบบประสาท และมักมีผู้เชี่ยวชาญทางด้านอื่น ๆ ด้วย[4]
โดยปกติแล้วการตัดสินใจเลือกว่าจะรักษาด้วยการใส่คลิปหรือใส่ขดลวดนั้นทำโดยดูจากตำแหน่งและขนาดของหลอดเลือดโป่งพอง และภาวะทั่วไปของผู้ป่วย หลอดเลือดโป่งพองของหลอดเลือดแดงมิดเดิลซีรีบรัล และหลอดเลือดที่เกี่ยวข้องนั้นเข้าถึงได้ยากจากการสวนหลอดเลือด จึงมักเลือกใช้การใส่คลิปมากกว่า ในขณะที่หลอดเลือดโป่งพองของหลอดเลือดแดงเบสิลา และหลอดเลือดแดงโพสทีเรียร์ซีรีบรัลนั้นเข้าถึงได้ยากจากการผ่าตัด จึงมักเลือกใช้การสวนหลอดเลือดมากกว่า [34] การเลือกใช้วิธีการเช่นนี้ส่วนใหญ่ขึ้นอยู่กับประสบการณ์ของศัลยแพทย์ผู้ผ่าตัด การวิจัยเชิงทดลองแบบสุ่มและมีกลุ่มควบคุมเพียงชิ้นเดียวที่ได้เปรียบเทียบวิธีการรักษาแต่ละวิธีก็เป็นการทำกับผู้ป่วยที่มีอาการค่อนข้างดีและมีหลอดเลือดโป่งพองขนาดเล็ก (ไม่เกิน 10 มิลลิเมตร) ที่หลอดเลือดแดงแอนทีเรียร์ซีรีบรัลและหลอดเลือดแดงแอนทีเรียร์คอมมิวนิเคติง (รวมกันแล้วเรียกว่า "ระบบไหลเวียนส่วนหน้า" (anterior circulation)) ซึ่งผู้ป่วยกลุ่มนี้คิดเป็นจำนวนเพียง 20% ของผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่มีสาเหตุมาจากหลอดเลือดสมองโป่งพอง[34][35] งานวิจัยนี้ชื่อว่า International Subarachnoid Aneurysm Trial (ISAT) (การวิจัยเชิงทดลองระดับนานาชาติว่าด้วยหลอดเลือดสมองโป่งพองใต้เยื่อหุ้มสมองชั้นกลาง) และได้แสดงให้เห็นว่ากลุ่มที่ได้รับการรักษาด้วยการใส่ขดลวดมีโอกาสตายหรือไม่สามารถช่วยเหลือตนเองได้น้อยกว่ากลุ่มที่รักษาด้วยการผ่าตัด (7.4% absolute risk reduction และ 23.5% relative risk reduction) [34] ข้อเสียหลักของการรักษาด้วยการใส่ขดลวดคือมีความเป็นไปได้ที่จะเกิดมีหลอดเลือดโป่งพองกลับเป็นซ้ำ ซึ่งพบได้น้อยมากในการรักษาด้วยการผ่าตัด ในงานวิจัย ISAT พบว่าผู้ป่วย 8.3% ต้องได้รับการรักษาเพิ่มเติมในระยะยาว ดังนั้นผู้ป่วยที่รับการรักษาด้วยการใส่ขดลวดจึงจำเป็นต้องติดตามการรักษาต่อด้วยการฉีดสีหลอดเลือดหรือวิธีอื่นๆ อีกเป็นเวลาหลายปีเพื่อให้สามารถตรวจพบหลอดเลือดโป่งพองที่เกิดขึ้นใหม่ได้ตั้งแต่เนิ่นๆ[36] งานวิจัยอื่นๆ พบมีอัตราการกลับเป็นซ้ำจนต้องมีการรักษาเพิ่มเติมมากกว่าที่พบในงานวิจัยนี้[37][38]
การหดเกร็งของหลอดเลือด[แก้]
การหดเกร็งของหลอดเลือด (อังกฤษ: vasospasm) จะทำให้มีเลือดไหลไปยังบริเวณที่เกิดการหดเกร็งของหลอดเลือดน้อยลง ถือเป็นภาวะแทรกซ้อนของภาวะเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่อันตรายมาก อาจทำให้เกิดการบาดเจ็บของเนื้อสมองที่เกิดจากการขาดเลือด (ischemic brain injury) จนสมองเสียหายอย่างถาวรได้เนื่องจากการขาดออกซิเจนของเนื้อเยื่อสมอง หากรุนแรงมากอาจทำให้เสียชีวิตได้ การขาดเลือดที่เกิดขึ้นภายหลังมีลักษณะเฉพาะคือการมีอาการทางระบบประสาทที่เกิดขึ้นใหม่ อาจตรวจยืนยันได้โดยการตรวจด้วยคลื่นเสียงความถี่สูงผ่านกะโหลกศีรษะ (transcranial doppler) หรือการฉีดสีเข้าหลอดเลือดสมอง (cerebral angiography) ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่ต้องรับไว้นอนรักษาในโรงพยาบาลประมาณหนึ่งในสามจะมีการขาดเลือดที่เกิดขึ้นภายหลัง ผู้ป่วยกลุ่มนี้ครึ่งหนึ่งจะมีความเสียหายที่เกิดขึ้นถาวร[39] การตรวจคัดกรองเพื่อค้นหาการหดเกร็งของหลอดเลือดนั้นสามารถทำได้โดยการทำ transcranial doppler ทุกๆ 24–48 ชั่วโมง โดยความเร็วของการไหลของเลือดที่ช้ากว่า 120 เซนติเมตรต่อนาทีถือว่าอาจมีการหดเกร็งของหลอดเลือดเกิดขึ้น[6]
เป็นที่เชื่อกันว่าสามารถใช้ยากลุ่มแคลเซียมแชนแนลบล็อกเกอร์ในการป้องกันการหดเกร็งของหลอดได้โดยผ่านทางการป้องกันไม่ให้มีแคลเซียมไหลเข้าเซลล์กล้ามเนื้อเรียบ[21] โดยยาแคลเซียมแชนแนลบล็อกเกอร์ชนิดกินอย่าง nimodipine นั้นสามารถให้ผลการรักษาที่ดีได้หากได้ให้ยานี้ภายในวันที่ 4–21 หลังมีเลือดออก แม้จะไม่สามารถลดการตรวจพบการหดเกร็งของหลอดเลือดผ่านการตรวจด้วยการฉีดสีหลอดเลือด (angiography) ได้ก็ตาม[40] สำหรับผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดจากอุบัติเหตุ พบว่า nimodipine ไม่มีผลในระยะยาว จึงไม่มีการแนะนำให้ใช้[41] มีการศึกษาการใช้ยาแคลเซียมแชนแนลบล็อกเกอร์ตัวอื่นและแมกนีเซียมซัลเฟตอยู่บ้างแต่ยังไม่เป็นที่แนะนำให้ใช้ นอกจากนี้ยังไม่มีหลักฐานว่าการให้ยา nimodipine ทางหลอดเลือดดำจะมีประโยชน์มากกว่าการให้ด้วยการกินอีกด้วย[39]
เมื่อมีอาการของการหดเกร็งของหลอดเลือด มักมีการนำแนวทางการรักษาที่เรียกว่า Triple H มาใช้ ซึ่งได้แก่ การให้สารน้ำทางหลอดเลือดดำเพื่อให้เกิดภาวะความดันโลหิตสูง (Hypertension), ภาวะมีปริมาตรเลือดมาก (Hypervolemia) และมีเลือดเจือจาง (Hemodilution)[42] หลักฐานสนับสนุนแนวทางการรักษานี้ยังไม่มีข้อสรุป ยังไม่มีการวิจัยเชิงทดลองแบบสุ่มและมีกลุ่มควบคุมชิ้นใดที่ทำเพื่อแสดงให้เห็นประโยชน์ที่เกิดจากแนวทางการรักษาแนวทางนี้[43]
หากการรักษาด้วยยาไม่สามารถทำให้อาการของการขาดเลือดยาวนานดีขึ้นได้ อาจมีการใช้การฉีดสีหลอดเลือดเพื่อระบุตำแหน่งของหลอดเลือดที่เกิดการหดเกร็งและฉีดยาขยายหลอดเลือด (vasodilator) เข้าไปที่หลอดเลือดแดงเส้นนั้นโดยตรง หรืออาจทำการผ่าตัดขยายหลอดเลือด (angioplasty)[6]
ภาวะแทรกซ้อนอื่น ๆ[แก้]
อาจพบภาวะโพรงสมองคั่งน้ำ (hydrocephalus) เป็นภาวะแทรกซ้อนของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางได้ทั้งในระยะสั้นและระยะยาว โดยสามารถตรวจพบได้จาก CT scan โดยจะพบมีโพรงสมองข้าง (lateral ventricle) โตขึ้น ถ้ามีปัญหาระดับการรู้สึกตัวลดลงผู้ป่วยอาจต้องรับการเจาะหลังระบายน้ำ หรือวางสายระบายนอกโพรงสมอง (extraventricular drain) หรืออาจต้องวางทางลัดโพรงสมอง (shunt) ถาวร[4][6] การที่สามารถบรรเทาภาวะโพรงสมองคั่งน้ำได้อาจทำให้ผู้ป่วยมีอาการดีขึ้นได้อย่างมาก[8] ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่นอนรักษาในโรงพยาบาลประมาณครึ่งหนึ่งมีภาวะแทรกซ้อนได้แก่ความแปรปรวนของความดันโลหิต ความผิดปกติของเกลือแร่ ปอดบวม และภาวะหัวใจล้มเหลวได้ ภาวะเหล่านี้อาจทำให้ผู้ป่วยมีพยากรณ์โรคแย่ลง[4]
ผู้ป่วยถึงหนึ่งในสามจะชักระหว่างที่นอนรักษาในโรงพยาบาล[6] จึงมีการให้ยากันชักกันโดยทั่วไป[44] โดยเชื่อว่าจะเป็นประโยชน์แก่ผู้ป่วย[6] แต่การให้ยากันชักในกรณีเช่นนี้ก็ยังเป็นที่ถกเถียงและไม่มีหลักฐานที่ดีรองรับ[45][46] งานวิจัยบางชิ้นบ่งชี้ว่าการให้ยาเหล่านี้มีความสัมพันธ์กับพยากรณ์โรคที่ไม่ดี ซึ่งอาจเป็นจากผลเสียของการให้ยาเหล่านี้ หรือเป็นจากการที่ยาเหล่านี้มักใช้ในผู้ป่วยที่อาการหนักอยู่แล้วก็ได้[47][48]
พยากรณ์โรค[แก้]
อัตราเสียชีวิตและทุพพลภาพระยะแรก[แก้]
ภาวะเลือดออกใต้เยื่อหุ้มสมองชั้นกลางมักให้ผลลัพธ์ที่ไม่ดีกับผู้ป่วย[5] โดยมีอัตราการเสียชีวิตอยู่ที่ 40-50%[17] แต่ปัจจุบันเริ่มมีอัตราการรอดชีวิตสูงขึ้นเรื่อย ๆ [4] ผู้ป่วยที่ไม่จำเป็นต้องรับไว้รักษาในโรงพยาบาลจำนวนมากกว่าหนึ่งในสี่มีความจำกัดในการดำเนินชีวิตอย่างมาก และมีจำนวนผู้ที่ไม่มีอาการหลงเหลืออยู่เลยเพียงไม่ถึงหนึ่งในห้าเท่านั้น[34] การได้รับการวินิจฉัยล่าช้า เช่น การวินิจฉัยผิดเป็นโรคปวดศีรษะไมเกรน มีส่วนทำให้เกิดผลลัพธ์ที่ไม่ดี[18] ปัจจัยที่ตรวจพบได้ตั้งแต่แรกรับไว้รักษาในโรงพยาบาลที่มีความสัมพันธ์กับการมีผลลัพธ์ไม่ดีมีหลายอย่าง ในจำนวนนี้เช่น การมีอาการทางระบบประสาทที่ไม่ดี มีความดันเลือดตัวบนสูง เคยเป็นโรคหัวใจมาก่อน เคยมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางมาก่อน มีโรคตับ ตรวจ CT scan พบมีเลือดออกมากหรือมีหลอดเลือดโป่งพองขนาดใหญ่ ตำแหน่งของหลอดเลือดโป่งพองอยู่ที่ระบบไหลเวียนส่วนหลัง และการมีอายุมาก[47] ปัจจัยที่ตรวจพบระหว่างนอนรักษาในโรงพยาบาลที่ทำให้มีพยากรณ์โรคที่ไม่ดีมีหลายอย่างเช่น มีการขาดเลือดของเนื้อสมองที่เกิดขึ้นภายหลังซึ่งเกิดจากการหดเกร็งของหลอดเลือด มีก้อนเลือดในเนื้อสมอง มีเลือดออกในโพรงสมอง และการมีไข้ขึ้นในวันที่ 8 ของการนอนรักษาในโรงพยาบาล[47]
ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางบางรายแม้จะได้รับการตรวจด้วยการฉีดสีหลอดเลือดทั้งสี่เส้นแล้วยังไม่พบมีหลอดเลือดโป่งพองนั้นมีพยากรณ์โรคดีกว่าผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่มีหลอดเลือดโป่งพอง แต่ผลตรวจเช่นนี้ยังมีความสัมพันธ์กับความเสี่ยงของการขาดเลือด การมีเลือดออกซ้ำ และการเกิดภาวะโพรงสมองคั่งน้ำ[20] ในขณะที่การมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางบริเวณรอบสมองส่วนกลาง (perimesencephalic) มีโอกาสเกิดเลือดออกซ้ำหรือการขาดเลือดที่เกิดขึ้นภายหลังน้อยมาก และมีพยากรณ์โรคดีกว่ามาก[49]
เชื่อกันว่าพยากรณ์โรคของอุบัติเหตุกระทบกระเทือนศีรษะนั้นส่วนหนึ่งขึ้นอยู่กับตำแหน่งและความรุนแรงของการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง[21] แต่การแยกเอาผลของการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางออกจากผลอื่น ๆ ของภาวะสมองกระทบกระเทือนนั้นเป็นการยาก ทำให้ไม่มีใครทราบว่าการมีเลือดใต้เยื่อหุ้มสมองชั้นกลางนั้นเป็นปัจจัยที่ทำให้พยากรณ์โรคแย่ลง หรือเป็นเพียงสัญญาณบ่งบอกว่ามีการบาดเจ็บเกิดขึ้น ผู้ป่วยภาวะบาดเจ็บของสมอง (traumatic brain injury) ระดับปานกลางและรุนแรงที่มีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางตั้งแต่แรกรับไว้รักษาในโรงพยาบาลนั้นมีความเสี่ยงที่จะเสียชีวิตมากกว่ากลุ่มที่ไม่มีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางถึงสองเท่า นอกจากนั้นยังมีความเสี่ยงของการเกิดภาวะทุพพลภาพรุนแรงและสภาพผักเรื้อรังมากกว่าอีกด้วย นอกจากนี้เลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดจากอุบัติเหตุยังมีความสัมพันธ์กับตัวบ่งชี้ผลลัพธ์ที่ไม่ดีอย่างอื่น เช่น ภาวะลมชักหลังเกิดการบาดเจ็บ (post traumatic epilepsy) ภาวะโพรงสมองคั่งน้ำ และการต้องอยู่ในหออภิบาลผู้ป่วยหนักเป็นเวลานาน อย่างไรก็ดีผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางจากการบาดเจ็บที่มีคะแนนแบบประเมินกลาสโกวมากกว่า 12 นั้น 90% มีผลการรักษาดี[21]
ยังมีหลักฐานชนิดอ่อนอยู่บ้างว่ามีปัจจัยทางพันธุกรรมที่มีผลต่อพยากรณ์โรคของการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง ตัวอย่างเช่น การมียีน ApoE4 (ยีนชนิดหนึ่งซึ่งถอดรหัสออกมาเป็น apolipoprotein E ซึ่งมีบทบาทในโรคอัลไซเมอร์) สองชุดนั้นดูเหมือนจะเพิ่มความเสี่ยงของการเกิดการขาดเลือดที่เกิดขึ้นภายหลังและนำไปสู่ผลการรักษาที่ไม่ดี[50] ในขณะที่การเกิดภาวะน้ำตาลในเลือดสูงหลังจากมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางนั้นทำให้มีความเสี่ยงสูงที่จะมีผลการรักษาที่ไม่ดี[51]
ผลการรักษาระยะยาว[แก้]
อาการทางระบบประสาทชั้นสูง เช่น ความรู้สึกเปลี้ย อารมณ์แปรปรวน และอาการอื่น ๆ เป็นผลตามมาที่พบได้ทั่วไป แม้ในผู้ป่วยที่มีอาการทางระบบประสาทฟื้นตัวอย่างดีก็ยังพบมีภาวะวิตกกังวล ซึมเศร้า ความผิดปกติที่เกิดหลังความเครียดที่สะเทือนใจ (PTSD) และการเสื่อมถอยของสติปัญญาได้บ่อย ผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลางถึง 46% จะมีความบกพร่องของภาวะการรับรู้ที่รุนแรงถึงขั้นส่งผลต่อคุณภาพชีวิต[6] ผู้ป่วยถึง 60% มีอาการปวดศีรษะ[52] เลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดจากหลอดเลือดโป่งพองอาจทำให้มีความเสียหายต่อไฮโปทาลามัสและต่อมใต้สมอง ซึ่งทำหน้าที่สำคัญในการควบคุมและผลิตฮอร์โมนของร่างกาย ผู้ป่วยที่เคยมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางถึงกว่าหนึ่งในสี่มีภาวะต่อมใต้สมองทำงานน้อย ทำให้มีฮอร์โมนจากต่อมใต้สมองชนิดใดชนิดหนึ่งหรือหลายชนิดน้อยกว่าปกติ ฮอร์โมนเหล่านี้ เช่น โกรธฮอร์โมน (Growth hormone) เฟชเอสเอช (Follicle-stumulating hormone) แอลเอช (luteinizing hormone) เป็นต้น[53]
ระบาดวิทยา[แก้]

จากบททบทวนงานวิจัย 51 ชิ้น ใน 21 ประเภท พบว่าอุบัติการณ์โดยเฉลี่ยของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางอยู่ที่ 9.1 ต่อ 100,000 ต่อปี งานวิจัยจากญี่ปุ่นและฟินแลนด์พบมีอุบัติการณ์สูงกว่าอยู่ที่ 22.7 และ 19.7 ตามลำดับ โดยยังไม่ทราบเหตุผลแน่ชัด ในทางกลับกันอเมริกากลางและอเมริกาใต้มีอุบัติการณ์น้อยกว่าอยู่ที่ 4.2 ต่อ 100,000[54]
แม้ส่วนใหญ่ของผู้ป่วยที่เสี่ยงต่อการเกิดเลือดออกใต้เยื่อหุ้มสมองชั้นกลางจะเป็นกลุ่มอายุที่น้อยกว่าการเกิดโรคหลอดเลือดสมองชนิดอื่น ๆ [5] แต่ความเสี่ยงก็เพิ่มขึ้นตามอายุไม่ต่างกัน ผู้ที่มีอายุน้อยมีโอกาสเกิดเลือดออกใต้เยื่อหุ้มสมองชั้นกลางน้อยกว่าผู้ที่อยู่ในวัยกลางคนด้วยอัตราส่วนความเสี่ยง (risk ratio) 0.1 หรือ 10%[54] ความเสี่ยงเพิ่มขึ้นตามอายุโดยผู้มีอายุมาก (มากกว่า 85 ปี) เสี่ยงกว่าผู้มีอายุ 45–55 อยู่ 60%[54] ผู้หญิงอายุมากกว่า 55 ปีมีความเสี่ยงมากกว่าผู้ชายอายุเท่ากันประมาณ 25% ซึ่งอาจมีความเกี่ยวข้องกับปัจจัยที่เป็นผลมาจากการหมดประจำเดือน เช่นการลดลงของระดับฮอร์โมนเอสโตรเจน เป็นต้น[54]
พันธุกรรมอาจมีส่วนในการทำให้บางคนเสี่ยงต่อการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางมากกว่าคนอื่น โดยจะมีความเสี่ยงเพิ่มขึ้น 3–5 เท่าในผู้ที่มีญาติสายตรงอันดับที่หนึ่งป่วยด้วยมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง[7] อย่างไรก็ได้ปัจจัยเสี่ยงที่มาจากวิธีการดำเนินชีวิตมีผลต่อความเสี่ยงโดยรวมมากกว่า[5] ความเสี่ยงเหล่านี้ได้แก่ การสูบบุหรี่ ความดันเลือดสูง และการดื่มสุรา[17] ผู้ที่เคยสูบบุหรี่มีความเสี่ยงต่อการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางเป็นสองเท่าของผู้ที่ไม่เคยสูบ[5] มีข้อมูลที่ไม่ชัดเจนนักว่าปัจจัยบางอย่างเพิ่มความเสี่ยงของการเกิดเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง ปัจจัยเหล่านี้เช่น การมีเชื้อชาติคอเคเชียน การได้รับการรักษาด้วยฮอร์โมนทดแทน เบาหวาน และการมีระดับคอเลสเตอรอลมากกว่าปกติ[5] ประมาณ 4% ของการมีเลือดออกจากหลอดเลือดโป่งพองเกิดขึ้นหลังการมีเพศสัมพันธ์ และผู้ป่วยเลือดออกใต้เยื่อหุ้มสมองชั้นกลาง 10% เริ่มมีอาการขณะที่กำลังก้มตัวหรือยกของหนัก
โดยรวมแล้ว คนทั่วไปประมาณ 1% มีหลอดเลือดโป่งพองอยู่ ส่วนใหญ่มีขนาดเล็ก และมักไม่มีการแตกของหลอดเลือดโป่งพองเหล่านี้[30]
ประวัติ[แก้]
แม้จะมีการสังเกตเห็นอาการทางคลินิกของเลือดออกใต้เยื่อหุ้มสมองชั้นกลางมาตั้งแต่สมัยของฮิปโปกราเตสแล้วแต่การมีอยู่ของโรคหลอดเลือดสมองโป่งพองและข้อเท็จจริงที่ว่ามันสามารถแตกได้นั้นยังไม่เป็นที่ทราบกันจนกว่าจะถึงคริสต์ศตวรรษที่ 18[55] มีการอธิบายอาการที่เกี่ยวข้องเอาไว้โดยละเอียดกว่าโดยนายแพทย์ ไบรอม แบรมเวลล์ ชาวเอดินบะระในปีค.ศ. 1886[56] ต่อมาในปีค.ศ. 1924 เซอร์ ดร. ชาร์ลส์ ไซมอนส์ (1890–1978) นักประสาทวิทยาชาวลอนดอนได้บันทึกอาการหลัก ๆ ของการมีเลือดออกใต้เยื่อหุ้มสมองชั้นกลางเอาไว้อย่างครบถ้วน และเสนอให้ใช้คำว่า "เลือดออกใต้เยื่อหุ้มสมองชั้นกลางเกิดเอง" (spontaneous subarachnoid hemorrhage) [55][57][58] ไซมอนส์ ยังได้อธิบายการใช้การเจาะน้ำไขสันหลังและการมีสีออกเหลืองในการช่วยวินิจฉัยเอาไว้ด้วย[59]
การรักษาด้วยการผ่าตัดครั้งแรกทำโดยนอร์แมน ดอตต์ ซึ่งเป็นลูกศิษย์ของ ดร. ฮาร์วีย์ คุชชิง ซึ่งตอนนั้นทำงานอยู่ในเอดินบะระ เขาได้เสนอการรักษาด้วยการห่อหลอดเลือดที่โป่งพอง (wrapping of aneurysm) ในช่วงราวคริสต์ทศวรรษ 1930 และเป็นผู้บุกเบิกการฉีดสีหลอดเลือดคนหนึ่ง[58] ประสาทศัลยแพทย์ชาวอเมริกา ดร. วอลเตอร์ แดนดี ซึ่งทำงานในบอลทิมอร์เป็นผู้ที่ใช้คลิปหนีบในการรักษาเป็นครั้งแรกในปี ค.ศ. 1938[32] มีการนำการผ่าตัดด้วยการใช้กล้องขยายช่วย (microsurgery) มาใช้ในการรักษาหลอดเลือดโป่งพองในปี ค.ศ. 1972 เพื่อเพิ่มผลการรักษา[60] การรักษาแบบ Triple H[42] เริ่มนำมาใช้ในช่วงคริสต์ทศวรรษ 1980 โดยใช้เป็นการรักษาการขาดเลือดภายหลังที่เกิดจากการหดเกร็งของหลอดเลือด (delayed ischemia due to vasospasm) และในช่วงเดียวกันมีการวิจัยทดลองใช้ nimodipine[40][61] เพื่อป้องกันภาวะแทรกซ้อนนี้ ในปี ค.ศ. 1983 ประสาทศัลยแพทย์ชาวรัสเซีย Zubkov และคณะได้รายงานการใช้บอลลูน (transluminal balloon angioplasty) ในการรักษาและป้องกันการหดเกร็งของหลอดเลือดหลังเกิดเลือดออกใต้เยื่อหุ้มสมองชั้นกลางที่เกิดจากหลอดเลือดโป่งพอง[62][63] ประสาทศัลยแพทย์ชาวอิตาลี ดร. กวีโด กวีลเอลมี ได้เสนอการรักษาด้วยการใช้ขดลวดในหลอดเลือดในปี ค.ศ. 1991[33][64]
อ้างอิง[แก้]
- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อEM2016 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อCar2016 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อOx2007 - ↑ 4.00 4.01 4.02 4.03 4.04 4.05 4.06 4.07 4.08 4.09 4.10 4.11 4.12 4.13 4.14 4.15 4.16 4.17 4.18 4.19 4.20 4.21 4.22 4.23 4.24 4.25 van Gijn J, Kerr RS, Rinkel GJ (2007). "Subarachnoid haemorrhage". Lancet. 369 (9558): 306–18. doi:10.1016/S0140-6736(07)60153-6. PMID 17258671.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 5.0 5.1 5.2 5.3 5.4 5.5 Feigin VL; Rinkel GJ; Lawes CM; และคณะ (2005). "Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies". Stroke. 36 (12): 2773–80. doi:10.1161/01.STR.0000190838.02954.e8. PMID 16282541.
- ↑ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 Suarez JI, Tarr RW, Selman WR (January 2006). "Aneurysmal subarachnoid hemorrhage". New England Journal of Medicine. 354 (4): 387–96. doi:10.1056/NEJMra052732. PMID 16436770.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 7.0 7.1 7.2 Longmore, Murray; Ian Wilkinson; Tom Turmezei; Chee Kay Cheung (2007). Oxford Handbook of Clinical Medicine, 7th edition. Oxford University Press. p. 841. ISBN 0-19-856837-1.
- ↑ 8.0 8.1 8.2 8.3 8.4 Ramrakha, Punit; Kevin Moore (2007). Oxford Handbook of Acute Medicine (2nd ed.). Oxford University Press. pp. 466–470. ISBN 978-0199232628.
- ↑ 9.0 9.1 9.2 9.3 Warrell, David A; Timothy M. Cox; และคณะ (2003). Oxford Textbook of Medicine, Fourth Edition, Volume 3. Oxford. pp. 1032–1034. ISBN 0-19-857013-9.
- ↑ McCarron MO, Alberts MJ, McCarron P (2004). "A systematic review of Terson's syndrome: Frequency and prognosis after subarachnoid haemorrhage". Journal of Neurology, Neurosurgery, and Psychiatry. 75 (3): 491–3. doi:10.1136/jnnp.2003.016816. PMC 1738971. PMID 14966173.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Allman, Keith G.; Iain H. Wilson (2006). Oxford Handbook of Anaesthesia (2nd ed.). Oxford University Press. pp. 408–409. ISBN 978-0198566090.
- ↑ Banki NM; Kopelnik A; Dae MW; และคณะ (2005). "Acute neurocardiogenic injury after subarachnoid hemorrhage". Circulation. 112 (21): 3314–9. doi:10.1161/CIRCULATIONAHA.105.558239. PMID 16286583.
- ↑ Servadei F; Murray GD; Teasdale GM; และคณะ (February 2002). "Traumatic subarachnoid hemorrhage: demographic and clinical study of 750 patients from the European brain injury consortium survey of head injuries". Neurosurgery. 50 (2): 261–7, discussion 267–9. doi:10.1097/00006123-200202000-00006. PMID 11844260.
- ↑ Perry, JJ; Stiell, IG; Sivilotti, ML; และคณะ (18 July 2011). "Sensitivity of computed tomography performed within six hours of onset of headache for diagnosis of subarachnoid haemorrhage: prospective cohort study". BMJ (Clinical research ed.). 343: d4277. PMID 21768192.
- ↑ ศัพท์บัญญัติราชบัณฑิตยสถาน เก็บถาวร 2017-07-15 ที่ เวย์แบ็กแมชชีน.
- ↑ 16.0 16.1 16.2 Cruickshank A; Auld P; Beetham R; และคณะ (May 2008). "Revised national guidelines for analysis of cerebrospinal fluid for bilirubin in suspected subarachnoid haemorrhage". Annals of Clinical Biochemistry. 45 (Pt 3): 238–44. doi:10.1258/acb.2008.007257. PMID 18482910. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-05-30. สืบค้นเมื่อ 2010-03-12.
- ↑ 17.0 17.1 17.2 Teunissen LL, Rinkel GJ, Algra A, van Gijn J (1 March 1996). "Risk factors for subarachnoid hemorrhage: a systematic review". Stroke. 27 (3): 544–9. PMID 8610327.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 18.0 18.1 Kowalski RG; Claassen J; Kreiter KT; และคณะ (February 2004). "Initial misdiagnosis and outcome after subarachnoid hemorrhage". Journal of the American Medical Association. 291 (7): 866–9. doi:10.1001/jama.291.7.866. PMID 14970066.
- ↑ Nguyen H, Zaroff JG (November 2009). "Neurogenic stunned myocardium". Curr Neurol Neurosci Rep. 9 (6): 486–91. doi:10.1007/s11910-009-0071-0. PMID 19818236.
- ↑ 20.0 20.1 20.2 20.3 Rinkel GJ, van Gijn J, Wijdicks EF (1 September 1993). "Subarachnoid hemorrhage without detectable aneurysm. A review of the causes" (PDF). Stroke. 24 (9): 1403–9. PMID 8362440.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 21.0 21.1 21.2 21.3 21.4 Armin SS, Colohan AR, Zhang JH (June 2006). "Traumatic subarachnoid hemorrhage: Our current understanding and its evolution over the past half century". Neurological Research. 28 (4): 445–52. doi:10.1179/016164106X115053. PMID 16759448.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rosen D, Macdonald R (2005). "Subarachnoid hemorrhage grading scales: A systematic review". Neurocritical Care. 2 (2): 110–8. doi:10.1385/NCC:2:2:110. PMID 16159052.
- ↑ Hunt W, Hess R (1968). "Surgical risk as related to time of intervention in the repair of intracranial aneurysms". Journal of Neurosurgery. 28 (1): 14–20. doi:10.3171/jns.1968.28.1.0014. PMID 5635959.
- ↑ Fisher C, Kistler J, Davis J (1980). "Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning". Neurosurgery. 6 (1): 1–9. doi:10.1097/00006123-198001000-00001. PMID 7354892.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Claassen J; Bernardini GL; Kreiter K; และคณะ (September 2001). "Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited". Stroke. 32 (9): 2012–20. doi:10.1161/hs0901.095677. PMID 11546890.
- ↑ Teasdale G, Drake C, Hunt W, Kassell N, Sano K, Pertuiset B, De Villiers J (1988). "A universal subarachnoid hemorrhage scale: Report of a committee of the World Federation of Neurosurgical Societies". Journal of Neurology, Neurosurgery, and Psychiatry. 51 (11): 1457. doi:10.1136/jnnp.51.11.1457. PMC 1032822. PMID 3236024.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 27.0 27.1 Ogilvy CS, Carter BS (May 1998). "A proposed comprehensive grading system to predict outcome for surgical management of intracranial aneurysms". Neurosurgery. 42 (5): 959–68, discussion 968–70. doi:10.1097/00006123-199805000-00001. PMID 9588539.
- ↑ 28.0 28.1 White PM, Wardlaw JM (December 2003). "Unruptured intracranial aneurysms". Journal of Neuroradiology. 30 (5): 336–50. PMID 14752379.
- ↑ Gibbs GF; Huston J; Qian Q; และคณะ (May 2004). "Follow-up of intracranial aneurysms in autosomal-dominant polycystic kidney disease". Kidney International. 65 (5): 1621–7. doi:10.1111/j.1523-1755.2004.00572.x. PMID 15086900.
- ↑ 30.0 30.1 International Study of Unruptured Intracranial Aneurysms Investigators (December 1998). "Unruptured intracranial aneurysms—risk of rupture and risks of surgical intervention". New England Journal of Medicine. 339 (24): 1725–33. doi:10.1056/NEJM199812103392401. PMID 9867550. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-12-15. สืบค้นเมื่อ 2010-04-26.
- ↑ Naggara ON, White PM, Guilbert F, Roy D, Weill A, Raymond J (September 2010). "Endovascular treatment of intracranial unruptured aneurysms: systematic review and meta-analysis of the literature on safety and efficacy". Radiology. 256 (3): 887–97. doi:10.1148/radiol.10091982. PMID 20634431.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 32.0 32.1 Dandy WE (1938). "Intracranial aneurysm of the internal carotid artery: Cured by operation". Annals of Surgery. 107 (5): 654–9. doi:10.1097/00000658-193805000-00003. PMC 1386933. PMID 17857170.
- ↑ 33.0 33.1 Guglielmi G, Viñuela F, Dion J, Duckwiler G (1991). "Electrothrombosis of saccular aneurysms via endovascular approach. Part 2: Preliminary clinical experience". Journal of Neurosurgery. 75 (1): 8–14. doi:10.3171/jns.1991.75.1.0008. PMID 2045924.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 34.0 34.1 34.2 34.3 Molyneux AJ; Kerr RS; Yu LM; และคณะ (2005). "International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: A randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion". Lancet. 366 (9488): 809–17. doi:10.1016/S0140-6736(05)67214-5. PMID 16139655.
- ↑ van der Schaaf I; Algra A; Wermer M; และคณะ (2005). "Endovascular coiling versus neurosurgical clipping for patients with aneurysmal subarachnoid haemorrhage". Cochrane Database of Systematic Reviews (Online) (4): CD003085. doi:10.1002/14651858.CD003085.pub2. PMID 16235314. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-03-28. สืบค้นเมื่อ 2010-05-01.
- ↑ Campi A; Ramzi N; Molyneux AJ; และคณะ (2007). "Retreatment of ruptured cerebral aneurysms in patients randomized by coiling or clipping in the International Subarachnoid Aneurysm Trial (ISAT)". Stroke. 38 (5): 1538–44. doi:10.1161/STROKEAHA.106.466987. PMID 17395870.
- ↑ Piotin M; Spelle L; Mounayer C; และคณะ (2007). "Intracranial aneurysms: Treatment with bare platinum coils—aneurysm packing, complex coils, and angiographic recurrence". Radiology. 243 (2): 500–8. doi:10.1148/radiol.2431060006. PMID 17293572.
- ↑ Raymond J; Guilbert F; Weill A; และคณะ (2003). "Long-term angiographic recurrences after selective endovascular treatment of aneurysms with detachable coils". Stroke. 34 (6): 1398–403. doi:10.1161/01.STR.0000073841.88563.E9. PMID 12775880.
- ↑ 39.0 39.1 Dorhout Mees S; Rinkel G; Feigin V; และคณะ (2007). "Calcium antagonists for aneurysmal subarachnoid haemorrhage". Cochrane Database of Systematic Reviews (Online) (3): CD000277. doi:10.1002/14651858.CD000277.pub3. PMID 17636626.
- ↑ 40.0 40.1 Allen GS; Ahn HS; Preziosi TJ; และคณะ (1983). "Cerebral arterial spasm: A controlled trial of nimodipine in patients with subarachnoid hemorrhage". New England Journal of Medicine. 308 (11): 619–24. doi:10.1056/NEJM198303173081103. PMID 6338383.
- ↑ Vergouwen MD, Vermeulen M, Roos YB (December 2006). "Effect of nimodipine on outcome in patients with traumatic subarachnoid haemorrhage: A systematic review". Lancet Neurology. 5 (12): 1029–32. doi:10.1016/S1474-4422(06)70582-8. PMID 17110283.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 42.0 42.1 Kassell NF, Peerless SJ, Durward QJ, Beck DW, Drake CG, Adams HP (September 1982). "Treatment of ischemic deficits from vasospasm with intravascular volume expansion and induced arterial hypertension". Neurosurgery. 11 (3): 337–43. doi:10.1097/00006123-198209000-00001. PMID 7133349.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sen J, Belli A, Albon H, Morgan L, Petzold A, Kitchen N (October 2003). "Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage". Lancet Neurology. 2 (10): 614–21. doi:10.1016/S1474-4422(03)00531-3. PMID 14505583.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rosengart AJ; Huo JD; Tolentino J; และคณะ (August 2007). "Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs". Journal of Neurosurgery. 107 (2): 253–60. doi:10.3171/JNS-07/08/0253. PMID 17695377.
- ↑ Naval NS, Stevens RD, Mirski MA, Bhardwaj A (February 2006). "Controversies in the management of aneurysmal subarachnoid hemorrhage". Critical Care Medicine. 34 (2): 511–24. doi:10.1097/01.CCM.0000198331.45998.85. PMID 16424735.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Liu KC, Bhardwaj A (2007). "Use of prophylactic anticonvulsants in neurologic critical care: a critical appraisal". Neurocritical Care. 7 (2): 175–84. doi:10.1007/s12028-007-0061-5. PMID 17763834.
- ↑ 47.0 47.1 47.2 Rosengart AJ, Schultheiss KE, Tolentino J, Macdonald RL (August 2007). "Prognostic factors for outcome in patients with aneurysmal subarachnoid hemorrhage". Stroke. 38 (8): 2315–21. doi:10.1161/STROKEAHA.107.484360. PMID 17569871.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Naidech AM; Kreiter KT; Janjua N; และคณะ (March 2005). "Phenytoin exposure is associated with functional and cognitive disability after subarachnoid hemorrhage". Stroke. 36 (3): 583–7. doi:10.1161/01.STR.0000141936.36596.1e. PMID 15662039.
- ↑ Greebe P, Rinkel GJ (April 2007). "Life expectancy after perimesencephalic subarachnoid hemorrhage". Stroke. 38 (4): 1222–4. doi:10.1161/01.STR.0000260093.49693.7a. PMID 17332451.
- ↑ Lanterna LA; Ruigrok Y; Alexander S; และคณะ (August 2007). "Meta-analysis of APOE genotype and subarachnoid hemorrhage: clinical outcome and delayed ischemia". Neurology. 69 (8): 766–75. doi:10.1212/01.wnl.0000267640.03300.6b. PMID 17709709.
- ↑ Kruyt ND; Biessels GJ; de Haan RJ; และคณะ (June 2009). "Hyperglycemia and clinical outcome in aneurysmal subarachnoid hemorrhage: a meta-analysis". Stroke. 40 (6): e424–30. doi:10.1161/STROKEAHA.108.529974. PMID 19390078.
- ↑ Powell J, Kitchen N, Heslin J, Greenwood R (June 2002). "Psychosocial outcomes at three and nine months after good neurological recovery from aneurysmal subarachnoid haemorrhage: Predictors and prognosis". Journal of Neurology, Neurosurgery, and Psychiatry. 72 (6): 772–81. doi:10.1136/jnnp.72.6.772. PMC 1737916. PMID 12023423.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A (September 2007). "Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review". Journal of the American Medical Association. 298 (12): 1429–38. doi:10.1001/jama.298.12.1429. PMID 17895459.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 54.0 54.1 54.2 54.3 de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ (December 2007). "Incidence of subarachnoid haemorrhage: A systematic review with emphasis on region, age, gender and time trends". Journal of Neurology, Neurosurgery, and Psychiatry. 78 (12): 1365–72. doi:10.1136/jnnp.2007.117655. PMID 17470467.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 55.0 55.1 Longstreth WT, Koepsell TD, Yerby MS, van Belle G (1985). "Risk factors for subarachnoid hemorrhage" (PDF). Stroke. 16 (3): 377–85. PMID 3890278.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bramwell B (1886). "Spontaneous meningeal haemorrhage". Edinburgh Medical Journal. 32: 101.
- ↑ Symonds CP (1924). "Spontaneous subarachnoid hemorrhage". Quarterly Journal of Medicine. 18: 93–122.
- ↑ 58.0 58.1 Todd NV, Howie JE, Miller JD (June 1990). "Norman Dott's contribution to aneurysm surgery". Journal of Neurology, Neurosurgery, and Psychiatry. 53 (6): 455–8. doi:10.1136/jnnp.53.6.455. PMC 1014202. PMID 2199609.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Symonds CP (1924). "Spontaneous sub-arachnoid hæmorrhage". Proceedings of the Royal Society of Medicine. 17 (Neurol Sect): 39–52. PMC 2201441. PMID 19983808.
- ↑ Krayenbühl HA, Yaşargil MG, Flamm ES, Tew JM (December 1972). "Microsurgical treatment of intracranial saccular aneurysms". Journal of Neurosurgery. 37 (6): 678–86. doi:10.3171/jns.1972.37.6.0678. PMID 4654697.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Pickard JD; Murray GD; Illingworth R; และคณะ (March 1989). "Effect of oral nimodipine on cerebral infarction and outcome after subarachnoid haemorrhage: British aneurysm nimodipine trial". BMJ (Clinical research ed.). 298 (6674): 636–42. doi:10.1136/bmj.298.6674.636. PMC 1835889. PMID 2496789.
- ↑ Zubkov IuN, Nikiforov BM, Shustin VA (September–October 1983). "1st attempt at dilating spastic cerebral arteries in the acute stage of rupture of arterial aneurysms". Zh Vopr Neirokhir Im N N Burdenko. 5 (5): 17–23. PMID 6228084.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Zubkov YN, Nikiforov BM, Shustin VA (September–October 1984). "Balloon catheter technique for dilatation of constricted cerebral arteries after aneurysmal SAH". Acta Neurochir (Wien). 70 (1–2): 65–79. doi:10.1007/BF01406044. PMID 6234754.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Strother CM (1 May 2001). "Historical perspective. Electrothrombosis of saccular aneurysms via endovascular approach: part 1 and part 2". AJNR. American Journal of Neuroradiology. 22 (5): 1010–2. PMID 11337350.
แหล่งข้อมูลอื่น[แก้]
- Neuroland เก็บถาวร 2007-04-20 ที่ เวย์แบ็กแมชชีน SAH page
| การจำแนกโรค | |
|---|---|
| ทรัพยากรภายนอก |
