ผลต่างระหว่างรุ่นของ "สแตติน"
Thomas Walt (คุย | ส่วนร่วม) ล ย้อนการแก้ไขที่ 6327770 สร้างโดย Thomas Walt (พูดคุย) |
Thomas Walt (คุย | ส่วนร่วม) |
||
| บรรทัด 219: | บรรทัด 219: | ||
|} |
|} |
||
==โครงสร้าง== |
|||
[[ไฟล์:The schematic structure of statins.png|thumb|center|650px|โครงสร้างหลักของยากลุ่มสแตติน<ref name=A059>{{cite web|title=Safety and Statins: Pharmacologic and Clinical Perspectives - See more at: http://www.ajmc.com/journals/supplement/2004/2004-11-vol10-n3PreventiveMedicine/Nov04-1971pS030-S037#sthash.VZLloQYR.dpuf|author=Michael B. Bottorff|date=November 01, 2004|url=http://www.ajmc.com/journals/supplement/2004/2004-11-vol10-n3PreventiveMedicine/Nov04-1971pS030-S037|accessdate=February 6, 2016}}</ref>]] |
|||
โครงสร้างหลักของสแตตินที่ได้จากธรรมชาติ (โลวาสแตติน, ปราวาสแตติน, ซิมวาสแตติน, รวมไปถึง[[เมวาสแตติน]]ที่ยังไม่มีการนำมาใช้ในทางคลินิก) จะมีโครงสร้างเป็น hydrogenated naphthalene ที่ประกอบไปด้วยคาร์บอนจำนวน 7 อะตอม มีหมู่เมธิลที่ตำแหน่งที่ 7, หมุ่ไฮดรอกซิลในตำแหน่งที่ 4 (สำหรับปราวาสแตตินและ active form ของโลวาสแตติน, ซิมวาสแตติน, และแมวาสแตติน จะถูกเปลี่ยนแปลงโดยปฏิกิริยาไฮโดรไลสิสได้เป็น β-hydroxy carboxylic acid)<ref name=A060>{{cite book|author=Alfred Zejc, and Maria Gorczyca|title=Chemia leków|place=Warszawa, Poland|publisher=PZWL|date=2008|page=418-21|isbn=9788320036527}}</ref> ส่วนโครงสร้างหลักของสแตตินที่ได้จากการสังเคราะห์ ได้แก่ อะโทวาสแตตินมีโครงสร้างหลักเป็นวงไพร์โรล (pyrrole), ฟลูวาสแตตินมีโ๕รงสร้างหลักเป็น[[อินโดล|วงอินโดล]] (indole), เวอริวาสแตตินมีโครงสร้างหลักเป็นวงไพริดีน (pyridine), โรสุวาสแตตินมีโครงสร้างหลักเป็นวงไพริมิดีน (pyrimidine) และปราวาสแตตินมีโครงสร้างเป็นวงควิโนโลน (quinolone) <ref name=A060/><ref name=A061>{{cite journal|author=P. Alagona|title=Pitavastatin: evidence for its place in treatment of hypercholesterolemia|year=2010|url=https://www.dovepress.com/pitavastatin-evidence-for-its-place-in-treatment-of-hypercholesterolem-peer-reviewed-article-CE|journal=Core Evid|volume=5|page=91-105|doi=10.2147/CE.S8008|pmid=21468365}}</ref> ทั้งนี้ นอกจากโครงสร้างของสแตตินทุกชนิดจะมีความคล้ายคลึงกันกับโมเลกุลของ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG- CoA) แล้ว ยังมีความจำเพาะในการจับกับเอนไซม์ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG-CoA) reductase ได้มากกว่า HMG-CoA ถึง 1000 เท่า ซึ่งเมื่อมีการเกิดสารประกอบเชิงซ้อนระหว่างเอนไซม์ดังกล่าวกับยากลุ่มสแตตินแล้วจะเกิดการจับกันอย่างสมบูรณ์แต่ก็สามารถเกิดการผันกลับได้ (competitively and reversibly)<ref name=A062>{[cite journal|author=Dieter Steinhilber, Manfred Schubert-Zsilavecz, Hermann J. Roth|page=437|title=Chemia Medyczna|publisher=MedPharm Polska|year=2012|isbn=9788362283941}}</ref> |
|||
== [[เภสัชวิทยา]] == |
== [[เภสัชวิทยา]] == |
||
=== กลไกการออกฤทธิ์ === |
=== กลไกการออกฤทธิ์ === |
||
รุ่นแก้ไขเมื่อ 23:44, 6 กุมภาพันธ์ 2559

สแตติน (อังกฤษ: Statins หรือ HMG-CoA reductase inhibitors) เป็นกลุ่มของยาลดไขมันในกระแสเลือด (Hypolipidemic agents หรือ Lipid lowering agents) มีโครงสร้างเป็นสารประกอบอินทรีย์ที่ได้ทั้งจากการสังเคราะห์และจากธรรมชาติที่มีฤทธิ์ยับยั้งการทำงานของเอนไซม์ 3-hydroxy-3-methyl-glutaryl coenzyme A reductase (HMG-CoA reductase) ซึ่งเป็นเอนไซม์ในขั้นกำหนดอัตรา (rate limiting enzyme) ที่ทำหน้าที่เปลี่ยน HMG CoA เป็นสารจำพวกคอเลสเตอรอลในกระแสเลือด[2] ดังนั้น จึงมีการนำยากลุ่มสแตตินนี้มาใช้เป็นยาลดระดับคอเลสเตอรอลในกลุ่มคนที่เสี่ยงต่อการเป็นโรคหัวใจและหลอดเลือด (cardiovascular disease) จากภาวะไขมันสูงกว่าปกติ ทั้งในรูปแบบการใช้สแตตินเพียงชนิดเดียวหรือใช้ร่วมกับยาลดไขมันในกระแสเลือดกลุ่มอื่นๆ
อย่างไรก็ตาม ความเสี่ยงต่อโรคหัวใจและหลอดเลือดที่ลดลงในผู้ที่ใช้สแตตินนั้นไม่ได้เป็นผลมาจากการลดระดับคอเลสเตอรอลในกระแสเลือดเพียงอย่างเดียว หากแต่มาจากฤทธิ์ของยาต่อระบบหัวใจและหลอดหลายอย่างรวมกัน ที่เรียกว่า ไพลโอทรอปิกเอฟเฟกต์ (pleiotropic effect) โดยเฉพาะอย่างยิ่ง ฤทธิ์ในการลดการอักเสบ เพิ่มความคงตัวของคราบพลัคไขมันที่เกาะอยู่ในผนังหลอดเลือด (atherosclerotic plaques) รวมทั้งผลจากการรบกวนกระบวนการแข็งตัวของเลือด (coagulation and fibrinolysis system)[2]
สมาชิกในกลุ่มสแตติน

มีดังนี้
- อะโทวาสแตติน (atorvastatin-Lipitor®)
- ฟลูวาสแตติน (fluvastatin-Lescol®)
- โลวาสแตติน (lovastatin-Mevacor®, Altocor®, not marketed in the UK)
- ปราวาสแตติน (pravastatin-Pravachol®, Selektine®, Lipostat®)
- โรสุวาสแตติน (rosuvastatin-Crestor®)
- ซิมวาสแตติน (simvastatin-Zocor®, Lipex®)
- เซอริวาสแตติน (cerivastatin-Lipobay®, Baycol®)
- พิทาวาสแตติน (pitavastatin - Livalo®)
- เมวาสแตติน (Compactin, ML-236B)
- ยาผสมระหว่าง อีเซทิไมบ์ และ ซิมวาสแตติน (ezetimibe-Vytorin®)
การแบ่งประเภท


ยาลดไขมันในกระแสเลือดกลุ่มสแตตินนี้มีทั้งชนิดที่ได้มาจากธรรมชาติ, กึ่งสังเคราะห์, หรือบางชนิดได้จากการสังเคราะห์ขึ้นเองภายในห้องปฏิบัติการ โดยสแตตินที่ได้มาจากธรรมชาติ ได้แก่ โลวาสแตติน, เมวาสแตติน, และ ปราวาสแตติน [3]สแตตินกึ่งสังเคราะห์ ได้แก่ ซิมวาสแตติน ซึ่งได้จากสารที่เกิดขึ้นจากกระบวนการสร้างโลวาสแตติน แต่ในปัจจุบันพบว่าเชื้อ Escherichia coli ที่มีการสร้างเอนไซม์ acetyltransferase มากเกินไป ส่วนสแตตินชนิดที่เหลือ คือ อะโทวาสแตติน, เซอริวาสแตติน, ฟลูวาสแตติน, โรสุวาสแตติน,และ พิทาวาสแตติน ล้วนแล้วแต่ได้จากการสังเคราะห์ขึ้นในห้องปฏิบัติการเท่านั้น[3][4]
ทั้งนี้ ยาลดไขมันในกระแสเลือดกลุ่มสแตตินที่ได้จากธรรมชาตินั้น ส่วนใหญ่แล้วมักได้จากกระบวนการการหมักผลิตภัณฑ์ธรรมชาติจำพวกเห็ดรา เช่น โลวาสแตตินที่ได้จากการหมักเห็ดนางรม (oyster mushroom หรือ Pleurotus ostreatus)[5] และจากการหมักข้าวแดงจากเชื้อราโมแนสคัส (Red Yeast Rice)[6][7][8][9]
สแตตินที่ได้จากเชื้อรา
ในปัจจุบัน ยากลุ่มสแตตินนั้นสามารถถูกสร้างได้โดยเห็ดราหลายชนิด ได้แก่ Aspergillus terreus, บางสายพันธ์ของตระกูล Monascus, Penicillium, Doratomyces, Eupenicillinum, Gymnoascus, Hypomyces, Paecilomyces, Phoma, Trichoderma และ Pleurotis ในกรณีการผลิตปราวาสแตติน ในระดับอุตสาหกรรมนั้นจะใช้วิธีการเปลี่ยนแปลงโครงสร้างของเมวาสแตติน โดยกระบวนการทางชีวภาพ (bioconversion) ถึงแม้ว่าปราวาสแตตินจะสามารถสร้างขึ้นได้จากเห็ดราบางสายพันธ์ในตระกูล Aspergillus และ Monascus ก็ตาม[3] ตารางต่อไปนี้เป็นตารางที่แสดงถึงสายพันธ์ของเห็ดราที่สามารถสร้างสแตตินได้[3]
| ชนิดของสแตติน | สายพันธ์ของเห็ดรา |
|---|---|
| เมวาสแตติน |
Penicillium citrinum |
| โลวาสแตติน |
Monascus rube |
| ปราวาสแตติน |
Aspergillus sp. |
สแตตินที่ได้จากผลิตภัณฑ์อาหาร
นอกจากโลวาสแตตินจะถูกสร้างได้จากเชื้อราบางสายพันธ์ดังแสดงในตารางดังข้างต้นแล้ว ยาดังกล่าวยังสามารถถูกสร้างได้จากเห็ดนางรม (Pleurotus ostreatus) วึ่งพบได้ทั่วไปในธรรมชาติและมีการผลิตเชิงอุตสาหกรรมเพื่อเป็นส่วนประกอบของอาหารหลายชนิด โดยเห็ดนางรมที่พบในธรรมชาตินั้นสามารถพบได้ทั่วไปแทบทุกส่วนของภาคพื้นทวีป ยกเว้นในแอนตาร์กติกา โดยมักพบเห็ดสายพันธ์ดังกล่าวขึ้นตามลำต้นของต้นไม้ที่ตายแล้ว นอกจากนั้นอาจพบขึ้นได้ตามกองฟางข้าว, ข้าวโพด, หรือธัญพืชชนิดอื่นๆได้[5][10] นอกเหนือจากนั้น การหมักข้าวแดงจากเชื้อราโมแนสคัส (Red Yeast Rice) ก็ถือเป็นอีกวิธีหนึ่งที่ใช้ในการสร้างโลวาสแตติน ซึ่งทำได้ดดยการหมักข้าวด้วยเชื้อราสายพันธ์ Monascus purpureus [6][7][8][9] ซึ่งเป็นสายพันธ์ที่พบได้ตามธรรมชาติในอาหารพื้นเมืองของจีน เช่น เป็ดปักกิ่ง (Peking Duck) เป็นต้น[11][12]
ประวัติการค้นพบ
การศึกษาค้นคว้าเกี่ยวกับโรคหลอดเลือดแข็ง

ในปี คศ. 1575 นายแพทย์และนักกายวิภาคศาสตร์ชาวอิตาลีชื่อ Gabrielle Falloppio ค้นพบการเปลี่ยนแปลงพยาธิสภาพของหลอดเลือดเป็นครั้งแรก โดยพบการสะสมของหินปูนบริเวณผนังหลอดเลือด ซึ่งมีความสัมพันธ์กับการเกิดการเสื่อมสลายของกระดูก (bone degeneration)[15] ส่วนการเกิดคราบพลัคเกาะบริเวณผนังหลอดเลือดนั้นได้ถูกอธิบายไว้เป็นครั้งแรกในช่วงศตวรรษที่ 17 โดยนักกายวิภาคศาสตร์ชาวสวิสเซอร์แลนด์ 2 คน ชื่อ Johann Conrad Brunner และ Albrecht von Haller[16] และต่อมาในปี คศ. 1799 Caleb Hillier Parry นายแพทย์ชาวอังกฤษพบว่าการเกิดโรคกล้ามเนื้อหัวใจขาดเลือด (ischemic heart disease) อาจมีความสัมพันธ์กับการเกิดโรคหลอดเลือดหัวใจแข็ง (coronary atherosclerosis)[15][17][18] จากนั้นก็เริ่มมีการใช้ศัพท์ทางการแพทย์ว่า arteriosclerosis เพื่อใช้แทนความผิดปกติของหลอดเลือดในรูปแบบดังกล่าว[19] ครั้งแรกในปี คศ. 1835 โดยศัลยแพทย์ชาวฝรั่งเศส ชื่อ Jean Lobstein[20], ปี คศ. 1904 โดย Felix Marchand พยาธิแพทย์ชาวเยอรมนี[21] และต่อมาในปี คศ. 1843 Julius Vogel แพทย์ชาวเยอรมนีได้ค้นพบว่าส่วนประกอบหลักของคราบหลักที่เกาะอยู่ตามผนังหลอดเลือดนั้นมักเป็นคอเลสเตอรอล[22] ซึ่งบทบาทของคอเลสเตอรอลต่อการเกิดความผิดปกติของหลอดเลือดในรูปแบบดังกล่าวนั้นถูกค้นพบภายหลังในปี คศ. 1852 และ 1856 โดย Karl von Rokitansky และ Rudolf Virchow ตามลำดับ[16] ในปี คศ. 1913 Nikolai Anichkov พยาธิแพทย์ชาวรัสเซีย ได้ทำการศึกษาถึงความความสัมพันธ์ระหว่างคอเลสเตอรอลกับการเกิดโรคหลอดเลือดแข็งในสัตว์ทดลองที่ได้รับการเหนี่ยวนำให้มีภาวะคอเลสเตอรอลในเลือดสูง ผลการทดลองพบว่าสัตว์ทดลองเหล่านั้นเกิดโรคหลอดเลือดแข็งดังเช่นสมมติฐานที่ตั้งไว้[23]
ในการศึกษาวิจัยในประเด็นที่เชื่อกันว่า การเกิดโรคหลอดเลือดแข็งนั้นถือเป็นเรื่องปกติที่เกิดขึ้นได้จากการเสื่อมถอยตามธรรมชาติของร่างกายมนุษย์เมื่อมีอายุมากขึ้นและไม่มีวิธีการใดที่จะรบกวนการเกิดกระบวนการดังกล่าวได้นั้นยังคงไม่มีการศึกษาวิจัยเพิ่มเติม จนกระทั่งในช่วงต้นทศวรรษที่ 40[24] ในปี คศ. 1949 John Gofman ได้ค้นพบไลโปโปรตีนคอเลสเตอรอลชนิดความเข้มข้นต่ำ (low-density lipoprotein; LDL) ในกระแสเลือด จากนั้นอีกไม่กี่ปีถัดมา Gofman ก็ได้ค้นพบความสัมพันธ์ระหว่างการมีระดับ LDL ในกระแสเลือดสูงกับการเกิดโรคหลอดเลือดหัวใจ (coronary heart disease)[23] จากนั้นในปี คศ. 1959 สถานบันวิจัยเซลล์ชีววิทยาและพันธุศาสตร์ระดับโมเลกุลมักซ์ พลังค์ (Max Planck Institute of Molecular Cell Biology and Genetics; MPI-CBG) ในเยอรมนีได้ค้นพบว่าเอนไซม์ HMG-CoA reductase นั้นเป็นเอนไซม์ที่มีบทบาทสำคัญในกระบวนการการสังเคราะห์คอเลสเตอรอลของร่างกายมนุษย์[25] และต่อมาในปี คศ. 1961 จากการศึกษาวิจัยที่ตีพิมพ์ในวารสารทางการแพทย์ฉบับหนึ่งที่มีชื่อการศึกษาว่า Framingham study (Framingham Heart Study) ได้ค้นพบว่า การมีระดับคอเลสเตอรอลในกระแสเลือดที่สูงกว่าปกตินั้นถือเป็นอีกหนึ่งความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจ (cardiovascular diseases)[26][27] หลังจากนั้นไม่นาน เอกสารตีพิมพ์ของสมาคมโรคหัวใจแห่งสหรัฐอเมริกา (American Heart Association) ได้ยืนยันถึงความสัมพันธ์ดังกล่าวและให้คำแนะนำเกี่ยวกับการควบคุมอาหารในผู้ที่มีความเสี่ยงต่อการเกิดโรคหลอดเลือดหัวใจสูง [23] อย่างไรก็ตาม ในช่วงทศวรรษที่ 60 ได้มีการค้นพบในประเด็นดังกล่าวเพิ่มเติมว่า ถึงแม้จะมีการควบคุมการรับประทานอาหารเป็นอย่างดี ร่างกายก็ยังสามารถสร้างคอเลสเตอรอลเพิ่มขึ้นได้ เพื่อให้เพียงพอต่อความต้องการของร่างกายได้โดยผ่านกระบวนการการเพิ่มการทำงานของเอนไซม์ที่ใช้สังเคราะห์คอเลสเตอรอลในตับ[28] และในช่วงนั้น บทบาทของการใช้ยาลดระดับไขมันในกระแสเลือดเพื่อลดอัตราการเสียชีวิตและอัตราการเกิดความพิการจากโรคหลอดเลือดหัวใจนั้นยังสรุปได้ไม่แน่ชัดและยังคงเป็นเพียงการตั้งสมมติฐานที่ัยงไม่มีการพิสูจน์ให้เห็นได้เด่นชัด[29] จนกระทั่งในปี คศ. 1984 การศึกษาวิจัยที่มีชื่อว่า LRC-CPPT ได้ค้นพบว่า การลดลงของระดับ LDL ในกระแสเลือดนั้นสามารถลดอัตราการเสียชีวิตและอัตราการเกิดความพิการจากโรคหลอดเลือดหัวใจในผู้ป่วยชายที่มีระดับ LDL ในกระแสเลือดสูงได้[30]
การค้นพบยากลุ่มสแตติน

ในปี คศ. 1973 เอริกะ เอ็นโดะ (Akira Endo) นักชีวเคมีชาวญี่ปุ่น ได้ทำการคัดแยกสารประกอบต่างๆที่ได้จากเชื้อจุลชีพมากกว่า 6000 ชนิด โดยเฉพาะกลุ่มของเชื้อรา และพบว่าสารประกอบ ML-236B (เมวาสแตติน) ที่ถูกสร้างโดยเชื้อ Penicillium citrinum นั้นมีคุณสมบัติในการลดระดับคอเลสเตอรอลและ LDL ในกระแสเลือดทั้งในสัตว์ทดลองและในมนุษย์ แต่การศึกษาถึงผลของสารดังกล่าวในสัตว์ทดลองต่อมาในภายหลังพบว่ามีความเป็นพิษค่อนข้างสูง[28][31] ในปี คศ. 1976 นักวิทยาศาสตร์ชาวอังกฤษกลุ่มหนึ่งก็สามารถแยกสารประกอบที่มีชื่อว่า คอมเพคติน (Compactin) ได้จากสารเมทาบอไลต์ของเชื้อรา Penicillium brevicompactum ซึ่งต่อมาทราบว่าสารดังกล่าวนั้นเป็นสารชนิดเดียวกันกับเมวาสแตติน อย่างไรก็ตาม นักวิทยาศาสตร์กลุ่มดังกล่าวนั้นมุ่งเน้นศึกษาคุณสมบัติในการต้านเชื้อราของสารที่ค้นพบเป็นหลัก ไม่ได้มุ่งเน้นศึกษาฤทธิ์ในการยับยั้งเอนไซม์ HMG-CoA reductase แต่อย่างใด[32] ต่อมาในปี คศ. 1978 คณะศึกษาของ Alfred Alberts ได้ค้นพบสารชนิดหนึ่งที่มีโครงสร้างคล้ายคลึงกับสารประกอบ ML-236B ที่ได้จากกระบวนการการหมักของรา Aspergillus terreus ซึ่งต่อมาสารดังกล่าวถูกเรียกชื่อว่า Mevinolin[33][34] และในช่วงเวลาเดียวกันนี้เอง เอริกะ เอ็นโดะ ก็สามารถคัดแยกสารประกอบที่มีชื่อว่า Monacolin K ซึ่งมีกลไกออกฤทธิ์คล้ายคลึงกับสแตติน ได้จากรา Monascus ruber จากนั้นในปี 1979 เอ็นโดะก็ได้รับสิทธิบัตรในการผลิตสารดังกล่าว และในช่วงปลายปีนั้น ก็ได้มีการค้นพบว่า โดยที่จริงแล้ว Monacolin K และ Mevinolin นั้นเป็นสารประกอบชนิดเดียวกัน ซึ่งเป็นที่รู้จักกันดีในปัจจุบันภายใต้ชื่อว่า โลวาสแตติน[34]
การพัฒนายากลุ่มสแตติน
ในปี คศ. 1987 ได้มีการผลิต โลวาสแตติน เพื่อจำหน่ายเชิงการค้าเป็นครั้งแรก ภายใต้ชื่อการค้า Mevacor[33] ของบริษัท Merck & Co. (หรือ Merck Sharp & Dohme, MSD สำหรับในประเทศอื่นนอกเหนือจากสหรัฐอเมริกาและแคนาดา) ซึ่งสแตตินชนิดแรกที่ถูกผลิตขึ้นในเชิงอุตสาหกรรมการค้า[35] และต่อมาไม่นานนัก บริษัท ไดอิจิ ซังเคียว (Daiichi Sankyo) ซึ่งเป็นผู้ค้นพบเมวาสแตติน ได้พัฒนาสแตตินชนิดใหม่ซึ่งเป็นอนุพันธ์ของเมวาสแตตินขึ้นมา มีชื่อว่า ปราวาสแตติน ซึ่งมีความแรงและความจำเพาะในการออกฤทธิ์มากกว่าสารต้นแบบเดิม[36] และถูกนำออกจำหน่ายในญี่ปุ่นภายใต้ชื่อการค้า Mevalotin ในปี คศ. 1988 และปี คศ. 1991 ในสหรัฐอเมริกา ภายใต้ชื่อการค้า Pravachol[37] และจากนั้นอีก 2 เดือนถัดมา ซิมวาสแตติน ภายใต้ชื่อการค้า Zocor ก็ถูกผลิตออกวางจำหน่ายในท้องตลาด[38] ส่วนสแตตินที่ได้จากการสังเคราะห์ชนิดแรกที่ถูกผลิตออกจำหน่ายเชิงการค้า คือ ฟลูวาสแตติน (ชื่อการค้า Lescol) ของบริษัท โนวาร์ติส (Novartis) ในช่วงปี คศ. 1993 และอีก 3 ปีถัดมา บริษัทไฟเซอร์ (Pfizer) ก็ได้ผลิตสแตตินสังเคราะห์อีกชนิดหนึ่งออกจำหน่ายในท้องตลาด คือ อะโทวาสแตติน ภายใต้ชื่อการค้า Lipitor หลังจากนั้นมาเพียงแค่อีก 1 ปี บริษัท เบเยอ่ร์เอจี (Bayer AG) ก็ได้ผลิตสแตตินสังเคราะห์อีกชนิด คือ เซอริวาสแตติน ออกจำหน่ายในท้องตลาด ภายใต้ชื่อการค้า Baycol และ Lipobay [39] ซึ่งต่อมาในวันที่ 8 สิงหาคม คศ. 2001 ตัวยาดังกล่าวถูกทอนทะเบียนออกจากตลาดโดยความสมัครใจของบริษัท (ภายใต้ความเห็นชอบของคณะกรรมการอาหารและยาของสหรัฐอเมริกา) เนื่องจากการใช้ยาดังกล่าวนั้นเพิ่มความเสี่ยงต่อการเกิดอาการข้างเคียงที่รุนแรงคือ การเกิดภาวะกล้ามเนื้อสลายแบบ rhabdomyolysis[39][40] จากนั้น ในปี คศ. 2000 บริษัท โนวาร์ติส (Novartis) ได้มีการวางจำหน่ายยากลุ่มสแตตินชนิดใหม่ คือ ฟลูวาสแตติน ภายใต้ชื่อการค้า Lescol XL[39] และถัดจากนั้นมาอีกแค่ 3 ปี บริษัมโควะ ฟาร์มาซูตคอลส์ (Kowa Pharmaceuticals) ก็ได้มีการผลิตสแตตินตัวใหม่อีก 2 ชนิด ออกจำหน่ายในท้องตลาด คือ พิทาวาสแตติน ภายใต้ชื่อการค้า Livalo และโรสุวาสแตติน ภายใต้ชื่อการค้า Crestor และ AstraZeneca[14]
การศึกษาทางคลินิก
จากข้อมูลการศึกษาทางคลินิกหลายการศึกษาที่มีในปัจจุบันให้ผลสนับสนุนข้อเท็จจริงที่ว่าการใช้ยากลุ่มสแตตินมีผลลดอุบัติการณ์การเกิดโรคหลอดเลือดหัวใจในผู้ที่มีความเสี่ยงต่อการเกิดโรคดังกล่าวสูง ซึ่งรวมไปถึงการลดอัตราการเสียชีวิตจากการเกิดความผิดปกติดังกล่าวด้วย การศึกษาที่สำคัญที่ให้ข้อมูลยืนยันถึงประสิทธิภาพของสแตตินในการเป็นยาป้องกันปฐมภูมิ (primary prevention) ต่อการเกิดโรคหลอดเลือดหัวใจ ได้แก่ การศึกษา WOSCOPS, AFCAPS / TEXCAPS, HPS และ JUPITER ส่วนการศึกษาที่ให้ข้อมูลยืนยันถึงประสิทธิภาพของสแตตินในการเป็นยาป้องกันทุติยภูมิ (secondary prevention) ต่อการเกิดโรคหลอดเลือดหัวใจ ได้แก่ การศึกษา 4S, LIPID และ CARE และการศึกษาที่ให้ผลสนับสนุนถึงประสิทธิภาพของการใช้สแตตินร่วมกับยาลดไขมันในกระแสเลือดชนิดอื่น ได้แก่ การศึกษา ACCORD study และ LIPID SHARP ซึ่งรายละเอียดของแต่ละการศึกษาดังแสดงในตารางต่อไปนี้[41][42][43][44][45][46][47][48][49]
| ชื่อย่อ การศึกษา |
ชื่อ การศึกษา |
ระยะเวลา ศึกษา |
ยาที่ใช้ ในการศึกษา |
กลุ่มตัวอย่าง | วารสาร ที่ตีพิมพ์ |
จำนวน กลุ่มตัวอย่าง |
ผลการศึกษา |
| 4S | Scandinavian Simvastatin Survival Study |
5 ปี | ซิมวาสแตติน |
|
Lancet[41] | 4444 |
|
| LIPID | Long term Intervention with Pravastatin in Ischemic Disease |
6 ปี | ปราวาสแตติน |
|
NEJM[42] | 9014 |
|
| CARE | Cholesterol And Recurrent Events |
5 ปี | ปราวาสแตติน |
|
NEJM[43] | 4159 |
|
| WOSCOPS | West Of Scotland Coronary Prevention Study |
5 ปี | ปราวาสแตติน |
|
NEJM[44] | 6595 |
|
| TEXCAPS | Air Force/Texas Coronary Atherosclerosis Prevention Study |
5 ปี | โลวาสแตติน |
|
American Journal of Cardiology[45] |
6605 |
|
| HPS | Heart Protection Study of cholesterol lowering with simvastatin |
5 ปี | ซิมวาสแตติน |
|
Lancet[46] | 20,536 |
|
| JUPITER | Justification for the Use of Statins in Primary Prevention: An Intervention Trial Evaluating Rosuvastatin trial |
2 ปี | โรสุวาสแตติน |
|
NEJM[47] | 17,802 |
|
| ACCORD LIPID | Action to Control Cardiovascular Risk in Diabetes Lipid Trial |
5 ปี | ซิมวาสแตติน ฟีโนไฟเบรต |
|
NEJM[48] | 5518 |
|
| SHARP | Study of Heart and Renal Protection |
5 ปี | ซิมวาสแตติน อีเซทิไมบ์ |
|
Lancet[49] | 9270 |
|
โครงสร้าง

โครงสร้างหลักของสแตตินที่ได้จากธรรมชาติ (โลวาสแตติน, ปราวาสแตติน, ซิมวาสแตติน, รวมไปถึงเมวาสแตตินที่ยังไม่มีการนำมาใช้ในทางคลินิก) จะมีโครงสร้างเป็น hydrogenated naphthalene ที่ประกอบไปด้วยคาร์บอนจำนวน 7 อะตอม มีหมู่เมธิลที่ตำแหน่งที่ 7, หมุ่ไฮดรอกซิลในตำแหน่งที่ 4 (สำหรับปราวาสแตตินและ active form ของโลวาสแตติน, ซิมวาสแตติน, และแมวาสแตติน จะถูกเปลี่ยนแปลงโดยปฏิกิริยาไฮโดรไลสิสได้เป็น β-hydroxy carboxylic acid)[51] ส่วนโครงสร้างหลักของสแตตินที่ได้จากการสังเคราะห์ ได้แก่ อะโทวาสแตตินมีโครงสร้างหลักเป็นวงไพร์โรล (pyrrole), ฟลูวาสแตตินมีโ๕รงสร้างหลักเป็นวงอินโดล (indole), เวอริวาสแตตินมีโครงสร้างหลักเป็นวงไพริดีน (pyridine), โรสุวาสแตตินมีโครงสร้างหลักเป็นวงไพริมิดีน (pyrimidine) และปราวาสแตตินมีโครงสร้างเป็นวงควิโนโลน (quinolone) [51][52] ทั้งนี้ นอกจากโครงสร้างของสแตตินทุกชนิดจะมีความคล้ายคลึงกันกับโมเลกุลของ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG- CoA) แล้ว ยังมีความจำเพาะในการจับกับเอนไซม์ 3-hydroxy-3-methylglutaryl-coenzyme A (HMG-CoA) reductase ได้มากกว่า HMG-CoA ถึง 1000 เท่า ซึ่งเมื่อมีการเกิดสารประกอบเชิงซ้อนระหว่างเอนไซม์ดังกล่าวกับยากลุ่มสแตตินแล้วจะเกิดการจับกันอย่างสมบูรณ์แต่ก็สามารถเกิดการผันกลับได้ (competitively and reversibly)[53]
เภสัชวิทยา
กลไกการออกฤทธิ์
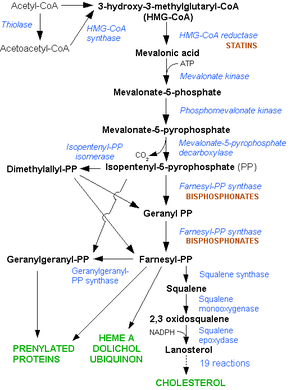
สแตตินออกฤทธ์ยับยั้งเอนไซม์ เอชเอ็มจี-โคเอ รีดักเทส (HMG-CoA reductase) ในกระบวนการสังเคราะห์คอเลสเตอรอลที่ตับ ซึ่งมีการผลิตคอเลสเตอรอลประมาณ 70% ของคอเลสเตอรอลทั้งหมดในร่างกาย
ข้อบ่งใช้
ยาในกลุ่มสแตตินเป็นยาลดคอเลสเตอรอล โดยเฉพาะคอเลสเตอรอล ชนิด แอลดีแอล คอเลสเตอรอล(LDL-cholesterol หรือ "คอเลสเตอรอล เลว") ซึ่งมีอยู่ประมาณ 30-50 % อย่างไรก็ดี สแตตินมีฤทธิ์น้อยกว่ายาในกลุ่มไฟเบรต (fibrates) ในการออกฤทธิ์ลดไตรกลีเซอไรด์ (triglyceride) และเพิ่มปริมาณเอชดีแอล คอเลสเตอรอล (HDL-cholesterol หรือ "คอเลสเตอรอล ดี")
ในงานวิจัยผลของการใช้สแตตินป้องกัน โรคหัวใจโคโรนารี (coronary heart disease) และ กล้ามเนื้อหัวใจขาดเลือด (myocardial infarction) พบว่ามีผลข้างเคียง ดังนี้
- การอักเสบ (inflammation)
- โรควิกลจริตที่มีจิตเสื่อม (dementia)
- เนื้องอก (neoplasm-tumors)
ประสิทธิภาพ
กราฟต่อไปนี้แสดงประสิทธิภาพในการลดระดับไลโปโปรตีนคอเลสเตอรอลชนิดความหนาแน่นต่ำ (แสดงด้วยเส้นกราฟสีฟ้า), ระดับคอเลสเตอรอลรวม (แสดงด้วยเส้นกราฟสีน้ำตาล) และระดับไตรกลีเซอรได์ (แสดงด้วยเส้นกราฟสีเขียว)ในกระแสเลือดของยากลุ่มสแตตินแต่ละชนิดในขนาดความแรงต่างๆ โดยเปรียบเทียบกับค่าพื้นฐานที่ยังไม่ได้รับการรักษาด้วยยา
|
กราฟต่อไปนี้แสดงประสิทธิภาพในการเพิ่มระดับไลโปโปรตีนคอเลสเตอรอลชนิดความหนาแน่นสูง (HDL cholesterol) ในกระแสเลือดของยากลุ่มสแตตินแต่ละชนิดในขนาดความแรงต่างๆ โดยเปรียบเทียบกับค่าพื้นฐานที่ยังไม่ได้รับการรักษาด้วยยา
|
อ้างอิง
- ↑ Istvan ES and Deisenhofer J (2001). "Structural mechanism for statin inhibition of HMG-CoA reductase". Science. 292 (5519): 1160-1164. doi:10.1126/science.1059344. PMID 11349148.
- ↑ 2.0 2.1 Friesen JA and Rodwell VW (2004). "The 3-hydroxy-3-methylglutaryl coenzyme-A (HMG-CoA) reductases" (PDF). Genome Biol. 5 (11): 248. doi:10.1186/gb-2004-5-11-248.
- ↑ 3.0 3.1 3.2 3.3 Gullo V and Demain AL (2003). Statins Fermentation Products for Cholesterol Control in Humans. CRC Press. p. 435-42. ISBN 9781439891674.
{{cite book}}: ไม่รู้จักพารามิเตอร์|in=ถูกละเว้น (help) - ↑ 4.0 4.1 Banach M, Filipiak KJ, and Opolski G (2013). Aktualny stan wiedzy na temat statyn. Poznań. p. 384-385. ISBN 978-83-63622-21-3.
{{cite book}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า :|in=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 5.0 5.1 Gunde-Cimerman N and Cimerman A (1995). "Pleurotus Fruiting Bodies Contain the Inhibitor of 3-Hydroxy-3-Methylglutaryl-Coenzyme A Reductase—Lovastatin". Experimental Mycologyl. 19 (1): 1-6. doi:10.1006/emyc.1995.1001. PMID 7614366.
- ↑ 6.0 6.1 Liu J, Zhang J, Shi Y, Grimsgaard S, Alraek T, and Fønnebø V (2006). "Chinese red yeast rice (Monascus purpureus) for primary hyperlipidemia: a meta-analysis of randomized controlled trials" (PDF). Chinese Medicinel. 1 (4): 1-13. doi:10.1186/1749-8546-1-4.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 7.0 7.1 U.S. Food and Drug Administration (2007). "FDA Warns Consumers to Avoid Red Yeast Rice Products Promoted on Internet as Treatments for High Cholesterol Products found to contain unauthorized drug". สืบค้นเมื่อ February 2, 2016.
- ↑ 8.0 8.1 Official Journal of the European Union (March 6, 2014). "ROZPORZĄDZENIE KOMISJI (UE) NR 212/2014 z dnia 6 marca 2014 r. zmieniające rozporządzenie (WE) nr 1881/2006 w odniesieniu do najwyższych dopuszczalnych poziomów zanieczyszczenia „cytrynina" w suplementach diety na bazie ryżu poddanego fermentacji grzybami Monascus purpureus". สืบค้นเมื่อ February 2, 2016.
- ↑ 9.0 9.1 OSOZ. "ArmoLipid". สืบค้นเมื่อ February 2, 2016.
- ↑ Marian Gapiński, Wanda Woźniak, Mirosława Ziombra (1992). Boczniak. Poznań, Poland: Państwowe Wydawnictwo Rolnicze i Leśne. p. 7-10. ISBN 83-09-01572-0.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Apteka Stlonik (July 29, 2014). "Armolipid tabletki na cholesterol 20tabletek". สืบค้นเมื่อ February 6, 2016.
- ↑ Medycyna Praktyczna (July 29, 2014). "Rola monakoliny w farmakoterapii dyslipidemii". สืบค้นเมื่อ February 6, 2016.
- ↑ Frost & Sullivan Market Insight (June 22, 2000). "Japanese Antihyperlipidemic Market: New Statin Products and Their Marketing Strategies". สืบค้นเมื่อ February 6, 2016.
- ↑ 14.0 14.1 Mukhtar RY, Reid J, and Reckless JP (2005). "Pitavastatin". Int J Clin Pract. 59 (2). doi:10.1111/j.1742-1241.2005.00461.x. PMID 15854203.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 15.0 15.1 Hanke H, Lenz C, and Finking G (2001). "The discovery of the pathophysiological aspects of atherosclerosis--a review". Acta Chir Belg. 101 (4): 162-9. PMID 11680058.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 16.0 16.1 Izabela Sokoluk. Rola statyn w zapobieganiu i leczeniu chorób układu krążenia. Medycyna Rodzinna. p. 219-26. ISSN 1731-2523. สืบค้นเมื่อ February 6, 2016.
- ↑ Parry CH (1799). An inquiry into the symptoms and causes of the syncope anginosa, commonly called angina pectoris : illustrated by dissections. London: Printed by R. Cruttwell and sold by Cadell and Davies. p. 1755-822.
- ↑ Fay Bound Alberti (2008). "Angina Pectoris and the Arnolds: Emotions and Heart Disease in the Nineteenth Century" (PDF). Medical History. 52 (2). PMC 2329859. PMID 18458783. สืบค้นเมื่อ February 6, 2016.
- ↑ Barbara Dąbrowska (1997). Podręczny słownik medyczny łacińsko-polski i polsko-łaciński. Warszawa, Polnad: PZWL. p. 54. ISBN 83-200-2109-X.
- ↑ Barbara Dąbrowska (1997). Podręczny słownik medyczny łacińsko-polski i polsko-łaciński. Warszawa, Polnad: PZWL. p. 60. ISBN 83-200-2109-X.
- ↑ Renu Virmani, Jagat Narula, Martin B. Leon, James T. Willerson (2008). The Vulnerable Atherosclerotic Plaque: Strategies for Diagnosis and Management. Wiley-Blackwell. p. 6. ISBN 9780470987339.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ World Health Organization (June 4, 2014). "Milestones in knowledge of heart and vascular disorders" (PDF). สืบค้นเมื่อ February 6, 2016.
- ↑ 23.0 23.1 23.2 Daniel Steinberg (2004). "Thematic review series: The Pathogenesis of Atherosclerosis. An interpretive history of the cholesterol controversy: part I". The Journal of Lipid Research. 45: 1583-93. doi:10.1194/jlr.R400003-JLR200. สืบค้นเมื่อ February 6, 2016.
- ↑ Endo A (2010). "A historical perspective on the discovery of statins". Proc Jpn Acad Ser B Phys Biol Sci. 86 (5): 484-93. doi:10.2183/pjab.86.484. PMC 3108295. PMID 20467214.
- ↑ Maciej Banach, Jacek Rysz, Krzysztof J. Filipiak (2009). Simwastatyna. Gdańsk, Poland: Via Medica. p. 2. ISBN 9788375991185.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Tadeusz Fojt, Jan Duława, Andrzej Kurek, Mirosława Janowska i inni (2002). "Czynniki ryzyka chorób układu sercowo--naczyniowego u chorych na nadciśnienie tętnicze i cukrzycę w bardzo zaawansowanym wieku". Diabetologia Doświadczalna i Kliniczna. 2 (4): 303-7. ISSN 1643-3165.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Kannel WB, Dawber TR, Kagan A, and Revotskie N (1961). "Factors of risk in the development of coronary heart disease--six year follow-up experience. The Framingham Study". Ann Intern Med. 55 (1): 33-50. PMID 13751193.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 28.0 28.1 Akira Endo (1992). "The discovery and development of HMG-CoA reductase inhibitors" (PDF). Journal of Lipid Research. 33 (11): 1569-82. PMID 15531278.
- ↑ J. McMichael (1979). "Fats and atheroma: an inquest" (PDF). Br Med J. 1 (6157): 173-5. PMC 1597573. PMID 105776. สืบค้นเมื่อ February 6, 2016.
- ↑ DJ Gordon, J Knoke, JL Probstfield, R Superko, and HA Tyroler (1986). "High-density lipoprotein cholesterol and coronary heart disease in hypercholesterolemic men: the Lipid Research Clinics Coronary Primary Prevention Trial". Circulation. 74: 1217-25. doi:10.1161/01.CIR.74.6.1217. สืบค้นเมื่อ February 6, 2016.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Endo, Akira; Kuroda M.; Tsujita Y. (December 1976). "ML-236A, ML-236B, and ML-236C, new inhibitors of cholesterogenesis produced by Penicillium citrinium". Journal of Antibiotics (Tokyo). 29 (12): 1346–8. doi:10.7164/antibiotics.29.1346. PMID 1010803.
- ↑ Brown, Allan G.; Smale, Terry C.; King, Trevor J.; Hasenkamp, Rainer; Thompson, Ronald H. (1976). "Crystal and molecular structure of compactin, a new antifungal metabolite from Penicillium brevicompactum". J. Chem. Soc., Perkin Trans. 1 (11): 1165–1170. doi:10.1039/P19760001165. PMID 945291.
- ↑ 33.0 33.1 Marcin Bizukojć, Stanisław Ledakowicz (2005). "Biosynteza lowastatyny przez Aspergillus terreus" (PDF). Biotechnologia – monografie (ภาษาGerman). 2 (2): 55-67.
{{cite journal}}: CS1 maint: unrecognized language (ลิงก์) - ↑ 34.0 34.1 Akira Endo (2004). "The origin of the statins". Atherosclerosis Supplements. 5 (3): 125-30. doi:10.1016/j.atherosclerosissup.2004.08.033. PMID 15531285.
- ↑ United States Patent Office. (November 9, 1980). "Hypocholesteremic fermentation products and process of preparation US 4231938 A". สืบค้นเมื่อ February 6, 2016.
- ↑ Y. Kishida, A. Naito, S. Iwado, A. Terahara (1991). "Research and development of pravastatin". Yakugaku Zasshi (ภาษาJapanese). 111 (9): 469-87. PMID 1762049.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) CS1 maint: unrecognized language (ลิงก์) - ↑ Daiichi Sankyo (February 17, 2006). "Future Business Prospects of the Hyperlipidemia Drug Pravastatin in the United States". สืบค้นเมื่อ February 6, 2016.
- ↑ Returns on Pharmaceutical R&D. W. Pharmaceutical R&D: Costs, Risks, and Rewards. Washington, DC: U.S. Congress, Office of Technology Assessment. p. 74. ISBN 0160416582.
- ↑ 39.0 39.1 39.2 Maciej Banach, Krzysztof J. Filipiak, Grzegorz Opolski (2013). Aktualny stan wiedzy na temat statyn. Poznań, Poland. ISBN 9788363622213.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Medycyna Praktyczna (August 9, 2001). "Ceriwastatyna wycofana z obrotu".
- ↑ 41.0 41.1 "Randomised trial of cholesterol lowering in 4444 patients with coronary heart disease: the Scandinavian Simvastatin Survival Study (4S)". Lancet. 344 (8934): 1383-9. 1994. PMID 7968073.
- ↑ 42.0 42.1 The Long-Term Intervention with Pravastatin in Ischaemic Disease (LIPID) Study Group (1998). "Prevention of Cardiovascular Events and Death with Pravastatin in Patients with Coronary Heart Disease and a Broad Range of Initial Cholesterol Levels". N Engl J Med. 339 (19): 1349-57. doi:10.1056/NEJM199811053391902. PMID 9841303.
- ↑ 43.0 43.1 F.M. Sacks, M.A. Pfeffer, L.A. Moye, J.L. Rouleau; และคณะ (1996). "The effect of pravastatin on coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events Trial investigators". N Engl J Med. 335 (14): 1001-9. doi:10.1056/NEJM199610033351401. PMID 8801446.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 44.0 44.1 J. Shepherd, S.M. Cobbe, I. Ford, C.G. Isles; และคณะ (1995). "Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group". N Engl J Med. 333 (20): 1301-7. doi:10.1056/NEJM199511163332001. PMID 7566020.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 45.0 45.1 J.R. Downs, M. Clearfield, S. Weis, E. Whitney; และคณะ (1998). "Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study". JAMA. 279 (20): 1615-22. doi:10.1001/jama.279.20.1615. PMID 9613910.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 46.0 46.1 R. Collins, J. Armitage, S. Parish, P. Sleight; และคณะ (2004). "Effects of cholesterol-lowering with simvastatin on stroke and other major vascular events in 20536 people with cerebrovascular disease or other high-risk conditions". Lancet. 363 (9411): 757-67. doi:10.1016/S0140-6736(04)15690-0. PMID 15016485.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 47.0 47.1 P.M. Ridker, E. Danielson, F.A. Fonseca, J. Genest; และคณะ (2008). "Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein". N Engl J Med. 359 (21): 2195-207. doi:10.1056/NEJMoa0807646. PMID 18997196.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 48.0 48.1 H.N. Ginsberg, M.B. Elam, L.C. Lovato, J.R. Crouse; และคณะ (2010). "Effects of combination lipid therapy in type 2 diabetes mellitus". N Engl J Med. 362 (17): 1563-74. doi:10.1056/NEJMoa1001282. PMID 20228404.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ 49.0 49.1 C. Baigent, M.J. Landray, C. Reith, J. Emberson; และคณะ (2011). "The effects of lowering LDL cholesterol with simvastatin plus ezetimibe in patients with chronic kidney disease (Study of Heart and Renal Protection): a randomised placebo-controlled trial". Lancet. 377 (9784): 2181-92. doi:10.1016/S0140-6736(11)60739-3. PMID 21663949.
{{cite journal}}: ใช้ et al. อย่างชัดเจน ใน|author=(help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Michael B. Bottorff (November 01, 2004). "Safety and Statins: Pharmacologic and Clinical Perspectives - See more at: http://www.ajmc.com/journals/supplement/2004/2004-11-vol10-n3PreventiveMedicine/Nov04-1971pS030-S037#sthash.VZLloQYR.dpuf". สืบค้นเมื่อ February 6, 2016.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|date=(help); แหล่งข้อมูลอื่นใน|title= - ↑ 51.0 51.1 Alfred Zejc, and Maria Gorczyca (2008). Chemia leków. Warszawa, Poland: PZWL. p. 418-21. ISBN 9788320036527.
- ↑ P. Alagona (2010). "Pitavastatin: evidence for its place in treatment of hypercholesterolemia". Core Evid. 5: 91-105. doi:10.2147/CE.S8008. PMID 21468365.
- ↑ {[cite journal|author=Dieter Steinhilber, Manfred Schubert-Zsilavecz, Hermann J. Roth|page=437|title=Chemia Medyczna|publisher=MedPharm Polska|year=2012|isbn=9788362283941}}
- ↑ 54.0 54.1 U.S. Drug and Food Administration (October, 2012). "HIGHLIGHTS OF PRESCRIBING INFORMATION: These highlights do not include all the information needed to use LIPITOR safely and effectively. See full prescribing information for LIPITOR" (PDF). สืบค้นเมื่อ February 4, 2016.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|date=(help) - ↑ 55.0 55.1 U.S. Drug and Food Administration. "BAYCOL® (cerivastatin sodium tablets)" (PDF). สืบค้นเมื่อ February 4, 2016.
{{cite web}}: line feed character ใน|title=ที่ตำแหน่ง 19 (help) - ↑ 56.0 56.1 U.S. Drug and Food Administration (October, 2012). "HIGHLIGHTS OF PRESCRIBING INFORMATION These highlights do not include all the information needed to use Lescol®/Lescol® XL safely and effectively. See full prescribing information for Lescol®/ Lescol® XL. Lescol® (fluvastatin sodium) capsules/ Lescol® XL (fluvastatin sodium) extended-release tablets for oral use. Initial U.S. Approval: 1993/ 2000" (PDF). สืบค้นเมื่อ February 4, 2016.
{{cite web}}: line feed character ใน|title=ที่ตำแหน่ง 38 (help); ตรวจสอบค่าวันที่ใน:|date=(help) - ↑ 57.0 57.1 U.S. Drug and Food Administration. "TABLETS MEVACOR® (LOVASTATIN)" (PDF). สืบค้นเมื่อ February 4, 2016.
- ↑ 58.0 58.1 U.S. Drug and Food Administration. "HIGHLIGHTS OF PRESCRIBING INFORMATION These highlights do not include all the information needed to use LIVALO® safely and effectively. See full prescribing information for LIVALO. LIVALO (pitavastatin) Tabl" (PDF). สืบค้นเมื่อ February 4, 2016.
{{cite web}}: line feed character ใน|title=ที่ตำแหน่ง 38 (help) - ↑ 59.0 59.1 U.S. Drug and Food Administration. "HIGHLIGHTS OF PRESCRIBING INFORMATION These highlights do not include all the information needed to use PRAVACHOL safely and effectively. See full prescribing information for PRAVACHOL. PRAVACHOL (pravastatin sodium) Tablets Initial U.S. Approval: 1991" (PDF). สืบค้นเมื่อ February 4, 2016.
{{cite web}}: line feed character ใน|title=ที่ตำแหน่ง 38 (help) - ↑ 60.0 60.1 U.S. Drug and Food Administration (July, 2014). "HIGHLIGHTS OF PRESCRIBING INFORMATION These highlights do not include all the information needed to use CRESTOR safely and effectively. See full prescribing information for CRESTOR. CRESTOR (rosuvastatin calcium) tablets Initial U.S. Approval: 2003" (PDF). สืบค้นเมื่อ February 4, 2016.
{{cite web}}: line feed character ใน|title=ที่ตำแหน่ง 38 (help); ตรวจสอบค่าวันที่ใน:|date=(help) - ↑ 61.0 61.1 Maciej Banach, Jacek Rysz, Krzysztof J. Filipiak (2009). Simwastatyna. Gdańsk, Germany: Via Medica. p. 10. ISBN 9788375991185.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์)
หนังสือ
- Banach M, Filipiak KJ, and Opolski G (2013). Aktualny stan wiedzy na temat statyn. Poznań. ISBN 978-83-63622-21-3.
{{cite book}}: Cite ไม่รู้จักพารามิเตอร์ว่างเปล่า s:|1=และ|in=(help)CS1 maint: multiple names: authors list (ลิงก์)
















