ผลทางประสาทชีวภาพของการออกกำลังกาย
| ผลทางประสาทชีวภาพ ของการออกกำลังกาย | |
|---|---|
| การบำบัดโดยออกกำลังกาย การแทรกแซงทางการแพทย์ | |
 หญิงวิ่งออกกำลังกาย | |
| ICD-9-CM | 93.19 |
| MeSH | D005081 |
| LOINC: | 73986-2 |
| eMedicine | 324583 |
การออกกำลังกายมีผลมากต่อโครงสร้าง หน้าที่การทำงาน และการรู้คิดของสมอง[1][2][3][4] งานวิจัยในมนุษย์จำนวนมากแสดงว่า การออกกำลังกายแบบแอโรบิก (จากเบาถึงหนักที่ใช้กระบวนการสร้างพลังงานโดยออกซิเจน) โดยอย่างน้อย 30 นาทีทุกวันปรับปรุงการทำงานของสมอง โดยปรับหน้าที่การรู้คิด (cognitive function) การแสดงออกของยีน สภาพพลาสติกทางประสาท (neuroplasticity) และพฤติกรรมที่มีผลดี ผลที่ได้ในระยะยาวรวมทั้งการเกิดเซลล์ประสาท (neurogenesis) ที่เพิ่มขึ้น, การทำงานทางประสาทที่ดีขึ้น (เช่นในการส่งสัญญาณแบบ c-Fos และ BDNF), การรับมือกับความเครียดที่ดีขึ้น, การควบคุมพฤติกรรมที่ดีขึ้น, ความจำชัดแจ้ง (declarative) ความจำปริภูมิ (spatial) ความจำใช้งาน (working) ที่ดีขึ้น, และการปรับปรุงทางโครงสร้างและหน้าที่ของสมองและวิถีประสาทที่สัมพันธ์กับการควบคุมการรู้คิดและความจำ[1][2][3][4][5][6][7][8][9][10] ผลการออกกำลังกายต่อความรู้คิดอาจช่วยการเรียนหนังสือในนักเรียนนักศึกษา เพิ่มผลิตผลการทำงาน ช่วยรักษาการทำงานของสมองในคนแก่ ป้องกันหรือบำบัดความผิดปกติทางประสาทแบบต่าง ๆ และปรับปรุงคุณภาพชีวิตโดยทั่วไป[1][11][12]
คนที่ออกกำลังกายแบบแอโรบิกอย่างสม่ำเสมอ (เช่น วิ่ง เดินเร็ว ว่ายน้ำ และขี่จักรยาน) ได้คะแนนดีกว่าเมื่อตรวจสอบการทำงานทางประสาทจิตวิทยาที่วัดหน้าที่การรู้คิดบางอย่าง เช่น การควบคุมการใส่ใจ การหยุดพฤติกรรมอัตโนมัติเพื่อทำสิ่งที่ได้ผลกว่า (inhibitory control) ความยืดหยุ่นทางการรู้คิด ความจำใช้งานในด้านการอัปเดตและความจุ ความจำชัดแจ้ง ความจำปริภูมิ และความเร็วในการประมวลข้อมูล[1][5][7][9][10]
การออกกำลังกายแบบแอโรบิกยังเป็นยาแก้ซึมเศร้าและยาทำให้ครึ้มใจอีกด้วย[13][14][15][16] ดังนั้น การออกกำลังกายให้สม่ำเสมอจะปรับปรุงอารมณ์และความภูมิใจในตนเอง (self-esteem) ให้ดีขึ้นโดยทั่วไป[17][18]
การออกกำลังกายแบบแอโรบิกให้สม่ำเสมอจะปรับปรุงอาการที่สัมพันธ์กับความผิดปกติของระบบประสาทกลาง (CNS disorder) ต่าง ๆ และสามารถใช้เป็นการรักษาเสริมสำหรับความผิดปกติเหล่านั้น มีหลักฐานที่ชัดเจนถึงประสิทธิผลของการออกกำลังกายเพื่อรักษาโรคซึมเศร้า (MDD)[11][15][19][20] และโรคสมาธิสั้น (ADHD)[21][22] หลักฐานพรีคลินิกและหลักฐานคลินิกที่กำลังออกมาเรื่อย ๆ จำนวนมาก สนับสนุนการรักษาโดยการออกกำลังกายเพื่อรักษาและป้องกันการติดยา[23][24][25][26] งานทบทวนวรรณกรรมที่ตรวจหลักฐานทางคลินิกยังสนับสนุนให้ออกกำลังกายเป็นการรักษาเสริมสำหรับโรคประสาทเสื่อม (neurodegenerative disorder) บางอย่าง โดยเฉพาะโรคอัลไซเมอร์[27][28] และโรคพาร์คินสัน[29][30][31][32] การออกกำลังกายอย่างสม่ำเสมอยังสัมพันธ์กับโอกาสเสี่ยงต่อโรคประสาทเสื่อมที่ต่ำกว่า[30][33] และเสนอให้ใช้เป็นการรักษาเสริมต่อมะเร็งสมองอีกด้วย[34]
ผลระยะยาว
[แก้]สภาพพลาสติกในระบบประสาท
[แก้]Neuroplasticity (สภาพพลาสติกในระบบประสาท) เป็นกระบวนการปรับตัวของเซลล์ประสาทต่อสิ่งรบกวนในช่วงระยะเวลาหนึ่ง และโดยมากเกิดตอบสนองต่อสิ่งเร้าที่ซ้ำ ๆ[35] การออกกำลังกายแบบแอโรบิกเพิ่มการผลิตปัจจัยบำรุงสมอง (neurotrophic factors)[a] (คือ brain-derived neurotrophic factor [BDNF], insulin-like growth factor 1 [IGF-1], vascular endothelial growth factor [VEGF], และ Glial cell line-derived neurotrophic factor [GDNF]) ซึ่งอำนวยปรับปรุงการรู้คิด (cognitive function) และความจำต่าง ๆ โดยโปรโหมตการเกิดหลอดเหลือดในสมอง (angiogenesis) การเกิดเซลล์ประสาทของผู้ใหญ่ (adult neurogenesis)[b] และการปรับเปลี่ยนทางประสาท (neuroplasticity) อย่างอื่น ๆ[2][5][17][37][38]
การออกกำลังกายแบบแอโรบิกอย่างสม่ำเสมอเป็นเวลาหลายเดือนจะทำให้ executive functions ดีขึ้นอย่างสำคัญ และเพิ่มปริมาตรเนื้อเทา (gray matter) ในเขตสมองหลายเขต โดยเฉพาะส่วนที่มีหน้าที่เกี่ยวกับ executive functions[1][5][6][7][9] โครงสร้างทางสมองที่ตอบสนองต่อการออกกำลังกายโดยขยายปริมาตรสูงสุดก็คือ prefrontal cortex, caudate nucleus, และฮิปโปแคมปัส[1][5][6][8] ส่วนที่น้อยลงมาก็คือ anterior cingulate cortex, สมองกลีบข้าง, สมองน้อย และ nucleus accumbens[5][6][8] และส่วน prefrontal cortex, caudate nucleus และ anterior cingulate cortex เป็นโครงสร้างทางสมองแบบโดพามีนและนอร์เอพิเนฟรินที่สำคัญที่สุดที่ควบคุมการรู้คิด[6][39]
การเกิดเซลล์ประสาทใหม่ที่ได้จากการออกกำลังกาย (คือปริมาตรที่เพิ่มขึ้นในเนื้อเทา) ในฮิปโปแคมปัสสัมพันธ์กับความจำปริภูมิ (spatial memory) ที่ดีขึ้นอย่างวัดได้[6][8][18][40] คะแนนฟิตเนสที่สูงกว่า วัดโดยอัตราการใช้ออกซิเจนระดับสูงสุดเมื่อออกกำลังกาย (VO2 max) สัมพันธ์กับ executive function ที่ดีกว่า การประมวลข้อมูลที่เร็วกว่า และปริมาตรเนื้อเทาที่เพิ่มขึ้นในฮิปโปแคมปัส, caudate nucleus, และ nucleus accumbens[1][6] การออกกำลังกายแบบแอโรบิกในระยะยาวยังสัมพันธ์กับการเปลี่ยนแปลงที่คงยืนและมีประโยชน์ที่นอกเหนือจากกรรมพันธุ์ (epigenetic) ที่ปรับปรุงการรับมือกับความเครียด ปรับปรุงการรู้คิด (cognitive function) และเพิ่มการทำงานของเซลล์ประสาท (c-Fos and BDNF signaling)[4][41]
BDNF signaling
[แก้]ผลสำคัญที่สุดอย่างหนึ่งต่อสมองของการออกกำลังกายก็คือการแสดงออกและการสังเคราะห์ BDNF ซึ่งเป็นฮอร์โมน neuropeptide ในสมองและระบบประสาทนอกส่วนกลาง ซึ่งเป็นการส่งสัญญาณเพิ่มขึ้นให้หน่วยรับแบบ tyrosine kinase receptor คือ tropomyosin receptor kinase B (TrkB)[4][42][43] เนื่องจาก BDNF สามารถผ่านตัวกั้นระหว่างเลือด-สมอง (blood-brain barrier) ได้ การสังเคราะห์ BDNF ที่เพิ่มขึ้นก็ยังเพิ่มการส่งสัญญาณแบบ BDNF ในสมองอีกด้วย[37] และสัญญาณที่เพิ่มสัมพันธ์กับความเปลี่ยนแปลงนอกเหนือจากกรรมพันธุ์ จะปรับปรุงการรู้คิด อารมณ์ และความจำ[4][8][17][42]
นอกจากนั้นแล้ว งานวิจัยยังแสดงหลักฐานของบทบาทของ BDNF ในฮิปโปแคมปัสรวมทั้งการเกิดเซลล์ประสาท การเปลี่ยนสภาพของไซแนปส์ (synaptic plasticity) และการฟื้นสภาพทางประสาท[5][42] การออกกำลังกายแบบแอโรบิกหนักระดับปานกลาง-สูง เช่น การวิ่ง การว่ายน้ำ และการขี่จักรยานเพิ่มชีวสังเคราะห์ของ BDNF ในเลือดและในสมองถึง 3 เท่า[4][42][43] ระดับการออกกำลังกายสัมพันธ์ในเชิงบวกกับระดับของ BDNF ที่สูงขึ้นทั้งโดยการสังเคราะห์และการแสดงออกของยีน[4][42][43] งานวิเคราะห์อภิมานเกี่ยวกับผลของการออกกำลังกายต่อระดับ BDNF พบว่า การออกกำลังกายปานกลางอย่างสม่ำเสมอยังเพิ่มระดับ BDNF เมื่อพักอีกด้วย[17]
IGF-1 signaling
[แก้]IGF-1 เป็นเพปไทด์ที่อำนวยผลบางอย่างของ growth hormone โดยออกฤทธิ์ผ่าน IGF-1 receptor เพื่อควบคุมการเติบโตของเนื้อเยื่อและการเปลี่ยนสภาพ[44] ในสมอง IGF-1 ทำหน้าที่เป็นปัจจัยบำรุงสมอง (neurotrophic factor) คล้ายกับ BDNF และมีบทบาทสำคัญในการรู้คิด การเกิดเซลล์ประสาท และการอยู่รอดของเซลล์ประสาท[42][45][46] การออกกำลังกายสัมพันธ์กับระดับที่เพิ่มขึ้นของ IGF-1 ในเลือด ซึ่งปรับสภาพทางประสาท (neuroplasticity) ในสมอง เพราะ IGF-1 สามารถผ่านตัวกั้นเลือด-สมอง และตัวกั้นเลือด-สมองร่วมไขสันหลัง (blood-cerebrospinal fluid barrier) ซึ่งก็คือ Choroid plexus ได้[5][42][44][45] ดังนั้น งานทบทวนวรรณกรรมหนึ่งจึงให้ข้อสังเกตว่า IGF-1 เป็นตัวอำนวยสำคัญของการเกิดเซลล์ประสาทของผู้ใหญ่ที่เป็นผลของการออกกำลังกาย และงานที่สองกำหนดว่า มันเป็นปัจจัยที่เชื่อม "ความฟิตของร่างกาย" กับ "ความฟิตของสมอง"[44][45] ปริมาณ IGF-1 ที่ปล่อยสู่เลือดมีสหสัมพันธ์เชิงบวกกับความแข็งขันและระยะเวลาของการออกกำลังกาย[47]
VEGF signaling
[แก้]VEGF เป็นโปรตีนส่งสัญญาณแบบบำรุงสมอง (neurotrophic) และสร้างหลอดเลือด (angiogenic) ที่ยึดกับตัวรับ tyrosine kinases 2 ประเภท คือ VEGFR1 และ VEGFR2 และมีอยู่ทั้งในเซลล์ประสาทและเซลล์เกลียในสมอง[46] ภาวะขาดออกซิเจน (Hypoxia) ทำให้มีการแสดงออกของยีน VEGF มากขึ้นมีผลป้องกันเซลล์ประสาทที่ขาดออกซิเจน[46] เหมือนกับ BDNF และ IGF-1 การออกกำลังกายมีหลักฐานว่าเพิ่มชีวสังเคราะห์ของ VEGF ในเนื้อเยื่อนอกประสาทส่วนกลางซึ่งสามารถข้ามตัวกั้นเลือด-สมองได้ แล้วโปรโหมตการเกิดเซลล์ประสาทและการเกิดหลอดเหลือดในสมอง[37][38][48] การเพิ่มการส่งสัญญาณโดย VEGF ที่เป็นผลของการออกกำลังกายมีหลักฐานว่าช่วยการไหลเวียนของเลือดในสมอง และมีส่วนให้เกิดเซลล์ประสาทในฮิปโปแคมปัสที่เกิดจากการออกกำลังกาย[5][38][48]
สมองใหญ่ขึ้น
[แก้]งานทบทวนวรรณกรรมที่ตรวจงานสร้างภาพในสมองพบว่า การออกกำลังกายให้สม่ำเสมอจะเพิ่มปริมาตรเนื้อเทาในเขตสมองที่เกี่ยวกับการประมวลความจำ การควบคุมการรู้คิด การเคลื่อนไหว และระบบรางวัล[1][5][6][8] ที่เพิ่มมากที่สุดก็คือ prefrontal cortex, caudate nucleus, และฮิปโปแคมปัส ซึ่งมีส่วนควบคุมการรู้คิดและการประมวลความจำ ในบรรดาหน้าที่การรู้คิดทั้งหลาย[1][6][8][9] นอกจากนั้นแล้ว ทั้งด้านซ้ายขวาของ prefrontal cortex, ฮิปโปแคมปัส และ cingulate cortex จะทำงานร่วมกันเมื่อทำกิจโดยเฉพาะ ๆ (functional connectivity) ในระดับที่สูงกว่า ตอบสนองต่อการออกกำลังกายแบบแอโรบิกอย่างสม่ำเสมอ[1][7] งานทบทวนวรรณกรรม 3 งานแสดงการเพิ่มปริมาตรเนื้อเทาที่ชัดเจนของ prefrontal cortex และฮิปโปแคมปัส ในผู้ใหญ่ปกติที่ออกำลังกายหนักกลาง ๆ เป็นเวลาหลายเดือน[1][6][49] เขตอื่นในสมองที่เพิ่มปริมาตรเนื้อเทาขึ้นปานกลางหรือน้อยกว่าเมื่อสร้างภาพสมองรวมทั้ง anterior cingulate cortex, สมองกลีบข้าง, สมองน้อย และ nucleus accumbens[5][6][8][50]
การออกกำลังกายให้สม่ำเสมอจะช่วยป้องกันการลดขนาดของฮิปโปแคมปัสและความจำที่แย่ลงที่เกิดขึ้นตามธรรมชาติในวัยสูงอายุ[5][6][8] คือ ผู้ใหญ่อายุเกิน 55 ที่อยู่เฉย ๆ จะมีปริมาตรฮิปโปแคมปัสลดลง 1-2% ทุก ๆ ปี[8][51] งานศึกษาสร้างภาพในสมองของผู้ใหญ่ 120 คนแสดงว่า การออกกำลังกายอย่างสม่ำเสมอเพิ่มปริมาตรของฮิปโปแคมปัสข้างซ้าย 2.12% และข้างขวา 1.97% ภายใน 1 ปี[8][51] ส่วนผู้ที่อยู่ในกลุ่มยืดตัวที่เบา ๆ ซึ่งมีระดับฟิตเนสที่ดีเมื่อเริ่มโปรแกรมสูญปริมาตรของฮิปโปแคมปัสน้อยกว่า ซึ่งเป็นหลักฐานว่า การออกกำลังกายช่วยป้องกันการเสื่อมความรู้คิดที่เกี่ยวกับอายุ[51] และโดยทั่วไปแล้ว บุคคลที่ออกกำลังกายมากกว่าในช่วง 1 ปีมีปริมาตรฮิปโปแคมปัสที่ดีกว่าและมีความจำดีกว่า[5][8] การออกกำลังกายแบบแอโรบิกมีหลักฐานว่าช่วยเพิ่มเนื้อขาวใน corpus callosum ด้านหน้า (เป็นส่วนที่ทำให้สมองด้านซ้ายขวาทำงานประสานกันได้) ซึ่งปกติจะฝ่อลงเมื่ออายุมากขึ้น[5][49] หน้าที่ของส่วนสมองต่าง ๆ ที่มีเนื้อเทาใหญ่ขึ้นเพราะการออกกำลังกายรวมทั้ง
- Prefrontal cortex และ Anterior cingulate cortex ซึ่งจำเป็นเพื่อควบคุมพฤติกรรม โดยเฉพาะก็คือในเรื่องความจำใช้งาน การควบคุมการใส่ใจ การตัดสินใจ ความยืดหยุ่นในการรู้คิด การรู้คิดทางสังคม การหยุดพฤติกรรมอัตโนมัติเพื่อทำสิ่งที่ได้ผลกว่า (inhibitory control)[52][53] โดยมีบทบาทในโรคสมาธิสั้น (ADHD) และการติดสิ่งเสพติด[52]
- Nucleus accumbens มีหน้าที่เกี่ยวกับ incentive salience (คือทำให้สิ่งเร้าน่าต้องการ เป็นรูปแบบแรงจูงใจที่สัมพันธ์กับระบบรางวัลและการเสริมแรงเชิงบวก) โดยมีบทบาทในการติดสิ่งเสพติด[54]
- ฮิปโปแคมปัส มีหน้าที่เก็บและทำให้มั่นคงซึ่งความจำชัดแจ้งและความจำปริภูมิ (spatial memory)[6][55] มีบทบาทในโรคซึมเศร้า (MDD)[8]
- สมองน้อย มีหน้าที่ประสานการเคลื่อนไหว (motor coordination) และเรียนรู้การเคลื่อนไหว (motor learning)[56]
- Caudate nucleus มีหน้าที่เกี่ยวกับการเรียนรู้การตอบสนองต่อสิ่งเร้าและการหยุดพฤติกรรมอัตโนมัติเพื่อทำสิ่งที่ได้ผลกว่า (inhibitory control) โดยมีบทบาทในโรคพาร์คินสัน โรคฮันติงตัน และโรคสมาธิสั้น[52][55]
- สมองกลีบข้าง มีหน้าที่รับรู้ความรู้สึกสัมผัส (sensory perception) ความจำใช้งาน และการใส่ใจ[52][57]
การควบคุมการรู้คิดและความทรงจำ
[แก้]ตามบทบาทหน้าที่ของส่วนสมองที่มีปริมาตรเพิ่ม การออกกำลังกายช่วยปรับปรุงด้านต่าง ๆ ของการควบคุมการรู้คิดและความทรงจำ[5][7][9][58][59] โดยเฉพาะก็คือ การออกกำลังกายอย่างสม่ำเสมอช่วยให้ควบคุมการใส่ใจได้ดีขึ้น [c] ให้ประมวลข้อมูลได้ดีขึ้น ปรับปรุงความยืดหยุ่นทางการรู้คิด (เช่น การเปลี่ยนความสนใจจากงานหนึ่งไปยังอีกงานหนึ่ง) การหยุดพฤติกรรมอัตโนมัติเพื่อทำสิ่งที่ได้ผลกว่า (inhibitory control) [d] ความทรงจำใช้งานในด้านการอัปเดตและความจุ [e] ความจำชัดแจ้ง และความจำปริภูมิ[5][6][7][9][10][58][59]
ในผู้ใหญ่ ผลต่าง (effect size) ต่อการรู้คิดใหญ่ที่สุดในเรื่อง executive functions และเล็กน้อยจนถึงปานกลางสำหรับด้านต่าง ๆ ของความจำและความเร็วในการประมวลข้อมูล[1][10] บุคคลที่มีไลฟ์สไตล์แบบอยู่เฉย ๆ มักจะมีการควบคุมการรู้คิดที่เสียหายเทียบกับคนที่ไม่ออกกำลังกายแต่ไม่ชอบอยู่เฉย ๆ[9][58] ความสัมพันธ์แบบกลับกันระหว่างการออกกำลังกายกับการควบคุมการรู้คิดก็พบด้วยเช่นกัน คือ การควบคุมการรู้คิดที่ดีขึ้น เช่น การควบคุมการใส่ใจเป็นต้น จะช่วยให้บุคคลมีแนวโน้มที่จะออกกำลังกาย[9] งานปริทัศน์เป็นระบบต่องานที่ทำในเด็กแสดงว่า เรื่องที่ดีขึ้นเกี่ยวกับ executive functions สามารถเห็นได้หลังจากการออกกำลังกายเพียงครั้งเดียว แต่เรื่องอื่น ๆ (เช่น การควบคุมการใส่ใจ) จะดีขึ้นหลังจากออกกำลังกายอย่างสม่ำเสมอ[59]
ผลระยะสั้น
[แก้]ความเครียดและคอร์ติซอล
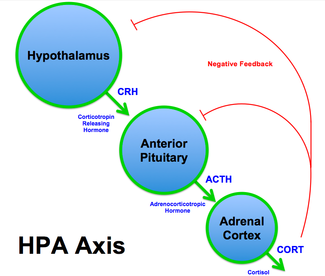
[แก้]"ฮอร์โมนความเครียด" คือ คอร์ติซอล เป็น glucocorticoid ที่ยึดกับหน่วยรับของมัน[61][62][63] ความเครียดทางจิตใจจะเหนี่ยวนำให้ต่อมหมวกไตปล่อยคอร์ติซอลโดยกระตุ้นแกนไฮโปทาลามัส-พิทูอิทารี-อะดรีนัล (HPA axis ดูรูป) ไปตามลำดับเหมือนลูกโซ่[61][62][63] ระดับที่เพิ่มขึ้นของคอร์ติซอลในระยะสั้น ๆ สัมพันธ์กับการปรับปรุงการรู้คิดที่เป็นการปรับตัว เช่น inhibitory control ที่ดีขึ้น[38][62][63] แต่การเพิ่มในระดับสูงหรือเป็นระยะเวลายาวจะทำการควบคุมการรู้คิดให้เสียหาย และมีผลเป็นพิษประสาท (neurotoxic) ต่อสมองมนุษย์[38][58][63] ยกตัวอย่างเช่น ความเครียดเรื้อรังจะลดการแสดงออกของ BDNF ซึ่งมีผลลบต่อปริมาตรของฮิปโปแคมปัสและอาจจะก่ออารมณ์ซึมเศร้า[38][61]
การออกกำลังกายแบบแอโรบิกจะกระตุ้นการหลั่งคอร์ติซอลขึ้นอยู่กับออกหนักแค่ไหน โดยเป็นความเครียดทางกาย [62] แต่นี่ไม่ได้เพิ่มการผลิตคอร์ติซอลในระยะยาวเพราะเป็นการตอบสนองต่อการเสียพลังงานเพียงแค่ชั่วคราว [f][62] บุคคลที่เพิ่งออกกำลังกายจะรับมือความเครียดได้ดีขึ้น[4][38][41] การออกกำลังกายแบบแอโรบิกเพิ่มระดับฟิตเนสทางกายและช่วยลดความไวปฏิกิริยาของ HPA axis และดังนั้นจึงช่วยลดปฏิกิริยาทางชีวภาพต่อความเครียดทางใจในมนุษย์ (คือ ช่วยลดการปล่อยคอร์ติซอล และลดอัตราการเต้นหัวใจที่เป็นการตอบสนอง)[38][64] การออกกำลังกายยังช่วยฟื้นสภาพระดับการแสดงออกและการส่งสัญญาณที่ลดลงของ BDNF ในสมองเนื่องจากความเครียด และดังนั้น จึงมีฤทธิ์ป้องกันโรคที่เกี่ยวกับความเครียดเช่นโรคซึมเศร้า[38][61][64] การออกกำลังกายยังช่วยปล่อยสารสื่อประสาทเช่นเอ็นดอร์ฟิน ซึ่งช่วยลดความรู้สึกไม่ดีที่เกิดจากอารมณ์ซึมเศร้า[65]
ความครึ้มใจ
[แก้]การออกกำลังกายอย่างต่อเนื่องอาจจะก่อความครึ้มใจ (euphoria) ในระยะสั้น ซึ่งเป็นความรู้สึกพอใจ อิ่มอกอิ่มใจ และมีความสุข[13][14][66][67] งานทบทวนวรรณกรรมทางการแพทย์ปัจจุบันชี้ว่า สารครึ้มใจธรรมชาติหลายตัวเป็นตัวให้เกิดความครึ้มใจเมื่อออกกำลังกาย โดยเฉพาะอย่างยิ่งคือสารกระตุ้น phenethylamine, สารกลุ่มโอปิออยด์ คือ เอ็นดอร์ฟิน, และ สารประเภท cannabinoid คือ anandamide[68][69][70][71][72]
สารสื่อประสาท สารควบคุมประสาท และนิวโรเพบไทด์
[แก้]β-Phenylethylamine
[แก้]phenethylamine (ตัวย่อ PEA) เป็น trace amine (TAAR1 agonist) และเป็นสารควบคุมประสาท (neuromodulator) ซึ่งทำงานเหมือนกับแอมเฟตามีนที่มีอยู่ตามธรรมชาติ [g][73][74] การออกกำลังหนักปานกลางจนถึงหนักเป็นเวลา 30 นาทีจะเพิ่มระดับกรดเบตา-ฟีนิลแอซีติก (β-phenylacetic) ในปัสสาวะอย่างมาก กรดเบตา-ฟีนิลแอซีติก เป็นเมแทบอไลต์หลักของ PEA[68][69][70]
งานทบทวนวรรณกรรม 2 งานแสดงงานศึกษาหนึ่ง ที่ระดับเฉลี่ยของกรดเบตา-ฟีนิลแอซีติกในปัสสาวะในช่วง 24 ชม. หลังจากออกกำลังกายหนัก 30 นาที เพิ่มขึ้น 77% จากระดับปกติ[68][69][70] งานแสดงว่า การสังเคราะห์ PEA เพิ่มขึ้นอย่างรวดเร็วระหว่างการออกกำลังกายที่ PEA มีเมแทบอลิซึมอย่างรวดเร็วเนื่องจากมี half-life สั้นเพียงแค่ 30 วินาที[68][69][70][75] ในช่วงที่พักอยู่ นิวรอนประเภท catecholamine จะสังเคราะห์ PEA จาก L-phenylalanine โดยใช้เอนไซม์ Aromatic L-amino acid decarboxylase ในอัตราเดียวกับการสังเคราะห์โดพามีน[75]
สังเกตการณ์นี้ทำให้ทั้งงานดั้งเดิมและงานทบทวนทั้งสองเสนอว่า PEA มีบทบาทสำคัญเพื่ออำนวยอารมณ์ครึ้มในผู้ออกกำลังกาย เพราะทั้ง PEA และแอมเฟตามีนล้วนแต่เป็นสารก่อความครึกครึ้นที่มีฤทธิ์แรง[68][69][70]
เอ็นดอร์ฟิน
[แก้]เอ็นดอร์ฟิน (ย่อมาจากคำอังกฤษว่า "endogenous morphine") เป็นนิวโรเพบไทด์แบบโอปิออยด์ที่เข้ายึดกับตัวรับแบบ μ-opioid receptor ซึ่งมีผลเป็นอารมณ์ครึ้มและการบรรเทาความปวด[71] งานวิเคราะห์อภิมานพบว่า การออกกำลังกายเพิ่มการหลั่งเอ็นดอร์ฟินอย่างสำคัญ ที่มีสหสัมพันธ์กับอารมณ์ที่ดีขึ้น[71] นอกจากนั้นแล้ว เอ็นดอร์ฟินยังช่วยให้นอนหลับดีขึ้นด้วย[76] การออกกำลังกายหนักปานกลางทำให้สังเคราะห์เอ็นดอร์ฟินมากที่สุด ในขณะที่แบบเบาหรือแบบหนักสัมพันธ์กับการสังเคราะห์สารที่น้อยกว่า[71] งานทบทวนวรรณกรรมเกี่ยวกับเอ็นดอร์ฟินกับการออกกำลังกายให้ข้อสังเกตว่า อารมณ์จะดีขึ้นตลอดวันที่เหลือหลังจากการออกกำลังกาย และอารมณ์เป็นสิ่งที่มีสหสัมพันธ์เชิงบวกกับระดับการออกแรงทั่วไปในชีวิตประจำวัน[71] อารมณ์ที่ดีขึ้นเพราะการออกกำลังกายพบทั้งในบุคคลที่นั่งนอนมาก บุคคลที่ออกกำลังกายเพื่อพักผ่อน และคนวิ่งมาราธอน แต่คนที่ออกกำลังกายเพื่อพักผ่อนและคนวิ่งมาราธอนมีอารมณ์ดีขึ้นมากกว่า[71]
อนันดาไมด์
[แก้]Anandamide เป็นสารสื่อประสาทแบบ cannabinoid ที่มีอยู่ในร่างกายและเข้ายึดกับตัวรับ cannabinoid ของเซลล์ประสาท[72] มีหลักฐานว่า การออกกำลังกายแบบแอโรบิกเพิ่มระดับ anandamide ในเลือด ซึ่งเพิ่มมากที่สุดถ้าออกกำลังกายหนักปานกลาง (คือ ที่ ~70-80% ของอัตราการเต้นหัวใจสูงสุด)[72] และระดับที่เพิ่มขึ้นในเลือดสัมพันธ์กับผลทางจิต (psychoactive) เพราะ anandamide สามารถข้ามตัวกั้นเลือด-สมอง และออกฤทธิ์ต่อระบบประสาทกลาง[72] ดังนั้น เพราะ anandamide เป็นสารทำให้ครึ้มใจ และการออกกำลังกายแบบแอโรบิกสัมพันธ์กับอารมณ์ครึ้ม จึงเสนอว่า anandamide มีส่วนอำนวยให้อารมณ์ดีขึ้นชั่วระยะหนึ่งเนื่องจากการออกกำลังกายเพิ่มการสังเคราะห์ของสาร[66][72] ในหนู พิสูจน์แล้วว่า อารมณ์ครึ้มจากการออกกำลังกายบางส่วนขึ้นอยู่กับตัวรับ cannabinoid ในสมอง การขัดขวางไม่ว่าจะโดยยาหรือโดยกรรมพันธุ์ของกระบวนการรับส่งสัญญาณของเซลล์ผ่านตัวรับ cannabinoid จะยับยั้งผลระงับปวดและผลลดความวิตกกังวลของการวิ่ง[77]
กลูตาเมต
[แก้]กลูตาเมตเป็นสารเคมีประสาทที่สามัญที่สุดอย่างหนึ่งในสมอง เป็นสารสื่อประสาทแบบกระตุ้น (excitatory) ที่มีบทบาทในกิจต่าง ๆ ของสมองรวมทั้งการเรียนรู้และความจำ[78] การออกกำลังกายทำการส่งสัญญาณร่วมกันของกลูตาเมตกับโดพามีนให้เป็นเรื่องปกติใน nucleus accumbens[23] งานทบทวนวรรณกรรมในเรื่องผลของการออกกำลังกายต่อการทำงานของหัวใจ-ประสาทในระยะพรีคลินิกให้ข้อสังเกตว่า การปรับสภาพทางประสาท (neuroplasticity) ที่เกิดจากการออกกำลังกายในเขต rostral ventrolateral medulla (RVLM) มีผลยับยั้งการสื่อประสาทแบบกลูตาเมต ซึ่งลดการทำงานของระบบประสาทซิมพาเทติก[79] (ซึ่งมีหน้าที่เกี่ยวกับปฏิกิริยาสู้หรือหนีและภาวะธำรงดุล) ผู้เขียนให้สมมติฐานว่า การปรับสภาพทางประสาทใน RVLM เป็นกลไกที่การออกกำลังกายเป็นปกติช่วยป้องกันโรคหลอดเลือดหัวใจแบบที่เกิดจากมีชีวิตนั่ง ๆ นอน ๆ [79]
ผลในเด็ก
[แก้]งานปี 2546 ทำการวิเคราะห์อภิมานตรวจสอบความสัมพันธ์ระหว่างการออกกำลังกายกับสมรรถภาพการรู้คิดในเด็ก[80] แล้วรายงานความสัมพันธ์ที่มีประโยชน์ในเรื่องทักษะการรับรู้ ระดับเชาวน์ปัญญา การประสบความสำเร็จ การทดสอบทางภาษา การทดสอบทางคณิต ระดับพัฒนาการ และความพร้อมทางการเรียนและด้านอื่น ๆ ยกเว้นเพียงแค่ความจำ[80] โดยพบค่าสหสัมพันธ์สูงสุดในเด็กอายุ 4-7 ขวบ และ 11-13 ปี[80]
แต่งานปี 2554 กับพบผลตรงกันข้ามในเรื่องความจำ สมมติฐานในงานศึกษานี้ก็คือว่า เด็กที่ฟิตน้อยกว่าจะได้คะแนนเกี่ยวกับ executive control และความจำที่น้อยกว่า มีปริมาตรฮิปโปแคมปัสที่น้อยกว่า เทียบกับเด็กที่ฟิตดีกว่า[81] แทนที่ข้อมูลว่า การออกกำลังกายไม่เกี่ยวข้องกับความจำในเด็กระหว่างอายุ 4-18 ปี อาจจะเป็นไปได้ว่า สำหรับเด็กก่อนวัยรุ่น เด็กที่แข็งแรงกว่าจะมีปริมาตรฮิปโปแคมปัสที่สูงกว่า และตามงานวิจัยที่ทำโดยนักวิจัยกลุ่มเดียวกันบางคน ปริมาตรฮิปโปแคมปัสที่สูงกว่ามีผลเป็น executive control และความจำที่ดีกว่า[82] และสรุปได้ว่า ปริมาตรฮิปโปแคมปัสสัมพันธ์ในเชิงบวกกับการทำงานทางความจำสัมพัทธ์ (relational memory tasks) ที่ดีกว่า [82] นี่เป็นหลักฐานแรกที่แสดงว่า การออกกำลังกายแบบแอโรบิกอาจสัมพันธ์กับโครงสร้างและการทำงานของสมองมนุษย์ก่อนวัยรุ่น[82]
งานวิเคราะห์อภิมานปี 2553 เกี่ยวกับผลของการออกกำลังกายต่อ executive functions ของเด็ก มีการทดลองสองแบบที่ใช้ประเมินผล แบบแรกเป็นการออกกำลังกายเป็นประจำ ที่จัดกลุ่มเด็กแบบสุ่มให้ออกกำลังกายตามเวลาเป็นเวลาหลายอาทิตย์แล้วประเมินผลทีหลัง[83] แบบที่สองเป็นการตรวจสอบผลทางการรู้คิดทันทีหลังจากการออกกำลังกาย[83] ผลของแบบประเมินทั้งสองแสดงว่า การออกกำลังกายแบบแอโรบิกอาจจะทั้งปรับปรุง executive functions ของเด็กแบบชั่วคราว และมีอิทธิพลต่อการปรับปรุงที่ยั่งยืนกว่า[83]
ส่วนงานวิจัยอื่น ๆ แสดงว่า การออกกำลังกายไม่มีผลต่อการเรียน ซึ่งอาจเป็นเพราะการกำหนดว่าอะไรเป็นการเรียนดีต่างกันมาก[84] นี่เป็นประเด็นการศึกษาที่คณะกรรมการการศึกษาเพ่งความสนใจเพื่อใช้ตัดสินใจว่า การออกกำลังกายควรเป็นส่วนหลักสูตรการศึกษาหรือไม่ นักเรียนควรใช้เวลาในวิชาพละเท่าไร และจะมีผลกระทบต่อการเรียนวิชาอื่น ๆ หรือไม่[80]
การศึกษาอื่นพบว่านักเรียนชั้นประถมปีที่ 6 ที่มีส่วนร่วมในการออกกำลังกายอย่างหนักอย่างน้อยสัปดาห์ละสามครั้งมีคะแนนสูงสุด เมื่อเทียบกับผู้ที่เข้าร่วมกิจกรรมทางกายในระดับปานกลางหรือไม่มีเลย เด็กที่มีส่วนร่วมในการออกกำลังกายอย่างจริงจังทำคะแนนได้สูงขึ้นสามคะแนนโดยเฉลี่ย ในการทดสอบทางวิชาการของพวกเขาซึ่งประกอบด้วย คณิตศาสตร์, วิทยาศาสตร์, ภาษาอังกฤษ และสังคมศีกษา[85]
งานศึกษาในสัตว์พบว่า การออกกำลังกายมีอิทธิพลต่อพัฒนาการของสมองในช่วงต้นของชีวิต หนูที่มีล้อวิ่งหรือมีของเล่นออกกำลังกายอื่น ๆ มีพัฒนาการของเซลล์ประสาทเกี่ยวกับการเรียนรู้และความจำที่ดีกว่า[84] งานสร้างภาพสมองในมนุษย์แสดงผลเช่นเดียวกัน ที่การออกกำลังกายนำไปสู่การเปลี่ยนแปลงทางโครงสร้างและการทำหน้าที่ของสมอง[84] นักวิจัยบางท่านได้เชื่อมระดับความฟิตต่ำในเด็กกับการมี executive function ที่เสียหายเมื่อถึงวัยสูงอายุ แต่ก็มีหลักฐานเพิ่มขึ้นเรื่อย ๆ ว่า ความจริงมันอาจจะสัมพันธ์กับความไม่สามารถควบคุมการการใส่ใจ หยุดพฤติกรรมอัตโนมัติ (inhibitory control) และไม่สนใจตัวกวนสมาธิ (interference control)[81]
ผลต่อความผิดปกติทางประสาท
[แก้]การติด
[แก้]หลักฐานทางคลินิกและพรีคลินิกแสดงว่า การออกกำลังกายอย่างสม่ำเสมอโดยเฉพาะที่ต้องอึดสู้ (เช่น การวิ่งมาราธอน) จริง ๆ สามารถป้องกันการติดยา และเป็นการรักษาเสริมที่มีประสิทธิผล โดยเฉพาะการติดยากระตุ้นจิต (เช่น แอมเฟตามีน)[23][24][25][26] การออกกำลังกายแบบแอโรบิกให้สม่ำเสมอสามารถลดความเสี่ยงการติดยาขึ้นอยู่กับว่าออกหนักเท่าไร (คือ โดยระยะเวลาและความหนักเบา) ซึ่งปรากฏโดยเป็นการฟื้นสภาพทางสมองจากการติดยา[23][24] งานทบทวนวรรณกรรมหนึ่งให้ข้อสังเกตว่า การออกกำลังกายอาจป้องกันการติดยาโดยเปลี่ยนการทำงานของ ΔFosB และ c-Fos (วัดโดย immunoreactivity) ของสมองส่วน striatum และส่วนอื่นของระบบรางวัล เพราะทั้ง ΔFosB และ c-Fos มีส่วนปรับสภาพสมองเมื่อเกิดการติด[26]
นอกจากนั้นแล้ว การออกกำลังกายแบบแอโรบิกยังลดการใช้ยากระตุ้นจิตเอง ลดการกลับมาใช้ยาอีกหรือการหายา และฟื้นสภาพของ striatal dopamine receptor D2 (DRD2) signaling คือคืนความหนาแน่นของ DRD2 ที่ลดลงเพราะใช้ยา[23][24] ดังนั้น การออกกำลังกายอย่างสม่ำเสมอโดยเป็นการรักษาเสริมอาจให้ได้ผลการรักษาที่ดีกว่าสำหรับการติดยา[23][25] โดยเดือนกรกฎาคม 2558 ยังต้องมีงานวิจัยทางคลินิกอีกเพื่อจะเข้าใจถึงกลไกการทำงานและยืนยันประสิทธิผลของการออกกำลังกายในการรักษาและป้องกันการติดยา[26]
โรคสมาธิสั้น
[แก้]การออกกำลังกายอย่างสม่ำเสมอ โดยเฉพาะแบบแอโรบิก เป็นการรักษาเสริมที่มีประสิทธิผลในเด็กและผู้ใหญ่ที่มีโรคสมาธิสั้น (ADHD) โดยเฉพาะเมื่อใช้ร่วมกับยากระตุ้น (เช่น แอมเฟตามีน หรือ methylphenidate) แม้ความหนักเบาและรูปแแบบของการออกกำลังกายที่ได้ผลดีที่สุดยังไม่ชัดเจน[21][22][86] โดยเฉพาะก็คือ ผลระยะยาวของการออกกำลังกายแบบแอโรบิกอย่างสม่ำเสมอในคนไข้ ADHD รวมทั้งพฤติกรรมที่ดีกว่า สมรรถภาพการเคลื่อนไหวที่ดีกว่า executive functions ที่ดีกว่า (รวมทั้งการใส่ใจ การหยุดพฤติกรรมอัตโนมัติ และการวางแผน ในบรรดากิจทางการรู้คิดทั้งหลาย) การประมวลข้อมูลได้เร็วกว่า และความจำที่ดีกว่า[21][22][86]
การให้คะแนนจากผู้ปกครอง-ครู ทางพฤติกรรมและทางสังคม-อารมณ์ ที่เป็นผลของการออกกำลังกายแบบแอโรบิกเป็นประจำรวมทั้งความดีขึ้นทั่วไป การลดอาการ ADHD ความภูมิใจในตนที่ดีกว่า การลดระดับความวิตกกังวลและความซึมเศร้า การบ่นเรื่องอาการทางกายอื่น ๆ ที่น้อยลง การเรียนที่ดีกว่า ความประพฤติที่ดีกว่าในห้องเรียน และพฤติกรรมทางสังคมที่ดีกว่า[21] การออกกำลังกายเมื่อกำลังทานยากระตุ้นเพิ่มผลของยาต่อ executive functions[21] เชื่อว่า ผลระยะสั้นของการออกกำลังกายเช่นนี้อำนวยโดยการเพิ่มขึ้นของโดพามีนและนอร์เอพิเนฟรินที่ไซแนปส์ของเซลล์ประสาทในสมอง[21]
โรคซึมเศร้า
[แก้]งานทบทวนวรรณกรรมทางการแพทย์จำนวนหนึ่งชี้ว่า การออกกำลังกายมีผลแก้ซึมเศร้าที่ชัดเจนและคงยืนในมนุษย์[5][15][16][19][87][88] ซึ่งเชื่อว่าอำนวยผ่านกระบวนการ BDNF signaling ที่ดีขึ้นในสมอง[8][19] งานปริทัศน์เป็นระบบหลายงานได้วิเคราะห์โอกาสที่การออกกำลังกายจะช่วยรักษาโรคซึมเศร้า (MDD) งานทบทวนวรรณกรรมแบบคอเครนปี 2556 ให้ข้อสังเกตว่า แม้จะมีหลักฐานจำกัด แต่การออกกำลังกายมีผลดีกว่าการแทรกแซงรักษาที่ใช้ในกลุ่มควบคุม และอาจมีผลเทียบกับจิตบำบัดหรือยาแก้ซึมเศร้าได้[87]
งานปริทัศน์เป็นระบบปี 2557 อีก 3 งาน ซึ่งวิเคราะห์งานทบทวนแบบคอเครนด้วย สรุปโดยคล้าย ๆ กัน งานหนึ่งชี้ว่า การออกกำลังกายมีประสิทธิผลเท่ากับการรักษาเสริม (adjunct treatment) แบบอื่น ๆ ที่ใช้ร่วมกับยาแก้ซึมเศร้า[19] ส่วนงานอีก 2 งานชี้ว่า การออกกำลังกายมีผลแก้ความซึมเศร้าอย่างชัดเจน และแนะนำให้รวมการออกกำลังกายเป็นการรักษาเสริมสำหรับโรคซึมเศร้าระดับปานกลาง-รุนแรง และสำหรับความเจ็บป่วยทางจิตใจอื่นโดยทั่วไป[15][16]
งานปริทัศน์อีกงานหนึ่งให้ข้อสังเกตว่า โยคะอาจมีประสิทธิผลบรรเทาอาการโรคซึมเศร้าก่อนคลอดบุตร (prenatal depression) ของหญิงมีครรภ์[89] ส่วนงานทบทวนอีกงานหนึ่งแสดงว่า หลักฐานจากการทดลองทางคลินิกสนับสนุนว่า การออกกำลังกายมีผลดีต่อการรักษาโรคซึมเศร้าที่ช่วง 2-4 เดือน[5] แต่งานทบทวนหลักฐานทางคลินิกปี 2558 และแนวทางทางการแพทย์สำหรับรักษาโรคซึมเศร้าด้วยการออกกำลังกายให้ข้อสังเกตว่า แม้หลักฐานเกี่ยวกับประสิทธิผลของการออกกำลังกายจะมีข้อจำกัด[20] แต่ก็ชัดเจนว่าช่วยลดอาการของโรค[20] แล้วให้ข้อสังเกตด้วยว่า ลักษณะคนไข้ รูปแบบความซึมเศร้า และลักษณะโปรแกรมการออกกำลังกายล้วนมีผลต่อการแก้ความซึมเศร้า[20]
งานวิเคราะห์อภิมานเดือนกรกฎาคม 2559 สรุปว่า การออกกำลังกายเพิ่มคุณภาพชีวิตโดยทั่วไปในคนไข้โรคซึมเศร้าเทียบกับกลุ่มควบคุม[11]
โรคประสาทเสื่อม
[แก้]โรคอัลไซเมอร์
[แก้]โรคอัลไซเมอร์เป็นโรคประสาทเสื่อมในเขตเปลือกสมอง และเป็นรูปแบบภาวะสมองเสื่อมที่สามัญที่สุด คือที่ 65% ซึ่งกำหนดโดยการรู้คิดที่พิการ ความผิดปกติทางพฤติกรรม และสมรรถภาพการใช้ชีวิตประจำวันที่ลดลง[27][28] งานปริทัศน์เป็นระบบ 2 งานทบทวนการทดลองแบบสุ่มและมีกลุ่มควบคุม (RCT) ที่มีระยะ 3-12 เดือน และตรวจสอบผลของการออกกำลังกายต่อลักษณะต่าง ๆ ที่ว่าของโรค[27][28] แล้วพบประโยชน์ต่อการรู้คิด อัตราการเสื่อมการรู้คิด และการใช้ชีวิตประจำวันของบุคคลที่เป็นโรค[27][28] งานหนึ่งเสนอว่า โดยอาศัยแบบจำลองหนูที่ตัดต่อยีนข้ามพันธุ์ (transgenic) ผลต่อการรู้คิดของการออกกำลังกายในโรคอัลไซเมอร์ อาจมีเหตุมาจากการลดปริมาณ amyloid plaque ซึ่งเชื่อว่าอาจเป็นเหตุของโรค[27][90]
งานศึกษาหนึ่ง (Caerphilly Prospective study) ติดตามชาย 2,375 คนตลอด 30 ปีและตรวจดูความสัมพันธ์ระหว่างวิถีชีวิตที่ถูกสุขภาพกับภาวะสมองเสื่อม ในบรรดาปัจจัยที่ตามดูทั้งหมด[91] การวิเคราะห์ข้อมูลของงานศึกษาแสดงว่า การออกกำลังกายสัมพันธ์กับการเกิดภาวะสมองเสื่อมที่ต่ำลง และการลดความเสื่อมในการรู้คิด[91][92] งานปริทัศน์เป็นระบบต่อมางานหนึ่งทบทวนงานศึกษาตามยาวต่าง ๆ ก็พบระดับการออกกำลังกายที่สูงขึ้นว่าสัมพันธ์กับการลดความเสี่ยงต่อภาวะสมองเสื่อมและความเสื่อมในการรู้คิดเช่นกัน[33] งานนี้ยังแจ้งอีกด้วยวว่า การออกกำลังกายที่เพิ่มขึ้นดูจะเป็นเหตุของความเสี่ยงที่ลดลงเหล่านั้น[33]
โรคพาร์คินสัน
[แก้]โรคพาร์คินสัน (PD) เป็นความผิดปกติทางการเคลื่อนไหวที่มีอาการคล้ายกับอาการเคลื่อนไหวช้า (hypokinesia) ตัวแข็ง ตัวสั่น และท่าเดินที่เสียไป[93]
งานทบทวนวรรณกรรมปี 2549 พบว่า มีระบบสารสื่อประสาทบางอย่างที่ได้ประโยชน์จากการออกกำลังกาย[94] มีงาน 2-3 งานที่รายงานว่าสุขภาพสมองและการรู้คิดดีขึ้นเพราะการออกกำลังกาย[94] งานหนึ่งโดยเฉพาะในปี 2542 พบว่า การออกกำลังกายแบบแอโรบิกปรับปรุงกระบวนการ executive control สนับสนุนโดยเขตด้านหน้าและเขต prefrontal ของสมอง[95] เขตเหล่านี้เป็นเหตุของความบกพร่องทางการรู้คิดของคนไข้โรคพาร์คินสัน แต่ก็คาดว่า ความแตกต่างของสิ่งแวดล้อมทางเคมีประสาทในสมองกลีบหน้าของคนไข้อาจจะห้ามประโยชน์จากการออกกำลังกาย[96] งานปี 2553 ศึกษาทฤษฎีนี้ที่ทดสอบผู้ร่วมการทดลองที่เป็นคนไข้ระยะต้นหรือกลางและกลุ่มควบคุมทางการรู้คิด/ภาษา ร่วมกับการออกกำลังกาย ซึ่งคนไข้จะออกกำลังแบบแอโรบิก 20 นาทีอาทิตย์ละ 3 ครั้งเป็นเวลา 8 อาทิตย์โดยปั่นจักรยานอยู่กับที่ แล้วพบว่า การออกกำลังกายช่วยให้ได้คะแนนการรู้คิดที่ดีขึ้น[96] โดยเป็นหลักฐานว่า โปรแกรมการออกกำลังกายอาจมีประโยชน์กับคนไข้ PD
ดูเพิ่ม
[แก้]เชิงอรรถ
[แก้]- ↑ ปัจจัยบำรุงสมอง (neurotrophic factors) เป็นเพปไทด์หรือโปรตีนขนาดเล็กอื่น ๆ ที่สนับสนุนการเติบโต การอยู่รอด และกระบวนการ differentiation ของเซลล์ประสาทโดยเข้ายึดกับ tyrosine kinase แล้วออกฤทธิ์ให้ทำงาน[36]
- ↑ การเกิดเซลล์ประสาทของผู้ใหญ่ (Adult neurogenesis) เป็นการเกิดนิวรอนหลังคลอด ซึ่งเป็นรูปแบบการปรับเปลี่ยนทางประสาทที่ดี[35]
- ↑ การควบคุมการใส่ใจช่วยให้บุคคลเพ่งความใส่ใจไปที่สิ่งเร้าบางอย่างและไม่สนใจสิ่งเร้าอย่างอื่นที่เรียกร้องความสนใจเหมือนกัน[39]
- ↑ การควบคุมแบบยับยั้ง (Inhibitory control) เป็นกระบวนการเปลี่ยนการตอบสนองทางพฤติกรรมที่ได้เรียนรู้ เพื่อให้ถึงเป้าหมายที่ต้องการได้ง่ายขึ้น[52][60] Inhibitory control ช่วยบุคคลให้ควบคุมอารมณ์ชั่ววูบหรือนิสัยได้เมื่อจำเป็นหรือต้องการ[52][58][60] เช่น การเลิกผัดวันประกันพรุ่ง
- ↑ ความจำใช้งาน (Working memory) เป็นรูปแบบความจำที่บุคคลใช้เพื่อประมวลข้อมูลปัจจุบัน[39] เช่นเมื่ออ่านหรือเขียนบทความสารานุกรม ความจำใช้งานมีความจุจำกัด ทำกิจเป็นที่พักข้อมูลคล้ายกับของคอมพิวเตอร์ ที่ช่วยให้จัดการข้อมูลเพื่อเข้าใจ ตัดสินใจ และแนะแนวพฤติกรรมได้[52]
- ↑ คือในบุคคลปกติ การขาดดุลทางพลังงานนี้จะหายไปเพียงแค่ทานอาหารหรือดื่มเครื่องดื่มอย่างเพียงพอหลังจากออกกำลังกาย
- ↑ กล่าวอีกอย่างก็คือ phenethylamine และแอมเฟตามีนมีผลคล้ายกันต่อระบบประสาทกลาง
อ้างอิง
[แก้]- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 1.10 1.11
Erickson, KI; Hillman, CH; Kramer, AF (August 2015). "Physical activity, brain, and cognition". Current Opinion in Behavioral Sciences. 4: 27–32. doi:10.1016/j.cobeha.2015.01.005.
Research in children finds that higher fit and more active preadolescent children show greater hippocampal and basal ganglia volume, greater white matter integrity, elevated and more efficient patterns of brain activity, and superior cognitive performance and scholastic achievement. Higher fit and more physically active older adults show greater hippocampal, prefrontal cortex, and basal ganglia volume, greater functional brain connectivity, greater white matter integrity, more efficient brain activity, and superior executive and memory function. ...
Cognitive performance: Cross-sectional, observational, and randomized clinical trials of PA in late adulthood have demonstrated that engaging in PA may preserve and/or enhance cognitive function even in cognitively impaired individuals (e.g., [18]). Summaries of these studies can now be found in several meta-analyses, most of which confirm that PA positively influences cognitive function in late adulthood with small to moderate sized effects [19]. In a meta-analysis of 18 randomized PA trials, engaging in moderate intensity PA resulted in enhanced cognitive function across all cognitive domains examined, but with the largest effect sizes for indices of executive function [20]. Meta-analyses of longitudinal observational studies have also confirmed that self-reported engagement in PA is associated with nearly a 40% reduced risk of experiencing cognitive decline over several years [21]. These, and other studies, make a convincing argument that both continuing to engage in, and starting to engage in, PA in late adulthood may have a profound effect on maintaining cognitive health, improving function, and reducing the risk of developing cognitive impairment.
Brain structure: There have been now more than 30 published studies of PA or fitness on brain structure in older adults (>60 years) with the majority showing positive associations (see [22]). Such effects are important since increasing age is associated with brain atrophy and loss of volume, which precedes and predicts conversion to dementia. Higher aerobic fitness levels have been associated with larger gray matter volumes in older adults in several areas including the frontal cortex [23,24], hippocampus [25,26], and caudate nucleus [27]. Longitudinal observational studies have also shown that greater amounts of PA are associated with larger gray matter volumes in these regions, and greater volume is, in turn, associated with a reduced risk of cognitive impairment [28]. These cross-sectional and observational results in older adults are further supported by clinical trials that have shown that six-months to one-year of regular PA is associated with an increase in both frontal cortex [29••,30] and hippocampal volume ... These effects on gray matter volume are accompanied by differences found in white matter integrity. For example, several studies have reported that higher cardiorespiratory fitness levels and PA are associated with greater white matter integrity along several tracts linking frontal and subcortical areas [34-36] and that greater changes in fitness after an intervention was associated with an increase in white matter integrity [37]. In sum, there is now convincing evidence that PA and fitness influence brain structure, characterized by both gray matter volume and white matter integrity, in late adulthood. - ↑ 2.0 2.1 2.2
Paillard, T; Rolland, Y; de Souto Barreto, P (July 2015). "Protective Effects of Physical Exercise in Alzheimer's Disease and Parkinson's Disease: A Narrative Review". J Clin Neurol. 11 (3): 212–219. doi:10.3988/jcn.2015.11.3.212. PMC 4507374. PMID 26174783.
Aerobic physical exercise (PE) activates the release of neurotrophic factors and promotes angiogenesis, thereby facilitating neurogenesis and synaptogenesis, which in turn improve memory and cognitive functions. ... Exercise limits the alteration in dopaminergic neurons in the substantia nigra and contributes to optimal functioning of the basal ganglia involved in motor commands and control by adaptive mechanisms involving dopamine and glutamate neurotransmission.
- ↑ 3.0 3.1
McKee AC, Daneshvar DH, Alvarez VE, Stein TD (January 2014). "The neuropathology of sport". Acta Neuropathol. 127 (1): 29–51. doi:10.1007/s00401-013-1230-6. PMC 4255282. PMID 24366527.
The benefits of regular exercise, physical fitness and sports participation on cardiovascular and brain health are undeniable ... Exercise also enhances psychological health, reduces age-related loss of brain volume, improves cognition, reduces the risk of developing dementia, and impedes neurodegeneration.
- ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 4.7
Denham J, Marques FZ, O'Brien BJ, Charchar FJ (February 2014). "Exercise: putting action into our epigenome". Sports Med. 44 (2): 189–209. doi:10.1007/s40279-013-0114-1. PMID 24163284.
Aerobic physical exercise produces numerous health benefits in the brain. Regular engagement in physical exercise enhances cognitive functioning, increases brain neurotrophic proteins, such as brain-derived neurotrophic factor (BDNF), and prevents cognitive diseases [76-78]. Recent findings highlight a role for aerobic exercise in modulating chromatin remodelers [21, 79-82]. ... These results were the first to demonstrate that acute and relatively short aerobic exercise modulates epigenetic modifications. The transient epigenetic modifications observed due to chronic running training have also been associated with improved learning and stress-coping strategies, epigenetic changes and increased c-Fos-positive neurons ... Nonetheless, these studies demonstrate the existence of epigenetic changes after acute and chronic exercise and show they are associated with improved cognitive function and elevated markers of neurotrophic factors and neuronal activity (BDNF and c-Fos). ... The aerobic exercise training-induced changes to miRNA profile in the brain seem to be intensity-dependent [164]. These few studies provide a basis for further exploration into potential miRNAs involved in brain and neuronal development and recovery via aerobic exercise.
- ↑ 5.00 5.01 5.02 5.03 5.04 5.05 5.06 5.07 5.08 5.09 5.10 5.11 5.12 5.13 5.14 5.15 5.16 5.17
Gomez-Pinilla, F; Hillman, C (January 2013). "The influence of exercise on cognitive abilities". Compr. Physiol. 3 (1): 403–428. doi:10.1002/cphy.c110063. PMC 3951958. PMID 23720292.
A second recent meta-analysis (162) corroborated Colcombe and Kramer’s (30) findings, in that aerobic exercise was related to attention, processing speed, memory, and cognitive control. ... Normal aging results in the loss of brain tissue (31), with markedly larger tissue loss evidenced in the frontal, temporal, and parietal cortices (16, 58, 149). As such, cognitive functions subserved by these brain regions (such as those involved in cognitive control and memory) are expected to decay more dramatically than other aspects of cognition. Specifically, age-related decreases in gray matter volume have been associated with decrements in a variety of cognitive control processes. ... Decreases in gray matter volume may result from several factors including loss in the number of neurons, neuronal shrinkage, reduction in dendritic arborization, and alterations in glia (158). Further, decreases in white matter (brain tissue composed primarily of myelinated nerve fibers) volume, which represent changes in connectivity between neurons, also occur as a result of aging. Loss of white matter volume further relates to performance decrements on a host of cognitive tasks ... aerobic fitness relates to larger hippocampal volume (23) and better relational memory performance (24), during preadolescent childhood. ... Specifically, those assigned to the aerobic training group demonstrated increases in gray matter in the frontal lobes, including the dorsal anterior cingulate cortex (ACC), supplementary motor area, middle frontal gyrus, dorsolateral region of the right inferior frontal gyrus, and the left superior temporal lobe (32). White matter volume changes were also evidenced for the aerobic fitness group with increases in white matter tracts within the anterior third of the corpus callosum (32). ... In addition, aerobic fitness has been shown to promote better functioning of brain, especially in neural networks involved in cognitive control of inhibition and attention (33). ... In addition to BDNF, the actions of IGF-1 and vascular endothelial growth factor (VEGF) (54) are considered essential for the angiogenic and neurogenic effects of exercise in the brain. ... Randomized and crossover clinical trials demonstrate the efficacy of aerobic or resistance training exercise (2-4 months) as a treatment for depression in both young and older individuals. ... exercise seems to have both preventative and therapeutic effects on the course of depression
- ↑ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 6.13
Erickson KI, Leckie RL, Weinstein AM (September 2014). "Physical activity, fitness, and gray matter volume". Neurobiol. Aging. 35 Suppl 2: S20-528. doi:10.1016/j.neurobiolaging.2014.03.034. PMC 4094356. PMID 24952993. สืบค้นเมื่อ 19 December 2014.
We conclude that higher cardiorespiratory fitness levels are routinely associated with greater gray matter volume in the prefrontal cortex and hippocampus and less consistently in other regions. We also conclude that physical activity is associated with greater gray matter volume in the same regions that are associated with cardiorespiratory fitness including the prefrontal cortex and hippocampus. ... Meta-analyses (Colcombe and Kramer, 2003; Smith et al., 2010) suggest that the effects of exercise on the brain might not be uniform across all regions and that some brain areas, specifically those areas supporting executive functions, might be more influenced by participation in exercise than areas not as critically involved in executive functions. ... The effects appear to be general in the sense that many different cognitive domains are improved after several months of aerobic exercise, but specific in the sense that executive functions are improved more than other cognitive domains. ... physical activity and exercise may reduce the risk for AD (Barnes and Yaffe, 2011; Podewils et al., 2005; Sofi et al., 2011) ... Erickson et al. (2010) reported that greater amounts of physical activity were associated with greater gray matter volume 9-years later in the prefrontal cortex, anterior cingulate, parietal cortex, cerebellum, and hippocampus. ... higher fitness levels (VO2max) were associated with larger hippocampal volumes, better executive function, and faster processing speed. ... Verstynen et al. (2012) examined the association between cardiorespiratory fitness levels (VO2max) and the size of the basal ganglia ... Verstynen et al. (2012) found that higher fitness levels were associated with greater volume of the caudate nucleus and nucleus accumbens, and in turn, greater volumes were associated with better performance on a task-switching paradigm. ... That is, higher physical activity levels mitigated the detrimental effects of lifetime stress on the size of the hippocampus. ... The few randomized interventions published thus far have found results highly overlapping with the cross-sectional studies and suggest that the prefrontal cortex and hippocampus remain pliable in late life and that moderate intensity exercise for 6 months-1 year is sufficient for changing the size of these areas.
- ↑ 7.0 7.1 7.2 7.3 7.4 7.5
Guiney, H; Machado, L (February 2013). "Benefits of regular aerobic exercise for executive functioning in healthy populations". Psychon Bull Rev. 20 (1): 73–86. doi:10.3758/s13423-012-0345-4. PMID 23229442.
Executive functions are strategic in nature and depend on higher-order cognitive processes that underpin planning, sustained attention, selective attention, resistance to interference, volitional inhibition, working memory, and mental flexibility ... Data to date from studies of aging provide strong evidence of exercise-linked benefits related to task switching, selective attention, inhibition of prepotent responses, and working memory capacity; furthermore, cross-sectional fitness data suggest that working memory updating could potentially benefit as well. In young adults, working memory updating is the main executive function shown to benefit from regular exercise, but cross-sectional data further suggest that task-switching and post-error performance may also benefit. In children, working memory capacity has been shown to benefit, and cross-sectional data suggest potential benefits for selective attention and inhibitory control. ... Support for the idea that higher levels of aerobic activity may be associated with superior brain structure has been gained through cross-sectional studies in older adults and children (for a recent review, see Voss, Nagamatsu, et al., 2011). ... only those in the aerobic exercise group exhibited improved connectivity between the left and right prefrontal cortices, two areas that are crucial to the effective functioning of the fronto-executive network. ... Together, these studies provide evidence that regular aerobic exercise benefits control over responses during selective attention in older adults. ... aerobic fitness is a good predictor of performance on tasks that rely relatively heavily on inhibitory control over prepotent responses (e.g., Colcombe et al., 2004, Study 1; Prakash et al., 2011) and also that regular aerobic exercise improves performance on such tasks ... Overall, the results from the span and Sternberg tasks suggest that regular exercise can also confer benefits for the volume of information that children and older adults can hold in mind at one time.
- ↑ 8.00 8.01 8.02 8.03 8.04 8.05 8.06 8.07 8.08 8.09 8.10 8.11 8.12 8.13
Erickson KI, Miller DL, Roecklein KA (2012). "The aging hippocampus: interactions between exercise, depression, and BDNF". Neuroscientist. 18 (1): 82–97. doi:10.1177/1073858410397054. PMC 3575139. PMID 21531985.
Late adulthood is associated with increased hippocampal atrophy and dysfunction. ... However, there is strong evidence that decreased BDNF is associated with age-related hippocampal dysfunction, memory impairment, and increased risk for depression, whereas increasing BDNF by aerobic exercise appears to ameliorate hippocampal atrophy, improve memory function, and reduce depression. ... For example, longitudinal studies have reported between 1% and 2% annual hippocampal atrophy in adults older than 55 years without dementia ... Over a nine-year period, greater amounts of physical activity in the form of walking are associated with greater gray matter volume in several regions including prefrontal, temporal, and hippocampal areas. ... The prefrontal cortex and hippocampus deteriorate in late adulthood, preceding and leading to deficits in executive and memory function. We examined in this review the evidence that age-related changes in BDNF might at least partially explain hippocampal atrophy and increased risk for memory impairment. We can conclude that 1) decreases in BDNF protein expression are associated with poorer hippocampal function and increased rates of geriatric depression and AD. ... 3) Aerobic exercise enhances executive and memory function and reduces hippocampal atrophy in late adulthood, and this may be partially mediated through a BDNF pathway.
- ↑ 9.0 9.1 9.2 9.3 9.4 9.5 9.6 9.7
Buckley J, Cohen JD, Kramer AF, McAuley E, Mullen SP (2014). "Cognitive control in the self-regulation of physical activity and sedentary behavior". Front Hum Neurosci. 8: 747. doi:10.3389/fnhum.2014.00747. PMC 4179677. PMID 25324754.
Recent theory (e.g., Temporal Self-Regulation Theory; Hall and Fong, 2007, 2010, 2013) and evidence suggest that the relation between physical activity and cognitive control is reciprocal (Daly et al., 2013). Most research has focused on the beneficial effects of regular physical activity on executive functions-the set of neural processes that define cognitive control. Considerable evidence shows that regular physical activity is associated with enhanced cognitive functions, including attention, processing speed, task switching, inhibition of prepotent responses and declarative memory (for reviews see Colcombe and Kramer, 2003; Smith et al., 2010; Guiney and Machado, 2013; McAuley et al., 2013). Recent research demonstrates a dose-response relationship between fitness and spatial memory (Erickson et al., 2011) ... The effects of physical activity on cognitive control appear to be underpinned by a variety of brain processes including: increased hippocampal volume, increased gray matter density in the prefrontal cortex (PFC), upregulation of neurotrophins and greater microvascular density ... Together, this research suggests that an improvement in control processes, such as attention and inhibition or interference control, is associated with an improvement in self-regulation of physical activity. ... Hoang et al. (2013) found that young adults who initially exhibited low levels of physical activity and remained relatively inactive for 25 years had nearly twofold greater odds of impaired executive function compared with those who exhibited higher activity levels; very-low physical activity patterns were associated with even more pronounced declines in executive functioning. … sedentary behavior indirectly led to poor executive function through depressive symptoms (Vance et al., 2005). … sedentary individuals display less capacity to quickly and accurately switch between tasks.
- ↑ 10.0 10.1 10.2 10.3
Cox EP, O'Dwyer N, Cook R, Vetter M, Cheng HL, Rooney K, O'Connor H (August 2016). "Relationship between physical activity and cognitive function in apparently healthy young to middle-aged adults: A systematic review". J. Sci. Med. Sport. 19 (8): 616–628. doi:10.1016/j.jsams.2015.09.003. PMID 26552574.
A range of validated platforms assessed CF across three domains: executive function (12 studies), memory (four studies) and processing speed (seven studies). Habitual PA was assessed via questionnaire/self-report methods (n=13, 8 validated) or accelerometers (n=1). In studies of executive function, five found a significant ES in favour of higher PA, ranging from small to large. Although three of four studies in the memory domain reported a significant benefit of higher PA, there was only one significant ES, which favoured low PA. Only one study examining processing speed had a significant ES, favouring higher PA.
CONCLUSIONS: A limited body of evidence supports a positive effect of PA on CF in young to middle-aged adults. Further research into this relationship at this age stage is warranted. ...
Significant positive effects of PA on cognitive function were found in 12 of the 14 included manuscripts, the relationship being most consistent for executive function, intermediate for memory and weak for processing speed. - ↑ 11.0 11.1 11.2
Schuch FB, Vancampfort D, Rosenbaum S, Richards J, Ward PB, Stubbs B (July 2016). "Exercise improves physical and psychological quality of life in people with depression: A meta-analysis including the evaluation of control group response". Psychiatry Res. 241: 47–54. doi:10.1016/j.psychres.2016.04.054. PMID 27155287.
Exercise has established efficacy as an antidepressant in people with depression. ... Exercise significantly improved physical and psychological domains and overall QoL. ... The lack of improvement among control groups reinforces the role of exercise as a treatment for depression with benefits to QoL.
- ↑
Pratali L, Mastorci F, Vitiello N, Sironi A, Gastaldelli A, Gemignani A (November 2014). "Motor Activity in Aging: An Integrated Approach for Better Quality of Life". Int. Sch. Res. Notices. 2014: 257248. doi:10.1155/2014/257248. PMC 4897547. PMID 27351018.
Research investigating the effects of exercise on older adults has primarily focused on brain structural and functional changes with relation to cognitive improvement. In particular, several cross-sectional and intervention studies have shown a positive association between physical activity and cognition in older persons [86] and an inverse correlation with cognitive decline and dementia [87]. Older adults enrolled in a 6-month aerobic fitness intervention increased brain volume in both gray matter (anterior cingulate cortex, supplementary motor area, posterior middle frontal gyrus, and left superior temporal lobe) and white matter (anterior third of corpus callosum) [88]. In addition, Colcombe and colleagues showed that older adults with higher cardiovascular fitness levels are better at activating attentional resources, including decreased activation of the anterior cingulated cortex. One of the possible mechanisms by which physical activity may benefit cognition is that physical activity maintains brain plasticity, increases brain volume, stimulates neurogenesis and synaptogenesis, and increases neurotrophic factors in different areas of the brain, possibly providing reserve against later cognitive decline and dementia [89, 90].
- ↑ 13.0 13.1
Cunha GS, Ribeiro JL, Oliveira AR (June 2008). "[Levels of beta-endorphin in response to exercise and overtraining]". Arq Bras Endocrinol Metabol (ภาษาโปรตุเกส). 52 (4): 589–598. PMID 18604371.
Interestingly, some symptoms of OT are related to beta-endorphin (beta-end (1-31)) effects. Some of its effects, such as analgesia, increasing lactate tolerance, and exercise-induced euphoria, are important for training.
- ↑ 14.0 14.1
Boecker H, Sprenger T, Spilker ME, Henriksen G, Koppenhoefer M, Wagner KJ, Valet M, Berthele A, Tolle TR (2008). "The runner's high: opioidergic mechanisms in the human brain". Cereb. Cortex. 18 (11): 2523–2531. doi:10.1093/cercor/bhn013. PMID 18296435.
The runner's high describes a euphoric state resulting from long-distance running.
- ↑ 15.0 15.1 15.2 15.3
Josefsson T, Lindwall M, Archer T (2014). "Physical exercise intervention in depressive disorders: meta-analysis and systematic review". Scand J Med Sci Sports. 24 (2): 259–272. doi:10.1111/sms.12050. PMID 23362828.
Physical activity has also become increasingly and firmly associated with improvements in mental health and psychological well-being (Mutrie, 2000; Landers & Arent, 2007). In particular, exercise is believed to be effective in preventing depression and also to significantly reduce depressive symptoms in clinical as well as in nonclinical populations (O’Neal et al., 2000; Landers & Arent, 2007). Several correlational studies show that exercise is negatively related to depressive symptoms (e.g., Galper et al., 2006; Hassmén et al., 2000). Moreover, a considerably large number of intervention studies have by now investigated the effect of various exercise programs on depression and the vast majority of them indicate that exercise significantly reduces depression (e.g., Blumenthal et al., 2007; Martinsen et al., 1985; Singh et al., 1997). ... To date, it is not possible to determine exactly how effective exercise is in reducing depression symptoms in clinical and nonclinical depressed populations, respectively. However, the results from the present meta-analysis as well as from seven earlier meta-analyses (North et al., 1990; Craft & Landers, 1998; Lawlor & Hopker, 2001; Stathopoulou et al., 2006; Mead et al., 2009; Rethorst et al., 2009; Krogh et al., 2011) indicate that exercise has a moderate to large antidepressant effect. Some meta-analytic results (e.g., Rethorst et al., 2009) suggest that exercise may be even more efficacious for clinically depressed people. ... In short, our final conclusion is that exercise may well be recommended for people with mild and moderate depression who are willing, motivated, and physically healthy enough to engage in such a program.
- ↑ 16.0 16.1 16.2
Rosenbaum S, Tiedemann A, Sherrington C, Curtis J, Ward PB (2014). "Physical activity interventions for people with mental illness: a systematic review and meta-analysis". J Clin Psychiatry. 75 (9): 964–974. doi:10.4088/JCP.13r08765. PMID 24813261.
This systematic review and meta-analysis found that physical activity reduced depressive symptoms among people with a psychiatric illness. The current meta-analysis differs from previous studies, as it included participants with depressive symptoms with a variety of psychiatric diagnoses (except dysthymia and eating disorders). ... This review provides strong evidence for the antidepressant effect of physical activity; however, the optimal exercise modality, volume, and intensity remain to be determined. ...
Conclusion
Few interventions exist whereby patients can hope to achieve improvements in both psychiatric symptoms and physical health simultaneously without significant risks of adverse effects. Physical activity offers substantial promise for improving outcomes for people living with mental illness, and the inclusion of physical activity and exercise programs within treatment facilities is warranted given the results of this review. - ↑ 17.0 17.1 17.2 17.3
Szuhany KL, Bugatti M, Otto MW (October 2014). "A meta-analytic review of the effects of exercise on brain-derived neurotrophic factor". J Psychiatr Res. 60C: 56–64. doi:10.1016/j.jpsychires.2014.10.003. PMC 4314337. PMID 25455510.
Consistent evidence indicates that exercise improves cognition and mood, with preliminary evidence suggesting that brain-derived neurotrophic factor (BDNF) may mediate these effects. The aim of the current meta-analysis was to provide an estimate of the strength of the association between exercise and increased BDNF levels in humans across multiple exercise paradigms. We conducted a meta-analysis of 29 studies (N = 1111 participants) examining the effect of exercise on BDNF levels in three exercise paradigms: (1) a single session of exercise, (2) a session of exercise following a program of regular exercise, and (3) resting BDNF levels following a program of regular exercise. Moderators of this effect were also examined. Results demonstrated a moderate effect size for increases in BDNF following a single session of exercise (Hedges' g = 0.46, p < 0.001). Further, regular exercise intensified the effect of a session of exercise on BDNF levels (Hedges' g = 0.59, p = 0.02). Finally, results indicated a small effect of regular exercise on resting BDNF levels (Hedges' g = 0.27, p = 0.005). ... Effect size analysis supports the role of exercise as a strategy for enhancing BDNF activity in humans
- ↑ 18.0 18.1
Lees C, Hopkins J (2013). "Effect of aerobic exercise on cognition, academic achievement, and psychosocial function in children: a systematic review of randomized control trials". Prev Chronic Dis. 10: E174. doi:10.5888/pcd10.130010. PMC 3809922. PMID 24157077.
This omission is relevant, given the evidence that aerobic-based physical activity generates structural changes in the brain, such as neurogenesis, angiogenesis, increased hippocampal volume, and connectivity (12,13). In children, a positive relationship between aerobic fitness, hippocampal volume, and memory has been found (12,13). ... Mental health outcomes included reduced depression and increased self-esteem, although no change was found in anxiety levels (18). ... This systematic review of the literature found that [aerobic physical activity (APA)] is positively associated with cognition, academic achievement, behavior, and psychosocial functioning outcomes. Importantly, Shephard also showed that curriculum time reassigned to APA still results in a measurable, albeit small, improvement in academic performance (24). ... The actual aerobic-based activity does not appear to be a major factor; interventions used many different types of APA and found similar associations. In positive association studies, intensity of the aerobic activity was moderate to vigorous. The amount of time spent in APA varied significantly between studies; however, even as little as 45 minutes per week appeared to have a benefit.
- ↑ 19.0 19.1 19.2 19.3
Mura G, Moro MF, Patten SB, Carta MG (2014). "Exercise as an add-on strategy for the treatment of major depressive disorder: a systematic review". CNS Spectr. 19 (6): 496–508. doi:10.1017/S1092852913000953. PMID 24589012.
Considered overall, the studies included in the present review showed a strong effectiveness of exercise combined with antidepressants. ...
Conclusions
This is the first review to have focused on exercise as an add-on strategy in the treatment of MDD. Our findings corroborate some previous observations that were based on few studies and which were difficult to generalize.41,51,73,92,93 Given the results of the present article, it seems that exercise might be an effective strategy to enhance the antidepressant effect of medication treatments. Moreover, we hypothesize that the main role of exercise on treatment-resistant depression is in inducing neurogenesis by increasing BDNF expression, as was demonstrated by several recent studies. - ↑ 20.0 20.1 20.2 20.3
Ranjbar E, Memari AH, Hafizi S, Shayestehfar M, Mirfazeli FS, Eshghi MA (June 2015). "Depression and Exercise: A Clinical Review and Management Guideline". Asian J. Sports Med. 6 (2): e24055. doi:10.5812/asjsm.6(2)2015.24055. PMC 4592762. PMID 26448838.
Keeping in mind that exercise shows no medication side effects such as withdrawal symptoms (20), weight gain, dry mouth or insomnia (21), but shows potential health benefits such as weight reduction, it is highly recommended to use exercise as an adjunctive treatment for depression (22). New findings confirm that exercise can be recommended as a first-line treatment for mild to moderate depression; as an adjunct to medications (23) ; as an alternative to cognitive behavioral therapy (11) ; and in preventing depression in clinical as well as healthy populations (24-26). ... Although recent findings have shown that exercise can decrease depressive symptoms, there are still many questions and limitations to wider application of exercise in depression. For instance, there are deficiencies in methodological planning such as uncontrolled nonrandomized trials, small sample sizes, inadequate allocation concealment, lack of intention-to-treat analyses, non-blinded outcome assessments, and inclusion of subjects without clinical diagnosis that limit the interpretability of research outcomes (53).
Box 1: Patients with Depression Who May Particularly Benefit From Exercise Programs
Box 2: Depressive Disorders Other Than Major Depression That May Benefit From Exercise Programs
Box 3: The Characteristics of an Exercise Program that will Maximize the Anti-depressive Properties - ↑ 21.0 21.1 21.2 21.3 21.4 21.5
Den Heijer AE, Groen Y, Tucha L, Fuermaier AB, Koerts J, Lange KW, Thome J, Tucha O (July 2016). "Sweat it out? The effects of physical exercise on cognition and behavior in children and adults with ADHD: a systematic literature review". J. Neural. Transm. (Vienna). doi:10.1007/s00702-016-1593-7. PMID 27400928.
Cardio exercise seems acutely beneficial regarding various executive functions (e.g., impulsivity), response time and several physical measures. Beneficial chronic effects of cardio exercise were found on various functions as well, including executive functions, attention and behavior. The acute and chronic effects of non-cardio exercise remain more questionable but seem predominantly positive too. Research provides evidence that physical exercise represents a promising alternative or additional treatment option for patients with ADHD. Acute and chronic beneficial effects of especially cardio exercise were reported with regard to several cognitive, behavioral, and socio-emotional functions.
Cardio exercise: chronic effects
Cardio exercise (e.g., running and jumping) has also been linked to longer lasting effects on cognition in children with ADHD, resulting in improved attention (including auditory sustained attention and selective attention/information processing), executive functioning (including set shifting, (accuracy of) response inhibition and planning), verbal working memory, and cognitive speed (Chang et al. 2014; Choi et al. 2014; Gapin and Etnier 2010; Kang et al. 2011; Smith et al. 2013; Verret et al. 2012; Ziereis and Jansen 2015). However, a lack of robustness of chronic effects on cognition after cardio exercise is shown by some studies not reporting affected functions [e.g., (working) memory], and by studies not confirming significant beneficial long-term effects in the areas of inhibition, processing speed, planning, memory span, and continuous motor timing (Gapin and Etnier 2010; Smith et al. 2013). The lack of agreement in findings might partly be explained by the small sample sizes examined in the latter two studies (n = 14 and n = 18, respectively, which is less than the requested n = 34 for a one-factorial within subject design) and their consequential low statistical power. ...
It is assumed that physical exercise entails similar neurobiological effects as stimulants (e.g., increased availability of monoaminergic catecholamines in the brain, Fritz and O’Connor 2016; Wigal et al. 2013) and that these effects result in improved functioning in overlapping areas of cognition. A number of studies even showed (cognitive) gains of physical exercise on top of medication treatment (i.e., when children were on stimulant medication during the exercise bouts and tests; Choi et al. 2014; Gapin and Etnier 2010; Jensen and Kenny 2004; Kang et al. 2011; Maddigan et al. 2003; Mahon et al. 2008; McKune et al. 2003; Tantillo et al. 2002; Verret et al. 2012). - ↑ 22.0 22.1 22.2
Kamp CF, Sperlich B, Holmberg HC (July 2014). "Exercise reduces the symptoms of attention-deficit/hyperactivity disorder and improves social behaviour, motor skills, strength and neuropsychological parameters". Acta Paediatr. 103 (7): 709–14. doi:10.1111/apa.12628. PMID 24612421. สืบค้นเมื่อ 14 March 2015.
The present review summarises the impact of exercise interventions (1-10 weeks in duration with at least two sessions each week) on parameters related to ADHD in 7-to 13-year-old children. We may conclude that all different types of exercise (here yoga, active games with and without the involvement of balls, walking and athletic training) attenuate the characteristic symptoms of ADHD and improve social behaviour, motor skills, strength and neuropsychological parameters without any undesirable side effects. Available reports do not reveal which type, intensity, duration and frequency of exercise is most effective in this respect and future research focusing on this question with randomised and controlled long-term interventions is warranted.
- ↑ 23.0 23.1 23.2 23.3 23.4 23.5
Lynch WJ, Peterson AB, Sanchez V, Abel J, Smith MA (September 2013). "Exercise as a novel treatment for drug addiction: a neurobiological and stage-dependent hypothesis". Neurosci Biobehav Rev. 37 (8): 1622–1644. doi:10.1016/j.neubiorev.2013.06.011. PMC 3788047. PMID 23806439.
[exercise] efficacy may be related to its ability to normalize glutamatergic and dopaminergic signaling and reverse drug-induced changes in chromatin via epigenetic interactions with brain-derived neurotrophic factor (BDNF) in the reward pathway. ... these data show that exercise can affect dopaminergic signaling at many different levels, which may underlie its ability to modify vulnerability during drug use initiation. Exercise also produces neuroadaptations that may influence an individual's vulnerability to initiate drug use. Consistent with this idea, chronic moderate levels of forced treadmill running blocks not only subsequent methamphetamine-induced conditioned place preference, but also stimulant-induced increases in dopamine release in the NAc (Chen et al., 2008) and striatum (Marques et al., 2008). ... [These] findings indicate the efficacy of exercise at reducing drug intake in drug-dependent individuals ... wheel running [reduces] methamphetamine self-administration under extended access conditions (Engelmann et al., 2013) ... These findings suggest that exercise may "magnitude"-dependently prevent the development of an addicted phenotype possibly by blocking/reversing behavioral and neuro-adaptive changes that develop during and following extended access to the drug. ... Exercise has been proposed as a treatment for drug addiction that may reduce drug craving and risk of relapse. Although few clinical studies have investigated the efficacy of exercise for preventing relapse, the few studies that have been conducted generally report a reduction in drug craving and better treatment outcomes (see Table 4). ... Taken together, these data suggest that the potential benefits of exercise during relapse, particularly for relapse to psychostimulants, may be mediated via chromatin remodeling and possibly lead to greater treatment outcomes.
- ↑ 24.0 24.1 24.2 24.3
Olsen, CM (December 2011). "Natural rewards, neuroplasticity, and non-drug addictions". Neuropharmacology. 61 (7): 1109–1122. doi:10.1016/j.neuropharm.2011.03.010. PMC 3139704. PMID 21459101.
Similar to environmental enrichment, studies have found that exercise reduces self-administration and relapse to drugs of abuse (Cosgrove et al., 2002; Zlebnik et al., 2010). There is also some evidence that these preclinical findings translate to human populations, as exercise reduces withdrawal symptoms and relapse in abstinent smokers (Daniel et al., 2006; Prochaska et al., 2008), and one drug recovery program has seen success in participants that train for and compete in a marathon as part of the program (Butler, 2005). ... In humans, the role of dopamine signaling in incentive-sensitization processes has recently been highlighted by the observation of a dopamine dysregulation syndrome in some patients taking dopaminergic drugs. This syndrome is characterized by a medication-induced increase in (or compulsive) engagement in non-drug rewards such as gambling, shopping, or sex (Evans et al., 2006; Aiken, 2007; Lader, 2008).
- ↑ 25.0 25.1 25.2
Linke SE, Ussher M (2015). "Exercise-based treatments for substance use disorders: evidence, theory, and practicality". Am J Drug Alcohol Abuse. 41 (1): 7–15. doi:10.3109/00952990.2014.976708. PMID 25397661.
The limited research conducted suggests that exercise may be an effective adjunctive treatment for SUDs. In contrast to the scarce intervention trials to date, a relative abundance of literature on the theoretical and practical reasons supporting the investigation of this topic has been published. ... numerous theoretical and practical reasons support exercise-based treatments for SUDs, including psychological, behavioral, neurobiological, nearly universal safety profile, and overall positive health effects.
- ↑ 26.0 26.1 26.2 26.3
Zhou Y, Zhao M, Zhou C, Li R (July 2015). "Sex differences in drug addiction and response to exercise intervention: From human to animal studies". Front. Neuroendocrinol. 40: 24–41. doi:10.1016/j.yfrne.2015.07.001. PMID 26182835.
Collectively, these findings demonstrate that exercise may serve as a substitute or competition for drug abuse by changing ΔFosB or cFos immunoreactivity in the reward system to protect against later or previous drug use. ... As briefly reviewed above, a large number of human and rodent studies clearly show that there are sex differences in drug addiction and exercise. The sex differences are also found in the effectiveness of exercise on drug addiction prevention and treatment, as well as underlying neurobiological mechanisms. The postulate that exercise serves as an ideal intervention for drug addiction has been widely recognized and used in human and animal rehabilitation. ... In particular, more studies on the neurobiological mechanism of exercise and its roles in preventing and treating drug addiction are needed.
- ↑ 27.0 27.1 27.2 27.3 27.4 Farina N, Rusted J, Tabet N (January 2014). "The effect of exercise interventions on cognitive outcome in Alzheimer's disease: a systematic review". Int Psychogeriatr. 26 (1): 9–18. doi:10.1017/S1041610213001385. PMID 23962667.
Six RCTs were identified that exclusively considered the effect of exercise in AD patients. Exercise generally had a positive effect on rate of cognitive decline in AD. A meta-analysis found that exercise interventions have a positive effect on global cognitive function, 0.75 (95% CI = 0.32-1.17). ... The most prevalent subtype of dementia is Alzheimer’s disease (AD), accounting for up to 65.0% of all dementia cases ... Cognitive decline in AD is attributable at least in part to the buildup of amyloid and tau proteins, which promote neuronal dysfunction and death (Hardy and Selkoe, 2002; Karran et al., 2011). Evidence in transgenic mouse models of AD, in which the mice have artificially elevated amyloid load, suggests that exercise programs are able to improve cognitive function (Adlard et al., 2005; Nichol et al., 2007). Adlard and colleagues also determined that the improvement in cognitive performance occurred in conjunction with a reduced amyloid load. Research that includes direct indices of change in such biomarkers will help to determine the mechanisms by which exercise may act on cognition in AD.
- ↑ 28.0 28.1 28.2 28.3 Rao AK, Chou A, Bursley B, Smulofsky J, Jezequel J (January 2014). "Systematic review of the effects of exercise on activities of daily living in people with Alzheimer's disease". Am J Occup Ther. 68 (1): 50–56. doi:10.5014/ajot.2014.009035. PMID 24367955.
Alzheimer’s disease (AD) is a progressive neurological disorder characterized by loss in cognitive function, abnormal behavior, and decreased ability to perform basic activities of daily living [(ADLs)] ... All studies included people with AD who completed an exercise program consisting of aerobic, strength, or balance training or any combination of the three. The length of the exercise programs varied from 12 weeks to 12 months. ... Six studies involving 446 participants tested the effect of exercise on ADL performance ... exercise had a large and significant effect on ADL performance (z = 4.07, p < .0001; average effect size = 0.80). ... These positive effects were apparent with programs ranging in length from 12 wk (Santana-Sosa et al., 2008; Teri et al., 2003) and intermediate length of 16 wk (Roach et al., 2011; Vreugdenhil et al., 2012) to 6 mo (Venturelli et al., 2011) and 12 mo (Rolland et al., 2007). Furthermore, the positive effects of a 3-mo intervention lasted 24 mo (Teri et al., 2003). ... No adverse effects of exercise on ADL performance were noted. ... The study with the largest effect size implemented a walking and aerobic program of only 30 min four times a week (Venturelli et al., 2011).
- ↑ Mattson, MP (2014). "Interventions that improve body and brain bioenergetics for Parkinson's disease risk reduction and therapy". J Parkinsons Dis. 4 (1): 1–13. doi:10.3233/JPD-130335. PMID 24473219.
- ↑ 30.0 30.1 Grazina, R; Massano, J (2013). "Physical exercise and Parkinson's disease: influence on symptoms, disease course and prevention". Rev Neurosci. 24 (2): 139–152. doi:10.1515/revneuro-2012-0087. PMID 23492553.
- ↑ van der Kolk NM, King LA (September 2013). "Effects of exercise on mobility in people with Parkinson's disease". Mov. Disord. 28 (11): 1587–1596. doi:10.1002/mds.25658. PMID 24132847.
- ↑ Tomlinson CL, Patel S, Meek C, Herd CP, Clarke CE, Stowe R, Shah L, Sackley CM, Deane KH, Wheatley K, Ives N (September 2013). "Physiotherapy versus placebo or no intervention in Parkinson's disease". Cochrane Database Syst Rev. 9: CD002817. doi:10.1002/14651858.CD002817.pub4. PMID 24018704.
- ↑ 33.0 33.1 33.2
Blondell SJ, Hammersley-Mather R, Veerman JL (May 2014). "Does physical activity prevent cognitive decline and dementia?: A systematic review and meta-analysis of longitudinal studies". BMC Public Health. 14: 510. doi:10.1186/1471-2458-14-510. PMC 4064273. PMID 24885250.
Longitudinal observational studies show an association between higher levels of physical activity and a reduced risk of cognitive decline and dementia. A case can be made for a causal interpretation. Future research should use objective measures of physical activity, adjust for the full range of confounders and have adequate follow-up length. Ideally, randomised controlled trials will be conducted. ... On the whole the results do, however, lend support to the notion of a causal relationship between physical activity, cognitive decline and dementia, according to the established criteria for causal inference.
- ↑ Cormie P, Nowak AK, Chambers SK, Galvão DA, Newton RU (April 2015). "The potential role of exercise in neuro-oncology". Front. Oncol. 5: 85. doi:10.3389/fonc.2015.00085. PMC 4389372. PMID 25905043.
- ↑ 35.0 35.1 Malenka RC, Nestler EJ, Hyman SE (2009). Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 5, 351. ISBN 9780071481274.
The clinical actions of fluoxetine, like those of many neuropharmacologic agents, reflect drug-induced neural plasticity, which is the process by which neurons adapt over time in response to chronic disturbance. ... For example, evidence indicates that prolonged increases in cortisol may be damaging to hippocampal neurons and can suppress hippocampal neurogenesis (the generation of new neurons postnatally).
- ↑ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 8:Atypical Neurotransmitters". ใน Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 199, 215. ISBN 9780071481274.
Neurotrophic factors are polypeptides or small proteins that support the growth, differentiation, and survival of neurons. They produce their effects by activation of tyrosine kinases.
- ↑ 37.0 37.1 37.2
Tarumi, T; Zhang, R (January 2014). "Cerebral hemodynamics of the aging brain: risk of Alzheimer disease and benefit of aerobic exercise". Front Physiol. 5: 6. doi:10.3389/fphys.2014.00006. PMC 3896879. PMID 24478719.
Exercise-related improvements in brain function and structure may be conferred by the concurrent adaptations in vascular function and structure. Aerobic exercise increases the peripheral levels of growth factors (e.g., BDNF, IFG-1, and VEGF) which cross the blood-brain barrier (BBB) and stimulate neurogenesis and angiogenesis (Trejo et al., 2001; Lee et al., 2002; Fabel et al., 2003; Lopez-Lopez et al., 2004).
- ↑ 38.0 38.1 38.2 38.3 38.4 38.5 38.6 38.7 38.8
Silverman MN, Deuster PA (October 2014). "Biological mechanisms underlying the role of physical fitness in health and resilience". Interface Focus. 4 (5): 20140040. doi:10.1098/rsfs.2014.0040. PMID 25285199.
Physical fitness, achieved through regular exercise and/or spontaneous physical activity, can protect against the development of chronic stress- and inflammatory-related disease by optimizing physiological and neuroendocrine stress responsivity, promoting an anti-inflammatory state, and enhancing neuroplasticity and growth factor expression. stress responsive systems are adaptive when activated and terminated in a timely manner, prolonged (or insufficient) activation of these systems can cause a variety of maladaptive responses. ... For example, Rimelle et al. [123] documented significantly lower cortisol and heart rate responses to psychosocial stress (Trier social stress test) in trained men compared with untrained men. Moreover, significantly greater calmness and better mood, and a trend towards lower state anxiety, were noted in these trained men during the stress protocol. ... Whereas hippocampal and/or serum/plasma BDNF levels are downregulated by chronic psychosocial stress and inflammation [138,180,201], central and peripheral BDNF levels can be upregulated by acute exercise [33,198,202,203]. ... Exercise-induced increases in brain monoamines (norepinephrine and serotonin) may also contribute to increased expression of hippocampal BDNF [194]. In addition, other growth factors—insulin-like growth factor-1 (IGF-1) and vascular endothelial growth factor—have been shown to play an important role in BDNF-induced effects on neuroplasticity [33,172,190,192], as well as exerting neuroprotective effects of their own [33,214,215], thereby contributing to the beneficial effects of exercise on brain health. Like BDNF, increases in circulating IGF-1 levels in response to acute exercise are only transient and possibly time-dependent as it relates to chronic training (i.e. increases seen after 12 weeks of training) [216]. ... Whereas reduced HPA axis reactivity to a given stressor has repeatedly been reported in physically fit individuals, the finding of reduced sympathetic reactivity is less consistent.
- ↑ 39.0 39.1 39.2 Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 6: Widely Projecting Systems: Monoamines, Acetylcholine, and Orexin". ใน Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147–148, 154–157. ISBN 9780071481274.
Neurons from the SNc densely innervate the dorsal striatum where they play a critical role in the learning and execution of motor programs. Neurons from the VTA innervate the ventral striatum (nucleus accumbens), olfactory bulb, amygdala, hippocampus, orbital and medial prefrontal cortex, and cingulate cortex. VTA DA neurons play a critical role in motivation, reward-related behavior, attention, and multiple forms of memory. ... Thus, acting in diverse terminal fields, dopamine confers motivational salience ("wanting") on the reward itself or associated cues (nucleus accumbens shell region), updates the value placed on different goals in light of this new experience (orbital prefrontal cortex), helps consolidate multiple forms of memory (amygdala and hippocampus), and encodes new motor programs that will facilitate obtaining this reward in the future (nucleus accumbens core region and dorsal striatum). ... DA has multiple actions in the prefrontal cortex. It promotes the "cognitive control" of behavior: the selection and successful monitoring of behavior to facilitate attainment of chosen goals. Aspects of cognitive control in which DA plays a role include working memory, the ability to hold information "on line" in order to guide actions, suppression of prepotent behaviors that compete with goal-directed actions, and control of attention and thus the ability to overcome distractions. ... Noradrenergic projections from the LC thus interact with dopaminergic projections from the VTA to regulate cognitive control. ...
- ↑ Carvalho A, Rea IM, Parimon T, Cusack BJ (2014). "Physical activity and cognitive function in individuals over 60 years of age: a systematic review". Clin Interv Aging. 9: 661–682. doi:10.2147/CIA.S55520. PMC 3990369. PMID 24748784.
- ↑ 41.0 41.1
Ehlert T, Simon P, Moser DA (February 2013). "Epigenetics in sports". Sports Med. 43 (2): 93–110. doi:10.1007/s40279-012-0012-y. PMID 23329609.
Alterations in epigenetic modification patterns have been demonstrated to be dependent on exercise and growth hormone (GH), insulin-like growth factor 1 (IGF-1), and steroid administration. ... the authors observed improved stress coping in exercised subjects. Investigating the dentate gyrus, a brain region which is involved in learning and coping with stressful and traumatic events, they could show that this effect is mediated by increased phosphorylation of serine 10 combined with H3K14 acetylation, which is associated with local opening of condensed chromatin. Consequently, they found increased immediate early gene expression as shown for c-FOS (FBJ murine osteosarcoma viral oncogene homologue).
- ↑ 42.0 42.1 42.2 42.3 42.4 42.5 42.6
Phillips C, Baktir MA, Srivatsan M, Salehi A (2014). "Neuroprotective effects of physical activity on the brain: a closer look at trophic factor signaling". Front Cell Neurosci. 8: 170. doi:10.3389/fncel.2014.00170. PMC 4064707. PMID 24999318.
Moreover, recent evidence suggests that myokines released by exercising muscles affect the expression of brain-derived neurotrophic factor synthesis in the dentate gyrus of the hippocampus, a finding that could lead to the identification of new and therapeutically important mediating factors. ... Studies have demonstrated the intensity of exercise training is positively correlated with BDNF plasma levels in young, healthy individuals (Ferris et al., 2007). Resistance exercise has also been shown to elevate serum BDNF levels in young individuals (Yarrow et al., 2010). Moreover, it has been shown that moderate levels of physical activity in people with AD significantly increased plasma levels of BDNF (Coelho et al., 2014). ... In humans, it has been shown that 4 h of rowing activity leads to increased levels of plasma BDNF from the internal jugular (an indicator of central release from the brain) and radial artery (an indicator of peripheral release; Rasmussen et al., 2009). Seifert et al. (2010) reported that basal release of BDNF increases following 3 months endurance training in young and healthy individuals, as measured from the jugular vein. These trends are augmented by rodent studies showing that endurance training leads to increased synthesis of BDNF in the hippocampal formation (Neeper et al., 1995, 1996). ... Both BDNF and IGF-1 play a significant role in cognition and motor function in humans. ... Multiple large-scale studies in humans have shown that serum levels of IGF-1 are correlated with fitness and as well as body mass indices (Poehlman and Copeland, 1990). Furthermore, animal studies have shown that exercise in rats is associated with increased amounts of IGF-1 in the CSF.
- ↑ 43.0 43.1 43.2
Heinonen I, Kalliokoski KK, Hannukainen JC, Duncker DJ, Nuutila P, Knuuti J (November 2014). "Organ-Specific Physiological Responses to Acute Physical Exercise and Long-Term Training in Humans". Physiology (Bethesda). 29 (6): 421–436. doi:10.1152/physiol.00067.2013. PMID 25362636.
The Effects of Acute Exercise
Studies in humans and animals have shown that brain blood flow remains largely unchanged in response to acute exercise[,] ... does not increase with increasing exercise intensity[, and] ... increased metabolic demands of active brain parts are mostly met by redistributing oxygen supply, although changes in oxygen extraction may also contribute. During exercise, blood flow is directed to the areas controlling locomotor, vestibular, cardiorespiratory, and visual functions (8, 91), facilitated by direct communication of neurons and vascular cells (94, 134). ... with increasing exercise intensity, brain glucose uptake decreases (75) as the uptake and utilization of lactate is enhanced (65, 139, 182). Regional differences in brain glucose uptake are also evident, which is furthermore influenced by the level of physical fitness. Thus the decrease in glucose uptake in the dorsal part of the anterior cingulate cortex during exercise is significantly more pronounced in subjects with higher exercise capacity (75) ...
The Effects of Long-Term Exercise Training
[A] physically active lifestyle has been shown to lead to higher cognitive performance and delayed or prevented neurological conditions in humans (71, 101, 143, 191). ... The production of brain-derived neurotrophic factor (BDNF), a key protein regulating maintenance and growth of neurons, is known to be stimulated by acute exercise (145), which may contribute to learning and memory. BDNF is released from brain already at rest but increases two- to threefold during exercise, which contributes 70-80% of circulating BDNF (145). - ↑ 44.0 44.1 44.2 Torres-Aleman, I (2010). "Toward a comprehensive neurobiology of IGF-I". Dev Neurobiol. 70 (5): 384–96. doi:10.1002/dneu.20778. PMID 20186710.
However, the adult brain appears to have an external input from serum IGF-I, where this anabolic peptide is abundant. Thus, serum IGF-I has been proven to be an important modulator of brain activity, including higher functions such as cognition. Many of these functions can be ascribed to its tissue-remodeling activity as IGF-I modulates adult neurogenesis and angiogenesis. Other activities are cytoprotective; indeed, IGF-I can be considered a key neuroprotective peptide. Still others pertain to the functional characteristics of brain cells, such as cell excitability. Through modulation of membrane channels and neurotransmission, IGF-I impinges directly on neuronal plasticity, the cellular substrate of cognition. However, to fully understand the role of IGF-I in the brain, we have to sum the actions of locally produced IGF-I to those of serum IGF-I ... An operational approach to overcome this limitation would be to consider IGF-I as a signal coupling environmental influences on body metabolism with brain function. Or in a more colloquial way, we may say that IGF-I links body "fitness" with brain fitness
- ↑ 45.0 45.1 45.2
Aberg, D (2010). "Role of the growth hormone/insulin-like growth factor 1 axis in neurogenesis". Endocr Dev. 17: 63–76. doi:10.1159/000262529. PMID 19955757.
The growth hormone/insulin-like growth factor 1 (GH/IGF-1) axis is not only involved in brain growth, development and myelination, but also in brain plasticity as indexed by neurogenesis. This may have links to various cognitive effects of GH and IGF-1. GH and IGF-1 affect the genesis of neurons, astrocytes, endothelial cells and oligodendrocytes. Specifically, IGF-1 increases progenitor cell proliferation and numbers of new neurons, oligodendrocytes, and blood vessels in the dentate gyrus of the hippocampus. In the adult cerebral cortex IGF-1 only affects oligodendrogenesis. ... Altogether, data suggest that both exogenous and endogenous GH and/or IGF-1 may be used as agents to enhance cell genesis and neurogenesis in the adult brain. ... GH and IGF-1 have been shown to affect a multitude of mechanisms, including neurogenesis, oligodendrogenesis, angiogenesis, glutamate receptor activation, cholinergic system, dopaminergic reward system, monoamine abundance, dendritic arborization, astrocyte communication via connexin 43, and opioid receptor abundance ... IGF-1 also reaches the brain via both the capillary bed BBB and via the blood-CSF barrier. It appears that IGF-1 uptake is mediated by a specific carrier both in the capillary bed BBB [40] and in the blood-CSF barrier [41, 42]. Moreover, IGF-1 transport across the BBB can be either increased, such as by exercise [43] ... Thus, although not fully characterized, there appear to be mechanisms for transport of both GH and IGF-1 across the BBB. ... Interestingly, exercise is a factor known to enhance cell genesis in the brain, and it appears that IGF-1 is a key mediator of the effect of exercise in terms of cell genesis in the adult brain [52, 53]. ... IGF-1 treatment enhances neurogenesis [52, 53, 55], oligodendrogenesis [56, 58] and angiogenesis [59]. ... As physical exercise has positive effects in many diseases as well as in normal health, it is of interest that circulating IGF-1 as been shown to be one of the mediators of enhanced neurogenesis in the hippocampus.
- ↑ 46.0 46.1 46.2
Malenka RC, Nestler EJ, Hyman SE (2009). Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 221, 412. ISBN 9780071481274.
BDNF, CNTF, insulin-like growth factor-1 (IGF-1), and VEGF have been proven to support motor neuron survival in vitro and in vivo. ... VEGF exerts its effects through two receptor tyrosine kinases, VEGFR1 (also known as flt-1) and VEGFR2 (or flk-1). VEGF and its receptors are expressed in neurons and glia, and this expression is highly up-regulated by hypoxia. The neurotrophic properties of VEGF were first identified when mutations in the VEGF promoter of mice resulted in ALS-like symptoms. Subsequently, VEGF was found to rescue hypoxia-induced motor neuron death both in vivo and in vitro. Recently, a polymorphism in the VEGF promoter sequence was identified in a subset of ALS patients. It is thought that low VEGF levels may underlie motor neuron degeneration in at least one group of patients, but measurement of VEGF in ALS patients has proven difficult. VEGF may also be important for response to stroke and other forms of neural injury. ... One of the prototypical triggers for apoptosis, at least in vitro, is the withdrawal of neurotrophic factors. Neurotrophic factor receptors, such as the TrkA receptor for NGF or the IGF-I receptor for insulin-like growth factor, activate prosurvival signaling cascades
- ↑ Gatti R, De Palo EF, Antonelli G, Spinella P (July 2012). "IGF-I/IGFBP system: metabolism outline and physical exercise". J. Endocrinol. Invest. 35 (7): 699–707. doi:10.3275/8456. PMID 22714057.
Copeland et al. (90) studied the effect of a moderate-intensity exercise and a high-intensity equal duration intervalled exercise in healthy males. IGF-I and IGFBP-3 increased during both exercise trials, but only the IGFBP-3 area under curve was significantly greater during high-intensity exercise than resting control session. ... Decreased IGF-I and increased IGFBP-1 levels, observed by Rarick et al. (100) after mild aerobic training, might be an adaptive physiological response to prevent hypoglycemia following insulin-sensitizing training. In fact the decrease of circulating IGF-I during short-term training seems to be reflective of favorable neuromuscular anabolic adaptation and is a normal adaptive response to increased physical activity. The potential for exercise-induced increases in circulating IGF-I seems to require longer training duration (100).
- ↑ 48.0 48.1
Bouchard, J; Villeda, SA (2015). "Aging and brain rejuvenation as systemic events". J. Neurochem. 132 (1): 5–19. doi:10.1111/jnc.12969. PMC 4301186. PMID 25327899.
The beneficial effects of exercise extend beyond peripheral tissues to also include the brain. ... Because of the blood-brain barrier, it was traditionally thought that the beneficial effects of exercise on the CNS were not orchestrated through systemic changes in the periphery. However, recent studies suggest that the effects of exercise are, in part, mediated by changes in the systemic environment. Investigations looking at magnetic resonance imaging (MRI) measurements of cerebral blood volume in the hippocampus have demonstrated that exercise selectively increased the cerebral blood volume of the dentate gyrus, correlating with post-mortem increase in neurogenesis (Pereira et al. 2007). From a molecular perspective, elevated systemic levels of circulating growth factors such as vascular endothelial growth factor and insulin-like growth factor 1 (IGF-1) in blood elicited by increased exercise have been shown to mediate, in part, enhancements in neurogenesis (Trejo et al. 2001; Fabel et al. 2003). Coincidently, circulating levels of IGF-1 decrease with age and the restoration to levels resembling a younger systemic environment up-regulate neurogenesis and improve learning and memory (Lichtenwalner et al. 2001; Darnaudery et al. 2006).
- ↑ 49.0 49.1
Valkanova V, Eguia RR, Ebmeier KP (June 2014). "Mind over matter—what do we know about neuroplasticity in adults?". Int Psychogeriatr. 26 (6): 891–909. doi:10.1017/S1041610213002482. PMID 24382194.
Control group: Active
Intervention: Aerobic exercise
[Increased GMV in:] Lobes (dorsal anterior cingulate cortex, supplementary motor area, middle frontal gyrus bilaterally) ; R inferior frontal gyrus, middle frontal gyrus and L superior temporal lobe; increase in the volume of anterior white matter tracts ... ↑GMV anterior hippocampus - ↑ Ruscheweyh R, Willemer C, Krüger K, Duning T, Warnecke T, Sommer J, Völker K, Ho HV, Mooren F, Knecht S, Flöel A (July 2011). "Physical activity and memory functions: an interventional study". Neurobiol. Aging. 32 (7): 1304–19. doi:10.1016/j.neurobiolaging.2009.08.001. PMID 19716631.
- ↑ 51.0 51.1 51.2 Erickson KI, Voss MW, Prakash RS, Basak C, Szabo A, Chaddock L, Kim JS, Heo S, Alves H, White SM, Wojcicki TR, Mailey E, Vieira VJ, Martin SA, Pence BD, Woods JA, McAuley E, Kramer AF (February 2011). "Exercise training increases size of hippocampus and improves memory". Proc. Natl. Acad. Sci. U.S.A. 108 (7): 3017–3022. doi:10.1073/pnas.1015950108. PMC 3041121. PMID 21282661.
- ↑ 52.0 52.1 52.2 52.3 52.4 52.5 52.6
Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 13: Higher Cognitive Function and Behavioral Control". ใน Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 313–321. ISBN 9780071481274.
• Executive function, the cognitive control of behavior, depends on the prefrontal cortex, which is highly developed in higher primates and especially humans.
• Working memory is a short-term, capacity-limited cognitive buffer that stores information and permits its manipulation to guide decision-making and behavior. ...
These diverse inputs and back projections to both cortical and subcortical structures put the prefrontal cortex in a position to exert what is often called “top-down” control or cognitive control of behavior. ... The prefrontal cortex receives inputs not only from other cortical regions, including association cortex, but also, via the thalamus, inputs from subcortical structures subserving emotion and motivation, such as the amygdala (Chapter 14) and ventral striatum (or nucleus accumbens; Chapter 15). ...
In conditions in which prepotent responses tend to dominate behavior, such as in drug addiction, where drug cues can elicit drug seeking (Chapter 15), or in attention deficit hyperactivity disorder (ADHD; described below), significant negative consequences can result. ... ADHD can be conceptualized as a disorder of executive function; specifically, ADHD is characterized by reduced ability to exert and maintain cognitive control of behavior. Compared with healthy individuals, those with ADHD have diminished ability to suppress inappropriate prepotent responses to stimuli (impaired response inhibition) and diminished ability to inhibit responses to irrelevant stimuli (impaired interference suppression). ... Functional neuroimaging in humans demonstrates activation of the prefrontal cortex and caudate nucleus (part of the striatum) in tasks that demand inhibitory control of behavior. ... Early results with structural MRI show thinning of the cerebral cortex in ADHD subjects compared with age-matched controls in prefrontal cortex and posterior parietal cortex, areas involved in working memory and attention. - ↑
Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 13: Higher Cognitive Function and Behavioral Control". ใน Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. p. 315. ISBN 9780071481274.
However, damage to the prefrontal cortex has a significant deleterious effect on social behavior, decision making, and adaptive responding to the changing circumstances of life. ... Several subregions of the prefrontal cortex have been implicated in partly distinct aspects of cognitive control, although these distinctions remain somewhat vaguely defined. The anterior cingulate cortex is involved in processes that require correct decision-making, as seen in conflict resolution (eg, the Stroop test, see in Chapter 16), or cortical inhibition (eg, stopping one task and switching to another). The medial prefrontal cortex is involved in supervisory attentional functions (eg, action-outcome rules) and behavioral flexibility (the ability to switch strategies). The dorsolateral prefrontal cortex, the last brain area to undergo myelination during development in late adolescence, is implicated in matching sensory inputs with planned motor responses. The ventromedial prefrontal cortex seems to regulate social cognition, including empathy. The orbitofrontal cortex is involved in social decision making and in representing the valuations assigned to different experiences.
- ↑ Malenka RC, Nestler EJ, Hyman SE (2009). Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 147, 266, 376. ISBN 9780071481274.
VTA DA neurons play a critical role in motivation, reward-related behavior (Chapter 15), attention, and multiple forms of memory. This organization of the DA system, wide projection from a limited number of cell bodies, permits coordinated responses to potent new rewards. Thus, acting in diverse terminal fields, dopamine confers motivational salience (“wanting”) on the reward itself or associated cues (nucleus accumbens shell region) ... Dopamine acts in the nucleus accumbens to attach motivational significance to stimuli associated with reward. ... The NAc and VTA are central components of the circuitry underlying reward and memory of reward. ... The NAc is involved in learning associated with reinforcement ... The shell of the NAc appears to be particularly important to initial drug actions within reward circuitry; addictive drugs appear to have a greater effect on dopamine release in the shell than in the core of the NAc.
- ↑ 55.0 55.1 Malenka RC, Nestler EJ, Hyman SE (2009). Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 148, 324–328, 438. ISBN 9780071481274.
[dopamine] helps consolidate multiple forms of memory (amygdala and hippocampus) ... the specific crucial structures underlying the ability to store declarative memories are the hippocampus, the subicular complex, and the entorhinal cortex ... These findings strongly suggest that LTP in the hippocampus is required for at least some forms of learning and memory known to be dependent on this brain region. ... Evidence that the caudate nucleus and putamen influence stimulus-response learning comes from lesion studies in rodents and primates and from neuroimaging studies in humans and from studies of human disease. In Parkinson disease, the dopaminergic innervation of the caudate and putamen is severely compromised by the death of dopamine neurons in the substantia nigra pars compacta (Chapter 17). Patients with Parkinson disease have normal declarative memory ... However, they have marked impairments of stimulus-response learning. Patients with Parkinson disease or other basal ganglia disorders such as Huntington disease (in which caudate neurons themselves are damaged) have deficits in other procedural learning tasks, such as the acquisition of new motor programs. ... Huntington disease is associated with degenerative changes that are most apparent in the caudate nucleus and putamen.
- ↑ Grimaldi G, Argyropoulos GP, Bastian A, Cortes M, Davis NJ, Edwards DJ, Ferrucci R, Fregni F, Galea JM, Hamada M, Manto M, Miall RC, Morales-Quezada L, Pope PA, Priori A, Rothwell J, Tomlinson SP, Celnik P (2014). "Cerebellar Transcranial Direct Current Stimulation (ctDCS) : A Novel Approach to Understanding Cerebellar Function in Health and Disease". Neuroscientist. doi:10.1177/1073858414559409. PMID 25406224.
- ↑ Sereno MI, Huang RS (2014). "Multisensory maps in parietal cortex". Curr. Opin. Neurobiol. 24 (1): 39–46. doi:10.1016/j.conb.2013.08.014. PMC 3969294. PMID 24492077.
- ↑ 58.0 58.1 58.2 58.3 58.4
Diamond, A (2013). "Executive functions". Annu Rev Psychol. 64: 135–168. doi:10.1146/annurev-psych-113011-143750. PMC 4084861. PMID 23020641.
Core EFs are inhibition [response inhibition (self-control—resisting temptations and resisting acting impulsively) and interference control (selective attention and cognitive inhibition)], working memory, and cognitive flexibility (including creatively thinking “outside the box,” seeing anything from different perspectives, and quickly and flexibly adapting to changed circumstances). ... EFs and prefrontal cortex are the first to suffer, and suffer disproportionately, if something is not right in your life. They suffer first, and most, if you are stressed (Arnsten 1998, Liston et al. 2009, Oaten & Cheng 2005), sad (Hirt et al. 2008, von Hecker & Meiser 2005), lonely (Baumeister et al. 2002, Cacioppo & Patrick 2008, Campbell et al. 2006, Tun et al. 2012), sleep deprived (Barnes et al. 2012, Huang et al. 2007), or not physically fit (Best 2010, Chaddock et al. 2011, Hillman et al. 2008). Any of these can cause you to appear to have a disorder of EFs, such as ADHD, when you do not. You can see the deleterious effects of stress, sadness, loneliness, and lack of physical health or fitness at the physiological and neuroanatomical level in prefrontal cortex and at the behavioral level in worse EFs (poorer reasoning and problem solving, forgetting things, and impaired ability to exercise discipline and self-control). ...
EFs can be improved (Diamond & Lee 2011, Klingberg 2010). ... At any age across the life cycle EFs can be improved, including in the elderly and in infants. There has been much work with excellent results on improving EFs in the elderly by improving physical fitness (Erickson & Kramer 2009, Voss et al. 2011) ... Inhibitory control (one of the core EFs) involves being able to control one’s attention, behavior, thoughts, and/or emotions to override a strong internal predisposition or external lure, and instead do what’s more appropriate or needed. Without inhibitory control we would be at the mercy of impulses, old habits of thought or action (conditioned responses), and/or stimuli in the environment that pull us this way or that. Thus, inhibitory control makes it possible for us to change and for us to choose how we react and how we behave rather than being unthinking creatures of habit. It doesn’t make it easy. Indeed, we usually are creatures of habit and our behavior is under the control of environmental stimuli far more than we usually realize, but having the ability to exercise inhibitory control creates the possibility of change and choice. - ↑ 59.0 59.1 59.2
Janssen M, Toussaint HM, van Mechelen W, Verhagen EA (2014). "Effects of acute bouts of physical activity on children's attention: a systematic review of the literature". Springerplus. 3: 410. doi:10.1186/2193-1801-3-410. PMC 4132441. PMID 25133092.
There is weak evidence for the effect of acute bouts of physical activity on attention. ... Fortunately, the literature-base on the acute effect of PA on the underlying cognitive processes of academic performance is growing. Hillman et al. (2011) found in their review a positive effect of acute PA on brain health and cognition in children, but concluded it was complicated to compare the different studies due to the different outcome measures (e.g. memory, response time and accuracy, attention, and comprehension). Therefore, this review focuses on the sole outcome measure ‘attention’ as a mediator for cognition and achievement.
- ↑ 60.0 60.1 Ilieva IP, Hook CJ, Farah MJ (2015). "Prescription Stimulants' Effects on Healthy Inhibitory Control, Working Memory, and Episodic Memory: A Meta-analysis". J Cogn Neurosci: 1–21. doi:10.1162/jocn_a_00776. PMID 25591060.
- ↑ 61.0 61.1 61.2 61.3
Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 14: Mood and Emotion". ใน Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 350–359. ISBN 9780071481274.
The excessive release of stress hormones, such as cortisol, which occurs in many individuals with mood disorders, may result from hyperfunctioning of the PVN of the hypothalamus, hyperfunctioning of the amygdala (which activates the PVN), or hypofunctioning of the hippocampus (which exerts a potent inhibitory influence on the PVN). ... Chronic stress decreases the expression of brain-derived neurotrophic factor (BDNF) in the hippocampus, which in turn may contribute to the atrophy of CA3 neurons and their increased vulnerability to a variety of neuronal insults. Chronic elevation of glucocorticoid levels is also known to decrease the survival of these neurons. Such activity may increase the dendritic arborizations and survival of the neurons, or help repair or protect the neurons from further damage. ... Stress and glucocorticoids inhibit, and a wide variety of antidepressant drugs, exercise, and enriched environments activate hippocampal neurogenesis.
- ↑ 62.0 62.1 62.2 62.3 62.4
Fuqua JS, Rogol AD (July 2013). "Neuroendocrine alterations in the exercising human: implications for energy homeostasis". Metab. Clin. Exp. 62 (7): 911–921. doi:10.1016/j.metabol.2013.01.016. PMID 23415825.
Cortisol has wide-ranging effects, including alterations of carbohydrate, protein, and lipid metabolism; catabolic effects on skin, muscle, connective tissue, and bone; immunomodulatory effects; blood pressure and circulatory system regulation; and effects on mood and central nervous system function. In the short term, activation of the HPA axis in response to stress is adaptive. However, long-term stress promoting chronic exposure of tissues to high cortisol concentrations becomes maladaptive. ... Exercise, particularly sustained aerobic activity, is a potent stimulus of cortisol secretion. The circulating concentrations of cortisol are directly proportional to the intensity of exercise as measured by oxygen uptake. As is the case for the GH/IGF-1 and HPG axes, the HPA axis also receives many other inputs, including the light/dark cycle, feeding schedules, immune regulation, and many neurotransmitters that mediate the effects of exercise and physical and psychic stress [52]. ... The HPA is activated by stress, whether physical (exercise) or psychological. ... Thus, a negative net energy balance leads to activation of the HPA axis and the circulating concomitants of the catabolic state in an attempt to keep core processes functional, realizing that the stress of exercise has no effect on cortisol and circulating metabolic substrates beyond the impact of the exercise energy expenditure on energy availability [60]. Thuma et al. [61] had already made the important observation that the reported differences in cortisol levels pre- and post-exercise depended on whether this difference was measured from a single pre-test level or from the physiologic circadian baseline as determined in an independent session in the resting state. By this analytical technique, these investigators showed that increasing energy expenditure led to significant cortisol release. This release was apparent if they subtracted the physiologic circadian baseline from the post-exercise value.
- ↑ 63.0 63.1 63.2 63.3
Ebner NC, Kamin H, Diaz V, Cohen RA, MacDonald K (January 2015). "Hormones as "difference makers" in cognitive and socioemotional aging processes". Front Psychol. 5: 1595. doi:10.3389/fpsyg.2014.01595. PMC 4302708. PMID 25657633.
It is known that chronically elevated levels of the stress hormone cortisol exert neurotoxic effects on the aging brain with negative impacts on cognition and socioemotional functioning. ... Cortisol is a steroid hormone released by the HPA axis in response to challenging situations. As the primary effector of the biological stress response in humans, it is implicated in a diverse array of physiologic, metabolic, immunologic, and psychological processes directed toward successful coping (Sapolsky et al., 2000; Kassel and Herrlich, 2007). Cortisol receptors are well-represented in limbic structures involved in affective response (i.e., hippocampus, hypothalamus, amygdala) and in regions central to executive function such as the prefrontal cortex and anterior cingulate cortex (Dedovic et al., 2009; Joëls and Baram, 2009). As a result, the effects of cortisol extend beyond the stress and threat response system to impact mood, attention, and memory (Lupien and McEwen, 1997; Sapolsky et al., 2000; de Kloet et al., 2005). ... In contrast, evidence indicated positive associations between cortisol levels that were acutely elevated by stress or hydrocortisone administration and inhibitory control (Schlosser et al., 2013) as well as spatial learning (Meyer et al., 2013). Regarding cortisol’s effect on memory, the evidence is currently mixed (Schwabe et al., 2012; van Ast et al., 2013). ... There also is evidence that effects of cortisol on cognition vary in a dose-dependent fashion. In particular, there is evidence of cognitive improvements under conditions of moderate, time-limited cortisol elevation but evidence of cognitive impairments when cortisol concentrations are persistent or excessively high (Lupien et al., 1999; Abercrombie et al., 2003; Hupbach and Fieman, 2012; Schilling et al., 2013; Moriarty et al., 2014).
- ↑ 64.0 64.1
Zschucke E, Gaudlitz K, Ströhle A (January 2013). "Exercise and physical activity in mental disorders: clinical and experimental evidence". J Prev Med Public Health. 46 (Suppl 1): S12–521. doi:10.3961/jpmph.2013.46.S.S12. PMC 3567313. PMID 23412549.
In psychiatric patients, different mechanisms of action for PA and EX have been discussed: On a neurochemical and physiological level, a number of acute changes occur during and following bouts of EX, and several long-term adaptations are related to regular EX training. For instance, EX has been found to normalize reduced levels of brain-derived neurotrophic factor (BDNF) and therefore has neuroprotective or even neurotrophic effects [7-9]. Animal studies found EX-induced changes in different neurotransmitters such as serotonin and endorphins [10,11], which relate to mood, and positive effects of EX on stress reactivity (e.g., the hypothalamus-pituitary-adrenal axis [12,13]). Finally, anxiolytic effects of EX mediated by atrial natriuretic peptide have been reported [14]. Potential psychological mechanisms of action include learning and extinction, changes in body scheme and health attitudes/behaviors, social reinforcement, experience of mastery, shift of external to more internal locus of control, improved coping strategies, or simple distraction [15,16].
- ↑ "Depression and anxiety: Exercise eases symptoms - Mayo Clinic". www.mayoclinic.org. สืบค้นเมื่อ 18 April 2016.
- ↑ 66.0 66.1
Raichlen DA, Foster AD, Gerdeman GL, Seillier A, Giuffrida A (2012). "Wired to run: exercise-induced endocannabinoid signaling in humans and cursorial mammals with implications for the 'runner's high'". J. Exp. Biol. 215 (Pt 8): 1331–1336. doi:10.1242/jeb.063677. PMID 22442371.
Humans report a wide range of neurobiological rewards following moderate and intense aerobic activity, popularly referred to as the 'runner's high', which may function to encourage habitual aerobic exercise. ... Thus, a neurobiological reward for endurance exercise may explain why humans and other cursorial mammals habitually engage in aerobic exercise despite the higher associated energy costs and injury risks
- ↑ Cohen EE, Ejsmond-Frey R, Knight N, Dunbar RI (2010). "Rowers' high: behavioural synchrony is correlated with elevated pain thresholds". Biol. Lett. 6 (1): 106–108. doi:10.1098/rsbl.2009.0670. PMC 2817271. PMID 19755532.
- ↑ 68.0 68.1 68.2 68.3 68.4
Szabo A, Billett E, Turner J (2001). "Phenylethylamine, a possible link to the antidepressant effects of exercise?". Br J Sports Med. 35 (5): 342–343. doi:10.1136/bjsm.35.5.342. PMC 1724404. PMID 11579070.
The 24 hour mean urinary concentration of phenylacetic acid was increased by 77% after exercise. ... These results show substantial increases in urinary phenylacetic acid levels 24 hours after moderate to high intensity aerobic exercise. As phenylacetic acid reflects phenylethylamine levels3 , and the latter has antidepressant effects, the antidepressant effects of exercise appear to be linked to increased phenylethylamine concentrations. Furthermore, considering the structural and pharmacological analogy between amphetamines and phenylethylamine, it is conceivable that phenylethylamine plays a role in the commonly reported "runners high" thought to be linked to cerebral β-endorphin activity. The substantial increase in phenylacetic acid excretion in this study implies that phenylethylamine levels are affected by exercise. ... A 30 minute bout of moderate to high intensity aerobic exercise increases phenylacetic acid levels in healthy regularly exercising men. The findings may be linked to the antidepressant effects of exercise.
- ↑ 69.0 69.1 69.2 69.3 69.4
Lindemann L, Hoener MC (2005). "A renaissance in trace amines inspired by a novel GPCR family". Trends Pharmacol. Sci. 26 (5): 274–281. doi:10.1016/j.tips.2005.03.007. PMID 15860375.
The pharmacology of TAs might also contribute to a molecular understanding of the well-recognized antidepressant effect of physical exercise [51]. In addition to the various beneficial effects for brain function mainly attributed to an upregulation of peptide growth factors [52,53], exercise induces a rapidly enhanced excretion of the main β-PEA metabolite β-phenylacetic acid (b-PAA) by on average 77%, compared with resting control subjects [54], which mirrors increased β-PEA synthesis in view of its limited endogenous pool half-life of ~30 s [18,55].
- ↑ 70.0 70.1 70.2 70.3 70.4
Berry, MD (2007). "The potential of trace amines and their receptors for treating neurological and psychiatric diseases". Rev Recent Clin Trials. 2 (1): 3–19. doi:10.2174/157488707779318107. PMID 18473983.
It has also been suggested that the antidepressant effects of exercise are due to an exercise-induced elevation of PE [151].
- ↑ 71.0 71.1 71.2 71.3 71.4 71.5
Dinas PC, Koutedakis Y, Flouris AD (2011). "Effects of exercise and physical activity on depression". Ir J Med Sci. 180 (2): 319–325. doi:10.1007/s11845-010-0633-9. PMID 21076975.
According to the 'endorphins hypothesis', exercise augments the secretion of endogenous opioid peptides in the brain, reducing pain and causing general euphoria. ... Based upon a large effect size, the results confirmed the endorphins hypothesis demonstrating that exercise leads to an increased secretion of endorphins which, in turn, improved mood states.
β-Endorphin, an endogenous μ-opioid receptor selective ligand, has received much attention in the literature linking endorphins and depression or mood states. ... exercise of sufficient intensity and duration can increase circulating β-endorphin levels. ... Moreover, a recent study demonstrated that exercise and physical activity increased β-endorphin levels in plasma with positive effects on mood. Interestingly, the researchers reported that, independently of sex and age, dynamic anaerobic exercises increased β-endorphin, while resistance and aerobic exercises seem to only have small effects on β-endorphins. ... The results showed that mood tends to be higher in a day an individual exercises as well as that daily activity and exercise overall are strongly linked with mood states. In line with these findings, a recent study showed that exercise significantly improved mood states in non-exercises, recreational exercisers, as well as marathon runners. More importantly, the effects of exercise on mood were twofold in recreational exercisers and marathon runners. - ↑ 72.0 72.1 72.2 72.3 72.4
Tantimonaco M, Ceci R, Sabatini S, Catani MV, Rossi A, Gasperi V, Maccarrone M (2014). "Physical activity and the endocannabinoid system: an overview". Cell. Mol. Life Sci. 71 (14): 2681–2698. doi:10.1007/s00018-014-1575-6. PMID 24526057.
The traditional view that PA engages the monoaminergic and endorphinergic systems has been challenged by the discovery of the endocannabinoid system (ECS), composed of endogenous lipids, their target receptors, and metabolic enzymes. Indeed, direct and indirect evidence suggests that the ECS might mediate some of the PA-triggered effects throughout the body. ... the evidence that PA induces some of the psychotropic effects elicited by the Cannabis sativa active ingredient Δ9-tetrahydrocannabinol (Δ9-THC, Fig. 1), like bliss, euphoria, and peacefulness, strengthened the hypothesis that endocannabinoids (eCBs) might mediate, at least in part, the central and peripheral effects of exercise [14]. ... To our knowledge, the first experimental study aimed at investigating the influence of PA on ECS in humans was carried out in 2003 by Sparling and coworkers [63], who showed increased plasma AEA content after 45 min of moderate intensity exercise on a treadmill or cycle ergometer. Since then, other human studies have shown increased blood concentrations of AEA ... A dependence of the increase of AEA concentration on exercise intensity has also been documented. Plasma levels of AEA significantly increased upon 30 min of moderate exercise (heart rate of 72 and 83 %), but not at lower and significantly higher exercise intensities, where the age-adjusted maximal heart rate was 44 and 92 %, respectively ... Several experimental data support the hypothesis that ECS might, at least in part, explain PA effects on brain functions, because: (1) CB1 is the most abundant GPCR in the brain participating in neuronal plasticity [18]; (2) eCBs are involved in several brain responses that greatly overlap with the positive effects of exercise; (3) eCBs are able to cross the blood-brain barrier [95]; and (4) exercise increases eCB plasma levels [64-67].
- ↑ "β-phenylethylamine: Biological activity". Guide to Pharmacology. The International Union of Basic and Clinical Pharmacology. สืบค้นเมื่อ 10 February 2015.
- ↑ "Dexamfetamine: Biological activity". Guide to Pharmacology. The International Union of Basic and Clinical Pharmacology. สืบค้นเมื่อ 10 February 2015.
- ↑ 75.0 75.1 Broadley, KJ (March 2010). "The vascular effects of trace amines and amphetamines". Pharmacol. Ther. 125 (3): 363–375. doi:10.1016/j.pharmthera.2009.11.005. PMID 19948186.
Trace amines are metabolized in the mammalian body via monoamine oxidase (MAO; EC 1.4.3.4) (Berry, 2004) (Fig. 2) ... It deaminates primary and secondary amines that are free in the neuronal cytoplasm but not those bound in storage vesicles of the sympathetic neurone ... Similarly, β-PEA would not be deaminated in the gut as it is a selective substrate for MAO-B which is not found in the gut ...
Brain levels of endogenous trace amines are several hundred-fold below those for the classical neurotransmitters noradrenaline, dopamine and serotonin but their rates of synthesis are equivalent to those of noradrenaline and dopamine and they have a very rapid turnover rate (Berry, 2004). Endogenous extracellular tissue levels of trace amines measured in the brain are in the low nanomolar range. These low concentrations arise because of their very short half-life ... - ↑ "Physical Activity Reduces Stress | Anxiety and Depression Association of America, ADAA". www.adaa.org. สืบค้นเมื่อ 19 April 2016.
- ↑ Fuss J, Steinle J, Bindila L, Auer MK, Kirchherr H, Lutz B, Gass P (2015). "A runner's high depends on cannabinoid receptors in mice". PNAS. 112 (42): 13105–13108. doi:10.1073/pnas.1514996112. PMC 4620874. PMID 26438875.
Exercise is rewarding, and long-distance runners have described a runner’s high as a sudden pleasant feeling of euphoria, anxiolysis, sedation, and analgesia. A popular belief has been that endogenous endorphins mediate these beneficial effects. However, running exercise increases blood levels of both β-endorphin (an opioid) and anandamide (an endocannabinoid). Using a combination of pharmacologic, molecular genetic, and behavioral studies in mice, we demonstrate that cannabinoid receptors mediate acute anxiolysis and analgesia after running. We show that anxiolysis depends on intact cannabinoid receptor 1 (CB1) receptors on forebrain GABAergic neurons and pain reduction on activation of peripheral CB1 and CB2 receptors. We thus demonstrate that the endocannabinoid system is crucial for two main aspects of a runner's high. Sedation, in contrast, was not influenced by cannabinoid or opioid receptor blockage, and euphoria cannot be studied in mouse models.
- ↑ Malenka RC, Nestler EJ, Hyman SE (2009). "Chapter 5: Excitatory and Inhibitory Amino Acids". ใน Sydor, A, Brown, RY (บ.ก.). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience (2nd ed.). New York: McGraw-Hill Medical. pp. 117–130. ISBN 9780071481274.
• The major excitatory neurotransmitter in the brain is glutamate; the major inhibitory neurotransmitter is GABA. ...
• The most extensively studied form of synaptic plasticity is long-term potentiation (LTP) in the hippocampus, which is triggered by strong activation of NMDA receptors and the consequent large rise in postsynaptic calcium concentration.
• Long-term depression (LTD), a long-lasting decrease in synaptic strength, also occurs at most excitatory and some inhibitory synapses in the brain. ... The bidirectional control of synaptic strength by LTP and LTD is believed to underlie some forms of learning and memory in the mammalian brain. - ↑ 79.0 79.1 Mischel NA, Subramanian M, Dombrowski MD, Llewellyn-Smith IJ, Mueller PJ (May 2015). "(In) activity-related neuroplasticity in brainstem control of sympathetic outflow: unraveling underlying molecular, cellular, and anatomical mechanisms". Am. J. Physiol. Heart Circ. Physiol. 309 (2): H235-43. doi:10.1152/ajpheart.00929.2014. PMC 4504968. PMID 25957223.
- ↑ 80.0 80.1 80.2 80.3 Sibley BA, Etnier JL (2003). "The Relationship Between Physical Activity and Cognition in Children: A Meta-Analysis". Pediatric Exercise Science. 15 (3): 243–256.
- ↑ 81.0 81.1 Chaddock L, Hillman CH, Buck SM, Cohen NJ (2011). "Aerobic Fitness and Executive Control of Relational Memory in Preadolescent Children". Medicine & Science in Sports & Exercise. 43 (2): 344–349. doi:10.1249/mss.0b013e3181e9af48.
- ↑ 82.0 82.1 82.2 Chaddock I, Erickson KI, Prakash RS, Kim JS, Voss MA, VanPatter M, และคณะ (2010). "A neuroimaging investigation of the association between aerobic fitness, hippocampal volume, and memory performance in preadolescent children". Brain Research. 1358: 172–183. doi:10.1016/j.brainres.2010.08.049.
- ↑ 83.0 83.1 83.2 Best, JR (2010). "Effects of physical activity on children's executive function: Contributions of experimental research on aerobic exercise". Developmental Review. 30 (4): 331–351. doi:10.1016/j.brainres.2010.08.049.
- ↑ 84.0 84.1 84.2 Hillman CH, Erickson KI, Kramer AF (2008). "Be smart, exercise your heart: exercise effects on brain and cognition". Nature Reviews Neuroscience. 9: 58–65. doi:10.1038/nrn2298.
- ↑ Coe, Dawn Podulka; Pivarnik, James M.; Womack, Christopher J.; Reeves, Mathew J.; Malina, Robert M. (August 2006). "Effect of Physical Education and Activity Levels on Academic Achievement in Children". Medicine & Science in Sports & Exercise. 38 (8): 1515–1519. doi:10.1249/01.mss.0000227537.13175.1b. PMID 16888468.
- ↑ 86.0 86.1
Rommel AS, Halperin JM, Mill J, Asherson P, Kuntsi J (September 2013). "Protection from genetic diathesis in attention-deficit/hyperactivity disorder: possible complementary roles of exercise". J. Am. Acad. Child Adolesc. Psychiatry. 52 (9): 900–910. doi:10.1016/j.jaac.2013.05.018. PMC 4257065. PMID 23972692.
As exercise has been found to enhance neural growth and development, and improve cognitive and behavioural functioning in [healthy] individuals and animal studies, we reviewed the literature on the effects of exercise in children and adolescents with ADHD and animal models of ADHD behaviours.
A limited number of undersized non-randomized, retrospective and cross-sectional studies have investigated the impact of exercise on ADHD and the emotional, behavioural and neuropsychological problems associated with the disorder. The findings from these studies provide some support for the notion that exercise has the potential to act as a protective factor for ADHD. ... Although it remains unclear which role, if any, BDNF plays in the pathophysiology of ADHD, enhanced neural functioning has been suggested to be associated with the reduction of remission of ADHD symptoms.49,50,72 As exercise can elicit gene expression changes mediated by alterations in DNA methylation38, the possibility emerges that some of the positive effects of exercise could be caused by epigenetic mechanisms, which may set off a cascade of processes instigated by altered gene expression that could ultimately link to a change in brain function. - ↑ 87.0 87.1 Cooney GM, Dwan K, Greig CA, Lawlor DA, Rimer J, Waugh FR, McMurdo M, Mead GE (September 2013). "Exercise for depression". Cochrane Database Syst. Rev. 9: CD004366. doi:10.1002/14651858.CD004366.pub6. PMID 24026850.
Exercise is moderately more effective than a control intervention for reducing symptoms of depression, but analysis of methodologically robust trials only shows a smaller effect in favour of exercise. When compared to psychological or pharmacological therapies, exercise appears to be no more effective, though this conclusion is based on a few small trials.
- ↑ Brené S, Bjørnebekk A, Aberg E, Mathé AA, Olson L, Werme M (2007). "Running is rewarding and antidepressive". Physiol. Behav. 92 (1–2): 136–140. doi:10.1016/j.physbeh.2007.05.015. PMC 2040025. PMID 17561174.
- ↑ Gong H, Ni C, Shen X, Wu T, Jiang C (February 2015). "Yoga for prenatal depression: a systematic review and meta-analysis". BMC Psychiatry. 15: 14. doi:10.1186/s12888-015-0393-1. PMC 4323231. PMID 25652267.
- ↑ Adlard PA, Perreau VM, Pop V, Cotman CW (2005). "Voluntary exercise decreases amyloid load in a transgenic model of Alzheimer's disease". J. Neurosci. 25 (17): 4217–21. doi:10.1523/JNEUROSCI.0496-05.2005. PMID 15858047.
- ↑ 91.0 91.1 Elwood P, Galante J, Pickering J, Palmer S, Bayer A, Ben-Shlomo Y, Longley M, Gallacher J (December 2013). "Healthy lifestyles reduce the incidence of chronic diseases and dementia: evidence from the Caerphilly cohort study". PLoS ONE. 8 (12): e81877. doi:10.1371/journal.pone.0081877. PMC 3857242. PMID 24349147.
- ↑ Morgan GS, Gallacher J, Bayer A, Fish M, Ebrahim S, Ben-Shlomo Y (2012). "Physical activity in middle-age and dementia in later life: findings from a prospective cohort of men in Caerphilly, South Wales and a meta-analysis". J. Alzheimers Dis. 31 (3): 569–80. doi:10.3233/JAD-2012-112171. PMID 22647258.
- ↑ Baatile J, Langbein WE, Weaver F, Maloney C, Jost MB (2000). "Effect of exercise on perceived quality of life of individuals with Parkinson's Disease". Journal of Rehabilitation Research and Development. 37 (5): 529–534.
- ↑ 94.0 94.1 Kramer AF, Erickson KI, Colcombe SJ (2006). "Exercise, cognition, and the aging brain". Journal of Applied Physiology. 101 (4): 1237–1242. doi:10.1152/japplphysiol.00500.2006.
- ↑ Kramer AF, Hahn S, Cohen NJ, Banich MT, McAuley H, และคณะ (1999). "Ageing, fitness and neurocognitive function". Nature. 400: 418–419.
- ↑ 96.0 96.1 Nocera JR, Altman LJP, Sapienza C, Okun MS, Hass CJ (2010). "Can exercise improve language and cognition in Parkinson's disease? A case report". Neurocase: The Neural Basis of Cognition. 16 (4): 301–306. doi:10.1080/13554790903559663.
