กรดอะมิโน
กรดอะมิโน (อังกฤษ: amino acid) คือ ชีวโมเลกุลที่มีทั้งหมู่ฟังก์ชันอะมิโนและคาร์บอกซิลเป็นส่วนประกอบ กรดอะมิโนเป็นองค์ประกอบสำคัญของโปรตีนซึ่งเป็นส่วนประกอบสำคัญที่มีอยู่ในสิ่งมีชีวิตทุกชนิด ในวิชาชีวเคมี คำว่า "กรดอะมิโน" มักหมายความถึงกรดอะมิโนแบบแอลฟา (alpha amino acids) ซึ่งเป็นกรดอะมิโนที่ทั้งหมู่อะมิโนและหมู่คาร์บอกซิลติดอยู่กับคาร์บอนอะตอมเดียวกัน เรียกว่า -คาร์บอน
เรซิดีวของกรดอะมิโน (amino acid residue) คือกรดอะมิโนที่ถูกดึงโมเลกุลของน้ำออกไปหนึ่งโมเลกุล (ไฮโดรเจนไอออนหนึ่งไอออนจากหมู่อะมิโน และไฮดรอกไซด์ไอออนหนึ่งไอออนจากหมู่คาร์บอกซิล) เรซิดีวของกรดมักเกิดขึ้นในขณะสร้างพันธะเพปไทด์
โครงสร้างทั่วไป
[แก้]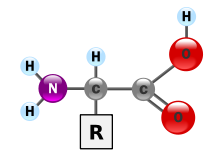
กรดอะมิโนเป็นหน่วยก่อสร้างโครงสร้างพื้นฐานของโปรตีน โดยสร้างพอลิเมอร์ที่เป็นโซ่สั้น ๆ เรียกว่า เพปไทด์ หรือพอลิเพปไทด์ และกลายเป็นโครงสร้างที่เรียกว่าโปรตีน โครงสร้างทั่วไปของโปรตีโนเจนิก แอลฟ่า อะมิโน แอซิด เป็นไปตามภาพด้านขวามือ
หมู่ "R" แทน โซ่ข้าง (side chain) หรือหมู่ฟังก์ชัน ซึ่งมีความเฉพาะสำหรับกรดอะมิโนแต่ละตัว กรดอะมิโนแบ่งตามคุณสมบัติของหมู่ฟังก์ชัน ได้เป็น[1]
- หมู่ฟังก์ชันไม่มีขั้ว และไม่ชอบน้ำ (hydrophobic) ได้แก่ ไกลซีน อะลานีน วาลีน ลิวซีน ไอโซลิวซีน และโพรลีน กรดอะมิโนเหล่านี้มีบทบาทในการทำปฏิกิริยากับส่วนที่ไม่ชอบน้ำของโปรตีน และเพิ่มความยืดหยุ่นของโปรตีน
- หมู่ฟังก์ชันเป็นอะโรมาติก ไฮโดรคาร์บอน ได้แก่ ฟีนิลอะลานีน ไทโรซีน และทริปโตเฟน มีบทบาทในการเพิ่มความแข็งแรงของโปรตีนโดยการซ้อนทับกับของวงแหวนอะโรมาติกซึ่งมีความคงตัว
- หมู่ฟังก์ชันมีขั้ว ไม่มีประจุ ได้แก่ เซอรีน ทรีโอนีน ซิสตีอีน มีไธโอนีน กลูตามีน แอสพาราจีน หมู่ฟังก์ชันเหล่านี้ชอบน้ำ (hydrophilic) และละลายในน้ำได้ดี
- หมู่ฟังก์ชันประจุลบ ได้แก่ กรดแอสปาร์ติก และกลูตาเมต โดยจะแตกตัวให้ประจุลบที่ pH 7
- หมู่ฟังก์ชันประจุบวก ได้แก่ ไลซีน อาร์จินีน ฮิสทิดีน โดยจะแตกตัวให้ประจุบวกที่ pH 7
กรดอะมิโนที่นอกเหนือจากกรดอะมิโนมาตรฐาน
[แก้]กรดอะมิโน 20 ตัวถูกตั้งรหัสโดยมาตรฐานรหัสพันธุกรรม และถูกเรียกว่า โปรตีโนเจนิก หรือกรดอะมิโนมาตรฐาน นอกเหนือจากกรดอะมิโน 20 ชนิดที่เป็นองค์ประกอบของโปรตีนแล้ว ยังพบกรดอะมิโนอื่น ๆ อีก เช่น
- ในโครงสร้างของโปรตีน มีกรดอะมิโนที่ดัดแปลงโครงสร้างไปจากกรดอะมิโน 20 ชนิดข้างต้น ตัวอย่างเช่น
- เดสโมซิน (desmosine) พบในเส้นใยอีลาสติน
- ซีลีโนซิสทีอีน (selenocysteine) มีหมู่ Se แทนที่ O ในโมเลกุลของซิสทีอีน พบในโมเลกุลของเอนไซม์ กลูตาไทโอนเปอร์ออกซิเดส (glutathione peroxidase)
- ไทโรซีน (tyrosine) พบในไธโรโกลบูลินที่สังเคราะห์โดยต่อมธัยรอยด์
- กรดอะมิโนอะดิปิก (aminoadipic acid) พบในโปรตีนในข้าวโพด
- มีอีกอย่างน้อย 2 ตัวที่กำหนดรหัสโดย DNA ซึ่งเป็นวิธีที่ไม่ได้มาตรฐานดังนี้:
- ซีลีโนซิสตีอีน (selenocysteine) ถูกใส่เข้าไปในโปรตีนบางตัวที่ UGA โคดอน, ซึ่งเป็นโคดอนสำหรับหยุด
- ไพร์โรไลซีน (pyrrolysine) ถูกใช้โดยเมตทาโนเจน (methanogen) บางตัวในเอนไซม์ที่มันใช้สำหรับผลิตมีเทน มันถูกกำหนดรหัสให้เหมือนซีลีโนซิสตีอีน แต่กับ UGA โคดอน แทน
- กรดอะมิโนและอนุพันธ์ที่ไม่เป็นองค์ประกอบของโปรตีน แต่มีหน้าที่สำคัญทางชีวภาพอื่น เช่น
- กาบา (GABA) เป็นสารสื่อประสาท
- อีพิเนปพริน (epinephrine) เป็นฮอร์โมนที่สร้างมาจากไทโรซีน
- เพนิซิลลามีน (penicillamine) เป็นส่วนประกอบของเพนนิซิลิน
- ไกลซีน และกลูตาเมต เป็นสารสื่อประสาท (neurotransmitters)
- คาร์นิตีน (carnitine) ใช้ประโยชน์ในการขนย้ายลิพิดภายในเซลล์
- ออร์นิทีน (ornithine)
- ซิตรูลลีน (citrulline)
- โฮโมซิสตีอิน (homocysteine)
- ไฮดรอกซิโพรลีน (hydroxyproline)
- ไฮดรอกซิไลซีน (hydroxylysine)
- ซาร์โคซีน (sarcosine)
- กรดอะมิโนหลายตัวสามารถใช้สังเคราะห์โมเลกุลอื่นได้ เช่น:
- ทริปโตเฟน (tryptophan) เป็นสารตั้งต้นของสารสื่อประสาทเซอโรโทนิน (serotonin) ;
- ไกลซีน (glycine) เป็นหนึ่งในตัวทำปฏิกิริยาในกระบวนการสังเคราะห์พอร์ไฟริน (porphyrins) เช่น ฮีม (heme)
- กรดอะมิโนอื่นที่มีในโปรตีนธรรมดาเกิดขึ้นโดย การปรับแต่งหลังทรานสเลชัน (post-translational modification) คือปรับแต่งหลังทรานสเลชันในการสังเคราะห์โปรตีน การปรับแต่งเหล่านี้บ่อยครั้งมีความสำคัญต่อหน้าที่ของโปรตีน เช่น
กรดอะมิโนมากกว่า 100 ชนิดพบในธรรมชาติ บางตัวถูกตรวจพบได้ในมีทีโอไรต์ (meteorite) โดยเฉพาะประเภทที่รู้จักกันในชื่อคาร์บอนาซีอัลคอนไดรต์ (carbonaceous chondrite) จุลินทรีย์และพืชบางครั้งผลิตกรดอะมิโนชนิดผิดปกติมาก ๆ ออกมา ซึ่งสามารถพบได้ในยาปฏิชีวนะประเภทเปปทีดิก เช่น นิซิน (nisin) หรืออะลาเมตทิซิน (alamethicin) แลนไทโอนีน (lanthionine) เป็นไดเมอร์ของอะลานีนที่เชื่อมกันด้วยพันธะแบบซัลไฟด์ซึ่งพบร่วมกับกรดอะมิโนอิ่มตัวในแลนติไบโอติก (lantibiotics-แอนติไบโอติกเพปไทด์ของแหล่งกำเนิดจุลินทรีย์) 1-อะมิโนไซโคลโพรเพน-1-คาร์บอกซิลิก แอซิก (1-aminocyclopropane-1-carboxylic acid-ACC) เป็นกรดอะมิโนไซคลิก และเป็นผลผลิตระหว่างทางของการผลิตฮอร์โมนพืชเอทิลีนในสาหร่ายสีแดง
กรดอะมิโนจำเป็น
[แก้]บางตัวใน 20 ตัวของกรดอะมิโนมาตรฐานเรียกว่ากรดอะมิโนจำเป็น (essential amino acid) เพราะว่ามันไม่สามารถสังเคราะห์ได้โดยร่างกาย แต่ได้จากสารประกอบผ่านปฏิกิริยาเคมี ซึ่งเราได้รับโดยการกินเข้าไป โดยกรดอะมิโนจำเป็นในมนุษย์ได้แก่
- ไลซีน (lysine)
- ลิวซีน (leucine)
- ไอโซลิวซีน (isoleucine)
- มีไธโอนีน (methionine)
- ฟีนิลอะลานีน (phenylalanine)
- ทรีโอนีน (threonine)
- ทริปโตเฟน (tryptophan)
- วาลีน (valine)
ในเด็กมีเพิ่มอีก 2 ตัว ดังนี้
คำว่า กรดอะมิโนโซ่สาขา หมายถึงกรดอะมิโนอะลิฟาติกซึ่งได้แก่: ลิวซีน, ไอโซลิวซีน และ วาลีน
ลักษณะทางโครงสร้าง
[แก้]ไอโซเมอริซึม (Isomerism)
[แก้]ยกเว้นไกลซีน ซึ่งมีหมู่ฟังก์ชัน R = H กรดอะมิโนที่เกิดขึ้นเป็นไปได้ที่จะมี 2 ออพติคัล ไอโซเมอร์ เรียกว่า D และ L กรดอะมิโน L จะแทนกรดอะมิโนจำนวนมากมายที่พบในโปรตีน กรดอะมิโน D พบใน โปรตีน ที่ผลิตจากสิ่งมีชีวิตที่อาศัยอยู่ในทะเลชนิดพิเศษ เช่น หอยทากกรวย (cone snail) และพบเป็นส่วนประกอบจำนวนมากของผนังเซลล์ (cell wall) ของแบคทีเรีย
ปฏิกิริยา (Reactions)
[แก้]โปรตีนจะถูกสร้างโดยกระบวนการพอลิเมอไรเซชันของกรดอะมิโนโดยพันธะเพปไทด์ ในกระบวนการที่เรียกว่า ทรานสเลชัน (translation)
1. กรดอะมิโน ; 2, โครงสร้างzwitterion; 3, แสดงพันธะเพปไทด์ระหว่างกรดอะมิโน 2 ตัว (ดูด้วย พันธะเคมี)
ดูเพิ่ม
[แก้]- รายชื่อกรดอะมิโนมาตรฐาน
- กรดอะมิโนจำเป็น (essential amino acids)
อ้างอิง
[แก้]- ↑ Lehninger, A.L., Nelson, D.L., and Cox, M.M. 1993. Principle of Biochemistry. 2nd ed. New York.: Worth
- Doolittle, R.F. (1989) Redundancies in protein sequences. In Predictions of Protein Structure and the Principles of Protein Conformation (Fasman, G.D. ed) Plenum Press, New York, pp. 599-623
- David L. Nelson and Michael M. Cox, Lehninger Principles of Biochemistry, 3rd edition, 2000, Worth Publishers, ISBN 1-57259-153-6
- On the hydrophobic nature of cysteine. เก็บถาวร 2010-02-01 ที่ เวย์แบ็กแมชชีน
ดูเพิ่ม
[แก้]อะมิโนวิต อาหารทดแทนโปรตีน หมอบุญชัย ช่วยโรค NCDS โรตไคได้ อะมิโนวิต.com/ กดดูรายละเอียดได้เลย
- Doolittle, R.F. (1989) Redundancies in protein sequences. In Predictions of Protein Structure and the Principles of Protein Conformation (Fasman, G.D. ed) Plenum Press, New York, pp. 599-623
- David L. Nelson and Michael M. Cox, Lehninger Principles of Biochemistry, 3rd edition, 2000, Worth Publishers, ISBN 1-57259-153-6
- Meierhenrich, U.J.: Amino acids and the asymmetry of life, Springer-Verlag, Berlin, New York, 2008. ISBN 978-3-540-76885-2
แหล่งข้อมูลอื่น
[แก้]- Amino acids overview physical-chemistry properties, 3D structures, etc
- List of Standard Amino Acids เก็บถาวร 2010-11-10 ที่ เวย์แบ็กแมชชีน The Detailed PDF List of Standard Amino Acids (including 3D depictions)
- Nomenclature and Symbolism for Amino Acids and Peptides IUPAC-IUB Joint Commission on Biochemical Nomenclature (JCBN)
- Molecular Expressions: The Amino Acid Collection - Has detailed information and microscopy photographs of each amino acid.
- Amino acid properties เก็บถาวร 2007-09-27 ที่ เวย์แบ็กแมชชีน - Properties of the amino acids (a tool aimed mostly at molecular geneticists trying to understand the meaning of mutations)
- Synthesis of Amino Acids and Derivatives
- Learn the 20 proteinogenic amino acids online เก็บถาวร 2010-10-29 ที่ เวย์แบ็กแมชชีน
- Molecular Expressions: The Amino Acid Collection - Has detailed information and microscopy photographs of each amino acid.
- 22nd amino acid เก็บถาวร 2005-12-15 ที่ เวย์แบ็กแมชชีน - Press release from Ohio State claiming discovery of a 22nd amino acid.


