ฟาวิพิราเวียร์
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |
| |
| ชื่อ | |
|---|---|
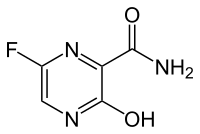
| IUPAC name
5-Fluoro-2-hydroxypyrazine-3-carboxamide
| |
| ชื่ออื่น
T-705; Avigan
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEMBL | |
| เคมสไปเดอร์ | |
ผับเคม CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| C5H4FN3O2 | |
| มวลโมเลกุล | 157.104 g·mol−1 |
| เภสัชวิทยา | |
| J05AX27 (WHO) | |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
ฟาวิพิราเวียร์ (Favipiravir) หรือที่รู้จักกันในชื่อ T-705 หรือ Avigan เป็นยาต้านไวรัสที่พัฒนาโดยบริษัทโตยามะเคมิคอล (富山化学工業) ของประเทศญี่ปุ่น มีฤทธิ์ต่อต้านอาร์เอ็นเอไวรัสหลายชนิด ในเดือนกุมภาพันธ์ พ.ศ. 2563 ได้รับการศึกษาแบบสุ่มในประเทศจีนเพื่อทำการทดลองรักษาโรค COVID-19 (โรคติดเชื้อโคโรนาไวรัส 2019) ที่พึ่งอุบัติขึ้น[1][2][3] ฟาวิพิราเวียร์ ได้รับการรับรองระยะสั้นเป็นเวลาห้าปี เมื่อวันที่ 16 กุมภาพันธ์ พ.ศ. 2563 ในฐานะยาต้านไวรัสที่มีประสิทธิภาพต่อต้านโรค และในตอนนี้ได้ผลิตในประเทศจีนภายใต้ชื่อ ฟาวิลาเวียร์ (Favilavir)[4] เช่นเดียวกับยาต้านไวรัสทดลองอื่น ๆ (T-1105 และ T-1106) ฟาวิพิราเวียร์เป็นอนุพันธ์ของ ไพราซีนคาร์โบซาไมด์ (Pyrazinecarboxamide) และยังมีฤทธิ์ต้านไวรัสไข้หวัดใหญ่, ไวรัสเวสต์ไนล์, ไวรัสไข้เหลือง, ไวรัสโรคปากและเท้า รวมถึงเชื้อไวรัสอื่น ๆ ในตระกูลฟลาวิไวรัส (Flaviviruses), อรีนาไวรัส (Arenaviruses), บุนยาไวรัส (Bunyaviruses) และ อัลฟาไวรัส (Alphaviruses)[5] ฤทธิ์ในการต่อต้านเอนเทอโรไวรัส (Enteroviruses)[6] และไวรัสโรคไข้ริฟต์แวลลีย์ ก็แสดงให้เห็นเช่นกัน[7] ฟาวิพิราเวียร์ แสดงประสิทธิภาพอย่างจำกัดต่อไวรัสซิกาในการศึกษาในสัตว์ แต่มีประสิทธิภาพน้อยกว่ายาต้านไวรัสชนิดอื่นเช่น MK-608[8] และยังแสดงให้เห็นถึงประสิทธิภาพบางอย่างในการต่อต้านโรคพิษสุนัขบ้า[9] ซึ่งได้ถูกนำมาใช้ในการทดลองในมนุษย์บางคนที่ติดเชื้อไวรัสดังกล่าว[10]
กลไกการออกฤทธิ์นั้นเชื่อกันว่าเกี่ยวข้องกับการยับยั้งการคัดเลือกเอนไซม์ อาร์เอ็นเอโพลิเมอเรสที่ขึ้นกับอาร์เอ็นเอของไวรัส (RNA-dependent RNA polymerase)[11] งานวิจัยอื่น ๆ แสดงให้เห็นว่า ฟาวิพิราเวียร์ ชักนำให้เกิดการกลายพันธุ์ในอาร์เอ็นเอที่ทำให้เกิดการตาย ซึ่งผลทำให้ฟีโนไทป์ของไวรัสไม่อาจมีชีวิตอยู่ได้[12] ฟาวิพิราเวียร์ เป็นโปร-ดรัก (prodrug) ที่ถูกกระบวนการเมตาบอลิซึมเผาผลาญไปเป็นรูปแบบที่ออกฤทธิ์คือ Favipiravir-ribofuranosyl-5'-triphosphate (Favipiravir-RTP) มีทั้งที่อยู่ในตำรับที่ให้โดยทางรับประทานและทางหลอดเลือดดำ[13][14] เอ็นไซม์ Human hypoxanthine guanine phosphoribosyltransferase (HGPRT) เชื่อว่ามีบทบาทสำคัญในกระบวนการกระตุ้นการออกฤทธิ์นี้[15] ฟาวิพิราเวียร์ ไม่ยับยั้งการสังเคราะห์อาร์เอ็นเอหรือดีเอ็นเอ ในเซลล์ของสัตว์เลี้ยงลูกด้วยนมและไม่เป็นพิษต่อเซลล์[5] ในปี พ.ศ. 2557 ฟาวิพิราเวียร์ได้รับการอนุมัติในประเทศญี่ปุ่นสำหรับการสำรองยาต่อต้านการระบาดทั่วของโรคไข้หวัดใหญ่[16] อย่างไรก็ตาม ฟาวิพิราเวียร์ยังไม่ได้แสดงว่ามีประสิทธิภาพในเซลล์เยื่อบุทางเดินหายใจปฐมภูมิของมนุษย์ เป็นเหตุให้ยังมีความสงสัยในประสิทธิภาพในการรักษาโรคไข้หวัดใหญ่[17]
กรณีโรคไวรัสอีโบลา
[แก้]ยาดูเหมือนจะมีประสิทธิภาพในตัวอย่างของโรคไวรัสอีโบลาในหนู แต่ประสิทธิภาพของยาต้านการติดเชื้ออีโบลาในมนุษย์นั้นไม่ได้รับการพิสูจน์[18][19][20] ในช่วงการระบาดของไวรัสอีโบลาในแอฟริกาตะวันตกปี พ.ศ. 2557 มีรายงานว่าพยาบาลชาวฝรั่งเศสคนหนึ่งซึ่งติดเชื้ออีโบลาในขณะที่เป็นอาสาสมัครขององค์การแพทย์ไร้พรมแดน (MSF) ในไลบีเรียฟื้นตัวจากโรคหลังจากได้รับ ฟาวิพิราเวียร์[21] การทดลองทางคลินิกที่ตรวจสอบการใช้ฟาวิพิราเวียร์ กับโรคไวรัสอีโบลาเริ่มต้นขึ้นในเมืองเกกเกดู (Guéckédou) ประเทศกินี ระหว่างเดือนธันวาคม พ.ศ. 2557[22] ผลเบื้องต้นแสดงให้เห็นว่าอัตราการตายลดลง ในผู้ป่วยที่มีเชื้อไวรัสอีโบลาในกระแสเลือดในระดับต่ำถึงปานกลาง แต่ไม่มีผลต่อผู้ป่วยที่ติดเชื้อไวรัสในระดับสูง ซึ่งเป็นกลุ่มที่มีความเสี่ยงสูงต่อการเสียชีวิต[23] การออกแบบการทดลองได้รับการวิพากษ์วิจารณ์จากสก็อตต์ แฮมเมอร์ (Scott Hammer) และคนอื่น ๆ จากการใช้เพียงประวัติในการควบคุมโรคเท่านั้น[24] ผลของการทดลองทางคลินิกนี้ได้ถูกนำเสนอโดยดาอูดา ซิสโซโก (Daouda Sissoko)[25] ในเดือนกุมภาพันธ์ พ.ศ. 2559 ณ การประชุมประจำปีเกี่ยวกับรีโทรไวรัสและการติดเชื้อฉวยโอกาส (CROI) และเผยแพร่เมื่อวันที่ 1 มีนาคม พ.ศ. 2559 ในวารสารทางการแพทย์ PLOS Medicine[26]
การประยุกต์ใช้กับโรคติดเชื้อโคโรนาไวรัส 2019 (COVID-19)
[แก้]ในช่วงต้นเดือนกุมภาพันธ์ พ.ศ. 2563 มีการคาดการณ์ว่าฟาริพิราเวียร์น่าจะมีผลต่อต้านโคโรนาไวรัสสายพันธุ์ใหม่ (SARS-CoV-2)[27] ได้
จากเอกสารฉบับร่างซึ่งตีพิมพ์ในเอกสารรายงานวิชาการ Nature Cell Biology โดยคณะนักวิจัยจากสถาบันวิจัยไวรัสแห่งอู่ฮั่นภายใต้สถาบันวิทยาศาสตร์แห่งประเทศจีน ในวันที่ 4 กุมภาพันธ์ พ.ศ. 2563 จากการวิจัยในหลอดทดลองโดยใช้เซลล์มาตรฐานที่แยกจากเซลล์เยื่อบุผิวไตที่สกัดจากลิงเวอร์เว็ท (Vero E6) ผลการประเมินการทดสอบสารต้านไวรัส SARS-CoV-2 จำนวนเจ็ดชนิดรวมถึง ฟาวิพิราเวียร์ซึ่งรายงานผลเป็นค่า 50% Effective concentration (EC50)[a] ซึ่งฟาวิพิราเวียร์ให้ค่า 61.88 μM (ไมโครโมล/ลิตร) ในขณะที่ เรมเดซิเวียร์ซึ่งถูกพัฒนาขึ้นเพื่อใช้ในการรักษาโรคไข้เลือดออกอีโบลา มีค่า EC50 0.77 μM (ไมโครโมล/ลิตร) ซึ่งแสดงถึงประสิทธิภาพที่ดีกว่าฟาริพิราเวียร์ถึง 80 เท่า และยาต้านไข้มาลาเรีย คลอโรควิน ให้ค่า EC50 1.13 μM (ไมโครโมล/ลิตร) มีประสิทธิภาพมากเป็นอันดับสองจากสารทดลองทั้งเจ็ด อย่างไรก็ตามเมื่อพิจารณาค่า EC50 ของฟาริพิราเวียร์เมื่อทดสอบกับไวรัสอีโบลามีค่า 67 μM (ไมโครโมล/ลิตร) และยังแสดงผลการต้านไวรัสอีโบลาที่ดีมากในการทดลองในสิ่งมีชีวิตทั้งการทดสอบทางคลินิก และผลในสัตว์ทดลอง ซึ่งในกรณีเดียวกัน เรมเดซิเวียร์ ไม่แสดงผลที่มีนัยสำคัญ จากเหตุดังกล่าว คณะวิจัยจึงสรุปให้มีการทดสอบฟาริพิราเวียร์ในสิ่งมีชีวิตต่อไป[28]
วันที่ 15 กุมภาพันธ์ พ.ศ. 2563 จากการตีพิมพ์ในหนังสือพิมพ์ เคอจี่รื่อเป้า (科技日报) ซึ่งเผยแพร่โดยกระทรวงวิทยาศาสตร์และเทคโนโลยีของสาธารณรัฐประชาชนจีน จากข้อสรุปผลการทดลองในหลอดทดลองข้างต้น การทดลองทางคลินิกได้เริ่มดำเนินการแล้วในสาธารณรัฐประชาชนจีน โดยดำเนินการให้ยาฟาริพิราเวียร์ในผู้ป่วย 70 ราย (รวมถึงกลุ่มควบคุมที่ได้รับยาหลอก) และได้แสดงผลการรักษาที่ชัดเจนมีอาการไม่พึงประสงค์จากยาที่ต่ำเพียงพอในระยะแรก ในกลุ่มที่ได้รับการรักษาอัตราการกำจัดกรดนิวคลีอิกของไวรัสสูงกว่ากลุ่มควบคุมอย่างมีนัยสำคัญ ใน 3 ถึง 4 วันหลังเริ่มการทดลอง (ผลของ เรมเดซิเวียร์ และคลอโรควิน ไม่ได้กล่าวถึงในบทความ)[29][30]
นอกจากนี้บทความในหนังสือพิมพ์ เคอจี่รื่อเป้า ฉบับวันที่ 13 กุมภาพันธ์ พ.ศ. 2563 มีข้อมูลเกี่ยวกับผลกระทบทางคลินิกที่ค่อนข้างเฉพาะเช่น จากการให้สัมภาษณ์กลุ่มการวิจัยทางคลินิกได้ทำการศึกษา 26 ตัวอย่างที่โรงพยาบาลประชาชนที่สามเชินเจิ้น (深圳市第三人民医院) ในจำนวนนี้ผู้ป่วย 25 คน มีความรุนแรงของโรคปานกลางและ 25 คนมีอาการหนัก ฟาริพิราเวียร์ไม่มีผลข้างเคียงที่ชัดเจน มีการยอมรับของผู้ป่วยที่ดี มีผลลดไข้ที่ค่อนข้างดีในผู้ป่วยที่มีไข้ โดยหลังจากได้รับยา 2 วัน 72% มีไข้ลดลง และในสามวันผู้ป่วย 38% มีผลภาพรังสีปอดที่ดีขึ้น และดีขึ้นเป็น 70% ภายใน 6 วัน[31]
เมื่อวันที่ 17 กุมภาพันธ์ พ.ศ. 2563 เหตุผลที่ฟาริพิราเวียร์ แสดงออกถึงผลที่ดีในการทดลองทางคลินิกในสิ่งมีชีวิต แม้จะมีผลน้อยกว่าเรมเดซิเวียร์ และคลอโรควิน ในสภาพแวดล้อมในหลอดแก้ว ได้รับการอธิบายโดย จง อู่ (钟武) หนึ่งในคณะวิจัยที่ตีพิมพ์บทความเมื่อวันที่ 4 กุมภาพันธ์ว่า "ฟาริพิราเวียร์ เป็นสารยับยั้งเอนไซม์อาร์เอ็นเอพอลิเมอเรส แต่ขณะเดียวกันก็เป็น โปร-ดัก และต้องการกระบวนการ Tri-phosphorylation ในสิ่งมีชีวิตเพื่อสร้างสารตั้งต้นแข่งขันเข้าทำปฏิกริยากับเอนไซม์อาร์เอ็นเอพอลิเมอเรส" ในการทดสอบในหลอดทดลอง กระบวนการ Tri-phosphorylation มีไม่เพียงพอ ซึ่งมีผลกระทบต่อผลการทดลองที่แสดงออกมา[32]
จากการรายงานของสำนักข่าวซินหัว ในวันที่ 21 กุมภาพันธ์ พ.ศ. 2563 มีการทดลองยาฟาพิลาเวียร์ (Fapilavir - ชื่อในประเทศจีน) ในผู้ป่วย 80 กรณีในเชินเจิ้น ซึ่งข้อมูลจำนวนกรณีของการทดลองค่อนข้างสับสน[33]
บริษัท เจ้อเจียงไห่เจิ้ง ฟาร์มาซูติคอล (浙江海正薬业股份有限公司) ได้รับการอนุมัติใบอนุญาตในการผลิตจากสำนักงานคณะกรรมการอาหารและยาแห่งชาติจีน (国家薬监局) ในวันที่ 16 กุมภาพันธ์ พ.ศ. 2563 และพร้อมที่จะผลิตและเริ่มจำหน่ายยาในชื่อฟาวิลาเวียร์ (Favilavir)[34]
ในวันที่ 22 กุมภาพันธ์ พ.ศ. 2563 รัฐบาลญี่ปุ่นตัดสินใจที่จะให้มีการใช้ยา Avigan สำหรับผู้ติดเชื้อไวรัส SARS-CoV-2 และมีรายงานว่า บริษัทยาจำเป็นต้องเพิ่มการผลิตในไม่ช้า[35] ในวันเดียวกันนั้นรัฐมนตรีว่าการกระทรวงสาธารณสุขแรงงานและสวัสดิการ คัตสึโนบุ คาโต ได้เปิดเผยว่าการสั่งจ่ายยาให้กับผู้ป่วยได้เริ่มขึ้นแล้ว[36][37][38]
การใช้ยา
[แก้]โดยทั่วไปสำหรับผู้ใหญ่โดยขนาดการรับประทาน 1,600 มิลลิกรัม วันละสองครั้งในวันแรก และ 600 มิลลิกรัม วันละสองครั้งในวันที่ 2 ถึงวันที่ 5 ระยะเวลาการรักษาโดยรวมคือ 5 วัน[39] ด้วยยาเม็ดขนาด 200 มิลลิกรัม ดังนั้นจึงต้องรับประทาน (1600 x 2 + 600 x 2 x 4) มก. / 200 มก. = 40 เม็ดต่อคน ผลจากการได้รับยาในปริมาณสูงยังคงอยู่ระหว่างการศึกษา
ความเป็นพิษต่อทารกในครรภ์ ได้รับการยืนยันในการศึกษาในสัตว์ทดลอง และมีข้อห้ามใช้ยาในหญิงตั้งครรภ์และหญิงที่สงสัยว่าตั้งครรภ์ และควรคุมกำเนิดในช่วงเวลาระหว่างได้รับยาจนถึง 7 วันภายหลัง[40][41]
ดูเพิ่ม
[แก้]เชิงอรรถ
[แก้]- ↑ หมายถึง ปริมาณยาที่ทำให้ความเข้มข้นของไวรัสลดลงเหลือ 50%
อ้างอิง
[แก้]- ↑ Li G; De Clercq E. (February 2020). "Therapeutic options for the 2019 novel coronavirus (2019-nCoV)". Nature Reviews Drug Discovery. doi:10.1038/d41573-020-00016-0.
- ↑ "BRIEF-Corrected-Zhejiang Hisun Pharma gets approval for clinical trial to test flu drug Favipiravir for pneumonia caused by new coronavirus". Reuters Healthcare. 16 February 2020.
- ↑ Wang Xiaoyu (15 February 2020). "Drugs with potential against coronavirus in human trials". China Daily.
- ↑ Zhang Yangfei (17 February 2020). "First antiviral drug approved to fight coronavirus". China Daily.
- ↑ 5.0 5.1 Furuta Y, Takahashi K, Shiraki K, Sakamoto K, Smee DF, Barnard DL, Gowen BB, Julander JG, Morrey JD (June 2009). "T-705 (favipiravir) and related compounds: Novel broad-spectrum inhibitors of RNA viral infections". Antiviral Research. 82 (3): 95–102. doi:10.1016/j.antiviral.2009.02.198. PMID 19428599.
- ↑ Furuta Y, Gowen BB, Takahashi K, Shiraki K, Smee DF, Barnard DL (November 2013). "Favipiravir (T-705), a novel viral RNA polymerase inhibitor". Antiviral Research. 100 (2): 446–54. doi:10.1016/j.antiviral.2013.09.015. PMC 3880838. PMID 24084488.
- ↑ Caroline AL, Powell DS, Bethel LM, Oury TD, Reed DS, Hartman AL (April 2014). "Broad spectrum antiviral activity of favipiravir (T-705): protection from highly lethal inhalational Rift Valley Fever". PLoS Neglected Tropical Diseases. 8 (4): e2790. doi:10.1371/journal.pntd.0002790. PMC 3983105. PMID 24722586.
- ↑ Mumtaz N, van Kampen JJ, Reusken CB, Boucher CA, Koopmans MP (2016). "Zika Virus: Where Is the Treatment?". Current Treatment Options in Infectious Diseases. 8 (3): 208–211. doi:10.1007/s40506-016-0083-7. PMC 4969322. PMID 27547128.
- ↑ Yamada K, Noguchi K, Komeno T, Furuta Y, Nishizono A (April 2016). "Efficacy of Favipiravir (T-705) in Rabies Postexposure Prophylaxis". The Journal of Infectious Diseases. 213 (8): 1253–61. doi:10.1093/infdis/jiv586. PMC 4799667. PMID 26655300.
- ↑ Murphy J, Sifri CD, Pruitt R, Hornberger M, Bonds D, Blanton J, Ellison J, Cagnina RE, Enfield KB, Shiferaw M, Gigante C, Condori E, Gruszynski K, Wallace RM (January 2019). "Human Rabies - Virginia, 2017". MMWR. Morbidity and Mortality Weekly Report. 67 (5152): 1410–1414. doi:10.15585/mmwr.mm675152a2. PMC 6334827. PMID 30605446.
- ↑ Jin Z, Smith LK, Rajwanshi VK, Kim B, Deval J (2013). "The ambiguous base-pairing and high substrate efficiency of T-705 (Favipiravir) Ribofuranosyl 5'-triphosphate towards influenza A virus polymerase". PLOS ONE. 8 (7): e68347. Bibcode:2013PLoSO...868347J. doi:10.1371/journal.pone.0068347. PMC 3707847. PMID 23874596.
- ↑ Baranovich T, Wong SS, Armstrong J, Marjuki H, Webby RJ, Webster RG, Govorkova EA (April 2013). "T-705 (favipiravir) induces lethal mutagenesis in influenza A H1N1 viruses in vitro". Journal of Virology. 87 (7): 3741–51. doi:10.1128/JVI.02346-12. PMC 3624194. PMID 23325689.
- ↑ Guedj J, Piorkowski G, Jacquot F, Madelain V, Nguyen TH, Rodallec A, และคณะ (March 2018). "Antiviral efficacy of favipiravir against Ebola virus: A translational study in cynomolgus macaques". PLoS Medicine. 15 (3): e1002535. doi:10.1371/journal.pmed.1002535. PMC 5870946. PMID 29584730.
- ↑ Smee DF, Hurst BL, Egawa H, Takahashi K, Kadota T, Furuta Y (October 2009). "Intracellular metabolism of favipiravir (T-705) in uninfected and influenza A (H5N1) virus-infected cells". The Journal of Antimicrobial Chemotherapy. 64 (4): 741–6. doi:10.1093/jac/dkp274. PMC 2740635. PMID 19643775.
- ↑ Naesens L, Guddat LW, Keough DT, van Kuilenburg AB, Meijer J, Vande Voorde J, Balzarini J (October 2013). "Role of human hypoxanthine guanine phosphoribosyltransferase in activation of the antiviral agent T-705 (favipiravir)". Molecular Pharmacology. 84 (4): 615–29. doi:10.1124/mol.113.087247. PMID 23907213.
- ↑ Koons C (7 August 2014). "Ebola Drug From Japan May Emerge Among Key Candidates". Bloomberg.com.
- ↑ Yoon JJ, Toots M, Lee S, Lee ME, Ludeke B, Luczo JM, และคณะ (August 2018). "Orally Efficacious Broad-Spectrum Ribonucleoside Analog Inhibitor of Influenza and Respiratory Syncytial Viruses". Antimicrobial Agents and Chemotherapy. 62 (8): e00766–18. doi:10.1128/AAC.00766-18. PMC 6105843. PMID 29891600.
- ↑ Gatherer D (August 2014). "The 2014 Ebola virus disease outbreak in West Africa". The Journal of General Virology. 95 (Pt 8): 1619–24. doi:10.1099/vir.0.067199-0. PMID 24795448.
- ↑ Oestereich L, Lüdtke A, Wurr S, Rieger T, Muñoz-Fontela C, Günther S (May 2014). "Successful treatment of advanced Ebola virus infection with T-705 (favipiravir) in a small animal model". Antiviral Research. 105: 17–21. doi:10.1016/j.antiviral.2014.02.014. PMID 24583123.
- ↑ Smither SJ, Eastaugh LS, Steward JA, Nelson M, Lenk RP, Lever MS (April 2014). "Post-exposure efficacy of oral T-705 (Favipiravir) against inhalational Ebola virus infection in a mouse model". Antiviral Research. 104: 153–5. doi:10.1016/j.antiviral.2014.01.012. PMID 24462697.
- ↑ "First French Ebola patient leaves hospital". Reuters. 4 October 2016.
- ↑ "Guinea: Clinical Trial for Potential Ebola Treatment Started in MSF Clinic in Guinea". AllAfrica - All the Time. สืบค้นเมื่อ 28 December 2014.
- ↑ Fink S (4 February 2015). "Ebola Drug Aids Some in a Study in West Africa". The New York Times.
- ↑ Cohen J (26 February 2015). "Results from encouraging Ebola trial scrutinized". Science. doi:10.1126/science.aaa7912. สืบค้นเมื่อ 21 January 2016.
- ↑ "Favipiravir in Patients with Ebola Virus Disease: Early Results of the JIKI trial in Guinea | CROI Conference". www.croiconference.org. สืบค้นเมื่อ 2016-03-17.
- ↑ Sissoko D, Laouenan C, Folkesson E, M'Lebing AB, Beavogui AH, Baize S, และคณะ (March 2016). "Experimental Treatment with Favipiravir for Ebola Virus Disease (the JIKI Trial): A Historically Controlled, Single-Arm Proof-of-Concept Trial in Guinea". PLoS Medicine. 13 (3): e1001967. doi:10.1371/journal.pmed.1001967. PMC 4773183. PMID 26930627.
- ↑ Gorbalenya, Alexander E.; Baker, Susan C.; Baric, Ralph S.; และคณะ (2020-02-11). "Severe acute respiratory syndrome-related coronavirus: The species and its viruses – a statement of the Coronavirus Study Group". bioRxiv: 2020.02.07.937862. doi:10.1101/2020.02.07.937862.
- ↑ Manli Wang; Ruiyuan Cao; และคณะ (2020-02-04). "Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro". Cell Research (Nature).
- ↑ "好消息! 磷酸氯喹等部分药物初步显示良好临床疗效". 科技日报记者 付丽丽 刘垠. 中華人民共和国科学技術部. 2020-02-15. สืบค้นเมื่อ 2020-02-27.
- ↑ "瑞德西韦等药物已初步显示良好临床疗效" (ภาษาจีน). 新浪. 2020-02-16.
- ↑ "对战新冠病毒,多种药物和疗法正在临床发挥效力丨科技战疫进行时". 张佳星. 科技日报. 2020-02-13. สืบค้นเมื่อ 2020-02-29.
- ↑ "新冠肺炎治疗药物获批上市?别急!注意看这三个字……". 张佳星. 科技日报. 2020-02-17. สืบค้นเมื่อ 2020-02-29.
- ↑ "药物研发到了哪一步? 复产复工如何防感染? ——疫情防控科技进展焦点透视". 孙奕、董瑞丰、侯雪静. 新华网. 2020-02-21. สืบค้นเมื่อ 2020-02-28.
- ↑ "全国首个潜在治新冠肺炎药物"法维拉韦"获批上市" (ภาษาจีน). 新浪. 2020-02-16.
- ↑ "新型インフル薬「アビガン」活用も、新型肺炎の治療薬に-加藤厚労相". Bloomberg. 2020-02-02. สืบค้นเมื่อ 2020-02-02.
- ↑ "患者にインフル治療薬「アビガン」投与 エボラ薬も". 産経ニュース. 産経新聞社. 2020-02-22. สืบค้นเมื่อ 2020-02-22.
- ↑ "コロナにインフル治療薬「アビガン」活用を検討". nikkansports.com. 日刊スポーツ社. 2020-02-22. สืบค้นเมื่อ 2020-02-22.
- ↑ "アビガンの投与開始". 47NEWS. 共同通信社. 2020-02-22. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-04-01. สืบค้นเมื่อ 2020-02-22.
- ↑ "抗インフルエンザウイルス薬「アビガン錠200mg」の日本国内での製造販売承認取得のお知らせ" (ภาษาญี่ปุ่น). 富山化学工業. 24 March 2014. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-08-10. สืบค้นเมื่อ 2020-02-19.
- ↑ "エボラ出血熱で世界が注目する日本発のある薬剤". 日経メディカル. 11 August 2014.
- ↑ "ファビピラビル製剤の使用に当たっての留意事項について" (PDF) (ภาษาญี่ปุ่น). 厚生労働省. 24 March 2014. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2020-10-22. สืบค้นเมื่อ 2020-02-19.
