การจัดการทาลัสซีเมีย
- สำหรับทาลัสซีเมียอย่างอ่อน คนไข้ที่มีลักษณะสืบสายพันธุ์ (trait) ไม่จำเป็นต้องรักษาหรือดูแลหลังจากได้วินิจฉัยแล้ว[1] แต่คนไข้ทาลัสซีเมียแบบบีตาควรทราบว่า สภาพของตนสามารถวินิจฉัยผิดว่าเป็นภาวะเลือดจางเหตุขาดธาตุเหล็กซึ่งสามัญได้ และควรปฏิเสธการรักษาแบบลองยาเสริมเหล็ก (iron supplement) แม้ว่าการขาดธาตุเหล็กอาจเกิดขึ้นได้เมื่อตั้งครรภ์หรือมีเลือดออกเรื้อรัง[2] เมื่อมีครอบครัว ควรปรึกษาแพทย์เรื่องโรคทางพันธุกรรมทุกอย่าง โดยเฉพาะถ้าลูกเสี่ยงมีโรคแบบรุนแรงที่ป้องกันได้[3]
- สำหรับทาลัสซีเมียอย่างรุนแรง คนไข้ต้องรักษา การถ่ายเลือดเป็นการรักษาที่ช่วยยืดชีวิตเป็นอย่างแรก[1]
ยา
[แก้]คนไข้ทาลัสซีเมียจะค่อย ๆ สะสมธาตุเหล็กเกินในร่างกาย การสะสมอาจจะเป็นเพราะโรคเอง จากเฮโมโกลบินผิดปกติที่ไม่รวมเหล็กเข้าในโครงสร้างอย่างสมควร หรืออาจจะเป็นเพราะการถ่ายเลือดหลายครั้งที่ได้ การมีภาวะเหล็กเกินสร้างปัญหาทางเคมี-ชีวภาพหลายอย่าง
สารสำคัญสองอย่างที่ขนส่งและเก็บธาตุเหล็กในร่างกายก็คือ ferritin และ transferrin. ferritin เป็นโปรตีนในเซลล์ที่ยึดกับเหล็ก (II) แล้วเก็บเป็นเหล็ก (III) โดยปล่อยออกในเลือดเมื่อจำเป็น ส่วน transferrin เป็นโปรตีนยึดเหล็กที่อยู่ในน้ำเลือด มีหน้าที่ขนส่งเหล็กในเลือด โดยให้เหล็กต่อเซลล์ผ่านกระบวนการ endocytosis โปรตีน transferrin ทำงานเฉพาะกับเหล็ก (III) โดยมีค่าคงตัวสมดุล (equilibrium constant) ที่ 1023 M−1 ที่ค่าพีเอช 7.4[4]
การมีทาลัสซีเมียทำให้มีเหล็กที่ไม่ยึดกับ transferrin ในเลือด เพราะว่า transferrin ที่มีทั้งหมดอิ่มตัว เหล็กที่เป็นอิสระเช่นนี้เป็นพิษต่อร่างกาย เพราะว่ามันเร่งปฏิกิริยาให้เกิดอนุมูลอิสระไฮดรอกซิล (free hydroxyl radical)[5] อนุมูลที่ว่านี้สามารถทำลายไขมันผ่านกระบวนการ lipid peroxidation ต่อออร์แกเนลล์ของเซลล์รวมทั้งไลโซโซม ไมโทคอนเดรีย และเยื่อหุ้ม sarcoplasm ในกล้ามเนื้อ lipid peroxide ที่เป็นผลสามารถปฏิสัมพันธ์กับโมเลกุลอื่น ๆ โดยเชื่อมโยงข้าม (cross link) และดังนั้น จึงเป็นเหตุให้ส่วนต่าง ๆ เหล่านี้ทำงานได้ไม่ดี หรือไม่ได้เลย[5]
ภาวะเหล็กเกินสามารถรักษาได้ด้วยการรักษาโดยคีเลชัน (chelation therapy) ซึ่งเป็นกระบวนการกำจัดเหล็กโดยยา deferoxamine, deferiprone, และ deferasirox เป็นยากำจัดเหล็กที่ใช้อย่างสามัญที่สุด
Deferoxamine
[แก้]โครงสร้างและการทำงาน
[แก้]ยา deferoxamine หรือที่เรียกว่า desferoxamine B และ DFO-B เป็นกรด trihydroxamic ที่ผลิตจาก actinobacteria พันธุ์ Streptomyces pilosus เป็นยาซึ่งยึดกับเหล็ก ลดพิษที่เร่งปฏิกิริยาโดยเหล็กที่เป็นอิสระ และยังลดการเก็บสะสมเหล็กภายในเนื้อเยื่อต่าง ๆ โดยทำงานเป็นลิแกนด์เกาะกับเหล็กแบบ hexadentate คือยึดกับจุดพันธะทั้ง 6 ของเหล็กที่ไม่ได้ยึดกับ transferrin ซึ่งทำให้เหล็กหมดฤทธิ์[6] แต่ยาก็ทำงานเฉพาะเจาะจงที่สุดกับ Fe3+ โดยยึดกับมันผ่านออกซิเจนที่อยู่ในกลุ่มไฮดรอกซิลและ carbonyl ของยา รวมกันเป็นโครงสร้างที่เรียกว่า ferrioxamine สารประกอบยา+เหล็กเช่นนี้โดยมากขับออกทางไตเพราะละลายน้ำได้[7] ประมาณ 1/3 ของสารประกอบก็ขับออกทางอุจจาระผ่านน้ำดีด้วย[5]
การให้ยาและฤทธิ์
[แก้]deferoxamine ให้โดยฉีดเข้าทางเส้นเลือด ในกล้ามเนื้อ หรือภายใต้ผิวหนัง ยาทานยังเป็นไปไม่ได้เพราะยาย่อยสลายได้อย่างรวดเร็วโดยเอนไซม์ และดูดซึมได้ไม่ดีผ่านทางเดินอาหาร วิธีการให้โดยฉีดเป็นจุดอ่อนอย่างหนึ่งเพราะว่าทำให้การรักษามีราคาสูงกว่าและทำให้เจ็บ[8]
แต่ยามีหลักฐานว่ารักษาปัญหาหลายอย่างที่มาจากภาวะเหล็กเกิน มีผลดีต่อโรคหัวใจที่เกิดจากการสะสมเหล็กในหัวใจ[9] ช่วยปรับปรุงหน้าที่การทำงานของตับโดยระงับการเกิดพังผืดตับ (hepatic fibrosis) ซึ่งเป็นผลจากการสะสมเหล็กในตับ[10] มีผลดีต่อการทำงานของระบบต่อมไร้ท่อ และการเจริญเติบโต
ความผิดปกติในต่อมไร้ท่อของคนไข้ทาลัสซีเมียที่มีภาวะเหล็กเกินก็คือ การขัดขวางการผลิต insulin-like growth factor (IGF-1) และทำให้เกิดภาวะการทำงานหย่อนของอวัยวะเพศ (hypogonadism) ซึ่งสภาพทั้งสองล้วนแต่ทำให้โตช้าในช่วงวัยรุ่น งานศึกษาหนึ่งแสดงว่า คนไข้ 90% ที่รักษาด้วย deferoxamine อย่างสม่ำเสมอตั้งแต่เด็กจะโตอย่างเป็นปกติในช่วงวัยรุ่น แต่ตกไปที่ระดับ 38% สำหรับคนไข้ที่รักษาด้วย deferoxamine ขนาดต่ำ ๆ เริ่มตั้งแต่ช่วงวัยรุ่น[5] ความผิดปกติทางต่อมไร้ท่ออีกอย่างที่คนไข้เผชิญก็คือโรคเบาหวาน เพราะตับอ่อนมีเหล็กเกินจึงขัดขวางการหลั่งอินซูลิน งานศึกษาหลายงานแสดงว่า คนไข้ที่รักษาด้วย deferoxamine เป็นประจำมีโอกาสเสี่ยงโรคเบาหวานน้อยกว่า[11]
ผลข้างเคียง
[แก้]deferoxamine สามารถมีผลเป็นพิษถ้าใช้เกิน 50 มก./กก. ของน้ำหนักร่างกาย โดยมีผลเป็นการได้ยินและการเห็นที่ผิดปกติ ความเป็นพิษต่อปอด (pulmonary toxicity) ความเป็นพิษต่อระบบประสาท (sensorimotor neurotoxicity) และการทำงานของไตเปลี่ยน[5] ผลเป็นพิษที่พบโดยมากในเด็กก็คือการไม่สูงขึ้น ซึ่งอาจเกิดจาก deferoxamine เข้ายึดกับโลหะชนิดอื่น ๆ ที่จำเป็นในการเจริญเติบโต
ยามีค่าคงตัวสัมพรรคภาพ (affinity constant คือ Ka) ที่ 1031 สำหรับ Fe3+, 1014 สำหรับ Cu2+, และ 1010 สำหรับ Zn2+ และดังนั้นอาจจะเข้าจับทองแดงและสังกะสีเมื่อไม่มีเหล็กให้จับ สังกะสีจำเป็นต่อการทำงานของ metalloenzyme ที่มีบทบาทในการสร้างกระดูก และการยึดสังกะสีอาจจะทำให้ขาดสังกะสี แล้วทำให้โตช้า ลดการสร้างคอลลาเจน และทำกระบวนการ mineralization ของกระดูกให้เสียหาย
โดยนัยเดียวกัน ทองแดงทำงานเป็น enzyme cofactor ในการสร้างกระดูก การเข้ายึดทองแดงอาจมีผลเป็นการขาดทองแดงเช่นกัน ทำให้เกิดอาการ metaphyseal cupping (กระดูก metaphysis เป็นรูปถ้วย) และภาวะกระดูกพรุน ยกตัวอย่างเช่น จะมีคอลลาเจนผิดปกติเกิดขึ้นถ้าขาดทองแดงเพราะเอนไซม์ lysyl oxidase ซึ่งใช้ทองแดงเป็น cofactor และเป็นตัวเร่งปฏิกิริยาขั้นตอน oxidative deamination ซึ่งสำคัญในการเชื่อมโยงคอลลาเจน ไม่สามารถทำงานได้อย่างปกติ มีงานศึกษาที่แสดงด้วยว่าแม้ว่าระดับทองแดงและสังกะสีจะไม่ขาดในเลือดของคนไข้ที่รับยา deferoxamine กระดูก metaphysis ก็ยังขาดโลหะ การขัดขวางการสูงขึ้นของยาอาจจะมาจากการมี deferoxamine สะสมในเนื้อเยื่อและรบกวนเอนไซม์ที่อาศัยเหล็ก และมีบทบาทในการปรับคอลลาเจนแบบ post-translational[12]
คนไข้ที่ได้ยาเสริมวิตามินซีจะสามารถขับเหล็กออกพร้อมกับ deferoxamine ได้ดีขึ้น เพราะวิตามินซีเพิ่มปริมาณธาตุเหล็กที่ deferoxamine เข้าถึงได้ แต่ว่า การได้ยาวิตามินซีก็สามารถเพิ่มความเป็นพิษของเหล็กได้เพราะสร้างอนุมูลอิสระเพิ่มขึ้น ดังนั้น ควรให้วิตามินซีเพียงแค่ 100 มก. 30 นาทีก่อนให้ยา deferoxamine[13]
มีหลักฐานแล้วด้วยว่าการใช้ยา deferoxamine ร่วมกับ deferiprone เพิ่มประสิทธิภาพของกระบวนการคีเลชันโดยเพิ่มการขับเหล็กออกถึงสองเท่า[14]
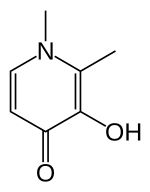
Deferiprone
[แก้]โครงสร้าง
[แก้]Deferiprone (DFP) เป็น ลิแกนด์เกาะกับเหล็กแบบ bidentate คือเข้ายึดพันธะของเหล็กเพียงสองจุด ดังนั้น จึงต้องมีโมเลกุลของยา 3 โมเลกุลต่อเหล็กอะตอมหนึ่ง โดยมีโครงสร้างแบบ orthorhombic[15]
DFP ผลิตโดยการสังเคราะห์และมีฤทธิ์เฉพาะเจาะจงต่อเหล็ก (III)[15][16] คุณสมบัติของ DFP ที่ทำให้มีประสิทธิภาพเป็นยาก็คือ ละลายน้ำได้ มีมวลโมเลกุลต่ำ (139 Da) ไม่มีขั้ว และละลายในลิพิดได้ (lipophilicity)[15] คุณสมบัติเหล่านี้ทำให้ยาผ่านเยื่อหุ้มเซลล์เข้าไปในเซลล์ทั่วร่างกายได้ง่าย รวมทั้งส่วนกั้นเลือด-สมอง ช่วยให้สามารถกำจัดเหล็กเกินจากอวัยวะต่าง ๆ ได้[15][17]
แม้ว่ากลไกการกำจัดเหล็กของ DFP จะยังไม่ชัดเจน คือคาดกันมาก่อนว่า ยาเข้ายึดกับเหล็กโดยการแยกพันธะคาร์บอน-คาร์บอน หรือพันธะคาร์บอน-ออกซิเจนที่อยู่ในยา แต่ว่างานศึกษาในไทยปี 2549 เสนอกลไกหนึ่งที่เป็นไปได้ โดยสรุปว่า กลไกเกิดจากการแยกพันธะคาร์บอน-คาร์บอน เพราะว่าต้องใช้พลังงานน้อยกว่าในการแยก และพลังงานที่ใช้ในการแยกพันธะพบว่าติดลบ ซึ่งแสดงนัยว่า เป็นกระบวนการเกิดขึ้นเอง (spontaneous process) และเป็นปฏิกิริยาคายพลังงาน (exergonic reaction) และโครงสร้างของผลิตผลจากกระบวนการนี้คล้ายกับโครงสร้าง 3-มิติ (tertiary structure) ของยาที่ยึดเหล็กแล้ว[18]
การให้ยาและฤทธิ์
[แก้]deferiprone (DFP) เป็นตัวยึดเหล็ก (iron chelator) ที่มีฤทธิ์ทางปาก และดังนั้นจึงใช้ได้ง่ายกว่า deferoxamine มาก[15] ระดับสารประกอบยาบวกกับเหล็กในเลือดจะถึงระดับสูงสุดหลังจาก 1 ชม. โดยยามีระยะครึ่งชีวิต 160 นาที สารประกอบยาบวกกับเหล็กจึงขับออกภายใน 3-4 ชม. หลังทาน โดยมากทางปัสสาวะ (90%)[15]
เมื่อเทียบ deferiprone กับ deferoxamine จะพบว่า ทั้งสองมีประสิทธิภาพพอ ๆ กัน แต่ว่า ยาที่มีลักษณะต่างกันจะเข้าถึงที่สะสมเหล็กต่าง ๆ ได้ต่างกัน DFP เล็กกว่า deferoxamine และสามารถเข้าไปในเซลล์ได้ง่ายกว่า อีกอย่างหนึ่ง ที่ระดับพีเอชของเลือด สัมพรรคภาพของ DFP กับเหล็กขึ้นอยู่กับความเข้มข้นของยา ในระดับความเข้มข้นต่ำ สารประกอบยา+เหล็กจะแยกออก โดยให้เหล็กกับลิแกนต์อื่นที่ต้องการเหล็กเหมือนกัน ซึ่งเป็นคุณสมบัติที่อธิบายว่า ทำไม DFP ดูเหมือนจะกระจายจำหน่ายเหล็กไปในร่างกาย และด้วยเหตุผลเดียวกัน DFP จึงสามารถ "ขนส่ง" เหล็กออกจากเซลล์ไปยังเลือด และให้เหล็กกับ deferoxamine ซึ่งเป็นตัวขับเหล็กออกจากร่างกาย[16]
DFP ยังมีประสิทธิภาพดีกว่า deferoxamine อย่างสำคัญในการรักษาภาวะเหล็กคั่งในกล้ามเนื้อหัวใจ (myocardial siderosis) ในคนไข้ที่มีทาลัสซีเมียใหญ่ (thalassemia major)[15] คือ เชื่อว่า DFP ปรับการทำงานของไมโทคอนเดรียในหัวใจโดยการกระจายจำหน่ายเหล็กที่ไม่เสถียร (labile) ในเซลล์หัวใจ
คนไข้ทาลัสซีเมียอาจเผชิญกับปัญหาออกซิเดชันในเซลล์สมองเพราะว่าสมองต้องการออกซิเจนมากกว่า แต่มีสารต้านอนุมูลอิสระในระดับที่ต่ำกว่าเพื่อป้องกันกระบวนการออกซิเดชัน ดังนั้น การมีเหล็กเกินในสมองอาจทำให้เกิดอนุมูลอิสระมากขึ้น ตัวยึดเหล็กแบบ hexadentate เช่น deferoxamine มีโมเลกุลใหญ่ และดังนั้นมีโอกาสข้ามตัวกั้นเลือด-สมองน้อยกว่า เพื่อจะยึดกับเหล็กที่เกิน แต่ DFP สามารถทำได้โดยเป็นสารประกอบยา+เหล็กที่ละลายน้ำได้ และสามารถผ่านเข้าเยื่อหุ้มเซลล์ผ่านกระบวนการแพร่ที่ไม่ต้องช่วย และการต่อยากับน้ำตาลยังอาจเพิ่มการผ่านเข้าตัวกั้นเลือด-สมองได้ เพราะว่า สมองมีตัวช่วยขนส่งน้ำตาลที่สมองต้องใช้ในระดับสูง[19]
ผลข้างเคียง
[แก้]DFP อาจเสี่ยงต่อกระบวนการ glucuronidation ในตับ ซึ่งอาจขับยาถึง 85% ออกจากร่างกายก่อนที่จะเข้ายึดเหล็กได้ ขอบเขตความปลอดภัยของ DFP เข้าใจกันดี โดยมีภาวะแกรนูโลไซต์น้อย (agranulocytosis) เป็นผลข้างเคียงที่หนักที่สุด[15] แม้ว่า ภาวะนี้จะรายงานในคนไข้น้อยกว่า 2% แต่ก็อาจเป็นอันตรายถึงชีวิต ดังนั้น จึงต้องตรวจตราดูจำนวนเม็ดเลือดขาวในเลือด[17] ผลข้างเคียงที่หนักน้อยกว่ารวมทั้งอาการในทางเดินอาหาร โดยพบในคนไข้ 33% ในช่วงปีแรกที่ใช้ยา แต่เหลืออยู่เพียง 3% ในปีต่อ ๆ มา, ปวดในข้อ (arthralgia), และการขาดสังกะสี ซึ่งเป็นปัญหาสำคัญโดยเฉพาะในคนไข้โรคเบาหวาน[15]

Deferasirox
[แก้]โครงสร้าง
[แก้]Deferasirox เป็น N-substituted bis-hydroxyphenyl-triazole และสามารถกำจัดเหล็กจากเลือดโดยใช้โมเลกุลของ deferasirox 2 โมเลกุลเข้ายึดกับเหล็กอะตอมหนึ่ง ซึ่งจะกลายเป็นสารประกอบโคออร์ดิเนชัน Fe-[deferasirox]2[20] deferasirox ซึ่งเป็นตัวยืดแบบ tridentate จะยึดกับเหล็กโดย 3 พันธะ โดยใช้อะตอมไนโตรเจนหนึ่งอะตอมและอะตอมออกซิเจนอีก 2 อะตอม ซึ่งมีผลเป็นโครงสร้างแปดด้าน (octahedral) โดยมีเหล็กอยู่ตรงกลาง สมรรถภาพกำจัดเหล็กของยามาจากขนาดที่เล็ก ซึ่งช่วยให้เข้าถึงเหล็กภายในเลือด และที่น่าสนใจกว่า ภายในเซลล์ นอกจากนั้นแล้ว deferasirox ยังจำเพาะกับ iron (+3) อย่างยิ่ง และดังนั้นการใช้ยาจะไม่ทำให้เสียโลหะสำคัญอื่น ๆ ภายในร่างกาย[21]
การใช้ยาและฤทธิ์
[แก้]deferasirox วางขายใต้ชื่อการค้า Exjade โดยสามัญที่สุด มีประโยชน์สำคัญเหนือกว่า desferoxamine เพราะสามารถทานได้ ไม่ต้องให้ผ่านเส้นเลือดหรือฉีดเข้าใต้ผิวหนัง โดยมีระยะครึ่งชีวิต (terminal elimination half life) ที่ 8-16 ชม. ยาอาจทานได้วันละครั้ง การทานยาที่ขนาด 20 มก./กก. ของน้ำหนักร่างกาย จะพอในคนไข้โดยมากเพื่อดำรง (maintenance) ระดับความเข้มข้นของเหล็กในตับ (liver iron concentration, LIC) ซึ่งปกติจะวัดเป็น มก. ของเหล็ก ต่อกรัมของเนื้อเยื่อตับ แต่เพื่อลดระดับ LIC อาจจะต้องใช้ยาในขนาดสูงขึ้น[22]
สมรรถภาพของ deferasirox ในการลดระดับ LIC มีหลักฐานมากมาย งานศึกษาหนึ่งแสดงว่า หลังจากใช้ยา 4-5 ปี ระดับมัชฌิมของ LIC ลดลงจาก 17.4 ± 10.5 mg Fe/g ไปเป็น 9.6 ± 8.0 mg Fe/g งานศึกษานี้แสดงว่า การรักษาระยะยาวมีผลลดระดับเหล็กอย่างคงยืนสำหรับคนไข้ที่ต้องถ่ายเลือดเพราะเหตุแห่งโรค[23]
ประโยชน์สำคัญอีกอย่างของการใช้ deferasirox แทน desferoxamine ก็คือ งานวิจัยเบื้องต้นไม่พบว่า ยามีผลสำคัญต่อการเจริญเติบโตของคนไข้เด็ก งานศึกษาปี 2554 พบว่า เด็กที่รักษาเติบโตได้เกือบปกติตลอดระยะ 5 ปีช่วงงานศึกษา[23]
ผลข้างเคียง
[แก้]deferasirox สามารถมีผลข้างเคียงมากมายหลายหลาก รวมทั้งปวดหัว คลื่นไส้ อาเจียน และปวดในข้อ[24] มีหลักฐานบ้างว่า มีปัญหาทางเดินอาหารเนื่องจากยา[23]

Indicaxanthin
[แก้]โครงสร้าง
[แก้]indicaxanthin เป็นสีที่ทำมาจากผลของต้นกระบองเพชร และสามารถใช้เป็นสารต้านอนุมูลอิสระ การเสริม indicaxanthin พบว่ามีผลป้องกันเม็ดเลือดแดงต่อคนที่มีทาลัสซีเมียแบบบีตา[25] สารมีโครงสร้างคล้ายกับกรดอะมิโนและชอบทั้งน้ำและลิพิด (amphiphilic) คือ มันสามารถยึดกับโครงสร้างที่เป็นหัวขั้ว (polar head groups) ของเยื่อหุ้มเซลล์ผ่านปฏิสัมพันธ์ทางไฟฟ้า แต่ก็สามารถดูดซับ (adsorption) เข้าไปในลิพิดของเซลล์ได้อีกด้วย เมื่อใส่ indicaxanthin กับเลือดในหลอดของคนไข้ทาลัสซีเมีย ก็พบว่า เซลล์เม็ดเลือดแดงจะเริ่มสะสม indicaxanthin ภายในเซลล์[25]
หน้าที่
[แก้]เฮโมโกลบินจะผ่านปฏิกิริยาออกซิเดชันต่อไปนี้ เป็นกระบวนการที่ในที่สุดทำลายเม็ดเลือดแดงโดยปกติธรรมดา
- Hb → Oxy-Hb → Met-Hb → [Perferryl-Hb] → Oxoferryl → ขั้นตอนออกซิเดชันอื่น ๆ
แต่ว่า ปฏิกิริยานี้มีกับคนไข้ทาลัสซีเมียมากกว่า ไม่ใช่เพราะเพียงว่า มีอนุมูลอิสระมากกว่าในเลือดเท่านั้น แต่เม็ดเลือดแดงของคนไข้ยังป้องกันสารอนุมูลอิสระได้จำกัดกว่าอีกด้วย และ indicaxanthin สามารถลดระดับ perferryl-Hb โดยเปลี่ยนมันกลับเป็น met-Hb โดยมีผลคือ เฮโมโกลบินจึงเสื่อมช้ากว่า ซึ่งช่วยป้องกันการทำลายเม็ดเลือดของระบบ[25]
นอกจากนั้นแล้ว indicaxathin ยังสามารถลดความเสียหายจากกระบวนการออกซิเดชันในเซลล์และเนื้อเยื่อโดยเข้าไปยึดสารอนุมูลอิสระ แต่กลไกการทำงานเช่นนี้ยังไม่ชัดเจน[25] indicaxanthin ดูดซึมได้ง่ายและมีผลข้างเคียงน้อย เช่นการอาเจียนและท้องเสีย
การตรวจจับความเป็นพาหะ
[แก้]- ประเทศไซปรัสมีนโยบายการตรวจคัดกรองเพื่อลดความชุกของทาลัสซีเมีย ซึ่งตั้งแต่เริ่มโปรแกรมในช่วงคริสต์ทศวรรษ 1970 (ซึ่งรวมทั้งการตรวจคัดกรองก่อนมีครรภ์และการทำแท้ง) ได้ลดจำนวนเด็กที่เกิดพร้อมกับโรคเลือดทางกรรมพันธุ์จาก 1 คนใน 158 คน จนเกือบเหลือ 0[26]
- ประเทศอิหร่านมีการตรวจคัดกรองก่อนแต่งงาน โดยเช็คเม็ดเลือดแดงของชายก่อน ถ้ามีเม็ดเลือดแดงเล็ก (microcytosis) คือมีปริมาณเฉลี่ยของฮีโมโกลบินในเม็ดเลือดแดง (MCH) < 27 pg หรือปริมาตรของเม็ดเลือดแดงโดยเฉลี่ย (MCV) < 80 fl ก็จะเช็คหญิงต่อไป และถ้าทั้งสองมีเม็ดเลือดแดงเล็ก ก็จะเช็คอัตราของเฮโมโกลบินแบบ A2 ต่อไป ถ้าทั้งสองมีระดับความเข้มข้นสูงกว่า 3.5% (ซึ่งเป็นลักษณะของพาหะทาลัสซีเมียบีตา คือ มี thalassemia trait) ก็จะส่งทั้งสองไปเพื่อปรึกษาผู้ชำนาญการในเรื่องกรรมพันธุ์ต่อ-[27]
ในปี 2551 ในประเทศสเปน มีการผสมเทียมทารกคนหนึ่งโดยเฉพาะเพื่อช่วยรักษาทาลัสซีเมียในพี่ชายของเขา คือ เด็กเกิดจากตัวอ่อนที่ได้ตรวจคัดกรองว่าไม่มีโรคก่อนฝังลงในมดลูกแม่ เลือดจากสายรกที่เข้ากับพี่ชายของเขาได้ก็เก็บไว้เพื่อปลูกถ่ายไขกระดูกให้กับพี่ชาย แพทย์จัดว่าประสบความสำเร็จ[28]
ในปี 2552 กลุ่มผู้เชี่ยวชาญในประเทศอินเดียได้แสดงผลการรักษาทาลัสซีเมียในเด็กหญิงที่สำเร็จ โดยใช้เซลล์ต้นกำเนิดจากเลือดที่ได้จากสายรกของน้องชายเพื่อปลูกถ่ายให้กับพี่สาว[29]
การปลูกถ่ายไขกระดูก
[แก้]การรักษาโรคให้หายโดยไม่ต้องถ่ายเลือดอีกต่อไปเป็นไปได้โดยปลูกถ่ายไขกระดูกจากผู้บริจาคที่เข้ากันได้ ในคนไข้ความเสี่ยงน้อยที่อายุน้อย อัตราการรอดชีวิตโดยไม่เป็นทาลัสซีเมียอยู่ที่ 87% อัตราเสี่ยงตายอยู่ที่ 3%[30] ข้อเสียอย่างเดียวคือต้องมีคนบริจาคที่มี Human leukocyte antigen (HLA) เข้ากันได้ แต่ว่าถ้าคนไข้ไม่มีผู้บริจาคที่เข้ากันได้ทาง HLA ก็ยังสามารถถ่ายปลูกไขกระดูกจากแม่ได้ (haploidentical mother, mismatched donor) ผลที่ได้ก็คือ การรอดชีวิตโดยไม่มีทาลัสซีเมียอยู่ที่อัตรา 70% การไม่ยอมรับไขกระดูก 23% และอัตราการตายที่ 7% ผลจะดีที่สุดในเด็กเล็กที่สุด[31]
เชิงอรรถและอ้างอิง
[แก้]- ↑ 1.0 1.1 "Pediatric Thalassemia Treatment & Management". Medical Care. Open Publishing. 30 April 2010. สืบค้นเมื่อ 27 September 2011.
- ↑ Burdick, Claude Owen. "Separating Thalassemia Trait and Iron Deficiency by Simple Inspection". American Society for Clinical Pathology. สืบค้นเมื่อ 27 September 2011.
- ↑ Harrison's Principles of Internal Medicine 17th Edition. McGraw-Hill medical. September 2008. p. 776. ISBN 0-07-164114-9.
- ↑ Aisen, P; Leibman, A; Zweier, J; Leibman; Zweier (March 1978). "Stoichiometric and site characteristics of the binding of iron to human transferrin". J. Biol. Chem. 253 (6): 1930–7. PMID 204636.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 5.0 5.1 5.2 5.3 5.4 Brittenham, Gary M; Olivieri, Nancy F (1997). "Iron-chelating therapy and the treatment of thalassemia". Journal of the American Society of Hematology. 89 (3): 739–761. PMID 9028304. สืบค้นเมื่อ 28 February 2013.
- ↑ Brittenham, Gary M.; Griffith, Patricia M.; Nienhuis, Arthur W.; McLaren, Christine E.; Young, Neal S.; Tucker, Eben E.; Allen, Christopher J.; Farrell, David E.; Harris, John W. (1994). "Efficacy of Deferoxamine in Preventing Complications of Iron Overload in Patients with Thalassemia Major". New England Journal of Medicine. 331 (9): 567–73. doi:10.1056/NEJM199409013310902. PMID 8047080.
- ↑ Cozar, O.; Leopold, N.; Jelic, C.; Chiş, V.; David, L.; Mocanu, A.; Tomoaia-Cotişel, M. (2006). "IR, Raman and surface-enhanced Raman study of desferrioxamine B and its Fe (III) complex, ferrioxamine B". Journal of Molecular Structure. 788: 1. Bibcode:2006JMoSt.788....1C. doi:10.1016/j.molstruc.2005.04.035.
- ↑ Cohen, Alan; Martin, Marie; Schwartz, Elias (1981). "Response to long-term deferoxamine therapy in thalassemia". The Journal of Pediatrics. 99 (5): 689–94. doi:10.1016/S0022-3476(81)80385-X. PMID 7299539.
- ↑ Pennell, D. J.; Berdoukas, V; Karagiorga, M; Ladis, V; Piga, A; Aessopos, A; Gotsis, ED; Tanner, MA; และคณะ (2006). "Randomized controlled trial of deferiprone or deferoxamine in beta-thalassemia major patients with asymptomatic myocardial siderosis". Blood. 107 (9): 3738–44. doi:10.1182/blood-2005-07-2948. PMID 16352815.
- ↑ Jin, Haiyan; Terai, Shuji; Sakaida, Isao (2007). "The iron chelator deferoxamine causes activated hepatic stellate cells to become quiescent and to undergo apoptosis". Journal of Gastroenterology. 42 (6): 475–84. doi:10.1007/s00535-007-2020-5. PMID 17671763.
- ↑ Kaye, Todd B.; Guay, André T.; Simonson, Donald C. (1993). "Non-insulin-dependent diabetes mellitus and elevated serum ferritin level". Journal of Diabetes and its Complications. 7 (4): 245. doi:10.1016/S0002-9610(05)80252-1.
- ↑ Olivieri, Nancy F.; Koren, Gideon; Harris, Jonathan; Khattak, Sohail; Freedman, Melvin H.; Templeton, Douglas M.; Bailey, John D.; Reilly, B. J. (1992). "Growth Failure and Bony Changes Induced by Deferoxamine". Journal of Pediatric Hematology/Oncology. 14: 48. doi:10.1097/00043426-199221000-00007.
- ↑ Ambruso, DR; Mahony, BS; Githens, JH; Rhoades, ED (1982). "Effect of subcutaneous deferoxamine and oral vitamin C on iron excretion in congenital hypoplastic anemia and refractory anemia associated with the 5q-syndrome". The American journal of pediatric hematology/oncology. 4 (2): 115–23. PMID 7114394.
- ↑ Kattamis, Antonis (2005). "Combined therapy with deferoxamine and deferiprone". Annals of the New York Academy of Sciences. 1054: 175–82. Bibcode:2005NYASA1054..175K. doi:10.1196/annals.1345.020. PMID 16339663.
- ↑ 15.0 15.1 15.2 15.3 15.4 15.5 15.6 15.7 15.8 Wiwanitkit, Viroj (2006). "Quantum chemical analysis of the deferiprone-iron binding reaction". International Journal of Nanomedicine. 1 (1): 111–3. doi:10.2147/nano.2006.1.1.111. PMC 2426763. PMID 17722270.
- ↑ 16.0 16.1 Olivieri, Nancy F.; Brittenham, Gary M. (1997). "Iron-Chelating Therapy and the Treatment of Thalassemia". Blood. 89 (3): 739–61. PMID 9028304.
- ↑ 17.0 17.1 Galanello, R.; Campus, S. (2009). "Deferiprone Chelation Therapy for Thalassemia Major". Acta Haematologica. 122 (2–3): 155–64. doi:10.1159/000243800. PMID 19907153.
- ↑ Wiwanitkit, Viroj (2006). "Quantum Chemical Analysis of the Deferiprone-Iron Binding Reaction". International journal of nanomedicine. 1 (1): 111–3. doi:10.2147/nano.2006.1.1.111. PMC 2426763. PMID 17722270.
- ↑ Heli, Hossein; Mirtorabi, Siamak; Karimian, Khashayar (2011). "Advances in iron chelation: An update". Expert Opinion on Therapeutic Patents. 21 (6): 819–56. doi:10.1517/13543776.2011.569493. PMID 21449664.
- ↑ Cappellini, M. D.; Cohen, A; Piga, A; Bejaoui, M; Perrotta, S; Agaoglu, L; Aydinok, Y; Kattamis, A; และคณะ (2006). "A phase 3 study of deferasirox (ICL670), a once-daily oral iron chelator, in patients with beta-thalassemia". Blood. 107 (9): 3455–62. doi:10.1182/blood-2005-08-3430. PMID 16352812.
- ↑ R Galanello; Piga, A; Forni, GL; Bertrand, Y; Foschini, ML; Bordone, E; Leoni, G; Lavagetto, A; และคณะ (2006-01-01). "Phase II clinical evaluation of deferasirox, a once-daily oral chelating agent, in pediatric patients with β-thalassemia major". Haematologica. 91 (10): 1343–51. PMID 17018383.
- ↑ Nisbet-Brown, Eric; Olivieri, Nancy F; Giardina, Patricia J; Grady, Robert W; Neufeld, Ellis J; Séchaud, Romain; Krebs-Brown, Axel J; Anderson, Judith R; และคณะ (2003). "Effectiveness and safety of ICL670 in iron-loaded patients with thalassaemia: A randomised, double-blind, placebo-controlled, dose-escalation trial". The Lancet. 361 (9369): 1597. doi:10.1016/S0140-6736(03)13309-0.
- ↑ 23.0 23.1 23.2 Cappellini, M. D.; Bejaoui, M.; Agaoglu, L.; Canatan, D.; Capra, M.; Cohen, A.; Drelichman, G.; Economou, M.; และคณะ (2011). "Iron chelation with deferasirox in adult and pediatric patients with thalassemia major: Efficacy and safety during 5 years' follow-up". Blood. 118 (4): 884–93. doi:10.1182/blood-2010-11-316646. PMID 21628399.
- ↑ "How Are Thalassemias Treated?". National Heat, Lung and Blood institute. สืบค้นเมื่อ 2 March 2013.
- ↑ 25.0 25.1 25.2 25.3 Tesoriere, L.; Allegra, M.; Butera, D.; Gentile, C.; Livrea, M. A. (2006). "Cytoprotective effects of the antioxidant phytochemical indicaxanthin in β-thalassemia red blood cells". Free Radical Research. 40 (7): 753–61. doi:10.1080/10715760600554228. PMID 16984002.
- ↑ Leung, TN; Lau, TK; Chung, TKH (April 2005). "Thalassaemia screening in pregnancy". Current Opinion in Obstetrics and Gynecology. 17 (2): 129–34. doi:10.1097/01.gco.0000162180.22984.a3. PMID 15758603.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Samavat, A; Modell, B; Modell (November 2004). "Iranian national thalassaemia screening programme". BMJ (Clinical Research Ed.). 329 (7475): 1134–7. doi:10.1136/bmj.329.7475.1134. PMC 527686. PMID 15539666.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Spanish Baby Engineered To Cure Brother". October 2008. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 4 December 2008.
- ↑ "His sister's keeper: Brother's blood is boon of life". Times of India. 17 September 2009.
- ↑ Sabloff, M; Chandy, M; Wang, Z; Logan, BR; Ghavamzadeh, A; Li, CK; Irfan, SM; Bredeson, CN; และคณะ (2011). "HLA-matched sibling bone marrow transplantation for β-thalassemia major". Blood. 117 (5): 1745–50. doi:10.1182/blood-2010-09-306829. PMC 3056598. PMID 21119108.
- ↑ Sodani, P; Isgrò, A; Gaziev, J; Paciaroni, K; Marziali, M; Simone, MD; Roveda, A; De Angelis, G; และคณะ (2011). "T cell-depleted hla-haploidentical stem cell transplantation in thalassemia young patients". Pediatric reports. 3 Suppl 2 (Suppl 2): e13. doi:10.4081/pr.2011.s2.e13. PMC 3206538. PMID 22053275.
