เนื้องอก
| เนื้องอก | |
|---|---|
| ชื่ออื่น | neoplasm, tumor, tumour, carcinocytes |
 | |
| ตัวอย่างชิ้นส่วนลำไส้ใหญ่ที่มีมะเร็งชนิดลุกลามหรือมะเร็งลำไส้ใหญ่ชนิดลุกลาม ลักษณะคล้ายปล่องภูเขาไฟ สีแดง รูปร่างไม่สม่ำเสมอ | |
| สาขาวิชา | วิทยามะเร็ง |
เนื้องอก (อังกฤษ: neoplasm, tumor) เป็นการเติบโตผิดปกติของเนื้อเยื่อ[1][2][3] โดยส่วนมากมักเกิดเป็นก้อนเนื้อ[4] ICD-10 จำแนกเนื้องอกเป็น 4 ประเภท แบ่งเป็น เนื้องอกไม่ร้าย (benign neoplasms) เนื้องอกเฉพาะที่ (in situ neoplasms) เนื้องอกร้าย (malignant neoplasms) และเนื้องอกที่มีพฤติกรรมไม่ชัดเจน[5] เนื้องอกร้ายยังถูกเรียกว่ามะเร็งและเป็นสิ่งที่ถูกศึกษาในวิทยามะเร็ง
ก่อนที่เนื้อเยื่อจะเติบโตอย่างผิดปกติ เซลล์มักมีรูปแบบการเติบโตที่ไม่ปกติ เช่น เมตาเพลเซีย (metaplasia) หรือ ดิสเพลเซีย (dysplasia)[6] อย่างไรก็ตาม เมตาเพลเซียหรือดิสเพลเซียอาจไม่ได้พัฒนาเป็นเนื้องอกเสมอไป[1] คำมีที่มาจากภาษากรีกโบราณ νέος- neo "ใหม่" และ πλάσμα plasma "การเกิดขึ้น การสร้างตัว"
ประเภท
[แก้]เนื้องอกอาจอยู่ในรูปแบบ เนื้องอกไม่ร้าย เนื้องอกอาจร้าย หรือ เนื้องอกร้าย (มะเร็ง)[7]
- เนื้องอกไม่ร้าย (benign neoplasms) รวมถึง เนื้องอกมดลูกและไฝเมลาโนไซต์ (ไฝมีสี) มีขอบเขต อยู่เฉพาะที่ และไม่กลายเป็นมะเร็ง[6]
- เนื้องอกที่อาจกลายเป็นมะเร็ง ได้แก่ เนื้องอกเฉพาะที่ (carcinoma in situ) ซึ่งอยู่เฉพาะที่ ไม่บุกรุกและทำลาย ทว่าอาจกลายเป็นมะเร็งเมื่อเวลาผ่านไป
- เนื้องอกร้าย (malignant neoplasms) หรือที่มักเรียกกันว่ามะเร็ง ซึ่งบุกรุกและทำลายเนื้อเยื่อรอบข้าง อาจแพร่กระจายและหากไม่ได้รับการรักษา หรือไม่ตอบสนองการรักษาอาจถึงตาย
- เนื้องอกชนิดทุติยภูมิ หมายถึงเนื้องอกร้ายแบบใดก็ตามที่เป็นการแพร่กระจายของเนื้องอกชนิดปฐมภูมิ หรือเป็นเนื้องอกที่ขยายตัวหลังเคมีบำบัดหรือรังสีบําบัด
- ไม่บ่อยนักอาจมีเนื้องอกชนิดลุกลามโดยไม่พบเนื้องอกชนิดปฐมภูมิ และถูกจัดอยู่ในประเภทมะเร็งที่ไม่รู้ที่มา
สำเนาพันธุ์
[แก้]เนื้องอกมักประกอบไปด้วยประชากรหลากหลาย (heterogeneous) และมีเซลล์มากกว่าหนึ่งชนิด ทว่ามักเริ่มต้นจากเซลล์หรือโคลนเดียวที่ผิดปกติและพัฒนากลายเป็นเนื้องอก กลุ่มเซลล์เหล่านี้มีสำเนาพันธุ์ (clone) เดียวกันหรือมีต้นตอจากเซลล์เดียว[8] และมีความผิดปกติทางพันธุกรรมหรือทางอีพีเจเนติกส์เดียวกัน สำหรับมะเร็งเม็ดเลือด เช่น มะเร็งต่อมน้ำเหลืองและมะเร็งเม็ดเลือดขาว ความเป็นสำเนาพันธุ์พิสูจน์ได้จากการขยายยีนอิมมิวโนโกลบูลิน (สำหรับรอยโรคในเซลล์บี) หรือยีนตัวรับเซลล์ที (สำหรับรอยโรคในเซลล์ที) ขณะนี้การพิสูจน์ความเป็นสำเนามีความจำเป็นในการชี้ว่าการเพิ่มจำนวนของเซลล์เม็ดเลือดเป็นเหตุมะเร็ง[9]
อย่างไรก็ตามความเป็นสำเนาพันธุ์ไม่อยู่ในความหมายของเนื้องอก เนื่องจากขณะนี้ยังไม่สามารถพิสูจน์ได้ว่าเนื้องอกต้องมาจากโคลนเดียวกันตลอด
ความแตกต่างระหว่าง Neoplasia กับ tumor
[แก้]คำว่า Tumor (ภาษาอังกฤษแบบอเมริกัน) หรือ tumour (ภาษาอังกฤษแบบบริติช) มาจากคำภาษาลาตินที่แปลว่า การบวม หนึ่งในอาการหลักของการอักเสบ แต่เดิมใช้กับอาการบวมทุกรูปแบบไม่ว่าจะเป็นเนื้องอกหรือไม่ อย่างไรก็ตามภาษาอังกฤษในปัจจุบันใช้คำว่า tumor เป็นดั่งชื่อพ้องของ neoplasm ทั้งทางการแพทย์และที่ไม่เกี่ยวกับการแพทย์ หมายถึง เนื้องอก (ก้อนหรือถุงน้ำที่อาจเกิดหรือไม่เกิดจากการเติบโตอย่างผิดปกติของเซลล์เนื้องอก) ที่ดูเหมือนขนาดใหญ่กว่าปกติ[10][11] Neoplasm บางแบบอาจไม่อยู่ในรูปแบบของเนื้องอก เช่น มะเร็งเม็ดเลือดขาว และเนื้องอกเฉพาะที่ส่วนใหญ่ ถึงเช่นนั้น เนื้องอก (tumor) ไม่เหมือนกับ มะเร็ง ซึ่งหมายความว่ามีการลุกลาม ไม่เหมือนกับเนื้องอกที่สามารถหมายถึงทั้งเนื้องอกแบบไม่ร้าย เนื้องอกที่อาจกลายเป็นมะเร็ง หรือมะเร็ง
คำว่าก้อนเนื้อ (mass) และปุ่ม (nodule) อาจถูกใช้ในความหมายเดียวกับเนื้องอก กล่าวคือคำว่าเนื้องอกถูกใช้ทั่วไปโดยไม่สื่อถึงขนาดของรอยโรค[1] คำว่าก้อนเนื้อมักใช้เมื่อรอยโรคมีขนาดตั้งแต่ 20 มิลลิเมตร ขึ้นไป ในขณะที่คำว่าปุ่มมักช้เมื่อเส้นผ่าศูนย์กลางเล็กกว่า 20 มม.[12]
สาเหตุ
[แก้]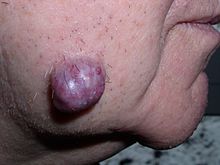

เนื้องอกอาจเกิดจากการงอกขยายอย่างผิดปกติของเนื้อเยื่อซึ่งอาจเกิดจากการกลายพันธุ์ อย่างไรก็ตามไม่ใช่ทุกแบบจะส่งผลให้เนื้อเยื้อโตแบบผิดปกติ ตัวอย่างเช่น มะเร็งเม็ดเลือดขาวหรือเนื้องอกเฉพาะที่
ไม่นานมานี้ มีการใช้คณิตศาสตร์และกลศาสตร์ความต่อเนื่อง (continuum mechanics) เพื่อศึกษาการเติบโตของเนื้องอก เนื้องอกของหลอดเลือด (vascular tumors) ถูกมองว่าเป็นผลรวมของโครงสร้างของแข็งสร้างโดยเซลล์และบรรจุด้วยของเหลวอินทรีย์ในช่องว่างที่เซลล์สามารถเติบโต[13] ทำให้สามารถจำลองสิ่งกระตุ้นและสิ่งที่มีผลต่อการเติบโตของเนื้องอกรวมถึงเนื้อเยื่อรอบรอบ ๆ และหลอดเลือดได้ ไม่นานมานี้มีการค้นพบจากการทดลองที่ใช้แบบจำลองนี้ว่าการเติบโตของเนื้องอกถูกจำกัดโดยขอบนอกของเนื้องอก และเพิ่มความแข็งของเนื้อเยื่อรอบเนื้องอกสามารถหยุดยั้งการเติบโตของเนื้องอกได้เช่นกัน[14]
เนื้องอกที่อยู่กับที่ซึ่งไม่เกี่ยวข้อง กับเนื้อเยื่อที่เจริญเติบโตแบบผิดปกติ (เช่น ซีสต์ไขมันผิวหนัง (sebaceous cyst) สามารถเกิดขึ้นในรูปแบบของเนื้องอกที่ไม่มีโอกาสกลายเป็นเนื้อร้าย ซีสต์ที่เต้านม (breast cyst) ซึ่งมักถูกพบระหว่างตั้งครรภ์และช่วงอื่น รวมถึงก้อนบวมในถุง (ต่อมไทรอยด์ ต่อมหมวกไต ตับอ่อน) เป็นอีกตัวอย่าง
ภาวะเลือดออกแบบมีถุงหุ้ม (encapsulated hematoma), เนื้อเยื่อตายเฉพาะส่วนแบบมีถุงหุ้ม (encapsulated necrotic tissue) จากแมลงกัด สิ่งแปลกปลอม หรือสิ่งเป็นพิษอื่น, คีลอยด์ (เนื้อเยื่อแผลเป็น) และแกรนูโลมา (granuloma) อาจอยู่ในรูปแบบของเนื้องอก
การขยายตัวเฉพาะจุดของโครงสร้างปกติ เช่น ท่อไต, เส้นเลือด, ท่อน้ำดี, pulmonary inclusions, หรือ ซีสต์ลำไส้คู่ (Enteric duplication cyst) เนื่องจากทางออกแคบลง ถูกปิดกั้น หรือเชื่อมต่อผิดปกติ เรียกได้ว่าเป็นเนื้องอกเช่นกัน ต
สภาพของเนื้องอกระบุได้โดยการสร้างภาพ (imaging), การผ่าตัด, หรือการตรวจสอบเนื้อเยื่อโดยการตัดเนื้อเยื่อให้นักพยาธิวิทยาตรวจ
เนื้องอกร้าย
[แก้]ความเสียหายต่อดีเอ็นเอ
[แก้]
ความเสียหายต่อดีเอ็นเอถือว่าเป็นสาเหตุหลักที่ทำให้เกิดเนื้องอกร้ายหรือมะเร็ง[15][16] รูปในส่วนนี้แสดงถึงบทบาทของความเสียหายบนดีเอ็นเอที่นำไปสู่มะเร็ง (ลักษณะหลักของความเสียหายต่อดีเอ็นเอ คือการเปลี่ยนแปลงทางอีพีเจเนติกส์และการซ่อมแซมดีเอ็นเอที่ไม่สมบูรณ์ โดยทั้งหมดมีสีแดงในรูป) ความเสียหายต่อดีเอ็นเอเกิดขึ้นเป็นปกติ ส่วนใหญ่เป็นผลจากกระบวนการเมแทบอลิซึมเซลล์และคุณสมบัติของดีเอ็นเอในน้ำภายใต้อุณหภูมิร่างกาย โดยเกิดขึ้นในอัตราความเสียหายใหม่จำนวน 60,000 ครั้งโดยเฉลี่ยต่อเซลล์มนุษย์ต่อวัน[15] ความเสียหายอื่นอาจมาจากสิ่งภายนอก เช่น ควันยาสูบที่มักสร้างความเสียหายต่อดีเอ็นเอและมักนำไปสู่มะเร็งปอดเนื่องจากการสูบบุหรี่[17] แสงยูวีจากรังสีอาทิตย์สร้างความเสียหายต่อดีเอ็นเอและอาจทำให้เกิดเมลาโนมา[18] การติดเชื้อแบคทีเรีย Helicobacter pylori สร้างอนุมูลอิสระจำนวนมากที่นำไปสู่มะเร็งกระเพาะอาหาร[19] กรดน้ำดี (bile acids) ปริมาณมากในลำไส้ของคนที่กินอาหารไขมันสูงสามารถสร้างความเสียหายต่อดีเอ็นเอและทำให้เกิดมะเร็งลำไส้[20] งานวิจัยชี้ว่าแมคโครฟาจและนิวโตรฟิลในเนื้อเยื่อบุผิวลำไส้ที่อักเสพเป็นแหล่งอนุมูลลิสระที่สร้างความเสียหายแก่ดีเอ็นเอและเป็นตัวตั้งต้นให้เกิดเนื้องอกในลำไส้[21] ปัจจัยอื่นที่สร้างความเสียหายต่อดีเอ็นเออยู่ในกล่องตรงส่วนบนของภาพในส่วนนี้
บุคคลที่มีการกลายพันธุ์แบบพันธุกรรม (germ line mutation) บนหนึ่งในยีนซ่อมแซมดีเอ็นเอทั้ง 34 มีความเสี่ยงเป็นโรคมะเร็งมากขึ้น โดยบางแบบอาจส่งผลให้เป็นมะเร็งในช่วงเวลาหนึ่งของชีวิตอย่างแน่นอน (เช่น การกลายพันธุ์ยีน p53)[22] การกลายพันธุ์แบบพันธุกรรมแสดงอยู่ในกล่องทางด้านซ้ายของรูปโดยมีลูกศรชี้ถึงความบกพร่องทางการซ่อมแซมดีเอ็นเอ
ประมาณ 70% ของเนื้องอกร้ายไม่มีผลจากพันธุกรรม และถูกเรียกว่า "มะเร็งที่เกิดขึ้นเอง (sporadic cancer)"[23] ส่วนน้อยของมะเร็งที่เกิดขึ้นเองเกิดขึ้นจากความบกพร่องในการซ่อมแซมดีเอ็นเอเนื่องจากการกลายพันธุ์ของยีนซ่อมแซมดีเอ็นเอ อย่างไรก็ตาม มะเร็งที่เกิดขึ้นเองส่วนมากมีความบกพร่องในการซ่อมแซมดีเอ็นเอด้วยผลจากการเปลี่ยนแปลงของอีพีเจเนติกส์ซึ่งลดหรือหยุดการแสดงออกของยีนซ่อมแซมดีเอ็นเอ ตัวอย่างเช่น ในหมู่ 113 ยีนที่ทำให้เกิดมะเร็งลำไส้ มีเพียง 4 ยีนเท่านั้นที่มีการกลายพันธุ์บนยีนซ่อมแซมดีเอ็นเอ ส่วนที่เหลือมมีการลดการแสดงออก MGMT เนื่องจากปฏิกิริยาเมทิเลชันบริเวณยีนส่งเสริมของ MGMT (การเปลี่ยนแปลงทางอีพีเจเนติกส์)[24] ห้างานวิจัยเสนอหลักฐานว่าร้อยละ 40 ถึง 90 ของมะเร็งลำใส้มีการแสดงออกของ MGMT ที่ลดลงเนื่องจากปฏิกิริยาเมทิเลชันบริเวณยีนส่งเสริมของ MGMT[25][26][27][28][29]
อ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (Jul 2014). "Type-2 pericytes participate in normal and tumoral angiogenesis". American Journal of Physiology. Cell Physiology. 307 (1): C25-38. doi:10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Cooper GM (1992). Elements of human cancer. Boston: Jones and Bartlett Publishers. p. 16. ISBN 978-0-86720-191-8.
- ↑ Taylor, Elizabeth J. (2000). Dorland's Illustrated medical dictionary (29th ed.). Philadelphia: Saunders. p. 1184. ISBN 0721662544.
- ↑ Stedman's medical dictionary (28th ed.). Philadelphia: Lippincott Williams & Wilkins. 2006. p. Neoplasm. ISBN 0781733901.
- ↑ "II Neoplasms". World Health Organization. สืบค้นเมื่อ 19 June 2014.
- ↑ 6.0 6.1 Abrams, Gerald. "Neoplasia I". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2015-10-31. สืบค้นเมื่อ 23 January 2012.
- ↑ "Cancer - Activity 1 - Glossary, page 4 of 5". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-05-09. สืบค้นเมื่อ 2008-01-08.
- ↑ "Clone definition - Medical Dictionary definitions of popular medical terms easily defined on MedTerms". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-10-25. สืบค้นเมื่อ 2018-02-02.
- ↑ Lee ES, Locker J, Nalesnik M, Reyes J, Jaffe R, Alashari M, Nour B, Tzakis A, Dickman PS (January 1995). "The association of Epstein-Barr virus with smooth-muscle tumors occurring after organ transplantation". N. Engl. J. Med. 332 (1): 19–25. doi:10.1056/NEJM199501053320104. PMID 7990861.
- ↑ "Pancreas Cancer: Glossary of Terms". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-06-05. สืบค้นเมื่อ 2008-01-08.
- ↑ "Tumor". Dorland's Illustrated Medical Dictionary (31st ed.). Saunders. 2007. ISBN 978-1-84972-348-0.
- ↑ Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (Jul 2014). "Type-2 pericytes participate in normal and tumoral angiogenesis". American Journal of Physiology. Cell Physiology. 307 (1): C25-38. doi:10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Ambrosi D, Mollica F (2002). "On the mechanics of a growing tumor". International Journal of Engineering Science. 40 (12): 1297–316. doi:10.1016/S0020-7225(02)00014-9.
- ↑ Volokh KY (September 2006). "Stresses in growing soft tissues". Acta Biomater. 2 (5): 493–504. doi:10.1016/j.actbio.2006.04.002. PMID 16793355.
- ↑ 15.0 15.1 Bernstein C, Prasad AR, Nfonsam V, Bernstei H (2013). "DNA Damage, DNA Repair and Cancer". New Research Directions in DNA Repair. pp. 413–65. doi:10.5772/53919. ISBN 978-953-51-1114-6.
- ↑ ข้อผิดพลาดสคริปต์: ไม่มีมอดูล "ParseVauthors"
- ↑ Cunningham FH, Fiebelkorn S, Johnson M, Meredith C (November 2011). "A novel application of the Margin of Exposure approach: segregation of tobacco smoke toxicants". Food Chem. Toxicol. 49 (11): 2921–33. doi:10.1016/j.fct.2011.07.019. PMID 21802474.
- ↑ Kanavy HE, Gerstenblith MR (December 2011). "Ultraviolet radiation and melanoma". Semin Cutan Med Surg. 30 (4): 222–8. doi:10.1016/j.sder.2011.08.003. PMID 22123420.
- ↑ Handa O, Naito Y, Yoshikawa T (2011). "Redox biology and gastric carcinogenesis: the role of Helicobacter pylori". Redox Rep. 16 (1): 1–7. doi:10.1179/174329211X12968219310756. PMID 21605492.
- ↑ Bernstein C, Holubec H, Bhattacharyya AK, Nguyen H, Payne CM, Zaitlin B, Bernstein H (August 2011). "Carcinogenicity of deoxycholate, a secondary bile acid". Arch. Toxicol. 85 (8): 863–71. doi:10.1007/s00204-011-0648-7. PMC 3149672. PMID 21267546.
- ↑ Katsurano M, Niwa T, Yasui Y, Shigematsu Y, Yamashita S, Takeshima H, Lee MS, Kim YJ, Tanaka T, Ushijima T (January 2012). "Early-stage formation of an epigenetic field defect in a mouse colitis model, and non-essential roles of T- and B-cells in DNA methylation induction". Oncogene. 31 (3): 342–51. doi:10.1038/onc.2011.241. PMID 21685942.
- ↑ Malkin D (April 2011). "Li-fraumeni syndrome". Genes Cancer. 2 (4): 475–84. doi:10.1177/1947601911413466. PMC 3135649. PMID 21779515.
- ↑ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (July 2000). "Environmental and heritable factors in the causation of cancer--analyses of cohorts of twins from Sweden, Denmark, and Finland". N. Engl. J. Med. 343 (2): 78–85. doi:10.1056/NEJM200007133430201. PMID 10891514.
- ↑ Halford S, Rowan A, Sawyer E, Talbot I, Tomlinson I (June 2005). "O(6)-methylguanine methyltransferase in colorectal cancers: detection of mutations, loss of expression, and weak association with G:C>A:T transitions". Gut. 54 (6): 797–802. doi:10.1136/gut.2004.059535. PMC 1774551. PMID 15888787.
- ↑ Shen L, Kondo Y, Rosner GL, Xiao L, Hernandez NS, Vilaythong J, Houlihan PS, Krouse RS, Prasad AR, Einspahr JG, Buckmeier J, Alberts DS, Hamilton SR, Issa JP (September 2005). "MGMT promoter methylation and field defect in sporadic colorectal cancer". J. Natl. Cancer Inst. 97 (18): 1330–8. doi:10.1093/jnci/dji275. PMID 16174854.
- ↑ Psofaki V, Kalogera C, Tzambouras N, Stephanou D, Tsianos E, Seferiadis K, Kolios G (July 2010). "Promoter methylation status of hMLH1, MGMT, and CDKN2A/p16 in colorectal adenomas". World J. Gastroenterol. 16 (28): 3553–60. doi:10.3748/wjg.v16.i28.3553. PMC 2909555. PMID 20653064.
- ↑ Lee KH, Lee JS, Nam JH, Choi C, Lee MC, Park CS, Juhng SW, Lee JH (October 2011). "Promoter methylation status of hMLH1, hMSH2, and MGMT genes in colorectal cancer associated with adenoma-carcinoma sequence". Langenbecks Arch Surg. 396 (7): 1017–26. doi:10.1007/s00423-011-0812-9. PMID 21706233.
- ↑ Amatu A, Sartore-Bianchi A, Moutinho C, Belotti A, Bencardino K, Chirico G, Cassingena A, Rusconi F, Esposito A, Nichelatti M, Esteller M, Siena S (April 2013). "Promoter CpG island hypermethylation of the DNA repair enzyme MGMT predicts clinical response to dacarbazine in a phase II study for metastatic colorectal cancer". Clin. Cancer Res. 19 (8): 2265–72. doi:10.1158/1078-0432.CCR-12-3518. PMID 23422094.
- ↑ Mokarram P, Zamani M, Kavousipour S, Naghibalhossaini F, Irajie C, Moradi Sarabi M, Hosseini SV (May 2013). "Different patterns of DNA methylation of the two distinct O6-methylguanine-DNA methyltransferase (O6-MGMT) promoter regions in colorectal cancer". Mol. Biol. Rep. 40 (5): 3851–7. doi:10.1007/s11033-012-2465-3. PMID 23271133.
