แกรนูโลไซต์
| แกรนูโลไซต์ Granulocyte | |
|---|---|
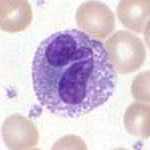 แกรนูโลไซต์ ชนิดเบโซฟิล | |
| รายละเอียด | |
| ระบบ | ระบบภูมิคุ้มกัน |
| ตัวระบุ | |
| MeSH | D006098 |
| FMA | 62854 |
| ศัพท์ทางกายวิภาคของจุลกายวิภาคศาสตร์ | |
แกรนูโลไซต์ (อังกฤษ: granulocytes) เป็นเซลล์เม็ดเลือดขาวในระบบภูมิคุ้มกันโดยกำเนิด ลักษณะเด่นคือมีแกรนูลอยู่ภายในไซโทพลาซึม[1] เรียกได้อีกอย่างหนึ่งว่า พอลีมอร์โฟนิวเคลียร์ ลูโคไซต์ (polymorphonuclear leukocytes, PMN, PML, หรือ PMNL) เนื่องจากมีนิวเคลียสที่รูปร่างแตกต่างกัน โดยมักจะแบ่งออกเป็น 3 พู ซึ่งจะแตกต่างจากโมโนนิวเคลียร์อะแกรนูโลไซต์ คำว่า พอลีมอร์โฟนิวเคลียร์ ลูโคไซต์ มักใช้เรียกแกรนูโลไซต์ชนิดนิวโทรฟิลชนิดเดียว[2] ซึ่งเป็นชนิดของแกรนูโลไซต์ที่มีจำนวนมากที่สุด ส่วนชนิดอื่น ๆ ซึ่งได้แก่ อีโอซิโนฟิล เบโซฟิล และแมสต์เซลล์ จะมีจำนวนพูน้อยกว่า แกรนูโลไซต์ถูกสร้างขึ้นโดยกระบวนการแกรนูโลโพอีซิส (granulopoiesis) ในไขกระดูก
ชนิด
[แก้]แกรนูโลไซต์มี 4 ชนิด (หรือชื่อเต็มคือ พอลีมอร์โฟนิวเคลียร์ แกรนูโลไซต์) ดังนี้[3]
ชื่อของแต่ละชนิด (ยกเว้นแมสต์เซลล์) มาจากลักษณะการติดสีย้อม ตัวอย่างเช่น แกรนูโลไซต์ที่มีจำนวนมากที่สุด นิวโทรฟิล จะมีลักษณะการติดสีย้อมของไซโทพลาซึมที่เป็นกลาง
นิวโทรฟิล
[แก้]
โดยปกตินิวโทรฟิลจะพบในกระแสเลือดและเป็นชนิดของฟาโกไซต์ที่มีมากที่สุด โดยเป็นส่วนประกอบร้อยละ 60 ถึง 65 ของเซลล์เม็ดเลือดขาวที่ไหลเวียนในร่างกายทั้งหมด[4] และประกอบด้วยกลุ่มย่อย ๆ 2 กลุ่ม ได้แก่ นิวโทรฟิล-คิลเลอร์ (neutrophil-killer) และนิวโทรฟิล-เคเจอร์ (neutrophil-cager) เลือดมนุษย์ 1 ลิตร ประกอบด้วยนิวโทรฟิลประมาณ 5 พันล้านเซลล์ (5x109)[5] ซึ่งมีเส้นผ่านศูนย์กลางประมาณ 12–15 ไมโครเมตร[6] เมื่อถึงเวลาที่นิวโทรฟิลได้รับสัญญาณ จะใช้เวลาประมาณ 30 นาทีในการออกจากกระแสเลือดและไปถึงบริเวณที่ติดเชื้อ[7] โดยนิวโทรฟิลจะไม่กลับสู่กระแสเลือด และจะกลายเป็นเซลล์หนองและตาย[7] นิวโทรฟิลที่เจริญเต็มที่มีขนาดเล็กกว่าโมโนไซต์ และมีนิวเคลียสที่แบ่งเป็นหลายส่วน (2–5 ส่วน) แต่ละส่วนจะเชื่อมต่อกันด้วยเส้นใยโครมาติน โดยปกตินิวโทรฟิลจะไม่ออกจากไขกระดูกจนกว่าจะเจริญเติบโตเต็มที่ แต่ในระหว่างการติดเชื้อ เซลล์ตั้งต้นของนิวโทรฟิลที่เรียกว่า ไมอีโลไซต์ และโพรไมอีโลไซต์ จะถูกปล่อยออกมา[8]
อีโอซิโนฟิล
[แก้]
อีโอซิโนฟิลจะมีนิวเคลียสเป็นพูรูปไต (2–4 พู) จำนวนของแกรนูลในอีโอซิโนฟิลอาจแตกต่างกันไป เนื่องจากแกรนูลมีแนวโน้มที่จะสลายตัว (degranulate) ในขณะที่อยู่ในกระแสเลือด[9] อีโอซิโนฟิลมีบทบาทสำคัญในการฆ่าปรสิต (เช่น พยาธิตัวกลมในลำไส้) เนื่องจากแกรนูลของพวกมันมีโปรตีนพื้นฐานที่เป็นพิษเฉพาะตัวและโปรตีนที่เป็นประจุบวก (เช่น คาเทปซิน[10]);[11] รวมถึงอีโอซิโนฟิลยังมีรีเซปเตอร์ที่จับกับ IgE มาช่วยในหน้าที่นี้ด้วย[12] อีกทั้งยังมีส่วนร่วมในกระบวนการฟาโกไซโตซิส,[13] เป็นเซลล์นำเสนอแอนติเจน (antigen-presenting cell), ควบคุมการทำงานของเซลล์ภูมิคุ้มกันอื่น ๆ (เช่น การทำงานของเซลล์ที CD4+, เซลล์เดนไดรต์, เซลล์บี, แมสต์เซลล์, นิวโทรฟิล, และเบโซฟิล),[14] มีส่วนร่วมในการทำลายเซลล์เนื้องอก,[9] และส่งเสริมการซ่อมแซมเนื้อเยื่อที่เสียหาย[15] พอลิเพปไทด์ที่ชื่อ อินเตอร์ลิวคิน-5 จะมีปฏิกิริยาต่ออีโอซิโนฟิล และทำให้อีโอซิโนฟิลเจริญพัฒนาขึ้นเป็นตัวเต็มวัย โดยพอลิเพปไทด์นี้ผลิตขึ้นโดยเบโซฟิลและเซลล์ทีเฮลเปอร์ 2 (TH2)[11]
เบโซฟิล
[แก้]
เบโซฟิลเป็นหนึ่งในเซลล์ที่มีจำนวนน้อยที่สุดในไขกระดูกและเลือด (มีอยู่น้อยกว่าร้อยละ 2 ของเซลล์ทั้งหมด) เบโซฟิลมีนิวเคลียสเป็นพูเช่นเดียวกับนิวโทรฟิลและอีโอซิโนฟิล อย่างไรก็ตาม เบโซฟิลจะมีเพียง 2 พู และเส้นใยโครมาตินที่เชื่อมต่อระหว่างพูนั้นมักมองไม่เห็นชัดเจน เบโซฟิลมีรีเซปเตอร์ที่สามารถจับกับ IgE, IgG, คอมพลีเมนต์, และฮิสตามีน ไซโตพลาสซึมของเบโซฟิลมีปริมาณแกรนูลที่แตกต่างกัน แกรนูลเหล่านี้มักจะมีจำนวนมากพอที่จะบดบังบางส่วนของนิวเคลียสได้ แกรนูลของเบโซฟิลนั้นประกอบด้วย ฮิสตามีน, เฮพาริน, คอนดรอยตินซัลเฟต, เพอร์ออกซิเดส, สารกระตุ้นเกล็ดเลือด, และสารตั้งต้นอื่น ๆ
แมสต์เซลล์
[แก้]แมสต์เซลล์เป็นแกรนูโลไซต์ชนิดหนึ่งที่มีอยู่ในเนื้อเยื่อ[3] เป็นสื่อกลางในการป้องกันโฮสต์จากจุลชีพก่อโรค (เช่น ปรสิต) และมีบทบาทในปฏิกิริยาภูมิแพ้ โดยเฉพาะอย่างยิ่ง แอนาฟิแล็กซิส[3] แมสต์เซลล์ยังมีส่วนเกี่ยวข้องในการอักเสบและภูมิต้านตนเอง รวมถึงเป็นสื่อกลางและควบคุมการตอบสนองของระบบประสาทภูมิคุ้มกัน (neuroimmune system)[3][16][17]
การพัฒนา
[แก้]แกรนูโลไซต์พัฒนามาจากเซลล์ต้นกำเนิดที่อยู่ในไขกระดูก กระบวนการเปลี่ยนแปลงจากเซลล์ต้นกำเนิดเม็ดเลือดที่สามารถพัฒนาได้หลายชนิด (pluripotent hematopoietic stem cell) ไปเป็นแกรนูโลไซต์ จะเรียกว่า แกรนูโลโพอีซิส (granulopoiesis) โดยจะมีเซลล์ที่อยู่ในระหว่างกระบวนการเปลี่ยนแปลงหลายชนิดด้วยกัน เช่น ไมอิโลบลาสต์ และโพรไมอิโลไซต์
ภาพเพิ่มเติม
[แก้]-
ฮีมาโทโพอีซิส (hematopoiesis)
ดูเพิ่ม
[แก้]- การตรวจนับเม็ดเลือดอย่างสมบูรณ์
- ฮีมาโทโพอีซิส
- ระบบภูมิคุ้มกัน
- ระบบภูมิคุ้มกันโดยกำเนิด
- โทรโกไซโทซิส
- เม็ดเลือดขาว
อ้างอิง
[แก้]- ↑ WebMD (2009). "granulocyte". Webster's New World Medical Dictionary (3rd ed.). Houghton Mifflin Harcourt. p. 181. ISBN 978-0-544-18897-6.
- ↑ WebMD (2009). "leukocyte, polymorphonuclear". Webster's New World Medical Dictionary (3rd ed.). Houghton Mifflin Harcourt. p. 244. ISBN 978-0-544-18897-6.
- ↑ 3.0 3.1 3.2 3.3 Breedveld A, Groot Kormelink T, van Egmond M, de Jong EC (October 2017). "Granulocytes as modulators of dendritic cell function". Journal of Leukocyte Biology. 102 (4): 1003–1016. doi:10.1189/jlb.4MR0217-048RR. PMID 28642280.
- ↑ Stvrtinová, Viera; Ján Jakubovský and Ivan Hulín (1995). "Neutrophils, central cells in acute inflammation". Inflammation and Fever from Pathophysiology: Principles of Disease. Computing Centre, Slovak Academy of Sciences: Academic Electronic Press. ISBN 80-967366-1-2. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ December 31, 2010. สืบค้นเมื่อ March 28, 2009.
- ↑ Hoffbrand p. 331
- ↑ Abbas, Chapter 12, 5th Edition[ต้องการอ้างอิงเต็มรูปแบบ][ต้องการเลขหน้า]
- ↑ 7.0 7.1 Sompayrac p. 18
- ↑ Linderkamp O, Ruef P, Brenner B, Gulbins E, Lang F (December 1998). "Passive deformability of mature, immature, and active neutrophils in healthy and septicemic neonates". Pediatric Research. 44 (6): 946–50. doi:10.1203/00006450-199812000-00021. PMID 9853933.
- ↑ 9.0 9.1 Hess CE. "Segmented Eosinophil". University of Virginia Health System. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-08-13. สืบค้นเมื่อ 2009-04-10.
- ↑ Mayer, Gene (2006). "Immunology — Chapter One: Innate (non-specific) Immunity". Microbiology and Immunology On-Line Textbook. USC School of Medicine. สืบค้นเมื่อ November 12, 2008.
- ↑ 11.0 11.1 Baron, Samuel (editor) (1996). Medical Microbiology (4th ed.). EditionThe University of Texas Medical Branch at Galveston. ISBN 978-0-9631172-1-2.
{{cite book}}:|first=มีชื่อเรียกทั่วไป (help) - ↑ Gleich GJ, Adolphson CR (1986). "The Eosinophilic Leukocyte: Structure and Function". Advances in Immunology Volume 39. Advances in Immunology. Vol. 39. pp. 177–253. doi:10.1016/S0065-2776(08)60351-X. ISBN 978-0-12-022439-5. PMID 3538819.
- ↑ Campbell p. 903
- ↑ Akuthota P, Wang HB, Spencer LA, Weller PF (August 2008). "Immunoregulatory roles of eosinophils: a new look at a familiar cell". Clinical and Experimental Allergy. 38 (8): 1254–63. doi:10.1111/j.1365-2222.2008.03037.x. PMC 2735457. PMID 18727793.
- ↑ Kariyawasam HH, Robinson DS (April 2006). "The eosinophil: the cell and its weapons, the cytokines, its locations". Seminars in Respiratory and Critical Care Medicine. 27 (2): 117–27. doi:10.1055/s-2006-939514. PMID 16612762.
- ↑ Lee DM, Friend DS, Gurish MF, Benoist C, Mathis D, Brenner MB (September 2002). "Mast cells: a cellular link between autoantibodies and inflammatory arthritis". Science. 297 (5587): 1689–92. Bibcode:2002Sci...297.1689L. doi:10.1126/science.1073176. PMID 12215644. S2CID 38504601.
- ↑ Polyzoidis S, Koletsa T, Panagiotidou S, Ashkan K, Theoharides TC (September 2015). "Mast cells in meningiomas and brain inflammation". Journal of Neuroinflammation. 12 (1): 170. doi:10.1186/s12974-015-0388-3. PMC 4573939. PMID 26377554.
MCs originate from a bone marrow progenitor and subsequently develop different phenotype characteristics locally in tissues. Their range of functions is wide and includes participation in allergic reactions, innate and adaptive immunity, inflammation, and autoimmunity [34]. In the human brain, MCs can be located in various areas, such as the pituitary stalk, the pineal gland, the area postrema, the choroid plexus, thalamus, hypothalamus, and the median eminence [35]. In the meninges, they are found within the dural layer in association with vessels and terminals of meningeal nociceptors [36]. MCs have a distinct feature compared to other hematopoietic cells in that they reside in the brain [37]. MCs contain numerous granules and secrete an abundance of prestored mediators such as corticotropin-releasing hormone (CRH), neurotensin (NT), substance P (SP), tryptase, chymase, vasoactive intestinal peptide (VIP), vascular endothelial growth factor (VEGF), TNF, prostaglandins, leukotrienes, and varieties of chemokines and cytokines some of which are known to disrupt the integrity of the blood-brain barrier (BBB) [38–40].
They key role of MCs in inflammation [34] and in the disruption of the BBB [41–43] suggests areas of importance for novel therapy research. Increasing evidence also indicates that MCs participate in neuroinflammation directly [44–46] and through microglia stimulation [47], contributing to the pathogenesis of such conditions such as headaches, [48] autism [49], and chronic fatigue syndrome [50]. In fact, a recent review indicated that peripheral inflammatory stimuli can cause microglia activation [51], thus possibly involving MCs outside the brain.

