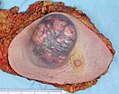
มะเร็ง
| มะเร็ง | |
|---|---|
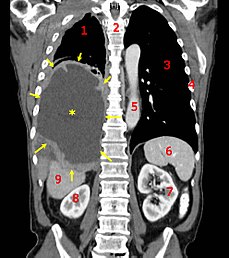 ภาพจากการถ่ายภาพรังสีส่วนตัดอาศัยคอมพิวเตอร์แสดงเนื้อร้ายมีโซเธลิโอมา (mesothelioma) ความหมาย: → เนื้องอก ←, ✱ น้ำซึมซ่านในช่องเยื่อหุ้มปอดกลาง, 1 & 3 ตับ, 2 กระดูกสันหลัง, 4 ซี่โครง, 5 ท่อเลือดแดง, 6 ม้าม, 7 & 8 ไต, 9 ตับ | |
| บัญชีจำแนกและลิงก์ไปภายนอก | |
| ICD-10 | C00—C97 |
| ICD-9 | 140—239 |
| DiseasesDB | 28843 |
| MedlinePlus | 001289 |
| MeSH | D009369 |
มะเร็ง หรือทางการแพทย์ว่า เนื้องอกร้าย (อังกฤษ: malignant tumor) หมายรวมถึงโรคหลายๆ โรคที่เกี่ยวข้องกับการเจริญเติบโตของเซลล์อย่างผิดปกติ คือ เซลล์จะแบ่งตัวและเจริญอย่างควบคุมไม่ได้ ก่อเป็นเนื้องอกร้าย และมีศักยภาพในการรุกรานร่างกายส่วนข้างเคียง มะเร็งอาจแพร่กระจายไปยังร่างกายส่วนที่อยู่ห่างไกลได้[1][2]ผ่านระบบน้ำเหลืองหรือกระแสเลือด แต่ไม่ใช่เนื้องอกทุกชนิดจะเป็นมะเร็ง เพราะเนื้องอกไม่ร้ายจะไม่ลุกลามไปยังอวัยวะข้างเคียงและไม่กระจายไปทั่วร่างกาย[2] อาการและอาการแสดงของโรคมะเร็งที่เป็นไปได้รวมถึงมีก้อนเนื้อเกิดใหม่, มีเลือดออกผิดปกติ, มีการไอเป็นเวลานาน, การสูญเสียน้ำหนักที่อธิบายไม่ได้, และการเปลี่ยนแปลงในการขับถ่ายของลำไส้และอื่น ๆ[3] แต่อาการเหล่านี้อาจเกิดขึ้นเนื่องจากปัญหาอื่น ๆ ได้เช่นกัน[3] มีมะเร็งที่ส่งผลต่อมนุษย์ที่ทราบแล้วกว่า 100 ชนิด[2]
สาเหตุของมะเร็งนั้นมีหลากหลาย ซับซ้อนและเข้าใจเพียงบางส่วนเท่านั้น มีหลายปัจจัยที่ทราบแล้วว่าเพิ่มปัจจัยเสี่ยงมะเร็ง ได้แก่ การสูบบุหรี่ (อัตราการตาย 22%[1]) ปัจจัยด้านอาหาร, การขาดกิจกรรมการออกกำลังกาย, โรคอ้วน, และการบริโภคแอลกอฮอล์ (อัตราการตายรวมกัน 10%[1]) นอกนั้นเป็นการติดเชื้อบางอย่าง, การสัมผัสรังสี, และมลภาวะสิ่งแวดล้อม[4] ในกลุ่มประเทศกำลังพัฒนา เกือบ 20% ของโรคมะเร็งเกิดจากการติดเชื้อเช่นโรคตับอักเสบจากไวรัสชนิด B, ชนิด C, และ human papillomavirus.[1] โดยทั่วไปก่อนที่มะเร็งจะพัฒนาขึ้น การเปลี่ยนแปลงหลายอย่างของยีนจะเกิดขึ้นก่อน[5] ประมาณ 5–10% ของมะเร็งเกิดจากการติดเชื้อทางพันธุกรรมที่ถ่ายทอดมาจากพ่อแม่[6] ปัจจัยเหล่านี้สามารถทำให้ยีนเสียหายโดยตรง[5] หรืออาจประกอบกับความบกพร่องทางพันธุกรรมที่มีอยู่เดิมในเซลล์ก่อให้เกิดการกลายพันธุ์เป็นมะเร็งได้[7] มะเร็งราว 5–10% สามารถติดตามไปยังความบกพร่องทางพันธุกรรมแต่กำเนิดโดยตรง[6]
มะเร็งสามารถตรวจพบได้หลายวิธี รวมทั้งการมีอาการและอาการแสดงบางอย่าง การตรวจคัดกรองโรค[1] จากนั้น จะต้องทำการสร้างภาพทางการแพทย์ เมื่อตรวจพบว่ามีโอกาสเป็นมะเร็งแล้ว จะมีการวินิจฉัยเพื่อยืนยันโดยการตรวจตัวอย่างชิ้นเนื้อ[8]
มะเร็งหลายประเภทสามารถป้องกันได้โดยการไม่สูบบุหรี่, รักษาน้ำหนักตัวเพื่อสุขภาพที่ดี, ไม่ดื่มเครื่องดื่มแอลกอฮอล์มากเกินไป, กินอาหารประเภทผักผลไม้และธัญพืชมาก ๆ, ฉีดวัคซีนป้องกันโรคติดเชื้อบางอย่าง, ไม่กินเนื้อแดงมากเกินไป, และหลีกเลี่ยงการสัมผัสกับแสงแดดมากเกินไป[9][10] การตรวจพบแต่เนิ่น ๆ ผ่านการตรวจคัดกรองจะเป็นประโยชน์สำหรับโรคมะเร็งปากมดลูกและมะเร็งลำไส้ใหญ่[11] ประโยชน์ของการตรวจคัดกรองสำหรับมะเร็งเต้านมยังมีความขัดแย้ง[11][12] โรคมะเร็งมักจะได้รับการรักษาผสมกันของการรักษาด้วยรังสีบางอย่าง, การผ่าตัด, การรักษาด้วยเคมีบำบัด, และการรักษาด้วยการกำหนดเป้าหมาย[1][13] การจัดการกับการปวดและอาการอื่นเป็นส่วนสำคัญของการดูแล การดูแลแบบประคับประคองเป็นสิ่งสำคัญโดยเฉพาะอย่างยิ่งในผู้ป่วยที่โรคมีการพัฒนาไปมาก[1] โอกาสของการอยู่รอดขึ้นอยู่กับชนิดของโรคมะเร็งและระยะของโรคในช่วงเริ่มต้นของการรักษา[5] ในเด็กอายุต่ำกว่า 15 ที่วินิจฉัยอัตราการรอดตายในช่วงห้าปีใน โลกที่พัฒนาแล้วโดยเฉลี่ยอยู่ที่ 80%[14] สำหรับโรคมะเร็งในประเทศสหรัฐอเมริกาอัตราการรอดตายห้าปีเฉลี่ยอยู่ที่ 66%[15]
ในปี 2012 มีมะเร็งรายใหม่เกิดขึ้นทั่วโลกประมาณ 14,100,000 ราย (ไม่รวมถึงโรคมะเร็งผิวหนังอื่นที่ไม่ใช่เนื้องอก)[5] มันะทำให้เกิดการเสียชีวิต 8,200,000 รายหรือ 14.6% ของการเสียชีวิตของมนุษย์ทั้งหมด[5][16] ชนิดที่พบบ่อยที่สุดของโรคมะเร็ง ในเพศชายเป็นมะเร็งปอด, มะเร็งต่อมลูกหมาก, มะเร็งลำไส้ใหญ่, และมะเร็งกระเพาะอาหาร ในเพศหญิงชนิดที่พบมากที่สุดคือมะเร็งเต้านม, มะเร็งลำไส้ใหญ่, มะเร็งปอด, และมะเร็งปากมดลูก[5] หากมะเร็งผิวหนังอื่นที่ไม่ใช่เนื้องอกถูกรวมอยู่ใน มะเร็งใหม่ทั้งหมด ในแต่ละปีมะเร็งดังกล่าวจะคิดเป็นประมาณ 40% ของผู้ป่วย[17][18] ในเด็ก โรคมะเร็งเม็ดเลือดขาวแบบ lymphoblastic เฉียบพลันและเนื้องอกในสมองเป็นโรคส่วนใหญ่ร่วมกันยกเว้นในทวีปแอฟริกาที่มะเร็งต่อมน้ำเหลืองชนิดแพร่กระจายเร็วเกิดขึ้นบ่อย[14] ในปี 2012 เด็กอายุต่ำกว่า 15 ปีประมาณ 165,000 คนได้รับการวินิจฉัยว่าเป็นมะเร็ง ความเสี่ยงของการเป็นโรคมะเร็งเพิ่มขึ้นอย่างมีนัยสำคัญตามอายุและมะเร็งหลายชนิดเกิดขึ้นได้ทั่วไปในประเทศที่พัฒนาแล้ว[5] อัตราเสี่ยงจะเพิ่มขึ้นเมื่อประชาชนมีชีวิตมากขึนและวิถีชีวิตมีการเปลี่ยนแปลงในประเทศกำลังพัฒนา[19] ต้นทุนทางการเงินของโรคมะเร็งอยู่ที่ประมาณ US$ 1.16 ล้านล้านต่อปีในปี 2010[20]
นิยาม
[แก้]มะเร็งคือกลุ่มของโรคหลายโรค ที่มีลักษณะร่วมกันคือมีการเจริญของเซลล์ที่ผิดปกติ และมีความสามารถที่จะรุกล้ำหรือแพร่กระจายไปยังส่วนอื่นของร่างกายได้[1][2] จัดเป็นชนิดหนึ่งของเนื้องอก เนื้องอกหมายถึงกลุ่มของเซลล์ที่มีการเจริญอย่างไม่มีการควบคุม มักเกิดเป็นก้อน แต่ก็อาจเกิดเป็นลักษณะแผ่กว้างได้[21][22]
ปัจจุบันถือว่าเซลล์ที่จะนับว่าเป็นเซลล์มะเร็งต้องมีลักษณะเฉพาะของความเป็นมะเร็ง ลักษณะเหล่านี้เป็นลักษณะที่จำเป็นต่อการดำเนินโรคของมะเร็ง ได้แก่[23]
- มีการเจริญของเซลล์และการแบ่งเซลล์ได้โดยไม่ต้องมีสัญญาณกระตุ้นตามปกติ
- มีการเจริญของเซลล์และการแบ่งเซลล์ได้แม้จะมีสัญญาณยับยั้ง
- มีกลไกหลีกเลี่ยงการทำให้เซลล์ตายตามปกติ
- มีความสามารถที่จะแบ่งเซลล์ได้โดยไม่มีจำนวนจำกัด
- มีการสร้างหลอดเลือดใหม่
- มีการรุกรานเนื้อเยื่อข้างเคียง และมีความสามารถที่จะแพร่กระจายไปยังตำแหน่งห่างไกลได้[24]
การที่เซลล์ปกติจะกลายเป็นเซลล์ที่เพิ่มจำนวนจนกลายเป็นก้อนเนื้องอกและกลายเป็นมะเร็งเต็มขั้นนั้นมีขั้นตอนหลายขั้นตอน ขั้นตอนเหล่านี้เรียกว่าการพัฒนาของมะเร็ง[24][25]
การแพทย์แผนไทยมีการใช้คำว่า "มะเร็ง" ในความหมายถึงโรคต่างๆ ที่รักษาได้ยาก แสดงอาการในระยะท้าย ซึ่งอาจนับรวมโรคอื่นๆ ที่ไม่ตรงนิยามของมะเร็งในการแพทย์แผนปัจจุบันเข้ามาด้วย เช่น ฝีเรื้อรัง ริดสีดวง เป็นต้น[26]
อาการและอาการแสดง
[แก้]บทความหลัก: สัญญาณและอาการแสดงของมะเร็ง

ในระยะเริ่มต้นของมะเร็งผู้ป่วยจะยังไม่มีอาการ ต่อเมื่อขนาดของก้อนเริ่มโตขึ้นหรือเริ่มเกิดเป็นแผลจึงอาจจะมีอาการหรืออาการแสดงได้ ขึ้นอยู่กับชนิดและตำแหน่งของมะเร็ง อาการส่วนใหญ่เป็นอาการที่ไม่มีความจำเพาะ สามารถพบได้บ่อยในภาวะอื่นที่ไม่ใช่มะเร็ง จึงถือได้ว่ามะเร็งเป็นโรคนักเลียนแบบอย่างหนึ่ง ผู้ป่วยมะเร็งส่วนใหญ่จึงมักได้รับการรักษาภาวะอื่นมาระยะหนึ่งก่อน ก่อนที่จะได้รับการวินิจฉัยว่าเป็นมะเร็ง[27]
อาการเฉพาะที่
[แก้]ผู้ป่วยอาจมีอาการเฉพาะที่จากผลของตัวก้อนที่ขยายขนาดขึ้น ตัวอย่างเช่น ผลจากก้อนของมะเร็งปอดอาจกดเบียดหลอดลม ทำให้ผู้ป่วยมีอาการไอ หรือเกิดปอดอักเสบได้ง่ายขึ้น มะเร็งหลอดอาหารทำให้เกิดการตีบแคบของหลอดอาหาร ทำให้ผู้ป่วยมีอาการกลืนลำบากหรือกลืนเจ็บ มะเร็งลำไส้ใหญ่และไส้ตรงอาจทำให้เกิดการตีบแคบหรือการอุดกั้นของลำไส้ ทำให้มีการถ่ายอุจจาระที่ผิดปกติไป ก้อนในเต้านมหรืออัณฑะอาจปรากฏเป็นก้อนให้ผู้ป่วยสังเกตได้ชัดเจน อาการบางอย่างอาจเกิดจากการเกิดแผลที่ก้อนมะเร็ง เช่น ในปอดอาจทำให้มีอาการไอเป็นเลือด ในลำไส้ทำให้ผู้ป่วยค่อย ๆ เสียเลือดจนมีอาการซีด หรือเลือดออกมากจนเห็นเป็นเลือดปนมากับอุจจาระได้ ในกระเพาะปัสสาวะอาจทำให้มีอาการปัสสาวะเป็นเลือด และในมดลูกทำให้มีเลือดออกผิดปกติทางช่องคลอด เป็นต้น ผู้ป่วยระยะลุกลามบางรายอาจมีอาการเจ็บจากตัวก้อนได้ แต่ในระยะแรกที่ก้อนเพิ่งเริ่มขยายขนาดผู้ป่วยมักไม่มีอาการเจ็บจากตัวก้อน มะเร็งบางชนิดอาจทำให้เกิดของเหลวสะสมในโพรงร่างกาย เช่นในช่องอก หรือช่องท้องได้[27]
อาการที่เป็นระบบ
[แก้]เป็นอาการที่เกิดขึ้นทั่วไปเนื่องจากผลกระทบที่อยู่ไกลจากตำแหน่งของโรคมะเร็งที่ไม่ได้เกี่ยวข้องกับการแพร่กระจายโดยหรือเป็นการแพร่กระจายของโรค อาการเหล่านี้อาจรวมถึง:.. การสูญเสียน้ำหนักโดยไม่ได้ตั้งใจ, เป็นไข้, เหนื่อยมากเกินไป, และมีการเปลี่ยนแปลงกับผิว[28] มะเร็งต่อมน้ำเหลืองชนิดแพร่กระจายช้า(อังกฤษ: Hodgkin disease), โรคเม็ดโลหิตขาวผิดปกติ (อังกฤษ: leukemias), และโรคมะเร็งตับหรือโรคมะเร็งไตอาจทำให้เกิดไข้ถาวรไม่ทราบที่มา[27]
มะเร็งบางชนิดอาจทำให้เกิดกลุ่มอาการเฉพาะของระบบที่เรียกว่าปรากฏการณ์ paraneoplastic ตัวอย่างเช่นการปรากฏตัวของโรคกล้ามเนื้ออ่อนแรงชนิดร้าย (อังกฤษ: myasthenia gravis) ในเนื้องอกต่อมไทมัส (อังกฤษ: thymoma) และอาการปลายนิ้วโต (อังกฤษ: clubbing) ในโรคมะเร็งปอด[27]
การแพร่กระจาย
[แก้]บทความหลัก: Metastasis
มะเร็งสามารถแพร่กระจายจากจุดกำเนิดเดิมของมันโดยการแพร่กระจายเฉพาะที่, การแพร่กระจายผ่านทางน้ำเหลืองไปยังต่อมน้ำเหลืองในภูมิภาคหรือผ่านทางเลือด (การแพร่กระจาย แบบ haematogenous) ไปยังเนื้อเยื่ออื่นที่ไกลออกไป การแพร่กระจายทั้งหมดนี้เรียกว่า metastasis เมื่อมะเร็งแพร่กระจายไปตามเส้นทาง haematogenous มันก็มักจะแพร่กระจายไปทั่วร่างกาย อย่างไรก็ตาม 'เมล็ดพันธุ์' มะเร็งจะเจริญเติบโตได้ดีใน 'ดิน' บางจุดที่เลือกโดยเฉพาะเท่านั้น เป็นสมมติฐานของการแพร่กระจายโรคมะเร็งในรูปของ 'ดินและเมล็ดพันธ์' อาการของการเกิดโรคมะเร็งในระยะแพร่กระจายขึ้นอยู่กับตำแหน่งของเนื้องอกและอาจรวมถึงต่อมน้ำเหลืองโต (ซึ่งสามารถรู้สึกได้หรือบางครั้งก็เห็นได้ใต้ผิวหนังและมักจะแข็ง), ตับโตหรือม้ามโตซึ่งสามารถรู้สึกได้ในช่องท้อง, รู้สึกเจ็บปวดหรือเศษหักของกระดูกและอาการทางระบบประสาท[27]
สาเหตุ
[แก้]บทความหลัก: สาเหตุของการเกิดโรคมะเร็ง
90-95% ของสาเหตุหลักของการเกิดโรคมะเร็งเนื่องมาจากปัจจัยด้านสิ่งแวดล้อม ส่วนที่เหลืออีก 5-10% เนื่องมาจากการถ่ายทอดทางพันธุกรรม[4] คำว่า "สิ่งแวดล้อม" ที่ใช้โดยนักวิจัยโรคมะเร็งหมายถึงสาเหตุใด ๆ ที่ไม่ได้มาจากการถ่ายทอดทางพันธุกรรมเช่นวิถีการดำเนินชีวิต, ปัจจัยทางเศรษฐกิจและพฤติกรรม, และไม่ใช่แค่มลพิษ[29] ปัจจัยแวดล้อมที่พบบ่อยที่นำไปสู่การตายของโรคมะเร็ง ได้แก่ ยาสูบ (25-30%) อาหารและโรคอ้วน (30-35%), การติดเชื้อ (15-20%), การสัมผัสกับรังสี (ทั้งโอโซนและไม่โอโซน 10%) ความเครียด, ขาดการออกกำลังกาย, และมลพิษสิ่งแวดล้อม[4]
มันแทบจะเป็นไปไม่ได้ที่จะพิสูจน์ว่าอะไรทำให้เกิดโรคมะเร็งในบุคคลหนึ่ง ๆ เพราะมะเร็งส่วนใหญ่มีสาเหตุหลายอย่าง ตัวอย่างเช่นถ้าคนที่ใช้ยาสูบอย่างหนักจนพัฒนาเป็นโรคมะเร็งที่ปอด ดังนั้นสาเหตุก็อาจมาจากการใช้ยาสูบ แต่เนื่องจากทุกคนมีโอกาสเล็กน้อยที่จะพัฒนาโรคมะเร็งปอดโดยเป็นผลมาจากมลพิษทางอากาศหรือการฉายรังสี ดังนั้นมีโอกาสเล็กน้อยที่ โรคมะเร็งจะได้รับการพัฒนาเพราะมลพิษทางอากาศหรือการฉายรังสี ยกเว้นการติดต่อที่หายากที่เกิดขึ้นกับการตั้งครรภ์และมีเพียงเล็กน้อยจากการบริจาคอวัยวะ มะเร็งโดยทั่วไปจะไม่เป็นโรคที่ติดต่อถ่ายทอดได้[30]
สารเคมี
[แก้]ข้อมูลเพิ่มเติม: แอลกอฮอล์กับโรคมะเร็งและการสูบบุหรี่กับโรคมะเร็ง

การสัมผัสกับสารบางอย่างมีการเชื่อมโยงกับบางชนิดของโรคมะเร็ง สารเหล่านี้จะเรียกว่า "สารก่อมะเร็ง" (อังกฤษ: carcinogens) ยกตัวอย่าง การสูบบุหรี่เป็นสาเหตุของโรคมะเร็งปอดถึง 90%[31] นอกจากนี้ยังเป็นสาเหตุของโรคมะเร็งในกล่องเสียง, ในศีรษะ, ในลำคอ, ในกระเพาะอาหาร, ในกระเพาะปัสสาวะ, ในไต, ในหลอดอาหาร, และในตับอ่อน[32] ควันของยาสูบมีสารก่อมะเร็งที่รู้จักกันมากกว่าห้าสิบอย่าง รวมทั้งไนโตรซามีน และ polycyclic aromatic hydrocarbon[33] ยาสูบรับผิดชอบหนึ่งในสามของทั้งหมดที่เสียชีวิตจากมะเร็งในประเทศที่พัฒนาแล้ว[34] และประมาณหนึ่งในห้าทั่วโลก[33] อัตราการตายด้วยโรคมะเร็งปอดในประเทศสหรัฐอเมริกาเป็นภาพสะท้อนของการสูบบุหรี่ ที่มีการเพิ่มขึ้นของการสูบบุหรี่ตามด้วยการเพิ่มขึ้นอย่างมากของอัตราการตายเนื่องจากมะเร็งปอดและเมื่อเร็ว ๆ นี้การลดลงของอัตราการสูบบุหรี่มาตั้งแต่ปี 1950s ตามด้วยการลดลงของอัตราการตายเนื่องจากโรคมะเร็งปอดในผู้ชายตั้งแต่ปี 1990[35][36]
ในยุโรปตะวันตก 10% ของมะเร็งในเพศชายและ 3% ของมะเร็งทั้งหมดในเพศหญิงจะมีสาเหตุมาจากการดื่มสุรา โดยเฉพาะอย่างยิ่งมะเร็งตับและมะเร็งทางเดินอาหาร[37] มะเร็งที่เกี่ยวข้องกับการสัมผัสสารเคมีขณะทำงานเชื่อว่าจะเป็นสาเหตุระหว่าง 2-20% ของทุกกรณี[38] ในทุก ๆ ปี อย่างน้อย 200,000 คนทั่วโลกเสียชีวิตจากโรคมะเร็งที่เกี่ยวข้องกับสถานที่ทำงานของพวกเขา[39] คนงานหลายล้านมีความเสี่ยงของการพัฒนาสู่โรคมะเร็งเช่นโรคมะเร็งปอดและโรคจากการสูดดมควันบุหรี่หรือ เส้นใยแร่ใยหินในระหว่างการทำงานหรือโรคมะเร็งเม็ดเลือดขาวจากการสัมผัสกับสารเบนซีนที่สถานที่ทำงานของพวกเขา[39]
อาหารและการออกกำลังกาย
[แก้]บทความหลัก: อาหารกับโรคมะเร็ง
อาหาร การไม่ออกกำลังกาย และโรคอ้วนเกี่ยวข้องกับการเสียชีวิตจากมะเร็งได้ถึง 30-35% ของ[4][40] ในสหรัฐอเมริกาน้ำหนักตัวเกินเป็นเรื่องที่เกี่ยวข้องกับการพัฒนาของโรคมะเร็งหลายชนิดและเป็นปัจจัยใน 14-20% ของการเสียชีวิตจากมะเร็งทั้งหมด[40] การศึกษาในสหราชอาณาจักรรวมทั้งข้อมูลเกี่ยวกับกว่า 5 ล้านคนแสดงให้เห็นว่าดัชนีมวลกายที่สูงขึ้นจะเกี่ยวข้องกับอย่างน้อย 10 ชนิดของโรคมะเร็งและมีความรับผิดชอบประมาณ 12,000 กรณีในแต่ละปีในประเทศนั้น[41] การไม่ออกกำลังกายเชื่อว่าจะนำไปสู่ความเสี่ยงโรคมะเร็ง ไม่เพียงแต่ผ่านทางผลกระทบต่อน้ำหนักตัว แต่ยังผ่านผลกระทบด้านลบต่อระบบภูมิคุ้มกันและระบบต่อมไร้ท่อ[40] มากกว่าครึ่งหนึ่งของผลกระทบจากการรับประทานอาหารเกิดจากการมีภาวะโภชนาการเกิน ( การรับประทานอาหารมากเกินไป) มากกว่าจากการกินผักน้อยเกินไปหรืออาหารที่ดีต่อสุขภาพอื่น ๆ
อาหารบางอย่างจะเชื่อมโยงกับการเกิดโรคมะเร็งบางชนิด อาหารที่มีเกลือสูงเชื่อมโยงกับโรคมะเร็งกระเพาะอาหาร[42] 'อะฟลาท็อกซินบี 1' สารปนเปื้อนอาหารที่พบบ่อยประเภทหนึ่งทำให้เกิดโรคมะเร็งตับ[42] การเคี้ยวพลูถั่ว (อังกฤษ: Betel nut) ทำให้เกิดโรคมะเร็งในช่องปาก[42] ความแตกต่างในการรับประทานอาหารส่วนหนึ่งอาจอธิบายความแตกต่างในการเกิดมะเร็งในแต่ละประเทศที่แตกต่างกัน ยกตัวอย่างเช่นโรคมะเร็งกระเพาะอาหารจะพบมากในประเทศญี่ปุ่นเนื่องจากอาหารมีเกลือสูง[43] และมะเร็งลำไส้ใหญ่จะพบมากในประเทศสหรัฐอเมริกา ผู้อพยพเข้าเมืองพัฒนาความเสี่ยงของประเทศใหม่ของพวกเขาภายในหนึ่งเจนเนอเรชั่น แนะนำการเชื่อมโยงที่สำคัญระหว่างการรับประทานอาหารและโรคมะเร็ง[44]
การติดเชื้อ
[แก้]บทความหลัก: สาเหตุการติดเชื้อของโรคมะเร็ง
ทั่วโลกประมาณ 18% ของการเสียชีวิตจากโรคมะเร็งเกี่ยวข้องกับโรคติดเชื้อ[4] สัดส่วนนี้แตกต่างกันไปในภูมิภาคต่าง ๆ ของโลกจากที่สูง 25% ในทวีปแอฟริกาจนถึงน้อยกว่า 10% ในประเทศที่พัฒนาแล้ว[4] ไวรัสเป็นเชื้อโรคปกติของการติดเชื้อที่ก่อให้เกิดโรคมะเร็ง แต่แบคทีเรียและปรสิตยังอาจสร้างผลกระทบกับโรคมะเร็งได้เช่นกัน
ไวรัสที่สามารถทำให้เกิดมะเร็งได้เรียกว่า oncovirus ซึ่งรวมถึง humam papillomavirus (มะเร็งปากมดลูก), Epstein-Barr ไวรัส (โรค B-cell lymphoproliferative และโรคมะเร็งโพรงหลังจมูก), herpesvirus sarcoma ของ Kaposi (เนื้องอก Kaposi และ primary effusion lymphomas), ไวรัสตับอักเสบบีและไวรัสตับอักเสบ C (มะเร็งตับ), และ human T -cell ไวรัส-1 โรคมะเร็งเม็ดเลือดขาว (leukemias T-cell) การติดเชื้อแบคทีเรียยังอาจเพิ่มความเสี่ยงของโรคมะเร็ง เท่าที่เห็นในมะเร็งกระเพาะอาหารที่เกิดจาก Helicobacter pylori[45] การติดเชื้อปรสิตเกี่ยวข้องอย่างมากกับโรคมะเร็งรวมถึง Schistosoma haematobium (มะเร็งเซลล์ squamous ของกระเพาะปัสสาวะ) และพยาธิใบไม้ในตับ, Opisthorchis viverrini และ Clonorchis sinensis (มะเร็งท่อน้ำดี)[46]
การแผ่รังสี
[แก้]บทความหลัก: โรคมะเร็งที่เกิดขึ้นจากการฉายรังสี
10% ของมะเร็งที่แพร่กระจายเกี่ยวข้องกับการได้รับรังสี รวมทั้งจากรังสีอัลตราไวโอเลตทั้งแบบโอโซนและแบบที่ไม่ใช่โอโซน[4] นอกจากนี้ส่วนใหญ่ของมะเร็งที่ไม่แพร่กระจายจะเป็นมะเร็งผิวหนังที่ไม่ใช่ melanoma ที่เกิดจากรังสีอัลตราไวโอเลตแบบที่ไม่ใช่โอโซน ส่วนใหญ่มาจากแสงแดด แหล่งที่มาของรังสีรวมถึงการถ่ายภาพทางการแพทย์และก๊าซเรดอน
รังสีไม่ได้เป็นสารกลายพันธุ์ที่แข็งแกร่งอย่างชัดเจน[47] ตัวอย่างเช่น การสัมผัสกับก๊าซเรดอนโดยผู้อยู่อาศัยมีความเสี่ยงโรคมะเร็งเช่นเดียวกับผู้สูบบุหรี่ไม่สม่ำเสมอ[47] รังสีเป็นแหล่งโรคมะเร็งที่มีศักยภาพมากขึ้นเมื่อมีการรวมกับสารก่อให้เกิดมะเร็งอื่น ๆ เช่นการสัมผัสก๊าซเรดอนบวกกับยาสูบ[47] รังสีสามารถทำให้เกิดมะเร็งในพื้นที่ส่วนใหญ่ของร่างกาย ในสัตว์ทุกชนิดและทุกเพศทุกวัย เด็กและวัยรุ่นมีแนวโน้มที่จะพัฒนาโรคมะเร็งเม็ดเลือดขาวที่เกิดจากรังสีเป็นสองเท่าที่เกิดขึ้นกับผู้ใหญ่; การได้รับรังสีก่อนเกิดมีผลเป็นสิบเท่า[47]
รังสีที่ใช้ทางการแพทย์มีขนาดเล็ก แต่แหล่งกำเนิดรังสีมะเร็งมีจำนวนเพิ่มขึ้น รังสีอาจจะใช้ในการรักษามะเร็งอื่น ๆ แต่ในบางกรณีอาจทำให้เกิดรูปแบบที่สองของโรคมะเร็ง[47] นอกจากนี้ มันยังใช้ในบางชนิดของการถ่ายภาพทางการแพทย์อีกด้วย[48]
การสัมผัสกับรังสีอัลตราไวโอเลตจากดวงอาทิตย์เป็นเวลานานสามารถนำไปสู่มะเร็งผิวหนังแบบ melanoma และมะเร็งผิวหนังร้ายแรงอื่น ๆ[49] หลักฐานที่ชัดเจนได้ชี้ไปที่รังสีอัลตราไวโอเลต โดยเฉพาะอย่างยิ่งคลื่นความยาวขนาดกลางที่ไม่ใช่โอโซน (UVB) ว่าเป็นสาเหตุของมะเร็งผิวหนังที่ไม่ใช่เนื้องอกส่วนใหญ่ ซึ่งเป็นรูปแบบทั่วไปส่วนใหญ่ของโรคมะเร็งในโลก[49]
รังสีความถี่วิทยุที่ไม่โอโซนจากระบบโทรศัพท์มือถือ, ระบบส่งกำลังไฟฟ้าและแหล่งอื่นที่คล้ายคลึงกันได้รับการอธิบายว่าเป็น "สารก่อมะเร็งที่เป็นไปได้" โดยองค์การระหว่างประเทศเพื่อการวิจัยมะเร็งขององค์การอนามัยโลก[50] อย่างไรก็ตามการศึกษายังไม่พบความเชื่อมโยงสอดคล้องกันระหว่างรังสีจากโทรศัพท์มือถือและความเสี่ยงโรคมะเร็ง[51]
พันธุกรรม
[แก้]ส่วนใหญ่ของโรคมะเร็งจะไม่สามารถถ่ายทอดทางพันธุกรรม ("โรคที่เกิดครั้งเดียว") โรคมะเร็งที่ติดต่อทางกรรมพันธุ์เบื้องต้นเป็นสาเหตุมาจากข้อบกพร่องในการถ่ายทอดทางพันธุกรรม น้อยกว่า 0.3% ของประชากรจะเป็นพาหะของการกลายพันธุ์ทางพันธุกรรมที่มีผลกระทบอย่างมากต่อความเสี่ยงโรคมะเร็งและความเสี่ยงเหล่านี้ก่อให้เกิดน้อยกว่า 3-10% ของโรคมะเร็งทั้งหมด[52] บางส่วนของอาการเหล่านี้รวมถึง:. การกลายพันธุ์บางอย่างที่ได้รับการถ่ายทอดในยีน BRCA 1 และ BRCA2 ที่มีความเสี่ยงมากกว่า 75% ของมะเร็งเต้านมและมะเร็งรังไข่[52] และมะเร็งลำไส้ใหญ่ชนิด hereditary nonpolyposis (HNPCC หรือ Lynch syndrome) ซึ่งมีอยู่ในประมาณ 3% ของผู้ที่มีโรคมะเร็งลำไส้ใหญ่[53]
สารที่มีการสัมผัสทางกายภาพ
[แก้]สารบางชนิดทำให้เกิดโรคมะเร็ง ส่วนใหญ่เนื่องจากการสัมผัสทางกายภาพมากกว่าทางเคมี[54] ตัวอย่างที่โดดเด่นได้แก่การสัมผัสกับแร่ใยหินเป็นเวลานาน, แร่ใยหินเป็นเส้นใยแร่ธาตุที่เกิดขึ้นตามธรรมชาติ มันเป็นสาเหตุสำคัญของโรค mesothelioma (โรคมะเร็งชนิดหนึ่งของเยื่อเซรุ่ม ซึ่งมักจะเป็นเยื่อเซรุ่มรอบปอด)[54] สารอื่น ๆ ในหมวดหมู่นี้รวมทั้งที่เกิดขึ้นตามธรรมชาติและที่เกิดขึ้นผ่านการสังเคราะห์เช่นเส้นใยคล้ายแร่ใยหินได้แก่ wollastonite, attapulgite, glass wool และ rock wool สารเหล่านี้เชื่อว่าจะมีผลกระทบที่คล้ายกัน[54] วัสดุที่ไม่ใช่ไฟเบอร์ที่ก่อให้เกิดโรคมะเร็งได้แก่ผงโลหะโคบอลต์และนิกเกิล และผลึกซิลิกา (ควอทซ์, cristobalite และ tridymite)[54] โดยปกติสารก่อมะเร็งทางกายภาพจะต้องเข้าไปในร่างกาย (เช่นผ่านการสูดดมชิ้นเล็ก ๆ ) และต้องใช้เวลาหลายปีของการสัมผัสจนพัฒนาขึ้นเป็นโรคมะเร็ง[54]
การบาดเจ็บทางร่างกายจนส่งผลให้เป็นโรคมะเร็งค่อนข้างหายาก[55] ยกตัวอย่างเช่น การอ้างว่าการที่กระดูกแตกส่งผลให้เกิดโรคมะเร็งกระดูกไม่เคยได้รับการพิสูจน์ว่าจริง[55] ในทำนองเดียวกัน การบาดเจ็บทางร่างกายก็ไม่ได้รับการยอมรับว่าเป็นสาเหตุของมะเร็งปากมดลูกมะเร็งเต้านมหรือมะเร็งสมอง[55] กรณีเดียวที่ยอมรับได้คือการที่ร่างกายได้รับความร้อนบ่อยและเป็นเวลานอน เป็นไปได้ว่าการเผาไหม้ซ้ำ ๆ ในส่วนเดียวกันของร่างกายเช่นความร้อนที่สร้างโดย Kanger (หม้อใส่ถ่านร้อนของชาวแคชเมียร์เพื่อให้ความอบอุ่นแก่ร่างกาย) และเครื่องทำความร้อนแบบ Kairo (เครื่องอุ่นมือด้วยถ่าน) อาจสร้างมะเร็งบนผิวหนัง โดยเฉพาะอย่างยิ่งถ้ามีการใช้สารเคมีที่เป็นสารก่อมะเร็งในการให้ความร้อน[55] ที่พบบ่อยคือการดื่มน้ำชาร้อนจนลวกอาจสร้างมะเร็งหลอดอาหาร[55] โดยทั่วไป เชื่อกันว่ามะเร็งจะเกิดขึ้น, หรือมะเร็งที่มีอยู่ก่อนแล้วได้รับการสนับสนุน, ในระหว่างขั้นตอนการซ่อมแซมอาการบาดเจ็บ มากกว่ามะเร็งจะเกิดจากการบาดเจ็บโดยตรง[55] อย่างไรก็ตาม การได้รับบาดเจ็บซ้ำ ๆ ที่เนื้อเยื่อเดียวกันอาจส่งเสริมการเพิ่มจำนวนเซลล์มากเกินไปซึ่งก็จะไปเพิ่มอัตราการกลายพันธุ์ของมะเร็ง
เป็นที่ถกเถียงกันว่าการอักเสบเรื้อรังอาจทำให้เกิดการกลายพันธุ์โดยตรงได้หรือไม่[55][56] อย่างไรก็ตาม เป็นที่ยอมรับว่าการอักเสบสามารถนำไปสู่การขยายจำนวน, การอยู่รอด, การก่อตัวของเส้นเลือดใหม่และการย้ายถิ่นของเซลล์มะเร็งโดยการสร้างอิทธิพลต่อจุลสิ่งแวดล้อมรอบ ๆ เนื้องอก[57][58] มากไปกว่านั้น ยีนมะเร็ง (อังกฤษ: oncogenes) เป็นที่รู้จักกันว่าเป็นตัวสะสมจุลสิ่งแวดล้อมแบบส่งเสริมให้เกิดยีนเนื้องอกที่อักเสบ (อังกฤษ: inflammatory pro-tumorigenic microenvironment)[59]
ฮอร์โมน
[แก้]ฮอร์โมนบางชนิดมีบทบาทสำคัญในการพัฒนามะเร็งโดยการส่งเสริมการเพิ่มจำนวนเซลล์[60] ปัจจัยการเจริญเติบโตอย่างเช่นอินซูลินและโปรตีนที่ผูกพันของพวกมันมีบทบาทสำคัญในการเพิ่มจำนวนเซลล์, การแยกความแตกต่างและการตาย, บอกถึงความเป็นไปได้ในการมีส่วนร่วมในการเกิดมะเร็ง[61]
ฮอร์โมนเป็นตัวการสำคัญในการเกิดโรคมะเร็งที่เกี่ยวข้องกับเพศ เช่นโรคมะเร็งของเต้านม, เยื่อบุมดลูก, ต่อมลูกหมาก, รังไข่, และอัณฑะ รวมทั้งโรคมะเร็งต่อมไทรอยด์และมะเร็งกระดูก[60] ตัวอย่างเช่นหญิงที่มีมารดามีมะเร็งเต้านมจะมีระดับของเอสโตรเจนและ progesterone ที่สูงขึ้นอย่างมีนัยสำคัญมากกว่าหญิงที่มีมารดาที่ไม่มีมะเร็งเต้านม การเพิ่มขึ้นของระดับฮอร์โมนอาจจะอธิบายได้ว่าทำไมผู้หญิงเหล่านี้จึงมีความเสี่ยงสูงต่อการเป็นมะเร็งเต้านมได้แม้ว่าจะไม่มียีนมะเร็งเต้านม[60] ในทำนองเดียวกันชายเชื้อสายแอฟริกันมีระดับเทสโทสเทอโรนที่สูงขึ้นอย่างมีนัยสำคัญมากกว่าชายเชื้อสายยุโรปจึงมีระดับที่สอดคล้องกันของมะเร็งต่อมลูกหมากที่สูงมาก[60] ชายเชื้อสายเอเชียที่มีระดับต่ำสุดของ androstanediol glucuronide ที่เกิดจากเทสโทสเทอโรน ก็มีระดับต่ำสุดของมะเร็งต่อมลูกหมาก[60]
นอกจากนี้ปัจจัยอื่น ๆ ก็เกี่ยวข้องด้วย เช่นคนที่เป็นโรคอ้วนมีระดับที่สูงขึ้นของฮอร์โมนบางชนิดที่เกี่ยวข้องกับโรคมะเร็งและอัตราที่สูงขึ้นของโรคมะเร็งเหล่านั้น[60] ผู้หญิงที่บำบัดด้วยฮอร์โมนทดแทนมีความเสี่ยงสูงของโรคมะเร็งที่เกี่ยวข้องกับฮอร์โมนเหล่านั้น[60] ในทางตรงกันข้าม ผู้ที่ออกกำลังกายมากกว่าค่าเฉลี่ยมีระดับที่ลดลงของฮอร์โมนเหล่านี้และลดความเสี่ยงของโรคมะเร็ง[60] มะเร็งกระดูก (อังกฤษ: Osteosarcoma) อาจได้รับการส่งเสริมจากฮอร์โมนการเจริญเติบโต[60] การรักษาและการป้องกันบางอย่างจะช่วยถ่วงดุลสาเหตของโรคเหล่านี้โดยการลดแบบเทียมของระดับฮอร์โมน ซึ่งจะไม่ส่งเสริมมะเร็งที่ไวต่อฮอร์โมนนั้น[60]
พยาธิสรีรวิทยา
[แก้]บทความหลัก: การเกิดมะเร็ง
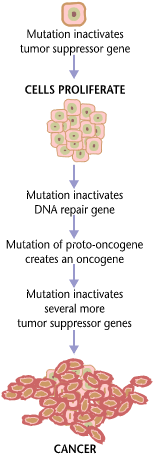
พันธุศาสตร์
[แก้]โรคมะเร็งโดยพื้นฐานเป็นโรคของการล้มเหลวในการควบคุมการเจริญเติบโตของเนื้อเยื่อ ในการที่จะให้เซลล์ปกติเปลี่ยนให้เป็นเซลล์มะเร็ง ยีนที่ควบคุมการเจริญเติบโตของเซลล์และแยกความแตกต่างจะต้องมีการเปลี่ยนแปลง[62]
ยีนที่ได้รับผลกระทบสามาถแบ่งออกเป็นสองประเภทกว้าง ๆ คือ 1. ยีนก่อมะเร็ง (อังกฤษ: oncogenes) เป็นยีนที่ส่งเสริมการเจริญเติบโตและการเพิ่มจำนวนของเซลล์ 2. ยีนต้านเนื้องอก (อังกฤษ: Tumor suppressor gene) เป็นยีนที่ยับยั้งการแบ่งตัวและความอยู่รอดของเซลล์ การแปลงร่างของเนื้อร้ายสามารถเกิดขึ้นได้ผ่านการก่อตัวของ oncogenes แบบนวนิยาย (เป็นการออกฤทธิ์ที่มากเกินไปอย่างไม่เหมาะสมของยีนก่อมะเร็งปกติ) หรือเกิดขึ้นโดยการออกฤทธิ์หรือการปิดใช้งานที่น้อยเกินไปของยีนต้านมะเร็ง โดยปกติแล้วการเปลี่ยนแปลงในยีน"จำนวนมาก"จะต้องเป๋นการเปลี่ยนจากเซลล์ปกติให้เป็นเซลล์มะเร็ง[63]
การเปลี่ยนแปลงทางพันธุกรรมสามารถเกิดขึ้นได้ในระดับที่แตกต่างกันและโดยกลไกที่แตกต่างกัน การได้รับหรือการสูญเสียของโครโมโซมทั้งมวลสามารถเกิดขึ้นได้ผ่านความผิดพลาดในกระบวนการแบ่งเซลล์ (อังกฤษ: mitosis) ที่พบกันมากกว่าเป็นกระบวนการกลายพันธุ์ที่มีการเปลี่ยนแปลงในลำดับนิวคลีโอไทด์[64]ของจีโนมิกส์ดีเอ็นเอ
การกลายพันธุ์ขนาดใหญ่ที่เกี่ยวข้องกับการลบออกหรือการได้รับส่วนหนึ่งของโครโมโซม การขยายจีโนมจะเกิดขึ้นเมื่อเซลล์ได้รับหลาย ๆ สำเนา (มักจะ 20 สำเนาหรือมากกว่า) ของตำแหน่งโครโมโซม (อังกฤษ: chromosomal locus) ขนาดเล็กที่มักจะมียีนมะเร็งหนึ่งตัวหรือมากกว่าหนึ่งและสารพันธุกรรมที่อยู่ติดกัน การโยกย้าย (อังกฤษ: transloacation) จะเกิดขึ้นเมื่อสองภูมิภาคของโครโมโซมที่แยกจากกันมีการหลอมเข้าด้วยกันอย่างผิดปกติ โดยมักจะเกิดขึ้นที่ตำแหน่งที่เป็นลักษณะสมบัติ ตัวอย่างที่รู้จักกันดีเป็น'ฟิลาเดลเฟียโครโมโซม' หรือการโยกย้ายของโครโมโซม 9 และ 22 ซึ่งเกิดขึ้นในโรคมะเร็งเม็ดเลือดขาวเรื้อรังแบบ myelogenous และส่งผลในการผลิตโปรตีนฟิวชั่นแบบ BCR-ABL, ซึ่งเป็น tyrosine kinase (เอนไซม์ขนิดหนึ่งที่สามารถเปลี่ยนฟอสเฟสแบบ ATP ให้เป็นโปรตีนในเซลล์ มันทำงานเหมือนสวิทช์ปิด-เปิดในหลายหน้าที่ของเซลล์ มันเป็นชั้นย่อยหนึ่งของโปรตีนไคเนส)ที่เป็นยีนมะเร็งชนิดหนึ่ง
การกลายพันธุ์ขนาดเล็กจะรวมถึงการกลายพันธุ์, การลบออกและแทรกเป็นจุดจุด ซึ่งอาจเกิดขึ้นในภูมิภาคส่งเสริมของยีนและมีผลต่อการออกฤทธิ์ของมัน หรืออาจเกิดขึ้นในลำดับการเข้ารหัสของยีนและปรับเปลี่ยนฟังก์ชันหรือความมั่นคงของผลิตภัณฑ์โปรตีนของมัน การหยุดชะงักของยีนตัวเดียวยังอาจเกิดจากการรวมตัวกันของวัสดุจีโนมจากดีเอ็นเอไวรัสหนึ่ง(หรือ retrovirus) ที่นำไปสู่การออกฤทธิ์ของยีนมะเร็งของไวรัสในเซลล์ที่ได้รับผลกระทบและลูกหลานของมัน
การจำลองแบบของข้อมูลจำนวนมหาศาลที่มีอยู่ภายในดีเอ็นเอของเซลล์ที่มีชีวิตจะส่งผลที่เป็นไปได้ทางสถิติให้เกิดข้อผิดพลาดบางอย่าง (นั่นคือการกลายพันธุ์) การแก้ไขและการป้องกันข้อผิดพลาดที่ซับซ้อนจะถูกสร้างขึ้นให้เป็นกระบวนการ และป้องกันเซลล์ให้ปลอดภัยจากโรคมะเร็ง ถ้าข้อผิดพลาดที่มีนัยสำคัญเกิดขึ้น เซลล์ที่เสียหายสามารถ "ทำลายตัวเอง" ผ่านการตายของเซลล์ที่ได้โปรแกรมไว้แล้วที่เรียกว่าการตายของเซลล์ (อังกฤษ: apoptosis) หากกระบวนการควบคุมความผิดพลาดเกิดการล้มเหลว, การกลายพันธุ์ก็จะอยู่รอดและถูกส่งผ่านไปยังเซลล์ลูก
สภาพแวดล้อมบางอย่างมีแนวโน้มที่ทำความผิดพลาดให้เกิดขึ้นและเผยแพร่ออกไป สภาพแวดล้อมดังกล่าวอาจรวมถึงการปรากฏตัวของสารก่อกวนที่เรียกว่ายีนมะเร็ง (อังกฤษ: carcinogens), การบาดเจ็บทางกายภาพซ้ำ ๆ, ความร้อน, รังสีหรือการขาดออกซิเจน[65]
ตัวอย่างของข้อผิดพลาดที่เป็นสาเหตุของโรคมะเร็ง เช่น "การขยายตัวเอง" และ "การประสม" ได้แก่:
- การกลายพันธุ์ในเครื่องแก้ไขข้อผิดพลาดของเซลล์อาจเป็นสาเหตุให้เซลล์และลูก ๆ ของมันทำการสะสมข้อผิดพลาดได้รวดเร็วมากขึ้น
- การกลายพันธุ์ที่ขยายตัวในยีนมะเร็งตัวหนึ่งอาจทำให้เซลล์แบ่งตัวเพิ่มจำนวนมากขึ้นอย่างรวดเร็วและบ่อยครั้งมากขึ้นกว่าเซลล์ปกติอื่น ๆ
- การกลายพันธุ์ที่ขยายตัวอาจทำให้เกิดการสูญเสียยีนต้านมะเร็ง ชะงักเส้นทางการส่งสัญญาณการตายและส่งผลให้เซลล์กลายเป็นอมตะ
- การกลายพันธุ์ที่ขยายตัวในเครื่องส่งสัญญาณของเซลล์อาจส่งสัญญาณที่ผิดพลาดไปยังเซลล์ที่อยู่ใกล้เคียง
การแปลงร่างของเซลล์ปกติจนกลายเป็นเซลล์มะเร็งจะคล้ายกับการเกิดปฏิกิริยาลูกโซ่ที่เกิดจากความผิดพลาดครั้งแรก ซึ่งประสมกันขึ้นเป็นข้อผิดพลาดที่รุนแรงมากขึ้น แต่ละข้อผืดพลาดช่วยอย่างก้าวหน้าให้เซลล์สามารถที่จะหลบหนีการควบคุมที่จำกัดการเจริญเติบโตของเนื้อเยื่อปกติ สถานการณ์ที่เหมือนการก่อจลาจลนี้จะกลายเป็นที่ไม่พึงประสงค์ของการอยู่รอดของผู้เหมาะสมที่สุด (อังกฤษ: survival of the fittest) ที่แรงผลักดันของวิวัฒนาการทำงานต่อต้านกับการออกแบบและการบังคับให้ทำตามคำสั่งของร่างกาย เมื่อมะเร็งได้เริ่มที่จะพัฒนา กระบวนการอย่างต่อเนื่องแบบนี้ ที่เรียกว่าการวิวัฒนาการที่เกิดมาจากเซลล์เดียวกัน (อังกฤษ: somatic evolution (clonal evolution)) จะผลักดันให้เกิดความก้าวหน้าไปสู่ระยะของโรคที่มีการบุกรุกมากขึ้น[66] clonal evolution จะนำไปสู่เนื้องอกแบบภายในไม่ได้เป็นเนื้อเดียวกัน (อังกฤษ: intra-tumour heterogeneity) ที่ทำให้กลยุทธ์การให้การรักษาที่มีประสิทธิภาพอย่างที่ได้ออกแบบไว้เกิดความสลับซับซ้อน
ความสามารถด้านลักษณะสมบัติที่มีการพัฒนาโดยโรคมะเร็งสามารถแบ่งออกเป็นหลายประเภท มีการนำเสนอแต่เดิมอยู่หกประเภทในบทความปี 2000 ที่เรียกว่า "เครื่องหมายแสดงว่ามีคุณภาพสูงของมะเร็ง" โดยดักลาส Hanahan และโรเบิร์ต Weinberg เกี่ยวกับ: การหลีกเลี่ยงการตาย, การพึ่งตัวเองในสัญญาณการเจริญเติบโต, การไม่รู้สึกถึงสัญญาณป้องกันการเจริญเติบโต, การสร้างหลอดเลือดอย่างยั่งยืน, ศักยภาพการทำซ้ำอย่างไร้ขีดจำกัด, และ การแพร่กระจาย. ในงานที่เขียนเพิ่มเติม ผู้เขียนเดียวกันเพิ่มอีกสองประเภทมากขึ้นในปี 2011 ได้แก่ โปรแกรมใหม่ของการเผาผลาญพลังงานและการหลีกเลี่ยงการทำลายภูมิคุ้มกัน [24][25]
การแพร่กระจาย
[แก้]การแพร่กระจาย (อังกฤษ: metastasis) หมายถึงการแพร่กระจายของมะเร็งไปยังตำแหน่งอื่น ๆ ในร่างกาย เนื้องอกที่เกิดใหม่จะเรียกว่าเนื้องอกที่แพร่กระจาย ในขณะที่เดิมเรียกว่าเนื้องอกขั้นต้น โรคมะเร็งเกือบทั้งหมดสามารถแพร่กระจายได้[67] การเสียชีวิตจากมะเร็งส่วนใหญ่เกิดจากโรคมะเร็งที่มีการแพร่กระจายจากตำแหน่งแรกของมันไปยังอวัยวะอื่น ๆ (ที่แพร่กระจายเข้ามา)[68]
การแพร่กระจายเป็นเรื่องธรรมดามากในช่วงปลายของการเกิดโรคมะเร็งและมันสามารถกระจายได้ผ่านทางเลือดหรือระบบน้ำเหลืองหรือทั้งสองอย่าง ขั้นตอนทั่วไปในการแพร่กระจายก็คือ การบุกรุกเฉพาะที่, การแทรกซึมเข้าสู่กระแสเลือดหรือน้ำเหลือง การไหลเวียนผ่านร่างกาย การซึมออกจากกระแสไหลเวียนเข้าไปในเนื้อเยื่อใหม่ การเพิ่มจำนวน และการสร้างหลอดเลือดใหม่ ขนิดของโรคมะเร็งที่แตกต่างกันมีแนวโน้มที่จะแพร่กระจายไปยังอวัยวะที่แตกต่างกันโดยเฉพาะของมัน แต่โดยรวมแล้วบริเวณที่พบมากที่สุดสำหรับการแพร่กระจายจะเกิดขึ้นที่ปอด ตับ สมอง และกระดูก[67]
การวินิจฉัย
[แก้]
โรคมะเร็งส่วนใหญ่ในตอนแรกจะได้รับการยืนยันโดยลักษณะของสัญญาณหรืออาการหรือผ่านการคัดกรองอย่างใดอย่างหนึ่ง แต่ไม่มีสักตัวที่นำไปสู่การวินิจฉัยที่ชัดเจนยกเว้นจะต้องมีการตรวจสอบตัวอย่างเนื้อเยื่อโดยวิธีการทางพยาธิวิทยา คนที่ต้องสงสัยว่าเป็นโรคมะเร็งจะถูกตรวจสอบด้วยการทดสอบต่าง ๆ ทางการแพทย์ โดยทั่วไปรวมถึงการทดสอบเลือด, เอกซ์เรย์, CT สแกน, และการส่องกล้อง
คนส่วนใหญ่จะไม่มีความสุขเมื่อรู้ว่าพวกเขามีโรคมะเร็ง พวกเขาอาจจะมีความกังวลและไม่มีความสุขอย่างมาก ความเสี่ยงในการฆ่าตัวตายของผู้ที่มีโรคมะเร็งอยู่ที่ประมาณสองเท่าของความเสี่ยงปกติ[69]
การจัดหมวดหมู่
[แก้]ข้อมูลเพิ่มเติม: รายการประเภทของโรคมะเร็งและรายชื่อของคำที่เกี่ยวข้องกับมะเร็ง
โรคมะเร็งสามารถจัดหมวดหมู่ได้ตามชนิดของเซลล์ที่มีลักษณะคล้ายกับเซลล์เนื้องอกที่เชื่อว่าจะเป็นจุดเริ่มต้นของเนื้องอก ชนิดของเซลล์เหล่านี้ได้แก่:
- Carcinoma: เป็นมะเร็งที่ได้มาจากเซลล์เยื่อบุผิว (อังกฤษ: epithelium) กลุ่มนี้ได้แก่โรคมะเร็งจำนวนมากที่พบมากที่สุด โดยเฉพาะอย่างยิ่งในหมู่ผู้สูงอายุและเกือบทุกคนที่กำลังพัฒนาเป็นมะเร็งในเต้านม, ในต่อมลูกหมาก, ในปอด, ในตับอ่อน, และในลำไส้
- Sarcoma: เป็นมะเร็งที่เกิดจากเนื้อเยื่อเกี่ยวพัน (เช่นกระดูก, กระดูกอ่อน, ไขมัน, เส้นประสาท) ซึ่งแต่ละตัวมีการพัฒนาจากเซลล์ต้นกำเนิดในเซลล์ mesenchymal นอกไขกระดูก
- Lymphoma และ leukemia (มะเร็งต่อมน้ำเหลืองและมะเร็งเม็ดเลือดขาว): โรคมะเร็งสองชนิดนี้เกิดจากเซลล์เม็ดเลือด (เกิดจากเลือด) (อังกฤษ: hematopoietic (blood-forming) cells) ที่ออกมาจากไขกระดูกและมีแนวโน้มที่จะโตเต็มที่ในต่อมน้ำเหลืองและเลือดตามลำดับ โรคมะเร็งเม็ดเลือดขาวเป็นชนิดของมะเร็งที่พบมากที่สุดในเด็กโดยคิดเป็นประมาณ 30%[70]
- เนื้องอกเซลล์สืบพันธุ์ (อังกฤษ: Germ cell tumor): เป็นโรคมะเร็งที่ได้มาจากเซลล์หลายฤทธิ์หลายสรรพคุณ (อังกฤษ: pluripotent cell) (คุณสมบัติของเซลล์ต้นตอในการเปลี่ยนแปลงคุณสมบัติของเซลล์ต้นตอในการเปลี่ยนแปลงไปเป็นเซลล์จำเพาะของเนื้อเยื่อชนิดอื่น ๆ ได้หลายชนิด แต่เซลล์ต้นตอชนิดพลูริโพเทนท์ไม่สามารถเปลี่ยนแปลงไปเป็นเนื้อเยื่อที่อยู่ชั้นนอกสุดของตัวอ่อน (Extraembryonic Tissues) ได้ ซึ่งเนื้อเยื่อนี้ได้แก่ ถุงน้ำคร่ำ (Amnion) เยื่อหุ้มตัวอ่อน (Chorion) และองค์ประกอบของรก (Placenta) [วิทยาศาสตร์และเทคโนโลยี])ส่วนใหญ่มักจะพบในลูกอัณฑะหรือรังไข่ (seminoma และ dysgerminoma ตามลำดับ)
- blastoma: เป็นโรคมะเร็งที่ได้จากการเซลล์ "ปูชนียบุคคล" หรือเนื้อเยื่อของตัวอ่อนที่ยังไม่โตเต็มที่ Blastoma จะพบในเด็กมากกว่าในผู้มีอายุมากกว่า
มะเร็งมักจะใช้คำต่อไปนี้ -carcinoma, -sarcoma หรือ -blastoma เป็นคำต่อท้ายและใช้ชื่ออวัยวะหรือเนื้อเยื่อของแหล่งกำเนิดเป็นภาษาละตินหรือกรีกเป็นคำนำหน้า ยกตัวอย่างเช่นโรคมะเร็งของเนื้อเยื่อตับที่เกิดจากเซลล์เยื่อบุผิวเนื้อร้ายจะถูกเรียกว่า hepatocarcinoma ในขณะที่เนื้อร้ายที่เกิดจากเซลล์ตับสารตั้งต้นดั้งเดิมจะถูกเรียกว่า hepatoblastoma และมะเร็งที่เกิดจากเซลล์ไขมันจะถูกเรียกว่า liposarcoma สำหรับมะเร็งทั่วไปบางอย่างชื่ออวัยวะจะใช้เป็นภาษาอังกฤษ ตัวอย่างเช่นชนิดที่พบมากที่สุดของมะเร็งเต้านมจะเรียกว่า ductal carcinoma ของเต้านม คำว่า ductal (ท่อ)เป็นคำคุณศัพท์ที่หมายถึงการปรากฏตัวของโรคมะเร็งภายใต้กล้องจุลทรรศน์ซึ่งแสดงให้เห็นว่ามันมีต้นกำเนิดในท่อน้ำนม
เนื้องอกไม่ร้ายแรง (ซึ่งไม่ใช่มะเร็ง) จะใช้คำว่า-omaเป็นคำต่อท้าย และใช้ชื่ออวัยวะเป็นคำนำหน้า ตัวอย่างเช่นเนื้องอกไม่ร้ายแรงของเซลล์กล้ามเนื้อเรียบจะเรียกว่าleiomyoma (แต่ชื่อสามัญของเนื้องอกไม่ร้ายแรงที่เกิดขึ้นบ่อยในมดลูก (uterus)จะเรียกว่า uterine fibroid หรือแค่ fibroid) ด้วยความสับสน มะเร็งบางชนิดใช้คำต่อท้ายว่า -noma ตัวอย่างเช่น melanoma และ seminoma
บางชนิดของโรคมะเร็งได้รับการตั้งชื่อตามชื่อขนาดและรูปร่างของเซลล์ภายใต้กล้องจุลทรรศน์เช่นโรคมะเร็งเซลล์ยักษ์ (อังกฤษ: giant cell carcinoma), เซลล์มะเร็งแกน (อังกฤษ: spindle cell carcinoma)และมะเร็งเซลล์ขนาดเล็ก(อังกฤษ: small-cell carcinoma)
พยาธิวิทยา
[แก้]การวินิจฉัยเนื้อเยื่อที่ทำโดยนักพยาธิวิทยาจะระบุประเภทของเซลล์ที่กำลังขยายปริมาณ, เกรดเนื้อเยื่อ (อังกฤษ: histological grade) ของเซลล์นั้น, ความผิดปกติทางพันธุกรรม, และคุณสมบัติอื่น ๆ ของเนื้องอก ข้อมูลนี้จะเป็นประโยชน์ในการประเมินการพยากรณ์โรคของผู้ป่วยและเพื่อเลือกการรักษาที่ดีที่สุด นักอายุรเวชอาจดำเนินการทดสอบตัวอย่างเนื้อเยื่อแบบเซลล์พันธุศาสตร์ (อังกฤษ: Cytogenetics) และ เคมีภูมิเนื้อเยื่อ (อังกฤษ: immunohistochemistry) การทดสอบเหล่านี้อาจให้ข้อมูลเกี่ยวกับการเปลี่ยนแปลงโมเลกุล (เช่นการกลายพันธุ์, ยีนฟิวชั่น, และการเปลี่ยนแปลงโครโมโซมเกี่ยวกับตัวเลข) ที่ได้เกิดขึ้นในเซลล์มะเร็ง และอาจยังบ่งบอกให้เห็นถึงพฤติกรรมในอนาคตของโรคมะเร็ง (การพยากรณ์โรค) และการรักษาที่ดีที่สุด
-
มะเร็งในท่อน้ำนม (อังกฤษ: ductal carcinoma) ที่รุกรานของเต้านม (พื้นที่สีซีดตรงกลาง) ล้อมรอบไปด้วยหนามแหลมของเนื้อเยื่อแผลเป็นสีขาวและเนื้อเยื่อไขมันสีเหลือง
-
มะเร็งลำไส้ใหญ่ (อังกฤษ: colorectal carcinoma) ที่รุกราน (กลางบน) ในตัวอย่างเนื้อเยื่อลำใส้ใหญ่
-
มะเร็งของเซลล์บุผิวสแควมัส (อังกฤษ: squamous-cell carcinoma) (เนื้องอกสีขาว) ใกล้หลอดลมในเนื้อเยื่อปอดตัวอย่าง
-
มะเร็งในท่อน้ำนมที่รุกรานขนาดใหญ่ในตัวอย่างเนื้อเยื่อที่ผ่าตัดเอาเต้านมออก
การป้องกัน
[แก้]การป้องกันโรคมะเร็งมีการกำหนดเป็นมาตรการที่จริงจังเพื่อลดความเสี่ยงของโรคมะเร็ง[71] ส่วนใหญ่ของผู้ป่วยโรคมะเร็งเกิดจากปัจจัยเสี่ยงด้านสิ่งแวดล้อม และจำนวนมากแต่ไม่ใช่ทั้งหมดของปัจจัยแวดล้อมเหล่านี้เป็นการเลือกวิถีชีวิตที่สามารถควบคุมได้ ดังนั้นโรคมะเร็งถือว่าเป็นโรคที่สามารถป้องกันได้เป็นส่วนใหญ่[72] มากกว่า 30% ของการเสียชีวิตจากมะเร็งสามารถป้องกันได้โดยการหลีกเลี่ยงปัจจัยเสี่ยง ได้แก่ :. ยาสูบ, การมีน้ำหนักเกิน / โรคอ้วน, อาหารที่ไม่เพียงพอ, ขาดการออกกำลังกาย, เครื่องดื่มแอลกอฮอล์, การติดเชื้อติดต่อทางเพศสัมพันธ์, และมลพิษทางอากาศ[73] สาเหตุด้านสิ่งแวดล้อมไม่สามารถควบคุมได้ทั้งหมดเช่นการเกิดขึ้นตามธรรมชาติของรังสีที่เป็นพื้นหลัง และกรณีอื่น ๆ ของโรคมะเร็งที่เกิดจากความผิดปกติของพันธุกรรม ดังนั้นมันจึงเป็นไปไม่ได้ที่จะป้องกันโรคมะเร็งได้ทุกกรณี
อาหาร
[แก้]บทความหลัก: อาหารกับโรคมะเร็ง
ในขณะที่มีคำแนะนำเรื่องการบริโภคอาหารจำนวนมากได้รับการนำเสนอเพื่อลดความเสี่ยงของโรคมะเร็ง แต่หลักฐานที่จะสนับสนุนคำแนะนำนั้นไม่ค่อยชัดเจน[9][74] ปัจจัยการบริโภคอาหารขั้นต้นที่เพิ่มความเสี่ยงคือการเป็นโรคอ้วนและการบริโภคเครื่องดื่มแอลกอฮอล์ แต่ส่วนที่เกี่ยวข้องกับการรับประทานผักและผลไม้ในปริมาณที่ต่ำและเนื้อแดงในปริมาณที่สูงไม่ได้รับการยืนยัน[75][76] ในรายงานของ meta-analysis ปี 2014 ไม่พบความสัมพันธ์ระหว่างผักและผลไม้กับโรคมะเร็ง[77] การบริโภคกาแฟมีล่วนเกี่ยวข้องกับการลดความเสี่ยงของโรคมะเร็งตับ[78] การศึกษาได้เชื่อมโยงการบริโภคมากเกินไปของเนื้อสีแดงหรือเนื้อผ่านการกระบวนการเข้ากับการเพิ่มความเสี่ยงของโรคมะเร็งเต้านม, มะเร็งลำไส้ใหญ่, และมะเร็งตับอ่อน ซึ่งเป็นปรากฏการณ์หนึ่งที่อาจจะเป็นสาเหตุให้พบสารก่อมะเร็งในเนื้อสัตว์ที่ปรุงสุกที่อุณหภูมิสูง[79][80] คำแนะนำเกี่ยวกับการบริโภคอาหารเพื่อป้องกันโรคมะเร็งมักจะรวมถึงการให้ความสำคัญกับผัก ผลไม้ ธัญพืช และปลา และหลีกเลี่ยงเนื้อผ่านกระบวนการและเนื้อแดง (เนื้อวัว, เนื้อหมู, เนื้อแกะ) ไขมันสัตว์และ คาร์โบไฮเดรตกลั่น[9][74]
ยา
[แก้]แนวคิดที่ว่ายาสามารถใช้ในการป้องกันโรคมะเร็งได้เป็นที่น่าสนใจ และมีหลักฐานสนับสนุนการใช้ยาในไม่กี่สถานการณ์ที่กำหนดไว้[81] ในประชากรทั่วไป ยาต้านอักเสบที่ไม่ใช้สตีรอยด์ (อังกฤษ: Non-steroidal anti-inflammatory drug (NSAIDs)) อาจลดความเสี่ยงของโรคมะเร็งลำไส้ใหญ่ แต่เนื่องจากมันมีผลกระทบแบบ side effect ต่อหัวใจและหลอดเลือดและระบบทางเดินอาหาร ยาดังกล่าวจึงอาจก่อให้เกิดอันตรายโดยรวมเมื่อนำมาใช้[82] แอสไพรินถูกพบว่าสามารถลดความเสี่ยงของการเสียชีวิตจากโรคมะเร็งได้ประมาณ 7%[83] COX-2 inhibitor อาจลดอัตราการก่อตัวของติ่งเนื้อ (อังกฤษ: polyp) ในผู้ที่มีโรคติ่งเนื้อเมือกมากของเนื้องอกไม่ร้ายที่เนื้อเยื่อบุผิวที่มีโครงสร้างคล้ายต่อม (อังกฤษ: familial adenomatous polyposis) อย่างไรก็ตาม มันมีผลกระทบเช่นเดียวกับยากลุ่ม NSAIDs[84] การใช้ยา tamoxifen หรือ raloxifene เป็นประจำวันได้แสดงให้เห็นถึงการลดความเสี่ยงของการเกิดมะเร็งเต้านมในผู้หญิงที่มีความเสี่ยงสูง[85] เมื่อเอาประโยชน์มาเทียบกับอันตรายสำหรับยายับยั้งเอนไซม์ชื่อ 5-alpha-reductase inhibitor เช่นตัวยา finasteride แล้ว ประโยชน์ยังไม่ชัดเจน[86]
วิตามินยังไม่ได้ถูกพบว่ามีประสิทธิภาพในการป้องกันโรคมะเร็งได้[87] แม้ว่าระดับเลือดต่ำของวิตามินดีจะมีความสัมพันธ์กับความเสี่ยงที่เพิ่มขึ้นของโรคมะเร็ง[88][89] ความสัมพันธ์นี้จะเป็นสาเหตุหรือไม่และอาหารเสริมวิตามินดีสามารถช่วยในการป้องกันหรือไม่นั้นยังไม่ได้มีการค้นหาความจริงอย่างแน่วแน่[90] การเสริมเบต้าแคโรทีนมีการค้นพบว่าใช้เพิ่มอัตราการเกิดมะเร็งปอดในผู้ที่มีความเสี่ยงสูง[91] การเสริมกรดโฟลิกยังไม่พบว่ามีประสิทธิภาพในการป้องกันโรคมะเร็งลำไส้ใหญ่แต่อาจเพิ่มติ่งลำไส้ใหญ่[92][93] ยังไม่มีความชัดเจนว่าการเสริมซีลีเนียมมีประโยชน์[94]
การฉีดวัคซีน
[แก้]วัคซีนได้รับการพัฒนาเพื่อป้องกันการติดเชื้อจากไวรัสสารก่อมะเร็งบางชนิด[95] วัคซีน Human papillomavirus (Gardasil และ Cervarix) ช่วยลดความเสี่ยงของการเกิดมะเร็งปากมดลูก[95] วัคซีนตับอักเสบจากไวรัสชนิด บี ป้องกันการติดเชื้อจากไวรัสตับอักเสบชนิด บี ดังนั้นมันจึงช่วยลดความเสี่ยงของโรคมะเร็งตับ[95] การบริหารงานเพื่อการฉีดวัคซีน human papillomavirus และไวรัสตับอักเสบชนิด B จะแนะนำให้ทำเมื่อมีทรัพยากรพอเพียง[96]
การคัดกรอง
[แก้]ซึ่งแตกต่างจากความพยายามในการวินิจฉัยโรคที่ได้รับแจ้งจากอาการและสัญญาณทางการแพทย์ จะเกี่ยวข้องกับความพยายามที่จะตรวจหามะเร็งหลังจากที่มันได้เกิดขึ้นแล้ว แต่ก่อนที่อาการใด ๆ จะปรากฏออกมา[97] การตรวจคัดกรองมะเร็งนี้อาจเกี่ยวข้องกับการตรวจทางกายภาพ, การทดสอบเลือดหรือปัสสาวะ, หรือถ่ายภาพทางการแพทย์[97]
การตรวจคัดกรองโรคมะเร็งปัจจุบันยังไม่สามารถทำได้ในมะเร็งหลายประเภท และถึงแม้ว่าจะมีการทดสอบ ก็อาจไม่แนะนำสำหรับทุกคน การตรวจคัดกรองแบบสากล หรือ การตรวจคัดกรองแบบกลุ่มจะเกี่ยวข้องกับการตรวจคัดกรองทุกคน[98] คัดกรองตามที่เลือกจะใช้ระบุคนที่เป็นที่รู้กันว่ามีความเสี่ยงสูงในการพัฒนาเป็นโรคมะเร็งเช่นคนที่มีประวัติครอบครัวเป็นโรคมะเร็ง[98] มีหลายปัจจัยที่จะพิจารณาว่าประโยชน์ของตรวจคัดกรองมีค่ามากกว่าความเสี่ยงและค่าใช้จ่ายในการตรวจคัดกรองหรือไม่[97] ปัจจัยเหล่านี้ได้แก่:
- อันตรายที่อาจเกิดจากการทดสอบคัดกรอง: ยกตัวอย่างเช่นการสร้างภาพด้วยเอ็กซ์เรย์จะเกี่ยวข้องกับการสัมผัสกับรังสีที่อาจเป็นอันตรายได้
- ความน่าจะเป็นของการทดสอบที่จะระบุโรคมะเร็งได้อย่างถูกต้อง
- ความน่าจะเป็นของมะเร็งที่จะปรากฏขึ้น: การคัดกรองปกติจะไม่มีประโยชน์สำหรับการเกิดโรคมะเร็งที่หายาก
- อันตรายที่อาจเกิดจากขั้นตอนการติดตาม
- มีการรักษาที่เหมาะสมหรือไม่
- การตรวจพบแต่เนิ่น ๆ จะช่วยเพิ่มผลการรักษาหรือไม่
- โรคมะเร็งเคยต้องการการรักษาหรือไม่
- คนที่ต้องสงสัยยอมรับการทดสอบหรือไม่: ถ้าการตรวจคัดกรองเป็นภาระมากเกินไป (เช่นมีการเจ็บปวดอย่างมาก) คนนั้นก็จะปฏิเสธที่จะให้ความร่วมมือ[98]
- ค่าใช้จ่ายของการทดสอบ
คำแนะนำ
[แก้]หน่วยงานการบริการป้องกันของสหรัฐ (USPSTF) ได้แนะนำอย่างแข็งแรงให้ไปรตรวจคัดกรองมะเร็งปากมดลูกในผู้หญิงที่ยังมีกิจกรรมทางเพศสัมพันธอย่างน้อยจนถึงอายุ 65[99] หน่วยงานยังแนะนำให้ชาวอเมริกันมีการคัดกรองโรคมะเร็งลำไส้ใหญ่โดยการทดสอบเลือดในอุจจาระ (อังกฤษ: fecal occult blood), การส่องตรวจไส้ใหญ่ส่วนคด (อังกฤษ: sigmoidoscopy), การส่องตรวจลำไส้ใหญ่ด้วยกล้อง (อังกฤษ: colonoscopy) เริ่มต้นที่อายุ 50 ปีจนอายุ 75[100] แต่มีหลักฐานไม่เพียงพอที่จะแนะนำหรือคัดค้านการตรวจคัดกรองโรคมะเร็งผิวหนัง[101] รวมทั้งมะเร็งในช่องปาก[102] กับโรคมะเร็งปอด[103] และมะเร็งต่อมลูกหมากในผู้ชายอายุต่ำกว่า 75[104] การตรวจคัดกรองเป็นประจำไม่แนะนำสำหรับโรคมะเร็งกระเพาะปัสสาวะ[105] รวมทั้งโรคมะเร็งอัณฑะ[106] และมะเร็งรังไข่[107] และโรคมะเร็งตับอ่อน[108] และมะเร็งต่อมลูกหมาก[109]
USPSTF แนะนำการถ่ายภาพเต้านม (อังกฤษ: mammography) เพื่อคัดกรองมะเร็งเต้านมทุกสองปีสำหรับผู้ที่มีอายุ 50-74 ปี; แต่ไม่แนะนำการตรวจเต้านมด้วยตนเองหรือการตรวจเต้านมทางคลินิก[110] รายงานของ Cochrane ปี 2011 มาถึงข้อสรุปที่แตกต่างกันเล็กน้อยเกี่ยวกับการตรวจคัดกรองมะเร็งเต้านมโดยระบุว่าการถ่ายภาพเต้านมเป็นประจำอาจเป็นอันตรายมากกว่าผลดี[111]
ญี่ปุ่นจะตรวจคัดกรองสำหรับโรคมะเร็งกระเพาะอาหารโดยใช้การสร้างภาพเอ็กซเรย์บนจอเรืองแสง (อังกฤษ: photofluorography) เนื่องจากมีอุบัติการณ์สูงที่นั่น[19]
การทดสอบทางพันธุกรรม
[แก้]ดูเพิ่มเติม: กลุ่มอาการของโรคมะเร็ง
| ยีน | ชนิดของมะเร็ง |
|---|---|
| BRCA1, BRCA2 | เต้านม, รังไข่, ตับอ่อน |
| HNPCC, MLH1, MSH2, MSH6, PMS1, PMS2 | ลำไส้ใหญ่, มดลูก, ลำไส้เล็ก, กระเพาะอาหาร, ทางเดินปัสสาวะ |
การทดสอบทางพันธุกรรมจะแนะนำให้ทำสำหรับบุคคลที่มีความเสี่ยงสูงของโรคมะเร็งบางชนิด[96][112] จากนั้นพาหะของการกลายพันธุ์เหล่านี้อาจได้รับการปรับปรุงการเฝ้าระวังหรือการป้องกันทางเคมี (อังกฤษ: chemoprevention) หรือการป้องกันด้วยการผ่าตัดเพื่อลดความเสี่ยงที่ตามมา[112]
การรักษา
[แก้]ตัวเลือกในการรักษาโรคมะเร็งมีหลากหลายคน หลักก็คือการผ่าตัด, เคมีบำบัด, รังสีบำบัด, การรักษาด้วยฮอร์โมน, การรักษาด้วยการกำหนดเป้าหมายและการดูแลแบบประคับประคอง การรักษาแบบไหนจะขึ้นอยู่กับชนิด, ตำแหน่ง, และเกรดของโรคมะเร็งเช่นเดียวกับสุขภาพและความปรารถนาของบุคคล ความตั้งใจในการรักษาอาจจะเป็นแบบเพื่อแก้ไขหรือไม่แก้ไข
เคมีบำบัด
[แก้]เคมีบำบัดคือการรักษาโรคมะเร็งที่ใช้ยาต้านมะเร็งพิษ (อังกฤษ: cytotoxic anti-neoplastic drug) (ยาเคมีบำบัด (อังกฤษ: chemotherapeutic agents)) หนึ่งตัวหรือมากกว่าเป็นส่วนหนึ่งของกฎเกณฑ์มาตรฐาน เคมีบำบัดจะครอบคลุมยาต้านมะเร็งใด ๆ ซึ่งจะแบ่งออกเป็นหมวดหมู่ในวงกว้างเช่น alkylating agents และ antimetabolites[113] ยาเคมีบำบัดแบบดั้งเดิมทำหน้าที่ฆ่าเซลล์ที่แบ่งอย่างรวดเร็วซึ่งเป็นหนึ่งในคุณสมบัติหลักของเซลล์มะเร็งส่วนใหญ่
การรักษาด้วยการกำหนดเป้าหมายเป็นรูปแบบหนึ่งของยาเคมีบำบัดที่เล็งเป้าหมายไปที่โมเลกุลเฉพาะที่แตกต่างกันระหว่างเซลล์มะเร็งและเซลล์ปกติ การรักษาที่ตรงเป้าหมายครั้งแรกที่จะได้รับการพัฒนาขึ้นจะปิดกั้นโมเลกุลที่เป็นตัวรับฮอร์โมนเอสโตรเจนซึ่งเป็นการยับยั้งการเจริญเติบโตของมะเร็งเต้านม ตัวอย่างธรรมดาอีกกรณีหนึ่งก็คือระดับชั้นของสารยับยั้ง Bcr-Abl ซึ่งจะใช้ในการรักษาโรคมะเร็งเม็ดเลือดขาว myelogenous เรื้อรัง (CML)[114] ปัจจุบันมีการรักษาโดยกำหนดเป้าหมายเพื่อรักษามะเร็งเต้านม, เนื้องอกไขกระดูกหลายจุด (อังกฤษ: multiple myeloma), โรคมะเร็งต่อมน้ำเหลือง, มะเร็งต่อมลูกหมาก, มะเร็งผิวหนังและมะเร็งอื่น ๆ[115]
ประสิทธิภาพของยาเคมีบำบัดขึ้นอยู่กับชนิดของโรคมะเร็งและระยะของโรค เมื่อใช้ร่วมกับการผ่าตัด เคมีบำบัดได้พิสูจน์แล้วว่ามีประโยชน์ในหลายชนิดมะเร็งที่แตกต่างกัน ได้แก่ :. มะเร็งเต้านม, มะเร็งลำไส้ใหญ่, มะเร็งตับอ่อน, มะเร็งกระดูก, มะเร็งอัณฑะ, มะเร็งรังไข่และมะเร็งปอดบางอย่าง[116] ประสิทธิภาพโดยรวมมีช่วงจากอยู่ระหว่างการรักษาโรคมะเร็งบางชนิดเช่น leukemias บางชนิด[117][118] จนถึงไม่สัมฤทธิ์ผลเช่นในบางขนิดของเนื้องอกในสมอง[119] จนถึงไม่จำเป็นในมะเร็งอื่น ๆ เช่นมะเร็งผิวหนังที่ไม่ใช่เนื้องอกส่วนใหญ่[120] ประสิทธิภาพของยาเคมีบำบัดมักจะถูกจำกัดโดยความเป็นพิษต่อเนื้อเยื่ออื่น ๆ ในร่างกาย ถึงแม้ในขณะที่มันเป็นไปไม่ได้ที่จะให้ยาเคมีบำบัดสามารถรักษาโรคได้อย่างถาวร เคมีบำบัดอาจจะมีประโยชน์ในการลดอาการเช่นอาการปวดหรือเพื่อลดขนาดของเนื้องอกที่ไม่ทำงานในความหวังว่าการผ่าตัดจะเป็นไปได้ในอนาคต
การฉายรังสี
[แก้]การรักษาด้วยการฉายรังสีจะเกี่ยวข้องกับการใช้รังสีในความพยายามที่จะรักษาหรือปรับปรุงอาการของโรคมะเร็ง มันทำงานโดยการทำลายดีเอ็นเอของเนื้อเยื่อมะเร็งที่นำไปสู่การตายของเซลล์ เพื่อป้องกันเนื้อเยื่อที่ดี (เช่นผิวหนังหรืออวัยวะที่รังสีจะต้องฉายผ่านระหว่างการรักษาเนื้องอก) ลำแสงรังสีที่มีการปรับรูปร่างจะถูกเล็งไปที่หลาย ๆ มุมของจุดสัมผัสกับเนื้องอกเพื่อให้จุดนั้นดูดซึมรังสีมากกว่าพื้นที่โดยรอบของเนื้อเยื่อที่ดี เช่นเดียวกับการรักษาด้วยเคมีบำบัด โรคมะเร็งที่แตกต่างกันมีการตอบสนองต่อรังสีที่แตกต่างกัน[121][122][123]
การรักษาด้วยการฉายรังสีถูกใช้ประมาณครึ่งหนึ่งของทุกกรณีและแหล่งสร้างรังสีอาจมาจากแหล่งภายในร่างกายในรูปแบบของการฝังแร่ (อังกฤษ: brachytherapy) หรือจากแหล่งสร้างรังสีภายนอก การฉายรังสีโดยทั่วไปส่วนใหญ่ใช้รังสีเอกซ์พลังงานต่ำสำหรับการรักษามะเร็งผิวหนังในขณะที่ลำแสงเอ็กซ์เรย์พลังงานสูงจะใช้ในการรักษาโรคมะเร็งภายในร่างกาย[124] รังสีโดยปกติจะใช้เสริมการผ่าตัดหรือเสริมเคมีบำบัด แต่บางประเภทของโรคมะเร็งเช่นโรคมะเร็งศีรษะและลำคอในระยะเริ่มต้นอาจจะใช้เพียงการฉายรังสีอย่างเดียว[125] สำหรับการแพร่กระจายไปที่กระดูกและสร้างความเจ็บปวดพบว่าการฉายรังสีมีประสิทธิภาพประมาณ 70% ของผู้ป่วย[125]
การผ่าตัดเป็นวิธีการเบิ้องต้นของการรักษาโรคมะเร็งที่เป็นของแข็งแยกส่วนส่วนใหญ่และอาจมีบทบาทในการบรรเทาและการยีดอายุการอยู่รอด ปกติแล้วส่วนสำคัญของการวินิจฉัยที่ชัดเจนและการหาระยะของเนื้องอกด้วยวิธีตรวจชิ้นเนื้อมักเป็นสิ่งจำเป็น ในการหาตำแหน่งของมะเร็ง การผ่าตัดมักจะพยายามตัดเอาก้อนเนื้อทั้งหมดออกมา(ในบางกรณี)พร้อมกับต่อมน้ำเหลืองในพื้นที่ สำหรับโรคมะเร็งบางชนิด การตัดออกทั้งหมดเป็นสิ่งที่จำเป็นในการกำจัดโรคมะเร็ง[116]
การดูแลแบบประคับประคอง
[แก้]การดูแลแบบประคับประคองหมายถึงการรักษาที่พยายามที่จะทำให้ผู้ป่วยรู้สึกดีขึ้นและอาจจะหรืออาจจะไม่สามารถใช้ร่วมกับความพยายามที่จะรักษาโรคมะเร็ง การดูแลแบบประคับประคองรวมถึงการดำเนินการเพื่อลดความทุกข์ทางร่างกาย ทางอารมณ์ ทางจิตวิญญาณและจิตสังคม ที่ผู้ป่วยต้องเผชิญอันเนื่องมาจากโรคมะเร็ง ซึ่งแตกต่างจากการรักษาที่มีวัตถุประสงค์ที่จะฆ่าเซลล์มะเร็งโดยตรง เป้าหมายหลักของการดูแลแบบประคับประคองคือการปรับปรุงคุณภาพชีวิตของบุคคลนั้น
ผู้ป่วยในทุกขั้นตอนของการรักษาโรคมะเร็งควรที่จะมีบางชนิดของการดูแลแบบประคับประคองเพื่อให้เกิดความสะดวกสบาย ในบางกรณีองค์กรวิชาชีพทางการแพทย์พิเศษจะแนะนำให้ผู้ป่วยและแพทย์ตอบสนองต่อการเป็นโรคมะเร็งด้วยการดูแลแบบประคับประคองเท่านั้นและไม่ใช่การบำบัดแบบมุ่งหมายเพื่อการรักษาแต่เพียงอย่างเดียว[126] การบำบัดดังกล่าวรวมถึง:[127]
- ผู้ป่วยที่มีสมรถนะต่ำ สอดคล้องกับความสามารถในการดูแลตัวเองที่จำกัด[126]
- ผู้ป่วยที่ไม่ได้รับประโยชน์จากการรักษาตามหลักฐานก่อนหน้านี้[126]
- ผู้ป่วยที่ไม่ได้สิทธิ์ในการเข้าร่วมในการทดลองทางคลินิกที่เหมาะสมใด ๆ[126]
- ผู้ป่วยที่แพทย์ไม่เห็นหลักฐานที่ชัดเจนว่าการรักษาจะมีประสิทธิภาพในการเยียวยา[126]
การดูแลแบบประคับประคองมักจะสับสนกับบ้านพักรับรองซึ่งมีส่วนเกี่ยวข้องกับผู้ป่วยที่เข้าสู่จุดสิ้นสุดของชีวิตเท่านั้น เช่นเดียวกับการดูแลที่บ้านพักรับรอง, การดูแลแบบประคับประคองพยายามที่จะช่วยให้ผู้ป่วยได้รับในสิ่งเขาต้องการได้ทันทีและเพื่อเพิ่มความสะดวกสบายให้แก่บุคคลนั้น แต่ที่แตกต่างจากการดูแลที่บ้านพักรับรองก็คือ การดูแลแบบประคับประคองผู้ป่วยไม่จำเป็นต้องหยุดการรักษาที่มุ่งเป้าไปที่การยืดชีวิตหรือการรักษาโรคมะเร็งของพวกเขา
แนวทางทางการแพทย์แห่งชาติหลายแห่งแนะนำการดูแลแบบประคับประคองเบื้องต้นสำหรับคนที่โรคมะเร็งสร้างอาการวิตก (ความเจ็บปวด, หายใจถี่, อ่อนเพลีย, คลื่นไส้) หรือผู้ที่ต้องการความช่วยเหลือในการรับมือกับความเจ็บป่วยของพวกเขา ในผู้ที่มีโรคแพร่กระจายเมื่อมีการวินิจฉัยครั้งแรก, ผู้เชี่ยวชาญด้านเนื้องอกวิทยาควรพิจารณาการดูแลแบบประคับประคองให้คำปรึกษาได้ทันที นอกจากนี้นักเนื้องอกควรพิจารณาการดูแลแบบประคับประคองให้คำปรึกษาให้คนที่รู้สึกว่ามีจะมีชีวิตอยู่น้อยกว่า 12 เดือนแม้ว่าการรักษาเชิงรุกจะกระทำอย่างต่อเนื่อง[128][129][130]
การบำบัดด้วยระบบภูมิคุ้มกัน
[แก้]บทความหลัก: การบำบัดโรคมะเร็งด้วยระบบภูมิคุ้มกัน ความหลากหลายของการรักษาโดยใช้ภูมิคุ้มกัน เป็นการกระตุ้นหรือช่วยระบบภูมิคุ้มกันในการต่อสู้กับโรคมะเร็ง ได้เข้ามาใช้ตั้งแต่ปี 1997 และยังคงเป็นพื้นที่ของการวิจัยที่จริงจังอย่างมาก.[131]
การแพทย์ทางเลือก
[แก้]การรักษาโรคมะเร็งแบบเสริมและแบบทางเลือกเป็นระบบการดูแลสุขภาพที่มีความหลากหลายระบบหนึ่ง, เป็นการปฏิบัติและผลิตภัณฑ์ที่ไม่ได้เป็นส่วนหนึ่งของการแพทย์แผนปัจจุบัน[132] "การแพทย์เสริม" หมายถึงวิธีการและยาที่ใช้พร้อมกับการแพทย์แผนปัจจุบันในขณะที่ "การแพทย์ทางเลือก" หมายถึง สารประกอบที่ใช้แทนการแพทย์แผนปัจจุบัน[133] ส่วนใหญ่การแพทย์เสริมและการแพทย์ทางเลือกสำหรับโรคมะเร็งยังไม่ได้รับการศึกษาหรือการทดสอบอย่างจริงจังง บางการรักษาแบบทางเลือกได้รับการตรวจสอบและแสดงให้เห็นแล้วว่าจะไม่ได้ผล แต่ก็ยังคงมีจำหน่ายในตลาดและได้รับการส่งเสริม นักวิจัยโรคมะเร็ง Andrew J. Vickers ได้กล่าวว่า "ฉลาก 'ไม่ผ่านการพิสูจน์' ยังไม่เหมาะสมสำหรับการรักษาดังกล่าว ถึงเวลาแล้วที่จะยืนยันว่าการรักษาโรคมะเร็งทางเลือกจำนวนมาก 'ไม่ได้รับการพิสูจน์'"[134]
การพยากรณ์โรค
[แก้]ดูเพิ่มเติม: รายชื่อของอัตราการตายด้วยโรคมะเร็งในประเทศสหรัฐอเมริกาและผู้รอดชีวิตจากโรคมะเร็ง
โรคมะเร็งมีชื่อเสียงว่าเป็นโรคแห่งความตาย เมื่อพิจารณาในภาพรวม ประมาณครึ่งหนึ่งของบุคคลที่ได้รับการรักษาโรคมะเร็งรุกราน (ไม่รวมมะเร็งในแหล่งกำเนิดและมะเร็งผิวหนังที่ไม่ใช่เนื้องอก) จะเสียชีวิตจากโรคมะเร็งหรือจากการรักษา[19] การอยู่รอดจะเลวร้ายยิ่งกว่าในประเทศกำลังพัฒนา[19] ส่วนหนึ่งเป็นเพราะ โรคมะเร็งที่พบมากที่สุดในปัจจุบันยากที่จะรักษามากกว่าโรคมะเร็งที่เกี่ยวข้องกับการดำเนินชีวิตของประเทศที่พัฒนาแล้ว[135] อย่างไรก็ตามอัตราการรอดชีวิตแตกต่างกันไปอย่างมากตามประเภทของโรคมะเร็งและตามระยะที่มันจะได้รับการวินิจฉัยอีกด้วย โดยมีช่วงตั้งแต่ส่วนใหญ่มีชีวิตรอดไปจนถึงเกือบจะไม่มีใครมีชีวิตรอดเลยภายในห้าปีหลังการวินิจฉัย เมื่อมะเร็งแพร่กระจายได้ขยายตัวหรือแพร่กระจายเกินกว่าตำแหน่งต้นกำเนิดเดิม การพยากรณ์โรคตามปกติจะกลายเป็นเลวร้ายมากขึ้น
บรรดาผู้ที่มีชีวิตรอดจากโรคมะเร็งจะมีความเสี่ยงที่เพิ่มขึ้นของการพัฒนาเป็นมะเร็งหลักที่สองประมาณสองเท่าของอัตราของผู้ที่ไม่เคยได้รับการวินิจฉัยเลยว่าเป็นมะเร็ง[136] ความเสี่ยงที่เพิ่มขึ้นเชื่อว่าเป็นสาเหตุหลักมาจากปัจจัยเสี่ยงเช่นเดียวกับการก่อมะเร็งครั้งแรก ส่วนหนึ่งเนื่องจากการรักษาโรคมะเร็งตัวแรกและเป็นไปได้ที่เกี่ยวข้องกับการให้ความร่วมมืออย่างสม่ำเสมอที่ดีกว่ากับการตรวจคัดกรอง[136]
การคาดการณ์การอยู่รอดระยะสั้นหรือระยะยาวเป็นเรื่องยากและขึ้นอยู่กับหลายปัจจัย ปัจจัยที่สำคัญที่สุดคือชนิดของโรคมะเร็งและอายุและสุขภาพโดยรวมของผู้ป่วย คนที่มีความอ่อนแอเนื่องจากปัญหาสุขภาพอื่น ๆ มากมายมีอัตราการรอดตายต่ำกว่าคนที่มีสุขภาพดี คนที่มีอายุเป็นร้อยปีไม่น่าจะอยู่รอดถึงห้าปีแม้ว่าการรักษาจะประสบความสำเร็จ คนที่มีคุณภาพชีวิตที่สูงกว่ามีแนวโน้มที่จะอยู่รอดได้นานกว่า[137] คนที่มีคุณภาพชีวืตต่ำกว่าอาจได้รับผลกระทบจากโรคซึมเศร้าและภาวะแทรกซ้อนอื่น ๆ จากการรักษาโรคมะเร็งและ / หรือจากความก้าวหน้าของโรคที่ทั้งบั่นทอนคุณภาพชีวิตและลดอายุของพวกเขา นอกจากนี้ผู้ป่วยที่มีการพยากรณ์โรคที่เลวร้ายอาจจะขาดความสุขหรือมีรายงานว่ามีคุณภาพชีวิตที่ต่ำลงเพราะพวกเขาได้รับรู้อย่างถูกต้องว่าสภาพของพวกเขามีแนวโน้มที่จะเป็นอันตรายถึงชีวิต
คนที่เป็นมะเร็งแม้ว่าเขาจะเดินได้ด้วยตัวของเขาเอง เขาก็มีความเสี่ยงเพิ่มขึ้นกับเลือดอุดตันในเส้นเลือด การใช้เฮปารินปรากฏว่าช่วยปรับปรุงการอยู่รอดและลดความเสี่ยงของเลือดอุดตัน[138]
การระบาดวิทยา
[แก้]บทความหลัก: ระบาดวิทยาของโรคมะเร็ง
ดูเพิ่มเติม: รายชื่อประเทศจากอัตราการเกิดโรคมะเร็ง

no data ≤ 55 55–80 80–105 105–130 130–155 155–180 | 180–205 205–230 230–255 255–280 280–305 ≥ 305 |
ในปี 2008 ประมาณ 12.7 ล้านรายได้รับการวินิจฉัยว่าเป็นโรคมะเร็ง (ไม่รวมมะเร็งผิวหนังที่ไม่ใช่เนื้องอกและมะเร็งไม่รุกรานอื่น ๆ)[19] และในปี 2010 เกือบ 7.98 ล้านคนเสียชีวิต[140] กลุ่มของโรคมะเร็งมีส่วนประมาณ 13% ของการเสียชีวิตทั้งหมดในแต่ละปี โรคที่พบมากที่สุด ได้แก่: โรคมะเร็งปอด (เสียชีวิต 1.4 ล้านราย), มะเร็งกระเพาะอาหาร (เสียชีวิต 740,000 ราย), มะเร็งตับ (เสียชีวิต 700,000 ราย), โรคมะเร็งลำไส้ใหญ่ (เสียชีวิต 610,000 ราย) และโรคมะเร็งเต้านม (เสียชีวิต 460,000 ราย)[141] นี่ทำให้มะเร็งรุกรานเป็นสาเหตุนำของการตายในประเทศที่พัฒนาแล้วและสาเหตุสำคัญที่สองของการเสียชีวิตในประเทศกำลังพัฒนา[19] กว่าครึ่งหนึ่งของกรณีเหล่านี้เกิดขึ้นในประเทศกำลังพัฒนา[19]
การเสียชีวิตจากโรคมะเร็งมีจำนวน 5.8 ล้านรายในปี 1990[140] และอัตรานี้จะเพิ่มขึ้นโดยมีสาเหตุหลักจากการสูงอายุของประชากรและการเปลี่ยนแปลงวิถีการดำเนินชีวิตในประเทศกำลังพัฒนา[19] ปัจจัยเสี่ยงที่สำคัญที่สุดในการพัฒนาโรคมะเร็งคือการสูงอายุ[142] แม้ว่ามันจะเป็นไปได้ที่โรคมะเร็งจะเกิดในวัยใด ๆ ก็ได้ คนส่วนใหญ่ที่ได้รับการวินิจฉัยว่าเป็นมะเร็งแบบรุกรานจะมีอายุมากกว่า 65[142] อ้างถึงนักวิจัยโรคมะเร็ง Robert A. Weinberg "ถ้าเรามีชีวิตอยู่นานพอ ไม่ช้าก็เร็วเราทุกคนจะเป็นโรคมะเร็ง"[143] บางส่วนของความสัมพันธ์ระหว่างการสูงวัยกับโรคมะเร็งมีสาเหตุมาจากการเสื่อมถอยของระบบภูมิคุ้มกันในผู้สูงอายุ (อังกฤษ: immunosenescence)[144] และความผิดพลาดที่สะสมในดีเอ็นเอไปตลอดช่วงอายุ[145] และการเปลี่ยนแปลงที่เกี่ยวข้องกับอายุในระบบต่อมไร้ท่อ[146] ผลของภาวะสูงอายุต่อโรคมะเร็งมีความซับซ้อนด้วยหลายปัจจัยต่าง ๆ เช่นความเสียหายของดีเอ็นเอและการอักเสบที่ส่งเสริมความเสียหายนั้นและหลายปัจจัยต่าง ๆ เช่นการสูงอายุของหลอดเลือดและการเปลี่ยนแปลงของต่อมไร้ท่อที่ยับยั้งมัน[147]
โรคมะเร็งบางชนิดมีการเจริญเติบโตที่ช้าเป็นเรื่องปกติ การศึกษาด้วยการชันสูตรศพในยุโรปและเอเชียได้แสดงว่าสูงถึง 36% ของคนได้รับการวินิจฉัยที่ต่ำเกินจริงและปรากฏว่าเป็นมะเร็งต่อมไทรอยด์ที่ไม่เป็นพิษเป็นภัยในช่วงเวลาที่พวกเขาเสียชีวิตและว่า 80% ของผู้ชายมีการพัฒนาเป็นโรคมะเร็งต่อมลูกหมากตอนอายุ 80[148][149] เนื่องจากว่าโรคมะเร็งเหล่านี้ไม่ก่อให้เกิดการเสียชีวิตของบุคคลนั้น การระบุโรคเหล่านี้จึงเป็นการวินิจฉัยที่มากเกินจริงเกินกว่าจะเป็นการดูแลทางการแพทย์ที่มีประโยชน์
โรคมะเร็งในเด็กที่พบมากที่สุดมีสามโรคคือโรคมะเร็งเม็ดเลือดขาว (34%) เนื้องอกในสมอง (23%) และ มะเร็งต่อมน้ำเหลือง (12%)[150] ในสหรัฐอเมริกา โรคมะเร็งส่งผลกระทบต่อเด็กประมาณ 1 คนใน 285 คน[151] อัตราการเกิดโรคมะเร็งในเด็กเพิ่มขึ้น 0.6% ต่อปีระหว่างปี 1975-2002 ในสหรัฐอเมริกา[152] และ 1.1% ต่อปีระหว่างปี 1978 และปี 1997 ในยุโรป[150] การตายจากโรคมะเร็งในวัยเด็กได้ลดลงครึ่งหนึ่งตั้งแต่ปี 1975 ในประเทศสหรัฐอเมริกา[151]
มะเร็งในประเทศไทย
[แก้]ในปี พ.ศ. 2549 ประเทศไทยมีผู้เสียชีวิตจากโรคมะเร็ง 66,000 ราย โดยในผู้ชายพบมะเร็งปอดมากที่สุด 5,535 ราย รองลงมาคือโรคมะเร็งตับ ส่วนผู้หญิงพบมะเร็งปากมดลูกมากที่สุด 1,484 ราย รองลงมาคือ มะเร็งปอด มะเร็งเต้านม[153]
ในปี พ.ศ. 2553 สถิติมะเร็งที่พบมากที่สุด 10 อันดับแรกในประเทศไทย[154]
| อันดับ | โรคมะเร็งที่พบบ่อยในเพศชาย | จำนวน (%) | โรคมะเร็งที่พบบ่อยในเพศหญิง | จำนวน (%) |
|---|---|---|---|---|
| 1 | Trachea, Bronchus, Lung หลอดลม, ปอด |
23.6 | Breast เต้านม |
47.8 |
| 2 | Colon, Rectum ลำไส้ใหญ่ |
21.5 | Cervix uteri คอมดลูก |
16.2 |
| 3 | Liver, Bile ducts ตับ, ท่อน้ำดี |
17.3 | Colon, Rectum ลำไส้ใหญ่ |
10.4 |
| 4 | Esophagus หลอดอาหาร |
8.2 | Trachea, Bronchus, Lung หลอดลม, ปอด |
7.1 |
| 5 | Nasopharynx คอหอยส่วนจมูก |
6.6 | Corpus uteri มดลูก |
4.0 |
| 6 | Non-Hodgkin lymphoma มะเร็งต่อมน้ำเหลืองชนิดแพร่กระจายเร็ว |
6.4 | Ovary รังไข่ |
4.0 |
| 7 | Tongue ลิ้น |
4.8 | Liver, Bile ducts ตับ |
3.5 |
| 8 | Mouth ปาก |
4.5 | Thyroid ไทรอยด์ |
2.6 |
| 9 | Larynx กล่องเสียง |
3.7 | Non-Hodgkin lymphoma มะเร็งต่อมน้ำเหลืองชนิดแพร่กระจายเร็ว |
2.4 |
| 10 | Stomach กระเพาะอาหาร |
3.6 | Stomach กระเพาะอาหาร |
2.0 |
ประวัติศาสตร์
[แก้]คำอธิบายที่รู้จักกันเร็วที่สุดของโรคมะเร็งปรากฏในหลายพงศาวดารเก่าจากอียิปต์โบราณ เอ็ดวิน สมิธ พาไพรัสเขียนราว 1600 ปีก่อนคริสต์ศักราช (สันนิฐานว่าอาจเป็นสำเนาข้อความจาก 2500 ปีก่อนคริสต์ศักราช) และมีคำอธิบายของโรคมะเร็งเช่นเดียวกับขั้นตอนในการลบเนื้องอกเต้านมด้วยการทำให้แข็งตัว คาดว่าคำบอกเล่าดังกล่าวอาจจะเป็นฮิปโปเครติส เป็นแพทย์ชาวกรีกโบราณ เมื่อประมาน 460 ปีก่อนคริสตกาล มนุษย์ยังใช้สมุนไพรแทนยารักษาโรคและยังอธิบายโรคมะเร็งหลายชนิดโดยอ้างอิงจากคำว่า karkinos (carcinos) คำภาษากรีกสำหรับปูหรือกั้งเช่นเดียวกับมะเร็งสิ่งนี้มาจากการปรากฏตัวของพื้นผิวที่ถูกตัดของเนื้องอกมะเร็งชนิดแข็งที่มี "เส้นเลือดยื่นออกไปทุกด้านเมื่อสัตว์ที่ปูมีเท้ามันจะมาจากชื่อเนื่องจากเป็นการขัดกับธรรมเนียมของกรีกที่จะเปิดร่างกาย Hippocrates ได้อธิบายและทำภาพวาดของเนื้องอกที่มองเห็นภายนอกบนผิวหนังจมูกและหน้าอกการรักษาขึ้นอยู่กับทฤษฎีอารมณ์ขันของของเหลวในร่างกายทั้งสี่ (น้ำดีสีดำและสีเหลืองเลือดและเสมหะ) ตามอารมณ์ขันของผู้ป่วยการรักษาประกอบด้วยอาหารการให้เลือดและพลังงานหรือยาระบาย Celsus (เมื่อ25 ปี ก่อน ค.ศ.-50ปีก่อน ค.ศ.) แปลคำนิยาม karkinos เป็นมะเร็งคำภาษาละตินสำหรับปูหรือ crayfish ในศตวรรษที่ 2 แพทย์ชาวกรีก กาเรนใช้ oncos (ภาษากรีกสำหรับบวม) เพื่ออธิบายเนื้องอกทั้งหมดสำรอง carcinos คำศัพท์ของ Hippocrates สำหรับเนื้องอกมะเร็งและผิวหนังในยุคกลางในช่วงสงครามร้อยปีชาวอังกฤษมักจะเสียชีวิตด้วยโรคผิวหนังซึ่งคนในสมัยนั้นคิดว่าเป็นกาฬโรค ในยุคเรเนอซองค์แพทย์ชาวอังกฤษชื่อ พอร์ซิวอล พ็อตต์ ได้พยายามศึกษาเกี่ยวกับโรคนี้จนทำองค์การอนามัยโรคให้โรคมะเร็งถูกประกาศว่ากลายเป็นโรคอันดับที่ 3 ของโลกที่รักษาไม่หาย สำหรับประเทศไทยแล้วโรคมะเร็งกลายเป็นโรคร้ายแรงในประเทศไทยคาดว่าอยู่ควบมาตั้งแต่สมัยโบราณแล้ว.
สังคมและวัฒนธรรม
[แก้]การวิจัย
[แก้]บทความหลัก: การวิจัยโรคมะเร็ง
เนื่องจากโรคมะเร็งเป็นระดับหนึ่งของโรค[155][156] มันจึงไม่น่าที่จะเคยมี "การรักษาโรคมะเร็ง" เพียงครั้งเดียวอย่างการรักษาเพียงครั้งเดียวสำหรับโรคติดเชื้อทั้งหมด[157] สารยับยั้งการสร้างหลอดเลิอดใหม่ (อังกฤษ: Angiogenesis Inhibitor) ครั้งหนึ่งเคยถูกคิดว่ามีศักยภาพในการเป็นการรักษาแบบ "กระสุนเงิน" ที่สามารถนำมาใช้กับมะเร็งหลายชนิด แต่ตอนนี้ยังไม่ได้ถูกนำมาใช้ในทางปฏิบัติ[158] มันมีแนวโน้มมากกว่าว่าสารยับยั้งการสร้างหลอดเลิอดใหม่และวิธีการรักษาโรคมะเร็งอื่น ๆ จะถูกนำมาใช้ร่วมกันเพื่อลดการเจ็บป่วยและการตายจากโรคมะเร็ง[159]
'การรักษาโรคมะเร็งแบบทดลอง'เป็นการรักษาที่อยู่ระหว่างการศึกษาเพื่อดูว่ามันใช้งานได้หรือไม่ โดยปกติแล้วการรักษาเหล่านี้จะทำการศึกษาโดยการทดลองทางคลินิกเพื่อเปรียบเทียบการรักษาที่นำเสนอกับการรักษาที่ใช้อยู่ที่ดีที่สุด การรักษาอาจจะเป็นการรักษาแบบใหม่ทั้งหมดหรืออาจจะเป็นวิธีการรักษาที่เคยประสบความสำเร็จในบางชนิดของโรคมะเร็งและตอนนี้กำลังมีการทดสอบเพื่อดูว่ามันจะมีประสิทธิภาพกับมะเร็งแบบอื่น[160] ยิ่งมากขึ้นเรื่อย ๆ, การรักษาดังกล่าวกำลังได้รับการพัฒนาควบคู่ไปกับการตรวจวินิจฉัยร่วมกันเพื่อที่จะกำหนดเป้าหมายสำหรับยาที่ถูกต้องให้แก่ผู้ป่วยที่ขึ้นอยู่กับชีววิทยาของแต่ละคน[161]
การวิจัยโรคมะเร็งเป็นความพยายามทางวิทยาศาสตร์ที่รุนแรงเพื่อที่จะเข้าใจกระบวนการการเกิดของโรคและเพื่อค้นหาวิธีการรักษาที่เป็นไปได้
การวิจัยเกี่ยวกับสาเหตุการเกิดโรคมะเร็งมุ่งเน้นในประเด็นต่อไปนี้:
- ตัวแทน (เช่นไวรัส) และเหตุการณ์ที่เกิดขึ้น (เช่นการกลายพันธุ์) ที่เป็นสาเหตุหรืออำนวยความสะดวกในการเปลี่ยนแปลงทางพันธุกรรมในเซลล์ที่มีชะตากรรมที่จะกลายเป็นโรคมะเร็ง
- ธรรมชาติที่แม่นยำของความเสียหายทางพันธุกรรมและตัวยีนที่ถูกกระทบจากมัน
- ผลกระทบของการเปลี่ยนแปลงทางพันธุกรรมเหล่านั้นกับชีววิทยาของเซลล์ ทั้งในการสร้างคุณสมบัติที่กำหนดของเซลล์มะเร็ง และในการอำนวยความสะดวกกิจกรรมทางพันธุกรรมเพิ่มเติมที่นำไปสู่การส่งเสริมความก้าวหน้าของโรคมะเร็ง
ความเข้าใจที่ดีขึ้นของอณูชีววิทยาและชีววิทยาของเซลล์ที่ได้จากการวิจัยโรคมะเร็งได้นำไปสู่การรักษาใหม่จำนวนมากสำหรับโรคมะเร็งนับแต่ประธานาธิบดีนิกสันแห่งสหรัฐประกาศ "สงครามกับมะเร็ง" ในปี 1971 ตั้งแต่นั้นมาสหรัฐได้ใช้เงินกว่า $2 แสนล้านในการวิจัยโรคมะเร็ง รวมทั้งทรัพยากรจากภาครัฐและเอกชนและมูลนิธิ[162] ในช่วงเวลานั้น สหรัฐได้เห็นอัตราการเสียชีวิตจากโรคมะเร็งลดลงร้อยละห้า (ปรับตามขนาดและอายุของประชากร) ระหว่างปี 1950 และปี 2005[163]
การแข่งขันกันที่สูงมากสำหรับทรัพยากรทางการเงินที่จำเป็นต้องใช้ในการดำเนินการทางวิทยาศาสตร์ทำให้เกิดความกดดันกับความคิดริเริ่มสร้างสรรค์ รวมทั้งความร่วมมือกับความเสี่ยงและความคิดดั้งเดิมที่จำเป็นเพื่อการค้นพบขั้นพื้นฐาน ซึ่งเป็นการวิจัยแบบความเสี่ยงต่ำอันเป็นที่นิยมมากเกินควรให้เป็นความก้าวหน้าที่เพิ่มขึ้นขนาดเล็กบนการวิจัยนวัตกรรมที่อาจค้นพบการรักษาอย่างรุนแรงที่ใหม่และดีขึ้นอย่างมาก ผลกระทบอื่น ๆ ของการแข่งขันที่กดดันอย่างมากสำหรับทรัพยากรการวิจัยทำให้เกิดปรากฏงานวิจัยจำนวนมากที่มีผลลัพธ์ที่ไม่สามารถจำลองแบบได้ และเกิดเแรงจูงใจที่ประหลาดในการระดมทุนวิจัยที่ส่งเสริมให้สถาบันผู้รับสิทธิ์มีการเติบโตโดยไม่มีการลงทุนที่เพียงพอในคณะและสิ่งอำนวยความสะดวกของตัวเอง[164][165][166][167]
การตั้งครรภ์
[แก้]เพราะโรคมะเร็งเป็นโรคส่วนใหญ่ของผู้สูงอายุ มันก็ไม่ได้พบบ่อยในหญิงตั้งครรภ์ โรคมะเร็งส่งผลกระทบต่อหญิงตั้งครรภ์ประมาณ 1 ใน 1,000 คน[168] โรคมะเร็งที่พบมากที่สุดในระหว่างการตั้งครรภ์เป็นเช่นเดียวกับโรคมะเร็งที่พบมากที่สุดที่พบในผู้หญิงที่ไม่ได้ตั้งครรภ์ในช่วงวัยการคลอดบุตร ได้แก่: มะเร็งเต้านม มะเร็งปากมดลูก มะเร็งเม็ดเลือดขาว, มะเร็งต่อมน้ำเหลือง, มะเร็งรังไข่ และโรคมะเร็งลำไส้ใหญ่[168]
การวินิจฉัยโรคมะเร็งใหม่ในหญิงตั้งครรภ์เป็นเรื่องยาก ส่วนหนึ่งเป็นเพราะอาการบางอย่างปกติจะถือว่าจะเป็นความรู้สึกไม่สบายธรมดาที่เกี่ยวข้องกับการตั้งครรภ์[168] เป็นผลให้เป็นโรคมะเร็งโดยทั่วไปถูกค้นพบในระยะของโรคที่ค่อนข้างสายกว่าค่าเฉลี่ยในหญิงตั้งครรภ์หลายกรณีหรือเพิ่งตั้งครรภ์ไม่นาน บางขั้นตอนของการถ่ายภาพเช่น MRIs, CT สแกน, ultrasounds และ mammograms (การเอ็กซ์เรย์เต้านม) ที่มีเครื่องป้องกันรังสีให้กับทารกในครรภ์จะได้รับการพิจารณาว่ามีความปลอดภัยเมื่อทำการถ่ายภาพในระหว่างการตั้งครรภ์ แต่บางระบบอื่น ๆ เช่น PET scan ไม่ปลอดภัย[168]
การรักษาโดยทั่วไปจะดำเนินการเช่นเดียวกับผู้หญิงที่ไม่ได้ตั้งครรภ์[168] อย่างไรก็ตามการฉายรังสีและยาที่ใช้สารกัมมันตรังสีตามปกติจะมีการหลีกเลี่ยงในระหว่างตั้งครรภ์โดยเฉพาะอย่างยิ่งถ้าปริมาณยาสำหรับทารกในครรภ์อาจเกิน 100 CGY ในบางกรณี บางส่วนของการรักษาหรือทั้งหมดจะถูกเลื่อนออกไปจนถึงหลังคลอดถ้าโรคมะเร็งได้รับการวินิจฉัยในช่วงปลายของการตั้งครรภ์ การคลอดที่เร็วขึ้นเพื่อเริ่มต้นการรักษาให้เร็วขึ้นไม่ใช่เป็นสิ่งผิดปกติ การผ่าตัดโดยทั่วไปมีความปลอดภัย แต่การผ่าตัดกระดูกเชิงกรานในช่วงไตรมาสแรกอาจทำให้เกิดการแท้งบุตร การรักษาบางอย่างโดยเฉพาะอย่างยิ่งยาเคมีบำบัดบางอย่างที่ใช้ในช่วงไตรมาสแรกอาจเพิ่มความเสี่ยงของการเกิดข้อบกพร่องกับการคลอด (อังกฤษ: birth defect) และการสูญเสียการตั้งครรภ์ (อังกฤษ: pregnancy loss) (การแท้งที่เกิดขึ้นเองและการคลอดแบบทารกตายในครรภ์).[168]
การเลือกที่จะทำแท้งจะไม่จำเป็นและสำหรับรูปแบบและระยะของโรคมะเร็งที่พบมากที่สุดจะไม่ช่วยการอยู่รอดของแม่ให้ดีขึ้นหรือได้รับการรักษาจนหายขาด[168] ในไม่กี่กรณี เช่นมะเร็งมดลูกระยะก้าวหน้า การตั้งครรภ์ไม่สามารถเป็นไปได้อย่างต่อเนื่อง และในกรณีอื่น ๆ เช่นโรคมะเร็งเม็ดเลือดขาวเฉียบพลันที่ถูกค้นพบในช่วงต้นของการตั้งครรภ์ หญิงที่ตั้งครรภ์อาจเลือกที่จะทำแท้งเพื่อที่เธอจะเริ่มต้นการรักษาด้วยเคมีบำบัดในเชิงรุกโดยไม่ต้องกังวลเกี่ยวกับการเกิดข้อบกพร่องตอนคลอด[168]
การรักษาบางครั้งอาจจะรบกวนความสามารถของแม่ที่จะให้กำเนิดผ่านช่องคลอดหรือการให้นมจากทรวงอกแก่ทารกของเธอ[168] มะเร็งปากมดลูกอาจต้องการการทำคลอดโดยการผ่าตัดหน้าท้อง (อังกฤษ: Caesarean section) การใช้รังสีกับเต้านมจะลดความสามารถของเต้านมในการผลิตน้ำนมและเพิ่มความเสี่ยงของโรคเต้านมอักเสบ (อังกฤษ: mastitis) นอกจากนี้เมื่อรักษาด้วยเคมีบำบัดหลังคลอด ยาจำนวนมากจะผ่านนมแม่ไปยังลูกน้อยซึ่งอาจเป็นอันตรายต่อทารกได้[168]
สัตว์อื่น ๆ
[แก้]โภชนาการ
[แก้]จากการศึกษาพบว่า อาหารอาจมีส่วนสัมพันธ์ กับการเกิดโรคมะเร็งได้ประมาณ 30-50% แต่ในขณะเดียวกันอาหารประเภทพืชผัก ผลไม้ ธัญพืช และ เครื่องเทศต่าง ๆ ก็มี คุณสมบัติในการป้องกันมะเร็งได้ ดังนั้น การรับประทานอาหารอย่างถูกต้องตามหลัก โภชนาการ จึงเป็นหนทางหนึ่ง ซึ่งสามารถป้องกันโรคมะเร็งได้
| การปฏิบัติ | ป้องกันโรค |
|---|---|
| รับประทานผักตระกูลกะหล่ำให้มาก เช่น กะหล่าปลี, กะหล่ำดอก, ผักคะน้า, หัวผักกาด, บรอคโคลี่ | เพื่อป้องกันโรคมะเร็งลำไส้ใหญ่, ลำไส้ส่วนปลาย, กระเพาะอาหาร และอวัยวะระบบทางเดินหายใจ |
| รับประทานอาหารที่มีกากมาก เช่น ผัก, ผลไม้, ข้าว, ข้าวโพด และเมล็ดธัญพืชอื่น ๆ | เพื่อป้องกันมะเร็งลำไส้ใหญ่ |
| รับประทานอาหารที่มีเบต้าแคโรทีน และวิตามินเอสูง เช่น ผัก ผลไม้สีเขียว-เหลือง | เพื่อป้องกันมะเร็งหลอดอาหาร กล่องเสียง และปอด |
| รับประทานอาหารที่มีวิตามินซีสูง เช่น ผัก ผลไม้ต่าง ๆ | เพื่อป้องกันมะเร็งหลอดอาหาร และกระเพาะอาหาร |
| ควบคุมน้ำหนักตัว | โรคอ้วนมีความสัมพันธ์กับโรคมะเร็งมดลูก, ถุงน้ำดี, เต้านม และลำไส้ใหญ่ การออกกำลังกายและการลดรับประทานอาหารที่ให้พลังงานสูง จะช่วยป้องกันมะเร็งเหล่านี้ได้ |
อาหารที่มีความเสี่ยงสูงต่อการเกิดมะเร็ง
- อาหารที่มีราขึ้นโดยเฉพาะราสีเขียว-สีเหลือง
- อาหารไขมันสูง
- อาหารเค็มจัด ส่วนไหม้เกรียมของอาหารปิ้ง ย่าง รมควัน และอาหารที่ถนอมด้วยเกลือ ดินประสิว[170]
ดูเพิ่ม
[แก้]อ้างอิง
[แก้]- ↑ 1.0 1.1 1.2 1.3 1.4 1.5 1.6 1.7 "Cancer Fact sheet N°297". World Health Organization. February 2014. สืบค้นเมื่อ 10 June 2014.
- ↑ 2.0 2.1 2.2 2.3 "Defining Cancer". National Cancer Institute. สืบค้นเมื่อ 10 June 2014.
- ↑ 3.0 3.1 "Cancer - Signs and symptoms". NHS Choices. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-06-08. สืบค้นเมื่อ 10 June 2014.
- ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 Anand P, Kunnumakkara AB, Kunnumakara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, Sung B, Aggarwal BB (September 2008). "Cancer is a preventable disease that requires major lifestyle changes". Pharm. Res. 25 (9): 2097–116. doi:10.1007/s11095-008-9661-9. ISSN 0724-8741. PMC 2515569. PMID 18626751.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 5.0 5.1 5.2 5.3 5.4 5.5 5.6 World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 1.1. ISBN 9283204298.
- ↑ 6.0 6.1 "Heredity and Cancer". American Cancer Society. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-08-02. สืบค้นเมื่อ July 22, 2013.
- ↑ Kinzler, Kenneth W.; Vogelstein, Bert (2002). "Introduction". The genetic basis of human cancer (2nd, illustrated, revised ed.). New York: McGraw-Hill, Medical Pub. Division. p. 5. ISBN 978-0-07-137050-9.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "How is cancer diagnosed?". American Cancer Society. 2013-01-29. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-07-14. สืบค้นเมื่อ 10 June 2014.
- ↑ 9.0 9.1 9.2 Kushi LH, Doyle C, McCullough M; และคณะ (2012). "American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity". CA Cancer J Clin. 62 (1): 30–67. doi:10.3322/caac.20140. PMID 22237782.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Parkin, DM; Boyd, L; Walker, LC (6 December 2011). "16. The fraction of cancer attributable to lifestyle and environmental factors in the UK in 2010". British journal of cancer. 105 Suppl 2: S77-81. doi:10.1038/bjc.2011.489. PMID 22158327.
- ↑ 11.0 11.1 World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 4.7. ISBN 9283204298.
- ↑ Gøtzsche PC, Jørgensen KJ (4 Jun 2013). "Screening for breast cancer with mammography". The Cochrane database of systematic reviews. 6: CD001877. doi:10.1002/14651858.CD001877.pub5. PMID 23737396.
- ↑ "Targeted Cancer Therapies". NCI. 2014-04-25. สืบค้นเมื่อ 11 June 2014.
- ↑ 14.0 14.1 World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 1.3. ISBN 9283204298.
- ↑ "SEER Stat Fact Sheets: All Cancer Sites". National Cancer Institute. สืบค้นเมื่อ 18 June 2014.
- ↑ "The top 10 causes of death Fact sheet N°310". WHO. May 2014. สืบค้นเมื่อ 10 June 2014.
- ↑ Dubas, LE; Ingraffea, A (Feb 2013). "Nonmelanoma skin cancer". Facial plastic surgery clinics of North America. 21 (1): 43–53. doi:10.1016/j.fsc.2012.10.003. PMID 23369588.
- ↑ Cakir, BÖ; Adamson, P; Cingi, C (Nov 2012). "Epidemiology and economic burden of nonmelanoma skin cancer". Facial plastic surgery clinics of North America. 20 (4): 419–22. doi:10.1016/j.fsc.2012.07.004. PMID 23084294.
- ↑ 19.0 19.1 19.2 19.3 19.4 19.5 19.6 19.7 Jemal A, Bray, F, Center, MM, Ferlay, J, Ward, E, Forman, D (February 2011). "Global cancer statistics". CA: a cancer journal for clinicians. 61 (2): 69–90. doi:10.3322/caac.20107. PMID 21296855.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ World Cancer Report 2014. World Health Organization. 2014. pp. Chapter 6.7. ISBN 9283204298.
- ↑ "Cancer Glossary". cancer.org. American Cancer Society. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-09-01. สืบค้นเมื่อ September 11, 2013.
- ↑ "What is cancer?". cancer.gov. National Cancer Institute. สืบค้นเมื่อ September 11, 2013.
- ↑ Hanahan D, Weinberg RA (January 2000). "The hallmarks of cancer". Cell. 100 (1): 57–70. doi:10.1016/s0092-8674(00)81683-9. PMID 10647931.
- ↑ 24.0 24.1 24.2 Hanahan D, Weinberg RA (January 2000). "The hallmarks of cancer". Cell. 100 (1): 57–70. doi:10.1016/S0092-8674(00)81683-9. PMID 10647931.
- ↑ 25.0 25.1 Hanahan D, Weinberg RA (March 2011). "Hallmarks of cancer: the next generation". Cell. 144 (5): 646–74. doi:10.1016/j.cell.2011.02.013. PMID 21376230.
- ↑ ยส พฤกษเวช. มะเร็งในทัศนะแพทย์แผนไทย. เข้าถึงข้อมูลเมื่อ 7 มีนาคม 2562, ที่ http://www.prueksaveda.com/%E0%B9%82%E0%B8%A3%E0%B8%84%E0%B9%83%E0%B8%99%E0%B8%97%E0%B8%A3%E0%B8%A3%E0%B8%A8%E0%B8%99%E0%B8%B0%E0%B9%81%E0%B8%9E%E0%B8%97%E0%B8%A2%E0%B9%8C%E0%B9%81%E0%B8%9C%E0%B8%99%E0%B9%84%E0%B8%97%E0%B8%A2/%E0%B8%A1%E0%B8%B0%E0%B9%80%E0%B8%A3%E0%B9%87%E0%B8%87.html เก็บถาวร 2019-03-14 ที่ เวย์แบ็กแมชชีน
- ↑ 27.0 27.1 27.2 27.3 27.4 Holland Chp. 1
- ↑ O'Dell, edited by Michael D. Stubblefield, Michael W. (2009). Cancer rehabilitation principles and practice. New York: Demos Medical. p. 983. ISBN 978-1-933864-33-4.
{{cite book}}:|first=มีชื่อเรียกทั่วไป (help) - ↑ Kravchenko J, Akushevich I, Manton, KG (2009). Cancer mortality and morbidity patterns in the U. S. population: an interdisciplinary approach. Berlin: Springer. ISBN 0-387-78192-7.
The term environment refers not only to air, water, and soil but also to substances and conditions at home and at the workplace, including diet, smoking, alcohol, drugs, exposure to chemicals, sunlight, ionizing radiation, electromagnetic fields, infectious agents, etc. Lifestyle, economic and behavioral factors are all aspects of our environment.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Tolar J, Neglia JP (June 2003). "Transplacental and other routes of cancer transmission between individuals". J. Pediatr. Hematol. Oncol. 25 (6): 430–4. doi:10.1097/00043426-200306000-00002. PMID 12794519.
- ↑ Biesalski HK, Bueno de Mesquita B, Chesson A, Chytil F, Grimble R, Hermus RJ, Köhrle J, Lotan R, Norpoth K, Pastorino U, Thurnham D (1998). "European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel". CA Cancer J Clin. 48 (3): 167–76, discussion 164–6. doi:10.3322/canjclin.48.3.167. PMID 9594919.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Kuper H, Boffetta P, Adami HO (September 2002). "Tobacco use and cancer causation: association by tumour type". Journal of Internal Medicine. 252 (3): 206–24. doi:10.1046/j.1365-2796.2002.01022.x. PMID 12270001.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 33.0 33.1 Kuper H, Adami HO, Boffetta P (June 2002). "Tobacco use, cancer causation and public health impact". Journal of Internal Medicine. 251 (6): 455–66. doi:10.1046/j.1365-2796.2002.00993.x. PMID 12028500.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sasco AJ, Secretan MB, Straif K (August 2004). "Tobacco smoking and cancer: a brief review of recent epidemiological evidence". Lung Cancer. 45 Suppl 2: S3–9. doi:10.1016/j.lungcan.2004.07.998. PMID 15552776.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Thun MJ, Jemal A (October 2006). "How much of the decrease in cancer death rates in the United States is attributable to reductions in tobacco smoking?". Tob Control. 15 (5): 345–7. doi:10.1136/tc.2006.017749. PMC 2563648. PMID 16998161.
- ↑ Dubey S, Powell CA (May 2008). "Update in lung cancer 2007". Am. J. Respir. Crit. Care Med. 177 (9): 941–6. doi:10.1164/rccm.200801-107UP. PMC 2720127. PMID 18434333.
- ↑ Schütze M, Boeing H, Pischon T, Rehm J, Kehoe T, Gmel G, Olsen A, Tjønneland AM, Dahm CC, Overvad K, Clavel-Chapelon F, Boutron-Ruault MC, Trichopoulou A, Benetou V, Zylis D, Kaaks R, Rohrmann S, Palli D, Berrino F, Tumino R, Vineis P, Rodríguez L, Agudo A, Sánchez MJ, Dorronsoro M, Chirlaque MD, Barricarte A, Peeters PH, van Gils CH, Khaw KT, Wareham N, Allen NE, Key TJ, Boffetta P, Slimani N, Jenab M, Romaguera D, Wark PA, Riboli E, Bergmann MM (2011). "Alcohol attributable burden of incidence of cancer in eight European countries based on results from prospective cohort study". BMJ. 342: d1584. doi:10.1136/bmj.d1584. PMC 3072472. PMID 21474525.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Irigaray P, Newby JA, Clapp R, Hardell L, Howard V, Montagnier L, Epstein S, Belpomme D (December 2007). "Lifestyle-related factors and environmental agents causing cancer: an overview". Biomed. Pharmacother. 61 (10): 640–58. doi:10.1016/j.biopha.2007.10.006. PMID 18055160.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 39.0 39.1 "WHO calls for prevention of cancer through healthy workplaces" (Press release). World Health Organization. 27 April 2007. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-10-12. สืบค้นเมื่อ 13 October 2007.
- ↑ 40.0 40.1 40.2 Kushi LH, Byers T, Doyle C, Bandera EV, McCullough M, McTiernan A, Gansler T, Andrews KS, Thun MJ (2006). "American Cancer Society Guidelines on Nutrition and Physical Activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity". CA Cancer J Clin. 56 (5): 254–81, quiz 313–4. doi:10.3322/canjclin.56.5.254. PMID 17005596.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bhaskaran, K (2014). "Body mass index and risk of 22 specific cancers". Lancet. 384 (9945): 755–765. doi:10.1016/S0140-6736(14)60892-8. PMID 25129328.
- ↑ 42.0 42.1 42.2 Park S, Bae J, Nam BH, Yoo KY (2008). "Aetiology of cancer in Asia" (PDF). Asian Pac. J. Cancer Prev. 9 (3): 371–80. PMID 18990005.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Brenner H, Rothenbacher D, Arndt V (2009). "Epidemiology of stomach cancer". Methods Mol. Biol. Methods in Molecular Biology. 472: 467–77. doi:10.1007/978-1-60327-492-0_23. ISBN 978-1-60327-491-3. PMID 19107449.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Buell P, Dunn JE (May 1965). "Cancer mortality among Japanese Issei and Nisei of California". Cancer. 18 (5): 656–64. doi:10.1002/1097-0142(196505)18:5<656::AID-CNCR2820180515>3.0.CO;2-3. PMID 14278899.
- ↑ Pagano JS, Blaser M, Buendia MA, Damania B, Khalili K, Raab-Traub N, Roizman B (December 2004). "Infectious agents and cancer: criteria for a causal relation". Semin. Cancer Biol. 14 (6): 453–71. doi:10.1016/j.semcancer.2004.06.009. PMID 15489139.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Samaras V, Rafailidis PI, Mourtzoukou EG, Peppas G, Falagas ME (May 2010). "Chronic bacterial and parasitic infections and cancer: a review" (PDF). J Infect Dev Ctries. 4 (5): 267–81. doi:10.3855/jidc.819. PMID 20539059.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 47.0 47.1 47.2 47.3 47.4 Little JB (2000). "Chapter 14: Ionizing Radiation". ใน Kufe DW, Pollock RE, Weichselbaum RR, Bast RC Jr, Gansler TS, Holland JF, Frei E III (บ.ก.). Cancer medicine (6th ed.). Hamilton, Ont: B.C. Decker. ISBN 1-55009-113-1.
{{cite book}}: CS1 maint: multiple names: editors list (ลิงก์) - ↑ Brenner DJ, Hall EJ (November 2007). "Computed tomography—an increasing source of radiation exposure". N. Engl. J. Med. 357 (22): 2277–84. doi:10.1056/NEJMra072149. PMID 18046031.
- ↑ 49.0 49.1 Cleaver JE, Mitchell DL (2000). "15. Ultraviolet Radiation Carcinogenesis". ใน Bast RC, Kufe DW, Pollock RE; และคณะ (บ.ก.). Holland-Frei Cancer Medicine (5th ed.). Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. สืบค้นเมื่อ 31 January 2011.
{{cite book}}: CS1 maint: multiple names: editors list (ลิงก์) - ↑ "IARC classifies radiofrequency electromagnetic fields as possibly carcinogenic to humans" (PDF). World Health Organization.
- ↑ "Cell Phones and Cancer Risk - National Cancer Institute". Cancer.gov. 2013-05-08. สืบค้นเมื่อ 2013-12-15.
- ↑ 52.0 52.1 Roukos DH (April 2009). "Genome-wide association studies: how predictable is a person's cancer risk?". Expert Rev Anticancer Ther. 9 (4): 389–92. doi:10.1586/era.09.12. PMID 19374592.
- ↑ Cunningham D, Atkin W, Lenz HJ, Lynch HT, Minsky B, Nordlinger B, Starling N (March 2010). "Colorectal cancer". Lancet. 375 (9719): 1030–47. doi:10.1016/S0140-6736(10)60353-4. PMID 20304247.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 54.0 54.1 54.2 54.3 54.4 Maltoni CFM, Holland JF (2000). "Chapter 16: Physical Carcinogens". ใน Bast RC, Kufe DW, Pollock RE; และคณะ (บ.ก.). Holland-Frei Cancer Medicine (5th ed.). Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. สืบค้นเมื่อ 31 January 2011.
{{cite book}}: CS1 maint: multiple names: editors list (ลิงก์) - ↑ 55.0 55.1 55.2 55.3 55.4 55.5 55.6 Gaeta, John F (2000). "Chapter 17: Trauma and Inflammation". ใน Bast RC, Kufe DW, Pollock RE; และคณะ (บ.ก.). Holland-Frei Cancer Medicine (5th ed.). Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. สืบค้นเมื่อ 27 January 2011.
{{cite book}}: CS1 maint: multiple names: editors list (ลิงก์) - ↑ Colotta, F.; Allavena, P.; Sica, A.; Garlanda, C.; Mantovani, A. (2009). "Cancer-related inflammation, the seventh hallmark of cancer: links to genetic instability". Carcinogenesis (review). 30 (7): 1073–1081. doi:10.1093/carcin/bgp127. ISSN 0143-3334. PMID 19468060.
- ↑ Hendrik Ungefroren; Susanne Sebens; Daniel Seidl; Hendrik Lehnert; Ralf Haas (2011). "Interaction of tumor cells with the microenvironment". Cell Communication and Signaling. 9 (18): 18. doi:10.1186/1478-811X-9-18.
- ↑ Mantovani A (June 2010). "Molecular pathways linking inflammation and cancer". Current Molecular Medicine (review). 10 (4): 369–73. doi:10.2174/156652410791316968. PMID 20455855.
- ↑ Borrello, Maria Grazia; Degl’Innocenti, Debora; Pierotti, Marco A. (2008). "Inflammation and cancer: The oncogene-driven connection". Cancer Letters (review). 267 (2): 262–270. doi:10.1016/j.canlet.2008.03.060. ISSN 0304-3835. PMID 18502035.
- ↑ 60.00 60.01 60.02 60.03 60.04 60.05 60.06 60.07 60.08 60.09 Henderson BE, Bernstein L, Ross RK (2000). "Chapter 13: Hormones and the Etiology of Cancer". ใน Bast RC, Kufe DW, Pollock RE; และคณะ (บ.ก.). Holland-Frei Cancer Medicine (5th ed.). Hamilton, Ontario: B.C. Decker. ISBN 1-55009-113-1. สืบค้นเมื่อ 27 January 2011.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rowlands, Mari-Anne; Gunnell, David; Harris, Ross; Vatten, Lars J; Holly, Jeff MP; Martin, Richard M (May 15, 2009). "Circulating insulin-like growth factor peptides and prostate cancer risk: a systematic review and meta-analysis". Int J Cancer. 124 (10): 2416–29. doi:10.1002/ijc.24202. PMC 2743036. PMID 19142965.
- ↑ Croce CM (January 2008). "Oncogenes and cancer". N. Engl. J. Med. 358 (5): 502–11. doi:10.1056/NEJMra072367. PMID 18234754.
- ↑ Knudson AG (November 2001). "Two genetic hits (more or less) to cancer". Nature Reviews Cancer. 1 (2): 157–62. doi:10.1038/35101031. PMID 11905807.
- ↑ nucleotide: เป็นหน่วยย่อยของดีเอ็นเอและอาร์เอ็นเอ ประกอบด้วยเบสและหมู่ฟอสเฟตเชื่อมต่อกับน้ำตาล เบสที่พบในดีเอ็นเอและอาร์เอ็นเอได้แก่ adenine (A) guanine (G) และ cytosine (C) ที่แตกต่างคือ thymine (T) พบเฉพาะในดีเอ็นเอ ส่วน uracil (U) พบเฉพาะในอาร์เอ็นเอ น้ำตาลที่พบในดีเอ็นเอเป็นดีออกซีไรโบสและน้ำตาลไรโบสพบในอาร์เอ็นเอ ส่วนหมู่ฟอสเฟตเป็นตัวกลางในการเชื่อมต่อระหว่างนิวคลีโอไทด์โมเลกุลหนึ่งกับอีกโมเลกุลหนึ่งโดยเกิดพันธะฟอสโฟไดเอสเทอร์ ทำให้สายดีเอ็นเอและอาร์เอ็นเอยาวขึ้น แหล่งข้อมูล สุรินทร์ ปิยะโชคณากุล. "โครงสร้างและหน้าที่ของดีเอ็นเอ" ในพันธุวิศวกรรมเบื้องต้น. หน้า 5-41. กรุงเทพฯ : สำนักพิมพ์มหาวิทยาลัยเกษตรศาสตร์, 2545. [วิทยาศาสตร์และเทคโนโลยี]
- ↑ Nelson DA, Tan TT, Rabson AB, Anderson D, Degenhardt K, White E (September 2004). "Hypoxia and defective apoptosis drive genomic instability and tumorigenesis". Genes & Development. 18 (17): 2095–107. doi:10.1101/gad.1204904. PMC 515288. PMID 15314031.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Merlo LM, Pepper JW, Reid BJ, Maley CC (December 2006). "Cancer as an evolutionary and ecological process". Nature Reviews Cancer. 6 (12): 924–35. doi:10.1038/nrc2013. PMID 17109012.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 67.0 67.1 "Metastatic Cancer: Questions and Answers". National Cancer Institute. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-08-27. สืบค้นเมื่อ 2008-08-28.
- ↑ "What is Metastasized Cancer?". National Comprehensive Cancer Network. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-07-07. สืบค้นเมื่อ 18 July 2013.
- ↑ Anguiano L, Mayer DK, Piven ML, Rosenstein D (Jul–Aug 2012). "A literature review of suicide in cancer patients". Cancer Nursing. 35 (4): E14–26. doi:10.1097/NCC.0b013e31822fc76c. PMID 21946906.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Varricchio, Claudette G. (2004). A cancer source book for nurses. Boston: Jones and Bartlett Publishers. p. 229. ISBN 0-7637-3276-1.
- ↑ "Cancer prevention: 7 steps to reduce your risk". Mayo Clinic. 27 September 2008. สืบค้นเมื่อ 30 January 2010.
- ↑ Danaei G, Vander Hoorn S, Lopez AD, Murray CJ, Ezzati M (2005). "Causes of cancer in the world: comparative risk assessment of nine behavioural and environmental risk factors". Lancet. 366 (9499): 1784–93. doi:10.1016/S0140-6736(05)67725-2. PMID 16298215.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Cancer". World Health Organization. สืบค้นเมื่อ 9 January 2011.
- ↑ 74.0 74.1 Wicki A, Hagmann, J (September 2011). "Diet and cancer". Swiss medical weekly. 141: w13250. doi:10.4414/smw.2011.13250. PMID 21904992.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Cappellani A, Di Vita M, Zanghi A, Cavallaro A, Piccolo G, Veroux M, Berretta M, Malaguarnera M, Canzonieri V, Lo Menzo E (2012). "Diet, obesity and breast cancer: an update". Front Biosci (Schol Ed). 4: 90–108. PMID 22202045.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Key TJ (January 2011). "Fruit and vegetables and cancer risk". Br. J. Cancer. 104 (1): 6–11. doi:10.1038/sj.bjc.6606032. PMC 3039795. PMID 21119663.
- ↑ Wang, X; Ouyang, Y; Liu, J; Zhu, M; Zhao, G; Bao, W; Hu, FB (29 July 2014). "Fruit and vegetable consumption and mortality from all causes, cardiovascular disease, and cancer: systematic review and dose-response meta-analysis of prospective cohort studies". BMJ (Clinical research ed.). 349: g4490. doi:10.1136/bmj.g4490. PMID 25073782.
- ↑ Larsson SC, Wolk A (May 2007). "Coffee consumption and risk of liver cancer: a meta-analysis". Gastroenterology. 132 (5): 1740–5. doi:10.1053/j.gastro.2007.03.044. PMID 17484871.
- ↑ Zheng W, Lee SA (2009). "Well-done meat intake, heterocyclic amine exposure, and cancer risk". Nutr Cancer. 61 (4): 437–46. doi:10.1080/01635580802710741. PMC 2769029. PMID 19838915.
- ↑ Ferguson LR (February 2010). "Meat and cancer". Meat Sci. 84 (2): 308–13. doi:10.1016/j.meatsci.2009.06.032. PMID 20374790.
- ↑ Holland Chp.33
- ↑ Rostom A, Dubé C, Lewin G, Tsertsvadze A, Barrowman N, Code C, Sampson M, Moher D (March 2007). "Nonsteroidal anti-inflammatory drugs and cyclooxygenase-2 inhibitors for primary prevention of colorectal cancer: a systematic review prepared for the U.S. Preventive Services Task Force". Annals of Internal Medicine. 146 (5): 376–89. doi:10.7326/0003-4819-146-5-200703060-00010. PMID 17339623.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rothwell PM, Fowkes FG, Belch JF, Ogawa H, Warlow CP, Meade TW (January 2011). "Effect of daily aspirin on long-term risk of death due to cancer: analysis of individual patient data from randomised trials". Lancet. 377 (9759): 31–41. doi:10.1016/S0140-6736(10)62110-1. PMID 21144578.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Cooper K, Squires H, Carroll C, Papaioannou D, Booth A, Logan RF, Maguire C, Hind D, Tappenden P (June 2010). "Chemoprevention of colorectal cancer: systematic review and economic evaluation". Health Technol Assess. 14 (32): 1–206. doi:10.3310/hta14320. PMID 20594533.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Thomsen A, Kolesar JM (December 2008). "Chemoprevention of breast cancer". Am J Health Syst Pharm. 65 (23): 2221–8. doi:10.2146/ajhp070663. PMID 19020189.
- ↑ Wilt TJ, MacDonald R, Hagerty K, Schellhammer P, Kramer BS (2008). Wilt, Timothy J (บ.ก.). "Five-alpha-reductase Inhibitors for prostate cancer prevention". Cochrane Database Syst Rev (2): CD007091. doi:10.1002/14651858.CD007091. PMID 18425978.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Vitamins and minerals: not for cancer or cardiovascular prevention". Prescrire Int. 19 (108): 182. August 2010. PMID 20939459.
- ↑ Giovannucci E, Liu Y, Rimm EB, Hollis BW, Fuchs CS, Stampfer MJ, Willett WC (April 2006). "Prospective study of predictors of vitamin D status and cancer incidence and mortality in men". J. Natl. Cancer Inst. 98 (7): 451–9. doi:10.1093/jnci/djj101. PMID 16595781.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Vitamin D Has Role in Colon Cancer Prevention". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2006-12-04. สืบค้นเมื่อ 27 July 2007.
- ↑ Schwartz GG, Blot WJ (April 2006). "Vitamin D status and cancer incidence and mortality: something new under the sun". J. Natl. Cancer Inst. 98 (7): 428–30. doi:10.1093/jnci/djj127. PMID 16595770.
- ↑ Fritz H, Kennedy D, Fergusson D, Fernandes R, Doucette S, Cooley K, Seely A, Sagar S, Wong R, Seely D (2011). Minna, John D (บ.ก.). "Vitamin A and retinoid derivatives for lung cancer: a systematic review and meta analysis". PLoS ONE. 6 (6): e21107. Bibcode:2011PLoSO...6E1107F. doi:10.1371/journal.pone.0021107. PMC 3124481. PMID 21738614.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ http://www.inmu.mahidol.ac.th/th/news/?id=4
- ↑ Cole BF, Baron JA, Sandler RS, Haile RW, Ahnen DJ, Bresalier RS, McKeown-Eyssen G, Summers RW, Rothstein RI, Burke CA, Snover DC, Church TR, Allen JI, Robertson DJ, Beck GJ, Bond JH, Byers T, Mandel JS, Mott LA, Pearson LH, Barry EL, Rees JR, Marcon N, Saibil F, Ueland PM, Greenberg ER (June 2007). "Folic acid for the prevention of colorectal adenomas: a randomized clinical trial". JAMA. 297 (21): 2351–9. doi:10.1001/jama.297.21.2351. PMID 17551129.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Vinceti, M; Dennert, G; Crespi, CM; Zwahlen, M; Brinkman, M; Zeegers, MP; Horneber, M; D'Amico, R; Del Giovane, C (Mar 30, 2014). "Selenium for preventing cancer". The Cochrane database of systematic reviews. 3: CD005195. doi:10.1002/14651858.CD005195.pub3. PMID 24683040.
- ↑ 95.0 95.1 95.2 "Cancer Vaccine Fact Sheet". NCI. 8 June 2006. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-10-25. สืบค้นเมื่อ 15 November 2008.
- ↑ 96.0 96.1 Lertkhachonsuk AA, Yip CH, Khuhaprema T, Chen DS, Plummer M, Jee SH, Toi M, Wilailak S (2013). "Cancer prevention in Asia: resource-stratified guidelines from the Asian Oncology Summit 2013". Lancet Oncology. 14 (12): e497-507. doi:10.1016/S1470-2045(13)70350-4. PMID 24176569.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 97.0 97.1 97.2 "What Is Cancer Screening?". National Cancer Institute.
- ↑ 98.0 98.1 98.2 Wilson JMG, Jungner G. (1968) Principles and practice of screening for disease. เก็บถาวร 2011-06-04 ที่ เวย์แบ็กแมชชีน Geneva:World Health Organization. Public Health Papers, #34.
- ↑ "Screening for Cervical Cancer". U.S. Preventive Services Task Force. 2003. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-12-23. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Colorectal Cancer". U.S. Preventive Services Task Force. 2008. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2015-02-07. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Skin Cancer". U.S. Preventive Services Task Force. 2009. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-01-08. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Oral Cancer". U.S. Preventive Services Task Force. 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-10-24. สืบค้นเมื่อ 2015-06-12.
- ↑ "Lung Cancer Screening". U.S. Preventive Services Task Force. 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-11-04. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Prostate Cancer". U.S. Preventive Services Task Force. 2008. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-12-31. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Bladder Cancer". U.S. Preventive Services Task Force. 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-08-23. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Testicular Cancer". U.S. Preventive Services Task Force. 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-05-15. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Ovarian Cancer". U.S. Preventive Services Task Force. 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-10-23. สืบค้นเมื่อ 2015-06-12.
- ↑ "Screening for Pancreatic Cancer". U.S. Preventive Services Task Force. 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-11-21. สืบค้นเมื่อ 2015-06-12.
- ↑ Chou, Roger; Croswell, Jennifer M.; Dana, Tracy; Bougatous, Christina; Blazina, Ian; Fu, Rongwei; Gleitsmann, Ken; Koenig, Helen C.; และคณะ (7 October 2011). "Screening for Prostate Cancer: A Review of the Evidence for the U.S. Preventive Services Task Force". United States Preventive Services Task Force. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-08-18. สืบค้นเมื่อ 8 October 2011.
- ↑ "Screening for Breast Cancer". U.S. Preventive Services Task Force. 2009. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-01-02. สืบค้นเมื่อ 2015-06-12.
- ↑ Gøtzsche PC, Nielsen M (2011). Gøtzsche, Peter C (บ.ก.). "Screening for breast cancer with mammography". Cochrane Database Syst Rev (1): CD001877. doi:10.1002/14651858.CD001877.pub4. PMID 21249649.
- ↑ 112.0 112.1 Gulati AP, Domchek, SM (Jan 2008). "The clinical management of BRCA1 and BRCA2 mutation carriers". Current oncology reports. 10 (1): 47–53. doi:10.1007/s11912-008-0008-9. PMID 18366960.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lind M.J., M.J. (2008). "Principles of cytotoxic chemotherapy". Medicine. 36 (1): 19–23. doi:10.1016/j.mpmed.2007.10.003.
- ↑ National Cancer Institute (Dec 2012). "Targeted Cancer Therapies". www.cancer.gov. สืบค้นเมื่อ 9 March 2014.
- ↑ "NCI: Targeted Therapy tutorials". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-10-04. สืบค้นเมื่อ 2015-06-15.
- ↑ 116.0 116.1 Holland Chp. 40
- ↑ Nastoupil, LJ; Rose, AC; Flowers, CR (May 2012). "Diffuse large B-cell lymphoma: current treatment approaches". Oncology (Williston Park, N.Y.). 26 (5): 488–95. PMID 22730604.
- ↑ Freedman, A (October 2012). "Follicular lymphoma: 2012 update on diagnosis and management". American journal of hematology. 87 (10): 988–95. doi:10.1002/ajh.23313. PMID 23001911.
- ↑ Rampling, R; James, A; Papanastassiou, V (June 2004). "The present and future management of malignant brain tumours: surgery, radiotherapy, chemotherapy". Journal of neurology, neurosurgery, and psychiatry. 75 Suppl 2 (Suppl 2): ii24–30. doi:10.1136/jnnp.2004.040535. PMC 1765659. PMID 15146036.
- ↑ Madan, V; Lear, JT; Szeimies, RM (February 20, 2010). "Non-melanoma skin cancer". Lancet. 375 (9715): 673–85. doi:10.1016/S0140-6736(09)61196-X. PMID 20171403.
- ↑ CK Bomford, IH Kunkler, J Walter. Walter and Miller’s Textbook of Radiation therapy (6th Ed), p311
- ↑ "Radiosensitivity" on GP notebook http://www.gpnotebook.co.uk/simplepage.cfm?ID=2060451853
- ↑ "Radiation therapy- what GPs need to know" on patient.co.uk http://www.patient.co.uk/showdoc/40002299/ เก็บถาวร 2012-04-19 ที่ เวย์แบ็กแมชชีน
- ↑ Hill, R; Healy, B; Holloway, L; Kuncic, Z; Thwaites, D; Baldock, C (21 March 2014). "Advances in kilovoltage x-ray beam dosimetry". Physics in medicine and biology. 59 (6): R183-231. doi:10.1088/0031-9155/59/6/r183. PMID 24584183.
- ↑ 125.0 125.1 Holland Chp. 41
- ↑ 126.0 126.1 126.2 126.3 126.4 American Society of Clinical Oncology. "Five Things Physicians and Patients Should Question" (PDF). Choosing Wisely: an initiative of the ABIM Foundation. American Society of Clinical Oncology. สืบค้นเมื่อ August 14, 2012
{{cite journal}}: CS1 maint: postscript (ลิงก์) - ↑
- The American Society of Clinical Oncology made this recommendation based on various cancers. See American Society of Clinical Oncology. "Five Things Physicians and Patients Should Question" (PDF). Choosing Wisely: an initiative of the ABIM Foundation. American Society of Clinical Oncology. สืบค้นเมื่อ August 14, 2012
{{cite journal}}: CS1 maint: postscript (ลิงก์) - for lung cancer, see Azzoli, CG; Temin, S; Aliff, T; Baker, S; Brahmer, J; Johnson, DH; Laskin, JL; Masters, G; Milton, D; Nordquist, L; Pao, W; Pfister, DG; Piantadosi, S; Schiller, JH; Smith, R; Smith, TJ; Strawn, JR; Trent, D; Giaccone, G; American Society of Clinical Oncology (2011). "2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer". Journal of clinical oncology : official journal of the American Society of Clinical Oncology. 29 (28): 3825–31. doi:10.1200/JCO.2010.34.2774. PMC 3675703. PMID 21900105. and Ettinger, DS; Akerley, W; Bepler, G; Blum, MG; Chang, A; Cheney, RT; Chirieac, LR; d'Amico, TA; Demmy, TL; Ganti, AK; Govindan, R; Grannis Jr, FW; Jahan, T; Jahanzeb, M; Johnson, DH; Kessinger, A; Komaki, R; Kong, FM; Kris, MG; Krug, LM; Le, QT; Lennes, IT; Martins, R; O'Malley, J; Osarogiagbon, RU; Otterson, GA; Patel, JD; Pisters, KM; Reckamp, K; Riely, GJ (2010). "Non-small cell lung cancer". Journal of the National Comprehensive Cancer Network : JNCCN. 8 (7): 740–801. PMID 20679538.
- for breast cancer, see Carlson, RW; Allred, DC; Anderson, BO; Burstein, HJ; Carter, WB; Edge, SB; Erban, JK; Farrar, WB; Goldstein, LJ; Gradishar, WJ; Hayes, DF; Hudis, CA; Jahanzeb, M; Kiel, K; Ljung, BM; Marcom, PK; Mayer, IA; McCormick, B; Nabell, LM; Pierce, LJ; Reed, EC; Smith, ML; Somlo, G; Theriault, RL; Topham, NS; Ward, JH; Winer, EP; Wolff, AC; NCCN Breast Cancer Clinical Practice Guidelines Panel (2009). "Breast cancer. Clinical practice guidelines in oncology". Journal of the National Comprehensive Cancer Network : JNCCN. 7 (2): 122–92. PMID 19200416.
- for colon cancer, see Engstrom, PF; Arnoletti, JP; Benson Ab, 3rd; Chen, YJ; Choti, MA; Cooper, HS; Covey, A; Dilawari, RA; Early, DS; Enzinger, PC; Fakih, MG; Fleshman Jr, J; Fuchs, C; Grem, JL; Kiel, K; Knol, JA; Leong, LA; Lin, E; Mulcahy, MF; Rao, S; Ryan, DP; Saltz, L; Shibata, D; Skibber, JM; Sofocleous, C; Thomas, J; Venook, AP; Willett, C; National Comprehensive Cancer Network (2009). "NCCN Clinical Practice Guidelines in Oncology: Colon cancer". Journal of the National Comprehensive Cancer Network : JNCCN. 7 (8): 778–831. PMID 19755046.
- for other general statements see Smith, Thomas J.; Hillner, Bruce E. (2011). "Bending the Cost Curve in Cancer Care". New England Journal of Medicine. 364 (21): 2060–5. doi:10.1056/NEJMsb1013826. PMID 21612477. and Peppercorn, J. M.; Smith, T. J.; Helft, P. R.; Debono, D. J.; Berry, S. R.; Wollins, D. S.; Hayes, D. M.; Von Roenn, J. H.; Schnipper, L. E.; American Society of Clinical Oncology (2011). "American Society of Clinical Oncology Statement: Toward Individualized Care for Patients with Advanced Cancer". Journal of Clinical Oncology. 29 (6): 755–60. doi:10.1200/JCO.2010.33.1744. PMID 21263086.
- The American Society of Clinical Oncology made this recommendation based on various cancers. See American Society of Clinical Oncology. "Five Things Physicians and Patients Should Question" (PDF). Choosing Wisely: an initiative of the ABIM Foundation. American Society of Clinical Oncology. สืบค้นเมื่อ August 14, 2012
- ↑ "NCCN Guidelines".
- ↑ "Clinical Practice Guidelines for Quality Palliative Care" (PDF). The National Consensus Project for Quality Palliative Care (NCP). คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2011-05-16. สืบค้นเมื่อ 2015-06-15.
- ↑ Levy MH, Back, A, Bazargan, S, Benedetti, C, Billings, JA, Block, S, Bruera, E, Carducci, MA, Dy, S, Eberle, C, Foley, KM, Harris, JD, Knight, SJ, Milch, R, Rhiner, M, Slatkin, NE, Spiegel, D, Sutton, L, Urba, S, Von Roenn, JH, Weinstein, SM, National Comprehensive Cancer Network (September 2006). "Palliative care. Clinical practice guidelines in oncology". Journal of the National Comprehensive Cancer Network: JNCCN. 4 (8): 776–818. PMID 16948956.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Waldmann, TA (March 2003). "Immunotherapy: past, present and future". Nature Medicine. 9 (3): 269–77. doi:10.1038/nm0303-269. PMID 12612576.
- ↑ Cassileth BR, Deng G (2004). "Complementary and alternative therapies for cancer". Oncologist. 9 (1): 80–9. doi:10.1634/theoncologist.9-1-80. PMID 14755017.
- ↑ What Is CAM? National Center for Complementary and Alternative Medicine. retrieved 3 February 2008.
- ↑ Vickers A (2004). "Alternative cancer cures: 'unproven' or 'disproven'?". CA Cancer J Clin. 54 (2): 110–8. doi:10.3322/canjclin.54.2.110. PMID 15061600.
- ↑ World Cancer Report 2014. World Health Organization. 2014. p. 22. ISBN 9283204298.
- ↑ 136.0 136.1 Rheingold, Susan; Neugut, Alfred; Meadows, Anna (2003). "156: Secondary Cancers: Incidence, Risk Factors, and Management". ใน Frei, Emil; Kufe, Donald W.; Holland, James F. (บ.ก.). Holland-Frei Cancer Medicine (6th ed.). Hamilton, Ont: BC Decker. p. 2399. ISBN 1-55009-213-8. สืบค้นเมื่อ 5 November 2009.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Montazeri A (December 2009). "Quality of life data as prognostic indicators of survival in cancer patients: an overview of the literature from 1982 to 2008". Health Qual Life Outcomes. 7: 102. doi:10.1186/1477-7525-7-102. PMC 2805623. PMID 20030832.
- ↑ Akl, EA; Kahale, LA; Ballout, RA; Barba, M; Yosuico, VE; van Doormaal, FF; Middeldorp, S; Bryant, A; Schünemann, H (10 December 2014). "Parenteral anticoagulation in ambulatory patients with cancer". The Cochrane database of systematic reviews. 12: CD006652. doi:10.1002/14651858.CD006652.pub4. PMID 25491949.
- ↑ "WHO Disease and injury country estimates". World Health Organization. 2009. สืบค้นเมื่อ 11 November 2009.
- ↑ 140.0 140.1 Lozano, R; Mohsen, N; Foreman, K; Lim, S; Shibuya, K; Aboyans, V; Abraham, J; Adair, T; Aggarwal, R; Ahn, SY; AlMazroa, MA; Alvarado, M; Anderson, HR; Anderson, LM; Andrews, KG; Atkinson, C; Baddour, LM; Barker-Collo, S; Bartels, DH; Bell, ML; Benjamin, EJ; Bennett, D; Bhalla, K; Bikbov, B; Bin Abdulhak, A; Birbeck, G; Blyth, F; Bolliger, I; Boufous, S; Bucello, C (Dec 15, 2012). "Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2095–128. doi:10.1016/S0140-6736(12)61728-0. PMID 23245604.
- ↑ WHO (October 2010). "Cancer". World Health Organization. สืบค้นเมื่อ 5 January 2011.
- ↑ 142.0 142.1 Coleman, William B. and Rubinas, Tara C. (2009). "4". ใน Tsongalis, Gregory J. and Coleman, William L. (บ.ก.). Molecular Pathology: The Molecular Basis of Human Disease. Amsterdam: Elsevier Academic Press. p. 66. ISBN 0-12-374419-9.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Johnson, George (28 December 2010). "Unearthing Prehistoric Tumors, and Debate". The New York Times.
- ↑ Pawelec G, Derhovanessian, E, Larbi, A (Aug 2010). "Immunosenescence and cancer". Critical reviews in oncology/hematology. 75 (2): 165–72. doi:10.1016/j.critrevonc.2010.06.012. PMID 20656212.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Alberts, B, Johnson A, Lewis J; และคณะ (2002). "The Preventable Causes of Cancer". Molecular biology of the cell (4th ed.). New York: Garland Science. ISBN 0-8153-4072-9.
A certain irreducible background incidence of cancer is to be expected regardless of circumstances: mutations can never be absolutely avoided, because they are an inescapable consequence of fundamental limitations on the accuracy of DNA replication, as discussed in Chapter 5. If a human could live long enough, it is inevitable that at least one of his or her cells would eventually accumulate a set of mutations sufficient for cancer to develop.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Anisimov VN, Sikora, E, Pawelec, G (Aug 2009). "Relationships between cancer and aging: a multilevel approach". Biogerontology. 10 (4): 323–38. doi:10.1007/s10522-008-9209-8. PMID 19156531.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ de Magalhaes JP (2013). "How ageing processes influence cancer". Nature Reviews Cancer. 13 (5): 357–65. doi:10.1038/nrc3497. PMID 23612461.
- ↑ Fraumeni, Joseph F.; Schottenfeld, David; Marshall, James M. (2006). Cancer epidemiology and prevention. Oxford [Oxfordshire]: Oxford University Press. p. 977. ISBN 0-19-514961-0.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bostwick, David G.; Eble, John N. (2007). Urological Surgical Pathology. St. Louis: Mosby. p. 468. ISBN 0-323-01970-6.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 150.0 150.1 Kaatsch P, Sikora, E, Pawelec, G (June 2010). "Epidemiology of childhood cancer". Cancer treatment reviews. 36 (4): 277–85. doi:10.1016/j.ctrv.2010.02.003. PMID 20231056.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 151.0 151.1 Ward, Elizabeth; DeSantis, Carol; Robbins, Anthony; Kohler, Betsy; Jemal, Ahmedin (January 2014). "Childhood and adolescent cancer statistics, 2014". CA: A Cancer Journal for Clinicians. 64: n/a–n/a. doi:10.3322/caac.21219. PMID 24488779.
- ↑ Ward EM, Thun, MJ, Hannan, LM, Jemal, A (Sep 2006). "Interpreting cancer trends". Annals of the New York Academy of Sciences. 1076: 29–53. Bibcode:2006NYASA1076...29W. doi:10.1196/annals.1371.048. PMID 17119192.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "เผยคนไทยเสียชีวิตด้วยโรคมะเร็งเกือบ 7 หมื่น มะเร็งปอดสูงสุด". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-01-19. สืบค้นเมื่อ 2008-02-03.
- ↑ "ข้อมูลทะเบียนมะเร็ง". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-08-22. สืบค้นเมื่อ 2012-09-17.
- ↑ "What Is Cancer?". National Cancer Institute. สืบค้นเมื่อ 17 August 2009.
- ↑ "Cancer Fact Sheet". Agency for Toxic Substances & Disease Registry. 30 August 2002. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-08-13. สืบค้นเมื่อ 17 August 2009.
- ↑ Wanjek, Christopher (16 September 2006). "Exciting New Cancer Treatments Emerge Amid Persistent Myths". สืบค้นเมื่อ 17 August 2009.
- ↑ Hayden EC, Thun, MJ, Hannan, LM, Jemal, A (April 2009). "Cutting off cancer's supply lines". Nature. 458 (7239): 686–687. doi:10.1038/458686b. PMID 19360048.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bagri, A; Kouros-Mehr, Hosein; Leong, KG; Plowman, GD (Mar 2010). "Use of anti-VEGF adjuvant therapy in cancer: challenges and rationale". Trends in molecular medicine. 16 (3): 122–32. doi:10.1016/j.molmed.2010.01.004. PMID 20189876.
- ↑ Sleigh SH, Barton CL (2010). "Repurposing Strategies for Therapeutics". Pharm Med. 24 (3): 151–159. doi:10.2165/11536770-000000000-00000.
- ↑ Winther H, Jorgensen JT (2010). "Drug-Diagnostic Co-Development in Cancer". Pharm Med. 24 (6): 363–375. doi:10.2165/11586320-000000000-00000.
- ↑ Sharon Begley (16 September 2008). "Rethinking the War on Cancer". Newsweek. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-09-10. สืบค้นเมื่อ 8 September 2008.
- ↑ Kolata, Gina (23 April 2009). "Advances Elusive in the Drive to Cure Cancer". The New York Times. สืบค้นเมื่อ 5 May 2009.
- ↑ Bruce Albertsa, Marc W. Kirschnerb, Shirley Tilghmanc, and Harold Varmus, Rescuing US biomedical research from its systemic flaws, Proceedings of the National Academy of Sciences of the United States of America, vol. 111 no. 16, April 2014
- ↑ Kolata, Gina (April 23, 2009). "Advances Elusive in the Drive to Cure Cancer". The New York Times. สืบค้นเมื่อ 2009-12-29.
- ↑ Kolata, Gina (June 27, 2009). "Grant System Leads Cancer Researchers to Play It Safe". The New York Times. สืบค้นเมื่อ 2009-12-29.
- ↑ Leaf, Clifton (2004-03-22). "Why We're Losing The War On Cancer". Fortune Magazine (CNN Money).
- ↑ 168.00 168.01 168.02 168.03 168.04 168.05 168.06 168.07 168.08 168.09 Connie Henke Yarbro, Debra Wujcik, Barbara Holmes Gobel, บ.ก. (2011). Cancer nursing: principles and practice (7 ed.). Jones & Bartlett Publishers. pp. 901–905. ISBN 978-1-4496-1829-2.
{{cite book}}: CS1 maint: multiple names: editors list (ลิงก์) - ↑ "กลุ่มงานโภชนวิทยา สถาบันมะเร็งแห่งชาติ". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-06-27. สืบค้นเมื่อ 2012-11-11.
- ↑ "โภชนาการกับโรคมะเร็ง สถาบันมะเร็งแห่งชาติ". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-08-30. สืบค้นเมื่อ 2012-09-22.