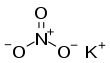ดินประสิว

| |||
| |||
| ชื่อ | |||
|---|---|---|---|
| IUPAC name
Potassium nitrate
| |||
| ชื่ออื่น | |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| ChEMBL | |||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.028.926 | ||
| EC Number |
| ||
| เลขอี | E252 (preservatives) | ||
| KEGG | |||
ผับเคม CID
|
|||
| RTECS number |
| ||
| UNII | |||
| UN number | 1486 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| คุณสมบัติ | |||
| KNO3 | |||
| มวลโมเลกุล | 101.1032 กรัม/โมล | ||
| ลักษณะทางกายภาพ | ของแข็งสีขาว | ||
| กลิ่น | ไม่มีกลิ่น | ||
| ความหนาแน่น | 2.109 กรัม/ลูกบาศก์เซนติเมตร (16 °C) | ||
| จุดหลอมเหลว | 334 องศาเซลเซียส (633 องศาฟาเรนไฮต์; 607 เคลวิน) | ||
| จุดเดือด | 400 องศาเซลเซียส (752 องศาฟาเรนไฮต์; 673 เคลวิน) (เน่าเปื่อย) | ||
| 133 กรัม/น้ำ 1000 กรัม (0 °C) 316 กรัม/น้ำ 1000 กรัม (20 °C) 383 กรัม/น้ำ 1000 กรัม (25 °C) 2439 กรัม/น้ำ 1000 กรัม (100 °C)[3] | |||
| ความสามารถละลายได้ | ค่อนข้างละลายน้ำในเอธานอล ละลายน้ำในกลีเซอรอล, แอมโมเนีย | ||
| Basicity (pKb) | 15.3[4] | ||
| −33.7·10−6 ลูกบาศก์เซนติเมตร/โมล | |||
ดัชนีหักเหแสง (nD)
|
1.335, 1.5056, 1.5604 | ||
| โครงสร้าง | |||
| Orthorhombic, Aragonite | |||
| อุณหเคมี | |||
ความจุความร้อน (C)
|
95.06 จูล/โมล K | ||
Std enthalpy of
formation (ΔfH⦵298) |
-494.00 กิโลจูล/โมล | ||
| ความอันตราย | |||
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |||
อันตรายหลัก
|
ตัวออกซิไดซ์ เป็นอันตรายถ้ากลืน หายใจเข้า หรือดูดซึมเข้าผิวหนัง สร้างความระคายเคืองบนผิวหนังและตา | ||
| GHS labelling: | |||
 
| |||
| H272, H315, H319, H335 | |||
| P102, P210, P220, P221, P280 | |||
| NFPA 704 (fire diamond) | |||
| จุดวาบไฟ | ไม่ติดไฟ (ออกซิไดซ์) | ||
| ปริมาณหรือความเข้มข้น (LD, LC): | |||
LD50 (median dose)
|
1901 มิลลิกรัม/กิโลกรัม (ปาก, กระต่าย) 3750 มิลลิกรัม/กิโลกรัม (ปาก, หนู)[5] | ||
| เอกสารข้อมูลความปลอดภัย (SDS) | ICSC 0184 | ||
| สารประกอบอื่นที่เกี่ยวข้องกัน | |||
แอนไอออนอื่น ๆ
|
โพแทสเซียมไนไตรต์ | ||
แคทไอออนอื่น ๆ
|
ลิเทียมไนไตรต์ โซเดียมไนไตรต์ รูบิเดียมไนไตรต์ ซีเซียมไนไตรต์ | ||
สารประกอบที่เกี่ยวข้อง
|
โพแทสเซียมซัลเฟต โพแทสเซียมคลอไรด์ | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
ดินประสิว หรือ โพแทสเซียมไนเตรต (อังกฤษ: potassium nitrate) เป็นสารประกอบที่มีสูตรเคมีเป็น KNO
3 มีจำนวนอะตอมอยู่ 5 อะตอม เป็นดินที่เป็นกรดเกิดจากมูลของค้างคาว โดยการที่นำเอามูลค้างคาวมาต้มเคี่ยว แล้วทิ้งไว้ให้เย็น จะมีเกล็ดสีขาวเกาะอยู่ เรียกว่า “ดินประสิวขาว” ส่วนดินประสิวตามร้านสมุนไพรทั่ว ๆ ไปนั้นจะมีจุดสีเหลือง ๆ สีดำ ๆ แสดงว่าทำยังไม่สะอาดดี การกลั่นกรองยังใช้ไม่ดี
ประโยชน์
[แก้]ดินประสิวที่ทางภาคเหนือนั้นจะขาว นำมาเป็นส่วนผสมของดอกไม้เพลิง ใช้ทำดินปืน ทำดอกไม้เพลิง หรือใช้ใส่อาหารหมักดอง เช่น พวกปลาร้า ปลาเจ่า หมูแหนม ซึ่งกระทรวงสาธารณสุขอนุญาตให้ผสมในอาหารได้ในปริมาณที่กำหนด คือ ใช้ไนเตรทได้ไม่เกิน 500 มิลลิกรัมต่ออาหาร 1 กิโลกรัม และไนไตรท์ไม่เกิน 125 มิลลิกรัมต่ออาหาร 1 กิโลกรัม เพื่อป้องกันไม่ให้อาหารบูดเน่า ช่วยระงับการเจริญเติบโตของเชื้อคลอสตริเดียม โบทูไลนัม หรือ เพื่อรักษาสีของเนื้อสัตว์ให้ดูใหม่สด [6]
ในธุรกิจอาหารจะใช้ดินประสิวเป็นสารกันบูดและสารถนอมสีเนื้อสัตว์ให้ดูสดอยู่เสมอ ความจริงแล้วผลของการกันบูดกันเสียนั้น สำคัญอยู่ที่อนุพันธ์ไนเตรต ดังนั้นในการถนอมอาหาร จึงสามารถใช้ไนเตรตในรูปอื่นด้วย คือ โซเดียมไนเตรต และนอกจากไนเตรตแล้ว ยังมีสารอีกชนิดหนึ่งที่คนชอบใช้เป็นสารกันบูดก็คือไนไตรต์ แต่ด้วยคุณสมบัติของไนเตรตและไนไตรต์ที่สามารถรักษาสีของเนื้อสัตว์ให้ดูสดอยู่ เสมอได้ โดยการทำปฏิกิริยากับสีของเม็ดเลือดแดง ทำให้สีคงทนอยู่ได้นานนี้ เป็นสาเหตุให้พ่อค้าแม่ค้าที่ไม่รู้ถึงอันตราย ที่อาจจะเกิดขึ้น หรืออาจจะด้วยความเห็นแก่ตัว เห็นแก่เงินต้องการขายสินค้าของตัวเองให้ได้มาก ๆ จึงใส่ดินประสิวหรือไนเตรตและสารไนไตรต์ในปริมาณสูงลงในอาหารเพื่อปกปิดสภาพ ที่แท้จริงของอาหารให้อาหารอย่างพวกเนื้อเค็ม ปลาเค็ม กุนเชียง ไส้กรอก เบคอน แหนมเป็นสีแดงสวยแม้จะค้างนานวันก็ตาม จากการสุ่มตัวอย่าง เคยตรวจพบ เนื้อเค็ม เนื้อสวรรค์ ไส้กรอก ไตปลาดิบ มีสารไนเตรตและไนไตรต์ในปริมาณที่สูงมากเกินปริมาณที่กระทรวงสาธารณสุขของไทยกำหนดให้ใช้ จุดประสงค์ที่ทางคณะกรรมการอาหารและยาอนุญาตให้ใช้สารในกลุ่มนี้ได้ เนื่องจากสารกลุ่มนี้มีคุณสมบัติใน การป้องกันการเจริญของเชื้อแบคทีเรียได้หลายชนิด โดยเฉพาะป้องกันการเจริญของเชื้อคลอสตริเดียมโบทูลินัม ซึ่งเชื้อนี้สามารถสร้างสารพิษโบทูลิน ที่มีอันตรายร้ายแรงมาก เชื้อโรคชนิดนี้มักเจริญเติบโตในอาหารที่เก็บในภาชนะปิดสนิทอากาศผ่านเข้าออกไม่ได้ เช่น อาหารกระป๋อง[7]
ในตำรายาโบราณเรียกเกลือสุรจระ ซึ่งนำเข้ามาจากประเทศอินเดีย โดยนำดินที่มีโพแทสเซียมไนเตรตปนอยู่มาต้ม กรอง แล้วเคี่ยวให้แห้ง ใช้เป็นยาขับลม ถอนพิษ ถ้านำมาจากมูลค้างคาวเรียกดินประสิว[8]
โทษ
[แก้]ดินประสิวเป็นสารก่อมะเร็ง[ต้องการอ้างอิง] สามารถทำปฏิกิริยากับสารเอมีน (amine) ในปลาหรือในร่างกายของมนุษย์ โดยมีน้ำย่อยในกระเพาะอาหารเป็นตัวช่วยทำให้เกิดสารประกอบหลายชนิดที่มีโครงสร้างคล้ายกัน เรียกว่า "ไนโตรซามีน" สารเหล่านี้บางชนิดไม่มีอันตรายต่อสุขภาพ แต่บางชนิดจะร้ายแรงมากทำให้เป็นมะเร็งได้ ถ้ารับประทานไนเตรตเข้าไปมาก ๆ อาจทำให้เกิดอาการท้องร่วงรุนแรงมาก อาจเกิดอาการตัวเขียว หายใจไม่ออกได้ โดยเฉพาะอย่างยิ่งเด็ก ๆ จะยิ่งไวต่อสารเคมีชนิดนี้มากกว่าผู้ใหญ่
ปัจจุบัน ยังพบว่าสารไนไตรต์สามารถจะทำปฏิกิริยากับสารประกอบบางอย่างในอาหาร และสิ่งแวดล้อมโดยทั่วไป แล้วเกิดเป็นสารประกอบชนิดใหม่ขึ้น เรียกว่าสารไนโตรซามีนซึ่งเป็นสารเคมีกลุ่มที่อาจทำให้เกิดเป็นมะเร็งใน อวัยวะต่าง ๆ ของร่างกายได้ การเกิดไนโตรซามีนนั้นอาจเกิดมาจากไนเตรต เปลี่ยนเป็นไนไตรต์ โดยเชื้อแบคทีเรียบางชนิด แล้วไนไตรต์ก็จะทำปฏิกิริยากับอามีนที่มีอยู่ในเนื้อสัตว์บางชนิด โดยเฉพาะอย่างยิ่งในสภาวะที่เป็นกรด จะเกิดปฏิกิริยาได้ไนโตรซามีน ซึ่งเป็นสารที่ก่อมะเร็งได้อย่างรวดเร็วในระยะหลังพบว่าไนโตรซามีนสามารถ เกิดขึ้นได้ในร่างกาย โดยเฉพาะในกระเพาะอาหารที่มีสภาวะเป็นกรด เมื่อเราได้รับไนเตรตเข้าไปในร่างกายแล้ว ภายใน 1-2 ชม. ร่างกายขับไนเตรตและบางส่วนเปลี่ยนเป็นไนไตรต์ออกมาทางน้ำลายสูง เมื่อเรากลืนน้ำลายผสมกับอาหารที่มีอามีนสูงก็จะเกิดปฏิกิริยาในกระเพาะอาหาร ได้ ดังนั้นถ้าเรากินอาหาร ที่มีดินประสิวหรือไนเตรตและสารไนไตรต์สูง แล้วกินอาหารที่มีอามีนในมื้อถัดไปก็จะได้รับ ไนโตรซามีนที่เกิดขึ้นในกระเพาะอาหารได้
อ้างอิง
[แก้]- ↑ Record of Potassium nitrate in the GESTIS Substance Database of the Institute for Occupational Safety and Health, accessed on 2007-03-09.
- ↑ Gustafson, A. F. (1949). Handbook of Fertilizers - Their Sources, Make-Up, Effects, And Use. p. 25. ISBN 9781473384521. เก็บจากแหล่งเดิมเมื่อ 2017-02-17.
- ↑ B. J. Kosanke; B. Sturman; K. Kosanke; I. von Maltitz; T. Shimizu; M. A. Wilson; N. Kubota; C. Jennings-White; D. Chapman (2004). "2". Pyrotechnic Chemistry. Journal of Pyrotechnics. pp. 5–6. ISBN 978-1-889526-15-7. เก็บจากแหล่งเดิมเมื่อ 2016-05-05.
- ↑ Kolthoff, Treatise on Analytical Chemistry, New York, Interscience Encyclopedia, Inc., 1959.
- ↑ chem.sis.nlm.nih.gov เก็บถาวร 2014-08-12 ที่ เวย์แบ็กแมชชีน
- ↑ "ไนเตรทและไนไตรท์". กรมวิทยาศาสตร์การแพทย์. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-11-14. สืบค้นเมื่อ 24 กุมภาพันธ์ พ.ศ. 2555.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ "อาหารที่มีดินประสิว". Healthy Canpus. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-03-11. สืบค้นเมื่อ 24 กุมภาพันธ์ พ.ศ. 2555.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|accessdate=(help) - ↑ ชยันต์ พิเชียรสุนทร และ วิเชียร จีรวงศ์. คู่มือเภสัชกรรมแผนไทยเล่ม 4 เครื่องยาธาตุวัตถุ. พิมพ์ครั้งที่ 2. กทม. อัมรินทร์พริ้นติ้งแอนด์พับลิชชิ่ง. 2556. หน้า 58 - 60
บรรณานุกรม
[แก้]- Barnum, Dennis W. (December 2003). "Some History of Nitrates". Journal of Chemical Education. 80 (12): 1393. Bibcode:2003JChEd..80.1393B. doi:10.1021/ed080p1393.
- David Cressy. Saltpeter: The Mother of Gunpowder (Oxford University Press, 2013) 237 pp online review by Robert Tiegs
- Alan Williams. "The production of saltpeter in the Middle Ages", Ambix, 22 (1975), pp. 125–33. Maney Publishing, ISSN 0002-6980.