โรคฮันติงตัน
| โรคฮันติงตัน (Huntington's disease) | |
|---|---|
| ชื่ออื่น | Huntington's chorea, Saint Vitus' dance[1] |
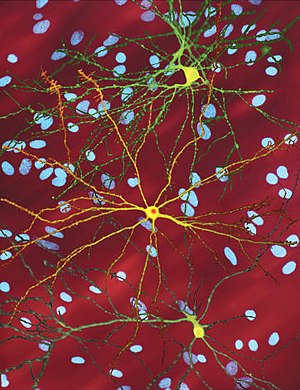 | |
| ภาพจากกล้องจุลทรรศน์แสดงให้เห็น medium spiny neuron (สีเหลือง) ซึ่งมีอินคลูชันบอดี้ในนิวเคลียส เป็นลักษณะบ่งบอกว่ากำลังมีการดำเนินของโรคอยู่ ภาพนี้มีความกว้าง 360 ไมโครเมตร | |
| สาขาวิชา | Neurology |
| อาการ | Problems with mood, mental abilities, coordination, jerky body movements[2][3] |
| ภาวะแทรกซ้อน | Pneumonia, heart disease, physical injury from falls, suicide[4] |
| การตั้งต้น | 30–50 ปี[5] |
| ระยะดำเนินโรค | ระยะยาว[5] |
| สาเหตุ | Genetic (inherited or new mutation)[5] |
| วิธีวินิจฉัย | Genetic testing[6] |
| โรคอื่นที่คล้ายกัน | Sydenham's chorea, benign hereditary chorea, lupus, paraneoplastic syndrome, Wilson's disease[7] |
| การรักษา | Supportive care[3] |
| ยา | Tetrabenazine[4] |
| พยากรณ์โรค | 15–20 ปีจากการวินิจฉัย[5] |
| ความชุก | 4–15 in 100,000 (European descent)[2] |
| การเสียชีวิต | 40 (2019) |
โรคฮันติงตัน (อังกฤษ: Huntington's disease / chorea / disorder) เป็นโรคทางพันธุกรรมโรคหนึ่งที่ทำให้เกิดการเสื่อมของระบบประสาท ส่งผลต่อการควบคุมการประสานงานของกล้ามเนื้อ ทำให้สติปัญญาเสื่อมถอย และนำไปสู่ภาวะสมองเสื่อมได้ ส่วนใหญ่ปรากฏอาการในช่วงวัยกลางคน เป็นโรคที่เป็นสาเหตุทางพันธุกรรมที่พบบ่อยที่สุดของภาวะการเคลื่อนไหวผิดปกติที่เรียกว่าโคเรีย และพบในคนเชื้อชาติยุโรปตะวันตกมากกว่าเอเชียหรือแอฟริกา เกิดจากการกลายพันธุ์ในยีนฮันติงตินยีนหนึ่งในสองยีนในร่างกาย ซึ่งมีการถ่ายทอดลักษณะแบบลักษณะเด่น ดังนั้นทายาทของผู้ป่วยโรคนี้มีโอกาสได้รับถ่ายทอดโรคนี้มา 50% ในบางกรณีที่ทั้งบิดาและมารดามียีนที่เป็นโรคคนละหนึ่งในสองยีน ทายาทจะมีโอกาสเป็นโรค 75% และหากมีบิดาหรือมารดามียีนที่เป็นโรคสองยีน ทายาทก็จะมีโอกาสติดโรค 100% อาการทางกายของโรคฮันติงตันอาจเริ่มปรากฏได้ตั้งแต่วัยทารกไปจนถึงวัยชรา แต่ส่วนใหญ่จะปรากฏในช่วงอายุ 35-44 ปี ผู้ป่วยประมาณ 6% เริ่มมีอาการตั้งแต่ก่อนอายุ 21 ปี โดยมีกลุ่มอาการกล้ามเนื้อเกร็งและเริ่มต้นเคลื่อนไหวลำบาก ซึ่งผู้ป่วยกลุ่มนี้อาการจะทรุดลงรวดเร็วเกือบทุกคน โรคฮันติงตันที่แสดงอาการเช่นนี้เรียกว่าโรคฮันติงตันวัยเด็ก (อังกฤษ: juvenile) หรือกล้ามเนื้อเกร็งเคลื่อนไหวลำบาก (อังกฤษ: akinetic-rigid) หรือชนิดเวสท์ฟาล (อังกฤษ: Westphal varient)
ยีนฮันติงตินเก็บข้อมูลทางพันธุกรรมสำหรับสร้างโปรตีนชื่อว่าฮันติงติน การกลายพันธุ์ของยีนฮันฮิงตินนี้ทำให้มีการสร้างโปรตีนซึ่งผิดปกติออกมา ซึ่งทำให้เกิดการเสื่อมลงอย่างช้าๆ ในบางบริเวณของสมอง กลไกของการเสื่อมที่เกิดจากการสร้างโปรตีนนี้ยังไม่เป็นที่เข้าใจอย่างสมบูรณ์ ปัจจุบันมีการตรวจทางพันธุกรรมที่สามารถพบการกลายพันธุ์ของยีนนี้ได้ในทุกระยะของการเจริญ รวมถึงก่อนเริ่มมีอาการด้วย ทำให้เป็นประเด็นถกเถียงทางจริยธรรมว่าผู้สงสัยเป็นโรคนั้นควรได้รับการตรวจหายีนก่อโรคเมื่ออายุเท่าไรจึงจะเหมาะสม สิทธิของบิดามารดาในการตรวจหาโรคในบุตร และการรักษาความลับของผลตรวจนั้นๆ มีการพัฒนาการให้คำปรึกษาทางพันธุกรรมเพื่อที่จะให้ข้อมูลและช่วยเหลือผู้ที่ต้องการตรวจหาโรคนี้ และกลายเป็นต้นแบบในการให้คำปรึกษาทางพันธุกรรมสำหรับโรคทางพันธุกรรมอื่นๆ ที่มีลักษณะการถ่ายทอดแบบลักษณะเด่นเช่นเดียวกัน
อาการของโรคในผู้ป่วยแต่ละคนอาจแตกต่างกันได้มาก บางครั้งผู้ป่วยในครอบครัวเดียวกันก็อาจมีอาการแตกต่างกันอย่างมากได้ แต่ผู้ป่วยส่วนใหญ่จะมีอาการแย่ลงเรื่อยๆ อาการแรกเริ่มโดยทั่วไปจะเป็นอาการของกล้ามเนื้อเสียการประสานงานและเดินไม่มั่นคง เมื่อโรคดำเนินไปอาการกล้ามเนื้อเสียการประสานงานและการเคลื่อนไหวผิดปกติจะเด่นชัดขึ้น พร้อมๆ กับที่มีกรสูญเสียความสามารถทางจิตใจ สติปัญญา และพฤติกรรม รวมทั้งอาจมีอาการทางจิตเวชได้ด้วย ความสามารถทางกายจะค่อยๆ เสื่อมลงจนในที่สุดการเคลื่อนไหวง่ายๆ ก็อาจกลายเป็นเรื่องยาก ความสามารถทางจิตใจอาจเสื่อมลงจนเข้าสู่ภาวะสมองเสื่อม อาจเกิดภาวะแทรกซ้อนต่างๆ เช่น ปอดบวม โรคหัวใจ อุบัติเหตุจากการพลัดตกหกล้ม จนทำให้อายุขัยสั้นลงอยู่ที่ประมาณ 20 ปีหลังเริ่มมีอาการ ปัจจุบันโรคฮันติงตันยังไม่มีวิธีรักษา ผู้ป่วยระยะท้ายของโรคจำเป็นต้องได้รับการดูแลช่วยเหลือตลอดเวลา แต่ระยะหลังเริ่มมีการรักษาใหม่ๆ ที่บรรเทาอาการบางอย่างของโรคได้
มีการก่อตั้งองค์กรช่วยเหลือตนเองสำหรับผู้ป่วยโรคฮันติงตันเป็นครั้งแรกในช่วงคริสต์ทศวรรษ 1960 และเพิ่มจำนวนมากขึ้นเรื่อยๆ ซึ่งองค์กรเหล่านี้จำนวนมากดำเนินการในด้านการให้ข้อมูลและสร้างความตื่นตัวให้กับสังคม ให้ความช่วยเหลือกับผู้ป่วยและครอบครัว และสนับสนุนการศึกษาวิจัยที่เกี่ยวข้อง มูลนิธิโรคที่สืบทอดทางพันธุกรรม (The Hereditary Disease Foundation) เป็นกลุ่มศึกษาวิจัยกลุ่มหนึ่งที่แตกยอดออกมาจากองค์กรให้ความช่วยเหลือที่ก่อตั้งขึ้นเป็นองค์กรแรกๆ ได้มีบทบาทในการค้นหายีนก่อโรคใน ค.ศ. 1993 ซึ่งหลังจากการค้นพบนี้แล้วก็มีการค้นพบสำคัญๆ ออกมาอย่างต่อเนื่องทุกๆ 2-3 ปี ทำให้องค์ความรู้เกี่ยวกับโรคฮันติงตันมีการพัฒนาอย่างต่อเนื่อง แนวทางการศึกษาวิจัยในปัจจุบันส่วนหนึ่งเน้นศึกษาหากลไกที่แท้จริงของการเกิดโรค พัฒนาสัตว์ทดลองที่เหมาะสมกับการศึกษาวิจัย ดำเนินการวิจัยเชิงทดลองทางคลินิกของยาที่รักษาอาการหรือชะลอการดำเนินโรค และศึกษาวิธีการรักษาใหม่ๆ อย่างเช่นการนำเซลล์ต้นกำเนิดมาใช้ในการรักษา โดยมีเป้าหมายเพื่อซ่อมแซมความเสียหายที่เกิดจากโรคนี้
อาการและอาการแสดง
[แก้]ส่วนใหญ่ผู้ป่วยโรคฮันติงตันมักเริ่มมีอาการในช่วงอายุ 35-44 ปี แต่ก็สามารถเริ่มมีอาการได้ในทุกช่วงอายุตั้งแต่วัยทารกไปจนถึงวัยชรา[8][9] ในระยะแรกๆ ของโรคผู้ป่วยอาจมีการเปลี่ยนแปลงเล็กน้อยทางด้านบุคลิกภาพ สติปัญญา และทักษะทางกาย[8] ส่วนใหญ่อาการที่มักได้รับการสังเกตเป็นอันดับแรกๆ คืออาการทางกาย เนื่องจากอาการทางสติปัญญาและทางจิตใจมักไม่เป็นรุนแรงมากจนเป็นที่สังเกตได้ในระยะแรกๆ ของโรค[8] เมื่อโรคดำเนินไปมากขึ้นผู้ป่วยโรคฮันติงตันเกือบทุกคนจะมีอาการทางกายที่คล้ายคลึงกัน แต่อาการแรกเริ่ม ช่วงเวลาที่เริ่มมีอาการ ความเร็วในการดำเนินโรค และระดับของความบกพร่องในด้านสติปัญญาและจิตใจนั้นแตกต่างกันมากในผู้ป่วยแต่ละคน[10][11]
อาการแรกเริ่มที่มีลักษณะเฉพาะตัวคือ การมีการเคลื่อนไหวผิดปกติแบบกระตุก เป็นขึ้นโดยฉับพลันไม่มีสัญญาณเตือนล่วงหน้าและควบคุมไม่ได้ เรียกว่าโคเรีย[8] อาการแรกเริ่มของโคเรียนี้อาจเป็นเพียงความรู้สึกอยู่ไม่สุขที่ไม่มีลักกษณะเฉพาะใดๆ อาจเป็นการเคลื่อนไหวที่ไม่มีความหมายพิเศษเกิดขึ้นเป็นช่วงสั้นๆ โดยไม่ได้ตั้งใจ อาจเป็นการที่ไม่สามารถควบคุมการเคลื่อนไหวให้แม่นยำได้ หรืออาจมี saccadic eye movement ที่ช้าลง[8] อาการผิดปกติของระบบกล้ามเนื้อนี้ส่วนใหญ่แล้วจะพบเกิดขึ้นก่อนอาการของความผิดปกติของการเคลื่อนไหวที่เห็นได้ชัดเจนอื่นๆ เป็นเวลาอย่างน้อย 3 ปี[10] โดยอาการที่ชัดเจนเช่นอาการกล้ามเนื้อแข็งเกร็ง การเคลื่อนไหวบิดงอ หรือมีกล้ามเนื้อแข็งเกร็งในท่าผิดปกติ จะพบได้เมื่อโรคดำเนินไปมากขึ้น[12] อาการแสดงเหล่านี้เกิดจากการที่สมองส่วนที่ควบคุมการเคลื่อนไหวได้รับความเสียหาย[13] การทำงานของระบบควบคุมการเคลื่อนไหวจะค่อยๆ เสื่อมลงเรื่อยๆ จนถึงที่สุดแล้วการเคลื่อนไหวใดๆ ที่ปกติจะต้องอยู่ภายใต้การควบคุมของจิตใจ จะได้รับผลกระทบไปทั้งหมด ผลที่มักพบตามมาคืออาการทรงตัวลำบาก แสดงสีหน้าผิดปกติ เคี้ยวลำบาก กลืนลำบาก และพูดลำบาก[12] อาการกินลำบากเหล่านี้มักทำให้ผู้ป่วยมีน้ำหนักลดและมีภาวะขาดสารอาหารตามมา[14][15] อาการอื่นที่พบได้เช่นความผิดปกติของการนอนหลับ[16] โรคฮันติงตันชนิดวัยเด็กจะมีอาการแตกต่างออกไปโดยจะมีการดำเนินโรคที่เร็วกว่ามาก อาจมีอาการโคเรียเพียงแค่ช่วงสั้นๆ หรือไม่มีเลย และเริ่มปรากฏอาการกล้ามเนื้อแข็งเกร็งอย่างรวดเร็ว โรคฮันติงตันชนิดนี้ยังอาจพบอาการชักได้บ่อยอีกด้วย[12]
| กระสับกระส่าย | 38–73% |
| ไร้อารมณ์ | 34–76% |
| วิตกกังวล | 34–61% |
| ซึมเศร้า | 33–69% |
| ย้ำคิดย้ำทำ | 10–52% |
| จิตเภท | 3–11% |
ระดับสติปัญญาจะค่อยๆ เสื่อมถอยลง[13] โดยเฉพาะความสามารถด้านการควบคุมที่ใช้สติปัญญา เช่น การวางแผน ความยืดหยุ่นทางสติปัญญา ความคิดเชิงนามธรรม การทำความเข้าใจและปฏิบัติตามกฎระเบียบ การแสดงพฤติกรรมที่เหมาะสม และการยับยั้งพฤติกรรมที่ไม่เหมาะสม[13] เมื่อโรคดำเนินไปมากขึ้นจะเริ่มมีความเสียหายของความจำ มีรายงานของระดับความเสียหายของความทรงจำตั้งแต่การสูญเสียความจำระยะสั้นไปจนถึงการสูญเสียความทรงจำระยะยาว รวมไปถึงสูญเสีย episodic memory, procedural memory (ความสามารถในการทำกิจกรรมต่างๆ) และความทรงจำที่ใช้ในการทำงาน[13] ปัญหาทางสติปัญญาจะค่อยๆ เป็นมากขึ้นๆ สุดท้ายแล้วอาจเป็นถึงภาวะสมองเสื่อม[13] แบบแผนของการเสื่อมเช่นนี้ถูกเรียกว่า subcortical dementia syndrome (กลุ่มอาการสมองเสื่อมจากใต้เปลือกสมอง) เพื่อแยกจากอาการที่เกิดจากสมองเสื่อมจากเปลือกสมองของโรคอื่นๆ เช่น โรคอัลไซเมอร์[13]
อาการทางจิตที่มีการรายงานได้แก่ วิตกกังวล ซึมเศร้า ไม่แสดงอารมณ์ เห็นแก่ตัว (egocentric) ก้าวร้าว และย้ำคิดย้ำทำ ซึ่งอาการย้ำคิดย้ำทำนี้อาจนำไปสู่อาการเสพติดอื่นๆ เช่น ติดเหล้า ติดการพนัน และติดเพศสัมพันธ์[17] นอกจากนี้ยังมีรายงานถึงการไม่สามารถสังเกตว่าอีกฝ่ายกำลังมีความรู้สึกทางลบอยู่อีกด้วย[13] ความชุกของอาการเหล่านี้มีความแตกต่างกันมากระหว่างการศึกษาวิจัยแต่ละครั้ง โดยรวมแล้วประมาณว่ามีความชุกตลอดชีวิตของความผิดปกติทางจิตอยู่ที่ 33-76%[17] สำหรับผู้ป่วยหลายคนและบางครอบครัวอาการทางจิตเหล่านี้เป็นหนึ่งในอาการที่ส่งผลมากที่สุด มักมีผลต่อการดำเนินชีวิตประจำวัน และบ่อยครั้งเป็นสาเหตุของการที่ทำให้ไม่สามารถออกจากบ้านหรือสถานพยาบาลได้[17] นอกจากนี้ผู้ป่วยยังมีความคิดฆ่าตัวตายและการลงมือกระทำการฆ่าตัวตายมากกว่าคนทั่วไปอีกด้วย[8]
ฮันติงตินที่ผิดปกติไม่ได้ส่งผลต่อสมองอย่างเดียวแต่ส่งผลต่อร่างกายส่วนอื่นซึ่งอาศัยการทำงานของฮันติงตินด้วย ความผิดปกติที่พบ เช่น กล้ามเนื้อฝ่อลีบ หัวใจวาย ความทนกลูโคสบกพร่อง (impaired glucose tolerance) น้ำหนักลด กระดูกพรุน และอัณฑะฝ่อ[18]
พันธุศาสตร์
[แก้]มนุษย์ทุกคนมียีนฮันติงติน (HTT) อยู่เป็นปกติ ยีนนี้ทำหน้าที่สร้างโปรตีนฮันติงติน (Htt) ส่วนหนึ่งของยีนฮันฮิงตินนี้เป็นบริเวณที่มีคู่เบสลำดับซ้ำกันเป็นชุดสามเรียกว่า trinucleotide repeat ซึ่งมีความยาวแตกต่างกันไปในแต่ละคนและอาจมีการเปลี่ยนแปลงของความยาวได้เมื่อมีการถ่ายทอดจากรุ่นสู่รุ่น เมื่อบริเวณนี้ของยีนมีความยาวมากถึงค่าหนึ่งจะทำให้การสร้างโปรตีนผิดปกติไป โดยสร้างเป็นโปรตีนฮันติงตินที่มีการกลายพันธุ์ (mutant Huntingtin protein) หรือ mHtt ซึ่งเป็นโปรตีนที่มีคุณสมบัติแตกต่างกับ Htt ปกติ ทำให้เกิดการเปลี่ยนแปลงที่นำไปสู่การเป็นโรคฮันติงตัน การกลายพันธุ์ที่เกิดขึ้นในโรคฮันติงตันนั้นมีการถ่ายทอดแบบลักษณะเด่นและมีเพเนแทรนซ์เกือบ 100% (หมายความว่าเมื่อได้รับยีนก่อโรคมาแล้ว จะมีโอกาสที่โรคจะแสดงอาการเกือบ 100%) โดยการกลายพันธุ์ของยีน HTT ยีนใดยีนหนึ่งในสองยีน ก็ทำให้เป็นโรคได้ทั้งสิ้น การถ่ายทอดของโรคฮันติงตันไม่เกี่ยวข้องกับเพศ แต่ความยาวของบริเวณลำดับซ้ำในยีนซึ่งขึ้นตรงกับความรุนแรงของโรคด้วยนั้นมีความสัมพันธ์กับการได้รับยีนที่เป็นโรคมาจากฝ่ายบิดาหรือมารดา[19]
ลักษณะการกลายพันธุ์
[แก้]โรคฮันติงตันเป็นโรคในกลุ่มที่มีความผิดปกติของจำนวนลำดับซ้ำชุดสามของคู่เบสในดีเอ็นเอโรคหนึ่งจากจำนวนหลายๆ โรค ซึ่งโรคในกลุ่มนี้เกิดจากการที่จำนวนลำดับซ้ำชุดสามของคู่เบสในดีเอ็นเอมีจำนวนมากกว่าค่าปกติ[20] ยีน HTT อยู่ในแขนสั้นของโครโมโซมคู่ที่ 4[20] ที่ตำแหน่ง 4p16.3 ซึ่งมีลำดับของเบสสามตัวซ้ำกัน ได้แก่ ไซโตซีน-อะดีนีน-กวานีน (CAG) ซึ่งเรียงต่อกันเรื่อยๆ เป็น CAGCAGCAG... ลักษณะนี้เรียกว่า trinucleotide repeat[20] ซึ่ง CAG เป็นรหัสที่จะถูกถอดรหัสออกมาเป็นกรดอะมิโนกลูตามีน ดังนั้นลำดับซ้ำชุดสามของ CAG จะถูกถอดรหัสออกมาเป็นสายโซ่โปรตีนกลูตามีนต่อกัน เรียกว่าสายโพลีกลูตามีน หรือสาย polyQ ดังนั้นบริเวณที่มีการซ้ำกันของลำดับดีเอ็นเอนี้จึงถูกเรียกว่า PolyQ region (บริเวณ PolyQ)[21]
| จำนวนชุดซ้ำ | ประเภท | ลักษณะของโรค |
|---|---|---|
| <28 | ปกติ | ไม่เป็นโรค |
| 28–35 | ปานกลาง | ไม่เป็นโรค |
| 36–40 | มีเพเนแทรนซ์ไม่ถึง 100% | อาจเป็นโรค |
| >40 | มีเพเนแทรนซ์ 100% | เป็นโรค |
คนปกติจะมีกลูตามีนซ้ำกันใน polyQ region ไม่เกิน 36 ชุด ซึ่งจะทำให้มีการถอดรหัสออกมาเป็นโปรตีนฮันติงตินชนิดปกติ คือ Htt ออกมาอยู่ในซัยโตพลาสซึมเพื่อทำหน้าที่ต่อไป[20] แต่ถ้ามีซ้ำกันตั้งแต่ 36 ชุดขึ้นไปจะทำให้มีการสร้างโปรตีนผิดปกติคือ mHtt ซึ่งทำให้เซลล์ประสาทหรือนิวรอนบางชนิดเสื่อมเร็วผิดปกติ[20] สมองแต่ละบริเวณมีเซลล์ประสาทที่ต้องใช้โปรตีนฮันติงตินเช่นนี้อยู่มากน้อยไม่เท่ากัน ทำให้ได้รับผลกระทบจากความผิดปกติของการสร้างโปรตีนฮันติงตินไม่เท่ากัน[12] โดยทั่วไปแล้วจำนวนชุดซ้ำของ CAG เป็นสิ่งที่ส่งผลต่อการเกิดโรคฮันติงตันในแง่ของอายุที่จะเริ่มมีอาการ ซึ่งถือว่ามีผล 60% ความแปรปรวนที่นอกเหนือจากนี้ขึ้นกับปัจจัยสิ่งแวดล้อมและยีนอื่นๆ ที่ส่งผลต่อการดำเนินโรคของโรคฮันติงตัน[20] การมีจำนวนชุด CAG ซ้ำ 36-40 ชุดมักทำให้เกิดโรคฮันติงตันที่มีเพเนแทรนซ์ไม่เป็น 100% และเริ่มมีอาการที่อายุมากกว่าชนิดอื่น ดำเนินโรคช้ากว่าชนิดอื่น ผู้ป่วยบางรายเริ่มมีอาการช้ามากจนไม่มีอาการอื่นๆ ปรากฏให้เห็นเลยก็มี[22] ในขณะเดียวกันหากมีจำนวนชุด CAG ซ้ำเยอะมาก จะทำให้โรคฮันติงตันนั้นมีเพเนแทรนซ์ 100% และเริ่มแสดงอาการตั้งแต่อายุน้อยกว่า 20 ปี ซึ่งจะเรียกว่าโรคฮันติงตันชนิดวัยเด็ก หรือชนิด akinetic-rigid หรือชนิดเวสท์ฟาล ซึ่งคิดเป็นประมาณ 7% ของพาหะโรคฮันติงตันทั้งหมด[23]
การถ่ายทอด
[แก้]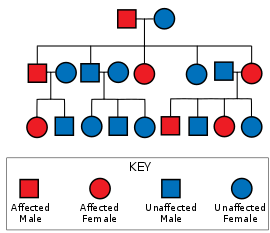
โรคฮันติงตันมีการถ่ายทอดแบบออโตโซมลักษณะเด่น หมายความว่าผู้ที่ได้รับอัลลีลของยีนฮันติงตินซึ่งผิดปกติ (mutant allele) มาเพียงยีนเดียวจากสองยีนก็สามารถแสดงอาการของโรคได้ และโอกาสที่ผู้ที่มียีนผิดปกติจะแสดงอาการของโรคก็มีสูงเกือบ 100%[8] เนื่องจากโรคฮันติงตันเป็นโรคที่มีเพเนแทรนซ์สูงมาก การถ่ายทอดแบบออโตโซมลักษณะเด่นนี้จะทำให้ทายาทของผู้ป่วยมีโอกาสได้รับอัลลีลที่ผิดปกติจากผู้ป่วยไป 50% ซึ่งโอกาส 50% นี้ ไม่เกี่ยวข้องกับเพศ[24]
ลำดับซ้ำชุดสามของ CAG ที่ยาวเกินกว่า 28 ชุดจะมีความไม่เสถียรระหว่างการทำซ้ำของสายดีเอ็นเอ โดยยิ่งมีจำนวนชุดซ้ำมากก็ยิ่งมีความไม่เสถียรมาก[22] ความไม่เสถียรนี้มักทำให้เกิดการเพิ่มขึ้นของจำนวนชุดซ้ำจากรุ่นสู่รุ่น (dynamic mutation) แทนที่จะมีการถ่ายทอดจำนวนชุดซ้ำโดยไม่มีการเปลี่ยนแปลง[20] ลักษณะเช่นนี้ทำให้คนรุ่นถัดไปอาจมีจำนวนชุด CAG ซ้ำไม่เท่ากับรุ่นพ่อแม่ ดังนั้นพ่อแม่ที่ไม่เป็นโรคแต่มีจำนวนชุดซ้ำอยู่ในระดับกลาง (28-35 ชุด) หรือเป็นโรคแต่อยู่ในระดับที่มีเพเนแทรนซ์ไม่ถึง 100% (36-40 ชุด) อาจมีทายาทที่มีจำนวนชุด CAG ซ้ำมากกว่าที่รุ่นพ่อแม่มี จนได้รับการถ่ายทอดโรคฮันติงตันที่มีเพเนแทรนซ์เป็น 100% ได้[20] การมีจำนวนชุด CAG ซ้ำเพิ่มขึ้นจากรุ่นสู่รุ่นเช่นนี้ทำให้โรคอาจมีความรุนแรงมากขึ้น (เช่น เริ่มมีอาการเร็วขึ้น อาการดำเนินไปรวดเร็วมากขึ้น) ปรากฏการณ์เช่นนี้เรียกว่า genetic anticipation[20] โดยความไม่เสถียรของลำดับ CAG นี้จะพบในกระบวนการสร้างอสุจิมากกว่ากระบวนการสร้างไข่[20] ดังนั้นอัลลีลที่ได้รับการถ่ายทอดมาจากแม่จะมีความยาวใกล้เคียงกันมากกว่าอัลลีลที่ได้รับการถ่ายทอดมาจากพ่อ ซึ่งมีโอกาสที่จะมีการเพิ่มขึ้นของจำนวนชุด CAG ซ้ำมากกว่า[20][25] ส่วนการเกิดการกลายพันธุ์จนเป็นโรคฮันติงตันซึ่งเกิดขึ้นใหม่ในคนที่พ่อแม่มีลำดับ CAG ซ้ำไม่เกิน 36 ชุดนั้นพบได้น้อยมาก[26]
ผู้ป่วยที่มียีนผิดปกติทั้งสองอัลลีลนั้นมีจำนวนน้อยมาก โดยอาจพบได้ในครอบครัวขนาดใหญ่ที่มีการแต่งงานภายในเครือญาติ[27] ก่อนหน้านี้เชื่อกันว่าโรคฮันติงตันเป็นโรคเพียงโรคเดียวที่การมีจำนวนยีนผิดปกติเป็นสองอัลลีลนั้นไม่ส่งผลต่ออาการและการดำเนินโรค[28] แต่ปัจจุบันนี้พบแล้วว่าการมียีนผิดปกติสองอัลลีลนั้นส่งผลต่อลักษณะปรากฏหรือฟีโนไทป์และความเร็วของการดำเนินโรคด้วย[20][27] ทายาทของผู้ป่วยที่มียีนผิดปกติทั้งสองอัลลีลนั้นจะต้องได้รับยีนผิดปกติมาอันหนึ่งอย่างแน่นอน ดังนั้นจะมีโรคฮันติงตันอย่างแน่นอน ในขณะที่ทายาทของพ่อแม่ที่เป็นโรคฮันติงตันแบบมียีนผิดปกติหนึ่งอัลลีลทั้งคู่นั้นมีโอกาสเป็นโรค 75% และมีโอกาสไม่เป็นโรค 25% โดยมีโอกาสเป็นโรคฮันติงตันแบบมียีนผิดปกติทั้งสองอีลลีลอยู่ 25%[24] โดยทั่วไปแล้วแฝดเหมือนที่ได้รับยีนผิดปกติที่เหมือนกันมานั้น จะเริ่มแสดงอาการและมีการดำเนินโรคไม่เหมือนกัน[27]
การวินิจฉัย
[แก้]การวินิจฉัยแยกโรค
[แก้]90% ของการวินิจฉัยโรคฮันติงตันขึ้นกับอาการและประวัติครอบครัวซึ่งมีลักษณะเฉพาะ ยืนยันได้ด้วยการตรวจทางพันธุศาสตร์พบมีการขยายของลำดับนิวคลีโอไทด์ที่ซ้ำกันซึ่งเป็นสาเหตุของโรค ยังมีโรคอื่นๆ ที่เรียกว่าโรคซึ่งคล้ายโรคฮันติงตัน (HD-like disorder)[12][29] โรคเหล่านี้มักถูกเรียกรวมๆ ว่า HDL หรือ HD-like ("คล้ายโรคฮันติงตัน")[29] สาเหตุของ HDL ส่วนใหญ่นั้นยังไม่เป็นที่ทราบ บางโรคที่ทราบสาเหตุนั้นพบว่าเกิดจากการกลายพันธุ์ของยีนพรีออนโปรตีน (HDL1) ยีนจังท์โตฟิลลิน 3 (HDL2) ยีน HTT ชนิดที่ถ่ายทอดแบบลักษณะด้อย (HDL3 พบในรายงานครอบครัวผู้ป่วยเพียงครอบครัวเดียว และยังไม่เป็นที่เข้าใจมากนัก) และยีนที่ถอดรหัสเป็น TATA box-binding protein (HDL4/SCA17)[29] โรคที่ถ่ายทอดทางออโตโซมลักษณะเด่นอื่นๆ ที่อาจถูกวินิจฉัยผิดไปเป็นโรคฮันติงตันได้เช่น dentatorubral-pallidoluysian atrophy (การฝ่อของเดนเตโตรูบราล-พาลลิโดลุยเซียน) และ neuroferritinopathy (ความผิดปกติของเฟอร์ไรตินในระบบประสาท)[29] นอกจากนี้ยังมีโรคที่ถ่ายทอดทางออโตโซมลักษณะด้อยอีกจำนวนหนึ่งที่อาจแสดงอาการคล้ายผู้ป่วยฮันติงตันที่ไม่ได้เกิดจากการถ่ายทอดในครอบครัว (sporadic case) เช่น chorea acanthocytosis (เม็ดเลือดแดงอะแคนโธซัยต์มากผิดปกติร่วมกับมีโคเรีย), pantothenate kinase-associated neurodegenartion (การเสื่อมของประสาทซึ่งสัมพันธ์กับแพนโทธีเนท ไคเนส) และ X-linked McLeod syndrome (กลุ่มอาการแม็คลีอ็อดซึ่งสัมพันธ์กับโครโมโซมเอกซ์)[29]
การวินิจฉัยทางคลินิก
[แก้]
การตรวจร่างกายและการตรวจสภาพจิตสามารถช่วยบอกได้ว่าผู้ป่วยเริ่มมีอาการของโรคแล้วหรือยังไม่มี[8] อาการที่มักนำผู้ป่วยมาพบแพทย์มากที่สุดคือการเคลื่อนไหวผิดปกติของส่วนต่างๆ ของร่างกาย หากอาการเหล่านี้เป็นขึ้นทันทีทันใด เริ่มเป็นแบบไม่สัมพันธ์กับเหตุการณ์หรืออาการอื่นๆ จะเป็นการชี้ให้ควรสงสัยว่าต้องให้การวินิจฉัยผู้ป่วยเป็นโรคฮันติงตัน อาการทางการรับรู้หรือทางสภาพจิตมักไม่เป็นอาการแรกๆ ที่ทำให้นึกถึงโรคฮันติงตัน ส่วนใหญ่จะเป็นจะนึกถึงอาการเหล่านี้ว่าเป็นจากโรคฮันติงตันก็ต่อเมื่อเป็นการได้ประวัติย้อนหลังของผู้ป่วยโรคฮันติงตันที่วินิจฉัยได้จากสาเหตุอื่น หรืออาการเหล่านี้ปรากฏขึ้นหลังจากได้รับการวินิจฉัยเรียบร้อยแล้ว แพทย์สามารถวัดการดำเนินโรคออกมาเป็นตัวเลขได้โดยใช้ unified Huntington's disease rating scale (เกณฑ์การให้คะแนนโรคฮันติงตันแบบสากล) โดยคะแนนนี้คิดจากการประเมินผู้ป่วยทั่งด้านการสั่งการ พฤติกรรม การรับรู้ และความสามารถในการดำเนินชีวิต[31][32] การถ่ายภาพรังสีทางการแพทย์เช่นซีทีสแกนหรือเอ็มอาร์ไออาจแสดงให้เห็นได้เพียงภาวะสมองใหญ่ฝ่อที่จะพบก็ต่อเมื่อโรคดำเนินไปมากแล้วเท่านั้น การถ่ายภาพรังสีของการทำงานของระบบประสาท เช่น fMRI หรือ PET scan อาจแสดงให้เห็นการเปลี่ยนแปลงของการทำงานของสมองก่อนที่จะปรากฏอาการได้ แต่วิธีนี้ยังมีที่ใช้เฉพาะในการศึกษาวิจัย ยังไม่มีการนำมาใช้ทางคลินิก[20]
อ้างอิง
[แก้]- ↑ Lawrence, David M. (2009). Huntington's Disease (ภาษาอังกฤษ). Infobase Publishing. p. 21. ISBN 9780791095867.
- ↑ 2.0 2.1 Dayalu P, Albin RL (February 2015). "Huntington disease: pathogenesis and treatment". Neurologic Clinics. 33 (1): 101–14. doi:10.1016/j.ncl.2014.09.003. PMID 25432725.
- ↑ 3.0 3.1 Caron NS, Wright GE, Hayden MR (2020). Adam MP, Ardinger HH, Pagon RA, Wallace SE, Bean LJ, Stephens K, Amemiya A (บ.ก.). "Huntington Disease". GeneReviews. PMID 20301482.
- ↑ 4.0 4.1 Frank S (January 2014). "Treatment of Huntington's disease". Neurotherapeutics. 11 (1): 153–60. doi:10.1007/s13311-013-0244-z. PMC 3899480. PMID 24366610.
- ↑ 5.0 5.1 5.2 5.3 "Huntington's Disease Information Page | National Institute of Neurological Disorders and Stroke". www.ninds.nih.gov. สืบค้นเมื่อ 14 December 2020.
- ↑ Durr A, Gargiulo M, Feingold J (November 2012). "The presymptomatic phase of Huntington disease". Revue Neurologique. 168 (11): 806–8. doi:10.1016/j.neurol.2012.07.003. PMID 22902173.
- ↑ Ferri, Fred F. (2010). Ferri's differential diagnosis : a practical guide to the differential diagnosis of symptoms, signs, and clinical disorders (2nd ed.). Philadelphia, PA: Elsevier/Mosby. p. Chapter H. ISBN 978-0323076999.
- ↑ 8.0 8.1 8.2 8.3 8.4 8.5 8.6 8.7 Walker FO (2007). "Huntington's disease". Lancet. 369 (9557): 218. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ "Huntington Disease". genereviews bookshelf. University of Washington. 2007-07-19. สืบค้นเมื่อ 2009-03-12.
- ↑ 10.0 10.1 Kremer B (2002). "Clinical neurology of Huntington's disease". ใน Bates G, Harper P, and Jones L (บ.ก.). Huntington's Disease – Third Edition. Oxford: Oxford University Press. pp. 28–53. ISBN 0-19-851060-8.
{{cite book}}: CS1 maint: multiple names: editors list (ลิงก์) - ↑ Wagle, A C; Wagle SA; Marková IS; Berrios GE (2000). "Psychiatric Morbidity in Huntington's disease". Neurology, Psychiatry and Brain Research (8): 5–16.
- ↑ 12.0 12.1 12.2 12.3 12.4 Walker FO (2007). "Huntington's disease". Lancet. 369 (9557): 219. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ 13.0 13.1 13.2 13.3 13.4 13.5 13.6 Montoya A, Price BH, Menear M, Lepage M (2006). "Brain imaging and cognitive dysfunctions in Huntington's disease" (PDF). J Psychiatry Neurosci. 31 (1): 21–9. PMC 1325063. PMID 16496032. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2016-03-23. สืบค้นเมื่อ 2009-04-01.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Aziz NA, van der Marck MA, Pijl H, Olde Rikkert MG, Bloem BR, Roos RA (2008). "Weight loss in neurodegenerative disorders". J. Neurol. 255 (12): 1872–80. doi:10.1007/s00415-009-0062-8. PMID 19165531.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Booklet by the Huntington Society of Canada" (PDF). Caregiver's Handbook for Advanced-Stage Huntington Disease. HD Society of Canada. 2007-04-11. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2008-06-25. สืบค้นเมื่อ 2008-08-10.
- ↑ Gagnon JF, Petit D, Latreille V, Montplaisir J (2008). "Neurobiology of sleep disturbances in neurodegenerative disorders". Curr. Pharm. Des. 14 (32): 3430–45. doi:10.2174/138161208786549353. PMID 19075719.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 17.0 17.1 17.2 17.3 van Duijn E, Kingma EM, van der Mast RC (2007). "Psychopathology in verified Huntington's disease gene carriers". J Neuropsychiatry Clin Neurosci. 19 (4): 441–8. doi:10.1176/appi.neuropsych.19.4.441. PMID 18070848.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ van der Burg JM, Björkqvist M, Brundin P (2009). "Beyond the brain: widespread pathology in Huntington's disease". Lancet Neurol. 8 (8): 765–74. doi:10.1016/S1474-4422(09)70178-4. PMID 19608102.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Walker FO (2007). "Huntington's disease". Lancet. 369 (9557): 221. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ 20.00 20.01 20.02 20.03 20.04 20.05 20.06 20.07 20.08 20.09 20.10 20.11 20.12 20.13 Walker FO (2007). "Huntington's disease". Lancet. 369 (9557): 220. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ Katsuno M, Banno H, Suzuki K; และคณะ (2008). "Molecular genetics and biomarkers of polyglutamine diseases". Curr. Mol. Med. 8 (3): 221–34. doi:10.2174/156652408784221298. PMID 18473821. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-02-13. สืบค้นเมื่อ 2009-04-01.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 22.0 22.1 Walker FO (2007). "Huntington's disease". Lancet. 369 (9557): 222. doi:10.1016/S0140-6736(07)60111-1. PMID 17240289.
- ↑ Nance MA, Myers RH (2001). "Juvenile onset Huntington's disease—clinical and research perspectives". Ment Retard Dev Disabil Res Rev. 7 (3): 153–7. doi:10.1002/mrdd.1022. PMID 11553930.
- ↑ 24.0 24.1 Passarge, E (2001). Color Atlas of Genetics (2nd ed.). Thieme. p. 142. ISBN 0-86577-958-9.
- ↑ Ridley RM, Frith CD, Crow TJ, Conneally PM (1988). "Anticipation in Huntington's disease is inherited through the male line but may originate in the female". Journal of Medical Genetics. 25 (9): 589–595. doi:10.1136/jmg.25.9.589. PMC 1051535. PMID 2972838.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Semaka A, Creighton S, Warby S, Hayden MR (2006). "Predictive testing for Huntington disease: interpretation and significance of intermediate alleles". Clin. Genet. 70 (4): 283–94. doi:10.1111/j.1399-0004.2006.00668.x. PMID 16965319.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 27.0 27.1 27.2 Squitieri F, Gellera C, Cannella M; และคณะ (2003). "Homozygosity for CAG mutation in Huntington disease is associated with a more severe clinical course". Brain. 126 (Pt 4): 946–55. doi:10.1093/brain/awg077. PMID 12615650.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Wexler NS, Young AB, Tanzi RE; และคณะ (1987). "Homozygotes for Huntington's disease". Nature. 326 (6109): 194–197. doi:10.1038/326194a0. PMID 2881213.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 29.0 29.1 29.2 29.3 29.4 Schneider SA, Walker RH, Bhatia KP (2007). "The Huntington's disease-like syndromes: what to consider in patients with a negative Huntington's disease gene test". Nat Clin Pract Neurol. 3 (9): 517–25. doi:10.1038/ncpneuro0606. PMID 17805246.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Gaillard, Frank (1 May 2007). "Huntington's disease". Radiology picture of the day. www.radpod.org. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-10-22. สืบค้นเมื่อ 24 July 2009.
- ↑ Rao AK, Muratori L, Louis ED, Moskowitz CB, Marder KS (2009). "Clinical measurement of mobility and balance impairments in Huntington's disease: validity and responsiveness". Gait Posture. 29 (3): 433–6. doi:10.1016/j.gaitpost.2008.11.002. PMID 19111470. สืบค้นเมื่อ 2009-04-14.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Unified Huntington's Disease Rating Scale (UHDRS)". UHDRS and Database. HSG. 2009-02-01. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-05-02. สืบค้นเมื่อ 2009-04-14.
