อะพอพโทซิส

อะพอพโทซิส (อังกฤษ: Apoptosis) เป็นรูปแบบหนึ่งของการตายของเซลล์แบบที่มีการโปรแกรมไว้แล้ว (programmed cell death) ของสิ่งมีชีวิตหลายเซลล์ ซึ่งเกี่ยวข้องกับชุดของปฏิกิริยาทางชีวเคมีซึ่งทำให้เซลล์ตายอย่างมีลักษณะที่เฉพาะ หรือกล่าวอย่างจำเพาะคือเป็นชุดของปฏิกิริยาทางชีวเคมีที่ทำให้เซลล์มีสัณฐานวิทยาเปลี่ยนแปลงหลายรูปแบบ เช่น การบวมของเซลล์ (blebbing) , การเปลี่ยนแปลงของเยื่อหุ้มเซลล์เช่นการเหี่ยวของเซลล์, นิวเคลียสแตกเป็นชิ้นส่วน, โครมาตินหนาตัวขึ้น, และดีเอ็นเอแตกเป็นท่อน กระบวนการกำจัดเศษซากเซลล์ก็จะไม่ทำให้เกิดการกระตุ้นให้เนื้อเยื่อข้างเคียงเกิดความเสียหายซึ่งต่างจากการตายแบบการตายเฉพาะส่วนหรือเนโครซิส (necrosis)
อะพอพโทซิสเป็นการตายที่เกิดขึ้นตามปกติในกระบวนการเจริญพัฒนาของสิ่งมีชีวิต ซึ่งต่างจากการตายเฉพาะส่วนที่เกิดจากการบาดเจ็บของเซลล์แบบเฉียบพลัน อะพอพโทซิสเกี่ยวข้องกับการพัฒนารูปร่างและอวัยวะของเอ็มบริโอ เช่นการเจริญของนิ้วมือและนิ้วเท้าเนื่องจากเซลล์ที่อยู่ระหว่างนิ้วอะพอพโทซิสไปทำให้นิ้วทั้งห้าแยกออกจากกัน โดยเฉลี่ยแล้วในผู้ใหญ่จะมีเซลล์ราว 5 หมื่นล้านถึง 7 หมื่นล้านเซลล์ตายแบบอะโพโทซิสทุกวัน และในเด็กอายุ 8-14 ปีจะมีเซลล์ตายราว 2 หมื่นล้านถึง 3 หมื่นล้านเซลล์ต่อวัน
งานวิจัยเกี่ยวกับการตายแบบอะพอพโทซิสมีจำนวนเพิ่มมากขึ้นตั้งแต่ต้นทศวรรษที่ 1990 ทำให้มีการค้นพบการตายแบบอะโพโทซิสที่ผิดปกติในโรคต่างๆ หากอะพอพโทซิสเกิดขึ้นมากเกินไปจะทำให้เกิดการฝ่อของอวัยวะ เช่นในภาวะการขาดเลือดเฉพาะที่ (ischemic damage) ในขณะที่การตายแบบอะพอพโทซิสที่ไม่เพียงพอทำให้เกิดเซลล์ที่เพิ่มจำนวนอย่างควบคุมไม่ได้ เช่นมะเร็ง
บทบาทหน้าที่ของอะพอพโทซิส[แก้]
การหยุดการเจริญของเซลล์[แก้]
อะพอพโทซิสจะเกิดขึ้นในเซลล์ที่เสียหายเกินกว่าจะซ่อมแซมได้ เช่น ติดเชื้อไวรัส, หรืออยู่ในภาวะกดดันเช่นการอดอาหาร ความเสียหายของดีเอ็นเอภายในเซลล์จากรังสีแตกตัว (ionizing radiation) หรือสารพิษจะชักนำให้เกิดอะโพโทซิสโดยผ่านการทำงานของยีนต้านมะเร็ง (tumour-suppressing gene) ชื่อ p53 การ "ตัดสินใจ" ของเซลล์ว่าจะเข้าสู่กระบวนการอะพอพโทซิสอาจขึ้นกับปัจจัยของเซลล์เอง, ปัจจัยของเนื้อเยื่อรอบๆ, และจากเซลล์ซึ่งเป็นส่วนหนึ่งของระบบภูมิคุ้มกัน ในกรณีนี้เซลล์จะเกิดการอะพอพโทซิสเพื่อกำจัดเซลล์ที่เสียหาย, เพื่อป้องกันการกระจายของไวรัส, และเพื่อลดจำนวนเซลล์ในภาวะอดอาหารเพื่อจะได้ไม่ต้องดึงอาหารจากสิ่งมีชีวิตตามลำดับ
อะพอพโทซิสยังมีบทบาทในการป้องกันมะเร็ง หากเซลล์ไม่สามารถที่จะเกิดการตายแบบอะพอพโทซิสอันเนื่องมาจากการกลายพันธุ์ (mutation) หรือการยับยั้งกระบวนการทางชีวเคมีจะทำให้เซลล์แบ่งตัวต่อเนื่องและเจริญกลายเป็นเนื้องอก ตัวอย่างเช่น การติดเชื้อ papillomavirus จะทำให้ยีนของไวรัสเข้าแทรกในโปรตีน p53 ของเซลล์ซึ่งเป็นโปรตีนสำคัญในวิถีอะโพโทซิส การรบกวนกระบวนการอะพอพโทซิสดังกล่าวเป็นปัจจัยสำคัญในการเจริญของมะเร็งปากมดลูก
ภาวะธำรงดุล[แก้]
ในสิ่งมีชีวิตตัวเต็มวัย จำนวนของเซลล์จะค่อนข้างคงที่โดยกระบวนการตายของเซลล์และการแบ่งเซลล์ทดแทน เซลล์จะต้องถูกทดแทนเมื่อเซลล์นั้นเป็นโรคหรือทำหน้าที่ผิดปกติไป แต่การเพิ่มจำนวนของเซลล์ก็ต้องถูกชดเชยด้วยการตายของเซลล์[1] ซึ่งเป็นกระบวนการหนึ่งในภาวะธำรงดุล (homeostasis) ที่จำเป็นในสิ่งมีชีวิตเพื่อรักษาภาวะภายในร่างกายให้อยู่ในระดับที่เหมาะสม
ภาวะธำรงดุลของจำนวนเซลล์ในร่างกายเกิดขึ้นเมื่ออัตราการแบ่งเซลล์แบบไมโทซิสในเนื้อเยื่อสมดุลกับการตายของเซลล์ หากภาวะสมดุลดังกล่าวถูกรบกวน จะทำให้เกิดความผิดปกติซึ่งอาจเป็นอันตรายถึงชีวิตได้ 2 แบบ ได้แก่
- เซลล์แบ่งตัวเร็วกว่าที่เซลล์ตาย จะทำให้เกิดการเจริญไปเป็นเนื้องอก
- เซลล์แบ่งตัวช้ากว่าที่เซลล์ตาย จะทำให้เกิดความผิดปกติเกี่ยวกับการสูญเสียเซลล์
ในสิ่งมีชีวิตหลายเซลล์จะต้องมีกระบวนการอันซับซ้อนดังกล่าวเพื่อควบคุมภาวะธำรงดุลภายในร่างกายอย่างเข้มงวดเพื่อให้สามารถดำรงชีวิตต่อไปได้ ซึ่งต้องอาศัยการส่งสัญญาณของเซลล์ (cell signaling) หลายชนิด การเสียหน้าที่ของการควบคุมในขั้นตอนใดขั้นตอนหนึ่งจะทำให้เกิดความผิดปกติหรือเกิดโรคได้ เช่น การสูญเสียการควบคุมของวิถีการส่งสัญญาณ (signaling pathway) อาจทำให้เกิดสัญญาณที่มากเกินไปและก่อให้เกิดมะเร็ง ตัวอย่างที่เห็นได้ชัดคือเช่นวิถีซึ่งส่งสัญญาณต้านอะพอพโทซิสของเซลล์พบว่าสามารถกระตุ้นให้เกิดมะเร็งชนิดต่อมของตับอ่อน (pancreatic adenocarcinoma)
พัฒนาการ[แก้]

Programmed cell death หรือกระบวนการตายของเซลล์ที่มีการโปรแกรมไว้เป็นส่วนหนึ่งของพัฒนาการของทั้งเนื้อเยื่อพืชและสัตว์ การเจริญเติบโตของอวัยวะหรือเนื้อเยื่อมักจะเริ่มด้วยการแบ่งเซลล์หรือการเปลี่ยนรูปร่างเซลล์ที่มากเกินควร จากนั้นจึงตามมาด้วยกระบวนการอะพอพโทซิสเพื่อปรับรูปแบบให้เนื้อเยื่อมีขนาดและรูปร่างปกติ โดยเป็นการตายของเซลล์ที่มีลักษณะเซลล์หดตัวและแตกเป็นท่อนๆ ซึ่งต่างจากการตายของเซลล์ที่เกิดจากการบาดเจ็บ การแตกเป็นท่อนๆ ทำให้ซากเซลล์สามารถถูกจับกินและนำองค์ประกอบของเซลล์กลับมาใช้ใหม่โดยไม่มีการหลั่งสารภายในเซลล์ที่ตาย (เช่น เอนไซม์) ซึ่งก่ออันตรายต่อเนื้อเยื่อข้างเคียง
ในการวิจัยเอ็มบริโอของไก่แสดงให้เห็นว่ามีการคัดเลือกการแบ่งเซลล์ (selective cell proliferation) ร่วมกับการคัดเลือกการอะพอพโทซิส (selective apoptosis) ซึ่งช่วยตกแต่งเนื้อเยื่อที่กำลังเจริญพัฒนาของสัตว์มีกระดูกสันหลัง ในระหว่างพัฒนาการของเอ็มบริโอของสัตว์ที่มีกระดูกสันหลัง โครงสร้างที่เรียกว่า โนโตคอร์ด (notochord) และ floor plate หลั่งโมเลกุลส่งสัญญาณชื่อว่า Shh ลาดความเข้มข้น (gradient) นี้จะช่วยนำพาเซลล์เพื่อประกอบเป็นโครงสร้างของนิวรัล ทูบ (neural tube) ของเอ็มบริโอ กล่าวคือเซลล์ที่ได้รับสารสื่อสัญญาณ Shh ผ่านทางตัวรับ (receptor) ชื่อว่า Patched1 (Ptc1) บนเยื่อหุ้มเซลล์จะสามารถมีชีวิตอยู่และแบ่งเซลล์ต่อไป ในทางตรงกันข้าม หากไม่มีสาร Shh ส่วนปลายด้านคาร์บอกซีของโมเลกุลตัวรับ Ptc1 ซึ่งอยู่ภายในเซลล์จะถูกตัดโดยเอนไซม์แคสเปส-3 (caspase-3) ซึ่งจะเสนอโดเมนที่กระตุ้นกระบวนการอะโพโทซิส (apoptosis-producing domain) [2][3]
ในระหว่างการเจริญเติบโต กระบวนการอะพอพโทซิสจะถูกควบคุมอย่างเข้มงวด และในแต่ละเนื้อเยื่อจะมีสัญญาณในการชักนำอะพอพโทซิสที่แตกต่างกันออกไป ในนกโปรตีนที่ชื่อว่า Bone morphogenetic protein (BMP) ส่งสัญญาณชักนำอะพอพโทซิสในเนื้อเยื่อระหว่างนิ้ว ในแมลงวัน Drosophila มีสเตอรอยด์ฮอร์โมนทำหน้าที่ควบคุมการตายของเซลล์ ในทางกลับกันนัยของการเจริญเติบโตสามารถชักนำกระบวนการอะพอพโทซิส ตัวอย่างเช่นการตายของเซลล์ที่จำเพาะกับเพศ (sex-specific cell death) ของเส้นประสาท hermaphrodite specific neurons ใน C. elegans เพศผู้ผ่านทางการแสดงออกที่ลดลงของ transcription factor TRA-1 (ยีน TRA-1 ช่วยป้องกันการตายของเซลล์)
ปฏิกิริยาระหว่างกันของลิมโฟไซต์[แก้]
พัฒนาการของบีเซลล์ (B cell) และทีเซลล์ (T cell) ซึ่งเป็นเซลล์ในระบบภูมิคุ้มกันทำหน้าที่ในการกำจัดสิ่งแปลกปลอมในร่างกายมนุษย์เป็นกระบวนการอันซับซ้อนซึ่งทำให้เกิดกลุ่มของเซลล์ที่มีความหลากหลาย ซึ่งอาจทำให้มีเซลล์บางเซลล์ที่ก่อให้เกิดอันตรายต่อร่างกายได้ เช่นการเกิดภูมิต้านเนื้อเยื่อตนเอง อะพอพโทซิสเป็นกลไกของร่างกายที่กำจัดเซลล์ตัวอ่อนในระบบภูมิคุ้มกันที่ไม่มีประสิทธิภาพหรือก่อให้เกิดอันตรายต่อร่างกาย โดยในทีเซลล์จะเริ่มถูกชักนำการตายโดยการขาดสัญญาณที่ช่วยดำรงชีพ (survival signal) [4]
Cytotoxic T-cell เป็นเซลล์ในระบบภูมิคุ้มกันซึ่งสามารถชักนำอะโพโทซิสของเซลล์อื่นโดยตรงโดยการเจาะรูบนพื้นผิวของเป้าหมายและหลั่งสารเคมีซึ่งลัดเข้าสู่วิถีอะพอพโทซิส การเกิดรูบนเมมเบรนเกิดจากสารเคมีที่ชื่อ เพอร์ฟอริน (perforin) และแกรนูลซึ่งมีสาร แกรนไซม์ บี (granzyme B) ซึ่งเป็นเอนไซม์ซีรีน โปรตีเอส (serine protease) ซึ่งกระตุ้นเอนไซม์แคสเปสหลายตัวโดยการตัดส่วนแอสปาเตต เรซิดิว (aspartate residue)[5]
กระบวนการ[แก้]

กระบวนการอะพอพโทซิสถูกควบคุมโดยการส่งสัญญาณของเซลล์ (cell signalling) หลากหลายชนิดซึ่งอาจเริ่มต้นจากภายนอกเซลล์ (extrinsic inducers) หรือภายในเซลล์ (intrinsic inducers) สัญญาณจากภายนอกเซลล์ ได้แก่ ชีวพิษ (toxin) [6], ฮอร์โมน, โกรท แฟคเตอร์ (growth factor) , ไนตริกออกไซด์ (nitric oxide)[7] หรือไซโตไคน์ (cytokine) ซึ่งอาจเข้ามาภายในเซลล์ผ่านพลาสมาเมมเบรนหรือผ่านตัวแปรสัญญาณ (signal transduction) เพื่อทำให้เกิดการตอบสนอง สัญญาณที่เข้ามานั้นอาจกระตุ้นหรือยับยั้งอะพอพโทซิสก็ได้
สัญญาณอะพอพโทซิสจากภายในเซลล์เป็นการตอบสนองของเซลล์ต่อภาวะกดดัน (stress) ต่างๆ และมักจะส่งผลสุดท้ายก่อให้เกิดการ "ฆ่าตัวตาย" ของเซลล์ การจับกับตัวรับ (receptor) ของนิวเคลียสของกลูโคคอร์ติคอยด์ (glucocorticoid) , ความร้อน, รังสี, การขาดสารอาหาร, การติดเชื้อไวรัส, และภาวะเลือดมีออกซิเจนน้อย (hypoxia) ทั้งหมดเป็นปัจจัยที่นำไปสู่การปล่อยสัญญาณอะพอพโทซิสภายในเซลล์จากเซลล์ที่เสียหาย[5] องค์ประกอบภายในเซลล์จำนวนมาก เช่น poly ADP ribose polymerase สามารถช่วยควบคุมกระบวนการอะโพโทซิสได้[8]
ก่อนที่กระบวนการตายของเซลล์จะเกิดขึ้นโดยเอนไซม์ สัญญาณอะพอพโทซิสจะต้องเชื่อมกับวิถีการตาย (actual death pathway) โดยกระบวนการของโปรตีนตัวควบคุม (regulatory proteins) ขั้นตอนนี้จะทำให้สัญญาณอะพอพโทซิสนั้นชักนำให้เซลล์นั้นเข้าสู่กระบวนการอะพอพโทซิส หรือสัญญาณนั้นถูกทำลายและเซลล์ไม่ต้องตายก็ได้ กระบวนการดังกล่าวมีโปรตีนหลายตัวที่มีส่วนเกี่ยวข้อง ซึ่งสรุปได้ว่ามี 2 วิธีหลักๆ ที่ทำหน้าที่ควบคุม คือวิถีที่ควบคุมโดยไมโทคอนเดรีย (targeting mitochondria functionality) และการแปรสัญญาณโดยตรงผ่านโปรตีนตัวปรับ (adapter proteins) ไปยังกลไกอะโพโทซิส กระบวนการเตรียมการทั้งหมดต่างต้องการพลังงานและการทำงานของเซลล์
การควบคุมโดยไมโทคอนเดรีย[แก้]
ไมโทคอนเดรีย (mitochondria) เป็นออร์แกเนลล์ที่จำเป็นสำหรับสิ่งมีชีวิตหลายเซลล์ หากเซลล์ไม่มีไมโทคอนเดรียเซลล์นั้นจะหยุดการหายใจแบบใช้ออกซิเจนและตายอย่างรวดเร็ว ซึ่งนั่นเป็นหนึ่งในวิถีชักนำการตายของกระบวนการอะพอพโทซิส โปรตีนที่เกี่ยวข้องกับอะพอพโทซิสซึ่งมีเป้าหมายที่ไมโทคอนเดรียจะเข้าไปมีผลในหลากหลายทาง เช่น การทำให้ไมโทคอนเดรียบวมโดยการเจาะรูบนผิวเมมเบรน หรืออาจเพิ่มสภาพซึมผ่าน (permeability) ของเยื่อหุ้มไมโทคอนเดรียซึ่งทำให้สารควบคุมกระบวนการอะโพโทซิสรั่วออกมา[5] นอกจากนี้ยังพบหลักฐานบ่งชี้ว่าไนตริกออกไซด์ (NO) ยังมีส่วนชักนำอะโพโทซิสโดยการลดศักย์เยื่อเซลล์ (membrane potential) ของไมโทคอนเดรียและเพิ่มสภาพซึมผ่านของเยื่อหุ้มไมโทคอนเดรีย[7]
หลังจากที่สภาพซึมผ่านของเยื่อไมโทคอนเดรียเพิ่มขึ้น โปรตีนของไมโทคอนเดรียชื่อว่า SMACs (second mitochondria-derived activator of caspases) จะถูกปล่อยออกมายังสารน้ำในเซลล์ (cytosol) SMAC จะจับและลดการทำงานของโปรตีนต้านการอะพอพโทซิส (IAPs - inhibitor of apoptosis proteins) ซึ่งทำให้โปรตีน IAPs ไม่สามารถไปหยุดกระบวนการอะพอพโทซิส และทำให้กระบวนการนี้ดำเนินต่อไปได้ โดยปกติแล้ว IAP จะทำหน้าที่กดการทำงานของกลุ่มเอนไซม์ซิสเตอีน โปรตีเอส (cysteine protease) ที่ชื่อว่า แคสเปส (caspases)[9] ซึ่งเป็นเอนไซม์ที่ทำหน้าที่ทำให้เซลล์เสื่อมสภาพ จะเห็นว่าการทำงานของเอนไซม์แคสเปสนั้นถูกควบคุมทางอ้อมจากสภาพซึมผ่านของไมโทคอนเดรีย
ไซโตโครม ซี (Cytochrome c) ก็เป็นอีกตัวหนึ่งที่ถูกปล่อยออกมาจากไมโทคอนเดรียจากการสร้างช่องว่างที่ชื่อ MAC ของเยื่อหุ้มชั้นนอกของไมโทคอนเดรีย[10] และทำหน้าที่เป็นโปรตีนควบคุมเพราะมันจะเปลี่ยนรูปร่างก่อนที่จะเกิดกระบวนการอะโพโทซิส[5] เมื่อไซโตโครม ซี ถูกปล่อยออกมาจะเข้าจับกับโปรตีน Apaf-1 และ ATP และจับกับ โปรแคสเปส-9 (pro-caspase-9) กลายเป็นโครงสร้างเชิงซ้อนที่เรียกว่าอะโพโทโซม (apoptosome) อะโพโทโซมจะย่อยโปรแคสเปสไปเป็นเอนไซม์รูปที่ทำงานได้คือ แคสเปส-9 (caspase-9) ซึ่งจะกระตุ้นการทำงานของแคสเปส-3 (caspase-3)
การแสดงออกของโปรตีน MAC ถูกควบคุมโดยโปรตีนหลายตัว เช่นยีน Bcl-2 ซึ่งเป็นกลุ่มยีนต้านอะโพโทซิสซึ่งถูกถอดรหัสในสัตว์เลี้ยงลูกด้วยน้ำนม ซึ่งมีต้นกำเนิดเหมือน (homolog) กับยีน ced-9 ซึ่งพบในC. elegans.[11][12] โปรตีน Bcl-2 สามารถทำหน้าที่ส่งเสริมหรือยับยั้งอะโพโทซิสจากการควบคุมโดยตรงผ่าน MAC หรือทางอ้อมผ่านทางโปรตีนอื่นๆ น่าสนใจว่าการทำงานของโปรตีน Bcl-2 บางชนิดสามารถหยุดกระบวนการอะโพโทซิสแม้ว่าไซโตโครม ซี จะถูกปล่อยออกจากไมโทคอนเดรียแล้วก็ตาม[5]
การแปรสัญญาณโดยตรง[แก้]
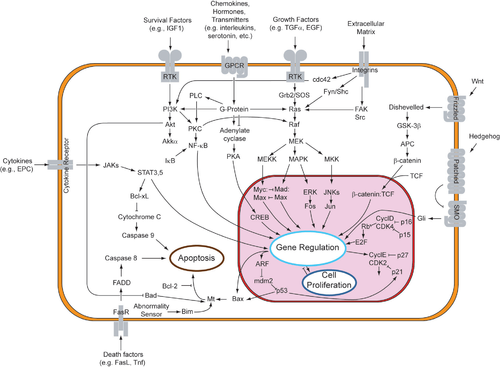


ตัวอย่างที่สำคัญของการริเริ่มกลไกอะโพโทซิสโดยตรงในสัตว์เลี้ยงลูกด้วยน้ำนมได้แก่โมเดลของการชักนำโดย TNF (tumour necrosis factor) และโมเดลที่ควบคุมโดย Fas-Fas ligand ตัวแบบทั้งสองเกี่ยวข้องกับตัวรับในกลุ่ม TNF receptor (TNFR) family[13] ที่จับกับสัญญาณจากภายนอกเซลล์
TNF เป็นไซโตไคน์ที่ถูกสร้างขึ้นมาจากเซลล์แมคโครฟาจที่ถูกกระตุ้น (activated macrophage) และนับเป็นสัญญาณภายนอกเซลล์หลักที่ควบคุมกระบวนการอะโพโทซิส เซลล์ส่วนใหญ่ในร่างกายมนุษย์มีตัวรับ 2 ชนิดที่ใช้จับกับ TNF ได้แก่ TNF-R1 และ TNF-R2 การจับกันระหว่าง TNF และ TNF-R1 จะริเริ่มวิถีซึ่งนำไปสู่การกระตุ้นแคสเปสโดยผ่านโปรตีนตัวกลางบนเมมเบรนชื่อว่า TNF receptor-associated death domain (TRADD) และ Fas-associated death domain protein (FADD) [14] นอกจากนี้การจับกับตัวรับชนิดนี้ยังทำให้เกิดการกระตุ้น transcription factor ที่เกี่ยวข้องกับการอยู่รอดของเซลล์และการตอบสนองโดยการอักเสบ[15] ความเชื่อมโยงระหว่าง TNF และกระบวนการอะโพโทซิสแสดงให้ทราบว่าเพราะเหตุใดความผิดปกติในการผลิต TNF จึงมีบทบาทหลักที่ทำให้เกิดโรคจำนวนมากในมนุษย์ โดยเฉพาะกลุ่มโรคภูมิคุ้มกันต่อต้านตนเอง (autoimmune disease)
ตัวรับ Fas (Fas receptor หรือ Apo-1 หรือ CD95) จับกับ Fas ligand (FasL) ซึ่งเป็นโปรตีนที่แทรกทะลุผ่านเยื่อหุ้มเซลล์ (transmembrane protein) ตัวหนึ่งในกลุ่ม TNF family[13] อันตรกิริยาระหว่าง Fas และ FasL ทำให้เกิดเป็นโครงสร้างเชิงซ้อนชื่อว่า death-inducing signaling complex (DISC) ซึ่งประกอบด้วย FADD, แคสเปส-8, และแคสเปส-10 ในเซลล์บางชนิด (ที่เรียกว่า type I) แคสเปส-8 จะเข้าไปกระตุ้นเอนไซม์ชนิดอื่นๆ ที่อยู่ในกลุ่มแคสเปส และเหนี่ยวนำให้เกิดกระบวนการอะโพโทซิส ส่วนในเซลล์อีกชนิดหนึ่ง (เรียกว่า type II) Fas-DISC จะมีกลไกย้อนกลับซึ่งทำให้เกิดการปล่อยแฟคเตอร์ที่กระตุ้นอะโพโทซิส (pro-apoptotic factors) จากไมโทคอนเดรียและเพิ่มการกระตุ้นแคสเปส-8 มากขึ้น[16]
หลังจากการเหนี่ยวนำกระบวนการอะโพโทซิสโดยการกระตุ้น TNF-R1 และ Fas ในเซลล์ของสัตว์เลี้ยงลูกด้วยน้ำนมแล้ว จะเกิดการเพิ่มจำนวนของยีนกระตุ้นอะโพโทซิส (BAX,[17] BID, BAK, หรือ BAD) และลดจำนวนยีนต้านอะโพโทซิส (Bcl-Xl และ Bcl-2) ซึ่งยีนทั้งสองกลุ่มต่างเป็นสมาชิกในกลุ่มยีน Bcl-2 family โฮโมไดเมอร์ (homodimer) ของโปรตีนกระตุ้นอะโพโทซิสจะทำให้เยื่อหุ้มไมโทคอนเดรียมีความซึมผ่านเพื่อให้เกิดการปล่อยสารที่กระตุ้นเอนไซม์แคสเปสเช่นไซโตโครม ซี และ SMAC ออกมาจากไมโทคอนเดรียซึ่งเป็นการกระตุ้นวิถีที่ควบคุมโดยไมโทคอนเดรียอีกทางหนึ่ง ในปัจจุบันกลไกการควบคุมโปรตีนกระตุ้นอะโพโทซิสในสภาวะปกติของเซลล์ยังไม่เข้าใจแน่ชัด แต่มีการค้นพบว่าโปรตีนที่อยู่ที่เมมเบรนชั้นนอกของไมโทคอนเดรียชื่อ VDAC2 จะทำหน้าที่ควบคุมและยับยั้ง BAK ซึ่งเป็นตัวการที่ทำให้เกิดอะโพโทซิสที่สำคัญ[18] เมื่อเซลล์ได้รับสัญญาณกระตุ้นการตาย ผลผลิตจากการกระตุ้นเอนไซม์แคสเปสจะเข้ามาแทนที่ VDAC2 และทำให้ BAK อยู่ในสภาวะที่ทำงานได้
นอกจากนี้ยังมีการค้นพบวิถีการอะโพโทซิสโดยไม่ต้องอาศัยเอนไซม์แคสเปส ซึ่งถูกควบคุมโดยแฟคเตอร์ชักนำอะโพโทซิส AIF (apoptosis-inducing factor)[19]
ขั้นตอนการตาย[แก้]
แม้ว่าจะมีกระบวนการและสารสื่อสัญญาณหลากหลายที่ชักนำให้เกิดกระบวนการอะโพโทซิส สุดท้ายกระบวนการทั้งหมดจะมารวมกันที่กลไกนี้ซึ่งทำให้เซลล์ตายอย่างแท้จริง หลังจากเซลล์ได้รับสิ่งเร้าที่เหมาะสมและผ่านการควบคุมอย่างมากมายแล้วเซลล์จะมีกระบวนการสลายออร์แกเนลล์ภายในเซลล์โดยการกระตุ้นเอนไซม์แคสเปสที่ทำหน้าที่สลายโปรตีน (proteolytic caspase) ซึ่งจะมีลักษณะรูปร่างที่จำเพาะซึ่งสามารถมองเห็นได้ภายใต้กล้องจุลทรรศน์ดังนี้
- การหดตัวของเซลล์และแตกออกเป็นชิ้นๆ รูปกลมอันเนื่องมาจากการสลายของโปรตีนไซโตสเกเลตอน (cytoskeleton) หรือโครงเซลล์โดยเอนไซม์แคสเปส
- ไซโทพลาซึม (cytoplasm) มีลักษณะหนาแน่นขึ้น และออร์แกเนลล์จะรวมตัวกันเข้าหนาแน่นขึ้น
- โครมาติน (chromatin) หดตัวแน่นขึ้นเป็นปื้นเทียบกับเยื่อหุ้มนิวเคลียสในกระบวนการที่เรียกว่า "Pyknosis" ซึ่งนับเป็นลักษณะสำคัญ (hallmark) ของอะโพโทซิส[20][21]
- เยื่อหุ้มเซลล์เกิดบวมเป็นตุ่มหรือหน่อขึ้น เรียกว่า bleb
- เซลล์แตกออกเป็นเม็ดเล็กๆ หรือเวสซิเคิล (vesicles) ซึ่งมีชื่อเรียกเฉพาะว่า อะโพโทติก บอดี (apoptotic bodies) ซึ่งต่อมาจะถูกจับกิน (phagocytosed) โดยเซลล์อื่นๆ
กระบวนการอะโพโทซิสจะเกิดขึ้นอย่างรวดเร็วมากและเศษซากจากกระบวนการดังกล่าวจะถูกกำจัดออกไปอย่างรวดเร็ว ทำให้อาจตรวจพบหรือมองเห็นได้ยาก ในกระบวนการที่นิวเคลียสแตกเป็นท่อนๆ หรือ karyorrhexis เอนไซม์เอนโดนิวคลีเอส (endonuclease) จะย่อยดีเอ็นเอออกเป็นท่อนสั้นๆ ซึ่งมีขนาดแตกต่างกันเป็นจำนวนเท่า ซึ่งทำให้เมื่อนำมาทำกระบวนการอิเล็กโตรโฟรีซิส (electrophoresis) หรือการแยกสารชีวโมเลกุลด้วยไฟฟ้าจะทำให้เห็นลักษณะเป็นขั้นบันได ("laddered" appearance) บนวุ้น (agar) ลักษณะของ DNA laddering ดังกล่าวช่วยจำแนกการตายของเซลล์แบบอะโพโทซิสออกจากการตายจากการขาดเลือดเฉพาะที่ (ischemic) หรือจากสารชีวพิษ[22]
การกำจัดซากเซลล์ที่ตาย[แก้]
เซลล์ที่ตายจากกระบวนการอะโพโทซิสในขั้นตอนสุดท้ายจะมีการนำเสนอโมเลกุลบนพื้นผิวเพื่อเป็นเครื่องหมายเรียกให้เซลล์เพื่อนบ้านมาช่วยเก็บกิน เช่น ฟอสฟาทิดิลซีรีน (phosphatidylserine)[23] ฟอสฟาทิดิลซีรีนโดยสภาวะปกติแล้วจะอยู่ที่เยื่อหุ้มเซลล์ด้านใน แต่ระหว่างการอะโพโทซิสจะถูกย้ายออกมาอยู่ด้านนอกโดยเชื่อว่าเกิดจากโปรตีนชื่อ สแครมเบลส (scramblase)[24] โมเลกุลที่เป็นเครื่องหมายดังกล่าวจะส่งสัญญาณเรียกเซลล์ข้างเคียงที่มีตัวรับที่เหมาะสม เช่น แมคโครฟาจ (macrophage) เข้ามาเกิดการกลืนกินของเซลล์[25] หลังจากเซลล์ข้างเคียงถูกกระตุ้นและรับรู้แล้ว เซลล์กลืนกิน (phagocyte) จะจัดเรียงไซโตสเกเลตอนใหม่เพื่อโอบกินเซลล์ตาย การกำจัดเศษซากเซลล์ที่ตายโดยเซลล์กลืนกินจะไม่ก่อให้เกิดกระบวนการอักเสบ
บทบาทของอะโพโทซิสต่อโรคต่างๆ[แก้]
ความบกพร่องของวิถีอะโพโทซิส[แก้]


วิถีของกระบวนการอะโพโทซิสมีจำนวนมากมายซึ่งประกอบด้วยองค์ประกอบทางชีวเคมีจำนวนมาก ซึ่งหลายอย่างที่ยังไม่มีคำอธิบายที่ชัดเจน[1] อย่างไรก็ตามการเปลี่ยนแปลงหรือความผิดปกติขององค์ประกอบใดองค์ประกอบหนึ่งมีผลกระทบต่อองค์ประกอบอื่นๆ ในวิถี ในสิ่งมีชีวิตความผิดปกติดังกล่าวจะมีผลกระทบอย่างรุนแรงและเกิดโรคหรือความผิดปกติได้ การจะอธิบายทุกโรคที่เกิดจากการเปลี่ยนแปลงของวิถีอะโพโทซิสนั้นเป็นไปไม่ได้ แต่ทุกโรคนั้นมีหลักการของสาเหตุที่เหมือนกัน นั่นคือวิถีอะโพโทซิสปกติถูกรบกวนทำให้เซลล์มีความผิดปกติในการเข้าสู่การตายแบบอะโพโทซิสตามปกติ ซึ่งทำให้เซลล์นั้นเป็นอมตะและสามารถแบ่งตัวอย่างควบคุมไม่ได้และเพิ่มโอกาสเกิดความผิดปกติของสารพันธุกรรม เพิ่มโอกาสที่เซลล์นั้นจะกลายเป็นมะเร็งหรือก่อโรคได้
ตัวอย่างที่แสดงถึงแนวความคิดดังกล่าวพบในการเจริญของมะเร็งปอดชนิด NCI-H460[26] ยีนที่ชื่อว่า X-linked inhibitor of apoptosis protein (XIAP) มีการแสดงออกเพิ่มมากขึ้นในเซลล์ตระกูล H460 cell line โปรตีน XIAPs จับกับเอนไซม์แคสเปส-9 และกดการทำงานของไซโตโครม ซี ซึ่งเป็นโปรตีนกระตุ้นอะโพโทซิส ทำให้สารกระตุ้นอะโพโทซิสลดลงและสารต้านอะโพโทซิสเพิ่มมากขึ้น เซลล์ที่มีความเสียหายจะแบ่งตัวเพิ่มแทนที่จะถูกทำลายและกลายเป็นมะเร็งในที่สุด
การขาดการควบคุมจากยีน p53[แก้]
โปรตีนต้านมะเร็ง p53 จะมีการสะสมมากขึ้นเมื่อดีเอ็นเอเสียหายจากปฏิกิริยาเคมีต่างๆ โดยผ่านวิถีซึ่งมีแอลฟา-อินเตอร์เฟอรอน (alpha-interferon) และบีตา-อินเตอร์เฟอรอน (beta-interferon) ซึ่งจะชักนำให้เกิดการถอดรหัส (transcription) ยีน p53 และเพิ่มระดับโปรตีน p53 ซึ่งช่วยส่งเสริมให้เซลล์มะเร็งเกิดการตายแบบอะโพโทซิส[27] โปรตีน p53 จะหยุดยั้งการแบ่งตัวเพิ่มจำนวนของเซลล์โดยการหยุดวัฏจักรเซลล์ที่ระยะ G1 หรืออินเตอร์เฟส (interphase) เพื่อให้เซลล์มีการซ่อมแซมหรือชักนำให้เกิดการตายหากความเสียหายนั้นมากเกินและซ่อมแซมไม่ได้ การขาดการควบคุมจากยีน p53 หรือยีนอินเตอร์เฟอรอนจะทำให้กระบวนการอะโพโทซิสเกิดไม่ได้และอาจเกิดการเปลี่ยนแปลงเป็นเซลล์มะเร็ง
การดำเนินโรคของ HIV[แก้]
การดำเนินโรคของไวรัสเอชไอวีหรือโรคเอดส์นั้นโดยหลักเกิดจากการลดจำนวนของลิมโฟไซต์ชนิด CD4+ T-helper cell และทำให้ระบบภูมิคุ้มกันบกพร่อง กลไกหนึ่งที่ทำให้เซลล์ T helper cell ลดลงนั้นเนื่องจากกระบวนการอะโพโทซิส อันเกิดจากวิถีชีวเคมีหลากหลายอย่าง ได้แก่[28]
- เอนไซม์ของไวรัส HIV ยับยั้งยีนต้านอะโพโทซิส Bcl-2 และกระตุ้นยีนกระตุ้นอะโพโทซิส โปรแคสเปส-8 (procaspase-8) แม้ว่ากลไกดังกล่าวไม่ได้ทำให้เซลล์ตายโดยตรงแต่เป็นการเตรียมเซลล์ให้เกิดอะโพโทซิสหลังจากได้รับสัญญาณกระตุ้น
- ผลผลิตจากเชื้อ HIV จะเพิ่มระดับของโปรตีนในเซลล์ซึ่งสนับสนุนให้เกิดกระบวนการอะโพโทซิสที่ควบคุมโดย Fas
- โปรตีนของเชื้อ HIV ลดจำนวนการแสดงออกของโมเลกุลไกลโคโปรตีน CD4 บนเยื่อหุ้มเซลล์
- การปลดปล่อยอนุภาคและโปรตีนของไวรัสออกมาภายนอกเซลล์ ชักนำกระบวนการอะโพโทซิสใน T-helper cell ตัวอื่นๆ
- ไวรัส HIV ลดการผลิตโมเลกุลที่เป็นเครื่องหมาย (marker) ให้เกิดกระบวนการอะโพโทซิส จึงชะลอเวลาให้ไวรัสสามารถแบ่งตัวเพิ่มจำนวนและปล่อยสารอะโพโทซิส (apoptotic agent) และวิริออน (virion) ออกมายังเนื้อเยื่อรอบข้าง
- เซลล์ CD4+ ที่ติดเชื้อสามารถรับสัญญาณกระตุ้นการตายจาก cytotoxic T cell ทำให้เกิดอะโพโทซิส
นอกจากเซลล์ที่ติดเชื้อจะตายจากกระบวนการอะโพโทซิสแล้ว ยังจะตายจากผลของการติดเชื้อไวรัสโดยตรงได้อีกด้วย
การติดเชื้อไวรัส[แก้]
ไวรัสสามารถกระตุ้นให้เซลล์ที่ติดเชื้อเกิดอะโพโทซิสได้โดยกลไกหลากหลาย เช่น
- การจับกับตัวรับ (receptor binding)
- การกระตุ้น protein kinase R (PKR)
- อันตรกิริยากับโปรตีน p53
- การแสดงออกของโปรตีนไวรัสร่วมกับโปรตีน MHC บนพื้นผิวของเซลล์ที่ติดเชื้อไวรัส ซึ่งทำให้เซลล์ในระบบภูมิคุ้มกันเช่น NK cell หรือ cytotoxic T cell รับรู้ และตอบสนองโดยชักนำให้เซลล์ติดเชื้อเกิดอะโพโทซิส[29]
ไวรัสส่วนใหญ่จะถอดรหัสโปรตีนซึ่งยับยั้งกระบวนการอะโพโทซิส[30] ไวรัสหลายชนิดสร้างโปรตีนซึ่งมีต้นกำเนิดเหมือน (homolog) กับ Bcl-2 ซึ่งสามารถยับยั้งโปรตีนกระตุ้นอะโพโทซิส (pro-apoptotic protein) เช่น BAX และ BAK ตัวอย่างของโปรตีน Bcl-2 ของไวรัสเช่นโปรตีน BHRF1 ของเอพสไตน์-บารร์ไวรัส (Epstein-Barr virus) หรือโปรตีน E1B 19K ของอะดีโนไวรัส (adenovirus)[31] ไวรัสบางชนิดแสดงออกโปรตีนที่ยับยั้งเอนไซม์แคสเปส เช่นโปรตีน CrmA ของไวรัสฝีดาษวัว (cowpox) ในขณะที่ไวรัสหลายชนิดสามารถยับยั้งการทำงานของ TNF และ Fas ตัวอย่างเช่นโปรตีน M-T2 ของมิกโซมาไวรัส (myxoma viruses) สามารถจับกับ TNF เพื่อป้องกันไม่ให้ TNF จับกับตัวรับได้[32] นอกจากนี้ไวรัสหลายชนิดแสดงออกโปรตีนที่ยับยั้ง p53 ซึ่งทำให้ p53 ไม่สามารถชักนำการแสดงออกของโปรตีนกระตุ้นอะโพโทซิส (pro-apoptotic proteins) และไม่สามารถชักนำให้เซลล์เกิดกระบวนการอะโพโทซิสได้ ตัวอย่างเช่นโปรตีน E1B-55K ของอะดีโนไวรัสและโปรตีน HBx ของไวรัสตับอีกเสบ บี[33]
น่าสนใจว่าไวรัสนั้นยังคงอยู่ภายในเซลล์ที่เกิดอะโพโทซิสโดยไม่ได้รับความเสียหายโดยเฉพาะอย่างยิ่งในระยะท้ายๆ ของการติดเชื้อ ไวรัสสามารถถูกขับออกมาอยู่ภายใน อะโพโทติก บอดี ที่แยกออกมาจากพื้นผิวของเซลล์ที่กำลังตาย และถูกจับกินโดยเซลล์ข้างเคียงซึ่งทำให้เกิดการกระจายของไวรัสยังเซลล์อื่นๆ ต่อไป[32]
ดูเพิ่ม[แก้]
อ้างอิง[แก้]
- ↑ 1.0 1.1 Thompson, CB (1995). "Apoptosis in the pathogenesis and treatment of disease". Science. 267 (5203): 1456–62. doi:10.1126/science.7878464. PMID 7878464.
- ↑ Guerrero I, Ruiz i Altaba A (Aug 2003). "Development. Longing for ligand: hedgehog, patched, and cell death". Science (journal). 301 (5634): 774–6. doi:10.1126/science.1088625. PMID 12907783.
- ↑ Thibert C, Teillet MA, Lapointe F, Mazelin L, Le Douarin NM, Mehlen P (Aug 2003). "Inhibition of neuroepithelial patched-induced apoptosis by sonic hedgehog". Science (journal). 301 (5634): 843–6. doi:10.1126/science.1085405. PMID 12907805.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Werlen G; และคณะ (2003). "Signaling life and death in the thymus: timing is everything". Science. 299 (5614): 1859–63. doi:10.1126/science.1067833. PMID 12649474.
- ↑ 5.0 5.1 5.2 5.3 5.4 Cotran RS, Kumar C (1998). Robbins Pathologic Basis of Disease. Philadelphia: W.B Saunders Company. ISBN 978-0-7216-7335-6.
- ↑ Popov SG, Villasmil R, Bernardi J; และคณะ (Apr 2002). "Lethal toxin of Bacillus anthracis causes apoptosis of macrophages". Biochem. Biophys. Res. Commun. 293 (1): 349–55. doi:10.1016/S0006-291X(02)00227-9. PMID 12054607.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 7.0 7.1 Brüne B (August 2003). "Nitric oxide: NO apoptosis or turning it ON?". Cell Death and Differentiation. 10 (8): 864–869. doi:10.1038/sj.cdd.4401261. PMID 12867993.
- ↑ Chiarugi A, Moskowitz MA (2002). "PARP-1—a perpetrator of apoptotic cell death?". Science. 297 (5579): 259–63. doi:10.1126/science.1074592. PMID 12114611.
- ↑ Fesik SW, Shi Y (November 2001). "Structural biology. Controlling the caspases". Science. 294 (5546): 1477–1478. doi:10.1126/science.1062236. PMID 11711663. S2CID 11392850.
- ↑ Laurent M. Dejean, Sonia Martinez-Caballero, Kathleen W. Kinnally (2006). "Is MAC the knife that cuts cytochrome c from mitochondria during apoptosis?". Cell Death and Differentiation. 13: 1387–5. doi:10.1038/sj.cdd.4401949.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Dejean LM, Martinez-Caballero S, Manon S, Kinnally KW (Feb 2006). "Regulation of the mitochondrial apoptosis-induced channel, MAC, by BCL-2 family proteins". Biochim. Biophys. Acta. 1762 (2): 191–201. doi:10.1016/j.bbadis.2005.07.002. PMID 16055309.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lodish, Harvey; และคณะ (2004). Molecular Cell Biology. New York: W.H. Freedman and Company. 0-7167-4366-3.
- ↑ 13.0 13.1 Wajant H (2002). "The Fas signaling pathway: more than a paradigm". Science. 296 (5573): 1635–6. doi:10.1126/science.1071553. PMID 12040174.
- ↑ Chen G, Goeddel DV (2002). "TNF-R1 signaling: a beautiful pathway". Science. 296 (5573): 1634–5. doi:10.1126/science.1071924. PMID 12040173.
- ↑ Goeddel, DV (2007). "Connection Map for Tumor Necrosis Factor Pathway". Science's STKE. 2007 (382): tw132. doi:10.1126/stke.3822007tw132. S2CID 85404086. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-07-10. สืบค้นเมื่อ 2004-01-01.
- ↑ Wajant H (2007). "Connection Map for Fas Signaling Pathway". Science's STKE. 2007 (380): tr1. doi:10.1126/stke.3802007tr1. S2CID 84909531. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2009-05-03. สืบค้นเมื่อ 2004-01-01.
- ↑ Murphy KM, Ranganathan V, Farnsworth ML, Kavallaris M, Lock RB (January 2000). "Bcl-2 inhibits Bax translocation from cytosol to mitochondria during drug-induced apoptosis of human tumor cells". Cell Death and Differentiation. 7 (1): 102–111. doi:10.1038/sj.cdd.4400597. PMID 10713725.
- ↑ Cheng EH (2003). "VDAC2 inhibits BAK activation and mitochondrial apoptosis". Science. 301 (5632): 513–7. doi:10.1126/science.1083995. PMID 12881569.
- ↑ Susin SA, Lorenzo HK, Zamzami N, Marzo I, Snow BE, Brothers GM, และคณะ (February 1999). "Molecular characterization of mitochondrial apoptosis-inducing factor". Nature. 397 (6718): 441–446. Bibcode:1999Natur.397..441S. doi:10.1038/17135. PMID 9989411. S2CID 204991081.
- ↑ Susin SA, Daugas E, Ravagnan L, Samejima K, Zamzami N, Loeffler M, และคณะ (August 2000). "Two distinct pathways leading to nuclear apoptosis". The Journal of Experimental Medicine. 192 (4): 571–580. doi:10.1084/jem.192.4.571. PMC 2193229. PMID 10952727.
- ↑ Kihlmark M, Imreh G, Hallberg E (October 2001). "Sequential degradation of proteins from the nuclear envelope during apoptosis". Journal of Cell Science. 114 (Pt 20): 3643–3653. doi:10.1242/jcs.114.20.3643. PMID 11707516.
- ↑ Iwata M, Myerson D, Torok-Storb B, Zager RA (December 1994). "An evaluation of renal tubular DNA laddering in response to oxygen deprivation and oxidant injury". Journal of the American Society of Nephrology. 5 (6): 1307–1313. doi:10.1681/ASN.V561307. PMID 7893995.
- ↑ Li MO, Sarkisian MR, Mehal WZ, Rakic P, Flavell RA (November 2003). "Phosphatidylserine receptor is required for clearance of apoptotic cells". Science. 302 (5650): 1560–1563. Bibcode:2003Sci...302.1560O. doi:10.1126/science.1087621. PMID 14645847. S2CID 36252352.
- ↑ Wang X, Wu YC, Fadok VA, Lee MC, Gengyo-Ando K, Cheng LC, และคณะ (November 2003). "Cell corpse engulfment mediated by C. elegans phosphatidylserine receptor through CED-5 and CED-12". Science. 302 (5650): 1563–1566. Bibcode:2003Sci...302.1563W. doi:10.1126/science.1087641. PMID 14645848. S2CID 25672278. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2021-04-14. สืบค้นเมื่อ 2017-02-26.
- ↑ Savill J, Gregory C, Haslett C (November 2003). "Cell biology. Eat me or die". Science. 302 (5650): 1516–1517. doi:10.1126/science.1092533. hdl:1842/448. PMID 14645835. S2CID 13402617.
- ↑ Yang L, Mashima T, Sato S, Mochizuki M, Sakamoto H, Yamori T, และคณะ (February 2003). "Predominant suppression of apoptosome by inhibitor of apoptosis protein in non-small cell lung cancer H460 cells: therapeutic effect of a novel polyarginine-conjugated Smac peptide". Cancer Research. 63 (4): 831–837. PMID 12591734. เก็บจากแหล่งเดิมเมื่อ 2012-12-20. สืบค้นเมื่อ 2008-09-04.
- ↑ Takaoka A, Hayakawa S, Yanai H, Stoiber D, Negishi H, Kikuchi H, และคณะ (July 2003). "Integration of interferon-alpha/beta signalling to p53 responses in tumour suppression and antiviral defence". Nature. 424 (6948): 516–523. Bibcode:2003Natur.424..516T. doi:10.1038/nature01850. PMID 12872134.
- ↑ Alimonti JB, Ball TB, Fowke KR (July 2003). "Mechanisms of CD4+ T lymphocyte cell death in human immunodeficiency virus infection and AIDS". The Journal of General Virology. 84 (Pt 7): 1649–1661. doi:10.1099/vir.0.19110-0. PMID 12810858.
- ↑ Everett H, McFadden G (April 1999). "Apoptosis: an innate immune response to virus infection". Trends in Microbiology. 7 (4): 160–165. doi:10.1016/S0966-842X(99)01487-0. PMID 10217831.
- ↑ Teodoro JG, Branton PE (March 1997). "Regulation of apoptosis by viral gene products". Journal of Virology. 71 (3): 1739–1746. doi:10.1128/jvi.71.3.1739-1746.1997. PMC 191242. PMID 9032302.
- ↑ Polster BM, Pevsner J, Hardwick JM (March 2004). "Viral Bcl-2 homologs and their role in virus replication and associated diseases". Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1644 (2–3): 211–227. doi:10.1016/j.bbamcr.2003.11.001. PMID 14996505.
- ↑ 32.0 32.1 Hay S, Kannourakis G (July 2002). "A time to kill: viral manipulation of the cell death program". The Journal of General Virology. 83 (Pt 7): 1547–1564. CiteSeerX 10.1.1.322.6923. doi:10.1099/0022-1317-83-7-1547. PMID 12075073.
- ↑ Wang XW, Gibson MK, Vermeulen W, Yeh H, Forrester K, Stürzbecher HW, และคณะ (December 1995). "Abrogation of p53-induced apoptosis by the hepatitis B virus X gene". Cancer Research. 55 (24): 6012–6016. PMID 8521383.
แหล่งข้อมูลอื่น[แก้]
- Apoptosis & Caspase 3, The Proteolysis Map – animation
- Apoptosis & Caspase 8, The Proteolysis Map – animation
- Apoptosis & Caspase 7, The Proteolysis Map – animation
- Apoptosis MiniCOPE Dictionary – list of apoptosis terms and acronyms
- Apoptosis (Programmed Cell Death) – The Virtual Library of Biochemistry, Molecular Biology and Cell Biology เก็บถาวร 2021-04-25 ที่ เวย์แบ็กแมชชีน
- Apoptosis Research Portal
- Apoptosis Info Apoptosis protocols, articles, news, and recent publications.
- Database of proteins involved in apoptosis
- Apoptosis Video
- Apoptosis Video (WEHI on YouTube )
- The Mechanisms of Apoptosis เก็บถาวร 2018-03-09 ที่ เวย์แบ็กแมชชีน Kimball's Biology Pages. Simple explanation of the mechanisms of apoptosis triggered by internal signals (bcl-2), along the caspase-9, caspase-3 and caspase-7 pathway; and by external signals (FAS and TNF), along the caspase 8 pathway. Accessed 25 March 2007.
- WikiPathways – Apoptosis pathway เก็บถาวร 2008-09-16 ที่ เวย์แบ็กแมชชีน
- "Finding Cancer's Self-Destruct Button". CR magazine (Spring 2007). Article on apoptosis and cancer.
- Xiaodong Wang's lecture: Introduction to Apoptosis เก็บถาวร 2013-10-29 ที่ เวย์แบ็กแมชชีน
- Robert Horvitz's Short Clip: Discovering Programmed Cell Death
- The Bcl-2 Database เก็บถาวร 2013-10-23 ที่ เวย์แบ็กแมชชีน
- DeathBase: a database of proteins involved in cell death, curated by experts
- European Cell Death Organization
- Apoptosis signaling pathway created by Cusabio
