เอมีน

ในวิชาเคมี เอมีน (Amine) เป็นชื่อสารประกอบและหมู่ฟังก์ชันที่ประกอบด้วยอะตอมไนโตรเจนที่มีอิเล็กตรอนคู่โดดเดี่ยว เอมีนเป็นอนุพันธ์ของแอมโมเนีย (NH3) โดยที่อะตอมไฮโดรเจนหนึ่งอะตอมหรือมากกว่าจะถูกแทนที่ด้วยหมู่ Alkyl หรือหมู่ Aryl เอมีนที่สำคัญ ได้แก่ กรดอะมิโน trimethylamine และอะนิลีน
หมู่แทนที่ −NH2 เรียกว่า หมู่อะมิโน
สารประกอบที่มีอะตอมไนโตรเจนเกาะติดกับหมู่คาร์บอนิล จึงมีโครงสร้าง R−C(=O)−NR′R″ เรียกว่า เอไมด์ และมีคุณสมบัติทางเคมีที่แตกต่างจากเอมีน
การจำแนกประเภทของเอมีน
[แก้]เอมีนสามารถจำแนกได้ตามหมู่แทนที่ไฮโดรเจนที่เกาะบนไนโตรเจน อะลิฟาติกเอมีนมีเพียงหมู่แทนที่ H และอัลคิล ส่วนอะโรมาติกเอมีนมีอะตอมไนโตรเจนเชื่อมต่อกับวงอะโรมาติก
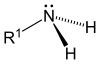
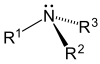
| เอมีนปฐมภูมิ (1°) | เอมีนทุติยภูมิ (2°) | เอมีนตติยภูมิ (3°) |
|---|---|---|
|

|
|
เอมีนถูกจัดออกเป็นสามประเภทย่อย ขึ้นอยู่กับจำนวนอะตอมของคาร์บอน ที่อยู่ติดกับไนโตรเจน (จำนวนอะตอมไฮโดรเจนของโมเลกุลแอมโมเนียถูกแทนที่ด้วยสารประกอบไฮโดรคาร์บอน): [1]
- เอมีนปฐมภูมิ (1°) เอมีนปฐมภูมิเกิดขึ้นเมื่ออะตอมไฮโดรเจนหนึ่งในสามอะตอมในแอมโมเนีย ถูกแทนที่ด้วยหมู่อัลคิลหรือสารอะโรมาติก อัลคิลเอมีนปฐมภูมิที่สำคัญ ได้แก่ methylamine กรดอะมิโน ส่วนใหญ่ บัฟเฟอร์ ในขณะที่อะโรมาติกเอมีนปฐมภูมิ ได้แก่ อะนิลีน
- เอมีนทุติยภูมิ (2°) เอมีนทุติยภูมิมีหมู่แทนที่สองตัว (อัลคิล อะริล หรือทั้งสองอย่าง) จับกับไนโตรเจนร่วมกับไฮโดรเจนหนึ่งตัว สารประกอบที่สำคัญ ได้แก่ Dimethylamine ในขณะที่ตัวอย่างของอะโรมาติกเอมีน ได้แก่ Diphenylamine
- เอมีนตติยภูมิ (3°) —ในเอมีนตติยภูมิ ไนโตรเจนจะมีหมู่แทนที่สามตัว เช่น Trimethylamine ซึ่งมีกลิ่นคาวอย่างเห็นได้ชัด และ EDTA
หมวดหมู่ย่อยที่สี่ถูกกำหนดโดยการเชื่อมต่อขององค์ประกอบทดแทนที่ติดอยู่กับไนโตรเจน:
- ไซคลิกเอมีน (Cyclic amines) - ไซคลิกเอมีนเป็นเอมีนทุติยภูมิหรือตติยภูมิเป็นวง ตัวอย่างของไซคลิกเอมีน คือ อะซิริดีน ซึ่งเป็นวงสามเหลี่ยม และพิเพอริดีนซึ่งเป็นวงหกเหลี่ยม
นอกจากนี้ยังเป็นไปได้ที่จะมีหมู่แทนที่สี่ตัวบนไนโตรเจน เหล่านี้ไม่ใช่เอมีน แต่เป็น Quaternary ammonium cation และไนโตรเจนจะมีประจุเป็น +1 เกลือควอเทอร์นารีแอมโมเนียมมักพบเจอกับแอนไอออนหลายชนิด และสามารถละลายน้ำได้
การอ่านชื่อสารประกอบเอมีน
[แก้]เอมีนมีวิธีอ่านชื่อได้หลายวิธี โดยปกติแล้วสารประกอบจะมีคำนำหน้าว่า "amino-" หรือต่อท้ายว่า "-amine" คำนำหน้า " N -" แสดงถึงการแทนที่ในอะตอมไนโตรเจน สารประกอบอินทรีย์ที่มีหมู่อะมิโนหลายหมู่เรียกว่า diamine, triamine, tetraamine

บางครั้งสารประกอบเอมีนจะให้คำนำหน้า amino เป็นหมู่ฟังก์ชัน อย่างไรก็ตาม IUPAC ไม่แนะนำหลักเกณฑ์นี้ [2] แต่ให้ใช้รูปแบบ alkanamine เช่น butan-2-amine

คุณสมบัติทางกายภาพ
[แก้]พันธะไฮโดรเจนส่งผลต่อคุณสมบัติของเอมีนปฐมภูมิและทุติยภูมิ ตัวอย่างเช่น เมทิลและเอทิลลามีนเป็นก๊าซภายใต้สภาวะมาตรฐาน ในขณะที่เมทิลและเอทิลแอลกอฮอล์เป็นของเหลว เอมีนมีกลิ่นแอมโมเนียที่มีลักษณะเฉพาะ เอมีนเหลวมีกลิ่น "คาว" และเหม็นเป็นพิเศษ
อะตอมไนโตรเจนมีอิเล็กตรอนคู่โดดเดี่ยว ที่สามารถจับ H+ เพื่อสร้างแอมโมเนียมไอออน R3NH+ คู่อิเล็กตรอนเดี่ยวแสดงในบทความนี้ด้วยจุดสองจุดด้านบนหรือถัดจาก N ความสามารถในการละลายน้ำของเอมีนจะเพิ่มขึ้นโดย พันธะไฮโดรเจน ที่เกี่ยวข้องกับคู่อิเล็กตรอนเดี่ยวเหล่านี้ โดยทั่วไปแล้วเกลือของสารประกอบแอมโมเนียมจะแสดงลำดับความสามารถในการละลายในน้ำดังต่อไปนี้: แอมโมเนียมปฐมภูมิ (R3NH+) > แอมโมเนียมทุติยภูมิ (R2NH2+) > แอมโมเนียมตติยภูมิ (R3NH+) ส่วนอะลิฟาติกเอมีนขนาดเล็กแสดงความสามารถในการละลายได้ในตัวทำละลายหลายชนิด ในขณะที่เอมีนขนาดใหญ่จะเป็นสารที่ละลายในตัวทำละลายไม่มีขั้ว อะโรมาติกเอมีน เช่น อะนิลีน มีวงเบนซีน ดังนั้น แนวโน้มที่จะเกิดพันธะไฮโดรเจนจึงลดลง จุดเดือดสูงและความสามารถในการละลายในน้ำต่ำ
การระบุโครงสร้างโดยใช้สเปกโทรสโกปี
[แก้]โดยทั่วไป การมีอยู่ของเอมีนจะอนุมานจะใช้เทคนิคต่างๆ ร่วมกัน เช่น แมสสเปกโตรเมทรี ตลอดจนสเปกโทรสโกปี NMR และ IR 1H NMR สัญญาณสำหรับเอมีนจะหายไปเมื่อใช้ D2O เป็นตัวทำละลาย เอมีนปฐมภูมิในสเปกตรัมอินฟราเรดจะมีพีค NH สองแถบ ในขณะที่เอมีนทุติยภูมิจะแสดงเพียงพีคเดียว ใกล้กับ 3300 cm -1
อัลคิลเอมีน
[แก้]
อัลคิลเอมีนมีลักษณะเด่นคือไนโตรเจนมีโครงสร้างแบบทรงสี่หน้า มุม CNC และ CNH เข้าใกล้มุมในอุดมคติที่ 109.5° ระยะ CN สั้นกว่าระยะ CC เล็กน้อย ผลต่างพลังงานสำหรับการผกผันสเตอริโอเซ็นเตอร์ของไนโตรเจนของมีค่าประมาณ 7 กิโลแคลอรี/โมล สำหรับไตรอัลคิลลามีน การเปลี่ยนแปลงระหว่างกันนั้นถูกเปรียบเทียบกับการกลับด้านของร่มที่เปิดอยู่เป็นลมแรง
อะโรมาติกเอมีน
[แก้]ในอะโรมาติกเอมีน หรือ "อะนิลีน" ไนโตรเจนมักจะอยู่ในระนาบเกือบเนื่องจากคอนจุเกชันกับหมู่แทนที่อะริล ระยะห่างของ CN ก็สั้นลงตามลำดับ ในอะนิลีน ระยะ CN จะเท่ากับระยะ CC [3]
ความเป็นเบสของเอมีน
[แก้]เช่นเดียวกับแอมโมเนีย เอมีนก็เป็นเบส[4] เมื่อเปรียบเทียบกับไฮดรอกไซด์ของโลหะอัลคาไลน์ เอมีนจะเป็นเบสที่อ่อนกว่า
| Alkylamine[5] or aniline[6] | pKa of
protonated amine |
Kb |
|---|---|---|
| Methylamine (MeNH2) | 10.62 | 4.17×10−4 |
| Dimethylamine (Me2NH) | 10.64 | 4.37×10−4 |
| Trimethylamine (Me3N) | 9.76 | 5.75×10−5 |
| Ethylamine (EtNH2) | 10.63 | 4.27×10−4 |
| Aniline (PhNH2) | 4.62 | 4.17×10−10 |
| 4-Methoxyaniline (4-MeOC6H4NH2) | 5.36 | 2.29×10−9 |
| N,N-Dimethylaniline (PhNMe2) | 5.07 | 1.17×10−9 |
| 3-Nitroaniline (3-NO2-C6H4NH2) | 2.46 | 2.88×10−12 |
| 4-Nitroaniline (4-NO2-C6H4NH2) | 1.00 | 1.00×10−13 |
| 4-Trifluoromethylaniline (CF3C6H4NH2) | 2.75 | 5.62×10−12 |
ความเป็นเบสของเอมีนขึ้นอยู่กับ:
- คุณสมบัติของหมู่แทนที่ (หมู่อัลคิลช่วยเพิ่มความเป็นเบส ส่วนหมู่เอริลจะทำให้ความเป็นเบสลดลง)
- การละลายของเอมีนในตัวทำละลายที่แตกตัวให้โปรตอนได้ ซึ่งรวมถึงการขัดขวางแบบสเตอริกโดยกลุ่มไนโตรเจน
เอฟเฟกต์อิเล็กทรอนิกส์
[แก้]เนื่องจาก inductive effect ความเป็นเบสของเอมีนอาจเพิ่มขึ้นตามจำนวนหมู่อัลคิลบนเอมีน สำหรับอะนิลีน อิเล็กตรอนคู่เดียวบนไนโตรเจนกระจายเข้าในวงเบนซีนได้ ส่งผลให้ค่าพื้นฐานลดลง หมู่แทนที่บนวงแหวนอะโรมาติก และตำแหน่งเมื่อเทียบกับหมู่อะมิโน ยังส่งผลต่อความเป็นเบสอีกด้วย
การสังเคราะห์
[แก้]จากแอลกอฮอล์
[แก้]อัลคิลเอมีนที่มีนัยสำคัญทางอุตสาหกรรมเตรียมจากแอมโมเนียโดยอัลคิลเลชันกับแอลกอฮอล์: [7]
จากอัลคิลและเอริลเฮไลด์
[แก้]ปฏิกิริยาของเอมีนและแอมโมเนียกับอัลคิลเฮไลด์ต่างจากปฏิกิริยาของเอมีนกับแอลกอฮอล์ เพราะนิยมใช้ในการสังเคราะห์ในห้องปฏิบัติการ:
ผ่านปฎิกิริยารีดักชัน
[แก้]โดยกระบวนการไฮโดรจิเนชัน หมู่ฟังก์ชันที่มี N ไม่อิ่มตัวจะถูกรีดิวซ์เป็นเอมีนโดยใช้ไฮโดรเจนเมื่อมีตัวเร่งปฏิกิริยานิกเกิล หมู่ที่เหมาะสมรวมถึง ไนตริล เอไซด์ อิมีน ออกไซม เอไมด์ และไนโตร ในกรณีของไนตริล ปฏิกิริยาจะไวต่อสภาวะที่เป็นกรดหรือด่าง ซึ่งสามารถทำให้เกิดการไฮโดรไลซิสของ−CN โดยทั่วไปมีการใช้ LiAlH₄ สำหรับการรีดิวซ์ในห้องปฏิบัติการ
เอมีนจำนวนมากผลิตจากอัลดีไฮด์และคีโตนโดยผ่าน reductive amination ซึ่งสามารถดำเนินการแบบเร่งปฏิกิริยาหรือแบบปกติก็ได้
วิธีการเฉพาะทาง
[แก้]มีหลายวิธีในการเตรียมเอมีน ซึ่งหลายวิธีเหล่านี้ค่อนข้างเฉพาะทาง
| Reaction name | Substrate | Comment |
|---|---|---|
| Staudinger reduction | Organic azide | This reaction also takes place with a reducing agent such as lithium aluminium hydride. |
| Schmidt reaction | Carboxylic acid | |
| Aza-Baylis–Hillman reaction | Imine | Synthesis of allylic amines |
| Birch reduction | Imine | Useful for reactions that trap unstable imine intermediates, such as Grignard reactions with nitriles.[8] |
| Hofmann degradation | Amide | This reaction is valid for preparation of primary amines only. Gives good yields of primary amines uncontaminated with other amines. |
| Hofmann elimination | Quaternary ammonium salt | Upon treatment with strong base |
| Leuckart reaction | Ketones and aldehydes | Reductive amination with formic acid and ammonia via an imine intermediate |
| Hofmann–Löffler reaction | Haloamine | |
| Eschweiler–Clarke reaction | Amine | Reductive amination with formic acid and formaldehyde via an imine intermediate |
ปฏิกิริยาของเอมีน
[แก้]อัลคิเลชัน เอซิลเลชันและซัลโฟเนชัน ฯลฯ
[แก้]นอกเหนือจากความเป็นเบสแล้ว สิ่งที่โดดเด่นของเอมีนก็คือ ความเป็นนิวคลีโอฟิลิก เอมีนปฐมภูมิส่วนใหญ่เป็นลิแกนด์ที่ดีสำหรับไอออนของโลหะเพื่อสร้างสารเชิงซ้อน เราสามารถเพิ่มหมู่แทนที่โดยอัลคิลเฮไลด์ ส่วนเอซิลคลอไรด์และแอนไฮไดรด์ทำปฏิกิริยากับเอมีนปฐมภูมิและทุติยภูมิเพื่อสร้างเอไมด์ (Schotten–Baumann reaction)
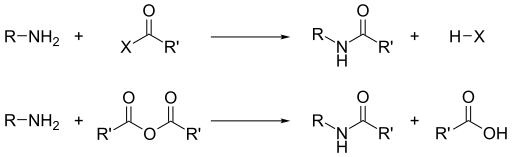
ในทำนองเดียวกัน หากทำปฏิกิริยากับซัลโฟนิลคลอไรด์ เราก็จะได้ซัลโฟนาไมด์ ปฏิกิริยานี้เรียกว่า Hinsberg reaction ซึ่งเป็นหนึ่งในการวิเคราะห์เอมีน
เนื่องจากเอมีนเป็นเบสจึงทำให้กรดเป็นกลางและเกิดเกลือแอมโมเนียม เช่น ปฏิกิริยาระหว่างกรดคาร์บอกซิลิกและเอมีนปฐมภูมิและทุติยภูมิ จะได้เกลือแอมโมเนียม และเกลือเมื่อให้ความร้อนจะเกิดเอไมด์
เอมีนเกิดปฏิกิริยาซัลฟาเมชัน จากซัลเฟอร์ไตรออกไซด์ หรือแหล่งที่มาของสารดังกล่าว:
ไดอะโซไทเซชัน
[แก้]เอมีนทำปฏิกิริยากับกรดไนตรัสได้เกลือไดอะโซเนียม ไดอาโซเนียมที่เกิดขึ้นจะไม่เสถียร
แต่อะนิลีนและแนพทิลามีนก่อให้เกิดเกลือไดอะโซเนียมที่มีความเสถียรมากกว่า ซึ่งสามารถแยกได้ในรูปผลึก เกลือไดอะโซเนียมมีประโยชน์มาก เพราะ N2 สามารถเกิดปฏิกิริยาแทนที่กับแอนไอออน ตัวอย่างเช่น cuprous cyanide (CuCN) ทำให้เกิดสารประกอบไนตริล:
อะริลไดอะโซเนียมเกิดปฏิกิริยากับสารประกอบอะโรมาติกที่มีหมู่ให้อิเล็กตรอน เช่น ฟีนอล จะเกิดสารประกอบเอโซ ปฏิกิริยาดังกล่าวใช้กันอย่างแพร่หลายในการผลิตสีย้อม [9]
การสังเคราะห์อิมมีน
[แก้]การก่อตัวของอิมมีน เป็นปฏิกิริยาที่สำคัญ โดยเอมีนปฐมภูมิทำปฏิกิริยากับคีโตนและอัลดีไฮด์ เพื่อสร้างอิมมีน ในกรณีของฟอร์มาลดีไฮด์ (R' = H) โดยทั่วไปแล้วผลิตภัณฑ์เหล่านี้จะมีอยู่ในรูปของวงไตรเมอร์
ปฏิกิริยารีดักชันของอิมีนเหล่านี้จะทำให้เกิดเอมีนทุติยภูมิ:
ในทำนองเดียวกัน เอมีนทุติยภูมิทำปฏิกิริยากับคีโตนและอัลดีไฮด์เพื่อสร้างอินามีน:
ภาพรวม
[แก้]ภาพรวมของปฏิกิริยาของเอมีนแสดงไว้ด้านล่าง:
อ้างอิง
[แก้]- ↑ "3.11 Basic properties of amines". Chemistry LibreTexts (ภาษาอังกฤษ). 2015-09-28. เก็บจากแหล่งเดิมเมื่อ 23 May 2021. สืบค้นเมื่อ 2021-05-23.
- ↑ Hellwich, K.-H.; Hartshorn, R. M.; Yerin, A.; Damhus, T.; Hutton, A. T. (June 2021). "Brief Guide to the Nomenclature of Organic Chemistry" (PDF). The International Union of Pure and Applied Chemistry (IUPAC). สืบค้นเมื่อ 2024-03-07.
- ↑ G. M. Wójcik "Structural Chemistry of Anilines" in Anilines (Patai's Chemistry of Functional Groups), S. Patai, Ed. 2007, Wiley-VCH, Weinheim. doi:10.1002/9780470682531.pat0385
- ↑ J. W. Smith (1968). "Basicity and complex formation". Patai's Chemistry of Functional Groups: 161–204. doi:10.1002/9780470771082.ch4. ISBN 9780470771082.
- ↑ Hall, H. K. (1957). "Correlation of the Base Strengths of Amines". Journal of the American Chemical Society. 79 (20): 5441–5444. doi:10.1021/ja01577a030.
- ↑ Kaljurand, I.; Kütt, A.; Sooväli, L.; Rodima, T.; Mäemets, V.; Leito, I.; Koppel, I. A. (2005). "Extension of the Self-Consistent Spectrophotometric Basicity Scale in Acetonitrile to a Full Span of 28 pKa Units: Unification of Different Basicity Scales". The Journal of Organic Chemistry. 70 (3): 1019–1028. doi:10.1021/jo048252w. PMID 15675863.
- ↑ Eller, Karsten; Henkes, Erhard; Rossbacher, Roland; Höke, Hartmut (2000), "Amines, Aliphatic", Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, doi:10.1002/14356007.a02_001
- ↑ Weiberth, Franz J.; Hall, Stan S. (1986). "Tandem alkylation-reduction of nitriles. Synthesis of branched primary amines". Journal of Organic Chemistry. 51 (26): 5338–5341. doi:10.1021/jo00376a053.
- ↑ Hunger, Klaus; Mischke, Peter; Rieper, Wolfgang; Raue, Roderich; Kunde, Klaus; Engel, Aloys (2000). "Azo Dyes". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a03_245. ISBN 3527306730.


![{\displaystyle {\ce {RX + 2 R'NH2 -> RR'NH + [RR'NH2]X}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6794927305086253cb9a82bae6719d74c1ae1c83)
![Amine reaction with carboxylic acids {\displaystyle {\underbrace {\ce {H-\!\!{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!\!\!:}} _{\text{amine}}+\underbrace {\ce {R3-{\overset {\displaystyle O \atop \|}{C}}-OH}} _{\text{carboxylic acid}}->}\ \underbrace {\ce {{H-{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N+}}}-H}+R3-COO^{-}}} _{{\text{substituted-ammonium}} \atop {\text{carboxylate salt}}}{\ce {->[{\text{heat}}][{\text{dehydration}}]}}{\underbrace {\ce {{\overset {\displaystyle R1 \atop |}{\underset {| \atop \displaystyle R2}{N}}}\!\!-{\overset {\displaystyle O \atop \|}{C}}-R3}} _{\text{amide}}+\underbrace {\ce {H2O}} _{\text{water}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0fe12f730885534fda8c9f8c41b2bd6ba4371fcc)





