อินโดล
| อินโดล | |
|---|---|

| |
| ทั่วไป | |
| Systematic name | Indole |
| ชื่ออื่น | 2,3-Benzopyrrole, ketole, 1-benzazole |
| สูตรโมเลกุล | C8H7N |
| SMILES | C1(NC=C2)=C2C=CC=C1 |
| Molar mass | 117.15 g/mol |
| ลักษณะทั่วไป | ของแข็งขาว |
| CAS number | 120-72-9 |
| คุณสมบัติ | |
| Density and phase | 1.22 g/cm3, ของแข็ง |
| การละลาย ใน น้ำ | 0.19 g/100 ml (20 °C) Soluble in hot water |
| ใน เอตทานอล, ether In benzene |
Highly soluble Soluble |
| จุดหลอมเหลว | 52 - 54°C (326 K) |
| จุดเดือด | 253 - 254°C (526 K) |
| Acidity (pKa) | 16.2 (21.0 in DMSO) |
| Basicity (pKb) | 17.6 |
| โครงสร้าง | |
| Molecular shape | Planar |
| Crystal structure | ? |
| Dipole moment | 2.11 D in benzene |
| วัตถุอันตราย | |
| MSDS | External MSDS |
| Main hazards | ? |
| NFPA 704 | |
| Flash point | 121°C |
| R/S statement | R: 21/22-37/38-41-50/53 S: 26-36/37/39-60-61 |
| RTECS number | NL2450000 |
| Supplementary data page | |
| Structure and properties |
n, εr, etc. |
| Thermodynamic data |
Phase behaviour Solid, liquid, gas |
| Spectral data | UV, IR, NMR, MS |
| สารประกอบที่เกี่ยวข้อง | |
| Related aromatic compounds |
เบนซีน (benzene), เบนโซฟูแรน (benzofuran), คาร์บาโซล (carbazole), คาร์โบลีน (carboline), อินดีน (indene), อินโดลีน (indoline), ไอสาติน (isatin), เมตทิลอินโดล (methylindole), ออกซินโดล (oxindole), ไพโรล (pyrrole), สกาโตล (skatole) |
| Except where noted otherwise, data are given for materials in their standard state (at 25°C, 100 kPa) Infobox disclaimer and references | |
อินโดล (อังกฤษ: Indole) เป็นสารประกอบอินทรีย์ประเภทอะโรมาติกเฮเทอโรไซคลิก มันเป็นโครงสร้าง 2 วงแหวน (bicyclic structure) ส่วนที่เป็น 6 เหลี่ยมเรียกเบนซีนเชื่อมกับวงแหวน 5 เหลี่ยมที่มีอะตอมไนโตรเจน 1 อะตอม เชื่อมต่อกับคาร์บอน 4 อะตอมซึ่งเรียกว่า วงแหวน ไพร์โรล (pyrrole) การเชื่อมต่อไนโตรเจนกับวงแหวนอะโรมาติก มีความหมายว่าอินโดลจะประพฤติตัวไม่เป็นด่าง และมันก็ไม่เป็นเอมีนธรรมดา อินโดลเป็นของแข็งที่อุณหภูมิห้องมีกลิ่นคล้ายอุจจาระ แต่ที่ความเข้มข้นต่ำๆ มันจะมีกลิ่นดอกไม้
โครงสร้าง อินโดล สามารถพบได้ในสารประกอบอินทรีย์มากมายเช่น กรดอะมิโน ทริปโตแฟน (tryptophan) ในอัลคะลอยด์ หรือ ในปิกเมนต์ อินโดล (indole) เป็นคำที่ได้จาก อินดิโก (indigo) เป็นสีน้ำเงินที่ได้จากพืชชนิดหนึ่ง โมเลกุลของอินดิโก ประกอบด้วยโครงสร้างอินโดล 2 หน่วยมาเชื่อมกัน
ประวัติ (History)
[แก้]
การศึกษาคุณสมบัติทางเคมีของอินโดลเริ่มที่การศึกษาสี อินดิโก (indigo) เริ่มจากการเปลี่ยน ไอสาติน (isatin)ออกซินโดล (oxindole) และในปี 1866 อดอล์ฟ วอน ไบเออร์ (Adolf von Baeyer) ได้รีดิว ออกซินโดล ไปเป็น อินโดล โดยใช้ สังกะสีเป็นตัวเร่งปฏิกิริยา
การสังเคราะห์อินโดล
[แก้]อินโดลเป็นส่วนประกอบหลักของโคล-ทาร์ มีวิธีสังเคราะห์ดังนี้
การสังเคราะห์อินโดลแบบ ไลม์กรูเบอร์-แบตโช (Leimgruber-Batcho)
[แก้]
การสังเคราะห์อินโดลแบบ ไลม์กรูเบอร์-แบตโช เป็นวิธีที่มีประสิทธิภาพที่สุดในการสังเคราะห์อินโดล และส่วนประกอบของมัน และถูกจดสิทธิบัตรในปี 1976วิธีนี้ให้ผลผลิตสูงที่สุดและนิยมมากที่สุดใน เภสัชอุตสาหกรรม
การสังเคราะห์อินโดลแบบฟิสเซอร์ (Fischer)
[แก้]
การสังเคราะห์อินโดลแบบฟิสเซอร์เป็นวิธีที่นิยมและเก่าแก่มากที่สุดซึ่งคิดค้นและพัฒนาในปี 1883 โดย อีมิล ฟิสเซอร์ (Emil Fischer)
การสังเคราะห์อินโดลแบบอื่นๆ
[แก้]- การสังเคราะห์อินโดลแบบบิสเชอร์-โมลัว (Bischler-Möhlau)
- การสังเคราะห์อินโดลแบบแกสส์แมน (Gassman)
- การสังเคราะห์อินโดลแบบฮีเมตเบอร์เกอร์ (Hemetsberger)
- การสังเคราะห์อินโดลแบบลาร์รอคก์ (Larock)
- การสังเคราะห์อินโดลแบบมาดีลุง (Madelung)
- การสังเคราะห์อินโดลแบบนีนิซีสกุ (Nenitzescu)
- การสังเคราะห์อินโดลแบบไรยส์เซอร์ต (Reissert)
ปฏิกิริยาเคมีของอินโดล
[แก้]Electrophilic substitution
[แก้]
กรามีน (Gramine) สามารถเตรียมได้จากปฏิกิริยาแมนนิช (Mannich reaction)ของอินโดลกับ ไดเมตทิลามีน (dimethylamine) และ ฟอร์มาดิไฮด์ (formaldehyde)

Nitrogen-H acidity and organometallic indole anion complexes
[แก้]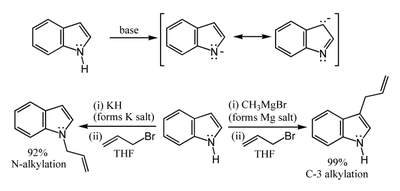
Carbon acidity and C-2 lithiation
[แก้]
Oxidation of indole
[แก้]
Cycloadditions of indole
[แก้]
การใช้ประโยชน์
[แก้]มะลิ (jasmine)ในธรรมชาติและ น้ำมันหอมระเหย ที่ใช้ในอุตสาหกรรมน้ำหอม มีอินโดลประมาณ 2.5 % กลิ่นมะลิที่สกัดจากธรรมชาติจะมีราคากิโลกรัมละ $10,000 แต่ถ้า สังเคราะจากอินโดลจะมีราคาเพียง $10/kg
ดูเพิ่ม
[แก้]- Martinet dioxindole synthesis
- Skatole (3-methylindole)
- Tryptamines
อ้างอิง
[แก้]- Indoles Part One, W. J. Houlihan (ed.), Wiley Interscience, New York, 1972.
- J. A. Joule, K. Mills Heterocyclic Chemistry, 4th edition, Blackwell Science, Oxford, UK, 2000.
- ^ A. Baeyer, A. Emmerling, Chemische Berichte, 2, 679 (1869).
- ^ Organic Syntheses, Coll. Vol. 4, p.539; Vol. 39, p.30 Article
- ^ Organic Syntheses, Coll. Vol. 6, p.104; Vol. 54, p.58 Article
- ^ Bergman, J.; Venemalm, L. J. Org. Chem. 1992, 57, 2495 - 2497.
- ^ Lynch, S. M. ; Bur, S. K.; Padwa, A.; Org. Lett. 2002, 4, 4643 - 4645. Abstract
