ทฤษฎีสนามผลึก
ทฤษฎีสนามผลึก (อังกฤษ: Crystal Field Theory; CFT) เป็นแบบจำลองที่อธิบายการสูญเสียดีเจเนเรซีของระดับพลังงานของออร์บิทัลซึ่งเป็นผลมาจากอันตรกิริยาแบบไฟฟ้าสถิตโดยอิเล็กตรอนในไอออนลบหรือโมเลกุลรอบๆออร์บิทัลนั้นๆ โดยปกติแล้วจะประยุกต์ใช้กับ d- และ f-ออร์บิทัล ทฤษฎีนี้เป็นประโยชน์ในการอธิบายสมบัติเชิงแสงโดยของสารประกอบของโลหะแทรนซิชัน โดยเฉพาะสมเปกตรัมการดูดกลืนแสงของสารละลาย การเกิดสีของสารประกอบ[1] เอนทัลปีของการเกิดไฮเดรชัน (enthalpy of hydration) สมบัติทางแม่เหล็ก และโครงสร้างสปินเนล (spinel)[2] ของสารเชิงซ้อนของโลหะแทรนซิชัน เป็นต้น โดยทฤษฎีนี้ถูกเสนอและพัฒนาขึ้นโดยนักฟิสิกส์สองคน ได้แก่ ฮันส์ เบเทอ และ จอห์น ฮัสบรูค แวน เลกก์ (John Hasbrouck van Vleck) ในปีช่วงทศวรรษ 1930 [3] ทฤษฎีสนามผลึกยังถูกพัฒนาต่อยอดโดยประยุกต์ใช้ทฤษฎีออร์บิทัลเชิงโมเลกุลและเกิดทฤษฎีใหม่ชื่อว่า ทฤษฎีสนามลิแกนด์ (Ligand Field Theory; LFT) ซึ่งใช้ในการอธิบายพันธะเคมีในสารประกอบเชิงซ้อนของโลหะแทรนซิชันได้เป็นอย่างดี
หลักการเบื้องต้น
[แก้]การแยกของระดับพลังงานในสนามผลึก
[แก้]ทฤษฎีสนามผลึกจะพิจารณาอันตรกิริยาระหว่างโลหะแทรนซิชันกับลิแกนด์โดยมีอันตรกิริยาแบบดึงดูดระหว่างประจุบวกของไอออนบวกของโลหะและประจุลบจากอิเล็กตรอนคู่โดดเดี่ยวในลิแกนด์ การใช้ทฤษฎีนี้จะเริ่มพิจารณาการพิจารณาให้ออร์บิทัลเชิงอะตอม d-ออร์บิทัล ทั้ง 5 ออร์บิทัลมีพลังงานเท่ากัน หรือ ดีเจเนเรซี (degeneracy) ล้อมรอบด้วยจุดประจุลบของลิแกนด์ เมื่อลิแกนเข้าใกล้ไอออนของโลหะอิเล็กตรอนจากลิแกนด์จะเข้าใกล้อิเล็กตรอนใน d-ออร์บิทัล และทำให้เกิดการสูญเสียดีเจเนเรซี อิเลกตรอนใน d-ออร์บิทัล และในลิแกนด์จะผลักกันและกันเนื่องจากมีประจุที่มีเครื่องหมายเหมือนกัน ดังนั้น อิเล็กตรอนใน d-ออร์บิทัลที่อยู่ใกล้ลิแกนด์มากกว่าจะมีพลังงานสูงกว่า ก่อให้เกิดการแยกของระดับพลังงานของ d-ออร์บิทัล [4] โดยการแยกออกของระดับพลังงานนี้ขึ้นอยู่กับหลายปัจจัย ดังนี้
- ธรรมชาติของไอออนบวกของโลหะ
- สถานะออกซิเดชันของโลหะ
- การจัดเรียงตัวของลิแกนรอบๆไอออนของโลหะ
- ธรรมชาติของลิแกนด์ที่อยู่รอบๆไอออนของโลหะ
โดยทั่วไปแล้ว สารประกอบโคออร์ดิเนชันของโลหะแทรนซิชันจะมีรูปทรงเรขาคณิตเป็นทรงแปดหน้า (octahedral) ที่มีลิแกนด์ 6 ตัวล้อมรอบไอออนของโลหะ ในสนามผลึกรูปทรงแปดหน้านั้น ระดับพลังงานของ d-ออร์บิทัลจะแยกออกเป็น 2 กลุ่ม โดย Δoct คือ พารามิเตอร์ของการแยกสนามผลึก (crystal-field splitting parameter) เมื่อออร์บิทัล dxy, dxz และ dyz จะมีพลังงานต่ำกว่าออร์บิทัล dz2 and dx2-y2 เนื่องจากอยู่ไกลจากลิแกนด์มากกว่า ออร์บิทัลกลุ่มที่มีพลังงานต่ำกว่าทั้ง 3 เรียกว่า t2g และออร์บิทัล 2 ออร์บิทัลที่มีพลังงานสูงกว่า เรียกว่า eg [5]

[Fe(NO2)6]3− เป็นแบบสปินต่ำ (low spin) (ซ้าย)
[FeBr6]3− เป็นแบบสปินสูง (high spin) (ขวา)
ในกรณีของสารเชิงซ้อนรูปทรงสี่หน้า การแยกออกของระดับพลังงานของd-ออร์บิทัลจะตรงกันข้าม พารามิเตอร์ของการแยกสนามผลึก เรียกว่า Δtet โดยที่ออร์บิทัล dz2 และ dx2-y2 จะมีพลังงานต่ำกว่าออร์บิบัล dxy, dxz และ dyz อย่างไรก็ตาม สารเชิงซ้อนที่มีรูปร่างโมเลกุลแบบอื่นๆก็สามารถอธิบายได้โดยใช้ทฤษฎีสนามผลึกเช่นกัน
พารามิเตอร์ของการแยกระดับพลังงาน
[แก้]ขนาดของ Δ ในสารเชิงซ้อนแต่ละชนิดจะแนกต่างกัน ทั้งนี้ขึ้นอยู่กับหลายๆปัจจัยดังกล่าวข้างต้น โดยสามารถพิจารณาแต่ละปัจจัย ดังนี้
ธรรมชาติของลิแกนด์
[แก้]ลิแกนด์บางชนิดสามารถแยกระดับพลังงานได้มาก ทำให้ Δ มีค่ามาก ในขณะที่ลิแกนด์อื่นๆอาจแยกได้น้อยกว่า จากการศึกษาสมบัติทางเคมีเชิงแสง ทำให้สามารถจัดเรียงความสามารถในการแยกระดับพลังงานในสนามผลึกของลิแกนด์ต่างๆเป็น อนุกรมสเปกโตรเคมี (spectrochemical series) ได้ดังนี้
I− < Br− < S2− < SCN− < Cl− < NO3− < N3− < F− < OH− < C2O42− < H2O < NCS− < CH3CN < py < NH3 < en < 2,2'-bipy < phen < NO2− < PPh3 < CN− < CO
ทั้งนี้ ลิแกนด์ที่สามารถสร้าง พันธะ π แบบกลับ (π back bonding) ได้ จะสามารถแยกระดับพลังงานของ d-ออร์บิทัลได้มาก
สถานะออกซิเดชัน
[แก้]สถานะออกซิเดชันของโลหะมีความสำคัญต่อขนาดของ Δ เช่นกัน โดยการเพิ่มขึ้นของสถานะออกซิเดชันจะทำให้ค่า Δ เพิ่มขึ้นด้วย อาทิ สารเชิงซ้อนของ Fe3+ จะมี Δ มากกว่าสารเชิงซ้อนของ Fe2+ ที่มีลิแกนด์ชนิดเดียวกัน ทั้งนี้ เนื่องมาจากความแตกต่างของความหนาแน่นประจุระหว่าง Fe3+ และ Fe2+ ที่ทำให้ลิแกนด์สามารถเข้าใกล้ไอออนของโลหะได้มากกว่าในกรณีของ Fe3+ แรงผลักระหว่างอิเล็กตรอนของลิแกนด์และอิเล็กตรอนในไอออนโลหะจึงมากกว่า
รูปทรงเรขาคณิตของโมเลกุล
[แก้]รูปทรงเรขาคณิตของโมเลกุลที่แตกต่างส่งผลให้มีสนามผลึกที่แตกต่าง ค่า Δ จึงแตกต่างกันด้วย ดูแผนภาพพลังงานได้ดังตารางต่อไปนี้
| ชื่อ | รูปร่าง | แผนภาพพลังงาน |
|---|---|---|
| ทรงแปดหน้า |  |
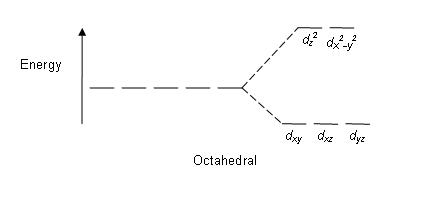 |
| พีระมิดฐานห้าเหลี่ยม |  |
 |
| ปริซึมจัตุรัสฐานตรงข้าม |  |
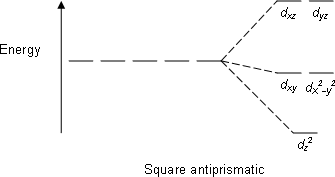 |
| ระนาบจัตุรัส |  |
 |
| พีระมิดฐานจัตุรัส |  |
 |
| ทรงสี่หน้า |  |
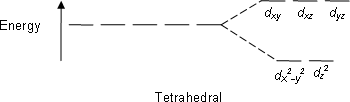 |
| พีนะมิดคู่ฐานสามเหลี่ยม |  |
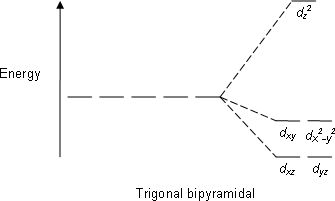 |
ดูเพิ่ม
[แก้]อ้างอิง
[แก้]- ↑ Mary Virginia Orna (1978),Chemical origins of color,J. Chem. Educ., 55 (8), 478.
- ↑ Jack L. Lambert(1964), Spinel models for demonstrating crystal field stabilization, J. Chem. Educ., 41 (1), p 41.
- ↑ Van Vleck, J. (1932).Theory of the Variations in Paramagnetic Anisotropy Among Different Salts of the Iron Group. Physical Review 41: 208.
- ↑ S. F. A. Kettle (1969),Crystal field potentials, Journal of Chemical Education 46 (6), 339.
- ↑ A. L. Companion and M. A. Komarynsky (1964), Crystal field splitting diagrams, J. Chem. Educ., 41 (5), p 257
