พันธุวิศวกรรม
พันธุวิศวกรรม หรือ วิศวกรรมพันธุศาสตร์ (อังกฤษ: Genetic engineering) หรือที่เรียกว่า "การดัดแปลงพันธุกรรม" (อังกฤษ: genetic modification) คือการยักย้ายถ่ายเทโดยตรงของจีโนมของสิ่งมีชีวิตโดยใช้เทคโนโลยีชีวภาพ ดีเอ็นเอใหม่อาจถูกแทรกอยู่ในจีโนมของเจ้าภาพโดยตอนแรกต้องแยกและคัดลอกสารพันธุกรรมที่น่าสนใจโดยใช้วิธีการโคลนนิงโมเลกุลเพื่อสร้างลำดับดีเอ็นเอขึ้นมาอันหนึ่ง หรือโดยการสังเคราะห์ดีเอ็นเอ จากนั้นก็แทรกโครงสร้างนี้เข้าไปในสิ่งมีชีวิตของเจ้าภาพ หลายยีนอาจถูกลบออกหรือ "เคาะออกมา" (อังกฤษ: knockout) โดยใช้ nuclease การกำหนดเป้าหมายยีน (อังกฤษ: Gene targeting) เป็นเทคนิคที่แตกต่างอันหนึ่งที่ใช้วิธีการรวมตัวแบบคล้ายคลึง (อังกฤษ: homologous recombination) เพื่อเปลี่ยนแปลงยีนภายใน, และสามารถนำมาใช้ในการลบยีน, รื้อถอน exons, เพิ่มยีน, หรือการใส่การกลายพันธุ์แบบจุด (อังกฤษ: point mutation).
สิ่งมีชีวิตที่ถูกสร้างขึ้นผ่านทางพันธุวิศวกรรมจะถือว่าเป็นสิ่งมีชีวิตดัดแปลงพันธุกรรม (จีเอ็มโอ) GMOs แรกเป็นเชื้อแบคทีเรียในปี 1973 และหนูจีเอ็มถูกสร้างขึ้นในปี 1974. แบคทีเรียที่ผลิตโดยอินซูลินอยู่ในการพาณิชย์ในปี 1982 และอาหารดัดแปลงพันธุกรรมได้มีการจำหน่ายตั้งแต่ปี 1994. Glofish, จีเอ็มโอแรกที่ออกแบบมาเป็นสัตว์เลี้ยง, ออกจำหน่ายครั้งแรกในประเทศสหรัฐอเมริกาในเดือนธันวาคมปี 2003[1]
เทคนิคพันธุวิศวกรรมมีการนำไปใช้ในหลายสาขารวมถึงการวิจัย, การเกษตร, อุตสาหกรรมเทคโนโลยีชีวภาพ, และการแพทย์. เอนไซม์ที่ใช้ในน้ำยาซักผ้าและยารักษาโรคเช่นอินซูลินและฮอร์โมนการเจริญเติบโตของมนุษย์มีการผลิตในขณะนี้ในเซลล์ GM, สายการทดลองเซลล์จีเอ็มและสัตว์จีเอ็มเช่นหนูหรือ zebrafish กำลังถูกใช้เพื่อการวิจัย, และพืชดัดแปลงพันธุกรรมได้อยู่ในการพาณิชย์.
ความหมาย
[แก้]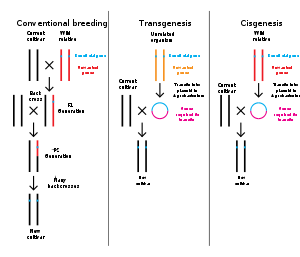
พันธุวิศวกรรมทำการเปลี่ยนแปลงส่วนประกอบทางพันธุกรรมของสิ่งมีชีวิตโดยใช้เทคนิคที่ถอดทิ้งวัสดุที่ถ่ายทอดได้หรือที่ใช้ดีเอ็นเอที่เตรียมด้านนอกสิ่งมีชีวิตโดยตรงเข้าสู่เจ้าภาพหรือเข้าสู่เซลล์ที่จากนั้นจะถูกหลอมละลายหรือถูกไฮบริดกับเจ้าภาพ[4], ซึ่งเกี่ยวข้องกับการใช้เทคนิคกรดนิวคลีอิก recombinant (DNA หรือ RNA) เพื่อสร้างรูปแบบผสมใหม่ของวัสดุพันธุกรรมที่ถ่ายทอดได้ตามมาด้วยการรวมตัวกันของวัสดุนั้นทั้งทางอ้อมผ่านระบบโมเลกุลเวกเตอร์หรือโดยตรงผ่านเทคนิคการฉีดแบบไมโคร (อังกฤษ: micro-injection), การฉีดแบบแมคโครและการห่อหุ้มแบบไมโคร (อังกฤษ: micro-encapsulation).
พันธุวิศวกรรมตามปกติไม่ได้รวมถึงการเพาะพันธ์สัตว์และการเพาะพันธ์พืชแบบดั้งเดิม, การปฏิสนธินอกร่างกาย (อังกฤษ: In vitro fertilisation), การเหนี่ยวนำของเซลล์ที่มีโครโมโซมเหมือนกันมากกว่าสองคู่ (อังกฤษ: polyploidy), การกลายพันธุ์และเทคนิคการละลายของเซลล์ที่ไม่ใช้กรดนิวคลีอิก recombinant หรือสิ่งมีชีวิตดัดแปลงพันธุกรรมในกระบวนการ[4]. อย่างไรก็ตามคณะกรรมาธิการยุโรปยังกำหนดพันธุวิศวกรรมในวงกว้างที่รวมทั้งการคัดเลือกพันธุ์และวิธีการอื่นๆของการเลือกประดิษฐ์[5]. การโคลนิงและการวิจัยเซลล์ต้นกำเนิด, แม้ว่าจะไม่ได้รับการพิจารณาว่าเป็นพันธุวิศวกรรม[6], ถูกนำไปสัมพันธ์กันอย่างใกล้ชิดและพันธุวิศวกรรมสามารถนำมาใช้ภายในพวกมัน[7]. ชีววิทยาสังเคราะห์ (อังกฤษ: Synthetic biology) เป็นสาขาวินัยที่เกิดขึ้นใหม่ที่ใช้พันธุวิศวกรรมอีกขั้นหนึ่งไกลกว่าเดิมโดยการใช้สารพันธุกรรมสังเคราะห์เทียมจากวัตถุดิบให้เป็นสิ่งมีชีวิต[8].
หากสารพันธุกรรมจากสายพันธุ์อื่นถูกเพิ่มลงในเจ้าภาพ, มีชีวิตที่เกิดขึ้นจะถูกเรียกว่าพันธุกรรมดัดแปร (อังกฤษ: transgenic). หากสารพันธุกรรมจากสายพันธุ์เดียวกันหรือสายพันธุ์ที่สามารถผสมพันธุ์ตามธรรมชาติกับเจ้าภาพถูกใช้, สิ่งมีชีวิตที่เกิดขึ้นจะถูกเรียกว่า cisgenic[9]. พันธุวิศวกรรมนอกจากนี้ยังสามารถใช้ในการรื้อถอนสารพันธุกรรมจากสิ่งมีชีวิตเป้าหมายอีกด้วย, ในการสร้างสิ่งมีชีวิตที่ยีนถูกน็อคเอาท์[10]. ในยุโรปการดัดแปลงพันธุกรรมเป็นคำพ้องกับพันธุวิศวกรรมในขณะที่ภายในสหรัฐอเมริกา มันยังสามารถหมายถึงวิธีการเพาะพันธุ์ธรรมดา[11][12]. ระบบการกำกับดูแลของแคนาดาจะขึ้นอยู่กับว่าผลิตภัณฑ์มีคำอธิบายโดยไม่คำนึงถึงวิธีการ ต้นกำเนิดหรือไม่. พูดอีกอย่าง, ผลิตภัณฑ์จะได้รับการกำกับดูแลแบบดัดแปลงพันธุกรรมถ้าจะประกอบด้วยลักษณะบางอย่างที่ไม่พบก่อนหน้านี้ในสายพันธุ์ไม่ว่ามันจะถูกสร้างขึ้นโดยใช้วิธีการปรับปรุงพันธุ์แบบดั้งเดิมหรือไม่ (เช่นการคัดเลือกพันธุ์, การละลายเซลล์, การเพาะพันธุ์แบบกลายพันธุ์) หรือพันธุวิศวกรรม[13][14][15]. ในชุมชนวิทยาศาสตร์, คำว่า "พันธุวิศวกรรม" ไม่ได้ถูกใช้กันทั่วไป; คำที่เฉพาะเจาะจงมากกว่าเช่น transgenic จะถูกใช้มากกว่า.
สิ่งมีชีวิตดัดแปลงพันธุกรรม
[แก้]บทความหลัก: Genetically modified organism
พืช, สัตว์หรือสิ่งมีชีวิตขนาดเล็กที่มีการเปลี่ยนแปลงผ่านทางพันธุวิศวกรรมเรียกว่าสิ่งมีชีวิตดัดแปลงพันธุกรรมหรือจีเอ็มโอ[16]. แบคทีเรียเป็นสิ่งมีชีวิตแรกที่ได้รับการดัดแปลงทางพันธุกรรม. ดีเอ็นเอแบบ Plasmid [17] ที่ประกอบด้วยยีนใหม่ที่สามารถถูกแทรกเข้าไปในเซลล์ของแบคทีเรีย จากนั้นเชื้อแบคทีเรียก็จะแสดงยีนเหล่านั้นออกมา. ยีนเหล่านี้สามารถเป็นรหัสสำหรับยาหรือเอนไซม์ที่ปรุงอาหารและพื้นผิวทางชีวะอื่นๆ[18][19]. พืชหลายชนิดได้รับการดัดแปลงเพื่อใช้ป้องกันแมลง, ต้านทานสารกำจัดวัชพืช, ต้านทานไวรัส, เพิ่มโภชนาการ, อดทนต่อแรงกดดันด้านสิ่งแวดล้อมและผลิตวัคซีนที่กินได้[20]. จีเอ็มโอในเชิงพาณิชย์ส่วนใหญ่จะต้านแมลงและ/หรืออดทนต่อสารกำจัดวัชพืช[21]. สัตว์ดัดแปลงพันธุกรรมได้ถูกนำมาใช้สำหรับการวิจัย, จำลองแบบสัตว์และการผลิตสินค้าเกษตรหรือยา. พวกมันรวมถึงสัตว์ที่มียีนที่ถูกเคาะออก, ถูกเพิ่มความไวต่อการเกิดโรค, มีฮอร์โมนสำหรับการเจริญเติบโตให้เกินและมีความสามารถในการแสดงโปรตีนในนมของพวกมัน[22].
ประวัติ
[แก้]บทความหลัก: ประวัติของพันธุวิศวกรรม
มนุษย์ได้ทำการเปลี่ยนแปลงจีโนมของสายพันธุ์เป็นเวลาหลายพันปีมาแล้วโดยการคัดเลือกเทียม (อังกฤษ: artificial selection) และเมื่อเร็วๆนี้เป็นพันธุกรรมกลายพันธ์ (อังกฤษ: mutagenesis). พันธุวิศวกรรมแบบการยักย้ายถ่ายเทดีเอ็นเอโดยตรงโดยมนุษย์นอกเหนือจากการเพาะพันธุ์และการกลายพันธุ์เพิ่งมีมาตั้งแต่ปี 1970s เท่านั้น. คำว่า "พันธุวิศวกรรม" ถูกตั้งขึ้นเป็นครั้งแรกโดยแจ็ค วิลเลียมสันในนิยายวิทยาศาสตร์เรื่อง "เกาะมังกร" ตีพิมพ์ในปี 1951[23], หนึ่งปีก่อนที่บทบาทของดีเอ็นเอในการถ่ายทอดทางพันธุกรรมได้รับการยืนยันโดยอัลเฟรด เฮอร์ชีย์และมาร์ธา เชส[24], และสองปีก่อนที่ เจมส์ วัตสันและฟรานซิส คริกแสดงว่าโมเลกุลของดีเอ็นเอมีโครงสร้างเป็นเกลียวคู่.

ในปี 1972 พอล Berg ได้สร้างโมเลกุลดีเอ็นเอ recombinant ขึ้นครั้งแรกโดยการรวมดีเอ็นเอจาก SV40 ไวรัสของลิงกับดีเอ็นเอของไวรัสแลมบ์ดา[25]. ในปี 1973 เฮอร์เบิร์ท บอยเยอร์และสแตนลีย์ โคเฮนที่สร้างสิ่งมีชีวิตดัดแปรพันธุกรรมครั้งแรกโดยการแทรกยีนต้านทานยาปฏิชีวนะเข้าไปในพลาสมิดของแบคทีเรีย E. coli[26][27]. หนึ่งปีต่อมารูดอล์ฟ Jaenisch สร้างหนูดัดแปรพันธุกรรมโดยการใส่ดีเอ็นเอต่างถิ่นเขัไปในตัวอ่อนของมัน, ทำให้มันเป็นสัตว์ดัดแปลงพันธุกรรมตัวแรกของโลก[28]. ความสำเร็จเหล่านี้นำไปสู่ความกังวลในชุมชนวิทยาศาสตร์เกี่ยวกับศักยภาพของความเสี่ยงจากพันธุวิศวกรรม, ซึ่งได้รับการกล่าวถึงเป็นครั้งแรกในเชิงลึกที่'การประชุม Asilomar' ในปี 1975. หนึ่งในข้อเสนอแนะหลักจากการประชุมครั้งนี้คือการกำกับดูแลของรัฐบาลของการวิจัยดีเอ็นเอ recombinant ควรได้รับการจัดตั้งขึ้นจนกว่าเทคโนโลยีจะถือว่าปลอดภัย[29][30].
ในปี 1976 Genentech, บริษัทพันธุวิศวกรรมแห่งแรก, ก่อตั้งโดยเฮอร์เบิร์ท บอยเยอร์และโรเบิร์ต สเวนสันและหนึ่งปีต่อมาบริษัทนี้ได้ผลิตโปรตีนของมนุษย์ (somatostatin) ใน "E.coli". Genentech ประกาศการผลิตอินซูลินของมนุษย์ดัดแปลงพันธุกรรมในปี 1978[31]. ในปี 1980 ศาลฎีกาสหรัฐในคดีระหว่าง Diamond กับ Chakrabarty ได้ตัดสินว่าชีวิตที่ถูกเปลี่ยนแปลงทางพันธุกรรมสามารถจดสิทธิบัตรได้[32]. อินซูลินที่ผลิตโดยแบคทีเรีย, ตรา humulin, ได้รับการอนุมัติให้เผยแพร่จากคณะกรรมการอาหารและยาในปี 1982[33].
ในปี 1970s นักศึกษาระดับบัณฑิตศึกษา สตีเว่น Lindow แห่งมหาวิทยาลัยวิสคอนซิน-แมดิสันกับ D.C. Arny และ C Upper พบแบคทีเรียที่เขาระบุว่าเป็น "P. syringae" ที่มีบทบาทในนิวเคลียสน้ำแข็ง และในปี 1977, เขาค้นพบสายพันธุ์น้ำแข็ง-ลบ (อังกฤษ: Ice-minus bacteria) ที่กลายพันธุ์. หลังจากนั้นเขาก็ประสบความสำเร็จในการสร้างสายพันธุ์น้ำแข็ง-ลบ recombinant[34]. ในปี 1983, บริษัทเทคโนโลยีชีวภาพ Advanced Genetic Sciences (AGS) ยื่นขอรับการอนุมัติจากรัฐบาลสหรัฐเพื่อดำเนินการทดสอบภาคสนามกับสายพันธ์น้ำแข็ง-ลบของ "P. syringae" เพื่อปกป้องพืชจากน้ำค้างแข็ง, แต่กลุ่มสิ่งแวดล้อมและผู้ประท้วงถ่วงเวลาการทดสอบภาคสนามออกไปเป็นเวลาสี่ปีกับความท้าทายทางกฎหมาย[35]. ในปี 1987 สายพันธุ์น้ำแข็งลบ-ของ "P. syringae" กลายเป็นสิ่งมีชีวิตดัดแปลงพันธุกรรม (จีเอ็มโอ)อันแรกที่จะถูกปล่อยออกสู่สิ่งแวดล้อม[36] เมื่อไร่สตรอเบอร์รี่และไร่มันฝรั่งในรัฐแคลิฟอร์เนียถูกพ่นด้วยมัน[37]. ทั้งสองสนามทดสอบถูกโจมตีโดยกลุ่มนักกิจกรรมในคืนก่อนการทดสอบจะเกิดขึ้น. "สถานที่ทดสอบแห่งแรกของโลกได้ดึงดูดสนามขยะแห่งแรกของโลก"[36].
การทดลองภาคสนามครั้งแรกของพืชดัดแปลงพันธุกรรมเกิดขึ้นในฝรั่งเศสและสหรัฐอเมริกาในปี 1986, ต้นยาสูบถูกดัดแปลงให้ทนต่อสารเคมีกำจัดวัชพืช[38]. สาธารณรัฐประชาชนจีนเป็นประเทศแรกที่จะทำการตลาดพืชดัดแปรพันธุกรรม, โดยการนำเสนอยาสูบทนไวรัสในปี 1992[39]. ในปี 1994 Calgene ได้รับการอนุมัติให้จำหน่ายมะเขือเทศ Flavr Savr ในเชิงพาณิชย์, มะเขือเทศที่ถูกดัดแปลงมาเพื่อมีชีวิตในชั้นเก็บยาวขึ้น[40]. ในปี 1994 สหภาพยุโรปได้อนุมัติยาสูบออกแบบที่ถูกดัดแปลงให้ทนต่อสารกำจัดวัชพืช bromoxynil, ทำให้มันเป็นพืชดัดแปลงพันธุกรรมแรกที่จำหน่ายในเชิงพาณิชย์ในยุโรป[41]. ในปี 1995 Bt Potato ได้รับการอนุมัติความปลอดภัยโดยหน่วยงานคุ้มครองสิ่งแวดล้อม, หลังจากที่ได้รับการรับรองจากองค์การอาหารและยา, ทำให้มันเป็นพืชที่ผลิตยาฆ่าแมลงตัวแรกที่ได้รับการอนุมัติในประเทศสหรัฐอเมริกา[42]. ในปี 2009 พืชดัดแปรพันธุกรรม 11 ตัวได้ปลูกในเชิงพาณิชย์ใน 25 ประเทศ, ที่ใหญ่ที่สุดโดยพื้นที่ที่ปลูกเป็นสหรัฐอเมริกา, บราซิล, อาร์เจนตินา, อินเดีย, แคนาดา, จีน, ปารากวัยและแอฟริกาใต้[43].
ในช่วงปลายปี 1980s และต้นปี 1990s, คำแนะนำเกี่ยวกับการประเมินความปลอดภัยของพืชดัดแปลงพันธุกรรมและอาหารได้เกิดขึ้นจากองค์กรรวมทั้ง FAO และ WHO[44][45][46][47].
ในปี 2010 นักวิทยาศาสตร์ที่สถาบัน J. Craig Venter ประกาศว่าพวกเขาได้สร้างจีโนมแบคทีเรียสังเคราะห์ตัวแรก. นักวิจัยได้เพิ่มจีโนมใหม่ให้กับเซลล์แบคทีเรียและเลือกเซลล์ที่มีจีโนมใหม่. เพื่อทำเช่นนี้เซลล์จะผ่านกระบวนการที่เรียกว่า resolution, นั้นคือในระหว่างการแบ่งตัวของเซลล์แบคทีเรีย เซลล์ใหม่หนึ่งตัวจะได้รับจีโนมดีเอ็นเอเดิมของแบคทีเรีย, ในขณะที่ตัวอื่นๆได้รับจีโนมสังเคราะห์ใหม่. เมื่อเซลล์นี้แบ่งตัว มันจะใช้จีโนมสังเคราะห์เป็นแม่แบบของมัน. แบคทีเรียที่ได้จากการพัฒนาของนักวิจัย, ชื่อ Synthia, เป็นรูปแบบชีวิตสังเคราะห์ตัวแรกของโลก[48][49].
กระบวนการ
[แก้]บทความหลัก: เทคนิคทางพันธุวิศวกรรม
ขั้นตอนแรกคือการเลือกและแยกยีนที่จะแทรกเข้าไปในสิ่งมีชีวิตดัดแปลงพันธุกรรม. ณ ปี 2012, ในพืชจีเอ็มเชิงพาณิชย์ส่วนใหญ่มียีนที่โอนเข้ามาในตัวมันที่ให้การป้องกันแมลงหรือทนทานต่อสารเคมีกำจัดวัชพืช[50]. ยีนสามารถแยกได้โดยการใช้เอนไซม์ข้อจำกัด (อังกฤษ: restriction enzymes) เพื่อตัดดีเอ็นเอให้เป็นเศษๆและใช้วิธี gel electrophoresis เพื่อแยกพวกมันออกตามความยาว[51]. ปฏิกิริยาลูกโซ่โพลิเมอร์ (PCR) ยังสามารถเพื่อขยายขึ้นส่วนของยีน, ซึ่งจากนั้นจะสามารถแยกได้ผ่านวิธีการ gel electrophoresis[52]. ถ้ายีนที่ถูกเลือกหรือจีโนมของสิ่งมีชีวิตผู้บริจาคได้มีการศึกษามาดี, มันก็อาจจะปรากฏในห้องสมุดทางพันธุกรรม. ถ้ารู้ลำดับดีเอ็นเอ, แต่ไม่มีสำเนาของยีน, มันก็สามารถถูกสังเคราะห์แบบเทียมได้[53].
ยีนที่จะแทรกเข้าไปในสิ่งมีชีวิตดัดแปลงพันธุกรรมจะต้องรวมเข้ากับองค์ประกอบทางพันธุกรรมอื่นๆเพื่อให้มันทำงานอย่างถูกต้อง. ยีนยังสามารถได้รับการดัดแปลงในขั้นตอนนี้เพื่อให้มันการแสดงออกหรือมีประสิทธิภาพที่ดีกว่าอีกด้วย. เช่นเดียวกับยีนที่จะแทรกเข้าไป, โครงสร้างดีเอ็นเอส่วนใหญ่จะประกอบด้วยผู้ก่อการ(ทางชีวภาพ) (อังกฤษ: (biology) promoter) และภูมิภาคที่เป็นตัวปิดท้ายทางพันธุกรรม (อังกฤษ: (genetics) terminator region) เช่นเดียวกับยีนเครื่องหมายที่เลือกได้ (อังกฤษ: selectable marker gene). ภูมิภาคผู้ก่อการจะเริ่มต้นการถอดรหัสของยีนและสามารถนำมาใช้ในการควบคุมสถานที่และระดับของการแสดงออกของยีน, ในขณะที่ภูมิภาคตัวปิดท้ายสิ้นสุดการถอดความ. เครื่องหมายที่เลือกได้, ซึ่งในกรณีส่วนใหญ่ประศาสน์ความต้านทานยาปฏิชีวนะให้กับสิ่งมีชีวิตที่มันแสดงออก, จำเป็นที่จะต้องตรวจสอบว่าเซลล์ตวไหนจะถูกแปลงกับยีนใหม่. โครงสร้างจะถูกทขึ้นำโดยใช้เทคนิคดีเอ็นเอ recombinant, เช่นข้อจำกัดน้ำย่อย (อังกฤษ: restriction digest), การผูก (อังกฤษ: ligations) และการโคลนโมเลกุล[54]. การยักย้ายถ่ายเทของดีเอ็นเอมักเกิดขึ้นภายในพลาสมิด.
รูปแบบที่พบมากที่สุดของพันธุวิศวกรรมเกี่ยวข้องกับการแทรกสารพันธุกรรมใหม่แบบสุ่มภายในจีโนมเจ้าภาพ[ต้องการอ้างอิง]. เทคนิคอื่นๆจะยอมให้สารพันธุกรรมใหม่ที่จะถูกแทรกในสถานที่เฉพาะในจีโนมเจ้าภาพหรือสร้างการกลายพันธุ์ที่ loci จีโนมที่สามารถเคาะยีนที่เกิดขึ้นภายในสิ่งมีชีวิต (อังกฤษ: endogenous genes) ออก. เทคนิคของ gene targeting จะใช้ homologous recombination เพื่อกำหนดเป้าหมายที่ต้องการที่จะเปลี่ยนแปลง endogenous genes ที่เฉพาะเจาะจง. สิ่งนี้มีแนวโน้มที่จะเกิดขึ้นที่ความถี่ที่ค่อนข้างต่ำในพืชและสัตว์และโดยทั่วไปต้องใช้ selectable markers. ความถี่ของ gene targeting สามารถเพิ่มขึ้นอย่างมากด้วยการใช้ nucleases ดัดแปลงเช่น zinc finger nucleases[55][56], homing endonucleases ที่ถูกดัดแปลง[57][58], หรือ nucleases ที่สร้างจาก TAL effectors[59][60]. นอกจากการเสริมสร้าง gene targeting, nucleases ที่ถูกดัดแปลงยังสามารถถูกใช้ในการแนะนำการกลายพันธุ์ใน endogenous genes ที่สร้าง gene knockout[61][62].
การแปลง
[แก้]บทความหลัก: การแปลง (พันธุศาสตร์)

ประมาณ 10% เท่านั้นของแบคทีเรียที่โดยธรรมชาติมีความสามารถดูดกลืนดีเอ็นเอต่างถิ่น. อย่างไรก็ตาม, ความสามารถนี้สามารถถูกเหนี่ยวนำให้เกิดในเชื้อแบคทีเรียอื่นผ่านความเครียด (เช่นช็อกด้วยความร้อนหรือไฟฟ้า), จึงเป็นการเพิ่มความสามารถในการซึมผ่านของเยื่อหุ้มเซลล์ให้กับดีเอ็นเอ, ดีเอ็นเอที่ถูกดูดกลืนสามารถรวมเข้ากับจีโนมหรือมีอยู่เป็นดีเอ็นเอแบบหลายโครโมโซม (อังกฤษ: extrachromosomal DNA). ดีเอ็นเอถูกแทรกโดยทั่วไปเข้าสู่เซลล์สัตว์โดยใช้ microinjection, ที่มันสามารถถูกฉีดผ่านเปลือกนิวเคลียร์ของเซลล์โดยตรงเข้าสู่นิวเคลียสหรือผ่านการใช้ viral vectors[63]. ในพืช, ดีเอ็นเอถูกแทรกโดยทั่วไปโดยใช้การรวมแบบพึ่งพาแบคทีเรียเกษตร (อังกฤษ: Agrobacterium-mediated recombination) หรือ biolistics(การฉีดเซลล์ด้วย gene gun)[64].
ในการรวมแบบพึ่งพาแบคทีเรียเกษตร, โครงสร้างพลาสมิดจะประกอบด้วย Transfer DNA (T-DNA), ดีเอ็นเอซึ่งเป็นผู้รับผิดชอบสำหรับการแทรกของดีเอ็นเอเข้าสู่จีโนมพืชเจ้าภาพ. พลาสมิดนี้จะถูกแปลงให้เป็น "Agrobacterium" ที่ไม่มีพลาสมิดก่อนที่จะติดเชื้อเซลล์พืช. Agrobacterium จากนั้นโดยธรรมชาติจะแทรกสารพันธุกรรมเข้าไปในเซลล์พืช[65]. ในการแปลงแบบ biolistics, อนุภาคของทองหรือทังสเตนจะถูกเคลือบด้วยดีเอ็นเอจากนั้นจะถูกยิงเข้าไปในเซลล์พืชอ่อนหรือตัวอ่อนของพืช. บางสารพันธุกรรมจะเข้าสู่เซลล์และแปลงพวกมัน. วิธีการนี้สามารถนำมาใช้กับพืชที่ไม่ไวต่อการติดเชื้อ Agrobacterium และยังช่วยในการแปลงของ plastids พืช. วิธีการอีกวิธีหนึ่งสำหรับเซลล์พืชและสัตว์คือ Electroporation. Electroporation เกี่ยวข้องการช๊อคด้วยไฟฟ้ากับเซลล์พืชหรือสัตว์, ซึ่งสามารถทำให้เยื่อหุ้มเซลล์สามารถดูดซึมเข้าไปในพลาสมิดดีเอ็นเอ. ในบางกรณีเซลล์ที่ถูก electroporated จะรวมดีเอ็นเอเข้าไปในจีโนมของพวกมัน. เนื่องจากความเสียหายที่เกิดจากเซลล์และดีเอ็นเอ, ประสิทธิภาพการแปลงของ biolistics และ electroporation จะต่ำกว่าการแปลงแบบ agrobacterial mediated และ แบบ microinjection[66].
เนื่องจากบ่อยๆที่เพียงเซลล์เดียวเท่านั้นจะถูกแปลงด้วยสารพันธุกรรม, สิ่งมีชีวิตจะต้องถูกสร้างขึ้นใหม่จากเซลล์เดียวอันนั้น. เมื่อแบคทีเรียประกอบด้วยเซลล์เดียวและถูกผลิตใหม่ (อังกฤษ: reproduce) แบบโคลนิง, การสร้างขึ้นใหม่ (อังกฤษ: regeneration) จึงไม่จำเป็น. ในพืช สิ่งนี้สามารถทำได้โดยการใช้การเพาะเลี้ยงเนื้อเยื่อ. พืชแต่ละสปีซีส์จะมีความต้องการที่แตกต่างกันสำหรับการ regeneration ที่ประสบความสำเร็จผ่านการเพาะเลี้ยงเนื้อเยื่อ. หากประสบความสำเร็จ, พืชผู้ใหญ่จะผลิตสิ่งที่ประกอบด้วยสิ่งดัดแปรพันธุกรรมในทุกๆเซลล์. ในสัตว์, มันมีความจำเป็นเพื่อให้แน่ใจว่าดีเอ็นเอที่ถูกแทรกจะปรากฏในเซลล์ต้นกำเนิดตัวอ่อน (อังกฤษ: embryonic stem cells). Selectable markers จะถูกใช้เพื่อง่ายต่อการแยกความแตกต่างของเซลล์ที่แปลงกับเซลล์ที่ไม่ถูกแปลง. markers เหล่านี้มักจะปรากฏในสิ่งมีชีวิตดัดแปรพันธุกรรม, แม้ว่าหลายกลยุทธ์ได้รับการพัฒนาที่สามารถลบ selectable marker ออกจากพืชดัดแปรพันธุกรรมผู้ใหญ่[67]. เมื่อลูกหลานถูกผลิต, พวกมันสามารถได้รับการคัดเลือกเพื่อหาการปรากฏตัวของยีน. ลูกหลานทั้งหมดจากรุ่นแรกจะเป็น heterozygous สำหรับยีนที่ถูกแทรกและจะต้องผสมพันธ์กันเพื่อผลิตสัตว์ homozygous.
การทดสอบเพิ่มเติมใช้วิธี polymerase chain reaction (PCR), Southern hybridization, และ DNA sequencing จะถูกดำเนินการเพื่อยืนยันว่าสิ่งมีชีวิตมียีนใหม่. การทดสอบเหล่านี้ยังสามารถยืนยันสถานที่ตั้งของโครโมโซมและคัดลอกหมายเลขของยีนที่ถูกแทรกอีกด้วย. การปรากฏตัวของยีนไม่ได้รับประกันว่ามันจะมีการแสดงออกในระดับที่เหมาะสมหรือไม่ในเนื้อเยื่อเป้าหมายดังนั้นวิธีการที่จะมองหาและวัดผลิตภัณฑ์ยีน (อาร์เอ็นเอและโปรตีน) ยังมีการใช้อีกด้วย. เหล่านี้รวมถึง northern hybridization, quantitative RT-PCR, Western blot, immunofluorescence, ELISA และการวิเคราะห์แบบ phenotype. สำหรับการแปลงที่เสถียร, ยีนควรจะถูกส่งผ่านไปยังลูกหลานในรูปแบบการถ่ายทอดทางพันธุกรรมของเมนเดล (อังกฤษ: Mendelian inheritance) เพื่อที่ว่าลูกหลานของสิ่งมีชีวิตจะได้ถูกศึกษาด้วย.
การแก้ไขจีโนม
[แก้]บทความหลัก: การแก้ไขจีโนม
การแก้ไขจีโนมเป็นชนิดของพันธุวิศวกรรมในการที่ดีเอ็นเอจะถูกแทรก, ถูกแทนที่, หรือถูกเคลื่อนย้ายออกจากจีโนมโดยใช้ nucleases วิศวกรรมเทียม, หรือ "กรรไกรโมเลกุล". nucleases จะสร้างการแบ่งเกลียวคู่ (อังกฤษ: double-stranded break (DSBs)) ที่เฉพาะในสถานที่ที่ต้องการในจีโนม, และใชประโยชน์ของกลไกภายใน (อังกฤษ: endogenous mechanisms) ของเซลล์เพื่อซ่อมแซมการแบ่งที่เกิดจากกระบวนการทางธรรมชาติของการรวมตัวกันอีกแบบคล้ายคลึงกัน (อังกฤษ: homologous recombination (HR)) และการเชื่อมปลายแบบไม่คล้ายคลึงกัน (อังกฤษ: nonhomologous end-joining (NHEJ)). ปัจจุบันมีสี่ครอบครัวของ nucleases วิศวกรรมคือ:. meganucleases, zinc finger nucleases (ZFNs), transcription activator-like effector nuclease (TALENs) และ CRISPRs[68][69].
การประยุกต์ใช้งาน
[แก้]พันธุวิศวกรรมมีการประยุกต์ใช้ในงานด้านการแพทย์, การวิจัย, อุตสาหกรรมและการเกษตรและสามารถนำมาใช้ในวงกว้างของพืช, สัตว์และจุลินทรีย์.
การแพทย์
[แก้]ในการแพทย์, พันธุวิศวกรรมได้ถูกนำมาใช้เพื่อผลิตแบบมวลของอินซูลิน, ฮอร์โมนที่สร้างการเจริญเติบโตของมนุษย์, follistim (สำหรับการรักษาภาวะมีบุตรยาก), อัลบูมินมนุษย์ (โปรตีนชนิดหนึ่งพบในไข่ นม เนื้อสัตว์ และเลือด เป็นตัวขนส่งฮอร์โมน, กรดไขมัน, และส่วนผสมอื่นๆ, ผ่อนความเป็นกรดหรือความเป็นด่าง, และรักษาแรงดันของสารละลายที่ไหลผ่านเนื้อเยื่อ, ไปยังส่วนต่างๆของร่างกาย), monoclonal antibodies, antihemophilic factors, วัคซีนและยาอื่นๆอีกมากมาย[70][71]. ขบวนการของวัคซีนโดยทั่วไปเกี่ยวข้องกับการฉีดรูปแบบของไวรัสหรือสารพิษของพวกมันที่อ่อนแอ, มีชีวิต, ตายแล้วหรือไม่มีกิจกรรมแล้วเข้าสู่บุคคลที่ไม่มีภูมิคุ้มกัน[72]. ไวรัสดัดแปลงพันธุกรรมกำลังมีการพัฒนาที่ยังคงสามารถให้ภูมิคุ้มกัน, แต่ขาดลำดับการติดเชื้อ[73]. หนูไฮบริด, เซลล์หลอมรวมกันเพื่อสร้าง monoclonal antibodies, ถูกทำให้ใช้ได้กับมนุษย์ผ่านทางพันธุวิศวกรรมเพื่อสร้าง monoclonal antibodies ของมนุษย์[74]. พันธุวิศวกรรมได้แสดงให้เห็นสัญญาสำหรับการรักษารูปแบบบางอย่างของโรคมะเร็ง[75][76].
พันธุวิศวกรรมถูกนำมาใช้เพื่อสร้างแบบจำลองสัตว์ของโรคของมนุษย์. หนูดัดแปลงพันธุกรรมเป็นแบบจำลองสัตว์ดัดแปลงพันธุกรรมที่พบมากที่สุด[77]. พวกมันได้ถูกนำมาใช้เพื่อการศึกษาและทำแบบจำลองมะเร็ง (หนู oncomouse), โรคอ้วน, โรคหัวใจ, โรคเบาหวาน, โรคไขข้อ, สารเสพติด, ความวิตกกังวล, โรคแก่และโรคพาร์กินสัน[78]. การรักษาที่มีศักยภาพสามารถทดสอบกับแบบจำลองหนูเหล่านี้. นอกจากนี้หมูดัดแปลงพันธุกรรมยังถูกเพาะพันธ์โดยมีวัตถุประสงค์เพื่อเพิ่มความสำเร็จของการปลูกถ่ายอวัยวะสุกรให้กับมนุษย์[79].
การบำบัดด้วยยีนเป็นพันธุวิศวกรรมที่ทำกับมนุษย์โดยการเปลี่ยนยีนบกพร่องของมนุษย์ด้วยสำเนาการทำงานซึ่งอาจเกิดขึ้นในเนื้อเยื่อของร่างกายหรือเนื้อเยื่อ germline. ถ้ายีนถูกแทรกเข้าไปในเนื้อเยื่อ germline มันสามารถส่งผ่านลงไปที่ลูกหลานของบุคคลนั้น[80][81]. การบำบัดด้วยยีนได้ถูกใช้อย่างประสบความสำเร็จในการรักษาหลายโรครวมถึง X-linked SCID[82], มะเร็งเม็ดเลือดขาวเรื้อรังแบบ lymphocytic (CLL)[83] และโรคพาร์กินสัน[84]. ในปี 2012, Glybera กลายเป็นการรักษาด้วยยีนบำบัดอันแรกที่ได้รับการอนุมัติสำหรับการใช้งานทางคลินิกทั้งในยุโรปหรือสหรัฐอเมริกาหลังจากการรับรองโดยคณะกรรมาธิการยุโรป[85][86]. นอกจากนี้ยังมีความกังวลเกี่ยวกับจริยธรรมว่าเทคโนโลยีควรจะถูกใช้ไม่เพียงแต่สำหรับการรักษาเท่านั้น, แต่สำหรับการเพิ่มประสิทธิภาพ, การดัดแปลงหรือการเปลี่ยนแปลงของภาพลักษณ์, การปรับตัว, ความเฉลียวฉลาด, นิสัยหรือพฤติกรรมของมนุษย์ด้วยหรือไม่[87]. ความแตกต่างระหว่างการรักษาและการเพิ่มประสิทธิภาพยังคงเป็นเรื่องยากที่จะจัดทำขึ้น[88]. นักแปลงมนุษย์พิจารณาว่าการเพิ่มประสิทธิภาพของมนุษย์เป็นสิ่งพึงประสงค์.
การวิจัย
[แก้]
พันธุวิศวกรรมเป็นเครื่องมือที่สำคัญอันหนึ่งสำหรับนักวิทยาศาสตร์ธรรมชาติ. ยีนและข้อมูลทางพันธุกรรมอื่นๆจากหลากหลายของสิ่งมีชีวิตจะถูกแปลงให้เป็นเชื้อแบคทีเรียสำหรับการจัดเก็บและการดัดแปลง, เป็นการสร้างแบคทีเรียดัดแปลงพันธุกรรมในกระบวนการ. แบคทีเรียมีราคาถูก, ง่ายต่อการเติบโต, ทำโคลนิงได้, ทวีคูณอย่างรวดเร็ว, ค่อนข้างง่ายที่จะแปลงและสามารถเก็บไว้ที่ -80 °C เกือบจะนานไม่สิ้นสุด. เมื่อยีนถูกแยกออก, มันก็สามารถถูกจัดเก็บไว้ภายในแบคทีเรียเป็นให้อุปทานที่ไม่จำกัดสำหรับการวิจัย.
สิ่งมีชีวิตจะได้รับการดัดแปลงพันธุกรรมเพื่อค้นหาการทำงานของยีนบางตัว, ซึ่งอาจเป็นผลกระทบต่อฟีโนไทป์ของสิ่งมีชีวิต, ที่ยีนจะแสดงหรือสิ่งที่ยีนอื่นๆที่มันโต้ตอบด้วย. การทดลองเหล่านี้มักจะเกี่ยวข้องกับการสูญเสียหน้าที่การทำงานบางอย่างไป, การได้รับหน้าที่การทำงานบางอย่างมา, การติดตามและการแสดงออก.
- การทดลองของการสูญเสียหน้าที่การทำงานบางอย่างไป, เช่นในการทดลองเกี่ยวกับ gene knockout ครั้งหนึ่ง, สิ่งมีชีวิตถูกดัดแปลงให้ขาดกิจกรรมของยีนหนึ่งยีนหรือมากกว่า. การทดลอง gene knockout จะเกี่ยวข้องกับการสร้างและการยักย้ายถ่ายเทของดีเอ็นเอที่สร้าง ในหลอดทดลอง, ซึ่งในการ knockout อย่างง่ายประกอบด้วยหนึ่งสำเนาของยีนที่ต้องการ, ซึ่งมีการเปลี่ยนแปลงให้มันไม่ทำงาน. เซลล์ต้นกำเนิดจากตัวอ่อน (อังกฤษ: Embryonic stem cells) จะรวมกับยีนที่ถูกดัดแปลง, ซึ่งไปแทนที่สำเนาหน้าที่การทำงานที่ปรากฏอยู่แล้ว. เซลล์ต้นกำเนิดเหล่านี้จะถูกฉีดเข้าไปในตัวอ่อนซึ่งเป็นระยะก่อนที่จะฝังตัวกับมดลูก (อังกฤษ: blastocysts), ซึ่งจะถูกฝังลงในแม่อุ้มบุญ. วิธีการนี้จะช่วยให้ผู้ทดลองสามารถวิเคราะห์ข้อบกพร่องที่เกิดจากการกลายพันธุ์นี้และเพื่อกำหนดบทบาทของยีนนั้นๆ. มันถูกใช้บ่อยโดยเฉพาะอย่างยิ่งในการพัฒนาทางชีววิทยา. อีกวิธีหนึ่ง, ที่มีประโยชน์ในสิ่งมีชีวิตเช่นแมลงหวี่ (แมลงวันผลไม้), คือการเหนี่ยวนำให้เกิดการกลายพันธุ์ในประชากรขนาดใหญ่แล้วทำการสกรีนลูกหลานเพื่อให้ได้แบบการกลายพันธุ์ที่ต้องการ. กระบวนการที่คล้ายกันนี้สามารถนำมาใช้ทั้งในพืชและ prokaryotes (สิ่งมีชีวิตเซลล์เดียวที่มีนิวเคลียสที่ขาดเยื่อหุ้ม).
- การทดลองของการได้รับหน้าที่การทำงานบางอย่างมา, คู่ที่คล้ายกันแบบตรรกะของการ knockouts. การทดลองเหล่านี้ในบางครั้งจะดำเนินการร่วมกับการทดลองแบบ knockouts เพื่อสร้างการทำงานของยีนที่ต้องการอย่างประณีตมากขึ้น. กระบวนการนี้เหมือนมากกับกระบวนการในงานดัดแปลงแบบ knockout, ยกเว้นว่าโครงสร้างที่ถูกออกแบบมาเพื่อเพิ่มหน้าที่การทำงานของยีน, ที่มักจะโดยการให้สำเนาพิเศษของยีนหรือการกระตุ้นให้เกิดการสังเคราะห์โปรตีนให้บ่อยขึ้น.
- การทดลองการติดตาม, ซึ่งพยายามที่จะได้รับข้อมูลเกี่ยวกับการเป็นแบบท้องถิ่นและการปฏิสัมพันธ์ของโปรตีนที่ต้องการ. วิธีหนึ่งที่จะทำเช่นนี้คือการแทนที่ยีนป่าด้วยยิน 'ละลาย', ซึ่งเป็นการวางติดกันเพื่อเทียบเคียงชนิดหนึ่งของยีนป่าชนิดที่มีองค์ประกอบของการรายงานเช่นโปรตีนเรืองแสงสีเขียว (GFP) ที่จะช่วยให้มองเห็นได้ง่ายของผลิตภัณฑ์ของการดัดแปลงพันธุกรรม. ในขณะที่นี่เป็นเทคนิคที่มีประโยชน์อันหนึ่ง, การยักย้ายถ่ายเทสามารถทำลายหน้าที่การทำงานของยีน, เป็นการสร้างผลรองและอาจเรียกหาคำถามสำหรับผลของการทดลอง. เทคนิคที่ซับซ้อนมากขึ้นในขณะนี้อยู่ระหว่างการพัฒนาที่สามารถติดตามผลิตภัณฑ์โปรตีนโดยไม่ต้องบรรเทาฟังก์ชันการทำงานของพวกมัน, เช่นการเพิ่มลำดับขนาดเล็กที่จะทำหน้าที่แรงจูงใจแบบผูกพันกับแอนติบอดีแบบโมโนโคลนอล.
- การศึกษาการแสดงออก, มีวัตถุประสงค์ที่จะค้นพบที่ไหนและเมื่อไหร่ที่โปรตีนที่เจาะจงจะถูกผลิตขึ้น. ในการทดลองเหล่านี้, ลำดับดีเอ็นเอก่อนดีเอ็นเอที่บอกรหัสสำหรับโปรตีน, ที่รู้จักกันว่าเป็นโปรโมเตอร์ของยีน, จะถูกใส่เข้าไปใหม่ในสิ่งมีชีวิตที่มีภูมิภาคเข้ารหัสโปรตีนถูกแทนที่โดยยีนนักรายงานเช่น GFP หรือเอนไซม์ที่เร่งปฏิกิริยาการผลิตของสีย้อม. ดังนั้นเวลาและสถานที่ที่เป็นโปรตีนที่เจาะจงจะถูกผลิตจึงสามารถสังเกตได้. การศึกษาการแสดงออกสามารถก้าวไปอีกขั้นโดยการเปลี่ยนโปรโมเตอร์เพื่อที่จะหาชิ้นไหนที่มีความสำคัญสำหรับการแสดงออกที่เหมาะสมของยีนและถูกผูกไว้จริงโดยโปรตีนปัจจัยการถอดความ (อังกฤษ: transcription factor proteins); ขั้นตอนนี้ถูกเรียกว่าการทุบตีโปรโมเตอร์ (อังกฤษ: promoter bashing).
ด้านอุตสาหกรรม
[แก้]การใช้เทคนิคพันธุวิศวกรรม, เราสามารถแปลงจุลินทรีย์เช่นแบคทีเรียหรือยีสต์, หรือแปลงเซลล์จากสิ่งมีชีวิตหลายเซลล์เช่นแมลงหรือสัตว์เลี้ยงลูกด้วยนม, ที่มียีนรหัสเข้าเป็นโปรตีนที่มีประโยชน์, เช่นเอนไซม์แบบหนึ่ง, เพื่อที่ว่าสิ่งมีชีวิตหลังการแปลงจะแสดงออกอย่างชัดแจ้งว่ามีโปรตีนที่ต้องการ. เราสามารถผลิตปริมาณแบบมวลของโปรตีนโดยการปลูกสิ่งมีชีวิตที่ถูกแปลงในอุปกรณ์เครื่องปฏิกรณ์ชีวภาพโดยใช้เทคนิคของการหมักอุตสาหกรรม, จากนั้นก็ทำโปรตีนให้บริสุทธิ์[89]. ยีนบางตัวไม่ทำงานได้ดีในแบคทีเรีย, ดังนั้นยีสต์, เซลล์แมลง, หรือเซลล์สัตวืเลี้ยงลูกด้วยนม, แต่ละ eukaryote, ยังสามารถนำมาใช้ได้[90]. เทคนิคเหล่านี้ถูกนำมาใช้ในการผลิตยารักษาโรคเช่นอินซูลิน, ฮอร์โมนการเจริญเติบโตของมนุษย์, และวัคซีน, อาหารเสริมเช่น tryptophan, ช่วยในการผลิตอาหาร (chymosin ในการทำชีส) และเชื้อเพลิง[91]. การประยุกต์ใช้งานอื่นๆที่เกี่ยวข้องกับเชื้อแบคทีเรียดัดแปลงพันธุกรรมที่กำลังทำการตรวจสอบอยู่จะเกี่ยวกับการทำให้แบคทีเรียปฏิบัติงานนอกวงจรธรรมชาติของพวกมัน, เช่นการทำเชื้อเพลิงชีวภาพ[92], การทำความสะอาดน้ำมันรั่วไหล, คาร์บอนและขยะพิษอื่นๆ[93] และการตรวจสอบสารหนูในน้ำดื่ม[94].
การประยุกต์ใช้ในอุตสาหกรรมและการทดลองในขนาดห้องปฏิบัติการ
[แก้]ในวัสดุศาสตร์, ไวรัสดัดแปลงพันธุกรรมได้ถูกนำมาใช้ในห้องปฏิบัติการทางวิชาการโดยเป็นนั่งร้านสำหรับการประกอบแบตเตอรี่ลิเธียมไอออนที่เป็นมิตรกับสิ่งแวดล้อมมากขึ้น[95][96].
แบคทีเรียได้รับการดัดแปลงมาเพื่อทำงานเป็นเซ็นเซอร์โดยแสดงโปรตีนเรืองแสงภายใต้สภาพแวดล้อมบางอย่าง[97].
เกษตรกรรม
[แก้]บทความหลัก: พืชดัดแปลงพันธุกรรม

หนึ่งในการประยุกต์ใช้พันธุวิศวกรรมที่รู้จักกันดีที่สุดและมีการโต้เถียงคือการสร้างและการใช้พืชดัดแปลงพันธุกรรมหรือสิ่งมีชีวิตดัดแปลงพันธุกรรม, เช่นปลาดัดแปลงพันธุกรรม, ซึ่งจะใช้ในการผลิตอาหารและวัสดุดัดแปลงพันธุกรรมที่มีการใช้งานที่หลากหลาย. มีสี่เป้าหมายหลักในการสร้างพืชดัดแปลงพันธุกรรม[99].
เป้าหมายหนึ่งและเป็นสิ่งแรกที่จะต้องตระหนักในเชิงพาณิชย์คือการให้ความคุ้มครองจากภัยคุกคามสิ่งแวดล้อม, เช่นความเย็น (ในกรณีของแบคทีเรียน้ำแข็ง-ลบ), หรือเชื้อโรค pathogen, เช่นแมลงหรือไวรัส, และ/หรือความต้านทานต่อสารเคมีกำจัดวัชพืช. นอกจากนี้ยังมีพืชทนเชื้อราและเชื้อไวรัสที่พัฒนาแล้วหรือกำลังพัฒนา[100][101]. พวกมันได้รับการพัฒนาเพื่อให้การจัดการแมลงและวัชพืชของพืชทำได้ง่ายขึ้นและสามารถเพิ่มผลผลิตของพืชได้ทางอ้อม[102].
อีกเป้าหมายหนึ่งในการสร้าง GMOs ก็คือเพื่อปรับเปลี่ยนคุณภาพของผลผลิตโดย, ตัวอย่างเช่น, การเพิ่มคุณค่าทางโภชนาการหรือเพื่อให้เกิดประโยชน์ต่อวงการอุตสาหกรรมมากขึ้นทั้งปริมาณและคุณภาพ[103]. มันฝรั่ง Amflora, ยกตัวอย่าง, ก่อให้เกิดประโยชน์มากขึ้นในอุตสาหกรรมการบ่มของแป้ง. วัวได้รับการดัดแปลงเพื่อผลิตโปรตีนในนมของพวกมันมากขึ้นเพื่ออำนวยความสะดวกในการผลิตชีส[104]. ถั่วเหลืองและคาโนลาได้รับการดัดแปลงพันธุกรรมในการผลิตน้ำมันเพื่อสุขภาพมากขึ้น[105][106].
เป้าหมายอีกประการหนึ่งประกอบด้วยการผลักดันจีเอ็มโอเพื่อผลิตวัสดุที่ปกติมันไม่ได้ทำ. ตัวอย่างหนึ่งคือ "การทำฟาร์ม", ซึ่งใช้พืชเป็นตัวปฏิกรณ์ชีวะ (อังกฤษ: bioreactor) เพื่อผลิตวัคซีน, ตัวกลางยาหรือตัวยาเอง; ผลิตภัณฑ์ที่มีประโยชน์ถูกมำให้บริสุทธิ์จากการเก็บเกี่ยวแล้วนำไปใช้ในกระบวนการผลิตยามาตรฐาน[107]. วัวและแพะที่ได้รับดัดแปลงเพื่อแสดงฤทธ์ของยาและโปรตีนอื่นๆในนมของพวกมัน, และในปี 2009 องค์การอาหารและยาได้อนุมัติยาที่ผลิตในนมแพะ[108][109].
เป้าหมายอีกอันในการสร้าง GMOs คือการเพิ่มผลผลิตโดยตรงด้วยการเร่งการเจริญเติบโต, หรือการทำสิ่งมีชีวิตบึกบึนกว่าเดิม (สำหรับพืช, โดยการปรับปรุงเกลือ, การอดทนต่อความเย็นหรือภัยแล้ง)[103]. บางสัตว์ที่สำคัญทางเกษตรกรรมได้รับการดัดแปลงพันธุกรรมด้วยฮอร์โมนการเจริญเติบโตเพิ่มขนาดของพวกมัน[110].
วิศวกรรมทางพันธุกรรมของพืชผลทางการเกษตรสามารถเพิ่มอัตราการเจริญเติบโตและความต้านทานต่อโรคที่แตกต่างกันที่เกิดจากเชื้อโรคและปรสิต[111]. นี้จะเป็นประโยชน์อย่างมากในขณะที่มันสามารถเพิ่มการผลิตของแหล่งอาหารด้วยการใช้ทรัพยากรที่น้อยลงกว่าที่จะต้องใช้จริงเพื่อเป็นเจ้าภาพด้านประชากรที่เพิ่มมากขึ้นของโลก. พืชดัดแปลงเหล่านี้ยังจะช่วยลดการใช้สารเคมี, เช่นปุ๋ยและสารกำจัดศัตรูพืช, และดังนั้นจึงลดความรุนแรงและความถี่ของการเกิดความเสียหายที่เกิดจากมลพิษทางเคมีเหล่านี้อีกด้วย[111][112].
ความกังวลด้านจริยธรรมและความปลอดภัยได้รับการพูดถึงรอบๆการใช้อาหารดัดแปลงพันธุกรรม[113]. ความกังวลด้านความปลอดภัยที่สำคัญเกี่ยวข้องกับผลกระทบต่อสุขภาพของมนุษย์จากการกินอาหารดัดแปลงพันธุกรรม, โดยเฉพาะเจาะจงว่าจะเป็นปฏิกิริยาที่เป็นพิษหรือการแพ้ที่อาจเกิดขึ้น[114]. การไหลของยีนเข้าสู่พืชดัดแปรพันธุกรรมที่เกี่ยวข้อง, และผลกระทบนอกเป้าหมายในสิ่งมีชีวิตที่เป็นประโยชน์และผลกระทบต่อความหลากหลายทางชีวภาพเป็นปัญหาสิ่งแวดล้อมที่สำคัญ[115]. ความกังวลด้านจริยธรรมเกี่ยวข้องกับประเด็นทางศาสนา, การควบคุมในองค์รวมของอุปทานอาหาร, สิทธิในทรัพย์สินทางปัญญาและระดับของการติดฉลากที่จำเป็นบนผลิตภัณฑ์ดัดแปลงทางพันธุกรรม.
BioArt และความบันเทิง
[แก้]พันธุวิศวกรรมนอกจากนี้ยังถูกใช้ในการสร้าง BioArt[116]. แบคทีเรียบางชนิดที่ได้รับการดัดแปลงพันธุกรรมเพื่อสร้างภาพขาวดำ[117].
พันธุวิศวกรรมได้ถูกนำมาใช้ในการสร้างรายการแปลกเช่นดอกคาร์เนชั่นสีลาเวนเดอร์[118] ดอกกุหลาบสีฟ้า[119] และปลาเรืองแสง[120][121].
การกำกับดูแล
[แก้]บทความหลัก: การกำกับดูแลของพันธุวิศวกรรมและการกำกับดูแลของการเปิดตัวของสิ่งมีชีวิตดัดแปลงพันธุกรรม
การกำกับดูแลของพันธุวิศวกรรมเกี่ยวข้องกับวิธีการดำเนินการของรัฐบาลในการประเมินและจัดการความเสี่ยงที่เกี่ยวข้องกับการพัฒนาและการเปิดตัวของพืชดัดแปลงพันธุกรรม. มีความแตกต่างในการกำกับดูแลของพืชดัดแปลงพันธุกรรมในแต่ละประเทศ, ที่มีบางประเทศที่แตกต่างกันส่วนใหญ่เกิดขึ้นระหว่างสหรัฐอเมริกาและยุโรป. การกำกับดูแลที่แตกต่างกันในประเทศหนึ่งๆขึ้นอยู่กับวัตถุประสงค์ของการใช้ผลิตภัณฑ์ของทางพันธุวิศวกรรม. ยกตัวอย่างเช่นพืชที่ไม่ได้มีไว้สำหรับใช้เป็นอาหารโดยทั่วไปจะไม่ถูกตรวจสอบโดยหน่วยงานที่รับผิดชอบสำหรับความปลอดภัยของอาหาร.
การโต้เถียง
[แก้]บทความหลัก: การถกเถียงเรื่องการดัดแปลงพันธุกรรมอาหารและพันธุวิศวกรรมของมนุษย์
นักวิจารณ์ได้คัดค้านการใช้พันธุวิศวกรรมด้วยเหตุผลหลายอย่าง, รวมถึงความกังวลด้านจริยธรรม, ความกังวลด้านระบบนิเวศ, และความกังวลทางเศรษฐกิจที่ถูกยกขึ้นมาโดยความเป็นจริงที่ว่าเทคนิคจีเอ็มและสิ่งมีชีวิตจีเอ็มอยู่ภายใต้กฎหมายทรัพย์สินทางปัญญา. GMOs ยังเกี่ยวข้องกับการถกเถียงกันในเรื่องอาหารจีเอ็มด้วยคำถามที่ว่าอาหารที่ผลิตจากพืชจีเอ็มมีความปลอดภัยหรือไม่, ว่ามันควรจะได้รับการติดฉลากหรือไม่, และว่าพืชจีเอ็มมีความจำเป็นเพื่อแก้ปัญหาความต้องการอาหารของโลกหรือไม่. โปรดดูบทความการถกเถียงเรื่องอาหารดัดแปลงพันธุกรรมสำหรับการอภิปรายในประเด็นที่เกี่ยวกับพืชจีเอ็มและอาหารจีเอ็ม. การถกเถียงเหล่านี้ได้นำไปสู่การฟ้องร้อง, ข้อพิพาทการค้าระหว่างประเทศ, และการประท้วง, และการกำกับดูแลที่เข้มงวดของผลิตภัณฑ์ในเชิงพาณิชย์ในบางประเทศ.
ดูเพิ่ม
[แก้]- Biological engineering
- Gene patent
- Gene drive
- Genetic engineering in the United States
- Genetically modified crops
- Genetically modified food
- Genetically modified food controversies
- Genetically modified organisms
- Induced stem cells
- Marker assisted selection, วิธีหนึ่งที่คัดเลือกลูกหลานที่เหมาะสมโดยไม่ต้องใช้พันธุวิศวกรรม
- Paratransgenesis
- Regulation of the release of genetic modified organisms
อ้างอิง
[แก้]- ↑ "First transgenic pet, 'GloFish', sold to US public". PHG Foundation. 9 January 2004. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-06-15. สืบค้นเมื่อ 2014-12-02.
- ↑ U.S. EPA online. "Terms and Acronyms".
- ↑ Vert, Michel; Doi, Yoshiharu; Hellwich, Karl-Heinz; Hess, Michael; Hodge, Philip; Kubisa, Przemyslaw; Rinaudo, Marguerite; Schué, François (2012). "Terminology for biorelated polymers and applications (IUPAC Recommendations 2012)" (PDF). Pure and Applied Chemistry. 84 (2): 377–410. doi:10.1351/PAC-REC-10-12-04. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2015-03-19. สืบค้นเมื่อ 2014-12-02.
- ↑ 4.0 4.1 The European Parliament and the council of the European Union (12 March 2001). "Directive on the release of genetically modified organisms (GMOs) Directive 2001/18/EC ANNEX I A". Official Journal of the European Communities: 17.
{{cite journal}}: Cite journal ต้องการ|journal=(help) - ↑ Staff Economic Impacts of Genetically Modified Crops on the Agri-Food Sector; P. 42 Glossary - Term and Definitions The European Commission Directorate-General for Agriculture, "Genetic engineering: The manipulation of an organism's genetic endowment by introducing or eliminating specific genes through modern molecular biology techniques. A broad definition of genetic engineering also includes selective breeding and other means of artificial selection.", Retrieved 5 November 2012
- ↑ Van Eenennaam, Alison. "Is Livestock Cloning Another Form of Genetic Engineering?" (PDF). agbiotech. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2013-05-26.
- ↑ David M. Suter, Michel Dubois-Dauphin, Karl-Heinz Krause (2006). "Genetic engineering of embryonic stem cells" (PDF). Swiss Med Wkly. 136 (27–28): 413–415. PMID 16897894. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2011-07-07. สืบค้นเมื่อ 2014-12-02.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ernesto Andrianantoandro, Subhayu Basu, David K Kariga & Ron Weiss (16 May 2006). "Synthetic biology: new engineering rules for an emerging discipline". Molecular Systems Biology. 2 (2006.0028): 2006.0028. doi:10.1038/msb4100073. PMC 1681505. PMID 16738572.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Jacobsen, E.; Schouten, H. J. (2008). "Cisgenesis, a New Tool for Traditional Plant Breeding, Should be Exempted from the Regulation on Genetically Modified Organisms in a Step by Step Approach". Potato Research. 51: 75. doi:10.1007/s11540-008-9097-y.
- ↑ Capecchi, Mario R. (2001). "Generating mice with targeted mutations". Nature Medicine. 7 (10): 1086–90. doi:10.1038/nm1001-1086. PMID 11590420.
- ↑ Staff Biotechnology - Glossary of Agricultural Biotechnology Terms เก็บถาวร 2014-08-30 ที่ เวย์แบ็กแมชชีน United States Department of Agriculture, "Genetic modification: The production of heritable improvements in plants or animals for specific uses, via either genetic engineering or other more traditional methods. Some countries other than the United States use this term to refer specifically to genetic engineering.", Retrieved 5 November 2012
- ↑ James H. Maryanski (19 October 1999). "Genetically Engineered Foods". Center for Food Safety and Applied Nutrition at the Food and Drug Administration.
- ↑ Evans, Brent and Lupescu, Mihai (15 July 2012) Canada - Agricultural Biotechnology Annual – 2012 เก็บถาวร 2013-12-15 ที่ เวย์แบ็กแมชชีน GAIN (Global Agricultural Information Network) report CA12029, United States Department of Agriculture, Foreifn Agricultural Service, Retrieved 5 November 2012
- ↑ McHugen, Alan (14 September 2000). "Chapter 1: Hors-d'oeuvres and entrees/What is genetic modification? What are GMOs?". Pandora's Picnic Basket. Oxford University Press. ISBN 978-0198506744.
- ↑ Staff (28 November 2005) Health Canada - The Regulation of Genetically Modified Food เก็บถาวร 2017-06-10 ที่ เวย์แบ็กแมชชีน Glossary definition of Genetically Modified: "An organism, such as a plant, animal or bacterium, is considered genetically modified if its genetic material has been altered through any method, including conventional breeding. A 'GMO' is a genetically modified organism.", Retrieved 5 November 2012
- ↑ "What is genetic modification (GM)?". CSIRO. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-12-24. สืบค้นเมื่อ 2014-12-03.
- ↑ พลาสมิด มีได้ในแบคทีเรียหลายชนิด เป็น DNA ที่อยู่นอกโครโมโซม มีขนาดตั้งแต่ไม่กี่พันคู่เบสจนถึงมากกว่าแสนคู่เบส มีโครงสร้างเป็นวงแหวนเกลียวคู่ มีการพันกันในลักษณะเกลียวซ้อนเกลียว มักมียีนที่ทำให้แบคทีเรียมีคุณสมบัติพิเศษ เช่น ทำให้ผลิตยาปฏิชีวนะได้ ทำให้เกิดความต้านทานต่อยาปฏิชีวนะ หรือสามารถย่อยสลายโมเลกุลบางอย่างได้ พลาสมิดบางชนิดสามารถส่งถ่ายจากเซลล์หนึ่งไปยังอีกเซลล์หนึ่งได้โดยกระบวนการที่คล้ายกับการ conjugation เรียกว่าพลาสมิดแบบ conjugative ส่วนพลาสมิดบางชนิดที่ไม่สามารถส่งถ่ายจากเซลล์หนึ่งไปยังเซลล์หนึ่งได้เรียกว่าพลาสมิดแบบ non conjugative พลาสมิดกลุ่มนี้จะถูกส่งเข้าไปในเซลล์ที่ต้องการได้ในห้องปฏิบัติการ โดยอาศัยกระบวนการ transformation นอกจากนี้พลาสมิดกลุ่มนี้ยังสามารถส่งถ่ายระหว่างเซลล์ได้ถ้าอยู่ในเซลล์เดียวกับพลาสมิดแบบ conjugative พลาสมิดแต่ละชนิดจะมีวิธีการจำลองตัวที่แตกต่างกัน เช่น พลาสมิดบางชนิดมีวิธีการจำลองตัวภายใต้การควบคุมแบบเดียวกับโครโมโซม ทำให้มีพลาสมิดชนิดนี้เพียง 1 หรือ 2 โมเลกุลในเซลล์เรียกว่าพลาสมิดแบบ stringent ส่วนพลาสมิดบางชนิดมีวิธีการจำลองตัวที่ไม่ได้ขึ้นกับการจำลองตัวของโครโมโซม ทำให้มีหลายโมเลกุลในหนึ่งเซลล์เรียกว่าพลาสมิดแบบ relaxed พลาสมิดแบบ stringent มักมีขนาดใหญ่และเป็นพลาสมิดแบบ conjugative ส่วนพลาสมิดแบบ relaxed มักมีขนาดเล็กและเป็นพลาสมิดแบบ non conjugative พลาสมิดได้ถูกนำมาใช้ในการโคลนยีนโดยนิยมใช้พลาสมิดที่มีขนาดเล็กและเป็นแบบ relaxed นอกจากนี้ต้องมียีนเครื่องหมายที่แสดงลักษณะที่สามารถตรวจสอบได้ และมีตำแหน่งที่สามารถตัดได้โดยเอนไซม์ตัดจำเพาะชนิดใดชนิดหนึ่งเพียงตำแหน่งเดียว ข้อดีของพลาสมิดขนาดเล็กคือ จะทนต่อการขาดเมื่อผ่านขั้นตอนต่างๆ แยกจากเซลล์เจ้าของได้ง่ายและเมื่อนำไปต่อกับชิ้น DNA ที่ต้องการโคลนมีขนาดที่ไม่ใหญ่มาก ถ้าขนาดใหญ่มากจะเป็นอุปสรรคต่อการส่งถ่ายไปยังเซลล์ผู้รับ แหล่งข้อมูล สุรินทร์ ปิยะโชคณากุล. (2536). เวกเตอร์. ในพันธุวิศวกรรมเบื้องต้น. (หน้า 85-110). กรุงเทพฯ : ภาควิชาพันธุศาสตร์ คณะวิทยาศาสตร์ มหาวิทยาลัยเกษตรศาสตร์. [วิทยาศาสตร์และเทคโนโลยี]
- ↑ "Genetic Modification of Bacteria". Annenberg Foundation. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-12-24. สืบค้นเมื่อ 2014-12-03.
- ↑ Panesar, Pamit et al (2010) "Enzymes in Food Processing: Fundamentals and Potential Applications", Chapter 10, I K International Publishing House, ISBN 978-9380026336
- ↑ "GM traits list". International Service for the Acquisition of Agri-Biotech Applications.
- ↑ "ISAAA Brief 43-2011: Executive Summary". International Service for the Acquisition of Agri-Biotech Applications.
- ↑ Steve Connor (2 November 2007). "The mouse that shook the world". The Independent.
- ↑ Stableford, Brian M. (2004). Historical dictionary of science fiction literature. p. 133. ISBN 9780810849389.
- ↑ Hershey A, Chase M (1952). "Independent functions of viral protein and nucleic acid in growth of bacteriophage" (PDF). J Gen Physiol. 36 (1): 39–56. doi:10.1085/jgp.36.1.39. PMC 2147348. PMID 12981234.
- ↑ Jackson, DA; Symons, RH; Berg, P (1 October 1972). "Biochemical Method for Inserting New Genetic Information into DNA of Simian Virus 40: Circular SV40 DNA Molecules Containing Lambda Phage Genes and the Galactose Operon of Escherichia coli". PNAS. 69 (10): 2904–2909. Bibcode:1972PNAS...69.2904J. doi:10.1073/pnas.69.10.2904. PMC 389671. PMID 4342968.
- ↑ Arnold, Paul (2009). "History of Genetics: Genetic Engineering Timeline".
- ↑ Stanley N. Cohen and Annie C. Y. Chang (1 May 1973). "Recircularization and Autonomous Replication of a Sheared R-Factor DNA Segment in Escherichia coli Transformants — PNAS". Pnas.org. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2019-05-21. สืบค้นเมื่อ 17 July 2010.
- ↑ Jaenisch, R. and Mintz, B. (1974 ) Simian virus 40 DNA sequences in DNA of healthy adult mice derived from preimplantation blastocysts injected with viral DNA. Proc. Natl. Acad. 71(4) 1250–1254 [1] เก็บถาวร 2019-07-07 ที่ เวย์แบ็กแมชชีน
- ↑ Berg P; Baltimore, D; Brenner, S; Roblin, RO; Singer, MF (1975). "Summary statement of the Asilomar Conference on recombinant DNA molecules" (PDF). Proc. Natl. Acad. Sci. U.S.A. 72 (6): 1981–4. Bibcode:1975PNAS...72.1981B. doi:10.1073/pnas.72.6.1981. PMC 432675. PMID 806076.
- ↑ "NIH Guidelines for research involving recombinant DNA molecules". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2012-09-10. สืบค้นเมื่อ 2014-12-03.
- ↑ Goeddel, David; Dennis G. Kleid; Francisco Bolivar; Herbert L. Heyneker; Daniel G. Yansura; Roberto Crea; Tadaaki Hirose; Adam Kraszewski; Keiichi Itakura; AND Arthur D. Riggs (January 1979). "Expression in Escherichia coli of chemically synthesized genes for human insulin" (PDF). PNAS. 76 (1): 106–110. Bibcode:1979PNAS...76..106G. doi:10.1073/pnas.76.1.106. PMC 382885. PMID 85300. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2017-11-15. สืบค้นเมื่อ 2014-12-03.
- ↑ US Supreme Court Cases from Justia & Oyez (16 June 1980). "Diamond V Chakrabarty". 447 (303). Supreme.justia.com. สืบค้นเมื่อ 17 July 2010.
{{cite journal}}: Cite journal ต้องการ|journal=(help) - ↑ "Artificial Genes". TIME. 15 November 1982. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2013-05-21. สืบค้นเมื่อ 17 July 2010.
- ↑ H. Patricia Hynes. (1989) Biotechnology in agriculture: an analysis of selected technologies and policy in the United States. Reproductive and Genetic Engineering (2)1:39–49 [2] เก็บถาวร 2014-12-04 ที่ เวย์แบ็กแมชชีน
- ↑ Rebecca Bratspies (2007) Some Thoughts on the American Approach to Regulating Genetically Modified Organisms. Kansas Journal of Law and Public Policy 16:393 [3][ลิงก์เสีย]
- ↑ 36.0 36.1 BBC News 14 June 2002 GM crops: A bitter harvest?
- ↑ Thomas H. Maugh II for the Los Angeles Times. 9 June 1987. Altered Bacterium Does Its Job : Frost Failed to Damage Sprayed Test Crop, Company Says
- ↑ James, Clive (1996). "Global Review of the Field Testing and Commercialization of Transgenic Plants: 1986 to 1995" (PDF). The International Service for the Acquisition of Agri-biotech Applications. สืบค้นเมื่อ 17 July 2010.
- ↑ James, Clive (1997). "Global Status of Transgenic Crops in 1997" (PDF). ISAAA Briefs No. 5.: 31.
- ↑ Bruening, G.; Lyons, J.M. (2000). "The case of the FLAVR SAVR tomato". California Agriculture. 54 (4): 6. doi:10.3733/ca.v054n04p6.
- ↑ MacKenzie, Debora (18 June 1994). "Transgenic tobacco is European first". New Scientist.
{{cite journal}}: Cite journal ต้องการ|journal=(help) - ↑ Genetically Altered Potato Ok'd For Crops Lawrence Journal-World - 6 May 1995
- ↑ Global Status of Commercialized Biotech/GM Crops: 2009 ISAAA Brief 41-2009, 23 February 2010. Retrieved 10 August 2010
- ↑ WHO (1987): Principles for the Safety Assessment of Food Additives and Contaminants in Food, Environmental Health Criteria 70. World Health Organization, Geneva
- ↑ WHO (1991): Strategies for assessing the safety of foods produced by biotechnology, Report of a Joint FAO/WHO Consultation. World Health Organization, Geneva
- ↑ WHO (1993): Health aspects of marker genes in genetically modified plants, Report of a WHO Workshop. World Health Organization, Geneva
- ↑ WHO (1995): Application of the principle of substantial equivalence to the safety evaluation of foods or food components from plants derived by modern biotechnology, Report of a WHO Workshop. World Health Organization, Geneva
- ↑ Gibson, D. G.; Glass, J. I.; Lartigue, C.; Noskov, V. N.; Chuang, R.-Y.; Algire, M. A.; Benders, G. A.; Montague, M. G.; Ma, L.; Moodie, M. M.; Merryman, C.; Vashee, S.; Krishnakumar, R.; Assad-Garcia, N.; Andrews-Pfannkoch, C.; Denisova, E. A.; Young, L.; Qi, Z.-Q.; Segall-Shapiro, T. H.; Calvey, C. H.; Parmar, P. P.; Hutchison Ca, C. A.; Smith, H. O.; Venter, J. C. (2010). "Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome". Science. 329 (5987): 52–6. doi:10.1126/science.1190719. PMID 20488990.
- ↑ Sample, Ian (20 May 2010). "Craig Venter creates synthetic life form". London: guardian.co.uk.
- ↑ James, Clive (2012). "Global Status of Commercilized Biotech/GM Crops:2012". ISSA Brief No. 44.
- ↑ Alberts B, Johnson A, Lewis J (2002). "8". Isolating, Cloning, and Sequencing DNA (4th ed.). New York: Garland Science.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ R I Kaufman and B T Nixon (1996). "Use of PCR to isolate genes encoding sigma54-dependent activators from diverse bacteria". J Bacteriol. 178 (13): 3967–3970. PMC 232662. PMID 8682806.
- ↑ Liang, Jing; Luo, Yunzi; Zhao, Huimin (2011). "Synthetic biology: Putting synthesis into biology". Wiley Interdisciplinary Reviews: Systems Biology and Medicine. 3: 7. doi:10.1002/wsbm.104.
- ↑ Berg, P.; Mertz, J. E. (2010). "Personal Reflections on the Origins and Emergence of Recombinant DNA Technology". Genetics. 184 (1): 9–17. doi:10.1534/genetics.109.112144. PMC 2815933. PMID 20061565.
- ↑
Townsend JA, Wright DA, Winfrey RJ (May 2009). "High-frequency modification of plant genes using engineered zinc-finger nucleases". Nature. 459 (7245): 442–5. Bibcode:2009Natur.459..442T. doi:10.1038/nature07845. PMC 2743854. PMID 19404258.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Shukla VK, Doyon Y, Miller JC (May 2009). "Precise genome modification in the crop species Zea mays using zinc-finger nucleases". Nature. 459 (7245): 437–41. Bibcode:2009Natur.459..437S. doi:10.1038/nature07992. PMID 19404259.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Grizot S, Smith J, Daboussi F (September 2009). "Efficient targeting of a SCID gene by an engineered single-chain homing endonuclease". Nucleic Acids Res. 37 (16): 5405–19. doi:10.1093/nar/gkp548. PMC 2760784. PMID 19584299.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Gao H, Smith J, Yang M (January 2010). "Heritable targeted mutagenesis in maize using a designed endonuclease". Plant J. 61 (1): 176–87. doi:10.1111/j.1365-313X.2009.04041.x. PMID 19811621.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Christian M, Cermak T, Doyle EL (July 2010). "TAL Effector Nucleases Create Targeted DNA Double-strand Breaks". Genetics. 186 (2): 757–61. doi:10.1534/genetics.110.120717. PMC 2942870. PMID 20660643.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Li T, Huang S, Jiang WZ (August 2010). "TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and FokI DNA-cleavage domain". Nucleic Acids Res. 39 (1): 359–72. doi:10.1093/nar/gkq704. PMC 3017587. PMID 20699274.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ S.C. Ekker (2008). "Zinc finger-based knockout punches for zebrafish genes". Zebrafish. 5 (2): 1121–3. doi:10.1089/zeb.2008.9988. PMC 2849655. PMID 18554175.
- ↑
Geurts AM, Cost GJ, Freyvert Y (July 2009). "Knockout rats via embryo microinjection of zinc-finger nucleases". Science. 325 (5939): 433. Bibcode:2009Sci...325..433G. doi:10.1126/science.1172447. PMC 2831805. PMID 19628861.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Chen I, Dubnau D (2004). "DNA uptake during bacterial transformation". Nat. Rev. Microbiol. 2 (3): 241–9. doi:10.1038/nrmicro844. PMID 15083159.
- ↑ Graham Head; Hull, Roger H; Tzotzos, George T. (2009). Genetically Modified Plants: Assessing Safety and Managing Risk. London: Academic Pr. p. 244. ISBN 0-12-374106-8.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Gelvin, S. B. (2003). "Agrobacterium-Mediated Plant Transformation: The Biology behind the "Gene-Jockeying" Tool". Microbiology and Molecular Biology Reviews. 67 (1): 16–37, table of contents. doi:10.1128/MMBR.67.1.16-37.2003. PMC 150518. PMID 12626681.
- ↑ Behrooz Darbani, Safar Farajnia, Mahmoud Toorchi, Saeed Zakerbostanabad, Shahin Noeparvar and C. Neal Stewart Jr. (2010). "DNA-Delivery Methods to Produce Transgenic Plants". Science Alert.
{{cite web}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Hohn, Barbara; Levy, Avraham A; Puchta, Holger (2001). "Elimination of selection markers from transgenic plants". Current Opinion in Biotechnology. 12 (2): 139–43. doi:10.1016/S0958-1669(00)00188-9. PMID 11287227.
- ↑ Esvelt, KM.; Wang, HH. (2013). "Genome-scale engineering for systems and synthetic biology". Mol Syst Biol. 9: 641. doi:10.1038/msb.2012.66. PMC 3564264. PMID 23340847.
- ↑ Tan, WS.; Carlson, DF.; Walton, MW.; Fahrenkrug, SC.; Hackett, PB. (2012). "Precision editing of large animal genomes". Adv Genet. Advances in Genetics. 80: 37–97. doi:10.1016/B978-0-12-404742-6.00002-8. ISBN 9780124047426. PMC 3683964. PMID 23084873.
- ↑ John C. Avise (2004). The hope, hype & reality of genetic engineering: remarkable stories from agriculture, industry, medicine, and the environment. Oxford University Press US. p. 22. ISBN 978-0-19-516950-8.
- ↑ (10 December 2012) Engineering algae to make complex anti-cancer 'designer' drug PhysOrg, Retrieved 15 April 2013
- ↑ National Institute of Allergies and Infectious Diseases. "Vaccine Types". national Institute of Health.
- ↑ Rodriguez, Luis L.; Grubman, Marvin J. (2009). "Foot and mouth disease virus vaccines". Vaccine. 27: D90–4. doi:10.1016/j.vaccine.2009.08.039. PMID 19837296.
- ↑ Roque AC, Lowe CR, Taipa MA. (2004). "Antibodies and genetically engineered related molecules: production and purification". Biotechnol Proress. 20 (3): 639–54. doi:10.1021/bp030070k. PMID 15176864.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Coghlan, Andy (26 March 2013) Gene therapy cures leukaemia in eight days The New Scientist, Retrieved 15 April 2013
- ↑ Coghlan, Andy (10 February 2013) Liver cancer survival time tripled by virus New Scientist, Retrieved 15 April 2013
- ↑ "Background: Cloned and Genetically Modified Animals". Center for Genetics and Society. 14 April 2005.
- ↑ "Knockout Mice". Nation Human Genome Research Institute. 2009.
- ↑ "GM pigs best bet for organ transplant". Medical News Today. 21 September 2003. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2011-05-10. สืบค้นเมื่อ 2014-12-05.
- ↑ "What is Genetic Engineering? A simple introduction". Physicians and scientists for responsible application of science and technology. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2016-10-13. สืบค้นเมื่อ 2014-12-05.
- ↑ "Gene Therapy". Oak Ridge national laboratory. 11 June 2009. สืบค้นเมื่อ 7 September 2010.
- ↑ Fischer, Alain; Hacein-Bey-Abina, Salima; Cavazzana-Calvo, Marina (2010). "20 years of gene therapy for SCID". Nature Immunology. 11 (6): 457–60. doi:10.1038/ni0610-457. PMID 20485269.
- ↑ Ledford, Heidi (2011). "Cell therapy fights leukaemia". Nature. doi:10.1038/news.2011.472.
- ↑ Lewitt, Peter A; Rezai, Ali R; Leehey, Maureen A; Ojemann, Steven G; Flaherty, Alice W; Eskandar, Emad N; Kostyk, Sandra K; Thomas, Karen; Sarkar, Atom; Siddiqui, Mustafa S; Tatter, Stephen B; Schwalb, Jason M; Poston, Kathleen L; Henderson, Jaimie M; Kurlan, Roger M; Richard, Irene H; Van Meter, Lori; Sapan, Christine V; During, Matthew J; Kaplitt, Michael G; Feigin, Andrew (2011). "AAV2-GAD gene therapy for advanced Parkinson's disease: A double-blind, sham-surgery controlled, randomised trial". The Lancet Neurology. 10 (4): 309–19. doi:10.1016/S1474-4422(11)70039-4. PMID 21419704.
- ↑ Gallagher, James. (2 November 2012) BBC News – Gene therapy: Glybera approved by European Commission. Bbc.co.uk. Retrieved on 15 December 2012.
- ↑ Richards, Sabrina. "Gene Therapy Arrives in Europe". The Scientist. สืบค้นเมื่อ 16 November 2012.
- ↑ Emilie R. Bergeson (1997). "The Ethics of Gene Therapy".
- ↑ Kathi E. Hanna. "Genetic Enhancement". National Human Genome Research Institute.
- ↑ "Applications of Genetic Engineering". Microbiologyprocedure. สืบค้นเมื่อ 7 September 2010.
- ↑ "Biotech: What are transgenic organisms?". Easyscience. 2002. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-05-27. สืบค้นเมื่อ 7 September 2010.
- ↑ Savage, Neil (1 August 2007). "Making Gasoline from Bacteria: A biotech startup wants to coax fuels from engineered microbes". Technology Review. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-04-09. สืบค้นเมื่อ 7 September 2010.
- ↑ Summers, Rebecca (24 April 2013) Bacteria churn out first ever petrol-like biofuel New Scientist, Retrieved 27 April 2013
- ↑ "Application of Some Genetically Engineered Bacteria". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-11-27. สืบค้นเมื่อ 7 September 2010.
- ↑ Sanderson, Katherine (24 February 2012) New Portable Kit Detects Arsenic In Wells Chemical and Engineering News, Retrieved 23 January 2013
- ↑ "New virus-built battery could power cars, electronic devices". Web.mit.edu. 2 April 2009. สืบค้นเมื่อ 17 July 2010.
- ↑ "Hidden Ingredient In New, Greener Battery: A Virus". Npr.org. สืบค้นเมื่อ 17 July 2010.
- ↑ "Researchers Synchronize Blinking 'Genetic Clocks' -- Genetically Engineered Bacteria That Keep Track of Time". ScienceDaily. 24 January 2010.
- ↑ Suszkiw, Jan (November 1999). "Tifton, Georgia: A Peanut Pest Showdown". Agricultural Research magazine. สืบค้นเมื่อ 23 November 2008.
- ↑ Magaña-Gómez JA, de la Barca AM (2009). "Risk assessment of genetically modified crops for nutrition and health". Nutr. Rev. 67 (1): 1–16. doi:10.1111/j.1753-4887.2008.00130.x. PMID 19146501.
- ↑ Islam, Aparna (2008). "Fungus Resistant Transgenic Plants: Strategies, Progress and Lessons Learnt". Plant Tissue Culture and Biotechnology. 16 (2): 117–38. doi:10.3329/ptcb.v16i2.1113.
- ↑ "Disease resistant crops". GMO Compass. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-06-03. สืบค้นเมื่อ 2014-12-06.
- ↑ Demont, M; Tollens, E (2004). "First impact of biotechnology in the EU: Bt maize adoption in Spain". Annals of Applied Biology. 145 (2): 197–207. doi:10.1111/j.1744-7348.2004.tb00376.x.
- ↑ 103.0 103.1 Deborah B. Whitman (2000). "Genetically Modified Foods: Harmful or Helpful?". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2015-02-16. สืบค้นเมื่อ 2014-12-06.
- ↑ Emma Young (2003). "GM cows to please cheese-makers". New Scientist.
- ↑ Rapeseed (พืชชนิดหนึ่งใช้สำหรับเลี้ยงสัตว์หรือสกัดเอาน้ำมันจากเมล็ด, canola) ได้ถูกดัดแปลงพันธุกรรมเพื่อปรับเปลี่บนส่วนประกอบน้ำมันของมันด้วยยีนทีมีรหัสเอนซายน์ "12:0 thioesterase" (TE) จากโรงงานใน California bay (Umbellularia californica) เพื่อเพิ่มกรดไขมันความยาวปานกลาง, ดู: Geo-pie.cornell.edu
- ↑ Bomgardner Melody M (2012). "Replacing Trans Fat: New crops from Dow Chemical and DuPont target food makers looking for stable, heart-healthy oils". Chemical and Engineering News. 90 (11): 30–32.
- ↑ Marvier, Michelle (2008). "Pharmaceutical crops in California, benefits and risks. A review". Agronomy for Sustainable Development. 28 (1): 1–9. doi:10.1051/agro:2007050.
- ↑ "FDA Approves First Human Biologic Produced by GE Animals". US Food and Drug Administration.
- ↑ Paulo Rebêlo (15 July 2004). "GM cow milk 'could provide treatment for blood disease'". SciDev.
- ↑ "Giant GM salmon on the way". BBC News. 11 April 2000.
- ↑ 111.0 111.1 Eric Chivian, Aaron Bernstein (2008). Sustaining Life. Oxford University Press, Inc. ISBN 978-0-19-517509-7.
{{cite book}}:|access-date=ต้องการ|url=(help) - ↑ Carrington, Damien (13 June 2012) GM crops good for environment, study finds The Guardian. Retrieved 16 June 2012
- ↑ John Pickrell (4 September 2006). "Introduction: GM Organisms". New Scientist.
- ↑ "20 questions on genetically modified foods". World Health Organization. 2010.
- ↑ "Can GM crops harm the environment?". National Environment Research Council (NERC). คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-07-29. สืบค้นเมื่อ 2014-12-06.
- ↑ Jessica M. Pasko (3/4/2007). "Bio-artists bridge gap between arts, sciences: Use of living organisms is attracting attention and controversy". msnbc.
{{cite web}}: ตรวจสอบค่าวันที่ใน:|date=(help) - ↑ Joab Jackson (6 December 2005). "Genetically Modified Bacteria Produce Living Photographs". National Geographic News.
- ↑ Phys.Org website. 4 April 2005 Plant gene replacement results in the world's only blue rose
- ↑ Katsumoto, Yukihisa; Fukuchi-Mizutani, Masako; Fukui, Yuko; Brugliera, Filippa; Holton, Timothy A.; Karan, Mirko; Nakamura, Noriko; Yonekura-Sakakibara, Keiko; Togami, Junichi; Pigeaire, Alix; Tao, Guo-Qing; Nehra, Narender S.; Lu, Chin-Yi; Dyson, Barry K.; Tsuda, Shinzo; Ashikari, Toshihiko; Kusumi, Takaaki; Mason, John G.; Tanaka, Yoshikazu (2007). "Engineering of the Rose Flavonoid Biosynthetic Pathway Successfully Generated Blue-Hued Flowers Accumulating Delphinidin". Plant and Cell Physiology. 48 (11): 1589–600. doi:10.1093/pcp/pcm131. PMID 17925311.
- ↑ Published PCT Application WO2000049150 "Chimeric Gene Constructs for Generation of Fluorescent Transgenic Ornamental Fish." National University of Singapore [4]
- ↑ Stewart, C. Neal (2006). "Go with the glow: Fluorescent proteins to light transgenic organisms". Trends in Biotechnology. 24 (4): 155–62. doi:10.1016/j.tibtech.2006.02.002. PMID 16488034.
