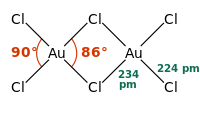โกลด์(III) คลอไรด์

| |
 Ball-and-stick model of AuCl3
| |
 Crystal structure of AuCl3
| |
| ชื่อ | |
|---|---|
| IUPAC name
Gold(III) trichloride
| |
| ชื่ออื่น
Auric chloride
Gold trichloride | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEBI | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.033.280 |
ผับเคม CID
|
|
| RTECS number |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| AuCl3 (exists as Au2Cl6) | |
| มวลโมเลกุล | 606.6511 g/mol |
| ลักษณะทางกายภาพ | ผลึกสีแดง (ไม่มีน้ำ); ผลึกสีเหลืองทอง (โมโนไฮเดรต)[1] |
| ความหนาแน่น | 4.7 g/cm3 |
| จุดหลอมเหลว | 160 องศาเซลเซียส (320 องศาฟาเรนไฮต์; 433 เคลวิน) (สลายตัว) |
| 68 g/100 ml (20 °C) | |
| ความสามารถละลายได้ | ละลายได้ในอีเทอร์และเอทานอล ละลายได้เล็กน้อยในแอมโมเนียเหลว ไม่ละลายในเบนซีน |
| −112·10−6 cm3/mol | |
| โครงสร้าง | |
| monoclinic | |
| P21/C | |
a = 6.57 Å, b = 11.04 Å, c = 6.44 Å α = 90°, β = 113.3°, γ = 90°[2]
| |
| Square planar | |
| อุณหเคมี | |
Std enthalpy of
formation (ΔfH⦵298) |
−117.6 kJ/mol[3] |
| ความอันตราย[4] | |
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |
อันตรายหลัก
|
ระคายเคือง |
| GHS labelling: | |

| |
| เตือน | |
| H315, H319, H335 | |
| P261, P264, P271, P280, P302+P352, P305+P351+P338 | |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
แอนไอออนอื่น ๆ
|
Gold(III) fluoride Gold(III) bromide |
แคทไอออนอื่น ๆ
|
Gold(I) chloride Silver(I) chloride Platinum(II) chloride Mercury(II) chloride |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
โกลด์ (III) คลอไรด์ (อังกฤษ: Gold (III) chloride) ชื่อการค้าคือ ออริก คลอไรด์ (auric chloride) เป็นสารประกอบอนินทรีย์ของทองคำ สูตรทางเคมีของมันคือ AuCl3 ทองคำที่มีออกซิเดชั่น สเตต (oxidation state) +3 เป็นฟอร์มที่มีเสถียรภาพมากที่สุดของมัน สารประกอบคลอไรด์ของทองในรูปแบบอื่น คือ โกลด์ (I) คลอไรด์ (AuCl) แตมีเสถียรภาพน้อยกว่า AuCl3 เมื่อเอาทองละลายในน้ำประสานทอง (aqua regia) จะได้คลอราออริก แอซิด (chlorauric acid- (HAuCl4)) ซึ่งมีชื่อเรียกหลายชื่อเช่น "โกลด์ คลอไรด์" ("gold chloride") หรือ "แอซิดโกลด์ไตรคลอไรด์" ("acid gold trichloride" ) หรือ"โกลด์ (III) คลอไรด์ไตรไฮเดรต" ("gold (III) chloride trihydrate") โกลด์ (III) คลอไรด์ มีคุณสมบัติดูดน้ำได้ดีมาก และละลายในน้ำและแอลกอฮอลได้ดีมากด้วย
โครงสร้าง
[แก้]พันธะในโครงสร้างนี้เป็นพันธะโควาเลนต์
คุณสมบัติทางเคมี
[แก้]แอนไฮดรัส AuCl3 จะเริ่มแตกตัวเป็น AuCl ที่อุณหภูมิ 160 ?C; และเมื่ออุณหภูมิสูงกว่านี้มันจะกลายเป็นโลหะทองคำ และ AuCl3.
AuCl3 → AuCl + Cl2 (>160 ?C)
3 AuCl → AuCl3 + 2 แม่แบบ:Gold (>420 ?C)
อ้างอิง
[แก้]- ↑ Egon Wiberg; Nils Wiberg; A. F. Holleman (2001). Inorganic Chemistry (101 ed.). Academic Press. pp. 1286–1287. ISBN 978-0-12-352651-9.
- ↑ E. S. Clark; D. H. Templeton; C. H. MacGillavry (1958). "The crystal structure of gold(III) chloride". Acta Crystallogr. 11 (4): 284–288. doi:10.1107/S0365110X58000694. สืบค้นเมื่อ 2010-05-21.
- ↑ Haynes, William M.; Lide, David R.; Bruno, Thomas J., บ.ก. (2016). CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data (95th ed.). Boca Raton, Florida. p. 5-5. ISBN 978-1-4987-5428-6. OCLC 930681942.
- ↑ "Gold Chloride". American Elements. สืบค้นเมื่อ July 22, 2019.
- N. N. Greenwood, A. Earnshaw, Chemistry of the Elements, 2nd ed., Butterworth-Heinemann, Oxford, UK, 1997.
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- H. Nechamkin, The Chemistry of the Elements, McGraw-Hill, New York, 1968.
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- G. Dyker, An Eldorado for Homogeneous Catalysis?, in Organic Synthesis Highlights V, H.-G. Schmaltz, T. Wirth (eds.) , pp 48-55, Wiley-VCH, Weinheim, 2003.
- Y. Fukuda, K. Utimoto, J. Org. Chem. 56, 3729-3731 (1991).
- A. S. K. Hashmi, T. M. Frost, J. W. Bats, J. Am. Chem. Soc. 122, 11553-11554 (2000).