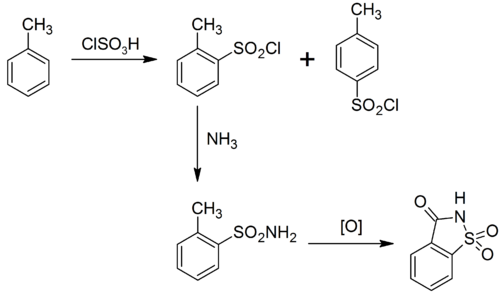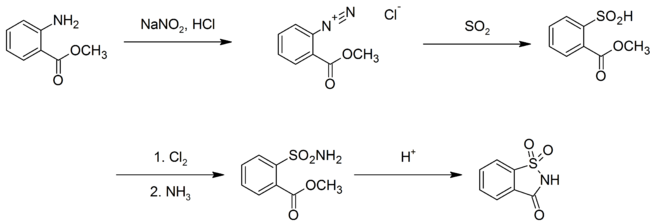แซ็กคาริน
| |

| |
| ชื่อ | |
|---|---|
| IUPAC name
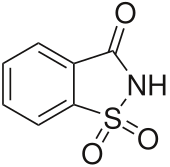
1,1-Dioxo-1,2-benzothiazol-3-one
| |
| ชื่ออื่น
Benzoic sulfinide
E954 | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ECHA InfoCard | 100.001.202 |
| เลขอี | E954 (glazing agents, ...) |
ผับเคม CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| คุณสมบัติ | |
| C7H5NO3S | |
| มวลโมเลกุล | 183.1845 |
| ลักษณะทางกายภาพ | White crystalline solid |
| ความหนาแน่น | 0.828 g/cm3 |
| จุดหลอมเหลว | 228.8-229.7 °C |
| 1 g per 290 mL | |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
แซ็กคาริน (อังกฤษ: saccharin) หรือ ดีน้ำตาล หรือเรียกอีกชื่อหนึ่งว่า ขัณฑสกร มีชื่อทางเคมีว่า 2,3-dihydro-3-oxobenzisosulfonazole มีความหวานมากกว่าน้ำตาลถึง 300 เท่า ถูกนำมาใช้กันอย่างกว้างขวางในช่วงสงครามโลกครั้งที่ 1 เพราะเป็นช่วงที่น้ำตาลขาดแคลน แซ็กคารินถูกค้นพบโดยบังเอิญ โดยคอนสแตนติน ฟาห์ลเบอร์ก มีรสหวานจัด เคยถูกใช้เพื่อปรุงแต่งรสหวานในอาหาร ปัจจุบันใช้น้อยลงเพราะเป็นสารก่อมะเร็ง[2]
ในปีค.ศ. 2000 องค์การอาหารและยาสหรัฐ ยกเลิกคำเตือนเรื่องการใช้งานแซ็กคาริน เนื่องจากนักวิจ้ยพบว่างานวิจัยเดิมนั้นทดลองในหนู ซึ่งมีระดับของ pH, calcium phosphate และโปรตีนในปัสสาวะสูงไม่เหมือนในมนุษย์[3][4] โปรตีนอย่างน้อยหนึ่งชนิดที่พบมากในหนูตัวผู้ เมื่อประกอบกับ calcium phosphate และแซ็กคารินแล้วทำให้เกินผลึกขนาดเล็กซึ่งทำอันตรายต่อกระเพาะปัสสาวะ ซึ่งเซลล์กระเพาะปัสสาวะของหนูจะเพิ่มจำนวนขึ้นอย่างมากเพื่อซ่อมแซมตัวเองซึ่งก่อให้เกิดเนื้องอกขึ้น ซึ่งอาการนี้ไม่เกิดขึ้นในมนุษย์ จึงไม่ได้เพิ่มความเสี่ยงในการเกิดมะเร็งกระเพาะปัสสาวะในมนุษย์[5] จากนั้นในปีค.ศ. 2001 องค์การอาหารและยาสหรัฐ และรัฐแคลิฟอร์เนีย ได้ประกาศว่าแซ็กคารินนั้นปลอดภัยต่อการบริโภค[6]
คุณสมบัติทางเคมี[แก้]
การเตรียม[แก้]
การผลิตดีน้ำตาลมีหลายวิธี[7] วิธีดั้งเดิมของเรมเซนและฟาห์ลเบอร์กเริ่มด้วยโทลูอีน อีกทางหนึ่งเริ่มด้วย o-chlorotoluene.[8] ปฏิกิริยาซัลโฟเนชันของโทลูอีนกับกรดคลอโรซัลโฟนิก จะได้ ortho และ para sulfonyl chloride ไอโซเมอร์ออร์โทถูกแยกออกมาและเปลี่ยนเป็นซัลโฟนาไมด์ โดยทำปฏิกิริยากับแอมโมเนีย ปฏิกิริยาออกซิเดชันของหมู่เมทิลให้ได้เป็นหมู่คาร์บอกซิลิก และจัดให้เป็นวงจะได้แซกคาริน:[9]
ใน พ.ศ. 2493 มีการปรับปรุงการสังเคราะห์โดยMaumee Chemical Company แห่ง Toledo, Ohio โดยใช้ กรดแอนทรานิลิก ทำปฏิกิริยากับ กรดไนตรัส (เกิดเป็น โซเดียมไนไตรต์ และ กรดไฮโดรคลอริก), ซัลเฟอร์ไดออกไซด์ คลอรีน สุดท้ายคือ แอมโมเนีย จนได้แซกคาริน:[9]
คุณสมบัติและปฏิกิริยา[แก้]
แซกคารินที่ไม่มีกรดมีค่า pKa 1.6 (ไฮโดรเจนที่เป็นกรดจับกับไนโตรเจน)[10] แซกคารินใช้เตรียมเอมีนจาก อัลคิลฮาไลด์[11] ตามด้วย Gabriel synthesis.[12][13]
แซกคารินใช้เป็นสารตัวกลางในการผลิต ไพรอซิแคม เทโนซิแคม ซูโดซิแคม ไอโซซิแคม และ เมโลซิแคม
อ้างอิง[แก้]
- ↑ Merck Index, 11th Edition, 8282.
- ↑ ชยันต์ พิเชียรสุนทร และ วิเชียร จีรวงศ์. คู่มือเภสัชกรรมแผนไทยเล่ม 1 น้ำกระสายยา. พิมพ์ครั้งที่ 3. กทม. อัมรินทร์พริ้นติ้งแอนด์พับลิชชิ่ง. 2556. หน้า 71 – 73
- ↑ Whysner, J.; Williams, GM. (1996). "Saccharin mechanistic data and risk assessment: urine composition, enhanced cell proliferation, and tumor promotion". Pharmacol Ther. 71 (1–2): 225–52. doi:10.1016/0163-7258(96)00069-1. PMID 8910956.
- ↑ Dybing, E. (Dec 2002). "Development and implementation of the IPCS conceptual framework for evaluating mode of action of chemical carcinogens". Toxicology. 181–182: 121–5. doi:10.1016/S0300-483X(02)00266-4. PMID 12505296.
- ↑ National Toxicology Program. Report on Carcinogens, Thirteenth Edition, Appendix B เก็บถาวร 2016-05-20 ที่ เวย์แบ็กแมชชีน. pages 2–4. Linked from Saccharin index page เก็บถาวร 2016-03-07 ที่ เวย์แบ็กแมชชีน at NTP, last updated on November 18, 2014. Page accessed Feb 29, 2016
- ↑ Conis, Elena. "Saccharin's mostly sweet following." เก็บถาวร 2011-02-17 ที่ เวย์แบ็กแมชชีน Los Angeles Times. December 27, 2010, accessed January 14, 2011.
- ↑ David J. Ager; David P. Pantaleone; Scott A. Henderson; Alan R. Katritzky; Indra Prakash; D. Eric Walters (1998). "Commercial, Synthetic Nonnutritive Sweeteners". Angewandte Chemie International Edition. 37 (13–24): 1802–23. doi:10.1002/(SICI)1521-3773(19980803)37:13/14<1802::AID-ANIE1802>3.0.CO;2-9.
- ↑ Bungard, G. (1967) Die SusStoffe Der Deut Apotheker, 19, 150.
- ↑ 9.0 9.1 แม่แบบ:Ullmann's
- ↑ Bell, R. P.; Higginson, W. C. E. (1949). "The Catalyzed Dehydration of Acetaldehyde Hydrate, and the Effect of Structure on the Velocity of Protolytic Reactions". Proc. R. Soc. A. 97 (1049): 141–159. doi:10.1098/rspa.1949.0055.
- ↑ Ervithayasuporn, V.; Yingsukkamol, Pa-Kwan; Phurat, Chuttree; Somsook, Ekasith; Osotchan, Tanakorn; Ervithayasuporn, Vuthichai (2012). "Synthesis and Reactivity of Nitrogen Nucleophiles-Induced Cage-Rearrangement Silsesquioxanes". Inorg. Chem. 51 (22): 12266–12272. doi:10.1021/ic3015145.
- ↑ Sugasawa, S.; Abe, K. (1952). J. Pharm. Soc. Jpn. 72: 270.
{{cite journal}}:|title=ไม่มีหรือว่างเปล่า (help)CS1 maint: multiple names: authors list (ลิงก์) - ↑ Chem Abstr. 47: 1626c. 1953.
{{cite journal}}:|title=ไม่มีหรือว่างเปล่า (help)