ผลต่างระหว่างรุ่นของ "มาลาเรีย"
| บรรทัด 38: | บรรทัด 38: | ||
== สาเหตุ == |
== สาเหตุ == |
||
ปรสิตมาลาเรียเป็นสิ่งมีชีวิตในสกุล ''[[Plasmodium]]'' (ไฟลัม [[Apicomplexa]]) ''P. falciparum'', ''P. malariae'', ''P. ovale'', ''P. vivax'' และ ''P. knowlesi'' เป็นสาเหตุของมาลาเรียในมนุษย์ ซึ่งในสปีชีส์เหล่านี้ ''P. falciparum'' เป็นสปีชีส์ที่พบมากที่สุด (~75%) รองลงมาคือ ''P. vivax'' (~20%) แม้ว่าเดิม ''P. falciparum'' เป็นชนิดที่ทำให้มีผู้เสียชีวิตมากที่สุด แต่หลักฐานปัจจุบันเสนอว่า มาลาเรีย ''P. vivax'' สัมพันธ์กับสภาพที่อาจอันตรายถึงชีวิตได้บ่อยครั้งเท่ากับการวินิจฉัยการติดเชื้อ ''P. falciparum'' มาลาเรีย ''P. vivax'' พบนอกทวีปแอฟริกามากกว่าโดยสัดส่วน มีการบันทึกการติดเชื้อมาลาเรีย''พลาสโมเดียม''สปีชีส์ที่มาจากลิงไม่มีหางชั้นสูงในมนุษย์ อย่างไรก็ดี สปีชีส์เหล่านี้ส่วนใหญ่มีความสำคัญทางสาธารณสุขน้อย โดยยกเว้น ''P. knowlesi'' ซึ่งเป็นสปีชีส์รับจากสัตว์ที่ก่อโรคมาลาเรียใน[[ลิงแม็กแค็ก]] |
ปรสิตมาลาเรียเป็นสิ่งมีชีวิตในสกุล ''[[Plasmodium]]'' (ไฟลัม [[Apicomplexa]]) ''P. falciparum'', ''P. malariae'', ''P. ovale'', ''P. vivax'' และ ''P. knowlesi''<ref name="Mueller 2007"/><ref name="Collins 2012"/> เป็นสาเหตุของมาลาเรียในมนุษย์ ซึ่งในสปีชีส์เหล่านี้ ''P. falciparum'' เป็นสปีชีส์ที่พบมากที่สุด (~75%) รองลงมาคือ ''P. vivax'' (~20%)<ref name="Nadjm 2012"/> แม้ว่าเดิม ''P. falciparum'' เป็นชนิดที่ทำให้มีผู้เสียชีวิตมากที่สุด<ref name="Sarkar 2009"/> แต่หลักฐานปัจจุบันเสนอว่า มาลาเรีย ''P. vivax'' สัมพันธ์กับสภาพที่อาจอันตรายถึงชีวิตได้บ่อยครั้งเท่ากับการวินิจฉัยการติดเชื้อ ''P. falciparum''<ref name="Baird 2013"/> มาลาเรีย ''P. vivax'' พบนอกทวีปแอฟริกามากกว่าโดยสัดส่วน<ref name="Arnott 2012"/> มีการบันทึกการติดเชื้อมาลาเรีย''พลาสโมเดียม''สปีชีส์ที่มาจากลิงไม่มีหางชั้นสูงในมนุษย์ อย่างไรก็ดี สปีชีส์เหล่านี้ส่วนใหญ่มีความสำคัญทางสาธารณสุขน้อย<ref name="Collins 2009"/> โดยยกเว้น ''P. knowlesi'' ซึ่งเป็นสปีชีส์รับจากสัตว์ที่ก่อโรคมาลาเรียใน[[ลิงแม็กแค็ก]]<ref name="Collins 2012"/> |
||
=== วงจรชีวิต === |
=== วงจรชีวิต === |
||
ในวงจรชีวิตของ ''Plasmodium'' [[ยุงก้นปล่อง]]เพศเมีย ([[ตัวถูกเบียนแท้]]) ส่งผ่านระยะติดต่อที่เคลื่อนที่ได้ (เรียก [[สปอโรซอยต์]]) มายังตัวถูกเบียนสัตว์มีกระดูกสันหลัง เช่น มนุษย์ ([[ตัวถูกเบียนมัธยันตร์]]) ฉะนั้นยุงก้นปล่องจึงเป็นเสมือนตัวนำโรคแพร่เชื้อ สปอโรซอยต์เดินทางผ่านเส้นเลือดไปยังเซลล์ตับ ที่ซึ่งมันจะสืบพันธุ์แบบไม่อาศัยเพศ (เรียกว่า tissue schizogony) ทำให้ได้เมอโรซอยต์นับหลายพันเซลล์ เมอโรซอยต์เหล่านี้เข้าไปติดเซลล์[[เม็ดเลือดแดง]]ใหม่และเริ่มต้นวงจรการเพิ่มจำนวนแบบไม่อาศัยเพศ (เรียกว่า blood schizogony) ซึ่งทำให้ได้เมอโรซอยต์ที่สามารถติดเชื้อได้ใหม่ 8 ถึง 24 เซลล์ ในระยะนี้ เซลล์จะระเบิดและวงจรการติดเชื้อเริ่มต้นใหม่ |
ในวงจรชีวิตของ ''Plasmodium'' [[ยุงก้นปล่อง]]เพศเมีย ([[ตัวถูกเบียนแท้]]) ส่งผ่านระยะติดต่อที่เคลื่อนที่ได้ (เรียก [[สปอโรซอยต์]]) มายังตัวถูกเบียนสัตว์มีกระดูกสันหลัง เช่น มนุษย์ ([[ตัวถูกเบียนมัธยันตร์]]) ฉะนั้นยุงก้นปล่องจึงเป็นเสมือนตัวนำโรคแพร่เชื้อ สปอโรซอยต์เดินทางผ่านเส้นเลือดไปยังเซลล์ตับ ที่ซึ่งมันจะสืบพันธุ์แบบไม่อาศัยเพศ (เรียกว่า tissue schizogony) ทำให้ได้เมอโรซอยต์นับหลายพันเซลล์ เมอโรซอยต์เหล่านี้เข้าไปติดเซลล์[[เม็ดเลือดแดง]]ใหม่และเริ่มต้นวงจรการเพิ่มจำนวนแบบไม่อาศัยเพศ (เรียกว่า blood schizogony) ซึ่งทำให้ได้เมอโรซอยต์ที่สามารถติดเชื้อได้ใหม่ 8 ถึง 24 เซลล์ ในระยะนี้ เซลล์จะระเบิดและวงจรการติดเชื้อเริ่มต้นใหม่<ref>{{harvnb|Schlagenhauf-Lawlor|2008|pp=[http://books.google.com/books?id=54Dza0UHyngC&pg=PA70 70–1]}}</ref> |
||
เมอโรซอยต์อื่นเจริญไปเป็นแกมีโตไซต์ที่ยังเจริญไม่เต็มที่ (immature gametocyte) ซึ่งเป็นเซลล์ต้นกำเนิดของเซลล์สืบพันธุ์เพศผู้และเพศเมีย เมื่อยุงกัดมนุษย์ แกมีโตไซต์จะถูกดูดจากเลือดและไปเจริญในทางเดินอาหารของยุง แกมีโตไซต์เพศผู้และเพศเมียผสมกันและก่อเป็นโอโอไคนีต (ookinete) ซึ่งเป็น[[ไซโกต]]ที่ได้รับการผสมและเคลื่อนที่ได้ จากนั้นโอโอไคนีตเจริญไปเป็นสปอโรซอยต์ใหม่ที่จะเคลื่อนที่ไปยังต่อมน้ำลายของยุง และพร้อมที่จะติดเชื้อตัวถูกเบียนสัตว์มีกระดูกสันหลังใหม่ เมื่อยุงดูดเลือดอีก สปอโรซอยต์ในน้ำลายจะถูกฉีดเข้าสู่ผิวหนัง |
เมอโรซอยต์อื่นเจริญไปเป็นแกมีโตไซต์ที่ยังเจริญไม่เต็มที่ (immature gametocyte) ซึ่งเป็นเซลล์ต้นกำเนิดของเซลล์สืบพันธุ์เพศผู้และเพศเมีย เมื่อยุงกัดมนุษย์ แกมีโตไซต์จะถูกดูดจากเลือดและไปเจริญในทางเดินอาหารของยุง แกมีโตไซต์เพศผู้และเพศเมียผสมกันและก่อเป็นโอโอไคนีต (ookinete) ซึ่งเป็น[[ไซโกต]]ที่ได้รับการผสมและเคลื่อนที่ได้ จากนั้นโอโอไคนีตเจริญไปเป็นสปอโรซอยต์ใหม่ที่จะเคลื่อนที่ไปยังต่อมน้ำลายของยุง และพร้อมที่จะติดเชื้อตัวถูกเบียนสัตว์มีกระดูกสันหลังใหม่ เมื่อยุงดูดเลือดอีก สปอโรซอยต์ในน้ำลายจะถูกฉีดเข้าสู่ผิวหนัง<ref name="Cowman 2012"/> |
||
เฉพาะยุงเพศเมียเท่านั้นที่ดูดเลือด ส่วนยุงเพศผู้กอนน้ำต้อยของพืชเป็นอาหาร ฉะนั้นจึงไม่ส่งต่อโรค ยุงก้นปล่องเพศเมียมักดูดเลือดในยามกลางคืน โดยปกติเริ่มค้นหาอาหารในช่วงเย็น และจะค้นหาต่อไปทั้งคืนจนกว่าจะได้ดูดเลือด ปรสิตมาลาเรียยังสามารถส่งผ่านได้โดยการถ่ายเลือด แม้จะพบน้อยก็ตาม |
เฉพาะยุงเพศเมียเท่านั้นที่ดูดเลือด ส่วนยุงเพศผู้กอนน้ำต้อยของพืชเป็นอาหาร ฉะนั้นจึงไม่ส่งต่อโรค ยุงก้นปล่องเพศเมียมักดูดเลือดในยามกลางคืน โดยปกติเริ่มค้นหาอาหารในช่วงเย็น และจะค้นหาต่อไปทั้งคืนจนกว่าจะได้ดูดเลือด<ref name="Arrow 2004"/> ปรสิตมาลาเรียยังสามารถส่งผ่านได้โดย[[การถ่ายเลือด]] แม้จะพบน้อยก็ตาม<ref name="Owusu-Ofori 2010"/> |
||
=== มาลาเรียกลับเป็นซ้ำ === |
=== มาลาเรียกลับเป็นซ้ำ === |
||
อาการแสดงของมาลาเรียสามารถกลับเป็นซ้ำได้หลังจากช่วงที่ไม่มีอาการแสดงต่าง ๆ กัน การกลับเป็นซ้ำนี้สามารถจำแนกตามสาเหตุได้เป็นการกลับกำเริบ การเป็นโรคกลับหรือการติดเชื้อซ้ำ การกลับกำเริบคือ การที่กลับแสดงอาการอีกครั้งหลังช่วงที่ไม่แสดงอาการ ซึ่งเกิดจากปรสิตที่ยังหลงเหลืออยู่ในเลือดซึ่งเป็นผลจากการรักษาที่ไม่เพียงพอหรือไม่มีประสิทธิภาพ การเป็นโรคกลับคือการที่กลับแสดงอาการหลังปรสิตถูกกำจัดหมดไปจากเลือดแล้วแต่ยังคงอยู่เป็นฮิพโนซอยต์แฝงในเซลล์ตับ การเป็นโรคกลับมักเกิดระหว่าง 8–24 สัปดาห์และมักพบในการติดเชื้อ ''P. vivax'' และ ''P. ovale'' ผู้ป่วยมาลาเรียชนิด P. vivax ในเขตอบอุ่นมักสัมพันธ์กับการที่ฮิพโนซอยต์มีชีวิตอยู่ในฤดูหนาว โดยการเป็นโรคกลับเริ่มต้นในปีถัดจากปีที่ถูกยุงกัด การติดเชื้อซ้ำหมายถึงปรสิตที่ก่อการติดเชื้อครั้งก่อนได้ถูกกำจัดหมดไปจากร่างกายแล้ว แต่มีการได้รับปรสิตใหม่เข้ามา การติดเชื้อซ้ำไม่สามารถแยกจากการกลับกำเริบได้ทันที แม้ว่าการกลับติดเชื้อซ้ำภายในสองสัปดาห์ของการรักษาการติดเชื้อครั้งแรกมักมีสาเหตุจากความล้มเหลวในการรักษา บุคคลอาจแสดงภูมิคุ้มกันระยะสั้น (premunity) ในกรณีการติดเชื้อซ้ำได้ |
อาการแสดงของมาลาเรียสามารถกลับเป็นซ้ำได้หลังจากช่วงที่ไม่มีอาการแสดงต่าง ๆ กัน การกลับเป็นซ้ำนี้สามารถจำแนกตามสาเหตุได้เป็นการกลับกำเริบ การเป็นโรคกลับหรือการติดเชื้อซ้ำ การกลับกำเริบคือ การที่กลับแสดงอาการอีกครั้งหลังช่วงที่ไม่แสดงอาการ ซึ่งเกิดจากปรสิตที่ยังหลงเหลืออยู่ในเลือดซึ่งเป็นผลจากการรักษาที่ไม่เพียงพอหรือไม่มีประสิทธิภาพ<ref>{{harvnb|WHO|2010|p=vi}}</ref> การเป็นโรคกลับคือการที่กลับแสดงอาการหลังปรสิตถูกกำจัดหมดไปจากเลือดแล้วแต่ยังคงอยู่เป็นฮิพโนซอยต์แฝงในเซลล์ตับ การเป็นโรคกลับมักเกิดระหว่าง 8–24 สัปดาห์และมักพบในการติดเชื้อ ''P. vivax'' และ ''P. ovale''<ref name="Nadjm 2012"/> ผู้ป่วยมาลาเรียชนิด ''P. vivax'' ในเขตอบอุ่นมักสัมพันธ์กับการที่ฮิพโนซอยต์มีชีวิตอยู่ในฤดูหนาว โดยการเป็นโรคกลับเริ่มต้นในปีถัดจากปีที่ถูกยุงกัด<ref name="White 2011"/> การติดเชื้อซ้ำหมายถึงปรสิตที่ก่อการติดเชื้อครั้งก่อนได้ถูกกำจัดหมดไปจากร่างกายแล้ว แต่มีการได้รับปรสิตใหม่เข้ามา การติดเชื้อซ้ำไม่สามารถแยกจากการกลับกำเริบได้ทันที แม้ว่าการกลับติดเชื้อซ้ำภายในสองสัปดาห์ของการรักษาการติดเชื้อครั้งแรกมักมีสาเหตุจากความล้มเหลวในการรักษา<ref>{{harvnb|WHO|2010|p=17}}</ref> บุคคลอาจแสดงภูมิคุ้มกันระยะสั้น (premunity) ในกรณีการติดเชื้อซ้ำได้<ref>{{Cite journal |
||
| last1 = Maegraith | first1 = BG | chapter = Malaria | title = Tropical Pathology | series = Spezielle pathologische Anatomie | volume = 8 | pages = 319–349 | year = 1973 | isbn = 978-3-662-00228-5 | doi = 10.1007/978-3-662-00226-1_11 }}</ref> |
|||
== พยาธิกำเนิด == |
== พยาธิกำเนิด == |
||
รุ่นแก้ไขเมื่อ 20:19, 24 มีนาคม 2557
| มาลาเรีย Malaria | |
|---|---|
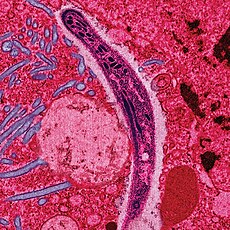 Plasmodium ในรูปที่เข้าสู่มนุษย์และสัตว์มีกระดูกสันหลังอื่นจากน้ำลายของยุงเพศเมีย (สปอโรซอยท์) ตัดขวางกับไซโทพลาสซึมของเซลล์เยื่อบุทางเดินอาหารส่วนกลางของยุง | |
| บัญชีจำแนกและลิงก์ไปภายนอก | |
| ICD-10 | B50-B54 |
| ICD-9 | 084 |
| OMIM | 248310 |
| DiseasesDB | 7728 |
| MedlinePlus | 000621 |
| eMedicine | med/1385 emerg/305 ped/1357 |
| MeSH | C03.752.250.552 |
มาลาเรีย (อังกฤษ: Malaria) หรือไข้จับสั่น ไข้ป่า ไข้ป้าง ไข้ร้อนเย็นหรือไข้ดอกสัก เป็นโรคติดเชื้อของมนุษย์และสัตว์อื่นที่มียุงเป็นพาหะ สาเหตุคือ ปรสิตโปรโตซัว (จุลินทรีย์เซลล์เดียวประเภทหนึ่ง) ในสกุล Plasmodium (พลาสโมเดียม) โดยทั่วไป โรคมาลาเรียส่งผ่านโดยการกัดจากยุงเพศเมียในสกุล Anopheles (ยุงก้นปล่อง) ที่มีเชื้ออยู่ โดยยุงจะนำเชื้อ Plasmodium จากน้ำลายเข้าสู่ระบบไหลเวียนโลหิตของผู้ถูกกัด จากนั้นเชื้อในเลือดจะเดินทางไปยังตับเพื่อเจริญและสืบพันธุ์ โรคมาลาเรียก่อให้เกิดอาการทั่วไป ซึ่งรวมไข้และปวดศีรษะ ซึ่งในกรณีที่รุนแรงสามารถดำเนินไปเป็นโคม่าหรือเสียชีวิตได้ โรคนี้ระบาดในบริเวณเขตร้อนและกึ่งเขตร้อนเป็นแถบกว้างรอบเส้นศูนย์สูตร ซึ่งรวมพื้นที่แอฟริกาใต้สะฮารา ทวีปเอเชียและทวีปอเมริกาเป็นบริเวณกว้าง
Plasmodium ห้าสปีชีส์สามารถติดต่อและส่งผ่านโดยมนุษย์ได้ ผู้เสียชีวิตส่วนมากเกิดจากเชื้อ P. falciparum และ P. vivax ขณะที่ P. ovale และ P. malariae ก่อให้เกิดโรคมาลาเรียแบบที่โดยทั่วไปรุนแรงน้อยกว่า ซึ่งไม่ค่อยมีผู้เสียชีวิต สปีชีส์รับจากสัตว์ P. knowlesi พบมากในเอเชียตะวันออกเฉียงใต้ ก่อให้เกิดโรคมาลาเรียในลิงแม็กแคก แต่ก็สามารถก่อให้เกิดการติดเชื้อรุนแรงในมนุษย์ได้เช่นกัน โรคมาลาเรียพบมากในพื้นที่เขตร้อนและกึ่งเขตร้อนเพราะปริมาณฝน อุณหภูมิอบอุ่นและน้ำนิ่งซึ่งเป็นแหล่งที่อยู่ที่ดีสำหรับตัวอ่อนของยุง การส่งผ่านโรคสามารถลดได้ด้วยการป้องกันมิให้ยุงกัด โดยการใช้มุ้งหรือสารขับไล่แมลง หรือด้วยมาตรการควบคุมยุง เช่น การฉีดพ่นยาฆ่าแมลงหรือการระบายน้ำนิ่ง
การตรวจเลือดด้วยกล้องจุลทรรศน์โดยใช้ฟิล์มเลือดหรือการวินิจฉัยชนิดรวดเร็ว (rapid diagnostic test) ที่อาศัยแอนติเจน เป็นวิธีการวินิจฉัยโรคมาลาเรียตามปกติ มีการพัฒนาเทคนิคสมัยใหม่ซึ่งใช้ปฏิกิริยาลูกโซ่พอลิเมอเรสเพื่อตรวจจับดีเอ็นเอของ Plasmodium แต่ยังไม่มีใช้แพร่หลายในพื้นที่ซึ่งโรคมาลาเรียเป็นโรคประจำถิ่นเนื่องจากราคาแพงและยุ่งยากซับซ้อน องค์การอนามัยโลกประเมินว่าในปี 2553 มีผู้ป่วยโรคมาลาเรียที่มีการบันทึก 219 ล้านคน ในปีนั้น มีผู้เสียชีวิตด้วยโรคมาลาเรียระหว่าง 660,000 คน ถึง 1.2 ล้านคน[1] จำนวนมากเป็นเด็กในทวีปแอฟริกา จำนวนผู้เสียชีวิตแท้จริงนั้นไม่อาจทราบได้แน่ชัด เพราะไม่มีข้อมูลที่แน่ชัดในพื้นที่ชนบทหลายแห่ง และไม่มีการบันทึกข้อมูลผู้ป่วยหลายคน โรมาลาเรียมักสัมพันธ์กับความยากจนและอาจยังเป็นอุปสรรคต่อการพัฒนาเศรษฐกิจ
โรคมาลาเรียไม่มีวัคซีนที่มีประสิทธิภาพ แม้กำลังมีความพยายามพัฒนาวัคซีนอยู่ในปัจจุบัน มียาหลายชนิดที่ใช้ป้องกันมาลาเรียในนักท่องเที่ยวที่เดินทางไปยังประเทศซึ่งโรคมาลาเรียเป็นโรคประจำถิ่น นอกจากนี้มียาต้านมาลาเรียหลายชนิด โรคมาลาเรียรุนแรงรักษาด้วยการฉีดควินินเข้าหลอดเลือดดำหรือกล้ามเนื้อ หรือ ตั้งแต่กลางคริสต์ทศวรรษ 2000 อาร์ทีซูเนต อนุพันธ์ของอาร์ตีมิซินิน ซึ่งให้ผลดีกว่าควินินทั้งในเด็กและผู้ใหญ่ และให้ร่วมกับยาต้านมาลาเรียตัวที่สอง เช่น เมโฟลควิน เชื้อมีการดื้อยาต่อยาต้านมาลาเรียหลายชนิด เช่น P. falciparum ซึ่งดื้อต่อคลอโรควินได้แพร่ไปยังพื้นที่ซึ่งมีการระบาดมากที่สุด และการเริ่มดื้อยาอาร์ทีมิซินินได้กลายมาเป็นปัญหาในบางพื้นที่ของเอเชียตะวันออกเฉียงใต้
อาการและอาการแสดง

ปกติอาการและอาการแสดงของมาลาเรียจะเริ่มต้น 8–25 วันหลังการติดเชื้อ[2] อย่างไรก็ดี อาการอาจเกิดขึ้นหลังจากนี้ในผู้ที่ทานยาต้านมาลาเรียป้องกันไว้ก่อน[3] การแสดงเริ่มต้นของโรคเป็นอาการคล้ายหวัด[4] ซึ่งเหมือนกันในมาลาเรียทุกสปีชีส์ และสามารถเหมือนกับสภาพอื่น เช่น ภาวะเลือดเป็นพิษ กระเพาะอาหารและลำไส้เล็กอักเสบ และโรคไวรัส[3] การแสดงอาการอาจรวมปวดศีรษะ เป็นไข้ สั่น ปวดในข้อ อาเจียน โลหิตจางเพราะเม็ดเลือดแดงแตก ดีซ่าน มีฮีโมโกลบินในปัสสาวะ จอตาเสียหายและการชัก[5]
อาการตรงต้นแบบของมาลาเรีย คือ อาการกำเริบ ซึ่งเป็นการเกิดการหนาวฉับพลัน ตามด้วยการสั่น และไข้และเหงื่อออกเป็นวัฏจักร แต่ละสปีชีส์มีความถี่ต่างกัน ในการติดเชื้อ P. vivax และ P. ovale อาการกำเริบทุกสองวัน P. malariae อาการกำเริบทุกสามวัน การติดเชื้อ P. falciparum สามารถเกิดไข้กลับทุก 36–48 ชั่วโมงหรือไข้แทบไม่สร่าง[6]
มาลาเรียรุนแรงปกติเกิดจาก P. falciparum อาการแสดงของมาลาเรียประเภทนี้เริ่มขึ้น 9–30 วันหลังการติดเชื้อ[4] บุคคลที่มีมาลาเรียขึ้นสมอง (cerebral malaria) มักแสดงอาการทางระบบประสาทบ่อยครั้ง ซึ่งรวมถึงท่าร่างผิดปกติ อาการตากระตุกแกว่ง อัมพาตเมื่อดูด้วยสองตา (ตาไม่สามารถกลอกไปในทิศทางเดียวกัน) อาการเกร็งหลังแอ่น ชักหรือโคม่า[4]
ภาวะแทรกซ้อน
โรคมาลาเรียมีภาวะแทรกซ้อนรุนแรงหลายอย่าง ภาวะแทรกซ้อนหนึ่งคือการพัฒนาการหายใจอึดอัก ซึ่งเกิดขึ้นมากถึง 25% ในผู้ใหญ่ และ 40% ในเด็กที่ป่วยด้วยมาลาเรียชนิด P. falciparum รุนแรง สาเหตุอาจเนื่องจากการชดเชยภาวะเลือดเป็นกรดเมตะบอลิกด้วยการหายใจ ปอดบวมน้ำที่ไม่ได้มีสาเหตุจากโรคหัวใจ ปอดบวมเกิดร่วม และโลหิตจางรุนแรง กลุ่มอาการหายใจลำบากเฉียบพลันพบได้ 5–25% ของผู้ใหญ่ และมากถึง 29% ของสตรีมีครรภ์ ทว่าพบน้อยในเด็กเล็กที่ป่วยเป็นโรคมาลาเรียรุนแรง[7] การติดเชื้อเอชไอวีร่วมกับมาลาเรียเพิ่มอัตราตาย[8] ภาวะไตล้มเหลวเป็นลักษณะของไข้น้ำดำ ซึ่งฮีโมโกลบินจากเม็ดเลือดแดงที่แตกรั่วออกสู่ปัสสาวะ[4]
การติดเชื้อ P. falciparum อาจส่งผลให้เกิดมาลาเรียขึ้นสมอง ซึ่งเป็นรูปแบบของมาลาเรียรุนแรงที่มีโรคสมองร่วมด้วย ภาวะดังกล่าวสัมพันธ์กับจอตาขาว (retinal whitening) ซึ่งอาจเป็นอาการแสดงทางคลินิกที่มีประโยชน์ในการแยกมาลาเรียจากสาเหตุอื่นของไข้[9] นอกจากนี้ยังอาจเกิดม้ามโต ปวดศีรษะรุนแรง ตับโต น้ำตาลในเลือดต่ำ และมีฮีโมโกลบินในปัสสาวะร่วมกับไตล้มเหลวได้[4]
มาลาเรียในสตรีมีครรภ์เป็นสาเหตุสำคัญของการตายคลอด ทารกตายและมีน้ำหนักแรกคลอดต่ำ[10] โดยเฉพาะอย่างยิ่งในการติดเชื้อ P. falciparum แต่การติดเชื้อ P. vivax ก็พบได้[11]
สาเหตุ
ปรสิตมาลาเรียเป็นสิ่งมีชีวิตในสกุล Plasmodium (ไฟลัม Apicomplexa) P. falciparum, P. malariae, P. ovale, P. vivax และ P. knowlesi[12][13] เป็นสาเหตุของมาลาเรียในมนุษย์ ซึ่งในสปีชีส์เหล่านี้ P. falciparum เป็นสปีชีส์ที่พบมากที่สุด (~75%) รองลงมาคือ P. vivax (~20%)[3] แม้ว่าเดิม P. falciparum เป็นชนิดที่ทำให้มีผู้เสียชีวิตมากที่สุด[14] แต่หลักฐานปัจจุบันเสนอว่า มาลาเรีย P. vivax สัมพันธ์กับสภาพที่อาจอันตรายถึงชีวิตได้บ่อยครั้งเท่ากับการวินิจฉัยการติดเชื้อ P. falciparum[15] มาลาเรีย P. vivax พบนอกทวีปแอฟริกามากกว่าโดยสัดส่วน[16] มีการบันทึกการติดเชื้อมาลาเรียพลาสโมเดียมสปีชีส์ที่มาจากลิงไม่มีหางชั้นสูงในมนุษย์ อย่างไรก็ดี สปีชีส์เหล่านี้ส่วนใหญ่มีความสำคัญทางสาธารณสุขน้อย[17] โดยยกเว้น P. knowlesi ซึ่งเป็นสปีชีส์รับจากสัตว์ที่ก่อโรคมาลาเรียในลิงแม็กแค็ก[13]
วงจรชีวิต
ในวงจรชีวิตของ Plasmodium ยุงก้นปล่องเพศเมีย (ตัวถูกเบียนแท้) ส่งผ่านระยะติดต่อที่เคลื่อนที่ได้ (เรียก สปอโรซอยต์) มายังตัวถูกเบียนสัตว์มีกระดูกสันหลัง เช่น มนุษย์ (ตัวถูกเบียนมัธยันตร์) ฉะนั้นยุงก้นปล่องจึงเป็นเสมือนตัวนำโรคแพร่เชื้อ สปอโรซอยต์เดินทางผ่านเส้นเลือดไปยังเซลล์ตับ ที่ซึ่งมันจะสืบพันธุ์แบบไม่อาศัยเพศ (เรียกว่า tissue schizogony) ทำให้ได้เมอโรซอยต์นับหลายพันเซลล์ เมอโรซอยต์เหล่านี้เข้าไปติดเซลล์เม็ดเลือดแดงใหม่และเริ่มต้นวงจรการเพิ่มจำนวนแบบไม่อาศัยเพศ (เรียกว่า blood schizogony) ซึ่งทำให้ได้เมอโรซอยต์ที่สามารถติดเชื้อได้ใหม่ 8 ถึง 24 เซลล์ ในระยะนี้ เซลล์จะระเบิดและวงจรการติดเชื้อเริ่มต้นใหม่[18]
เมอโรซอยต์อื่นเจริญไปเป็นแกมีโตไซต์ที่ยังเจริญไม่เต็มที่ (immature gametocyte) ซึ่งเป็นเซลล์ต้นกำเนิดของเซลล์สืบพันธุ์เพศผู้และเพศเมีย เมื่อยุงกัดมนุษย์ แกมีโตไซต์จะถูกดูดจากเลือดและไปเจริญในทางเดินอาหารของยุง แกมีโตไซต์เพศผู้และเพศเมียผสมกันและก่อเป็นโอโอไคนีต (ookinete) ซึ่งเป็นไซโกตที่ได้รับการผสมและเคลื่อนที่ได้ จากนั้นโอโอไคนีตเจริญไปเป็นสปอโรซอยต์ใหม่ที่จะเคลื่อนที่ไปยังต่อมน้ำลายของยุง และพร้อมที่จะติดเชื้อตัวถูกเบียนสัตว์มีกระดูกสันหลังใหม่ เมื่อยุงดูดเลือดอีก สปอโรซอยต์ในน้ำลายจะถูกฉีดเข้าสู่ผิวหนัง[19]
เฉพาะยุงเพศเมียเท่านั้นที่ดูดเลือด ส่วนยุงเพศผู้กอนน้ำต้อยของพืชเป็นอาหาร ฉะนั้นจึงไม่ส่งต่อโรค ยุงก้นปล่องเพศเมียมักดูดเลือดในยามกลางคืน โดยปกติเริ่มค้นหาอาหารในช่วงเย็น และจะค้นหาต่อไปทั้งคืนจนกว่าจะได้ดูดเลือด[20] ปรสิตมาลาเรียยังสามารถส่งผ่านได้โดยการถ่ายเลือด แม้จะพบน้อยก็ตาม[21]
มาลาเรียกลับเป็นซ้ำ
อาการแสดงของมาลาเรียสามารถกลับเป็นซ้ำได้หลังจากช่วงที่ไม่มีอาการแสดงต่าง ๆ กัน การกลับเป็นซ้ำนี้สามารถจำแนกตามสาเหตุได้เป็นการกลับกำเริบ การเป็นโรคกลับหรือการติดเชื้อซ้ำ การกลับกำเริบคือ การที่กลับแสดงอาการอีกครั้งหลังช่วงที่ไม่แสดงอาการ ซึ่งเกิดจากปรสิตที่ยังหลงเหลืออยู่ในเลือดซึ่งเป็นผลจากการรักษาที่ไม่เพียงพอหรือไม่มีประสิทธิภาพ[22] การเป็นโรคกลับคือการที่กลับแสดงอาการหลังปรสิตถูกกำจัดหมดไปจากเลือดแล้วแต่ยังคงอยู่เป็นฮิพโนซอยต์แฝงในเซลล์ตับ การเป็นโรคกลับมักเกิดระหว่าง 8–24 สัปดาห์และมักพบในการติดเชื้อ P. vivax และ P. ovale[3] ผู้ป่วยมาลาเรียชนิด P. vivax ในเขตอบอุ่นมักสัมพันธ์กับการที่ฮิพโนซอยต์มีชีวิตอยู่ในฤดูหนาว โดยการเป็นโรคกลับเริ่มต้นในปีถัดจากปีที่ถูกยุงกัด[23] การติดเชื้อซ้ำหมายถึงปรสิตที่ก่อการติดเชื้อครั้งก่อนได้ถูกกำจัดหมดไปจากร่างกายแล้ว แต่มีการได้รับปรสิตใหม่เข้ามา การติดเชื้อซ้ำไม่สามารถแยกจากการกลับกำเริบได้ทันที แม้ว่าการกลับติดเชื้อซ้ำภายในสองสัปดาห์ของการรักษาการติดเชื้อครั้งแรกมักมีสาเหตุจากความล้มเหลวในการรักษา[24] บุคคลอาจแสดงภูมิคุ้มกันระยะสั้น (premunity) ในกรณีการติดเชื้อซ้ำได้[25]
พยาธิกำเนิด
โรคมาลาเรียในมนุษย์มีสองระยะ ระยะหนึ่งอยู่ภายนอกเม็ดเลือดแดง (exoerythrocytic phase) คืออยู่ในเซลล์ตับ อีกระยะหนึ่งอยู่ภายในเม็ดเลือดแดง (erythrocytic phase) เมื่อยุงที่ติดเชื้อมาลาเรียไปดูดเลือดจากมนุษย์ สปอโรซอยต์ (sporozoite) ในน้ำลายของยุงตัวนั้นจะเข้าไปสู่กระแสเลือดของมนุษย์ เมื่อสปอโรซอยต์เข้าสู่กระแสเลือดแล้วเชื้อจะไปเดินทางไปถึงตับ และจะเข้าสู่เซลล์ตับภายใน 30 นาทีหลังจากยุงกัด หลังจากนั้นเชื้อจะสืบพันธุ์แบบไม่อาศัยเพศอยู่ประมาณ 6-15 วัน โดยไม่ก่อให้เกิดอาการผิดปกติใดๆต่อผู้ได้รับเชื้อ เชื้อในตับจะเพิ่มจำนวนขึ้นได้นับพันหรือหมื่นตัวต่อหนึ่งเซลล์ตับ แต่ละตัวเรียกว่า เมอโรซอยต์ (merozoite) กระบวนการนี้เรียกว่า merogony หรือ schizogony เมื่อเจริญมากถึงระดับหนึ่ง เซลล์ตับจะแตกออก และเมอโรซอยต์จำนวนมากจะเข้าสู่กระแสเลือด และเข้าสู่เม็ดเลือดแดง เป็นการเริ่ม erythrocytic phase เชื้อนี้ออกจากตับโดยเอาเยื่อหุ้มเซลล์ของเซลล์ตับคลุมตัวเองไว้ ภูมิคุ้มกันไม่สามารถตรวจจับได้
เมื่อเข้าสู่ระยะในเม็ดเลือดแดงแล้ว เชื้อจะเพิ่มจำนวนแบบไม่อาศัยเพศอีกครั้ง เมื่อได้จำนวนมากถึงระดับหนึ่งก็จะทำให้เม็ดเลือดแดงแตกออก และเชื้อจำนวนมากก็จะถูกแพร่เข้าสู่กระแสเลือดไปสู่เม็ดเลือดแดงใหม่ต่อไป ในแต่ละครั้งที่เม็ดเลือดแดงแตกออกและมีเชื้อจำนวนมากเข้าสู่กระแสเลือด ผู้ป่วยจะมีไข้เป็นระยะๆ ซึ่งช่วงของการเกิดไข้จะเป็นไปแล้วแต่ชนิดของเชื้อ การมีไข้จับเป็นระยะๆ นี้เอง ที่เรียกว่า "จับไข้"
เชื้อพลาสโมเดียมบางชนิด เช่น P. vivax และ P. ovale เมื่อเข้าสู่เซลล์ตับแล้วอาจจะไม่พัฒนาเป็นเมอโรซอยต์ในทันที แต่จะเข้าสู่ระยะพักที่เรียกว่า hypnozoite แทน เชื้ออาจอยู่ในระยะนี้ได้นานถึง 6-12 เดือน ไปจนถึง 3 ปี หลังจากนี้แล้ว เชื้อจึงจะเจริญต่อไป ทำให้ได้เมอโรซอยต์จำนวนมากไปสู่กระแสเลือดตามปกติ การมีระยะ hypnozoite นี้เอง ที่ทำให้โรคมาลาเรียที่เกิดจากเชื้อดังกล่าวมีระยะฟักตัวนาน และอาจมีการเป็นโรคซ้ำได้อีกหลังจากเป็นแล้ว[26]
ปรสิตนี้แทบไม่ถูกกำจัดโดยระบบภูมิคุ้มกันของร่างกาย เพราะวงจรชีวิตของเชื้อนี้ส่วนใหญ่จะอยู่ในเซลล์ คือเซลล์ตับและเซลล์เม็ดเลือดแดง ทำให้ไม่ถูกตรวจจับโดยภูมิคุ้มกันของร่างกาย อย่างไรก็ดี เซลล์เม็ดเลือดที่ติดเชื้อจะถูกกรองและทำลายทิ้งที่ม้าม ซึ่งเป็นการทำลายเชื้อได้ทางหนึ่ง อย่างไรก็ดี เชื้อ P. falciparum มีวิธีหลบหลีกจากกระบวนการการของร่างกายดังกล่าวโดยปรสิตจะมีการสร้างโปรตีนยึดเกาะบนผิวเซลล์เม็ดเลือดแดง ทำให้เม็ดเลือดแดงที่ติดเชื้อไปติดอยู่กับหลอดเลือดขนาดเล็ก ซึ่งทำให้เม็ดเลือดติดเชื้อนั้นไม่ถูกกำจัดที่ม้าม และเชื้อปรสิตสามารถเจริญเติบโตต่อไปได้[27] การที่เม็ดเลือดแดงไปติดอยู่กับหลอดเลือดนี้เองเป็นสาเหตุทำให้เกิดอาการแทรกซ้อนเป็นเลือดออกของมาลาเรีย และยังอาจทำให้เส้นเลือดอุดตันได้ ซึ่งเป็นสาเหตุของโรคมาลาเรียขึ้นสมอง (cerebral malaria)
แม้ว่าโปรตีนยึดเกาะนี้ (PfEMP1 ย่อมาจาก Plasmodium falciparum erythrocyte membrane protein 1) จะถูกนำไปแทรกไว้ที่ผิวเม็ดเลือดแดงก็ตาม โปรตีนนี้ไม่สามารถกระตุ้นระบบภูมิคุ้มกันให้ทำงานได้ดีนัก เนื่องจากโปรตีนนี้มีความหลากหลายมาก ลักษณะนี้อาจเปรียบเทียบได้กับคนร้ายปลอมตัวที่เมื่อถูกจับได้ครั้งหนึ่งก็เปลี่ยนหน้ากากเป็นอีกแบบหนึ่ง จึงทำให้ไม่ถูกตรวจจับได้โดยง่าย
เมอโรซอยต์บางตัวจะกลายเป็นเซลล์สืบพันธุ์เพศผู้และเพศเมีย (gametocyte) หากยุงมากัดคนที่ติดเชื้อและดูดเอาเลือดที่มีเม็ดเลือดที่ติดเชื้อมาลาเรียในระยะ gametocyte นี้ไป เซลล์เพศผู้และเพศเมียจะผสมพันธุ์กันในทางเดินอาหารของยุง (เนื่องจากการที่มีการสืบพันธุ์แบบอาศัยเพศในยุงนี้เอง จึงทำให้ถือว่ายุงเป็น definitive host ของเชื้อมาลาเรีย) เมื่อผสมพันธุ์กันแล้วจะทำให้ได้สปอโรซอยต์ใหม่เดินทางไปอยู่ในต่อมน้ำลายของยุง และเมื่อยุงไปกัดคนอื่นต่อไป ก็จะนำเชื้อมาลาเรียระยะสปอโรซอยต์ไปติดคนใหม่
การวินิจฉัย
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
การป้องกัน
เมื่อจะต้องเข้าไปในพื้นที่ที่มีแหล่งระบาดของมาลาเรีย ควรป้องกันตนเองไม่ให้ยุงกัด ดังนี้
- สวมเสื้อผ้าปกปิดร่างกายให้มิดชิด ควรใช้เสื้อผ้าสีอ่อนๆ
- ทายากันยุง
- นอนในมุ้ง (ถ้าใช้มุ้งชุบน้ำยา จะเพิ่มประสิทธิภาพในการป้องกัน)
- ถ้านอนในห้องที่มีมุ้งลวด ควรพ่นยากันยุงก่อน
การรักษา
มาลาเรียเป็นโรคที่รักษาให้หายขาดได้ ถ้าได้รับการวินิจฉัยที่ถูกต้อง รวดเร็ว และได้รับการรักษาด้วยยาที่มีประสิทธิภาพ ตรงตามชนิดของเชื้อที่เป็นสาเหตุ ยารักษามาลาเรียชนิดแรกทำจากเปลือกของต้นซิงโคนา และเรียกชื่อว่า ควินิน ตัวยายับยั้งการแบ่งตัวของปรสิต ส่วนยาแผนปัจจุบันที่ใช้รักษาที่มีใช้อยู่มีดังนี้คือ
ประเทศแซมเบียใช้ยารักษามาลาเรียที่ทำจากสมุนไพรชื่ออาดเทค ยาอาร์ทีมิซินินมีประสิทธิภาพเทียบเท่าควินิน แต่มีผลข้างเคียงน้อยกว่า[28]
ยาอาร์ทีมิซินินมีประสิทธิภาพเทียบเท่าควินิน แต่มีผลข้างเคียงน้อยกว่า นับเป็นยารักษามาลาเรียชนิดสุดท้ายที่มีอยู่ เพราะปรสิตได้พัฒนาจนดื้อยาทุกตัวที่ใช้รักษา รวมทั้งควินินด้วย จึงมีการนำอนุพันธ์ของยาอาร์ทีมิซินินไปให้ร่วมกับยาอื่น เพื่อลดโอกาสในการดื้อยาอาร์ทีมิซินินของปรสิต กลายเป็นยาชุดต้านมาลาเรียเอซีที (ACT: artemisinin-based combination therapy)
ระบาดวิทยา
การติดต่อสู่คนโดยการถูกยุงก้นปล่องตัวเมียที่มีเชื้อมาลาเรียกัด ยุงก้นปล่อง ที่เป็นพาหะของมาลาเรียที่สำคัญ ในเมืองไทย มีสองชนิด คือ
- Anopheles Dirus พบในป่าทึบชอบออกไข่ตามแอ่งน้ำนิ่งขังตามธรรมชาติ ลักษณะนิสัยชอบกินเลือดคนมาก ไม่ชอบกินเลือดสัตว์อื่นออกหากินตอนกลางคืนถึงเช้ามืด แต่ถ้าป่าทึบมาก ๆ ก็หากินช่วงกลางวันด้วย ยุงชนิดนี้ เป็นชนิดที่มีความสามารถในการแพร่เชื้อมาลาเรียมากกว่ายุงพาหะชนิดอื่นในประเทศไทย
- Anopheles Minimus พบตามชายป่า ชอบวางไข่ในลำธาร น้ำใส ไหลเอื่อย ๆ
พ.ศ. 2550 นี้ มีการประเมินว่าจะมีผู้ติดเชื้อมาลาเรียกว่า 500 ล้านคน โดยจะมีผู้เสียชีวิตด้วยโรคนี้อย่างน้อยหนึ่งล้านคน[28]
แหล่งระบาดของมาลาเรียในประเทศไทยอยู่ตามจังหวัดชายแดน โดยเฉพาะบริเวณที่เป็นภูเขาสูง ป่าทึบ และมีแหล่งน้ำ ลำธาร อันเป็นแหล่งแพร่พันธุ์ของยุงก้นปล่อง จังหวัดที่พบผู้ป่วยมาลาเรียส่วนใหญ่ ได้แก่ แม่ฮ่องสอน ตาก ตราด ระนอง กาญจนบุรี จันทบุรี สระแก้ว ประจวบคีรีขันธ์ ราชบุรี และชุมพร
ประวัติ
ตามหลักฐานการบันทึกได้มีการรายงานว่า การติดเชื้อโรคมาลาเรียในประชากรมนุษย์นั้น มีมานานกว่า 50,000 ปีแล้ว และเชื้อดังกล่าวอาจเป็นเชื้อก่อโรคในมนุษย์ที่มีการกำเนิดมาพร้อมกับการมีมนุษย์บนโลกก็เป็นได้[29] พบว่าเชื้อที่มีความใกล้เคียงกับมาลาเรียสามารถเป็นปรสิตในลิงชิมแปนซีซึ่งมีความใกล้เคียงกับมนุษย์มาก[30] ในช่วงประวัติศาสตร์ของมนุษยชาติ การติดเชื้อมาลาเรียได้มีการถูกบันทึกไว้อย่างต่อเนื่อง นับตั้งแต่ในประเทศจีนเมื่อ 2700 ปีก่อนคริสตกาล[31] คำว่ามาลาเรียมีที่มาจากภาษาอิตาลีโบราณคำว่า mala aria ซึ่งแปลว่า อากาศที่ไม่ดี
การศึกษาทางด้านวิทยาศาสตร์ได้ก่อเกิดความก้าวหน้าที่มีสำคัญต่อองค์ความรู้เรื่องโรคมาลาเรียในปี พ.ศ. 2423 เมื่อแพทย์ทหารชาวฝรั่งเศสที่ทำงานในประเทศอัลจีเรียชื่อ Charles Louis Alphonse Laveran ได้สังเกตเห็นปรสิตในเม็ดเลือดแดงของคนที่ป่วยด้วยโรคมาลาเรีย จึงเสนอแนวคิดว่าสาเหตุก่อโรคมาลาเรียคือเชื้อโปรโตซัว ซึ่งการตั้งสมมุติฐานนี้เป็นครั้งแรกที่มีการระบุว่าเชื้อโปรโตซัวเป็นสาเหตุของโรค[32] จากการค้นพบครั้งนี้และงานอื่นๆ ทำให้เขาได้รับรางวัลโนเบลสาขาสรีรวิทยาและการแพทย์ในปี พ.ศ. 2450 เชื้อโปรโตซัวนี้ได้รับการตั้งชื่อว่า Plasmodium (พลาสโมเดียม) โดยนักวิทยาศาสตร์ชาวอิตาลีชื่อ Ettore Marchiafava และ Angelo Celli[33] ในปีต่อมา แพทย์ชาวคิวบาชื่อ Carlos Finley ซึ่งปฏิบัติหน้าที่รักษาผู้ป่วยโรคไข้เหลืองในฮาวานาได้เสนอว่ามาลาเรียสามารถติดต่อได้โดยมียุงเป็นพาหะ อย่างไรก็ดี แพทย์ชาวอังกฤษชื่อ Sir Ronald Ross ที่ทำงานอยู่ในประเทศอินเดียได้พิสูจน์ในปี พ.ศ. 2441 ว่าเชื้อมาลาเรียติดต่อผ่านทางยุงได้จริง เขาสามารถพิสูจน์ได้ว่ายุงชนิดหนึ่งได้นำเชื้อโรคนี้ติดต่อไปยังนก และสามารถสกัดปรสิตมาลาเรียจากต่อมน้ำลายของยุงที่ไปกัดนกที่ติดเชื้อตัวนั้นได้[34] จากการวิจัยนี้ทำให้ Ross ได้รับรางวัลโนเบลสาขาการแพทย์ในปี พ.ศ. 2445 หลังจากลาออกจากการปฏิบัติงานทางการแพทย์ในประเทศอินเดีย Ross ได้เข้าทำงานใน Liverpool School of Tropical Medicine ที่เพิ่งก่อตั้งขึ้นใหม่ และมีส่วนร่วมในการควบคุมโรคมาลาเรียในประเทศอียิปต์ ปานามา กรีซ และ มอริเชียส[35] การค้นพบของ Finlay และ Ross ได้รับการยืนยันในเวลาต่อมาโดย medical board นำโดย Walter Reed ในปี พ.ศ. 2443 และได้รับการนำไปใช้ William C. Gorgas ในหน่วยงานสาธารณสุขระหว่างการก่อสร้างคลองปานามา การปฏิบัติงานทางสาธารณสุขนี้ได้ช่วยชีวิตคนงานนับพันและได้เริ่มสร้างวิธีการในการต่อสู้กับโรคมาลาเรียในปัจจุบัน
อ้างอิง
- ↑ Nayyar GML, Breman JG, Newton PN, Herrington J (2012). "Poor-quality antimalarial drugs in southeast Asia and sub-Saharan Africa". Lancet Infectious Diseases. 12 (6): 488–96. doi:10.1016/S1473-3099(12)70064-6. PMID 22632187.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 2.0 2.1 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อPPID 2010 - ↑ 3.0 3.1 3.2 3.3 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อNadjm 2012 - ↑ 4.0 4.1 4.2 4.3 4.4 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อBartoloni 2012 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อBeare 2006 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อFerri 2009 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อTaylor 2012 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อKorenromp 2005 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อBeare 2011 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อHartman 2010 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อRijken 2012 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อMueller 2007 - ↑ 13.0 13.1 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อCollins 2012 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อSarkar 2009 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อBaird 2013 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อArnott 2012 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อCollins 2009 - ↑ Schlagenhauf-Lawlor 2008, pp. 70–1
- ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อCowman 2012 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อArrow 2004 - ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อOwusu-Ofori 2010 - ↑ WHO 2010, p. vi
- ↑ อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อWhite 2011 - ↑ WHO 2010, p. 17
- ↑ Maegraith, BG (1973). "Tropical Pathology". Spezielle pathologische Anatomie. 8: 319–349. doi:10.1007/978-3-662-00226-1_11. ISBN 978-3-662-00228-5.
{{cite journal}}: Cite journal ต้องการ|journal=(help);|chapter=ถูกละเว้น (help) - ↑ Cogswell F (1992). "The hypnozoite and relapse in primate malaria". Clin Microbiol Rev. 5 (1): 26–35. PMID 1735093.
- ↑ Chen Q, Schlichtherle M, Wahlgren M (2000). "Molecular aspects of severe malaria". Clin Microbiol Rev. 13 (3): 439–50. PMID 10885986.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 28.0 28.1 อ้างอิงผิดพลาด: ป้ายระบุ
<ref>ไม่ถูกต้อง ไม่มีการกำหนดข้อความสำหรับอ้างอิงชื่อm1 - ↑ Joy D, Feng X, Mu J, Furuya T, Chotivanich K, Krettli A, Ho M, Wang A, White N, Suh E, Beerli P, Su X (2003). "Early origin and recent expansion of Plasmodium falciparum". Science. 300 (5617): 318–21. PMID 12690197.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Escalante A, Freeland D, Collins W, Lal A (1998). "The evolution of primate malaria parasites based on the gene encoding cytochrome b from the linear mitochondrial genome". Proc Natl Acad Sci U S A. 95 (14): 8124–9. PMID 9653151.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Cox F (2002). "History of human parasitology". Clin Microbiol Rev. 15 (4): 595–612. PMID 12364371.
- ↑ "Biography of Alphonse Laveran". The Nobel Foundation. สืบค้นเมื่อ 2007-06-15. ] Nobel foundation. Accessed 25 Oct 2006
- ↑ "Ettore Marchiafava". สืบค้นเมื่อ 2007-06-15.
- ↑ "Biography of Ronald Ross". The Nobel Foundation. สืบค้นเมื่อ 2007-06-15.
- ↑ "Ross and the Discovery that Mosquitoes Transmit Malaria Parasites". CDC Malaria website. สืบค้นเมื่อ 2007-06-15.
แม่แบบ:Link FA แม่แบบ:Link FA แม่แบบ:Link FA แม่แบบ:Link FA แม่แบบ:Link FA แม่แบบ:Link GA แม่แบบ:Link GA
