การแตกตัวเป็นไอออน
การแตกตัวเป็นไอออน (อังกฤษ: Ionization) เป็นกระบวนการหนึ่ง ที่อะตอมหรือโมเลกุลได้รับประจุลบหรือประจุบวกจากการได้มาหรือการเสียไปของอิเล็กตรอนอะตอมหรือโมเลกุลนั้นจึงกลายเป็นไอออน, มักจะเกิดขึ้นร่วมกับการเปลี่ยนแปลงทางเคมีอื่น ๆ[1] การแตกตัวเป็นไอออนอาจเป็นผลมาจากการสูญเสียอิเล็กตรอนหลังจากการชนกันของอนุภาคย่อยของอะตอมด้วยกัน, การชนกันของอะตอมกับอะตอมอื่น ๆ, การชนกันของโมเลกุลกับไอออน, หรือผ่านการมีปฏิสัมพันธ์กับแสง. การแตกตัวเป็นไอออนสามารถเกิดขึ้นได้ผ่านการสลายให้กัมมันตรังสีโดยกระบวนการการแปลงภายใน ซึ่งในกระบวนการนี้ นิวเคลียสที่ถูกกระตุ้นจะถ่ายโอนพลังงานของมันไปให้กับอิเล็กตรอนตัวหนึ่งภายในเปลือกอิเล็กตรอนวงในทำให้อิเล็กตรอนตัวนั้นถูกปล่อยออกมา
ประโยชน์[แก้]
ตัวอย่างในชีวิตประจำวันของการแตกตัวเป็นไอออนของก๊าซได้แก่อย่างเช่นภายในหลอดฟลูโอเรสเซนต์หรือหลอดประจุไฟฟ้าอื่น ๆ นอกจากนี้มันยังถูกใช้ในการตรวจจับรังสีเช่นเครื่องวัดกัมมันตภาพรังสี Geiger-Müller หรือห้องการแตกตัวเป็นไอออน ขั้นตอนของการแตกตัวเป็นไอออนถูกนำมาใช้กันอย่างแพร่หลายในอุปกรณ์ที่หลากหลายทางวิทยาศาสตร์พื้นฐานและในเครื่องวิเคราะห์สเปกตรัมของมวลและในการทำรังสีบำบัด
การผลิตไอออน[แก้]
ไอออนประจุลบจะถูกผลิตขึ้นเมื่ออิเล็กตรอนอิสระชนเข้ากับอะตอมและต่อมามันก็จะถูกขังอยู่ภายในกำแพงศักย์ไฟฟ้า, ปล่อยพลังงานส่วนเกินที่มีออกมา กระบวนการนี้เป็นที่รู้จักกันว่าเป็นการแตกตัวเป็นไอออนโดยการจับยึดอิเล็กตรอน (อังกฤษ: electron capture ionization) (เป็นการแตกตัวเป็นไอออนของอะตอมหรือโมเลกุลที่อยู่ในขั้นตอนที่เป็นก๊าซโดยการแปะติดอิเล็กตรอนเข้าไปเพื่อสร้างไอออนในรูปแบบของ A–• ตามสมการ เมื่อ M เหนือลูกศรหมายความว่าในการที่จะอนุรักษ์พลังงานและโมเมนตัม บุคคลที่สามต้องเข้ามามีส่วนร่วม (จำนวนของโมเลกุลที่เข้าทำปฏิกริยาคือสาม) การจับยึดอิเล็กตรอนสามารถถูกนำมาใช้ร่วมกับการแตกตัวเป็นไอออนด้วยวิธีทางเคมี (อังกฤษ: chemical ionization)[2] เครื่องตรวจจับการจับยึดอิเล็กตรอนจะถูกนำมาใช้บางระบบของการแยกสีของก๊าซ (อังกฤษ: gas chromatography)[3])
ไอออนประจุบวกจะมีการผลิตโดยการโอนพลังงานในจำนวนที่เพียงพอให้กับอิเล็กตรอนที่ถูกยึดเหนี่ยวไว้ในการปะทะกันกับอนุภาคที่มีประจุ (เช่นไอออน, อิเล็กตรอนหรือโพสิตรอน) หรือกับโฟตอน จำนวนที่เป็นเกณฑ์ของพลังงานที่ต้องใช้จะถูกเรียกว่าพลังงานศักย์ในการแตกตัวเป็นไอออน การศึกษาการชนกันดังกล่าวเป็นความสำคัญขั้นพื้นฐานในเรื่องเกี่ยวกับ few-body problem (ดูบทความเกี่ยวกับ few-body problem) ซึ่งเป็นหนึ่งในปัญหาที่ยังแก้ไม่ได้ที่สำคัญในสาขาฟิสิกส์ ในมุมมองของพลังงานจลน์ การทดลองที่สมบูรณ์[4] เช่นในการทดลองที่จะกำหนดเวกเตอร์โมเมนตัมที่สมบูรณ์ของทุกชิ้นส่วนเศษซากการชนทั้งหมด (กระสุนววิถีกระจาย, เป้าหมายไอออนที่ recoiling และอิเล็กตรอนพุ่งออกมา) ได้มีส่วนร่วมให้กับความก้าวหน้าที่สำคัญในการทำความเข้าใจในทฤษฎีของ few-body problem ในหลายปีที่ผ่านมา
การแตกตัวเป็นไอออนแบบไม่สูญเสียหรือได้รับความร้อน (อังกฤษ: Adiabatic ionization) เป็นรูปแบบหยึ่งของการแตกตัวเป็นไอออนที่อิเล็กตรอนถูกย้ายออกจากหรือเพิ่มเข้าให้อะตอมหรือโมเลกุลในสถานะพลังงานต่ำสุดเพื่อสร้างไอออนในสถานะพลังงานที่ต่ำสุดของมัน[5]
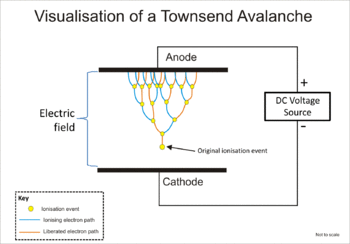
หิมะถล่มทาวน์เซนด์ (อังกฤษ: Townsend avalanche) เป็นตัวอย่างที่ดีของการสร้างไอออนบวกและอิเล็กตรอนอิสระเนื่องจากการกระทบของไอออน มันเป็นปฏิกิริยาที่ลดหลั่นที่เกี่ยวข้องกับอิเล็กตรอนในภูมิภาคที่มีสนามไฟฟ้าที่สูงพอสมควรในตัวกลางที่เป็นก๊าซที่สามารถถูกทำให้แตกตัวเป็นไอออนได้เช่นอากาศ หลังเหตุการณ์แตกตัวเป็นไอออนแต่เดิม อย่างเช่นเนื่องจากการแผ่รังสีโดยการแตกตัวเป็นไอออน ไอออนประจุบวกจะลอยไปที่แคโทด ในขณะที่อิเล็กตรอนอิสระจะลอยไปยังแอโหนดของอุปกรณ์ ถ้าสนามไฟฟ้ามีความแข้มพอเพียง อิเล็กตรอนอิสระอาจได้รับพลังงานเพียงพอที่จะปลดปล่อยอิเล็กตรอนต่อไปอีกในการชนครั้งต่อไปกับโมเลกุลอื่น ทั้งสองอิเล็กตรอนอิสระนั้นจะเดินทางไปยังแอโหนดและได้รับพลังงานที่เพียงพอจากสนามไฟฟ้าที่จะทำให้เกิดการแตกตัวเป็นไอออนจากการกระทบเมื่อมีการชนครั้งต่อไปเกิดขึ้น; และเกิดขึ้นเช่นนี้ต่อไปเรื่อย ๆ นี้เป็นปฏิกิริยาลูกโซ่อย่างมีประสิทธิภาพของการผลิตอิเล็กตรอนและจะขึ้นอยู่กับอิเล็กตรอนอิสระที่ได้รับพลังงานที่เพียงพอระหว่างการชนกันที่จะรักษาสภาวะหิมะถล่มให้ยั่งยินต่อไป[6]
ประสิทธิภาพของการแตกตัวเป็นไอออนคิดเป็นอัตราส่วนระหว่างจำนวนของไอออนที่ได้ต่อจำนวนของอิเล็กตรอนหรือโฟตอนที่ใช้[7][8]
อ้างอิง[แก้]
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Ionization".
- ↑ Donald F. Hunt; Frank W. Crow (1978), "Electron capture negative ion chemical ionization mass spectrometry", Analytical Chemistry, 50 (13): 1781, doi:10.1021/ac50035a017
{{citation}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006-) "electron capture detector (in gas chromatography)".
- ↑ Schulz, Michael (2003). "Three-Dimensional Imaging of Atomic Four-Body Processes". Nature 422: 48–51. Bibcode:2003Natur.422...48S. doi:10.1038/nature01415.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "adiabatic ionization".
- ↑ Glenn F Knoll. Radiation Detection and Measurement, third edition 2000. John Wiley and sons, ISBN 0-471-07338-5
- ↑ Todd, J. F. J. (1991). "Recommendations for Nomenclature and Symbolism for Mass Spectroscopy (including an appendix of terms used in vacuum technology)(IUPAC Recommendations 1991)". Pure & Appl. Chem. 63 (10): 1541–1566. doi:10.1351/pac199163101541.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "ionization efficiency".

