พรีออน
บทความนี้อาจต้องการตรวจสอบต้นฉบับ ในด้านไวยากรณ์ รูปแบบการเขียน การเรียบเรียง คุณภาพ หรือการสะกด คุณสามารถช่วยพัฒนาบทความได้ |
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |
พรีออน (prion) คือ โปรตีนขนาดเล็ก ไม่ละลายน้ำ ทนความร้อน ทนการเปลี่ยนแปลงอุณหภูมิทั้งร้อนและเย็น ทนต่อความแห้ง ทนต่อแสงยูวี ทนต่อการย่อยสลายโดยเอนไซม์ทั้ง protease และ nuclease สามารถติดต่อระหว่างสิ่งมีชีวิตและก่อโรคได้ ภาษาอังกฤษ เรียกว่า proteinaceous infectious particle คำว่า พรีออน เป็นคำเรียกที่แบบคำผวนของคำนี้เพราะว่า โพรอีน ฟังสับสนกับสารหลายชนิด
ผู้ตั้งคำว่า พรีออน คือนักวิทยาศาสตร์รางวัลโนเบลปี พ.ศ. 2540 Stanley B. Prusiner แห่งมหาวิทยาลัยแคลิฟอร์เนีย ณ ซานฟรานซิสโก ในปี พ.ศ. 2525 (1982)
เราสามารถพบพรีออนได้ทั่วไปทั้งพืช สัตว์ และยีสต์ แต่ที่พรีออนโด่งดังเพราะมันสามารถก่อโรคและทำให้ถึงแก่ชีวิตในเวลาอันรวดเร็วได้ โรคที่มีสาเหตุจากพรีออนคือ โรคสมองอักเสบแบบติดต่อ (Transmissible spongiform encephalopathies: TSEs) โรคชนิดนี้เป็นโรคที่ทำอันตรายถึงชีวิตได้ พบในทั้งคนและสัตว์ ที่ร้ายแรงคือ สามารถถ่ายทอดได้จากการบริโภคเนื้อสัตว์ที่ติดโรค ตัวอย่างโรคชนิดนี้ได้แก่ Creutzfeldt-Jakob disease (CJD) ในคน, โรควัวบ้า bovine spongiform encephalopathy "mad cow disease", โรค scrapie ในแกะ, โรค chronic wasting disease ในกวาง ที่ทวีปอเมริกาเหนือ ซึ่งมีความคล้ายคลึงกับโรคทางสมองอย่าง โรค Alzheimer ที่ในสมองผู้ป่วยจะพบอะไมลอยด์ (โปรตีนร่างแหที่ไม่ละลายน้ำ)
โปรตีน พรีออน (PrP) เป็นโปรตีนของร่างกาย เกิดจากการถอดรหัสของยีน พรีออน (Prnp Gene) PrP มีสองรูปแบบคือ
- รูปแบบปกติ (cellular: PrPC, PrPsen) พบในเซลล์ทั่วไป ละลายน้ำ มีโครงสร้างเป็น อัลฟ่าเฮลิกซ์ และไม่ทนต่อเอนไซม์โปรตีเอส (sensitive) โปรตีนนี้ปกติจะเกาะ (anchor) กับเยื่อหุ้มเซลล์โดย glycosylphosphatidylinositol (GPI) ที่ปลาย C-Terminus
- รูปแบบก่อโรค (scrapie form: PrPSc, PrPres) ก่อโรค ไม่ละลายน้ำ มีโครงสร้างเป็น เบต้าชีทแบบ anti-parallel ทนต่อเอนไซม์โปรตีเอส พบได้ในในเซลล์หลายชนิด แต่ที่พบมากคือที่ระบบประสาทและสมอง
พรีออนทั้งสองชนิดถูกสร้างเป็นปกติอยู่แล้วในเซลล์ แต่รูปแบบผิดปกติจะมีในปริมาณที่น้อยมาก
ประวัติ
[แก้]ราวทศวรรษที่ 1950 (ประมาณ พ.ศ. 2490) นายแพทย์ Daniel Carleton Gajdusek ได้พบโรค Kuru ซึ่งถ่ายทอดจากรุ่นพ่อแม่สู่รุ่นลูก ในชาวเผ่าดั้งเดิมบนเกาะปาปัวนิวกินีที่มีประเพณีกินสมองของศพของบรรพบุรุษ แต่ยังไม่ทราบแน่ชัดว่าเกิดจากสาเหตุใด โดยสันนิษฐานครั้งแรกว่าเกิดจากเชื้อไวรัสที่ยังไม่เป็นที่รู้จัก ต่อมาประมาณปี ค.ศ. 1959 William Hadlow ได้นำงานของ Gajdusek มาศึกษาและพบว่าอาการของโรคและเนื้อเยื่อสมองของผู้ป่วยมีความคล้ายคลึงกันมากกับโรค Scrapie ในแกะ จากข้อมูลนี้ทำให้ Gajdusek ทำการศึกษาต่อไปและพบว่าโรคทั้งสองเกิดจากต้นเหตุเดียวกันที่ยังก่อให้เกิดโรคอื่นๆอีก เช่น classic Creutzfeldt-Jakob disease (CJD) อีกทั้งการเลิกกินสมองของศพจะช่วยไม่ให้โรคเกิดการติดต่อ จากงานวิจัยนี้ทำให้ Gajdusek ได้รับรางวัลโนเบลสาขาสรีรวิทยาและการแพทย์ในปี ค.ศ. 1976
ประมาณปี ค.ศ. 1966 ได้ค้นพบสารต้นเหตุของโรค Scrapie ที่เป็นโรคติดต่อในแกะ ว่าเป็นสารที่เสถียรมาก แม้จะโดน ความร้อน แสงยูวี รังสีแกมม่า ความเป็นกรดเบส และ เอนไซม์ แต่ก็ยังสามารถก่อโรคต่อไปได้ อีกทั้งไม่พบกรดนิวคลีอิก หรือ สารพันธุกรรมใดๆเลย ในปี ค.ศ. 1967 J.S. Griffith จึงได้ตั้งสมมติฐานว่าโรคนี้เกิดจากโปรตีนเท่านั้น (Protein-only hypothesis) ซึ่งสันนิษฐานว่าโปรตีนสามารถเพิ่มจำนวนตัวเองได้ ข้อสมมติฐานนี้ขัดแย้งรุนแรงกับความเชื่อหลักทางชีววิทยา (central dogma of modern biology) อย่างไรก็ตาม ยังมีนักวิทยาศาสตร์ที่เชื่อว่าโรคนี้เกิดจากเชื้อไวรัสที่ยังไม่ถูกค้นพบ (Virino hypothesis)
ต่อมาในปี ค.ศ. 1981 Stanley B. Prusiner ทำการทดลองแยกสารที่ก่อโรคนั้นออกมาได้ซึ่งเป็นโปรตีนที่สามารถเพิ่มจำนวนตัวเองได้ (PrPSC SC ย่อมาจาก โรค scrapie) จึงเรียกสารนั้นว่า proteinaceous infectious particle หรือ prion โดยพบว่ามันเป็นโปรตีนที่ผิดรูปไป ทำให้ไม่ละลายน้ำ และทนต่อสารเคมีต่างๆ และ หลังจากงานวิจัยของ Prusiner ประมาณสิบปี ในช่วงทศวรรษที่ 1990 ได้มีการค้นพบยีนที่ถอดรหัสโปรตีน PrP ที่อยู่ในเซลล์ปกติของสิ่งมีชีวิต
อย่างไรก็ตาม ทฤษฎีนี้ถูกคัดค้านโดย นักวิทยาศาสตร์ Laura Manuelidis แห่ง มหาวิทยาลัยเยล ว่ามันไม่ได้เป็นโปรตีนแต่เป็นไวรัสที่ยังไม่ถูกค้นพบ เหตุผลหลักคือ โปรตีน PrPSc เพียงอย่างเดียวไม่สามารถทำให้สัตว์ทดลองที่มีสุขภาพแข็งแรงป่วยได้ ถ้าจะทำให้สัตว์นั้นป่วยต้องใช้สารสกัดจากสมองซึ่งไม่อาจจะมีไวรัสปะปนมาได้ และต่อมาในปี ค.ศ. 2007 เธอก็ได้ตีพิมพ์การทดลองที่แสดงได้ว่าไวรัสอาจมีส่วนในการก่อโรคนี้
การเพิ่มจำนวนของ พรีออน (PrPSC) ในเซลล์ และการก่อโรค
[แก้]โดยปกติ PrPC จะถูกสร้างออกมาจากเซลล์ตลอดเวลาอยู่แล้ว โดย PrPC จะเป็น integral membrane protein ที่เกาะกับ เซลล์ ด้วย GPI anchor ซึ่งจะทำหน้าที่ส่งสัญญาณเข้าเซลล์ปกติและไม่ก่อโรค แต่เมื่อร่างกายได้รับ PrPSC ที่จะกระตุ้น PrPC ให้กลายเป็น PrPSC อันเป็นฟอร์มที่ก่อให้เกิดโรค โดยโครงสร้างโปรตีนทุติยภูมิจากอัลฟ่าเฮลิกซ์ เปลี่ยนไปเป็น เบต้าชีท ทำให้โปรตีนไม่ละลายน้ำ และไม่สามารถถูกย่อยสลายได้โดยเอนไซม์ protease ดังนั้นจึงเกิดการสะสมของโปรตีนที่ภายนอกเซลล์เป็นขั้นแรก และ เนื่องจากPrPC นี้ ปกติ ทำหน้าที่ส่งสัญญาณเข้าไปในเซลล์ เมื่อโปรตีนนี้เปลี่ยนรูปไป ทำให้สัญญาณที่ส่งเข้าไปในเซลล์ผิดแปลกไปด้วย สัญญาณที่ผิดนี้มีผลอย่างหนึ่งในเซลล์คือทำให้เกิดการสะสมของโปรตีนนี้ในเซลล์ด้วยเช่นกัน โดยเริ่มที่ ไลโซไซม์ (Lysosyme) แล้วจับกับ โปรตีโอไกลแคน ชื่อ เฮพารินซัลเฟต กลายเป็น ร่างแหโปรตีน และ กลายเป็น plaque และ เมื่อรวมกับ สัญญาณอื่นๆ ที่ผิดปกติไป ก็จะทำให้เซลล์ดำเนินการฆ่าตัวตาย (Apoptosis) อันทำให้เซลล์ประสาทนี้สลายไป ซึ่งถ้ามีจำนวนมาก จะทำให้หน้าที่ของสมองผิดปกติไป และ สามารถเห็นได้จากเนื้อเยื่อสมองว่า เนื้อสมองเป็นรูอย่างฟองน้ำ
เป็นที่น่าสังเกตว่า เพียง PrPSC ไม่สามารถก่อโรค (ทำลายเซลล์) ได้ มันต้องการ PrPC ของสิ่งมีชีวิตเสมอ ซึ่งเป็นการให้สัญญาณต่อเซลล์ที่ผิดไป (Chesebro et. al., 2005) ดังนั้นการศึกษาเพื่อรู้หน้าที่ของ PrPC ในเซลล์จึงเป็นสิ่งที่น่าสนใจ ซึ่งหน้าที่ของมันที่พอจะคาดเดาได้ในขณะนี้ (พ.ศ. 2550) คือ เป็นสารช่วยการเติบโต (growth factor)ของ เซลล์ประสาท และ เซลล์เม็ดเลือด (haemopoietic stem cells) (Couzin J.,2006)
ส่วนกลไกการเปลี่ยน จาก PrPC เป็น PrPSC มีหลายโมเดล แต่ที่เชื่อกันคือการก่อแบบกระตุ้นทีละเยอะๆ (Seeding model) คือการสะสมทีละนิดๆของ PrPSC ในเซลล์ (seed) แล้วกลุ่ม PrPSC เมื่อมีจำนวนพอก็ไปเหนี่ยวนำให้PrPC ที่ปกติเปลี่ยนเป็นPrPSC ที่ไม่ปกติ ได้เป็นจำนวนทีละมากๆในเวลาอันรวดเร็ว อย่างไรก็ตามยังต้องทำการวิจัยต่อไปว่าพรีออนเพิ่มจำนวนในเซลล์ด้วยวิธีการใด
การติดต่อ
[แก้]พรีออนมีการติดต่อสองแบบคือ หนึ่งแบบการถ่ายทอดทางพันธุกรรมที่เกิดจากการกลายพันธุ์ (mutation) ของยีน prnp ซึ่งสามารถเกิดขึ้นเอง (sporadic) หรือได้รับถ่ายทอดจากพ่อแม่ก็ได้ (familial) ส่วนสาเหตุที่สองที่เป็นวิธีแพร่ของโรคร้ายแรงอย่างโรควัวบ้าคือการถ่ายทอดแบบ horizontal transmissable ผ่านการบริโภคอาหารที่มี PrPSC เข้าไป หรือ แบบ iatrogenic ที่เกิดจากการนำอุปกรณ์การแพทย์ที่เคยใช้กับผู้ป่วยพรีออนไปใช้กับผู้ป่วยปกติ แม้จะทำความสะอาดแล้วแต่เพราะพรีออนทนทานต่อสารเคมีและความร้อน ทำให้ยังคงเหลือพรีออนอยู่กับอุปกรณ์การแพทย์นั้น และสามารถทำให้เกิดการติดต่อได้ แต่อย่างไรก็ตาม ยังขึ้นอยู่กับปริมาณที่ได้รับและสภาพของตัวผู้ป่วยด้วย เพราะ มีการค้นพบว่าชาวเอเชียจะมีภูมิต้านทานต่อพรีออนมากกว่า และจะติดพรีออนได้น้อยกว่าฝรั่งผิวขาว หรือ แม้มีพรีออนในนมของวัวที่เป็นโรควัวบ้า แต่อยู่ในปริมาณที่ต่ำมากทำให้ผู้บริโภคไม่ติดโรคพรีออน สำหรับกรณีของการติดต่อจากการบริโภคที่เป็นสิ่งที่มีความเสี่ยงสูงสำหรับระบบอุตสาหกรรมอาหารในโลกสมัยใหม่ การเดินทางของพรีออนจากระบบทางเดินอาหารไปยังสมอง ยังไม่สามารถให้ความกระจ่างได้ แต่ปัจจุบันได้มีการค้นพบแล้วว่า ระบบภูมิคุ้มกันมีบทบาทอย่างมากในการพาพรีออนไปยังสมอง โดยเริ่มจากการผ่านการย่อยในทางเดินอาหารพรีออนแม้จะไม่ถูกทำลายโดยเอนไซม์ต่างๆแต่ก็ยังสามารถถูกดูดซึมเข้าสู่ร่างกายได้บริเวณ distal ileum (ลำไส้เล็กส่วนปลาย) โดยสันนิษฐานว่าน่าจะผ่านทาง Membranous epithelial cell (M cell) ซึ่งเป็นเซลล์บุเยื่อต่อมน้ำเหลืองชนิดหนึ่ง แล้วจึงถูกนำไปยังต่อมน้ำเหลืองทุติยภูมิ (secondary lymphoid organ: Peyer's patches) โดยเซลล์เคลื่อนที่ได้ ซึ่งยังไม่แน่ชัดว่าเป็นเซลล์ใด จากนั้นก็ไปเกิดการเพิ่มจำนวนที่ต่อมน้ำเหลืองนี้ที่เซลล์ Follicular dendritic cells (FDCs) โดยความช่วยเหลือของบีเซลล์ (B lymphocyte) ที่ปล่อยสาร Lymphotoxin (LT) มากระตุ้น FDCs นี้ จากนั้นก็จะมีปฏิกิริยาต่อกันทั้งการหลั่งสารไซโตคีนและ cell contact ระหว่างบีเซลล์ คอมพลีเมนต์ สโตรมาเซลล์ และ FDCs ซึ่งช่วยในการเพิ่มจำนวนพรีออนบน FDCs ส่วนการเดินทางของพรีออนไปยังระบบประสาทนั้น ที่ต่อมน้ำเหลืองทุติยภูมินี้จะมีเส้นประสาท autonomic nervous system ประเภท sympathetic มาเชื่อมกันอยู่แล้ว เซลล์ FDCs ที่สามารถเคลื่อนที่ได้ ก็จะพาเอาพรีออนไปยังเซลล์ประสาทนี้เอง (ยังมีการโต้เถึยงกันในเรื่องนี้ โดยเฉพาะระยะห่างระหว่างเซลล์ FDCs และเซลล์ประสาท) แล้วจากเซลล์ประสาทระบบซิมพาเทติกนี้ พรีออนก็จะถูกส่งไปยังระบบประสาทส่วนกลาง (central nervous system: CNS) ผ่านทาง ganglion cell ซึ่งจะไปเพิ่มจำนวนที่เซลล์สมองและทำลายสมองต่อไป ส่วนของสมองส่วนแรกที่จะติดพรีออนได้เร็วที่สุดคือ corpus callosum และ ไฮโปทาลามัส อนึ่งในผู้ป่วยหรือสัตว์ที่ป่วยจะไม่พบพรีออนเพียงแต่ในเซลล์ประสาทหรือสมองเท่านั้นแต่ยังพบได้ในกล้ามเนื้อ เลือด ม้าม ลูกตา ทางเดินอาหาร และต่อมต่างๆ เช่นต่อมน้ำนม
อาการของโรค
[แก้]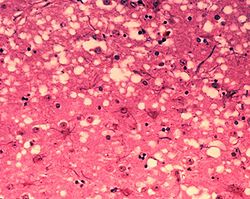
เนื้อสมองของผู้ป่วยจะถูกทำลาย รูปร่างสมองจะผิดรูปทั้งสมอง (atrophic) ขณะที่โรคอื่นจะไม่เป็นทั้งสมองแบบนี้ เพราะพรีออนไปเพิ่มจำนวนมากแพร่กระจายทั่วทั้งสมองทำให้เซลล์สมองโป่งเต็มไปด้วยของเหลว เมื่อดูลักษณะเซลล์แล้วเป็นรูพรุนคล้ายฟองน้ำ (spongioform encephalitis) เมื่อทิ้งไว้ก็จะพบว่าโปรตีนเหล่านั้นจับกันเป็นร่างแหอะไมลอยด์ เป็นก้อนในสมอง ซึ่งจะทำให้เนื้อสมองโดนทำลาย ผู้ป่วยก็จะมีอาการหลังเซลล์สมองโดนทำลายต่างๆกันไป เช่น ปวดหัว ไม่สามารถควบคุมร่างกายได้ หรือ กระทั่งความจำเสื่อม และถึงแก่ชีวิตในที่สุด โดยอาการแม้จะคล้ายกับโรคทางสมองอื่นๆและเกิดค่อนข้างช้าเพราะใช้เวลาฟักตัวนาน แต่เมื่อมีอาการแล้วอาการจะพัฒนาอย่างรวดเร็ว
การวินิจฉัยโรค
[แก้]เพราะอาการของโรคจะคล้ายกับโรคทางสมองชนิดอื่นทำให้ไม่สามารถวินิจฉัยว่าเป็นหรือไม่ แต่พรีออนสามารถตรวจได้จากการผ่าสมอง ตรวจหาพรีออนในเลือด น้ำไขสันหลัง หรือ สารสกัดจากสมอง (brain extract) ที่แย่ที่สุดคือตรวจชันสูตรหลังการเสียชีวิต ในห้องทดลองได้ค้นพบวิธีตรวจพรีออนได้แบบใหม่ด้วยวิธีการ Protein misfolding cyclic amplification (PMCA)
สำหรับกรณี ผู้ป่วยที่เกิดจากการผิดปกติทางพันธุกรรมสามารถตรวจสอบได้จากการตรวจหายีนก่อโรคได้ แต่โดยมากไม่เป็นที่นิยมกันเพราะเมื่อครอบครัวไหนมีผู้ป่วยโรคนี้แล้ว ก็จะถูกเฝ้าดูโดยแพทย์ โดยไม่ต้องทำการตรวจยีนเป็นกรณีพิเศษ
การรักษา
[แก้]ยังไม่มีการรักษาที่มีประสิทธิภาพ ที่มีอยู่มีเพียงการให้ยาลดอาการแต่ยังไม่มียาหรือวัคซีนใดที่กำจัดพรีออนได้โดยตรงอย่างมีประสิทธิภาพและไม่มีผลข้างเคียง สำหรับในพรีออนในสัตว์ทำได้เพียงแต่กันสัตว์ทีติดโรคออกไปเท่านั้นหรือทำลายสัตว์นั้นทิ้ง (Quarantine)
อย่างไรก็ตาม ในปี พ.ศ. 2542 (1999)คณะวิจัยของ Dale Schenk ได้จุดประกายความหวังของวัคซีนในการรักษาขึ้นมา โดย เขาและคณะของเขาค้นพบวัคซีนที่ใช้รักษาโรคอัลไซเมอร์ได้ ซึ่งทำการทดลองแล้วในคนขั้นต้น พบว่า สามารถลดปริมาณโปรตีนที่ผิดรูปได้จริง ด้วยเหตุนี้จึงเป็นที่คาดหวังว่า หลักการจากการสร้างวัคซีนนี้จะสามารถนำมาประยุกต์กับพรีออนที่มีกลไกการเกิดใกล้เคียงกันได้ในอนาคต
อ้างอิง
[แก้]- a virologist who had studied several infectious diseases among remote peoplesเก็บถาวร 2007-03-08 ที่ เวย์แบ็กแมชชีน
- We can’t seem to find the page you were looking for. Please try our search or A-Z index.
- Prion Diseasesเก็บถาวร 2006-04-28 ที่ เวย์แบ็กแมชชีน
- Abid, K. et. al. Cell Mol Life Sci vol. 63: 2342-2351, Aug 2006
- Aguzzi, A. et. al. Nat rev Immun vol. 4: 725-736, Sep 2004
- Aguzzi, A. et. al. Immunity vol. 22: 145-154, Feb 2005
- Aguzzi, A. et. al. Science vol. 308: 1420-1421, Jun 2005
- Aguzzi, A. et. al. Nat rev Immun vol. 4: 765-775, Oct 2006
- Chesebro, B. et. al. Science vol. 308: 1435-1439, Jun 2005
- Couzin, J. Science vol. 311:1091, Feb 2006
- Enzerink, M. Science vol. 310: 1756-1758, Dec 2005
- Kraehenbuhl, J. et. al. Annual Review of Cell and Developmental Biology vol. 16: 301-332, Nov 2000
- Prusiner, S.B. PNAS vol. 95: 13363-13383, Nov 1998
- Telling, G. N Eng J Med vol. 353;11 : 1177-1179, Sep 2005
- Karp, G. Zellbiologie 5.Auflage 2005, Springer Verlag, Seite 85
- Riede, U. et. al. Allgemeine und Spezielle Pathologie 5.Auflage 2004, Georg Thieme Verlag
- Modrow, S. et. al. Molekulare Virologie 2.Auflage 2003, Spektrum Verlag
