การชำระเลือดผ่านเยื่อ
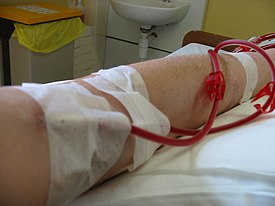

การชำระเลือดผ่านเยื่อ (อังกฤษ: hemodialysis) หรือที่นิยมเรียกว่าการฟอกเลือดหรือการฟอกไต เป็นวิธีการทางการแพทย์ที่กระทำภายนอกร่างกายในการกำจัดของเสียส่วนเกิน เช่น สารในกลุ่มครีเอทีนีนและยูเรียและน้ำออกจากเลือดในผู้ป่วยโรคไตวายซึ่งไตไม่สามารถทำงานได้เป็นปกติ ถือเป็นวิธีการรักษาทดแทนไตชนิดหนึ่ง นอกเหนือจากการปลูกถ่ายไตและการชำระเลือดผ่านเยื่อบุช่องท้อง (peritoneal dialysis) อีกทางเลือกหนึ่งสำหรับแยกส่วนประกอบของเลือดเช่นพลาสมาหรือเซลล์คือ apheresis (กระบวนการหนึ่งที่กระทำภายนอกร่างกายที่เลือดถูกถ่ายออกมาแล้วองค์ประกอบบางอย่างถูกแยกออกโดยการฟอก องค์ประกอบบางส่วนยังคงอยู่ที่เดิม เลือดส่วนที่เหลือจะถูกส่งกลับคืนผู้บริจาคโดยการถ่ายเลือด)
การฟอกเลือดสามารถเป็นการบำบัดสำหรับผู้ป่วยนอกหรือผู้ป่วยใน การฟอกเลือดเป็นประจำจะดำเนินการในศูนย์ฟอกไตผู้ป่วยนอกที่เป็นห้องในโรงพยาบาลที่สร้างโดยเฉพาะหรือห้องที่ทำขึ้นเฉพาะในคลินิกที่อยู่ลำพัง การฟอกเลือดที่ทำที่บ้านมีน้อย การฟอกเลือดในคลินิกจะดำเนินการและบริหารจัดการโดยทีมงานพิเศษจากพยาบาลและช่างเทคนิค; การฟอกเลือดที่บ้านสามารถดำเนินการได้เองและบริหารจัดการร่วมกันด้วยความช่วยเหลือของผู้ช่วยที่ผ่านการฝึกอบรมที่มักจะเป็นสมาชิกในครอบครัว[1]
หลักการ
[แก้]
หลักการของการฟอกเลือดเกี่ยวข้องกับการแพร่กระจายของสารผ่านเนื้อเยื่อที่มีความสามารถซึมผ่านเพียงกึ่งหนึ่ง การฟอกเลือดใช้การทวนกระแสการไหลของเลือด โดยที่สารฟอก (dialysate) ไหลในทิศทางตรงกันข้ามกับการไหลของเลือดในวงจรนอกร่างกาย การไหลทวนกระแสยังคงรักษาความเข้มข้นของส่วนประกอบทางเคมีผ่านเยื่อหุ้มเซลล์ที่จุดสูงสุดและเพิ่มประสิทธิภาพของการฟอกเลือด
การกำจัดของเหลว (การกรองยิ่งยวด (ultrafiltration)) จะกระทำโดยการเปลี่ยนความดันสถิตของน้ำ (hydrostatic pressure) ของช่องเก็บสารฟอก ทำให้เกิดน้ำอิสระและตัวทำละลายเจือจางบางส่วนเพื่อเคลื่อนย้ายข้ามเยื่อกรองไปตามระดับแรงดันตามลำดับ
สารละลายที่ใช้ในการฟอกอาจจะเป็นสารละลายที่ผ่านการฆ่าเชื้อของไอออนของแร่หรือปฏิบัติตามตำรับอังกฤษ (British Pharmacopoeia) ยูเรียและของเสียอื่น ๆ รวมทั้งโพแทสเซียมและฟอสเฟตจะกระจายลงในสารละลายฟอกไต อย่างไรก็ตามความเข้มข้นของโซเดียมและคลอไรด์มีความคล้ายคลึงกับพลาสมาปกติของเลือดเพื่อป้องกันการสูญเสีย โซเดียมไบคาร์บอเนตจะถูกใส่เข้าไปเพื่อเพิ่มความเข้มข้นให้สูงกว่าพลาสมาเพื่อแก้ไขความเป็นกรดในเลือด น้ำตาลกลูโคสจำนวนเล็กน้อยก็ยังถูกนำไปใช้อยู่ทั่วไป
โปรดสังเกตว่ากระบวนการนี้แตกต่างกับเทคนิคการกรองเลือด (hemofiltration)
ใบสั่งแพทย์
[แก้]ใบสั่งแพทย์สำหรับการฟอกเลือดจะออกโดยนักวักกวิทยา (ผู้เชี่ยวชาญทางการแพทย์ด้านไต) ซึ่งจะระบุพารามิเตอร์ต่าง ๆ สำหรับการบำบัดด้วยการฟอกเลือด พารามิเตอร์เหล่านี้รวมถึงความถี่ (จำนวนการรักษาต่อสัปดาห์), ระยะเวลาของการบำบัดในแต่ละครั้งและอัตราการไหลของเลือดและสารละลายฟอกเลือด รวมทั้งขนาดของสารฟอกไต นอกจากนี้ส่วนผสมของสารละลายฟอกเลือดบางครั้งยังมีการปรับเปลี่ยนในแง่ของระดับโซเดียมและโพแทสเซียมและระดับของไบคาร์บอเนต โดยทั่วไป ยิ่งผู้ป่วยมีร่างกายขนาดใหญ่ยิ่งต้องการฟอกเลือดมากขึ้น ในทวีปอเมริกาเหนือและสหราชอาณาจักร การบำบัด 3–4 ชั่วโมง (บางครั้งถึง 5 ชั่วโมงสำหรับผู้ป่วยตัวใหญ่) 3 ครั้งต่อสัปดาห์เป็นเรื่องปกติ การบำบัดสองครั้งต่อสัปดาห์จะถูกจำกัดสำหรับผู้ป่วยที่มีการทำงานของไตที่เหลืออยู่มากพอสมควร สี่ครั้งต่อสัปดาห์มักจะกำหนดให้สำหรับผู้ป่วยที่มีขนาดใหญ่เช่นเดียวกับผู้ป่วยที่มีปัญหาเกี่ยวกับของเหลวที่มากเกินพิกัด ในที่สุดแล้ว มีความสนใจมากขึ้นสำหรับการฟอกเลือดในบ้านระยะสั้นประจำวันซึ่งเป็นการบำบัด 1.5–4 ชั่วโมง 5–7 ครั้งต่อสัปดาห์ นอกจากนี้ยังมีความสนใจในการฟอกเลือดในเวลากลางคืนให้กับผู้ป่วยที่บ้าน 8–10 ชั่วโมงต่อคืน 3–6 คืนต่อสัปดาห์ นอกจากนี้ การฟอกไตในศูนย์ในเวลากลางคืน 3–4 ครั้งต่อสัปดาห์ยังมีให้บริการด้วยเครื่องฟอกไตเต็มกำลังในสหรัฐอเมริกา
ผลข้างเคียงและภาวะแทรกซ้อน
[แก้]การฟอกเลือดมักจะเกี่ยวข้องกับการกำจัดของเหลว (ผ่านการกรองยิ่งยวด (ultrafiltration)) เพราะผู้ป่วยส่วนใหญ่ที่มีภาวะไตวายจะปัสสาวะน้อยหรือไม่มีเลย ผลข้างเคียงที่เกิดจากการเอาของเหลวออกมากเกินไปและ / หรือการเอาของเหลวออกอย่างรวดเร็วเกินไปจะได้แก่ความดันโลหิตต่ำ, ความเมื่อยล้า, การปวดหน้าอก, ตะคริวที่ขา, คลื่นไส้และปวดหัว อาการเหล่านี้สามารถเกิดขึ้นได้ในระหว่างการบำบัดและจะยังคงอยู่หลังจากนั้น; บางครั้งอาการเหล่านี้จะเรียกรวมกันว่าอาการเมาค้างหรือการชะล้างจากการฟอกไต (hangover หรือ dialysis washout) ความรุนแรงของอาการเหล่านี้มักจะเป็นสัดส่วนกับปริมาณและความเร็วของการเอาของเหลวออก อย่างไรก็ตามผลกระทบของจำนวนหรืออัตราการเอาของเหลวออกที่กำหนดจะแตกต่างกันอย่างมากในแต่ละคนและในแต่ละวัน ผลข้างเคียงเหล่านี้สามารถหลีกเลี่ยงได้รวมทั้งอาจลดความรุนแรงของมันลงได้โดยการจำกัดการดื่มของเหลวระหว่างการช่วงการบำบัดในแต่ละครั้งหรือจำกัดการเพิ่มปริมาณยาของการฟอกไต เช่นทำการฟอกให้บ่อยขึ้นหรือใช้เวลานานขึ้นกว่าการบำบัดมาตรฐานที่เกินสามครั้งต่อสัปดาห์ 3–4 ชั่วโมงต่อครั้งตามตารางเวลาการบำบัด
เนื่องจากการฟอกเลือดต้องเข้าถึงระบบการไหลเวียนของเลือด ผู้ป่วยที่เข้ารับการฟอกเลือดอาจเปิดระบบไหลเวียนเลือดของตัวเองให้เผชิญกับจุลินทรีย์ที่สามารถนำไปสู่การติดเชื้อที่มีผลต่อลิ้นหัวใจ (เยื่อบุหัวใจอักเสบ) หรือการติดเชื้อที่มีผลต่อกระดูก (osteomyelitis) ความเสี่ยงของการติดเชื้อแตกต่างกันไปขึ้นอยู่กับชนิดของการเข้าถึงที่ใช้ (ดูด้านล่าง) อาจมีการตกเลือด การติดเชื้ออาจลดลงให้น้อยสุดได้โดยยึดมั่นอย่างเคร่งครัดในการควบคุมการติดเชื้อในทางปฏิบัติให้มากที่สุด
Heparin เป็นสารกันเลือดแข็งที่ใช้กันมากที่สุดในการฟอกเลือด เนื่องจากโดยทั่วไปมันอดทนได้ดีและสามารถกลับตัวได้อย่างรวดเร็วด้วย protamine sulfate การแพ้ Heparin อาจจะเป็นปัญหาไม่บ่อยนักและอาจทำให้เกล็ดเลือดต่ำ ในผู้ป่วยดังกล่าว สารกันเลือดแข็งที่เป็นทางเลือกสามารถนำมาใช้ได้ ในผู้ป่วยที่มีความเสี่ยงการตกเลือดสูง การล้างไตอาจสามารถทำได้โดยไม่ต้องใช้สารกันเลือดแข็ง
First Use Syndrome เป็นปฏิกิริยาการแพ้ (anaphylactic reaction) ที่หายากแต่รุนแรงต่อไตเทียม อาการของมันรวมถึงจาม หอบ หายใจถี่ ปวดหลัง เจ็บหน้าอกหรือเสียชีวิตอย่างกะทันหัน มันอาจเกิดจากสารฆ่าเชื้อ (sterilant) ที่ตกค้างในไตเทียมหรือจากวัสดุของเมมเบรนมันเอง ในปีที่ผ่านมาอุบัติการณ์ของโรค First Use Syndrome ได้ลดลงเนื่องจากการใช้งานที่เพิ่มขึ้นของการฉายรังสีแกมมา การฆ่าเชื้อด้วยการอบไอน้ำ หรือการฉายรังสีลำแสงอิเล็กตรอนแทนการใช้สารฆ่าเชื้อที่เป็นสารเคมี และการพัฒนาของเยื่อ semipermeable ใหม่ที่มีวัสดุชีวะ (biocompatibility) สูง วิธีการใหม่ของขบวนการชิ้นส่วนการฟอกเลือดที่ผ่านการยอมรับก่อนหน้านี้จะต้องนำมาพิจารณาเสมอ ยกตัวอย่างเช่นในปี ค.ศ. 2008 ปฏิกิริยาชนิดแรกของอาการ first-use ได้แก่การเสียชีวิต, ได้เกิดขึ้นจากการปนเปื้อนยา heparin ในระหว่างขั้นตอนการผลิตที่มี chondroitin sulfate ที่มีซัลเฟสมากเกินไป (oversulfated)[2]
ภาวะแทรกซ้อนระยะยาวของการฟอกเลือดจะรวมถึง amyloidosis (การผิดปรกติที่มีลักษณะของการสะสมของ amyloid (สารที่มีลักษณะคล้ายแป้ง) ในอวัยวะหรือในเนื้อเยื่อ) รวมทั้งการอักเสบและรูปแบบต่าง ๆ ของโรคหัวใจ การเพิ่มความถี่และระยะเวลาของการรักษาก็เพื่อปรับปรุงการโอเวอร์โหลดของของเหลวและหลีกเลี่ยงการขยายตัวของหัวใจที่มักเห็นได้บ่อยในผู้ป่วยดังกล่าว[3][4]
ข้างล่างนี้เป็นภาวะแทรกซ้อนเฉพาะที่เกี่ยวข้องกับประเภทของการเข้าถึงที่แตกต่างกันของการฟอกเลือด
การเข้าถึง
[แก้]ในการฟอกเลือด, มีสามวิธีหลักที่ใช้ในการเข้าถึงเลือด: สายสวนทางหลอดเลือดดำ, การเชื่อมหลอดเลือดแดงและหลอดเลือดดำ (arteriovenous fistula (AV)) และการพ่วงหลอดเลือดแดงและหลอดเลือดดำ ชนิดของการเข้าถึงได้รับอิทธิพลจากปัจจัยต่าง ๆ เช่นช่วงเวลาที่คาดหวังของเส้นทางการไตวายของผู้ป่วยและสภาพของระบบหลอดเลือดของเขา ผู้ป่วยอาจมีการเข้าถึงหลายทาง มักจะเป็นเพราะการเชื่อมหลอดเลือด หรือการพ่วงหลอดเลือดใช้งานได้ดีและสายสวนก็ยังคงนำมาใช้ได้ การเข้าถึงหลอดเลือดสามประเภทหลักเหล่านี้ทั้งหมดทำได้โดยการผ่าตัด[5]
สายสวน
[แก้]การเข้าถึงด้วยสายสวน หรือบางครั้งเรียกว่า CVC (สายสวนหลอดเลือดดำส่วนกลาง (central venous catheter)) ประกอบด้วยสายสวนทำด้วยพลาสติกหนึ่งเส้นมีสองรู (หรือบางครั้งเป็นสายสวนสองเส้นแยกจากกัน) ซึ่งจะถูกเจาะเข้าไปในหลอดเลือดดำขนาดใหญ่ (ปกติจะเป็นหลอด vena cava ผ่าน internal jugular vein หรือเส้นเลือด femoral vein) เพื่อให้กระแสของเลือดขนาดใหญ่ถูกดึงออกจากรูหนึ่ง ป้อนเข้าวงจรการฟอกเลือดแล้วส่งเลือดกลับผ่านทางอีกรูหนึ่ง อย่างไรก็ตามการไหลของเลือดมักจะน้อยกว่าการเข้าถึงแบบเชื่อมหรือแบบพ่วงที่สามารถทำงานได้ดีเสมอ
หลอดสวนมักจะพบในสองแบบทั่วไปคือแบบท่อลอดและแบบไม่ใช่ท่อลอด
้การเข้าถึงด้วยสายสวนแบบไม่ใช่ท่อลอดจะใช้สำหรับการเข้าถึงระยะสั้น (ไม่เกิน 10 วัน แต่มักจะใช้ฟอกไตเพียงครั้งเดียวเท่านั้น) โดยสายสวนจะโผล่ออกมาจากผิวหนังที่ตำแหน่งเดียวกับที่เจาะเข้าไปในหลอดเลือดดำ
การเข้าถึงด้วยสายสวนแบบท่อลอดเกี่ยวข้องกับสายสวนที่ยาวกว่า ซึ่งมันจะถูกปักเข้าไปใต้ผิวหนังจากจุดที่เจาะเข้าในหลอดเลือดดำลอดไปออกอีกจุดหนึ่งที่ห่างออกไป มันมักจะถูกสอดไว้ใน internal jugular vein ในลำคอและจุดออกมักจะอยู่บนผนังหน้าอก ท่อลอดจะใช้เป็นอุปกรณ์ขวางกั้นการบุกรุกของจุลินทรีย์ ดังนั้นสายสวนแบบท่อลอดจึงถูกออกแบบมาสำหรับการเข้าถึงระยะสั้นถึงระยะกลาง (เป็นสัปดาห์ถึงหลายเดือนเท่านั้น) เพราะการติดเชื้อยังคงเป็นปัญหาที่พบบ่อย
นอกเหนือจากการติดเชื้อ หลอดเลือดดำตีบก็เป็นอีกปัญหาหนึ่งที่ร้ายแรงเมื่อใช้การเข้าถึงแบบสายสวน สายสวนเป็นสิ่งแปลกปลอมในหลอดเลือดดำและมักจะกระตุ้นให้เกิดการอักเสบที่ผนังหลอดเลือดดำ ซึ่งส่งผลให้เกิดแผลเป็นและการตีบของหลอดเลือดดำที่มักจะเป็นจุดที่มีการเสียดสี อาจทำให้เกิดปัญหากับความแออัดของหลอดเลือดดำที่รุนแรงในบริเวณที่ระบายออกโดยเส้นเลือดดำและยังอาจทำลายหลอดเลือดดำและหลอดเลือดดำรั่ว มันจะไร้ประโยชน์สำหรับการเข้าถึงแบบเชื่อมหรือแบบพ่วงในภายหลัง ผู้ป่วยที่ทำการฟอกเลือดในระยะยาวจะไม่เหลือจุดการเข้าถึงอย่างสิ้นเชิง ดังนั้นนี่อาจจะเป็นปัญหาร้ายแรง
การเข้าถึงด้วยสายสวนมักจะใช้สำหรับการเข้าถึงอย่างรวดเร็วสำหรับการฟอกเลือดในทันที สำหรับการเข้าถึงแบบท่อลอดในผู้ป่วยที่มีแนวโน้มว่าจะฟื้นตัวจากภาวะไตวายเฉียบพลันและสำหรับผู้ป่วยไตวายระยะสุดท้ายที่กำลังรอคอยการเข้าถึงทางเลือกอื่นที่จะสมบูรณ์หรือผู้ที่ไม่สามารถเข้าถึงได้ด้วยทางเลือกอื่น
การเข้าถึงด้วยสายสวนมักจะเป็นที่นิยมกับผู้ป่วยเพราะสิ่งที่แนบมากับเครื่องฟอกไตไม่ต้องใช้เข็ม อย่างไรก็ตามความเสี่ยงที่ร้ายแรงของการเข้าถึงด้วยสายสวนที่ระบุไว้ข้างต้นหมายความว่าการเข้าถึงดังกล่าวควรจะมีการไตร่ตรองว่าเป็นเพียงการแก้ปัญหาระยะยาวในสถานการณ์การเข้าถึงที่สิ้นหวังมากที่สุด
การเชื่อมหลอดเลือดแดงและหลอดเลือดดำ
[แก้]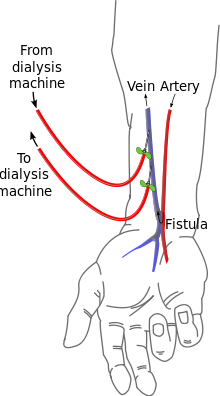

การเชื่อมหลอดเลือดแดงและหลอดเลือดดำ (AV (arteriovenous) fistulas) เป็นวิธีการเข้าถึงหลอดเลือดที่นิยมกัน ศัลยแพทย์หลอดเลือดจะเชื่อมหลอดเลือดแดงและหลอดเลือดดำเข้าด้วยกันโดยการเชื่อมประสาน (anastomosis) เนื่องจากเป็นการบายพาสเส้นเลือดฝอย เลือดจะไหลอย่างรวดเร็วผ่านจุดเชื่อมนี้ ผู้ป่วยสามารถรู้สึกได้โดยวางนิ้วของเขาบนรอยต่อนี้ เขายังสามารถฟังผ่านหูฟังซึ่งจะได้ยินเสียงของเลือดที่ไหลผ่านจุดเชื่อมนี้
จุดเชื่อมมักถูกสร้างขึ้นในแขนที่ไม่ถนัดและอาจจะอยู่ในมือ (เรียกว่า 'snuffbox') ที่แขน (เรียกว่า 'radiocephalic' หรือเรียกว่า Brescia-Cimino โดยที่หลอดเลือดแดง radial ถูกประสานกับหลอดเลือดดำศีรษะ (cephalic vein)) หรือที่ข้อศอก (ที่เรียกว่า brachiocephalic fistula ที่หลอดเลือดแดงที่แขน (brachial artery) จะถูกประสานกับหลอดเลือดดำศีรษะ (cephalic vein)) แม้ว่าจะพบได้น้อยกว่า จุดเชื่อมยังสามารถถูกสร้างขึ้นในขาหนีบ แต่ขั้นตอนการประสานอาจแตกต่างกัน ตำแหน่งในขาหนีบมักจะถูกเลือกเมื่อตำแหน่งที่แขนและมือไม่สามารถใช้ได้เนื่องจากลักษณะทางกายวิภาคหรือเนื่องจากล้มเหลวของจุดเชื่อมก่อนหน้านี้ที่ทำบนแขน / มือ จุดเชื่อมจะใช้เวลาหลายสัปดาห์ที่จะสมบูรณ์ใช้งานได้ โดยเฉลี่ยอาจจะใช้เวลา 4–6 สัปดาห์
ในระหว่างการบำบัด เข็มทั้งสองจะถูกปักลงไปในช่องจุดเชื่อม เข็มหนึ่งจะใช้ในการดึงเลือดออกมาและอีกเข็มหนึ่งจะใช้ส่งเลือดกลับไป การวางตัวของเข็มจะพืจารณาถึงการไหลปกติของเลือด้ เข็ม"เลือดแดง" จะดึงเลือดออกจากตำแหน่ง "ต้นน้ำ" ในขณะที่เข็ม "เลือดดำ"จะส่งเลือดกลับ "ท้ายน้ำ" การปักเข็มสลับกันจะนำไปสู่การรีไซเคิลบางส่วนของเลือดเดียวกันผ่านเครื่องฟอกไตทำให้การบำบัดมีประสิทธิภาพน้อยลง
ข้อดีของการเชื่อมหลอดเลือดก็คือมีอัตราการติดเชื้อต่ำ เพราะไม่มีสิ่งแปลกปลอมมาเกี่ยวข้อง อัตราการไหลเวียนของเลือดจะสูงขึ้น (ซึ่งแปลว่าการฟอกไตมีประสิทธิภาพมากขึ้น) และอัตราการเกิดลิ่มเลือดลดลง ภาวะแทรกซ้อนจะน้อยกว่าเมื่อเทียบกับวิธีการเข้าถึงแบบอื่น ๆ ถ้าจุดเชื่อมมีการไหลเวียนเลือดที่สูงมากและเส้นเลือดที่ให้เลือดส่วนที่เหลือของแขนขาทำงานไม่ดี อาจเกิดอาการที่เรียกว่า steal syndrome ขึ้นได้ นั่นคือเลือดที่ไหลเข้าแขนขาจะถูกดึงเข้าสู่จุดเชื่อมและถูกนำกลับคืนไปสู่ระบบหมุนเวียนทั่วไปโดยไม่ได้ป้อนเข้าสู่เส้นเลือดฝอยของแขนขา อาการนี้ส่งผลในแขนขาเย็น เป็นตะคริว และถ้ารุนแรงเนื้อเยื่ออาจเสียหาย ภาวะแทรกซ้อนในระยะยาวอันหนึ่งของการเชื่อม AV ก็คือการพัฒนาไปสู่ภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิต (aneurysm), การปูดในผนังของหลอดเลือดดำที่จะอ่อนแอลงเนื่องจากโดยการแทงซ้ำ ๆ กันของเข็มเมื่อเวลาผ่านไป แต่ความเสี่ยงของการพัฒนาไปสู่ภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตจะลดลงโดยการหมุนตำแหน่งเข็มอย่างระมัดระวังไปทั่ว ๆ จุดเชื่อม หรือใช้เทคนิค "รังดุม" (ตำแหน่งคงที่) ภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตอาจจำเป็นต้องมีการผ่าตัดเพื่อแก้ไขและอาจร่นอายุการใช้งานของจุดเชื่อม จุดเชื่อมยังสามารถอุดตันได้เนื่องจากการแข็งตัวของเลือดหรืออาจติดเชื้อได้ถ้าไม่ได้ปฏิบัติตามข้อระมัดระวังในการฆ่าเชื้อระหว่างการแทงเข็มในช่วงเริ่มต้นของการฟอกเลือด เนื่องจากปริมาณสูงของเลือดที่ไหลผ่านจุดเชื่อม การตกเลือดอย่างหนักอาจเกิดขึ้นได้ นี่พบมากที่สุดหลังจากการฟอกไต ต้องใส่ความดันที่หลุมเข็มเพื่อให้เกิดการแข็งตัว ถ้าความดันถูกเอาออกก่อนเวลาอันควรหรือผู้ป่วยที่เข้าร่วมในกิจกรรมทางกายภาพเร็วเกินไปหลังจากการล้างไต หลุมเข็มสามารถเปิดออกได้
เพื่อป้องกันไม่ให้เกิดความเสียหายต่อจุดเชื่อมและภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตหรือการก่อตัวของภาวะเส้นโลหิตแดงโป่งพองเป็นถุงขังโลหิตปลอม (pseudoaneurysm formation) มีข้อแนะนำว่าเข็มจะถูกแทงที่จุดแตกต่างกันในแบบหมุนเวียน อีกวิธีหนึ่งคือการฝังท่อพลาสติคเล็ก ๆ ด้วยเข็มทื่อ, ในตำแหน่งเดียวกัน วิธีการนี้เรียกว่า 'รังดุม' บ่อยครั้งที่มีรังดุมสองหรือสามที่ในจุดเชื่อมเดียว นอกจากนั้น วิธีการนี้ยังสามารถยืดอายุจุดเชื่อมและช่วยป้องกันไม่ให้เกิดความเสียหายต่อจุดเชื่อมอีกด้วย
การพ่วงหลอดเลือดดำและหลอดเลือดแดง (AV graft)
[แก้]
การพ่วงหลอดเลือดดำและหลอดเลือดแดงเป็นเหมือนการเชื่อมในหลาย ๆ ส่วน ยกเว้นแต่ว่าจะใช้หลอดเลือดเทียมในการต่อหลอดเลือดแดงเข้ากับหลอดเลือดดำ หลอดเลือดเทียมมักจะทำจากวัสดุสังเคราะห์เช่น Polytetrafluoroethylene (PTFE) แต่บางครั้งก็ใช้หลอดเลือดดำจากสัตว์ที่ผ่านการบำบัดทางเคมีและฆ่าเชื้อโรคแล้ว หลอดเลือดเทียมจะถูกใส่เข้าไปเมื่อเส้นเลือดธรรมชาติของผู้ป่วยไม่สามารถให้ทำการเชื่อมแบบ fistula ได้ หลอดเลือดเทียมสามารถพร้อมใช้งานได้เร็วกว่า fistulas และอาจจะพร้อมใช้งานเป็นเวลาไม่กี่สัปดาห์หลังจากการผ่าตัด (บางกรณีใหม่ ๆ อาจจะใช้งานได้เร็วกว่านี้) อย่างไรก็ตามการพ่วง AV มีความเสี่ยงสูงในการพัฒนาไปสู่หลอดเลือดตีบ โดยเฉพาะอย่างยิ่งในจุดที่ถัดจากแผลเย็บจากการโยงหลอดเลือดดำ การตีบมักจะนำไปสู่การเกิดลิ่มเลือด (เลือดแข็งตัว). เนื่องจากเป็นสิ่งแปลกปลอม หลอดเลือดเทียมมีความเสี่ยงมากขึ้นสำหรับการติดเชื้อ มีตัวเลือกเพิ่มเติมสำหรับตำแหน่งที่จะวางหลอดเลือดเทียมเพราะสามารถทำให้มันยาวขึ้นได้ ดังนั้นหลอดเลือดเทียมสามารถอยู่ในต้นขาหรือแม้กระทั่งที่คอ ('การโยงสร้อยคอ')
การเชื่อมโครงการแรก
[แก้]การเข้าถึงแบบ AV fistulas มีความเข้าใจง่ายและอยู่รอดมากกว่าการเข้าถึงแบบสายสวนหรือการพ่วงหลอดเลือดดำ มันยังสร้างภาวะแทรกซ้อนน้อยกว่าอีกด้วย ด้วยเหตุนี้ศูนย์การทำ Medicare และ Medicaid (CMS) ได้มีการจัดตั้งการริเริ่มการทำ fistula ครั้งแรก[6] เป้าหมายก็เพื่อเพิ่มการใช้ fistulas AV ในผู้ป่วยที่ต้องฟอกไต
มีงานวิจัยอย่างต่อเนื่องเพื่อทำให้หลอดเลือดด้วยวิธีชีววิศวกรรม ซึ่งอาจจะมีความสำคัญอันยิ่งใหญ่ในการทำ AV fistulas สำหรับผู้ป่วยในการฟอกเลือดที่ไม่มีหลอดเลือดที่ดีสำหรับการทำแม้เพียงจุดหนึ่ง มันเกี่ยวข้องกับการเลี้ยงเซลล์ที่ผลิตคอลลาเจนและโปรตีนอื่น ๆ ในหลอด micromesh ที่ย่อยสลายได้ ตามมาด้วยการกำจัดเซลล์เหล่านั้นเพื่อทำ 'หลอดเลือด' ให้สามารถจัดเก็บไว้ได้ในตู้เย็น[7]
อุปกรณ์
[แก้]ส่วนนี้ไม่มีการอ้างอิงจากเอกสารอ้างอิงหรือแหล่งข้อมูล โปรดช่วยพัฒนาส่วนนี้โดยเพิ่มแหล่งข้อมูลน่าเชื่อถือ เนื้อหาที่ไม่มีการอ้างอิงอาจถูกคัดค้านหรือนำออก |
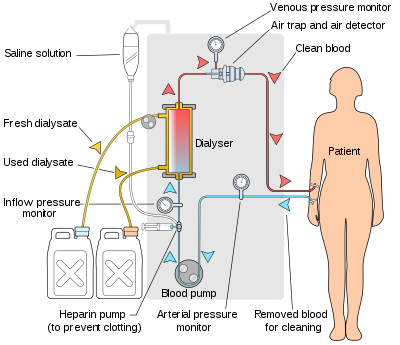
เครื่องฟอกเลือดจะปั๊มเลือดของผู้ป่วยและสารฟอก (dialysate) เข้าไปในตัวฟอก (dialyzer) เครื่องฟอกไตใหม่ล่าสุดในตลาดใช้ระบบคอมพิวเตอร์และมีการตรวจสอบอย่างต่อเนื่องของพารามิเตอร์ที่วิกฤตต่อความปลอดภัย เช่นอัตราการไหลของเลือดและสารฟอก; ความสามารถในการนำไฟฟ้า (conductivity) ของสารละลายการฟอกเลือด, อุณหภูมิและค่าพีเอช; และการวิเคราะห์สารฟอกเพื่อหาหลักฐานของการรั่วไหลของเลือดหรือการปรากฏตัวของอากาศ ค่าใด ๆ ที่อ่านได้ค่าผิดจากช่วงปกติจะสร้างเสียงแจ้งเตือนให้กับช่างเทคนิคผู้ดูแลผู้ป่วย ผู้ผลิตเครื่องฟอกไตรวมถึง บริษัท เช่น Nipro, Fresenius, Gambro แบ็กซ์เตอร์, B. Braun, NxStage และ Bellco
ระบบน้ำ
[แก้]
ระบบการทำน้ำให้บริสุทธิ์มีความสำคัญอย่างมากสำหรับการฟอกเลือด เนื่องจากผู้ป่วยที่ทำการฟอกเลือดต้องสัมผัสกับปริมาณมหาศาลของน้ำเมื่อผสมกับสารฟอกเข้มข้นเพื่อทำเป็นสารละลาย แม้เพียงเศษของสารปนเปื้อนหรือเชื้อแบคทีเรียก็สามารถเล็ดลอดเข้าสู่กระแสเลือดของผู้ป่วยได้ เนื่องจากไตเกิดความเสียหายจึงไม่สามารถปฏิบัติหน้าที่ตามวัตถุประสงค์ของการกำจัดสิ่งสกปรก ไอออนต่าง ๆ ที่เข้าสู่กระแสเลือดผ่านทางน้ำสามารถเติบโตขึ้นให้อยู่ในระดับที่เป็นอันตรายและก่อให้เกิดอาการต่าง ๆ นานาหรือเสียชีวิตได้ อะลูมิเนียม, คลอราไมน์, ฟลูออไรด์, ทองแดงและสังกะสีรวมทั้งเศษและพิษของแบคทีเรียทั้งหมดนี้สามารถก่อให้เกิดปัญหาได้
ด้วยเหตุนี้ น้ำที่ใช้ในการฟอกเลือดจะต้องทำให้บริสุทธิ์อย่างรอบคอบก่อนการใช้งาน ตอนแรกมันจะถูกกรองและปรับอุณหภูมิและค่าพีเอชจะได้รับการแก้ไขโดยการเพิ่มกรดหรือด่าง จากนั้นก็จะมีการปรับให้นุ่มลง ต่อไปน้ำจะวิ่งผ่านแทงค์ผงถ่านเพื่อดูดซับสารปนเปื้อนอินทรีย์ การทำให้บริสุทธ์ขั้นต้นก็จะทำโดยการบังคับให้น้ำไหลผ่านเมมเบรนที่มีรูขนาดเล็กมากที่เรียกว่าเมมเบรนออสโมซิสย้อนกลับ (reverse osmosis membrane) ซึ่งจะยอมให้น้ำผ่านไปได้ แต่จะขวางกั้นสิ่งเจือปนที่แม้มีจะขนาดเล็กมากเช่นอิเล็กโทรไลท์ การกำจัดขั้นตอนสุดท้ายของอิเล็กโทรไลท์ส่วนที่เหลือจะทำโดยปล่อยน้ำผ่านถังที่มีเรซินที่ทำหน้าที่แลกเปลี่ยนไอออนซึ่งไอออนลบและไอออนบวกที่เหลือจะถูกแทนที่ด้วยโมเลกุลของไฮดรอกซิลและไฮโดรเจนตามลำดับ สิ่งที่ได้คิอน้ำบริสุทธิ์ยิ่งยวด
แม้ว่าระดับความบริสุทธิ์ของน้ำนี้อาจจะไม่เพียงพอ แนวโน้มเมื่อเร็ว ๆ นี้คือการข้ามขั้นตอนการทำน้ำให้บริสุทธิ์ขั้นสุดท้าย (หลังจากผสมกับสารฟอกเลือดเข้มข้น) โดยใช้เมมเบรนที่เป็นตัวฟอกในตัว (dialyzer membrane) ซึ่งนี้จะเป็นอีกขั้นหนึ่งของการป้องกันโดยการเอาสิ่งสกปรกออก, โดยเฉพาะอย่างยิ่งสิ่งที่เป็นแหล่งกำเนิดของเชื้อแบคทีเรียที่อาจมีการสะสมในน้ำหลังจากไหลผ่านระบบทำน้ำให้บริสุทธิ์เดิม
เมื่อน้ำบริสุทธิ์ผสมกับสารฟอกเลิอดเข้มข้น ความนำไฟฟ้าของน้ำจะเพิ่มขึ้นเนื่องจากน้ำที่มีประจุไอออนจะนำไฟฟ้าได้ดี ในระหว่างการฟอกเลือด การนำไฟฟ้าของสารละลายการฟอกเลือดจะถูกตรวจสอบอย่างต่อเนื่องเพื่อให้แน่ใจว่าน้ำและสารฟอกเลือดเข้มข้นทำการผสมกันในสัดส่วนที่เหมาะสม ถ้าสารละลายการฟอกเลือดมีความเข้มข้นมากเกินไปหรือเจือจางมากเกินไปอาจทำให้เกิดปัญหาทางคลินิกที่รุนแรง
ตัวฟอกเลือด
[แก้]ตัวฟอกเลือด (dialyzer) เป็นอุปกรณ์ในเครื่องฟอกเลือดที่ทำการกรองเลือดจริง ๆ เกือบทั้งหมดที่ใช้อยู่ในปัจจุบันเป็นแแบบไฟเบอร์กลวงมัดเป็นรูปทรงกระบอกที่มีผนังเป็นเยื่อกึ่งน้ำซึมได้ (semi-permeable membrane) วางอยู่ที่ปลายแต่ละด้านของทรงกระบอกประกอบกันเป็นอุปกรณ์คล้ายกะเปาะ (ด้วยกาวชนิดหนึ่ง) จากนั้นอุปกรณ๋นี้จะถูกใส่ลงไปในกระบอกพลาสติกใสที่มีช่องเปิดสี่ช่อง สองช่องเปิดจะเป็นพอร์ตเลือดอยู่ที่แต่ละปลายของกระบอกซึ่งจะสื่อสารกับแต่ละปลายของมัดเส้นใยกลวง ซึ่งจะใช้เป็น "ช่องเลือด" ของตัวฟอก อีกสองพอร์ตจะถูกตัดเข้าด้านข้างของกระบอกซึ่งจะสื่อสารกับช่องว่างรอบเส้นใยกลวงที่เรียกว่า "ช่องสารฟอก" (dialysate compartment) เลือดจะสูบผ่านทางมัดของหลอดบางมาก ๆ ที่มีรูปร่างเหมือนเส้นเลือดฝอย และสารฟอกจะถูกสูบผ่านที่ว่างรอบเส้นใย ความดันไล่ระดับถูกใส่เข้าไปเมื่อจะย้ายของเหลวจากเลือดไปยังช่องสารฟอก
เยื่อกรองและฟลักซ์
[แก้]เยื่อกรองในตัวฟอกเลือดจะมีรูพรุนขนาดเล็กหลายขนาด รูพรุนที่มีขนาดเล็กเรียกว่า "ฟลักซ์ต่ำ" และรูพรุนที่มีขนาดใหญ่เรียกว่า "ฟลักซ์สูง" โมเลกุลขนาดใหญ่เช่นเบต้า-2-microglobulin ไม่ถูกลบออกเลยเมื่อใช้ตัวฟอกแบบฟลักซ์ต่ำ; ล่าสุดมีแนวโน้มที่จะใช้ตัวฟอกแบบฟลักซ์สูง อย่างไรก็ตาม ตัวฟอกดังกล่าวต้องการเครื่องฟอกไตสมัยใหม่ที่มีสารละลายฟอกเลือดคุณภาพสูงเพื่อควบคุมอัตราการกำจัดของเหลวอย่างเหมาะสมและเพื่อป้องกันสิ่งสกปรกจากสารละลายการฟอกไตที่อาจไหลกลับผ่านเยื่อกรองเข้าไปในผู้ป่วยได้
เยื่อกรองในตัวฟอกเลือดเคยทำจากเซลลูโลสเป็นหลัก (มาจากผ้าฝ้าย) พื้นผิวของเยื่อดังกล่าวไม่ใช่วัสดุชีวะ (biocompatible) อย่างมากเพราะกลุ่มไฮดรอกซิลที่ผ่านการสัมผัสแล้วจะเปิดใช้งานระบบเสริมให้กับเลือดที่กำลังผ่านเยิ่อกรอง ดังนั้นเยื่อเซลลูโลส "ที่ไม่ได้ทดแทน" ขั้นพื้นฐานได้มีการปรับเปลี่ยน หนึ่งในการเปลี่ยนแปลงนั้นก็เพื่อจะห่อหุ้มกลุ่มไฮดรอกซิลเหล่านี้ด้วยกลุ่มแอซิเตต (เซลลูโลสแอซิเตต); อีกการเปลี่ยนแปลงหนึ่งคือเพื่อผสมในสารบางอย่างที่จะยับยั้งการเปิดใช้งานระบบเสริมที่พื้นผิวของเยื่อกรอง(เซลลูโลสที่ผ่านการปรับเปลี่ยน) เยื่อกรอง "เซลลูโลสที่ไม่ถูกแทนที่" ต้นฉบับไม่ได้มีการใช้อย่างกว้างขวางอีกต่อไปในขณะที่เซลลูโลสแอซิเตตและตัวฟอกเลือดที่ทำจากเซลลูโลสที่ผ่านการดัดแปลงยังคงมีการใช้งาน เยื่อกรองแบบเซลลูโลสสามารถทำให้เป็นแบบฟลักซ์ต่ำหรือฟลักซ์สูงได้ขึ้นอยู่กับขนาดรูพรุนของมัน
อีกกลุ่มของเยื่อกรองจะทำจากวัสดุสังเคราะห์โดยใช้สารโพลีเมอร์ เช่น polyarylethersulfone, polyamide, polyvinylpyrrolidone, โพลีคาร์บอเนต, และ polyacrylonitrile เยื่อกรองสังเคราะห์เหล่านี้เปิดใช้งานระบบเสริมในระดับที่น้อยกว่าเยื่อกรองเซลลูโลสที่ไม่ถูกแทนที่ เยื่อกรองสังเคราะห์สามารถทำเป็นแบบฟลักซ์ต่ำหรือฟลักซ์สูงได้ แต่ส่วนใหญ่จะเป็นแบบฟลักซ์สูง
นาโนเทคโนโลยีจะถูกใช้ในบางกรณีของเยื่อกรองแบบฟลักซ์สูงล่าสุดเพิ่อสร้างขนาดรูที่มีขนาดเดียว เป้าหมายของเยื่อกรองฟลักซ์สูงคือการให้ผ่านโมเลกุลที่ค่อนข้างใหญ่ เช่นเบต้า-2-ไมโครกลอบูลิน (MW 11,600 ดาลตัน) แต่ไม่ให้ผ่านอัลบูมิน (MW ~66,400 ดาลตัน) ทุกเยื่อกรองจะมีรูพรุนในช่วงขนาดหนึ่ง เมื่อขนาดรูพรุนเพิ่มขึ้น บางตัวกรองแบบฟลักซ์สูงเริ่มที่จะยอมให้อัลบูมินผ่านออกจากเลือดเข้าสู่ตัวฟอก นี่คือกรณีที่ไม่พึงประสงค์ ถึงแม้ว่าบางแนวคิดถือว่าการเอาอัลบูมินออกบ้างอาจจะเป็นประโยชน์ในแง่ของการเอาสารพิษที่มีโปรตีนออก (protein-bound uremic toxins)
ฟลักซ์ของเยื่อกรองและผลลัพธ์
[แก้]การใช้ตัวฟอกแบบฟลักซ์สูงจะช่วยเพิ่มผลลัพธ์ในการรักษาให้กับผู้ป่วยหรือไม่ยังเป็นที่ถกเถียงกันอยู่บ้าง แต่การศึกษาที่สำคัญหลายครั้งบอกว่ามันมีประโยชน์ทางคลินิก การทดสอบการฟอกโดยการอุดหนุนทางการเงินจาก NIH ได้เปรียบเทียบการรอดชีวืตและการรักษาในโรงพยาบาลของผู้ป่วยล้างไตแบบสุ่มเมื่อใช้เยื่อกรองทั้งแบบฟลักซ์ต่ำหรือแบบฟลักซ์สูง แม้ว่าผลลัพธ์เบื้องต้น (ทุกสาเหตุการตาย) ไม่ถึงจุดทางสถิติที่มีนัยสำคัญในกลุ่มสุ่มที่ใช้เยื่อกรองแบบฟลักซ์สูง ผลลัพธ์รองหลายตัวจะดีกว่าในกลุ่มฟลักซ์สูง[8][9] การวิเคราะห์ของ Cochrane ที่ผ่านมาได้ข้อสรุปว่า การเลือกเยื่อกรองมีผลลลัพธ์ที่ยังไม่ได้แสดงให้เห็นประโยชน์[10] การทดลองแบบสุ่มด้วยความร่วมมือจากยุโรปที่เรียกว่า การศึกษา MPO (Membrane Permeabilities Outcomes)[11] เป็นการเปรียบเทียบอัตราการเสียชีวิตในผู้ป่วยที่เพิ่งเริ่มต้นล้างไตโดยใช้เยื่อกรองฟลักซ์สูงหรือฟลักซ์ต่ำ ได้พบแนวโน้มที่ไม่มีนัยสำคัญสำหรับการอยู่รอดที่ดีขึ้นในผู้ป่วยที่ใช้เยื่อกรองแบบฟลักซ์สูงและอัตราการรอดชีวิตในผู้ป่วยที่มีระดับแอลบูมินในซีรั่มที่ต่ำกว่าหรือในผู้ป่วยไดที่มาจากโรคเบาหวาน
ฟลักซ์ของเยื่อกรองและเบต้า 2 microglobulin amyloidosis
[แก้]นอกจากนี้เยื่อกรองสำหรับฟอกเลือดที่มีฟลักซ์สูงและ / หรือการฟอกเลือดแบบออนไลน์ไม่สม่ำเสมอ (intermittent on-line hemodiafiltration (IHDF)) ยังอาจจะเป็นประโยชน์ในการลดภาวะแทรกซ้อนของการสะสมเบต้า 2 microglobulin เนื่องจากเบต้า-2-microglobulin เป็นโมเลกุลขนาดใหญ่ที่มีน้ำหนักโมเลกุลประมาณ 11,600 ดาลตัน มันจึงไม่ผ่านเยื่อกรองฟอกเลือดแบบฟลักซ์ต่ำเลย Beta-2-M จะถูกกรองออกด้วยตัวฟอกเลือดฟลักซสูง และจะถูกกรองออกได้อย่างมีประสิทธิภาพมากยิ่งกว่าด้วย IHDF หลังจากหลายปี (โดยปกติอย่างน้อย 5–7 ปี) ่ของการสะสมของเบต้า-2-M ผู้ป่วยฟอกเลือดเริ่มที่จะพัฒนาภาวะแทรกซ้อน ได้แก่โรคอุโมงค์ carpal, ซีสต์ของกระดูก และการสะสมของ amyloid นี้ในข้อต่อและเนื้อเยื่ออื่น ๆ Beta-2-M amyloidosis สามารถทำให้เกิดภาวะแทรกซ้อนที่รุนแรงมากรวมทั้ง spondyloarthropathy และมักจะมีความเกี่ยวข้องกับปัญหาข้อต่อที่หัวไหล่ การศึกษาแบบสังเกตการณ์จากยุโรปและญี่ปุ่นได้แนะนำว่าการใช้เยื่อกรองฟลักซ์สูงในโหมดการฟอกเลือดหรือ IHDF ช่วยลดภาวะแทรกซ้อนจากเบต้า-2-M ในการเปรียบเทียบกับการฟอกเลือดปกติโดยใช้เยื่อกรองฟลักซ์ต่ำ[12][13][14][15][16]
ขนาดและประสิทธิภาพของตัวกรอง
[แก้]ตัวกรองมีหลายขนาดที่แตกต่างกันมาก ตัวกรองขนาดใหญ่มีพื้นที่เยื่อกรอง (A) ขนาดใหญ่เพื่อกรองสารละลายที่ใหญ่กว่า โดยเฉพาะอย่างยิ่งที่อัตราการไหลของเลือดสูง นอกจากนี้ยังขึ้นอยู่กับสัมประสิทธิ์การซึมผ่าน K0 ของเยื่อกรองสำหรับตัวทำละลายนั้น ๆ ดังนั้นประสิทธิภาพของตัวฟอกมักจะแสดงค่าเป็น K0A หรือผลคูณของค่าสัมประสิทธิ์การซึมผ่านกับพื้นที่ของเยื่อกรอง ตัวกรองส่วนใหญ่จะมีพื้นที่ผิวของเยื่อกรองอยู่ที่ 0.8–2.2 ตารางเมตรและค่าของ K0A อยู่ที่ตั้งแต่ประมาณ 500–1,500 มิลลิลิตร/นาที ค่าของ K0A อยู่ในรูปมิลลิลิตร/นาทีสามารถจะคิดว่าเป็นระยะห่างสูงสุดของตัวกรองที่อัตราการไหลของเลือดและสารฟอกที่สูงมาก
การใช้ตัวฟอกซ้ำ
[แก้]ตัวฟอกอาจจะถูกนำไปทิ้งหลังการบำบัดในแต่ละครั้งหรือถูกนำกลับมาใช้ใหม่ การนำมาใช้ใหม่ต้องมีขั้นตอนที่กว้างขวางของการฆ่าเชื้อโรคในระดับที่สูง ตัวกรองที่นำกลับมาใช้ใหม่ไม่ควรนำมาใช้ร่วมกับผู้ป่วยรายอื่น มีความขัดแย้งแต่แรกเกี่ยวกับว่าการนำตัวฟอกมาใช้ใหม่จะทำให้ผู้ป่วยได้ผลลัพธ์แย่ลงกว่าเดิมหรือไม่ ฉันทามติในวันนี้คือการนำตัวฟอกกลับมาใช้ใหม่ถ้าทำอย่างรอบคอบและถูกต้องจะก่อให้เกิดผลลัพธ์ที่คล้ายกับการใช้งานตัวฟอกแบบใช้แล้วทิ้ง[17]
การนำตัวฟอกกลับมาใช้ใหม่ได้มีการปฏิบัติกันมาตั้งแต่มีการประดิษฐ์ตัวฟอก การปฏิบัตินี้รวมถึงการทำความสะอาดตัวฟอกใช้แล้วเพื่อนำกลับมาใช้กับผู้ป่วยรายเดิมอีกหลายครั้ง คลินิกฟอกไตจะนำตัวฟอกกลับมาใช้ใหม่เพื่อความประหยัดและลดค่าใช้จ่าย เพราะการใช้ "แบบครั้งเดียวทิ้ง" อาจมีราคาแพงและสิ้นเปลืองอย่างมาก ตัวฟอกที่มีการใช้เพียงครั้งเดียวแล้วโยนทิ้งจะสร้างของเสียชีวภาพทางการแพทย์เป็นจำนวนมากโดยไม่มีการประหยัดค่าใช้จ่าย ถ้าทำถูกต้อง ตัวฟอกที่นำกลับมาใช้ใหม่จะปลอดภัยมากสำหรับผู้ป่วยล้างไต
มีสองวิธีในการนำตัวฟอกกลับมาใช้ใหม่ คือแบบทำด้วยมือกับแบบอัตโนมัติ การนำกลับมาใช้ใหม่ด้วยมือจะเกี่ยวกับการทำความสะอาดตัวฟอกด้วยมือ ตัวฟอกเป็นแบบกึ่งถอดได้แล้วถ่ายทิ้งซ้ำแล้วซ้ำอีกก่อนที่จะถูกล้างด้วยน้ำ หลังจากนั้นมันจะถูกเก็บไว้ร่วมกับยาฆ่าเชื้อแบบของเหลว (PAA) เป็นเวลากว่า 18 ชั่วโมงก่อนจะนำมาใช้งานครั้งต่อไป แม้ว่าหลายคลินิกนอกสหรัฐอเมริกาจะใช้วิธีการนี ้คลินิกบางแห่งจะเปลี่ยนไปใช้กระบวนการที่อัตโนมัติ/คล่องตัวมากขึ้นตามความก้าวหน้าของการปฏิบัติการฟอกไต กระบวนการใหม่ของการใช้ซ้ำแบบอัตโนมัติจะทำโดยวิธีการของอุปกรณ์ทางการแพทย์ซึ่งเริ่มขึ้นในช่วงต้นทศวรรษ 1980 อุปกรณ์เหล่านี้มีประโยชน์ต่อคลินิกฟอกไตที่นำมาใช้ในการปฏิบัติ - โดยเฉพาะอย่างยิ่งสำหรับหน่วยงานทางคลินิกฟอกไตขนาดใหญ่ - เพราะอุปกรณ์ยอมให้มีวงรอบการทำงานต่อวันได้หลายรอบ ตอนแรกตัวฟอกจะถูกทำความสะอาดล่วงหน้าโดยช่างเทคนิค จากนั้นการความสะอาดจะทำโดยอัตโนมัติผ่านกระบวนการเป็นขั้นเป็นตอนเป็นรอบจนในที่สุดมันก็จะถูกเติมเต็มด้วยยาฆ่าเชื้อของเหลวในการจัดเก็บ แม้ว่าการนำมาใช้ใหม่โดยอัตโนมัติจะมีประสิทธิภาพมากกว่าการนำมาใช้ใหม่ด้วยมือ เทคโนโลยีใหม่ได้ก่อให้เกิดความก้าวหน้ามากยิ่งขึ้นในกระบวนการของการที่นำมาใช้ เมื่อนำกลับมาใช้มากกว่า 15 ครั้งด้วยวิธีการปัจจุบัน ตัวฟอกอาจสูญเสีย B2M, โมเลกุลขนาดกลางและความสมบูรณ์ของโครงสร้างรูพรุนของเส้นใย ซึ่งมีศักยภาพในการลดประสิทธิภาพของเซสชั่นการฟอกเลือดของผู้ป่วย ในขณะนี้คือปี ค.ศ. 2010 เทคโนโลยีใหม่และการประมวลผลที่สูงขึ้นได้พิสูจน์ความสามารถในการกำจัดขั้นตอนการทำความสะอาด่วงหน้าโดยสิ้นเชิงและยังได้พิสูจน์แล้วว่ามีศักยภาพในการฟื้นฟูฟังก์ชันใหม่ทั้งหมด (เรียกคืนอย่างเต็มที่) ของตัวฟอกให้อยู่ในระดับที่ประมาณเทียบเท่ากับการ ใช้ครั้งเดียวทิ้งมากกว่า 30 รอบ[18] เนื่องจากอัตราการเบิกเงินคืนจากค่าใช้จ่ายทางการแพทย์เริ่มลดลงมากยิ่งขึ้น, คลินิกฟอกไตจำนวนมากได้มีการดำเนินงานอย่างมีประสิทธิภาพอย่างต่อเนื่องด้วยโปรแกรมที่นำกลับมาใช้ใหม่โดยเฉพาะอย่างยิ่งเนื่องจากกระบวนการมีความง่ายและคล่องตัวมากขึ้นกว่าแต่ก่อน
การดูแลรักษาพยาบาลสำหรับผู้ป่วยฟอกเลือด
[แก้]
ปรับจากคำแนะนำเพื่อปฏิบัติการพยาบาลด้านวักกวิทยา(เกี่ยวกับไต)ที่พัฒนาโดยสมาคมโรคไตและเทคโนโลยีแคนาดา (CANNT) ตามหลักฐานและแนวทางปฏิบัติที่มีที่ดีที่สุดทางคลินิกพยาบาลโรคไต ควรดำเนินการดังนี้[19]
การเข้าถึงหลอดเลือดเพื่อการฟอกเลือด: ทำการประเมินจุดเชื่อมต่อ/จุดพ่วงหลอดเลือดและแขนก่อนหน้า และหลังการฟอกเลือดแต่ละครั้งหรือทุกกะ: การไหลเข้าออกช่องผ่าน ภาวะแทรกซ้อน ประเมินภาวะแทรกซ้อนของการใส่สายสวนหลอดเลือดดำส่วนกลาง: ตำแหน่งปลายเจาะ, แต่ละปลาย เอกสารประกอบภาวะแทรกซ้อนและแจ้งให้ผู้ให้บริการดูแลสุขภาพที่เหมาะสมเกี่ยวกับความกังวลใด ๆ ให้ความรู้แก่ผู้ป่วยที่มีการทำความสะอาดที่เหมาะสมของจุดเชื่อม/จุดพ่วง และตำแหน่งขาออก; กับการรับรู้และการรายงานอาการของการติดเชื้อและภาวะแทรกซ้อน
ความเพียงพอในการฟอกเลือด: ประเมินผู้ป่วยอย่างต่อเนื่องสำหรับอาการของการฟอกเลือดที่ไม่เพียงพอ ประเมินสาเหตุของการฟอกเลือดที่ไม่เพียงพอ ให้ความรู้แก่ผู้ป่วยเกี่ยวกับความสำคัญของการได้รับการฟอกไตที่เพียงพอ
การบำบัดและภาวะแทรกซ้อนของการฟอกเลือด: ดำเนินการประเมินทางกายภาพตั้งแต่หัวจรดเท้าก่อน ระหว่างและหลังการฟอกเลือดเพื่อหาภาวะแทรกซ้อนที่เกี่ยวข้องและความปลอดภัยของการเข้าถึงหลอดเลือด ยืนยันและส่งมอบใบสั่งแพทย์เพื่อการฟอกเลือดหลังจากการทบทวนผลการทดลองล่าสุด ให้ความเห็นถึงความกังวลใด ๆ ของผู้ป่วยและให้ความรู้แก่ผู้ป่วยเมื่อเห็นช่องว่างการพัฒนา
การบริหารจัดการด้านการแพทย์และการปฏิบัติเพื่อควบคุมการติดเชื้อ: ทำงานร่วมกับผู้ป่วยเพื่อพัฒนาระบบการให้การรักษา ปฏิบัติตามแนวทางควบคุมการติดเชื้อตามหลักปฏิบัติ
ระบาดวิทยา
[แก้]การฟอกเลือดเป็นหนึ่งในขั้นตอนการดำเนินการที่ธรรมดาที่สุดในโรงพยาบาลของสหรัฐในปี ค.ศ. 2011 เกิดขึ้นในการเข้าพักในรพ. 909,000 ราย (อัตราการเข้าพัก 29 ต่อประชากร 10,000) เพิ่มขึ้นร้อยละ 68 จากปี ค.ศ. 1997 เมื่อมีการเข้าพักเพียง 473,000 รายในขณะนั้น การฟอกเลือดเป็นขั้นตอนลำดับที่ห้าที่พบมากที่สุดสำหรับผู้ป่วยที่อายุ 45–64 ปี[20]
อ้างอิง
[แก้]- ↑ "Kidney Failure: Choosing a Treatment That's Right for You". National Kidney and Urologic Diseases Information Clearinghouse guidance. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 16 กันยายน 2010.
- ↑ Kishimoto TK, Viswanathan K, Ganguly T, และคณะ (2008). "Contaminated heparin associated with adverse clinical events and activation of the contact system". N Engl J Med. 358 (23): 2457–67. doi:10.1056/NEJMoa0803200. PMC 3778681. PMID 18434646.
- ↑ "Effects of short daily versus conventional hemodialysis on left ventricular hypertrophy and inflammatory markers: a prospective, controlled study". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2 มกราคม 2008. สืบค้นเมื่อ 23 พฤษภาคม 2015.
- ↑ Weinreich T, De los Ríos T, Gauly A, Passlick-Deetjen J (2006). "Effects of an increase in time vs. frequency on cardiovascular parameters in chronic hemodialysis patients". Clin. Nephrol. 6 (6): 433–9. PMID 17176915.
- ↑ Kallenbach Judith Z. (2005). Review of hemodialysis for nurses and dialysis personnel (7th ed.). St. Louis, Missouri: Elsevier Mosby. ASIN B008AUE9NG.
- ↑ "Fistula First Initiative". 2009. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 10 มิถุนายน 2015. สืบค้นเมื่อ 26 พฤษภาคม 2015.
{{cite web}}: CS1 maint: bot: original URL status unknown (ลิงก์) - ↑ Seppa, Nathan (2 กุมภาพันธ์ 2011). "Bioengineering Better Blood Vessels". Science News. สืบค้นเมื่อ 4 กุมภาพันธ์ 2011.
- ↑ Eknoyan G, Beck GJ, Cheung AK, และคณะ (2002). "Effect of dialysis dose and membrane flux in maintenance hemodialysis". N. Engl. J. Med. 347 (25): 2010–9. doi:10.1056/NEJMoa021583. PMID 12490682.
- ↑ Cheung AK, Levin NW, Greene T, และคณะ (2003). "Effects of high-flux hemodialysis on clinical outcomes: results of the HEMO study". J. Am. Soc. Nephrol. 14 (12): 3251–63. doi:10.1097/01.ASN.0000096373.13406.94. PMID 14638924.
- ↑ Macleod AM, Campbell M, Cody JD, และคณะ (2005). MacLeod AM (บ.ก.). "Cellulose, modified cellulose and synthetic membranes in the haemodialysis of patients with end-stage renal disease". Cochrane Database Syst Rev (3): CD003234. doi:10.1002/14651858.CD003234.pub2. PMID 16034894.
- ↑ Locatelli F, Martin-Malo A, Hannedouche T, และคณะ (2009). "Effect of Membrane Permeability on Survival of Hemodialysis Patients". J Am Soc Nephrol. 20 (3): 645–54. doi:10.1681/ASN.2008060590. PMC 2653681. PMID 19092122.
- ↑ van Ypersele de Strihou C, Jadoul M, Malghem J, Maldague B, Jamart J (1991). "Effect of dialysis membrane and patient's age on signs of dialysis-related amyloidosis. The Working Party on Dialysis Amyloidosis". Kidney Int. 39 (5): 1012–9. doi:10.1038/ki.1991.128. PMID 2067196.
- ↑ "KDOQI Clinical Practice Guidelines for Hemodialysis Adequacy, 2006 Updates. CPR 5". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 30 มิถุนายน 2007. สืบค้นเมื่อ 2 มิถุนายน 2015.
- ↑ Küchle C, Fricke H, Held E, Schiffl H (1996). "High-flux hemodialysis postpones clinical manifestation of dialysis-related amyloidosis". Am. J. Nephrol. 16 (6): 484–8. doi:10.1159/000169048. PMID 8955759.
- ↑ Koda Y, Nishi S, Miyazaki S, และคณะ (1997). "Switch from conventional to high-flux membrane reduces the risk of carpal tunnel syndrome and mortality of hemodialysis patients". Kidney Int. 52 (4): 1096–101. doi:10.1038/ki.1997.434. PMID 9328951.
- ↑ Locatelli F, Mastrangelo F, Redaelli B, และคณะ (1996). "Effects of different membranes and dialysis technologies on patient treatment tolerance and nutritional parameters. The Italian Cooperative Dialysis Study Group". Kidney Int. 50 (4): 1293–302. doi:10.1038/ki.1996.441. PMID 8887291.
- ↑ "Clinical Practice Recommendation 5: Dialyzer membranes and reuse". KDOQI Clinical Practice Guidelines for Hemodialysis Adequacy, 2006 Updates. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 30 มิถุนายน 2007.
- ↑ Eduardo Lacson, Jr.; J. Michael Lazarus. "Dialyzer Best Practice: Single Use or Reuse?" (PDF). Unresolved Issues in Dialysis. Lexington, MA: Fresenius Medical Care–North America. pp. 120–128.
- ↑ "Canadian Association of Nephrology Nurses and Technologist Nephrology Nursing Standards and Practice Recommendations" (PDF). Canadian Association of Nephrology Nurses and Technologists. 2008. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2010-03-31. สืบค้นเมื่อ 2015-06-03.
- ↑ Pfuntner A, Wier LM, Stocks C (ตุลาคม 2013). "Most Frequent Procedures Performed in U.S. Hospitals, 2011". Healthcare Cost and Utilization Project (HCUP) Statistical Brief #165. Rockville, MD: Agency for Healthcare Research and Quality. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 24 ตุลาคม 2013.
แหล่งข้อมูลอื่น
[แก้]- Your Kidneys and How They Work – (American) National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), สถาบันสุขภาพแห่งชาติสหรัฐ.
- Treatment Methods for Kidney Failure – (American) National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK), สถาบันสุขภาพแห่งชาติสหรัฐ.
- Treatment Methods for Kidney Failure: Hemodialysis – (American) National Kidney and Urologic Diseases Information Clearinghouse, สถาบันสุขภาพแห่งชาติสหรัฐ.
