กรดคลอริก
| |

| |
| ชื่อ | |
|---|---|
| ชื่ออื่น
Chloric(V) acid
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.029.303 |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
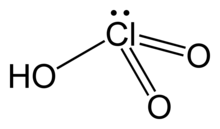
| HClO3 | |
| มวลโมเลกุล | 84.45914 g mol−1 |
| ลักษณะทางกายภาพ | สารละลายไม่มีสี (ใส) |
| ความหนาแน่น | 1 g/ml, สารละลาย (ค่าประมาณ) |
| >40 g/100 ml (20 °C) | |
| pKa | ประมาณ −1 |
| โครงสร้าง | |
| ทรงพีระมิด | |
| ความอันตราย | |
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |
อันตรายหลัก
|
ตัวออกซิไดซ์, สารกัดกร่อน |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
แอนไอออนอื่น ๆ
|
กรดโบรมิก กรดไอโอดิก |
แคทไอออนอื่น ๆ
|
แอมโมเนียมคลอเรต โซเดียมคลอเรต โพแทสเซียมคลอเรต |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
กรดคลอริก (อังกฤษ: Chloric acid) มีสูตรเคมีว่า HClO3 เป็นกรดออกโซ (กรดที่ประกอบด้วยธาตุออกซิเจน) ของคลอรีน และถือว่าเป็นสารประกอบเกลือคลอเรตตัวแรกในลำดับที่กำหนดไว้อย่างเป็นทางการ กรดคลอริกเป็นกรดแก่ มีค่าคงที่สมดุลของกรด (pKa) ประมาณ −1 และยังเป็นตัวรับอิเล็กตรอน (oxidant) อีกด้วย
การเตรียม[แก้]
กรดคลอริกเตรียมได้จากการนำกรดกำมะถันทำปฏิกิริยากับแบเรียมคลอเรต จะทำให้เกิดกรดคลอริกและตะกอนแบเรียมซัลเฟต เขียนเป็นสมการเคมีได้ดังนี้
หรืออาจเตรียมได้โดยการให้ความร้อนแก่กรดไฮโปคลอรัส ซึ่งจะได้ผลิตภัณฑ์เป็นกรดคลอริกพร้อมกับไฮโดรเจนคลอไรด์ เขียนเป็นสมการเคมีดังนี้
อ้างอิง[แก้]
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. ISBN 0-080-37941-9.
- R. Bruce King, ed. (1994). "Chloric acid". Encyclopedia of Inorganic Chemistry. 2. Chichester: Wiley. หน้า 658. ISBN 0-471-93620-0.


