เซลล์ต้นกำเนิด
บทความนี้ยังต้องการเพิ่มแหล่งอ้างอิงเพื่อพิสูจน์ความถูกต้อง |
| เซลล์ต้นกำเนิด | |
|---|---|
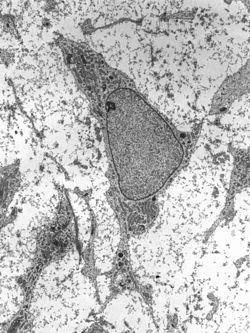 ลักษณะโครงสร้างดูจากกล้องจุลทรรศน์อิเล็กตรอนทั่วไปของเซลล์ต้นกำเนิดเต็มวัย | |
| รายละเอียด | |
| ตัวระบุ | |
| ภาษาละติน | Cellula praecursoria |
| MeSH | D013234 |
| TH | H1.00.01.0.00028, H2.00.01.0.00001 |
| FMA | 63368 |
| อภิธานศัพท์กายวิภาคศาสตร์ | |
เซลล์ต้นกำเนิด หรือ เซลล์ต้นตอ (อังกฤษ: stem cell) เป็นเซลล์ไม่จำเพาะซึ่งสามารถเจริญ (differentiate) ไปเป็นเซลล์ที่ทำหน้าที่เฉพาะและสามารถแบ่งตัวแบบไมโทซิสเพื่อสร้างเซลล์ต้นกำเนิดเพิ่มได้ เซลล์ต้นกำเนิดพบในสิ่งมีชีวิตหลายเซลล์ ในสัตว์เลี้ยงลูกด้วยนม แบ่งเซลล์ต้นกำเนิดออกกว้าง ๆ ได้เป็นสองชนิด คือ เซลล์ต้นกำเนิดจากตัวอ่อน (embryonic stem cell) ซึ่งแยกจากมวลเซลล์ชั้นในของตัวอ่อนระยะบลาสโตซิสท์ (blastocyst) และเซลล์ต้นกำเนิดเต็มวัย (adult stem cell) ซึ่งพบในเนื้อเยื่อหลายชนิด ในสิ่งมีชีวิตเต็มวัย เซลล์ต้นกำเนิดและโปรเจนิเตอร์เซลล์ (progenitor cell) ทำหน้าที่เป็นระบบซ่อมแซมของร่างกาย โดยทดแทนเนื้อเยื่อเต็มวัย ในตัวอ่อนที่กำลังเจริญ เซลล์ต้นกำเนิดสามารถเจริญไปเป็นเซลล์ที่ทำหน้าที่เฉพาะได้ทุกชนิด ทั้งเอ็กโทเดิร์ม เอ็นโดเดิร์มและเมโซเดิร์ม ทว่า ยังคงการหมุนเวียนปกติของอวัยวะที่สร้างใหม่ได้ (normal turnover of regenerative organ) เช่น เลือด ผิวหนังและเนื้อเยื่อลำไส้ได้อีกด้วย
แหล่งที่เข้าถึงได้ของเซลล์ต้นกำเนิดเต็มวัยตัวเอง (autologous) ในมนุษย์มีสามแหล่ง คือ
- ไขกระดูก ซึ่งต้องอาศัยการสกัดโดยการเก็บ นั่นคือ การเจาะเข้าไปในกระดูก (มักเป็นกระดูกต้นขาหรือสันกระดูกปีกสะโพก)
- เซลล์ไขมัน ซึ่งอาศัยการสกัดโดยการดูดไขมัน และ
- เลือด ซึ่งอาศัยการสกัดโดยการเจาะเอาเฉพาะส่วนประกอบหนึ่งของเลือด (apheresis) คือ เป็นการดึงเลือดจากผู้บริจาค (ทำนองเดียวกับการบริจาคเลือด) และผ่านเข้าเครื่องซึ่งแยกเซลล์ต้นกำเนิดและคืนเลือดส่วนอื่นคืนให้ผู้บริจาค
เซลล์ต้นกำเนิดยังได้มาจากเลือดสายสะดือไม่นานหลังคลอด ในบรรดาเซลล์ต้นกำเนิดทุกชนิด การเก็บจากตัวเองมีความเสี่ยงน้อยที่สุด ตามนิยาม คือ เก็บเซลล์จากร่างกายของตนเอง แบบเดียวกับที่เก็บสำรองเลือดของตนไว้ตามกระบวนการผ่าตัดแบบไม่เร่งด่วน
เซลล์ต้นกำเนิดเต็มวัยใช้ในการรักษาทางการแพทย์บ่อยครั้ง ตัวอย่างเช่นในการปลูกถ่ายไขกระดูก ปัจจุบัน มนุษย์สามารถเพาะเลี้ยงเซลล์ต้นกำเนิดได้และให้เจริญเปลี่ยนเป็นเซลล์ที่ทำหน้าที่เฉพาะโดยมีคุณสมบัติเข้ากันกับเซลล์ของเนื้อเยื่อหลายชนิด อย่างกล้ามเนื้อหรือเส้นประสาท มีการเสนอว่าเซลล์ไลน์ตัวอ่อนและเซลล์ต้นกำเนิดตัวอ่อนของตนเองที่ถูกสร้างผ่านการโคลนเพื่อการรักษาเป็นทางเลือกที่มีโอกาสสำหรับการรักษาในอนาคต[1] การวิจัยเรื่องเซลล์ต้นกำเนิดมีที่มาจากการค้นพบโดย Ernest A. McCulloch และ James E. Till แห่งมหาวิทยาลัยโตรอนโตในคริสต์ทศวรรษ 1960[2][3]
ประเภท[แก้]
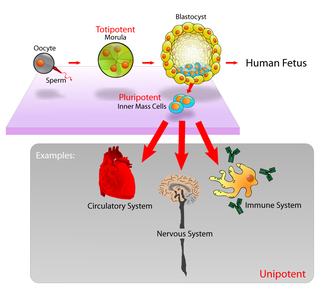
เซลล์ต้นกำเนิดจัดตามแหล่งที่ได้มาเป็น 2 ชนิดคือ
- เซลล์ต้นกำเนิดจากตัวอ่อนมนุษย์ (Embryonic Stem Cell) คือ เซลล์ต้นกำเนิดที่เก็บส่วนของ inner cell mass จากตัวอ่อนของมนุษย์หรือสัตว์ที่ยังอยู่ในครรภ์ในระยะ blastocyst เซลล์ต้นกำเนิดในระยะนี้จะมีอายุเพียง 3-5 วัน หลังการปฏิสนธิ แต่สามารถเจริญเปลี่ยนแปลงไปเป็นเซลล์ที่ทำหน้าที่เฉพาะได้ทุกชนิด
- เซลล์ต้นกำเนิดจากเนื้อเยื่อที่โตเต็มวัย (Adult Stem Cell) คือเซลล์ต้นกำเนิดที่เก็บจากเนื้อเยื่อที่โตเต็มวัย เช่นจาก ไขกระดูก เลือด ผิวหนัง ฟันน้ำนม เป็นต้น
และมีการจำแนกตามความสามารถในการนำไปพัฒนาได้อีก 3 ชนิด คือ
- Totipotent cell คือ เซลล์ที่พัฒนาไปได้แบบไม่จำกัด เช่น เซลล์ตัวอ่อนมนุษย์
- Pluripotent cell คือ เซลล์ที่พัฒนาไปได้หลายแบบ ซึ่งส่วนใหญ่เป็นเนื่อเยื่อต่างๆของสิ่งมีชีวิต
- Unipotent cell คือ เซลล์ที่พัฒนาไปเป็นเซลล์จำเพาะชนิดใดชนิดหนึ่งเท่านั้น
การรักษา[แก้]

นักวิจัยทางการแพทย์เชื่อว่าการรักษาด้วยเซลล์ต้นกำเนิดมีศักยภาพเปลี่ยนแปลงการรักษาโรคของมนุษย์อย่างสำคัญ มีการรักษาด้วยเซลล์ต้นกำเนิดเต็มวัยหลายชนิดแล้ว โดยเฉพาะอย่างยิ่งการปลูกถ่ายไขกระดูกซึ่งใช้รักษามะเร็งเม็ดเลือดขาว[4] ในอนาคต นักวิจัยทางการแพทย์คาดว่าจะสามารถใช้เทคโนโลยีที่มาจากการวิจัยเซลล์ต้นกำเนิดเพื่อรักษาอีกหลายโรค รวมถึง มะเร็ง, โรคพาร์กินสัน, การบาดเจ็บของไขสันหลัง, โรคกล้ามเนื้ออ่อนแรงเอแอลเอส, โรคมัลติเพิล สเกลอโรซิส และการบาดเจ็บของกล้ามเนื้อ ตลอดจนความบกพร่องและสภาพอื่นอีกจำนวนหนึ่ง[5][6] อย่างไรก็ดี ยังมีความไม่แน่นอนทางสังคมและวิทยาศาสตร์เกี่ยวกับการวิจัยเซลล์ต้นกำเนิดอยู่มาก ซึ่งต่อไปอาจเอาชนะได้ด้วยการถกเถียงสาธารณะ การวิจัยในอนาคตและการศึกษาของสาธารณะเพิ่มเติม
ความกังวลหนึ่งของการรักษา คือ ความเสี่ยงที่เซลล์ต้นกำเนิดที่ได้รับการปลูกถ่ายอาจเกิดเป็นเนื้องอกและกลายเป็นมะเร็งหากเซลล์ยังแบ่งตัวอย่างควบคุมไม่ได้[7]
อ้างอิง[แก้]
- ↑ Tuch BE (2006). "Stem cells—a clinical update". Australian Family Physician. 35 (9): 719–21. PMID 16969445.
- ↑ Becker AJ, McCulloch EA, Till JE (1963). "Cytological demonstration of the clonal nature of spleen colonies derived from transplanted mouse marrow cells". Nature. 197 (4866): 452–4. Bibcode:1963Natur.197..452B. doi:10.1038/197452a0. PMID 13970094.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Siminovitch L, McCulloch EA, Till JE (1963). "The distribution of colony-forming cells among spleen colonies". Journal of Cellular and Comparative Physiology. 62 (3): 327–36. doi:10.1002/jcp.1030620313. PMID 14086156.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Gahrton G, Björkstrand B (2000). "Progress in haematopoietic stem cell transplantation for multiple myeloma". J Intern Med. 248 (3): 185–201. doi:10.1046/j.1365-2796.2000.00706.x. PMID 10971785.
- ↑ Lindvall O (2003). "Stem cells for cell therapy in Parkinson's disease". Pharmacol Res. 47 (4): 279–87. doi:10.1016/S1043-6618(03)00037-9. PMID 12644384.
- ↑ Goldman S, Windrem M (2006). "Cell replacement therapy in neurological disease". Philos Trans R Soc Lond B Biol Sci. 361 (1473): 1463–75. doi:10.1098/rstb.2006.1886. PMC 1664668. PMID 16939969.
- ↑ "Stem-cell therapy: Promise and reality." Consumer Reports on Health 17.6 (2005): 8–9. Academic Search Premier. EBSCO. Web. 5 Apr. 2010.
แหล่งข้อมูลอื่น[แก้]
- ทั่วไป
- วารสารที่มีการทบทวน
