ฟีแนนทรีน
| |

| |

| |
| ชื่อ | |
|---|---|
| Preferred IUPAC name
Phenanthrene | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| 1905428 | |
| ChEBI | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.001.437 |
| EC Number |
|
| 28699 | |
| KEGG | |
| MeSH | C031181 |
ผับเคม CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| C14H10 | |
| มวลโมเลกุล | 178.234 g·mol−1 |
| ลักษณะทางกายภาพ | Colorless solid |
| ความหนาแน่น | 1.18 g/cm3[1] |
| จุดหลอมเหลว | 101 องศาเซลเซียส (214 องศาฟาเรนไฮต์; 374 เคลวิน)[1] |
| จุดเดือด | 332 องศาเซลเซียส (630 องศาฟาเรนไฮต์; 605 เคลวิน)[1] |
| 1.6 mg/L[1] | |
| -127.9·10−6 cm3/mol | |
| ความอันตราย | |
| NFPA 704 (fire diamond) | |
| จุดวาบไฟ | 171 องศาเซลเซียส (340 องศาฟาเรนไฮต์; 444 เคลวิน)[1] |
| โครงสร้าง | |
| C2v[2] | |
| 0 D | |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
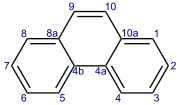
ฟีแนนทรีน (อังกฤษ: Phenanthrene) เป็น พอลิไซคลิกอะโรมาติกไฮโดรคาร์บอน (polycyclic aromatic hydrocarbon) ที่ประกอบด้วยวงเบนซีน 3 วงต่อเชื่อมกัน ผลึกเป็นของแข็งไม่มีสี แต่ก็สามารถปรากฏเป็นผลึกสีเหลืองได้เช่นกัน ฟีแนนทรีนใช้ในการผลิตสีย้อม พลาสติกและยาฆ่าแมลง วัตถุระเบิด และยา นอกจากนี้ยังใช้เพื่อสร้างกรดน้ำดี คอเลสเตอรอล และสเตียรอยด์อีกด้วย[3]
โดยทั่วไป มนุษย์ได้รับสารฟีแนนทรีนจากการสูดดมควันบุหรี่ แต่สามารถสัมผัสได้หลายทาง การศึกษาในสัตว์ทดลองแสดงให้เห็นว่าฟีแนนทรีนเป็นสารก่อมะเร็งได้ อย่างไรก็ตาม ตามข้อมูลของ IARC ไม่ได้ระบุว่าเป็นสารก่อมะเร็งในมนุษย์ที่น่าจะเป็นไปได้ เป็นไปได้ หรือได้รับการยืนยันแล้ว[3]
วงเบนซีนของฟีแนนทรีนมีมุมเหมือนในฟีนาซีเนส แทนที่จะเป็นตรงเหมือนในพวกเอซีน สารประกอบที่มีโครงสร้างแบบฟีแนนทรีนแต่มีไนโตรเจนที่ตำแหน่ง 4 และ 5 เรียกว่าฟีแนนโทรลีน[4]
การสังเคราะห์และปฏิกิริยา[แก้]
ฟีแนนทรีนไม่ละลายในน้ำแต่ละลายได้ดีในตัวทำละลายอินทรีย์ที่มีขั้วต่ำ เช่น โทลูอีน คาร์บอนเตตระคลอไรด์ อีเทอร์ คลอโรฟอร์ม กรดน้ำส้ม และเบนซีน การสังเคราะห์ฟีแนนทรีนโดยทั่วไปใช้การสังเคราะห์แบบ Bardhan-Sengupta'[5]
กระบวนการนี้เกี่ยวข้องกับปฏิกิริยาการแทนที่อะโรมาติกด้วยอิเล็กโทรไฟล์ โดยหมู่ไซโคลเฮกซานอลจะเชื่อมต่อกับวงเบนซีนโดยใช้ไดฟอสฟอรัสเพนทอกไซด์ จากนั้นดีไฮโดรจีเนชันโดยใช้ซีลีเนียม เพื่อทำให้วงไซโคลเฮกเซนอื่น ๆ กลายเป็นวงเบนซีน กลไกการเกิดอะโรมาไทเซชันของวงแหวนที่มีสมาชิก 6 วงด้วยซีลีเนียมนั้น ปัจจุบันยังไม่ค้นพบ แต่ทำให้เกิด H2Se เป็น by-product
Phenanthrene สามารถสังเคราะห์ได้จากปฏิกิริยาเคมีเชิงแสงจากไดเอริลเอทิลีนบางชนิด
ปฏิกิริยาของฟีแนนทรีนมักเกิดขึ้นที่คาร๋บอนตำแหน่ง 9 และ 10 ได้แก่:
- ปฏิกิริยาออกซิเดชันเป็นฟีแนนทรีควิโนนด้วยกรดโครมิก[6]
- การรีดิวซ์สารอินทรีย์เป็น 9,10-ไดไฮโดรฟีแนนทรีนด้วยก๊าซไฮโดรเจนและเรนีย์นิกเกิล[7]
- ปฏิกิริยาการแทนที่หมู่โบรโมในวงอะโรมาติกด้วยอิเล็กโทรไฟล์เป็น 9-โบรโมฟีแนนทรีนด้วยโบรมีน[8]
- ปฏิกิริยาซัลโฟเนชันเป็นกรดฟีแนนทรีซัลโฟนิกด้วยกรดซัลฟูริก[9]
- ปฏิกิริยาโอโซโนไลซิสเป็นไดฟีนิลอัลดีไฮด์[10]
- ↑ 1.0 1.1 1.2 1.3 1.4 Record of CAS RN 85-01-8 in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ↑ Peter Atkins, J. D. P., Atkins' Physical Chemistry. Oxford: 2010. Pg.443
- ↑ 3.0 3.1 "Phenanthrene Fact Sheet" (PDF). archive.epa.gov. U.S. Environmental Protection Agency. สืบค้นเมื่อ 19 July 2019.
- ↑ "Bardhan Sengupta Synthesis". Comprehensive Organic Name Reactions and Reagents. Vol. 49. 2010. pp. 215–219. doi:10.1002/9780470638859.conrr049. ISBN 9780470638859.
- ↑ "Bardhan Sengupta Synthesis". Comprehensive Organic Name Reactions and Reagents. Vol. 49. 2010. pp. 215–219. doi:10.1002/9780470638859.conrr049. ISBN 9780470638859.
- ↑ Organic Syntheses, Coll. Vol. 4, p.757 (1963); Vol. 34, p.76 (1954) Link
- ↑ Organic Syntheses, Coll. Vol. 4, p.313 (1963); Vol. 34, p.31 (1954) Link.
- ↑ Organic Syntheses, Coll. Vol. 3, p.134 (1955); Vol. 28, p.19 (1948) Link.
- ↑ Organic Syntheses, Coll. Vol. 2, p.482 (1943); Vol. 16, p.63 (1936) Link.
- ↑ Organic Syntheses, Coll. Vol. 5, p.489 (1973); Vol. 41, p.41 (1961) Link.


