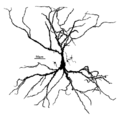
เซลล์พีระมิด
| เซลล์พีระมิด (Pyramidal cell) | |
|---|---|
 เซลล์ประสาทพีระมิดในคอร์เทกซ์ใหม่ของมนุษย์ แต้มสีด้วยเทคนิค Golgi ให้สังเกตเดนไดรต์ส่วนยอด (apical) ที่ยื่นตั้งขึ้นเหนือตัวเซลล์ (soma) และเดนไดรต์ส่วนฐาน (basal) จำนวนมากที่แผ่ไปทางด้านข้างจากฐานของตัวเซลล์ | |
 ภาพเซลล์พีระมิด ตัวเซลล์และเดนไดรต์มีสีแดง สาขาของแอกซอนมีสีน้ำเงิน (1) ตัวเซลล์ (2) เดนไดรต์ส่วนฐาน (3) เดนไดรต์ส่วนยอด (4) แอกซอน (5) แอกซอนรอง (collateral axon) | |
| รายละเอียด | |
| ที่ตั้ง | เปลือกสมองโดยเฉพาะชั้นที่ 3 และ 5 |
| รูปร่าง | รูปพีระมิด มีหลายขั้ว (multipolar) |
| หน้าที่ | เซลล์ประสาทส่งต่อ (projection neuron) แบบเร้า |
| สารส่งผ่านประสาท | กลูตาเมต กาบา |
| ตัวระบุ | |
| MeSH | D017966 |
| นิวโรเล็กซ์ ID | sao862606388 |
| TH | H1.00.01.0.00044 |
| FMA | 84105 |
| ศัพท์ทางกายวิภาคของประสาทกายวิภาคศาสตร์ | |
เซลล์พีระมิด หรือ เซลล์ประสาทพีระมิด หรือ นิวรอนพีระมิด (อังกฤษ: pyramidal cell, pyramidal neuron) เป็นเซลล์ประสาทหลายขั้วที่พบในเขตต่าง ๆ ของสมองรวมทั้งเปลือกสมอง ฮิปโปแคมปัส และอะมิกดะลา เป็นหน่วยส่งสัญญาณแบบเร้าหลักของ prefrontal cortex (คอร์เทกซ์กลีบหน้าผากส่วนหน้า) ในสัตว์เลี้ยงลูกด้วยนม และของลำเส้นใยประสาทเปลือกสมอง-ไขสันหลัง (corticospinal tract) เป็นเซลล์อย่างหนึ่งในสองอย่างที่มีลักษณะเฉพาะ คือ Negri bodies เมื่อชันสูตรศพหลังติดเชื้อโรคพิษสุนัขบ้า[1] นักประสาทวิทยาศาสตร์ชาวสเปนซานเตียโก รามอน อี กาฆัล เป็นผู้ค้นพบและศึกษาเซลล์นี้เป็นบุคคลแรก[2][3] ตั้งแต่นั้นมา ได้มีการศึกษาเซลล์พีระมิดในประเด็นต่าง ๆ ตั้งแต่สภาพพลาสติกของระบบประสาท (neuroplasticity) จนถึงเรื่องประชาน
โครงสร้าง[แก้]
-
นิวรอนพีระมิดที่เรืองแสงเนื่องกับโปรตีน green fluorescent protein (gfp) เมื่อส่องรังสีอัลตราไวโอเลต
-
นิวรอนพีระมิดในฮิปโปแคมปัส
ลักษณะโครงสร้างหลักของเซลล์ประสาทพีระมิดก็คือตัวเซลล์ (soma) รูปกรวย ที่ตั้งชื่อให้แก่เซลล์ ลักษณะสำคัญอื่น ๆ รวมทั้ง แอกซอนเดี่ยว, เดนไดรต์ส่วนยอด (apical) ขนาดใหญ่เดี่ยว, เดนไดรต์ส่วนฐาน (basal) หลายอัน และเงี่ยงเดนไดรต์ (dendritic spine)[4]
เดนไดรต์ส่วนยอด[แก้]
เดนไดรต์ส่วนยอด (apical dendrite) งอกออกจากยอดตัวเซลล์ เป็นเดนไดรต์อันเดียว ยาวและหนา ที่แตกออกเป็นหลายสาขาซึ่งยิ่งออกไกลจากตัวเซลล์ก็ยิ่งมาก โดยยื่นไปยังส่วนผิวของเปลือกสมอง[4]
เดนไดรต์ส่วนฐาน[แก้]
เดนไดรต์ส่วนฐาน (basal dendrites) งอกออกจากส่วนฐานของตัวเซลล์ "ต้นไม้เดนไดรต์ส่วนฐาน" (basal dendritic tree) มีเดนไดรต์หลัก ๆ 3-5 อัน ยิ่งไกลออกจากตัวเซลล์เท่าไร เดนไดรต์ส่วนฐานก็จะแตกสาขาอย่างมากมายเท่านั้น[4]
เซลล์พีระมิดเป็นเซลล์ประสาทขนาดใหญ่ที่สุดอย่างหนึ่งในสมอง ทั้งในมนุษย์และสัตว์ฟันแทะ ตัวเซลล์จะยาวโดยเฉลี่ยราว ๆ 20 ไมโครเมตร (μm) เดนไดรต์ปกติจะมีเส้นผ่านศูนย์กลางตั้งแต่ครึ่งไมโครเมตรจนถึงหลายไมโครเมตร และปกติจะยาวเป็นร้อย ๆ ไมโครเมตร เพราะมีสาขามากมาย เดนไดรต์อาจยาวรวม ๆ เป็นหลายเซนติเมตร แอกซอนบ่อยครั้งยาวยิ่งกว่าและมีสาขามากกว่า และอาจยาวเป็นหลาย ๆ เซนติเมตรรวม ๆ กัน
เงี่ยงเดนไดรต์ (dendritic spine)[แก้]
เงี่ยงเดนไดรต์ (dendritic spine) เป็นตัวรับกระแสประสาทแบบเร้า (excitatory postsynaptic potential, EPSP) ที่ส่งมายังเซลล์ ซึ่งรามอน อี กาฆัลได้เห็นเป็นครั้งแรกในปี 1888 เมื่อแต้มสีด้วยเทคนิค Golgi และยังเป็นคนแรกที่เสนอว่า เงี่ยงช่วยเพิ่มพื้นที่ผิวเพื่อรับกระแสประสาท เพราะยิ่งมีพื้นที่ผิวมากเท่าไร เซลล์ก็จะสามารถแปลและรวบรวมข้อมูลได้มากยิ่งเท่านั้น
เงี่ยงเดนไดรต์ไม่มีที่ตัวเซลล์ โดยจำนวนจะเพิ่มขึ้นตามระยะห่างจากตัวเซลล์[3] เดนไดรต์ส่วนยอดในหนูมีเงี่ยงเดนไดรต์อย่างน้อย 3,000 อัน เพราะเดนไดรต์ส่วนยอดของมนุษย์อาจยาวราว ๆ 2 เท่าของหนู จำนวนเงี่ยงเดนไดรต์จึงอาจมากถึง 6,000 อัน[5]
พัฒนาการ[แก้]
การเปลี่ยนสภาพให้แตกต่างเพื่อทำหน้าที่เฉพาะ[แก้]
การกำหนด (specification) เป็นเซลล์พีระมิด เกิดขึ้นในพัฒนาการระยะต้น ๆ ของสมองใหญ่ โดยเซลล์บรรพบุรุษ (progenitor cell) จะเปลี่ยนสถานะเป็น committed ว่าจะเป็นสายเซลล์ประสาทภายใน subcortical proliferative ventricular zone (VZ) และใน subventricular zone (SVZ) เซลล์พีระมิดที่ยังไม่เจริญเต็มที่จะย้ายไปอยู่ที่แผ่นเปลือกสมอง (cortical plate) เป็นที่ที่จะเปลี่ยนสภาพให้แตกต่างมากขึ้น โมเลกุลกลุ่มหนึ่งคือ endocannabinoid (eCB) มีผลโดยตรงต่อพัฒนาการของเซลล์พีระมิดและการวางทางดำเนินของแอกซอน[6] แฟ็กเตอร์ถอดรหัส (transcription factor) เช่น Ctip2 และ Sox5 พบว่ามีบทบาทกำหนดทิศทางแอกซอนของเซลล์พีระมิด[7]
พัฒนาการหลังคลอดใหม่ ๆ[แก้]
เซลล์พีระมิดในหนูพบว่า เปลี่ยนแปลงอย่างรวดเร็วในช่วงคลอดใหม่ ๆ คือระหว่างวันที่ 3-21 เซลล์พีระมิดพบว่าเพิ่มขนาดตัวเซลล์เป็นทวีคูณ เพิ่มความยาวเดนไดรต์ส่วนยอด 5 เท่า และเพิ่มความยาวเดนไดรต์ส่วนฐาน 13 เท่า ความเปลี่ยนแปลงอย่างอื่น ๆ รวมทั้ง ศักย์ช่วงพัก (resting potential) ของเยื่อหุ้มเซลล์ต่ำลง ความต้านทานของเยื่อหุ้มเซลล์ลดลง และค่าสูงสุดของศักยะงานสูงขึ้น[8]
การให้สัญญาณ (signaling)[แก้]
เหมือนกับนิวรอนอื่น ๆ โดยมาก เดนไดรต์โดยทั่วไปเป็นส่วนรับสัญญาณเข้าของเซลล์ประสาท และแอกซอนเป็นส่วนส่งสัญญาณออก ทั้งแอกซอนและเดนไดรต์ต่างก็มีสาขามาก ซึ่งทำให้เซลล์สามารถส่งและรับสัญญาณกับนิวรอนต่าง ๆ เป็นจำนวนมาก
เหมือนกับนิวรอนอื่น ๆ นิวรอนพีระมิดมีช่องไอออนเปิดปิดด้วยความต่างศักย์ (voltage-gated ion channel) เป็นจำนวนมาก เซลล์พีระมิดมีช่องไอออน Na+, Ca2+ และ K+ จำนวนมากในเดนไดรต์ และก็มีในตัวเซลล์บ้างด้วย โดยช่องที่เดนไดรต์จะมีคุณสมบัติต่างกับช่องไอออนประเภทเดียวกันที่ตัวเซลล์ ช่อง Ca2+ ที่เปิดปิดด้วยความต่างศักย์ (Voltage-gated Ca2+ channel) ภายในเดนไดรต์ จะเริ่มทำงานด้วยศักย์แบบเร้าคือ excitatory postsynaptic potential (EPSP) ที่ต่ำกว่าขีด (subthreshold) และด้วยศักยะงานจากเซลล์เองแบบ back-propagating[A] ขอบเขตของ back-propagation ของศักยะงานภายในเดนไดรต์ของเซลล์พีระมิดจะขึ้นอยู่กับช่อง K+ ในเดนไดรต์ ช่องเป็นกลไกที่ใช้ควบคุมแอมพลิจูดของศักยะงาน[9]
สมรรถภาพการรวบรวมข้อมูลของเซลล์พีระมิดจะขึ้นอยู่กับจำนวนและการกระจายตัวของไซแนปส์ขาเข้าที่มี เซลล์หนึ่ง ๆ มีไซแนปส์ขาเข้าแบบเร้าประมาณ 30,000 อัน และแบบยับยั้ง (ด้วยสัญญาณ Inhibitory postsynaptic potential, IPSP) ประมาณ 1,700 อัน สัญญาณแบบเร้า (EPSP) ส่งมาที่เงี่ยงเดนไดรต์เท่านั้น เทียบกับสัญญาณแบบยับยั้ง (IPSP) ที่ส่งมาที่ก้านเดนไดรต์ (dendritic shaft) ตัวเซลล์ และแม้แต่ที่แอกซอน สารสื่อประสาทแบบเร้าที่เซลล์ได้รับคือ กลูตาเมต และแบบยับยั้งก็คือ กาบา[4]
การส่งกระแสประสาท[แก้]
เซลล์พีระมิดสามารถจัดเป็นกลุ่ม ๆ ตามการตอบสนองเป็นกระแสประสาทต่อพัลส์ไฟฟ้า/พัลส์กระแสประสาทที่ได้ในช่วง 400-1,000 วินาที รวมทั้งเซลล์ประสาทแบบ RSad, RSna และ IB
RSad[แก้]
เซลล์ประสาทพีระมิดแบบ RSad หรือ adapting regular spiking neuron (นิวรอนที่ส่งสัญญาณยอดแหลมอย่างสม่ำเสมอและปรับตัวได้) ปล่อยกระแสประสาทเป็นศักยะงานต่างหาก ๆ ตามด้วยศักย์ไฟฟ้าตามหลัง (hyperpolarizing afterpotential) ที่ต่ำกว่าศักย์ช่วงพัก ศักย์ไฟฟ้าตามหลังอาจยาวขึ้น เป็นการปรับความถี่การส่งศักยะงาน (spike frequency adaptation, SFA) ภายในนิวรอน[10]
RSna[แก้]
เซลล์ประสาทพีระมิดแบบ RSad หรือ non-adapting regular spiking neuron (นิวรอนที่ส่งสัญญาณยอดแหลมอย่างสม่ำเสมอและไม่ปรับตัว) จะส่งศักยะงานเป็นขบวนหลังจากได้รับพัลส์ไฟฟ้าขาเข้า แต่ไม่ปรากฏว่าปรับความถี่การส่งศักยะงาน[10]
IB[แก้]
นิวรอนพีระมิดแบบ IB หรือ intrinsically bursting neuron (นิวรอนระเบิดส่งสัญญาณ) ตอบสนองต่อพัลส์สัญญาณที่ถึงขีดด้วยการระเบิดส่งศักยะงานอย่างถี่ ๆ 2-5 อัน โดยไม่ปรากฏว่าปรับความถี่ศักยะงาน[10]
หน้าที่[แก้]
ลำเส้นใยประสาทเปลือกสมอง-ไขสันหลัง (corticospinal tract)[แก้]
นิวรอนพีระมิดเป็นนิวรอนหลักภายในลำเส้นใยประสาทเปลือกสมอง-ไขสันหลัง (corticospinal tract) การทำงานของระบบสั่งการปกติจะต้องอาศัยพัฒนาการเป็นการเชื่อมต่อกันระหว่างแอกซอนภายในลำเส้นใยประสาทเปลือกสมอง-ไขสันหลังกับไขสันหลัง โดยแอกซอนของนิวรอนจะยื่นไปเชื่อมต่อที่จุดต่าง ๆ ขึ้นอยู่กับ growth factor เช่น เมื่อเชื่อมต่อกันอย่างถูกต้อง นิวรอนพีระมิดจะมีบทบาทในวงจรที่ทำให้เคลื่อนไหวอาศัยสายตาได้[11]
ระบบประชาน[แก้]
นิวรอนพีระมิดในคอร์เทกซ์กลีบหน้าผากส่วนหน้า (prefrontal cortex) มีหน้าที่ทางประชาน ในสัตว์เลี้ยงลูกด้วยนม ความซับซ้อนของเซลล์พีระมิดจะเพิ่มขึ้นจากเขตสมองด้านหลัง (posterior) ไปยังเขตสมองด้านหน้า (anterior) ระดับความซับซ้อนของเซลล์น่าจะสัมพันธ์กับสมรรถภาพทางประชานของลิงสปีชีส์ต่าง ๆ เช่น มันอาจมีบทบาทที่ขาดไม่ได้ในการรู้จำวัตถุ (object recognition) ที่ซับซ้อนภายในเขตเปลือกสมองที่แปลผลทางตา[2]
ดูเพิ่ม[แก้]
เชิงอรรถ[แก้]
- ↑ neural backpropagation (การแพร่สัญญาณกลับในประสาท) เป็นปรากฏการณ์ที่ศักยะงานของนิวรอนสร้างศักย์ยอดแหลม (voltage spike) ทั้งที่ปลายแอกซอน (ซึ่งเป็นการแพร่สัญญาปกติ) และกลับไปที่สาขาเดนไดรต์หรือตัวเดนไดรต์เอง ซึ่งเป็นแหล่งของกระแสประสาทขาเข้าด้วย พบว่า กระบวนการง่าย ๆ เช่นนี้สามารถใช้เหมือนกับขั้นตอนวิธีแบบ backpropagation ที่ใช้ใน multilayer perceptron ซึ่งเป็นโครงข่ายประสาทเทียมอย่างหนึ่ง แม้จะมีหลักฐานที่พิสูจน์ว่า ปรากฏการณ์นี้มีจริง ๆ หน้าที่ของกระบวนการเช่นนี้ และขอบเขต/ความกว้างขวางที่ใช้ในเดนไดรต์ก็ยังเป็นเรื่องไม่ยุติ
อ้างอิง[แก้]
- ↑ Sketchy Group, LLC. "2.3 rhabdovirus". SketchyMedical. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2017-04-13.
- ↑ 2.0 2.1 Elston, GN (Nov 2003). "Cortex, cognition and the cell: new insights into the pyramidal neuron and prefrontal function". Cereb. Cortex. 13 (11): 1124–38. doi:10.1093/cercor/bhg093. PMID 14576205.
- ↑ 3.0 3.1
García-López, P; García-Marín, V; Freire, M (Nov 2006). "Three-dimensional reconstruction and quantitative study of a pyramidal cell of a Cajal histological preparation". J. Neurosci. 26 (44): 11249–52. doi:10.1523/JNEUROSCI.3543-06.2006. PMID 17079652.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 4.0 4.1 4.2 4.3 Megías, M; Emri, Z; Freund, TF; Gulyás, AI (2001). "Total number and distribution of inhibitory and excitatory synapses on hippocampal CA1 pyramidal cells". Neuroscience. 102 (3): 527–40. doi:10.1016/S0306-4522(00)00496-6. PMID 11226691.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Laberge, D; Kasevich, R (Nov 2007). "The apical dendrite theory of consciousness". Neural Netw. 20 (9): 1004–20. doi:10.1016/j.neunet.2007.09.006. PMID 17920812.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Mulder, J; Aguado, T; Keimpema, E และคณะ (June 2008). "Endocannabinoid signaling controls pyramidal cell specification and long-range axon patterning". Proc. Natl. Acad. Sci. U.S.A. 105 (25): 8760–5. doi:10.1073/pnas.0803545105. PMC 2438381. PMID 18562289.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Fishell, G; Hanashima, C (Feb 2008). "Pyramidal neurons grow up and change their mind". Neuron. 57 (3): 333–8. doi:10.1016/j.neuron.2008.01.018. PMID 18255026.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Zhang, ZW (Mar 2004). "Maturation of layer V pyramidal neurons in the rat prefrontal cortex: intrinsic properties and synaptic function". J. Neurophysiol. 91 (3): 1171–82. doi:10.1152/jn.00855.2003. PMID 14602839.
- ↑ Magee, J; Hoffman, D; Colbert, C; Johnston, D (1998). "Electrical and calcium signaling in dendrites of hippocampal pyramidal neurons". Annu. Rev. Physiol. 60 (1): 327–46. doi:10.1146/annurev.physiol.60.1.327. PMID 9558467.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 10.0 10.1 10.2 Franceschetti, S; Sancini, G; Panzica, F; Radici, C; Avanzini, G (Apr 1998). "Postnatal differentiation of firing properties and morphological characteristics in layer V pyramidal neurons of the sensorimotor cortex". Neuroscience. 83 (4): 1013–24. doi:10.1016/S0306-4522(97)00463-6. PMID 9502243.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Salimi, I; Friel, KM; Martin, JH (July 2008). "Pyramidal tract stimulation restores normal corticospinal tract connections and visuomotor skill after early postnatal motor cortex activity blockade". J. Neurosci. 28 (29): 7426–34. doi:10.1523/JNEUROSCI.1078-08.2008. PMC 2567132. PMID 18632946.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์)
แหล่งข้อมูลอื่น[แก้]
- Pyramidal cell - Cell Centered Database
- Diagram เก็บถาวร 2018-05-26 ที่ เวย์แบ็กแมชชีน
- Diagram (as part of slideshow) เก็บถาวร 2016-11-02 ที่ เวย์แบ็กแมชชีน