แอมโมเนียมไนเตรต
| |

| |

| |
| ชื่อ | |
|---|---|
| IUPAC name
Ammonium nitrate
| |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.026.680 |
| EC Number |
|
ผับเคม CID
|
|
| RTECS number |
|
| UNII | |
| UN number | 0222 – with > 0.2% combustible substances 1942 – with ≤ 0.2% combustible substances 2067 – fertilizers 2426 – liquid |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| NH4NO3 | |
| มวลโมเลกุล | 80.043 g/mol |
| ลักษณะทางกายภาพ | colorless |
| ความหนาแน่น | 1.725 g/cm3 (20 °C) |
| จุดหลอมเหลว | 169.6 องศาเซลเซียส (337.3 องศาฟาเรนไฮต์; 442.8 เคลวิน) |
| จุดเดือด | approx. 210 องศาเซลเซียส (410 องศาฟาเรนไฮต์; 483 เคลวิน) decomposes |
| Endothermic 118 g/100 ml (0 °C) 150 g/100 ml (20 °C) 297 g/100 ml (40 °C) 410 g/100 ml (60 °C) 576 g/100 ml (80 °C) 1024 g/100 ml (100 °C)[1] | |
| -33.6·10−6 cm3/mol | |
| โครงสร้าง | |
| trigonal | |
| ข้อมูลระเบิด | |
| ความไวต่อแรงกระแทก | very low |
| ความไวต่อแรงเสียดทาน | very low |
| ความเร็วการระเบิด | 2500 m/s |
| ความอันตราย | |
| อาชีวอนามัยและความปลอดภัย (OHS/OSH): | |
อันตรายหลัก
|
Explosive, Oxidizer |
| GHS labelling: | |
  
| |
| อันตราย | |
| H201, H271, H319 | |
| P220, P221, P264, P271, P280, P372 | |
| NFPA 704 (fire diamond) | |
| ปริมาณหรือความเข้มข้น (LD, LC): | |
LD50 (median dose)
|
2085–5300 mg/kg (oral in rats, mice)[2] |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
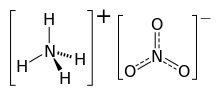
แอมโมเนียมไนเตรต (อังกฤษ: ammonium nitrate) เป็นสารประกอบทางเคมีที่มีสูตรทางเคมี NH
4NO
3 เป็นของแข็งผลึกสีขาวประกอบด้วยไอออนของแอมโมเนียและไนเตรต มีสามารถในการละลายสูง และมีการดูดความชื้นในรูปของแข็งแม้ว่าจะไม่สร้างไฮเดรต ส่วนใหญ่ใช้ในการเกษตรเป็นปุ๋ยไนโตรเจนสูง[4] การผลิตทั่วโลกอยู่ที่ 21.6 ล้านตันในปี 2017
การใช้งานหลักอื่น ๆ เป็นส่วนประกอบของสารผสมระเบิดที่ใช้ในการขุดเหมืองหินและการก่อสร้างทางแพ่ง เป็นส่วนประกอบหลักของแอนโฟซึ่งเป็นวัตถุระเบิดอุตสาหกรรมที่ได้รับความนิยมซึ่งคิดเป็น 80% ของวัตถุระเบิดที่ใช้ในอเมริกาเหนือ มีการใช้สูตรที่คล้ายคลึงกันในระเบิดแสวงเครื่อง
หลายประเทศกำลังยุติการใช้งานสำหรับผู้บริโภคเนื่องจากกังวลว่าอาจมีการใช้ในทางที่ผิด[5] การระเบิดของแอมโมเนียมไนเตรตโดยบังเอิญได้คร่าชีวิตผู้คนไปหลายพันคนตั้งแต่ต้นศตวรรษที่ 20
ภัยพิบัติ[แก้]
แอมโมเนียมไนเตรตสลายตัวโดยไม่มีการระเบิดเป็นแก๊สไนตรัสออกไซด์และไอน้ำเมื่อถูกความร้อน อย่างไรก็ตามมันสามารถถูกกระตุ้นให้สลายตัวได้โดยการระเบิด การกักตุนจำนวนมากอาจเสี่ยงต่อการเกิดเพลิงไหม้ได้เนื่องจากสามารถเกิดปฏิกิริยาออกซิเดชั่นซึ่งเป็นสถานการณ์ที่อาจขยายขนาดไปสู่การระเบิดได้ง่าย
การระเบิดไม่ใช่เรื่องผิดปกติ มีเหตุการณ์เล็กน้อยเกิดขึ้นเกือบทุกปี แต่ก็ยังเกิดการระเบิดขนาดใหญ่และร้ายแรงหลายครั้งตัวอย่างเช่น เหตุระเบิดที่อ็อพเพาเมื่อ ค.ศ. 1921 (หนึ่งในการระเบิดที่สร้างขึ้นที่ไม่ใช่ระเบิดนิวเคลียร์ที่ใหญ่ที่สุด), ภัยพิบัติในนครเท็กซัสเมื่อ ค.ศ. 1947, เหตุระเบิดในเทียนจินเมื่อ ค.ศ. 2015 และเหตุระเบิดที่เบรุตเมื่อ ค.ศ. 2020
อ้างอิง[แก้]
- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0-07-049439-8
- ↑ Martel, B.; Cassidy, K. (2004). Chemical Risk Analysis: A Practical Handbook. Butterworth–Heinemann. p. 362. ISBN 1-903996-65-1.
- ↑ "Archived copy". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 17 February 2015. สืบค้นเมื่อ 13 March 2015.
{{cite web}}: CS1 maint: archived copy as title (ลิงก์) - ↑ Karl-Heinz Zapp "Ammonium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry 2012, Wiley-VCH, Weinheim. doi:10.1002/14356007.a02_243
- ↑ Ammonium nitrate sold by ton as U.S. regulation is stymied. เก็บถาวร 28 กุมภาพันธ์ 2018 ที่ เวย์แบ็กแมชชีน – The Dallas Morning News

