ผลต่างระหว่างรุ่นของ "ไนตรัสออกไซด์"
ไม่มีความย่อการแก้ไข |
ล เพิ่มหมวดหมู่:ออกไซด์ ด้วยสคริปต์จัดให้) |
||
| บรรทัด 217: | บรรทัด 217: | ||
{{General anesthetics}} |
{{General anesthetics}} |
||
[[Category: |
[[Category:ออกไซด์]] |
||
[[Category:Nitrogen compounds]] |
[[Category:Nitrogen compounds]] |
||
[[Category:Aerosol propellants]] |
[[Category:Aerosol propellants]] |
||
| บรรทัด 259: | บรรทัด 259: | ||
{{โครงวิทยาศาสตร์}} |
{{โครงวิทยาศาสตร์}} |
||
[[หมวดหมู่:ออกไซด์]] |
|||
รุ่นแก้ไขเมื่อ 18:07, 20 เมษายน 2551
ลิงก์ข้ามภาษาในบทความนี้ มีไว้ให้ผู้อ่านและผู้ร่วมแก้ไขบทความศึกษาเพิ่มเติมโดยสะดวก เนื่องจากวิกิพีเดียภาษาไทยยังไม่มีบทความดังกล่าว กระนั้น ควรรีบสร้างเป็นบทความโดยเร็วที่สุด |

| |
| |
| เลขทะเบียน | |
|---|---|
| ECHA InfoCard | 100.030.017 |
| เลขอี | E942 (glazing agents, ...) |
CompTox Dashboard (EPA)
|
|
| คุณสมบัติ | |
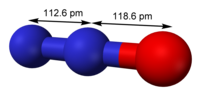
| N2O | |
| มวลโมเลกุล | 44.0128 g/mol |
| ลักษณะทางกายภาพ | colourless gas |
| ความหนาแน่น | 1222.8 kg m-3 (liquid) 1.8 kg m-3 (gas STP) |
| จุดหลอมเหลว | -90.86 °C (182.29 K) |
| จุดเดือด | -88.48 °C (184.67 K) |
| โครงสร้าง | |
| linear | |
| 0.166D | |
| อุณหเคมี | |
Std enthalpy of
formation (ΔfH⦵298) |
+82.05 |
| เภสัชวิทยา | |
| Inhalation | |
| เภสัชจลนศาสตร์: | |
| 0.004% | |
| 5 minutes | |
| Respiratory | |
| สถานะทางกฎหมาย |
|
| ความอันตราย | |
| NFPA 704 (fire diamond) | |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
ไนตรัสออกไซด์ ('Nitrous oxide) หรือ แก๊สหัวเราะ (laughing gas) ก็เรียก คือสารประกอบทางเคมีที่มีสูตรทางเคมีว่า N2O อุณหภูมิห้องไนตรัสออกไซด์จะมีสี และเป็นแก๊สไม่ติดไฟ มีกลิ่นหอมและมีรสหวานเล็กน้อย มีการนำไปใช้ในการผ่าตัดและทางทันตกรรมเพื่อให้เกิดการชาและเพื่อการระงับความปวด โดยทั่วไปรู้จักกันในชื่อ “แก๊สหัวเราะ”” เนื่องจากเมื่อสูดดมแล้วจะให้ความรู้สึกเคลิ้มสุขหรือครึ้มใจ เป็นคุณสมบัตืที่ทำให้มีการใช้ในเชิงนันทนาการโดยการใช้เป็นยาดม และยังมีการนำไปใช้ในการแข่งรถยนต์โดยให้เป็นตัวเติมออกซิเจนเพื่อเพิ่มกำลังให้เครื่องยนตร์อีกด้วย
การเกิด

ไนตรัสออกไซด์ต่างกับไนโตรเจนออกไซด์ตรงที่มันเป็นแก๊สเรือนกระจกที่สำคัญ ถึงแม้มันจะมีการแผ่รังสีความร้อนน้อยกว่า CO2 ก็ตาม แต่ไนตรัสออกไซด์ก็มีอายุในบรรยากาศยาวนานมากกว่า 100 ปีต่อหน่วยน้ำหนัก และมีผลกระทบต่อภาวะโลกร้อนเทียบต่อมวลคาร์บอนไดออกไซด์ (CO2) มากกว่า 296 เท่า[1] การควบคุมไนตรัสออกไซด์นับเป็นมาตรการหนึ่งเพื่อลดการปล่อยแก๊สเรือนกระจก เช่นในพิธีสารเกียวโต แม้มันจะมีประมาณการสะสมในบรรยากาศค่อนข้างน้อย แต่ไนตรัสออกไซด์กลับเป็นแก๊สเรือนกระจกที่ก่อภาวะโลกร้อนมากเป็นอันดับที่ 4 ต่อจากคาร์บอนไดออกไซด์ มีเทนและไอน้ำ (ไนโตรเจนออกไซด์ชนิดอื่นก่อภาวะโลกร้อนโดยตรงโดยเป็นตัวสร้างโอโซนในบรรยากาศชั้นโทรโปสเฟียร์ในช่วงที่เกิดหมอกปนควัน (smog)
ไนตรัสออกไซด์เกิดจากแบคทีเรียในดินและมหาสมุทร มันจึงเป็นส่วนของบรรยากาศของโลกมานับหลายบรมยุค (eon) มาแล้ว เกษตรกรรมเป็นแหล่งเกิดไนตรัสออกไซด์โดยฝีมือมนุษย์โดยการพรวนดินและการใช้ปุ๋ยไนโตรเจน ของเสียจากสัตว์ก็มีส่วนช่วยเพิ่มแบคทีเรียที่ให้เกิดไนตรัสออกไซด์เพิ่มขึ้นอีกด้วย ภาคปศุสัตว์ (ส่วนใหญ่คือโคกระบือ ไก่และสุกร) ปล่อยไนตรัสออกไซด์ที่ถือเป็นกิจกรรมมนุษย์มากถึงร้อยละ 65[2] แหล่งที่มาจากอุตสาหกรรมมีเพียงประมาณร้อยละ 20 และรวมถึงการผลิตไนลอนและกรดไนตริกและการเผาผลาญเชื้อเพลิงซากดึกดำบรรพ์ในเครื่องยนตร์สันดาปภายใน
คาดกันว่ากิจกรรมมนุษย์ปล่อยไนโตรเจนออกไซด์ออกมาน้อยกว่า 2 เทระกรัม (teragram หรือ 1012 กรัม) ต่อปี ธรรมชาติปล่อยมากกว่า 15 เทระกรัม.[3] ฟลักซ์ (flux) ของไนตรัสออกไซด์ที่เกิดโดยกิจกรรมมนุษย์มีประมาณ 1 เพตะกรัม (1015 กรัม) ของคาร์บอนไดออกไซด์เทียบเท่าคาร์บอนสมมูล (carbon dioxide carbon-equivalents) ต่อปี หรือเท่ากับ 2 เพตะกรัมของมีเทนเทียบเท่าคาร์บอนสมมูลต่อปี และมีการปล่อยสู่บรรยากาศ (atmospheric loading) ในอัตราเท่ากับ 3.3 เพตะกรัมของคาร์บอนไดออกไซด์เทียบเท่าคาร์บอนสมมูลต่อปี
ไนตรัสออกไซด์ทำปฏิกริยากับโอโซนในบรรยากาศชั้นสตราโตสเฟียร์ ส่วนไนโตรเจนออกไซด์เป็นตัวควบคุมตามธรรมชาติของโอโซนในบรรยากาศ
งานวิจัยของ พอล ครัทเซน (Paul Crutzen) ซึ่งเป็นนักวิทยาศาสตร์รางวัลโนเบลเสนอว่า การปล่อยไนตรัสออกไซด์ในการผลิตเชื้อเพลิงชีวภาพ (biofuel) มีปริมาณมากพอที่จะหักล้างข้อได้เปรียบของไบโอดีเซลที่หวังกันว่าจะช่วยลดการปล่อยคาร์บอนไดออกไซด์ได้[4]
การผลิต
การเตรียมไนตรัสออกไซด์โดยทั่วไปทำโดยการให้ความร้อนแอมโมเนียมไนเตรทอย่างมัดระวัง ซึ่งจะสลายตัวเป็นไนตรัสออกไซด์และไอน้ำ[5]
- NH4NO3(s) → 2 H2O(g) + N2O(g)
การใช้
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ผลจากการสูดดม
การแพทย์
การใช้ทางนันทนาการ
แก๊สพ่น
เครื่องยนตร์จรวด
เครื่องยนตร์สันดาปภายใน
เภสัชวิทยาประสาท
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |

ความปลอดภัย
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
คุณสมบัติทางเคมี/กายภาพ
คุณสมบัติทางชีวภาพ
ความร้อน
ด้านกฎหมาย
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
ประวัติความเป็มา
ส่วนนี้รอเพิ่มเติมข้อมูล คุณสามารถช่วยเพิ่มข้อมูลส่วนนี้ได้ |
อ้างอิง
- ↑ "Climate Change 2001: Working Group I: The Scientific Basis :". Intergovernmental Panel on Climate Change. สืบค้นเมื่อ 2008-02-02.
- ↑ H. Steinfeld, P. Gerber, T. Wassenaar, V. Castel, M. Rosales, C. de Haan (2006). "Livestock's long shadow -- Environmental issues and options". สืบค้นเมื่อ 2008-02-02.
{{cite web}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Sources and Emissions -- Where Does Nitrous Oxide Come From?". U. S. Environmental Protection Agency. 2006. สืบค้นเมื่อ 2008-02-02.
- ↑ P. J. Crutzen, A. R. Mosier, K. A. Smith, and W. Winiwarter (2007). "N2O release from agro-biofuel production negates global warming reduction by replacing fossil fuels" (PDF). Atmos. Chem. Phys. Discuss.,. 7: 11191–11205. สืบค้นเมื่อ 2008-02-02.
{{cite journal}}: CS1 maint: extra punctuation (ลิงก์) CS1 maint: multiple names: authors list (ลิงก์) - ↑ Holleman, A. F. (2001). Inorganic Chemistry. San Diego: Academic Press. ISBN 0-12-352651-5.
{{cite book}}: ไม่รู้จักพารามิเตอร์|coauthors=ถูกละเว้น แนะนำ (|author=) (help)
แหล่งข้อมูลภายนอก
- Occupational Safety and Health Guideline for Nitrous Oxide
- Paul Crutzen Interview Freeview video of Paul Crutzen Nobel Laureate for his work on decomposition of ozone talking to Harry Kroto Nobel Laureate by the Vega Science Trust.
- National Pollutant Inventory - Oxide of nitrogen fact sheet
- Nitrous Oxide Specs Extremely thorough Nitrous Oxide Facts
- National Institute for Occupational Safety and Health - Nitrous Oxide
แม่แบบ:Dissociative psychedelics แม่แบบ:E number infobox 930-949 แม่แบบ:General anesthetics
- CS1 maint: extra punctuation
- สารเคมีที่ไม่มีรหัสสารประกอบผับเคม
- บทความที่ไม่มีแหล่งที่มาของ InChI
- หน้าสารเคมีที่ไม่มี ChemSpiderID
- บทความที่ไม่มีแหล่งที่มาของ EBI
- บทความที่ไม่มีแหล่งที่มาของ UNII
- Pages using Chembox with unknown parameters
- E number from Wikidata
- ออกไซด์
- Nitrogen compounds
- Aerosol propellants
- Anesthetics
- Dissociatives
- Greenhouse gases
- Nitrogen metabolism
- NMDA receptor antagonists
- Monopropellants
- Rocket oxidizers
- Inhalants
- Occupational safety and health
- Vehicle modification
- บทความเกี่ยวกับ วิทยาศาสตร์ ที่ยังไม่สมบูรณ์

