ป่องรู้กลิ่น
| ป่องรับกลิ่น (Olfactory bulb) | |
|---|---|
 สมองมนุษย์มองจากด้านล่าง ป่องรับกลิ่นและลำเส้นใยประสาทรู้กลิ่น (olfactory tracts) มีสีแดง (รูป Fabrica ปี 2086 โดยแอนเดรียส เวซาเลียส) | |
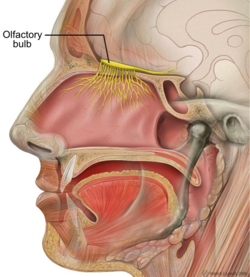 ศีรษะมนุษย์ตามระนาบซ้ายขวา แสดงป่องรับกลิ่น | |
| รายละเอียด | |
| ระบบ | ระบบรู้กลิ่น |
| ตัวระบุ | |
| ภาษาละติน | bulbus olfactorius |
| MeSH | D009830 |
| นิวโรเนมส์ | 279 |
| นิวโรเล็กซ์ ID | birnlex_1137 |
| TA98 | A14.1.09.429 |
| TA2 | 5538 |
| FMA | 77624 |
| ศัพท์ทางกายวิภาคของประสาทกายวิภาคศาสตร์ | |

ป่องรู้กลิ่น หรือ ป่องรับกลิ่น[1] (อังกฤษ: olfactory bulb, bulbus olfactorius, ตัวย่อ OB) เป็นโครงสร้างทางประสาทแบบเป็นชั้น ๆ ที่สมองส่วนหน้าของสัตว์มีกระดูกสันหลัง (โดยในมนุษย์จะอยู่ที่ด้านหน้าส่วนล่าง) ซึ่งมีบทบาทในการได้กลิ่น ป่องรับกลิ่นรับข้อมูลขาเข้ามาจากเซลล์ประสาทรับกลิ่นที่เยื่อรับกลิ่นซึ่งบุโพรงจมูกเป็นบางส่วน[2] แล้วส่งข้อมูลขาออกผ่านลำเส้นใยประสาท lateral olfactory tract ไปยังเปลือกสมองส่วนการรู้กลิ่น[3][4] แม้การแปลผลกลิ่นอย่างแม่นยำของป่องรู้กลิ่นจะยังไม่ชัดเจน แต่ก็เชื่อว่ามันทำหน้าที่เป็นตัวกรอง/ฟิลเตอร์[5] ที่อาจมีบทบาทต่าง ๆ รวมทั้ง แยกแยะกลิ่น, เพิ่มความไวการตรวจจับกลิ่น, กรองกลิ่นพื้นหลังเพื่อเพิ่มสัญญาณกลิ่นที่เลือก, และอำนวยให้สมองระดับสูงควบคุมระดับสัญญาณจากป่องรับกลิ่นตามสภาวะทางสรีรภาพของสัตว์[2]
โครงสร้าง[แก้]
ในสัตว์มีกระดูกสันหลังโดยมาก ป่องรับกลิ่นเป็นส่วนหน้าสุด (rostral) ของสมอง ดังที่เห็นในหนู แต่ในมนุษย์ ป่องรับกลิ่นอยู่ที่ด้านล่างสุด (inferior) ของสมอง ป่องรับกลิ่นมีฐานและเครื่องคุ้มกันเป็นส่วนของกระดูกเอทมอยด์คือแผ่นกระดูกพรุน (cribriform plate) ซึ่งในสัตว์มีกระดูกสันหลัง จะเป็นตัวแยกป่องจากเยื่อรับกลิ่น (olfactory epithelium) แอกซอนจากเซลล์ประสาทรับกลิ่นที่เยื่อรับกลิ่นซึ่งบุบางส่วนของโพรงจมูก จะรวมตัวเป็นมัด ๆ ซึ่งรวม ๆ กันเรียกว่า ประสาทรับกลิ่น/ฆานประสาท (olfactory nerve) แล้ววิ่งผ่านแผ่นกระดูกพรุนไปยังโครงสร้างนิวโรพิลที่เรียกว่าโกลเมอรูลัสในป่องรับกลิ่น โดยไปสุดเป็นไซแนปส์ที่สื่อประสาทแบบเร้าด้วยกลูตาเมต
สำหรับข้อมูลขาออก เซลล์รีเลย์ที่เรียกว่าเซลล์ไมทรัลและ tufted cell จะเป็นตัวส่งสัญญาณกลิ่นออกจากป่องหลังจากการประมวลผลทางไซแนปส์กับ interneuron ต่าง ๆ ภายในป่องรวมทั้งเซลล์รอบโกลเมอรูลัส (periglomerular cell) และ granule cell โดยส่งสัญญาณกลิ่นไปยังส่วนต่าง ๆ ของเปลือกสมองส่วนการได้กลิ่น แม้เซลล์รีเลย์ทั้งสองจะส่งไปยังเป้าหมายต่างกันบ้าง คือ tufted cell จะส่งข้อมูลไปยัง anterior olfactory nucleus, olfactory tubercle, และ piriform cortex แต่เซลล์ไมทรัลจะส่งข้อมูลไปยังส่วนที่กล่าวเหล่านั้นด้วย และส่งไปยังอะมิกดะลาบวกกกับ entorhinal cortex อีกด้วย[6]
ป่องจะแบ่งออกสองส่วน คือ ป่องรับกลิ่นหลัก (main olfactory bulb) และป่องรับกลิ่นเสริม (accessory olfactory bulb) ป่องรับกลิ่นหลักมีหน้าที่รับกลิ่นทั่วไป ส่วนป่องรับกลิ่นเสริมทำงานขนานคู่กับป่องรับกลิ่นหลักโดยรับรู้ฟีโรโมน มนุษย์ไม่ปรากฏว่ามีส่วนที่สามารถจัดว่าเป็นป่องรับกลิ่นเสริมที่ทำงานได้
ชั้นต่าง ๆ[แก้]
ป่องรับกลิ่นหลักมีโครงสร้างเซลล์ประสาทแบบเป็นชั้น ๆ เริ่มจากส่วนผิวไปถึงตรงกลางรวมทั้ง[7][2]
- ชั้นโกลเมอรูลัส ประกอบด้วยแอกซอนจากเซลล์ประสาทรับกลิ่น, เดนไดรต์หลัก (primary/apical) จากเซลล์ประสาทรีเลย์คือเซลล์ไมทรัลและ tufted cell, และตัวอินเตอร์นิวรอน คือเซลล์รอบโกลเมอรูลัส (periglomerular cell) ซึ่งเป็นตัวกำหนดขอบเขตของโกลเมอรูลัส บวกกับเดนไดรต์ของมัน
- External plexiform layer ประกอบด้วยเดนไดรต์ส่วนข้าง/ฐาน (lateral/basal/secondary) ของเซลล์ไมทรัล, ตัว tufted cell และเดนไดรต์ส่วนฐานของมัน, และเดนไดรต์จาก granule cell ที่เชื่อมกับเดนไดรต์อื่น ๆ ในชั้น
- ชั้นเซลล์ไมทรัล ประกอบด้วยตัวเซลล์ไมทรัล
- Internal plexiform layer ประกอบด้วยแอกซอนของเซลล์ไมทรัล
- Granule cell layer ประกอบด้วยตัว Granule cell
ป่องรับกลิ่นส่งข้อมูลกลิ่นจากจมูกไปยังสมอง ดังนั้น จึงเป็นโครงสร้างที่จำเป็นเพื่อได้กลิ่น โดยเป็นวงจรประสาทวงจรหนึ่ง ชั้นโกลเมอรูลัสจะได้รับข้อมูลแบบเร้าโดยตรงจากใยประสาทนำเข้า ซึ่งเป็นมัดแอกซอนจากเซลล์ประสาทรับกลิ่น (olfactory receptor neuron) ประมาณ 12 ล้านตัวในเยื่อเมือกรับกลิ่น (olfactory mucosa) ซึ่งอยู่ในส่วนหนึ่งของช่องจมูกมนุษย์ในซีกร่างกายเดียวกัน[8] ปลายของแอกซอนจะรวมกลุ่มที่โครงสร้างนิวโรพิลรูปกลมซึ่งเรียกว่า glomerulus (พหูพจน์ glomeruli) ซึ่งใหญ่ประมาณ 100-200 ไมโครเมตรและอยู่ติดใต้ผิวของป่องรับกลิ่น[7][2]
เซลล์รอบโกลเมอรูลัสและ granule cell เป็นเซลล์ประสาทในสมองส่วนหน้าประเภทที่สามารถสร้างทดแทนขึ้นใหม่ได้ตลอดชีวิต ซึ่งเป็นคุณสมบัติของเซลล์ประสาทน้อยประเภท[7]
โกลเมอรูลัส[แก้]

เซลล์รับกลิ่นแต่ละตัวจะส่งแอกซอนไปยังโกลเมอรูลัสอันเดียวเท่านั้นโดยเชื่อมกับเดนไดรต์ของทั้งเซลล์รีเลย์และอินเตอร์นิวรอน ส่วนเซลล์รีเลย์คือเซลล์ไมทรัลและ tufted cell ก็จะส่งเดนไดรต์หลักไปยังโกลเมอรูลัสเดียวเช่นกัน แต่สำหรับโกลเมอรูลัสแต่ละตัว จะมีแอกซอนจากเซลล์รับกลิ่นจำนวนเป็นพัน ๆ ที่แสดงออกหน่วยรับกลิ่นประเภทเดียวเท่านั้น เทียบกับเดนไดรต์จากเซลล์รีเลย์เพียง 40-50 ตัว เป็นการลดจำนวนเซลล์ที่ส่งสัญญาณกลิ่นต่อ ๆ กันเป็นร้อยเท่า[2]
เซลล์รับกลิ่นที่แสดงออกหน่วยรับกลิ่นประเภทเดียวกันจะส่งแอกซอนไปยังโกลเมอรูลัสไม่กี่อันในข้างทั้งสองของป่องรับกลิ่น (ปกติเป็นคู่) โดยตำแหน่งของโกลเมอรูลัสเช่นนี้ในป่องรับกลิ่นทั้งสองข้างจะสมมาตรกัน และตำแหน่งเช่นนี้จะคล้ายกันในระหว่างสัตว์แต่ละตัว ส่วนอินเตอร์นิวรอนคือเซลล์รอบโกลเมอรูลัสจะได้รับข้อมูลขาเข้าแบบเร้าจากเซลล์รับกลิ่น และสื่อประสาทแบบยับยั้งผ่านไซแนปส์แบบเดนไดรต์-เดนไดรต์ กับเซลล์รีเลย์ทั้งสองชนิดภายในโกลเมอรูลัสเดียวกันหรือบางทีในโกลเมอรูลัสข้าง ๆ ด้วย ซึ่งอาจช่วยปรับข้อมูลกลิ่น[2]
โครงสร้างเช่นนี้ในป่องรับกลิ่นอาจมีประโยชน์หลายอย่างคือ[2]
- เป็นการรวมสัญญาณกลิ่นจากหน่วยรับกลิ่นประเภทเดียวกันเพื่อส่งต่อโดยเซลล์รีเลยไม่กี่ตัว จึงอาจช่วยให้ได้กลิ่นอ่อน ๆ ได้ดี
- ตำแหน่งของโกลเมอรูลัสเป็นคู่หรือหลายตัวที่ได้รับข้อมูลจากหน่วยรับกลิ่นประเภทเดียวกันจะไม่เปลี่ยนตลอดชีวิต แม้เซลล์ประสาทรับกลิ่นและแอกซอนของมันจะต้องทดแทนใหม่เรื่อย ๆ นี่จึงเป็นแผนที่กลิ่นที่สามารถใช้เข้ารหัสกลิ่นได้อย่างคงที่ตลอดชีวิต ดังนั้น สัตว์จึงสามารถจำกลิ่นที่เคยประสบในอดีตนาน ๆ ได้
- การสื่อสัญญาณแบบยับยั้งจากเซลล์รอบโกลเมอรูลัสและ granule cell อาจช่วยทำให้ได้กลิ่นชัดขึ้นโดยระงับการส่งสัญญาณกลิ่นพื้นฐานที่อ่อน และเน้นสัญญาณกลิ่นที่ชัดกว่าเมื่อส่งสัญญาณต่อไปยังเปลือกสมองส่วนการได้กลิ่น
ชั้นโกลเมอรูลัสของป่องรับกลิ่นเป็นระดับแรกที่แปลผลข้อมูลกลิ่นผ่านไซแนปส์[9] เพราะกลิ่นต่าง ๆ ที่สัมพันธ์อย่างใกล้ชิดดูเหมือนจะทำให้โกลเมอรูลัสใกล้ ๆ กันทำงาน ชั้นนี้จึงอาจเป็นแผนที่ที่จัดตามโครงสร้างทางเคมีของโมเลกุลกลิ่น เช่น ตามหมู่ทำหน้าที่ (functional group) และตามความยาวของโซ่คาร์บอนเป็นต้น แผนที่จะแบ่งออกเป็นกลุ่ม ๆ คือเป็นโกลเมอรูลัสที่คล้าย ๆ กัน และดังนั้น จะทำงานตอบสนองต่อกลิ่นที่คล้าย ๆ กัน แผนที่ของชั้นโกลเมอรูลัสอาจใช้เพื่อการรับรู้กลิ่นในเปลือกสมองส่วนการรู้กลิ่น (olfactory cortex) ที่ประมวลผลในขั้นต่อ ๆ ไป[10]
โกลเมอรูลัสที่ได้ข้อมูลจากหน่วยรับกลิ่นชนิดเดียวกันจะตอบสนองต่อกลิ่นเป็นบางอย่าง กลิ่นหนึ่ง ๆ จะทำให้โกลเมอรูลัสหลายกลุ่มทำงาน กลิ่นที่แรงเพิ่มขึ้นจะเพิ่มการทำงานของโกลเมอรูลัสหนึ่ง ๆ แต่ก็ยังเพิ่มจำนวนโกลเมอรูลัสที่ทำงานด้วย[7] กลุ่มโดยเฉพาะกลุ่มหนึ่งสัมพันธ์กับกลิ่นเหม็นเน่า ซึ่งเป็นคุณสมบัติพิเศษทางเคมี ซึ่งอาจวิวัฒนาการเกิดขึ้นเพื่อช่วยระบุอาหารที่ไม่ควรกินอีกต่อไป
โกลเมอรูลัสจำนวนน้อยดูเหมือนจะตอบสนองต่อกลิ่นบริสุทธิ์ต่างหาก ๆ ดังนั้น ก็น่าจะหวังได้ว่า โกลเมอรูลัสจำนวนมากจะตอบสนองต่อกลิ่นธรรมชาติซึ่งเป็นสารประกอบที่ซับซ้อน เช่น กลิ่นกาแฟ ผลไม้เป็นต้น แต่ปรากฏว่า แม้สำหรับกลิ่นธรรมชาติ ก็ยังเป็นโกลเมอรูลัสจำนวนน้อยที่ตอบสนอง เพราะฉะนั้น ระบบรับกลิ่นดูเหมือนจะตอบสนองต่อแค่สารเคมีหลัก ๆ ในกลิ่นธรรมชาติหนึ่ง ๆ เท่านั้น เป็นกระบวนการที่สามารถเรียกได้ว่า การเข้ารหัสแบบใช้โครงสร้างน้อยส่วน (sparse coding)[7] และเพราะมีกลุ่มโกลเมอรูลัสที่ตอบสนองต่อกลิ่น ๆ หนึ่งอย่างเป็นรูปแบบ นี่ก็สามารถเรียกได้ว่า การเข้ารหัสเชิงผสม (combinational coding)[11]
External plexiform layer[แก้]
การแปลผลขั้นต่อไปในป่องรับกลิ่นเกิดที่ชั้น external plexiform layer ซึ่งอยู่ระหว่างชั้นโกลเมอรูลัสและชั้นเซลล์ไมทรัล แม้ชั้นนี้จะมีเซลล์ประสาทแบบแอสโทรไซต์, interneuron, และเซลล์ไมทรัลบ้าง แต่ก็มีตัวเซลล์ไม่มากเพราะเป็นเดนไดรต์ของเซลล์ไมทรัลและ granule cell โดยมาก[12]
ในชั้น External plexiform เซลล์รีเลย์คือเซลล์ไมทรัลและ tufted cell จะมีเดนไดรต์ด้านข้างที่เชื่อมกับเดนไดรต์ของ granule cell โดยเซลล์รีเลย์จะส่งสัญญาณแบบเร้า และ granule cell จะส่งสัญญาณแบบยับยั้ง เป็นโครงสร้างที่อำนวยการป้อนกลับสัญญาณเชิงลบ (negative feedback)[2]
Granule cell[แก้]
มี interneuron มากมายหลายประเภทในป่องรับกลิ่นรวมทั้งเซลล์รอบโกลเมอรูลัส (periglomerular cell) ซึ่งมีไซแนปส์อยู่ทั้งในโกลเมอรูลัสเดียวกันและต่าง ๆ กัน และมี granule cell ซึ่งมีไซแนปส์กับเซลล์รีเลย์คือเซลล์ไมทรัลและ tufted cell ชั้น granule cell เป็นชั้นลึกที่สุดของป่องรับกลิ่น ซึ่งประกอบด้วย granule cell ที่ส่งเดนไดรต์ไปสุดเป็นไซแนปส์กับเดนไดรต์ของเซลล์รีเลย์ในชั้น external plexiform[13]
granule cell ในป่องรับกลิ่นปกติของสัตว์มีกระดูกสันหลังจะไม่มีแอกซอนและสื่อประสาทโดยกาบา แต่ละเซลล์จะมีเดนไดรต์ส่วนฐานสั้น ๆ และเดนไดรต์ส่วนยอดยาวอันหนึ่งที่ยื่นไปทาง granule cell layer เข้าไปในชั้นเซลล์ไมทรัล เดนไดรต์จะไปยุติเป็นสาขาต่าง ๆ ภายในชั้น external plexiform พร้อมกับเดนไดรต์ต่าง ๆ ของเซลล์รีเลย์ที่เป็นส่วนของ olfactory tract[14] ในป่องรับกลิ่นของสัตว์เลี้ยงลูกด้วยนม granule cell จะสามารถรับและส่งข้อมูลภายใน spine ของเดนไดรต์ที่ใหญ่[15]
granule cell เป็นเซลล์สื่อสัญญาณแบบกาบาซึ่งมีจำนวนมากที่สุดในป่อง การส่งสัญญาณแบบยับยั้งของเซลล์มีบทบาทที่ขาดไม่ได้ในการประมวลข้อมูลกลิ่นของป่อง[16] มีข้อมูลแบบเร้าขาเข้าสองแบบที่ granule cell ได้รับ คือข้อมูลที่ได้จากหน่วยรับความรู้สึกแบบ AMPA receptor และแบบ NMDA receptor ซึ่งช่วยให้เซลล์สามารถควบคุมการประมวลผลของป่องรับกลิ่น[16] เซลล์ยังพบว่าสำคัญต่องการสร้างความจำที่เชื่อมกับกลิ่น[17]
หน้าที่[แก้]
ในฐานเป็นวงจรประสาท ป่องรับกลิ่นมีแหล่งข้อมูลความรู้สึกเข้าแหล่งหนึ่ง (คือ แอกซอนจากเซลล์ประสาทรับกลิ่นที่เยื่อรับกลิ่น) และข้อมูลขาออกหนึ่งแหล่ง (คือ แอกซอนของเซลล์ไมทรัลและ tufte cel) ดังนั้น จึงเชื่อโดยทั่ว ๆ ไปว่า มันทำหน้าที่เป็นตัวกรอง/ฟิลเตอร์ ไม่ใช่วงจรประสาทเพื่อเชื่อมโยงซึ่งจะมีข้อมูลขาเข้าและข้อมูลขาออกจำนวนมาก อย่างไรก็ดี ป่องรับกลิ่นยังได้ข้อมูลแบบ "บนลงล่าง" จากส่วนต่าง ๆ ของสมองด้วย เช่น อะมิกดะลา, คอร์เทกซ์ใหม่, ฮิปโปแคมปัส, locus coeruleus, substantia nigra[5], basal forebrain (horizontal of the diagonal band), และ ralph nuclei[2] ซึ่งมีผลต่อข้อมูลกลิ่นที่ส่งออกจากป่อง[18] หน้าที่ที่อาจเป็นไปได้ของมันจึงสามารถจัดได้เป็นหมวดที่ไม่ได้แยกต่างหากจากกันและกัน 4 หมวดคือ[ต้องการอ้างอิง]
- แยกแยะกลิ่น[2]
- เพิ่มความไวการตรวจจับกลิ่น[2]
- กรองกลิ่นพื้นหลังจำนวนมากเพื่อเพิ่มสัญญาณกลิ่นที่เลือกไม่กี่กลิ่น[2]
- อำนวยให้สมองระดับสูงควบคุมระดับสัญญาณจากป่องรับกลิ่นตามสภาวะทางสรีรภาพของสัตว์ เช่น เมื่อสัตว์หิว จะทำให้กลิ่นอาหารชัดขึ้น[2]
แม้หน้าที่เหล่านี้โดยทฤษฎีอาจมาจากวงจรประสาทของป่องรับกลิ่น แต่ก็ไม่ชัดเจนว่า มีหน้าที่ไหนหรือไม่ที่ป่องรับกลิ่นทำเองทั้งหมด โดยอาศัยความคล้ายคลึงกันจากส่วนต่าง ๆ ของสมองเช่น จอตา นักวิจัยจำนวนมากได้มุ่งตรวจว่า ป่องรับกลิ่นจะกรองข้อมูลขาเข้าจากเซลล์ประสาทรับกลิ่นตามพื้นที่หรือตามเวลาได้อย่างไร ตัวกรองหลักที่เสนอก็คือ interneuron สองกลุ่ม คือ เซลล์รอบโกลเมอรูลัสและ granule cell การแปลผลจะเกิดในชั้นต่าง ๆ ของป่องรับกลิ่นหลัก เริ่มด้วยแผนที่เชิงพื้นที่ที่จัดหมวดกลิ่นต่าง ๆ ในชั้นโกลเมอรูลัส[10]
ต่อจากนั้น Interneuron ต่าง ๆ ในชั้น external plexiform layer จะตอบสนองต่อสัญญาณกลิ่นแบบเร้า โดยส่งศักยะงานทั้งแบบเร้าและแบบยับยั้ง การส่งกระแสประสาทจะแปรไปตามเวลา โดยมีระยะที่ยิงสัญญาณแบบเร็วและเกิดขึ้นทันที และระยะที่ยิงสัญญาณอย่างช้า ๆ รูปแบบการยิงสัญญาณอาจเกี่ยวกับการสูดดม หรือความเปลี่ยนแปลงในความรุนแรงหรือความเข้มข้นของกลิ่น[12] รูปแบบทางเวลาอาจมีผลต่อการแปลผลในระดับต่อไปในเรื่องแหล่งของกลิ่น[ต้องการอ้างอิง] ยกตัวอย่างเช่น การยิงขบวนศักยะงานแบบประสานของเซลล์ไมทรัล ดูเหมือนจะช่วยแยกแยะกลิ่นที่คล้าย ๆ กันดีกว่าเมื่อขบวนศักยะงานไม่ประสาน[19]
ระบบรับกลิ่นต่างจากระบบรับความรู้สึกอื่น ๆ ที่ปลายประสาทรับความรู้สึกของระบบจะมีเซลล์ส่งสัญญาณต่อ (relay neuron) ที่ทาลามัส / diencephalon คือป่องรับกลิ่นจะมีบทบาทนี้แทนในระบบรับกลิ่น[20]
การยับยั้งในชั้น external plexiform[แก้]
interneuron ในชั้น external plexiform รวมทั้ง granule cell จะส่งสัญญาณป้อนกลับแบบยับยั้ง (feedback inhibition) แก่เซลล์รีเลย์ คือ เซลล์ไมทรัลและ tufted cell และก็ส่งสัญญาณยับยั้งจากเซลล์ข้าง ๆ (lateral inhibition) แก่เซลล์รีเลย์ด้วย การยับยั้งเช่นนี้สำคัญต่อการได้กลิ่นเพราะมันช่วยแยกแยะกลิ่นโดยลดการตอบสนองต่อกลิ่นพื้นฐาน และเพิ่มความต่างของข้อมูลขาเข้าจากเซลล์รับกลิ่น[9] การยับยั้งการตอบสนองของเซลล์รีเลย์โดย interneuron ต่าง ๆ จะอำนวยการแยกแยะกลิ่นและการแปลผลในระดับสูงขึ้น โดยควบคุมข้อมูลขาออกของป่องรับกลิ่น เพราะการเพิ่มขั้ว (hyperpolarization) ที่เป็นผลจากการยับยั้งเนื่องกับการได้กลิ่น จะแต่งการตอบสนองของเซลล์ไมทรัลเพื่อให้เฉพาะเจาะจงต่อกลิ่นหนึ่ง ๆ ยิ่งขึ้น[13]
เดนไดรต์ส่วนฐานของเซลล์รีเลย์จะเชื่อมกับ interneuron ที่เรียกว่า granule cell ซึ่งบางทฤษฎีแสดงว่า อำนวยการยับยั้งจากข้าง ๆ ระหว่างเซลล์รีเลย์ ไซแนปส์ระหว่างเซลล์รีเลย์กับ granule cell อยู่ในรูปแบบที่มีน้อยคือเดนไดรต์-เดนไดรต์ (dendro-dendritic) โดยทั้งสองฝั่งของไซแนปส์ต่างก็เป็นเดนไดรต์ที่สื่อประสาท ในกรณีเฉพาะนี้ เซลล์รีเลย์จะหลั่งสารสื่อประสาทแบบเร้าคือ กลูตาเมต และ granule cell จะหลั่งสารสื่อประสาทแบบยับยั้งคือ กรดแกมมาอะมิโนบิวทีริก (GABA) เพราะการสื่อสารแบบเกิดได้ทั้งสองทางเช่นนี้ เซลล์รีเลย์จึงอาจยับยั้งแม้ตนเอง (auto-inhibition) และยับยั้งเซลล์ไมทรัลข้าง ๆ ได้ด้วย (lateral inhibition) กล่าวอีกอย่างก็คือ ชั้น granule cell จะได้รับสัญญาณแบบเร้าผ่านกลูตาเมตจากเดนไดรต์ส่วนฐานของเซลล์ไมทรัลและ tufted cell ส่วน granule cell เองก็จะหลั่งสาร GABA ซึ่งมีผลยับยั้งเซลล์รีเลย์[13]
ยังไม่ชัดเจนว่า การยับยั้งจากเซลล์ข้าง ๆ มีผลอะไร แต่อาจเป็นการเพิ่มอัตราส่วนของสัญญาณต่อสัญญาณรบกวน (signal-to-noise ratio) ของข้อมูลกลิ่น โดยยับยั้งการตอบสนองในอัตราพื้นฐานของเซลล์รอบ ๆ ที่ไม่ได้รับสิ่งเร้าหรือสิ่งเร้าที่อ่อน ซึ่งช่วยในการแยกแยะกลิ่น[9] งานวิจัยอื่น ๆ แสดงนัยว่า การยับยั้งข้าง ๆ ทำให้ตอบสนองต่อกลิ่นในรูปแบบต่าง ๆ กัน ซึ่งช่วยในการแปลผลและรับรู้กลิ่นต่าง ๆ[13]
ยังมีหลักฐานด้วยว่าสารสื่อประสาท acetylcholine ซึ่งมาจากเซลล์ประสาทแบบ cholinergic ในระบบประสาทกลางระดับสูงขึ้น มีผลเพิ่มการลดขั้วของ granule cell ทำให้มันเร้าได้ง่ายขึ้น ซึ่งก็มีผลยับยั้งเซลล์รีเลย์มากขึ้น ซึ่งทำให้ข้อมูลกลิ่นจากป่องรับกลิ่นเฉพาะเจาะจงมากขึ้นและสามารถแยกแยะได้ดีขึ้น[21][22]
ป่องรับกลิ่นเสริม (Accessory Olfactory Bulb)[แก้]
ป่องรับกลิ่นเสริม (accessory olfactory bulb, ตัวย่อ AOB) ซึ่งอยู่ที่ส่วนบนด้านหลัง (dorsal-posterior) ของป่องรับกลิ่นหลัก เป็นวิถีประสาทที่ขนานและเป็นอิสระจากป่องรับกลิ่นหลัก vomeronasal organ (VNO) (ที่มนุษย์ผู้ใหญ่เพียงแค่ 8% มี[23]) เป็นอวัยวะรับความรู้สึกในจมูกที่ส่งกระแสประสาทไปยังป่องรับกลิ่นเสริม[24][25] จึงทำให้มันเป็นตัวแปลผลทุติยภูมิของระบบรับกลิ่นเสริม (accessory olfactory system)
มีหลักฐานปฏิเสธว่า มนุษย์และไพรเมตอื่น ๆ มีป่องรับกลิ่นเสริมที่ใช้งานได้[26] คือ นอกจากมนุษย์โดยมากจะไม่มี VNO แล้ว ก็ยังไม่มีส่วนในป่องรับกลิ่นที่สามารถจัดเป็น AOB ได้อีกด้วย[27]
เหมือนกับป่องรับกลิ่นหลัก แอกซอนขาเข้าของป่องรับกลิ่นเสริมจะไปสุดที่ไซแนปส์ซึ่งเชื่อมกับเซลล์ไมทรัลและ tufted cell ภายในโกลเมอรูลัส โดยป่องรับกลิ่นเสริมจะได้แอกซอนขาเข้าจาก vomeronasal organ ซึ่งเป็นเยื่อรับความรู้สึกต่างหากจากเยื่อรับกลิ่น และตรวจจับสิ่งเร้าเคมีเช่นฟีโรโมนที่เกี่ยวข้องกับพฤติกรรมทางสังคมและทางการสืบพันธุ์ แต่ก็อาจจะตรวจจับกลิ่นทั่ว ๆ ไปได้ด้วย[28] มีสันนิษฐานว่า เพื่อจะให้ปั๊มของอวัยวะเริ่มทำงาน เยื่อรับกลิ่นหลักจะต้องได้กลิ่นที่สมควรก่อน[29] แต่ก็ยังเป็นไปได้อยู่ว่า ระบบรับกลิ่นเสริมทำงานขนานกับหรือต่างหากจากการรับกลิ่นทั่วไป
เซลล์ประสาทรับความรู้สึกแบบ vomeronasal จะส่งสัญญาณแบบเร้าโดยตรงให้กับเซลล์ประสาทหลักของ AOB คือเซลล์ไมทรัล[30] ซึ่งก็จะส่งข้อมูลต่อไปยังอะมิกดะลาและไฮโปทาลามัส ดังนั้น ระบบรับกลิ่นเสริมจึงมีบทบาทโดยตรงเกี่ยวกับการทำงานของฮอร์โมนทางเพศ และอาจมีอิทธิพลต่อความดุและพฤติกรรมทางเพศ[31]
เซลล์ประสาทรับความรู้สึกที่มีหน่วยรับความรู้สึกประเภทเดียวกันจะส่งแอกซอนไปยังโกลเมอรูลัสเดียวกัน ๆ เหมือนกับในป่องรับกลิ่นหลัก แต่ต่างกันตรงที่โกลเมอรูลัสสำหรับหน่วยรับความรู้สึกหนึ่ง ๆ จะมีมากกว่าคู่ คือ อาจมีถึง 6-30 อัน และกระจายไปตามป่องรับกลิ่นเสริมในรูปแบบที่ไม่ตายตัวเท่ากับป่องหลัก[32][30] ที่โกลเมอรูลัสซึ่งรับข้อมูลจากหน่วยรับกลิ่นชนิดเดียวกันมักจะมีเป็นคู่โดยแต่ะละอันจะอยู่ในด้านตรงข้ามของป่อง
นอกจากนั้น AOB ยังแบ่งออกเป็นสองส่วน คือ ส่วนหน้า (anterior) และส่วนหลัง (posterior) ซึ่งได้สัญญาณเข้าต่างหาก ๆ จากเซลล์รับความรู้สึกสองกลุ่มคือ V1R และ V2R ตามลำดับ[33] ซึ่งเป็นการทำงานแยกกันโดยเฉพาะ ๆ เพราะเซลล์รับความรู้สึกเหล่านี้แยกตรวจจับสิ่งเร้าทางเคมีที่มีประเภทและมวลโมเลกุลซึ่งต่างกัน ในหนูหริ่ง V1R และ V2R แต่ละกลุ่มมีสมาชิกมากกว่า 100 ชนิด[32]
การแยกส่วนทำงานเช่นนี้ไม่ได้ดำรงในส่วนต่อ ๆ ไป เพราะเซลล์ไมทรัลจากทั้งสองส่วนจะส่งแอกซอนออกไปรวมกัน คือ ความแตกต่างที่ชัดอีกอย่างของวงจรประสาทของ AOB เมื่อเทียบกับป่องรับกลิ่นหลักก็คือ เซลล์ไมทรัลหนึ่ง ๆ จะส่งเดนไดรต์ไปเชื่อมกับโกลเมอรูลัสของป่องรับกลิ่นเสริมหลายอัน ไม่ใช่อันเดียวเหมือนในป่องหลัก[34] โดยเป็นโกลเมอรูลัสที่แต่ละอันรับแอกซอนมาจากหน่วยรับกลิ่นต่าง ๆ ชนิดกันอีกด้วย ซึ่งไม่เหมือนกับป่องหลักที่เซลล์ไมทรัลจะรับข้อมูลหลักมาจากโกลเมอรูลัสอันเดียวซึ่งรับข้อมูลมาจากหน่วยรับกลิ่นชนิดเดียว ซึ่งแสดงว่า สิ่งเร้าที่ได้จาก VNO จะประมวลผลใน AOB อย่างแตกต่างและซับซ้อนกว่า สิ่งเร้าที่ได้จากเซลล์ประสาทรับกลิ่น จริงอย่างนั้น เซลล์ไมทรัลของ AOB มีรูปแบบการยิงสัญญาณที่ต่างจากเซลล์รีเลย์ของป่องรับกลิ่นอื่น ๆ[35]
อย่างไรก็ดี ก็ยังมีงานศึกษาเมื่อไม่นานที่แสดงว่า เดนไดรต์หลายอันของเซลล์ไมทรัลแม้ไม่ทั้งหมด จะส่งไปยังโกลเมอรูลัสที่ได้รับข้อมูลจากหน่วยรับกลิ่นประเภทเดียวกัน[36] จึงทำให้มีสมมติฐานว่า เซลล์ไมทรัลจะเป็นตัวรวมข้อมูลกลิ่นที่ส่งกระจายไปยังโกลเมอรูลัสต่าง ๆ โดยการกระจายของโกลเมอรูลัสก็เพื่อให้สามารถประมวลสัญญาณเทียบกับโกลเมอรูลัสข้าง ๆ แบบ lateral inhibition และการกระจายเช่นนี้ไม่จำเป็นในป่องรับกลิ่นหลักก็เพราะมีเครือข่ายประสาทระหว่างโกลเมอรูลัสที่กว้างขวางกว่าที่พบใน AOB[34]
นอกจากนั้น สัญญาณจาก "บนลงล่าง" ซึ่งสมองในระดับที่สูงขึ้นส่งสัญญาณไปยังป่องรับกลิ่นเสริม ก็ยังมีผลควบคุมข้อมูลที่ส่งออกจากป่องต่างจากป่องรับกลิ่นหลักอีกด้วย[37]
การแปลผลในขั้นต่อ ๆ ไป[แก้]
ป่องรับกลิ่นส่งข้อมูลเพื่อแปลผลต่อ ทั้งโดยตรงและโดยอ้อมไปยังอะมิกดะลา, orbitofrontal cortex (OFC), และฮิปโปแคมปัส ซึ่งมีบทบาทเกี่ยวกับอารมณ์ ความจำ และการเรียนรู้ ป่องรับกลิ่นหลักจะเชื่อมกับอะมิกดะลาโดยตรงกับส่วนเฉพาะ ๆ ในอะมิกดะลา[38] (คือ cortical nuclei ของอะมิกดะลาทั้งส่วนหน้าและหลัง[4]) ส่วนฮิปโปแคมปัสจะเชื่อมกับป่องผ่าน Entorhinal cortex[4][39]
อะมิกดะลา[แก้]
การเรียนรู้แบบเชื่อมโยง (Associative learning) ซึ่งเชื่อมกลิ่นและการตอบสนองทางพฤติกรรมจะเกิดที่อะมิกดะลา กลิ่นสามารถเป็นตัวเสริมแรงหรือตัวตัดแรงเมื่อกำลังเรียนรู้กลิ่นคู่กับประสบการณ์ที่ดีหรือไม่ดี ไม่ว่าจะโดยทางพฤติกรรมหรือทางอารมณ์ จนกระทั่งตัวกลิ่นเองสามารถทำให้เกิดการตอบสนองทางอารมณ์เอง[40]
ฮิปโปแคมปัส[แก้]
ฮิปโปแคมปัสช่วยให้สามารถจำและเรียนรู้เกี่ยวกับกลิ่นได้ เช่น การสัมพันธ์กลิ่นกับความรู้สึกที่ดี ๆ ข้อมูลกลิ่นที่ฮิปโปแคมปัสยังช่วยสร้างความจำอาศัยเหตุการณ์ (episodic memory) อีกด้วย เช่น การได้กลิ่นอาจช่วยให้ระลึกถึงเหตุการณ์ในอดีตได้[41]
Orbitofrontal cortex[แก้]
ข้อมูลกลิ่นจะส่งไปยังเปลือกสมองส่วนรับกลิ่น (olfactory cortex) ซึ่งก็จะส่งข้อมูลต่อไปยัง orbitofrontal cortex (OFC)[39][3] OFC มีบทบาทต่อความสัมพันธ์ระหว่างกลิ่นกับความรู้สึกที่ดี ๆ ด้วย เพราะเป็นส่วนที่ประเมินค่าของรางวัล เช่น คุณค่าทางโภชนาการของอาหาร[40] OFC ยังส่งข้อมูลต่อไปยัง anterior cingulate cortex ซึ่งมีบทบาทเกี่ยวกับความอยากอาหาร[42] อนึ่ง OFC ยังสัมพันธ์กลิ่นกับสิ่งเร้าอื่น ๆ อีกด้วย เช่น รสชาติ[40] การรับรู้และการแยกแยะกลิ่นก็เกี่ยวข้องกับ OFC ด้วย[10]
กำเนิดประสาทในผู้ใหญ่[แก้]
ป่องรับกลิ่นบวกกับ dentate gyrus ส่วน subventricular zone และ subgranular zone ของฮิปโปแคมปัส เป็นโครงสร้างสามอย่างในสมองที่ได้พบกำเนิดเซลล์ประสาท (neurogenesis) อย่างต่อเนื่องในสัตว์เลี้ยงลูกด้วยนมที่โตแล้ว[43] แม้เซลล์ประสาทรับกลิ่นก็สามารถเกิดใหม่จากเซลล์ต้นกำเนิดซึ่งอยู่ที่ฐานของเยื่อรับกลิ่น ดังนั้น แอกซอนของเซลล์รับกลิ่นก็จะงอกใหม่ไปที่ป่องรับกลิ่นด้วย แม้จะมีการทดแทนสร้างแอกซอนของเซลล์รับกลิ่นและ interneuron อยู่เสมอ ๆ เซลล์ที่ส่งสัญญาณต่อ (คือเซลล์ไมทรัลและ tufted cell) ซึ่งมีไซแนปส์กับโครงสร้างเหล่านั้น ก็ไม่ใช่ว่าจะเปลี่ยนแปลงได้[ต้องการอ้างอิง] แต่กระบวนการที่ให้กำเนิดประสาทในเขตนี้ ก็ยังเป็นประเด็นการศึกษาอยู่
การแพทย์[แก้]
ความเสียหายต่อป่องรับกลิ่นมีผลเป็นภาวะเสียการรู้กลิ่น (anosmia) ในซีกร่างกายเดียวกัน
งานศึกษาสัตว์ตัวแบบสำหรับโรคซึมเศร้า ได้แสดงความสัมพันธ์ระหว่างป่องรับกลิ่นกับอารมณ์และความจำ คือ การผ่าเอาป่องรับกลิ่นในหนูออก จะมีผลเป็นความเปลี่ยนแปลงทางพฤติกรรมที่คล้ายกับของคนไข้โรคซึมเศร้า ดังนั้น นักวิจัยจึงใช้หนูที่ผ่าเอาป่องรับกลิ่นออกเพื่อศึกษายาแก้ซึมเศร้า[44]
วิวัฒนาการ[แก้]

การเปรียบเทียบโครงสร้างของป่องรับกลิ่นในบรรดาสัตว์มีกระดูกสันหลังต่าง ๆ เช่น กบพันธุ์ Lithobates pipiens และหนูหริ่งบ้านแสดงว่า ทั้งหมดมีแบบคล้าย ๆ กัน (คือ มีชั้น 5 ชั้นที่มีนิวเคลียสของเซลล์หลัก ๆ 3 อย่าง ดูที่โครงสร้าง)
แม้แมลงวันทองก็มีศูนย์การแปลผลกลิ่นที่มีโครงสร้างคล้าย ๆ กัน คือ antennal lobe โดยอธิบายได้อย่างหนึ่งว่า ป่องรับกลิ่นของสัตว์มีกระดูกสันหลังและ antennal lobe ของแมลงมีโครงสร้างคล้ายกันก็เพราะเป็นการแก้ปัญหาซึ่งดีที่สุดสำหรับการแปลผลที่ต้องทำในระบบรับกลิ่น และดังนั้น จึงวิวัฒนาการขึ้นต่างหาก ๆ ในไฟลัมต่าง ๆ ซึ่งเป็นปรากฏการณ์ที่ทั่วไปเรียกว่า วิวัฒนาการเบนเข้า (convergent evolution)[45][46]
อย่างไรก็ดี วิวัฒนาการของป่องรับกลิ่นในมนุษย์อาจมีประโยชน์ในด้านต่าง ๆ ดังที่นักวิชาการได้ยกประเด็นไว้ว่า
การเพิ่มขนาดของสมองเมื่อเทียบกับขนาดร่างกาย คือกระบวนการ encephalization จะสัมพันธ์อย่างแนบแน่นกับวิวัฒนาการของมนุษย์ แต่แม้สายพันธุ์วิวัฒนาการทางกรรมพันธุ์ที่ต่างกัน คือ นีแอนเดอร์ทาลและมนุษย์ที่มีกายวิภาคปัจจุบัน ก็ได้สร้างสปีชีส์มนุษย์ที่มีสมองใหญ่ใกล้ ๆ กัน ดังนั้น ความเข้าใจเกี่ยวกับวิวัฒนาการของสมองมนุษย์ควรจะรวมงานวิจัยเรื่องการจัดระเบียบของสมองใหญ่โดยเฉพาะ ซึ่งอาจสะท้อนโดยรูปร่างของสมองที่เปลี่ยนไป
ในงานนี้ เราถือเอาประโยชน์จากความประสานกันทางพัฒนาการระหว่างสมองและฐานกะโหลกที่เป็นมูลฐาน เพื่อตรวจสอบสมมติฐานของวิวัฒนาการสมองในมนุษย์สกุล Homo การวิเคราะห์ค่าวัดสัณฐานตามลักษณะทางเลขาคณิตใน 3 มิติของรูปร่างกะโหลกศีรษะภายใน ได้แสดงรายละเอียดความเปลี่ยนแปลงทางวิวัฒนาการของ Homo sapiens ที่ไม่เคยกล่าวถึงมาก่อน คือ ป่องรับกลิ่นที่ใหญ่กว่า, orbitofrontal cortex ที่กว้างกว่าโดยเปรียบเทียบ, และ temporal lobe poles ที่ใหญ่ขึ้นและยื่นไปข้างหน้ามากขึ้น ทั้งหมดดูเหมือนจะเป็นเอกลักษณ์ของมนุษย์ปัจจุบัน
การจัดระเบียบสมองเช่นนี้ นอกจากจะมีผลทางกายภาพต่อรูปร่างของกะโหลกศีรษะโดยทั่วไป ก็อาจมีส่วนต่อวิวัฒนาการของสมรรถภาพทางการเรียนรู้และทางสังคมใน H. sapiens ด้วย ซึ่งการได้กลิ่นที่ดีกว่าและผลของมันโดยนัยทางประชาน ทางประสาท และทางพฤติกรรม ก็อาจเป็นปัจจัยที่จนกระทั่งบัดนี้ได้ประเมินค่าต่ำไป
— Evolution of the base of the brain in highly encephalized human species (Bastir et al. 2011)[47]
ดูเพิ่ม[แก้]
เชิงอรรถและอ้างอิง[แก้]
- ↑ "olfactory", ศัพท์บัญญัติอังกฤษ-ไทย, ไทย-อังกฤษ ฉบับราชบัณฑิตยสถาน (คอมพิวเตอร์) รุ่น ๑.๑ ฉบับ ๒๕๔๕,
(วิทยาศาสตร์) -รับกลิ่น (แพทยศาสตร์) -รู้กลิ่น
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 Buck & Bargmann 2013a, Sensory Inputs in the Olfactory Bulb Are Arranged by Receptor Type, pp. 717-719
- ↑ 3.0 3.1 Doty & Saito 2008, Figure 1: Primary afferent neural connections of the human olfactory system, p. 866
- ↑ 4.0 4.1 4.2 Buck & Bargmann 2013a, The Olfactory Bulb Transmits Information to the Olfactory Cortex, pp. 720
- ↑ 5.0 5.1 Zurawicki, Leon (2010-09-02). Neuromarketing: Exploring the Brain of the Consumer. Springer Science & Business Media. p. 22. ISBN 978-3-540-77828-8. สืบค้นเมื่อ 2015-07-04.
- ↑ Buck & Bargmann 2013, Figure 32-8 The olfactory cortex, p.720
- ↑ 7.0 7.1 7.2 7.3 7.4 Purves et al 2008a, The Olfactory Bulb, pp. 378-381
- ↑ Purves et al 2008a, Figure 15.2 Odorant perception in mammals, p. 366
- ↑ 9.0 9.1 9.2 Hamilton, K.A.; Heinbockel, T.; Ennis, M.; Szabó, G.; Erdélyi, F.; Hayar, A. (2005). "Properties of external plexiform layer interneurons in mouse olfactory bulb slices". Neuroscience. 133 (3): 819–829. doi:10.1016/j.neuroscience.2005.03.008. ISSN 0306-4522. PMC 2383877. PMID 15896912. 843 KBPDF
- ↑ 10.0 10.1 10.2 Mori, K; Takahashi, YK; Igarashi, KM; Yamaguchi, M (Apr 2006). "Maps of odorant molecular features in the Mammalian olfactory bulb". Physiol. Rev. 86 (2): 409–33. doi:10.1152/physrev.00021.2005. PMID 16601265.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Buck & Bargmann 2013, Different Combinations of Receptors Encode Different Odorants, 715-716
- ↑ 12.0 12.1 Spors, H.; Albeanu, D. F.; Murthy, V. N.; Rinberg, D.; Uchida, N.; Wachowiak, M.; Friedrich, R. W. (2012). "Illuminating Vertebrate Olfactory Processing". Journal of Neuroscience. 32 (41): 14102-14108a. doi:10.1523/JNEUROSCI.3328-12.2012. PMC 3752119. PMID 23055479.
- ↑ 13.0 13.1 13.2 13.3 Scott, JW; Wellis, DP; Riggott, MJ; Buonviso, N (Feb 1993). "Functional organization of the main olfactory bulb". Microsc. Res. Tech. 24 (2): 142–56. doi:10.1002/jemt.1070240206. PMID 8457726.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Neville, K; Haberly, L (2004). The Synaptic Organization of the Brain. Oxford University Press. doi:10.1093/acprof:oso/9780195159561.003.0010.
{{cite book}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Egger, V; Svoboda, K; Mainen, Z (2005). "Dendrodendritic Synaptic Signals in Olfactory Bulb Granule Cells: Local Spine Boost and Global Low-Threshold Spike". The Journal of Neuroscience. 21 (11): 3521–3531. doi:10.1523/JNEUROSCI.4746-04.2005. PMID 15814782.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 16.0 16.1 Balu, R; Pressler, R; Strowbridge, B (2001). "Multiple Modes of Synaptic Excitation of Olfactory Bulb Granule Cells". The Journal of Neuroscience. 21 (21): 5621–5631. doi:10.1523/JNEUROSCI.4630-06.2007.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Jansen, Jaclyn. "First glimpse of brain circuit that helps experience to shape perceptions". ScienceDaily. สืบค้นเมื่อ 2014-03-02.
- ↑ Smith, RS; Hu, R; DeSouza, A; Eberly, CL; Krahe, K; Chan, W; Araneda, RC (2015-07-29). "Differential Muscarinic Modulation in the Olfactory Bulb". The Journal of Neuroscience. 35 (30): 10773–85. doi:10.1523/JNEUROSCI.0099-15.2015. PMC 4518052. PMID 26224860.
- ↑ Linster, Christiane; Cleland, Thomas (2013-06-17). "Spatiotemporal Coding in the Olfactory System". 20 Years of Computational Neuroscience. 9: 238. doi:10.1007/978-1-4614-1424-7_11. สืบค้นเมื่อ 2016-03-29.
- ↑ Purves et al 2008a, The Organization of the Olfactory System, pp. 363-365
- ↑ Pressler, R. T.; Inoue, T.; Strowbridge, B. W. (2007). "Muscarinic Receptor Activation Modulates Granule Cell Excitability and Potentiates Inhibition onto Mitral Cells in the Rat Olfactory Bulb". Journal of Neuroscience. 27 (41): 10969–10981. doi:10.1523/JNEUROSCI.2961-07.2007. PMID 17928438. Full Article PDF (1.89 MB)
- ↑ Smith, RS; Hu, R; DeSouza, A; Eberly, CL; Krahe, K; Chan, W; Araneda, RC (2015-07-29). "Differential Muscarinic Modulation in the Olfactory Bulb". The Journal of Neuroscience. 35 (30): 10773–85. doi:10.1523/JNEUROSCI.0099-15.2015. PMC 4518052. PMID 26224860. [10.1523/JNEUROSCI.0099-15.2015 Full Article] PDF (2.77 MB)
- ↑ Purves et al 2008a, Physiological and Behavioral Responses to Odorants, pp. 368-369
- ↑ Taniguchi, K.; Saito, S.; Taniguchi, K. (Feb 2011). "Phylogenic outline of the olfactory system in vertebrates". J Vet Med Sci. 73 (2): 139–47. doi:10.1292/jvms.10-0316. PMID 20877153.
- ↑ Carlson, Neil R. (2013). Physiology of behavior (11th ed.). Boston: Pearson. p. 335. ISBN 0205239390.
- ↑ Brennan, PA; Zufall, F (Nov 2006). "Pheromonal communication in vertebrates". Nature. 444 (7117): 308–15. doi:10.1038/nature05404. PMID 17108955.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ Purves et al 2008a, ฺBox 15A Pheromones, Reproduction, and the Vomeronasal System, pp. 370-371
- ↑ Trinh, K.; Storm DR. (2003). "Vomeronasal organ detects odorants in absence of signaling through main olfactory epithelium". Nat Neurosci. 6 (5): 519–25. doi:10.1038/nn1039. PMID 12665798.
- ↑ Slotnick, B.; Restrepo, D.; Schellinck, H.; Archbold, G.; Price, S.; Lin, W. (Mar 2010). "Accessory olfactory bulb function is modulated by input from the main olfactory epithelium". Eur J Neurosci. 31 (6): 1108–16. doi:10.1111/j.1460-9568.2010.07141.x. PMC 3745274. PMID 20377623.
- ↑ 30.0 30.1 Hovis, KR.; Ramnath, R.; Dahlen, JE.; Romanova, AL.; LaRocca, G.; Bier, ME.; Urban, NN. (June 2012). "Activity regulates functional connectivity from the vomeronasal organ to the accessory olfactory bulb". J Neurosci. 32 (23): 7907–16. doi:10.1523/JNEUROSCI.2399-11.2012. PMC 3483887. PMID 22674266. [www.jneurosci.org/content/32/23/7907.full.pdf Full Article] PDF (2.21 MB)
- ↑ Trotier, D. (Sep 2011). "Vomeronasal organ and human pheromones". European Annals of Otorhinolaryngology Head Neck Diseases. 128 (4): 184–90. doi:10.1016/j.anorl.2010.11.008. PMID 21377439.
- ↑ 32.0 32.1 Buck & Bargmann 2013a, Pheromones Are Detected in Two Olfactory Structures, pp. 721-722
- ↑ Zufall & Leinders-Zufall 2008, Figure 6 Diagram showing the mosaic projection of vomeronasal sensory neurons (VSNs), p. 799
- ↑ 34.0 34.1 Zufall & Leinders-Zufall 2008, 4.43.4.2 Functional Organization of the Accessory Olfactory Bulb, pp. 799-802
- ↑ Shpak, G.; Zylbertal, A.; Yarom, Y.; Wagner, S. (2012). "Calcium-Activated Sustained Firing Responses Distinguish Accessory from Main Olfactory Bulb Mitral Cells". Journal of Neuroscience. 32 (18): 6251–62. doi:10.1523/JNEUROSCI.4397-11.2012. PMID 22553031.
- ↑ Zufall & Leinders-Zufall 2008, 4.43.4.2 Functional Organization of the Accessory Olfactory Bulb, p. 800 อ้างอิงงาน
- Del Punta, K; Puche, A; Adams, N; Rodriguez, I; Mombaerts, P (2002b). "A divergent pattern of sensory axonal projections is rendered convergent by second-order neurons in the accessory olfactory bulb". Neuron. 35: 1057.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์)
- Del Punta, K; Puche, A; Adams, N; Rodriguez, I; Mombaerts, P (2002b). "A divergent pattern of sensory axonal projections is rendered convergent by second-order neurons in the accessory olfactory bulb". Neuron. 35: 1057.
- ↑ Smith, RS; Hu, R; DeSouza, A; Eberly, CL; Krahe, K; Chan, W; Araneda, RC (2015-07-29). "Differential Muscarinic Modulation in the Olfactory Bulb". The Journal of Neuroscience. 35 (30): 10773–85. doi:10.1523/JNEUROSCI.0099-15.2015. PMC 4518052. PMID 26224860.
- ↑ Royet, JP; Plailly, J (Oct 2004). "Lateralization of olfactory processes". Chem. Senses. 29 (8): 731–45. doi:10.1093/chemse/bjh067. PMID 15466819.
{{cite journal}}: CS1 maint: uses authors parameter (ลิงก์) - ↑ 39.0 39.1 Purves et al 2008a, Figure 15.1, p. 364; Central Projections of the Olfactory Bulb, p. 381
- ↑ 40.0 40.1 40.2 Kadohisa, M (2013). "Effects of odor on emotion, with implications". Front Syst Neurosci. 7: 66. doi:10.3389/fnsys.2013.00066. PMC 3794443. PMID 24124415.
- ↑ Rolls, ET (Dec 2010). "A computational theory of episodic memory formation in the hippocampus". Behav. Brain Res. 215 (2): 180–96. doi:10.1016/j.bbr.2010.03.027. PMID 20307583.
- ↑ Rolls, ET (Nov 2012). "Taste, olfactory and food texture reward processing in the brain and the control of appetite". The Proceedings of the Nutrition Society. 71 (4): 488–501. doi:10.1017/S0029665112000821. PMID 22989943.
- ↑ Ming, GL; Song, H (2011-05-26). "Adult neurogenesis in the mammalian brain: significant answers and significant questions". Neuron. 70 (4): 687–702. doi:10.1016/j.neuron.2011.05.001. PMC 3106107. PMID 21609825.
- ↑ Song, C.; Leonard, BE (2005). "The olfactory bulbectomized rat as a model of depression". Neuroscience Biobehavioral Reviews. 29 (4–5): 627–47. doi:10.1016/j.neubiorev.2005.03.010. PMID 15925697.
- ↑ Ache, BW. (Sep 2010). "Odorant-specific modes of signaling in mammalian olfaction". Chem Senses. 35 (7): 533–9. doi:10.1093/chemse/bjq045. PMC 2924424. PMID 20519266.
- ↑ Wang, JW. (Jan 2012). "Presynaptic modulation of early olfactory processing in Drosophila". Dev Neurobiol. 72 (1): 87–99. doi:10.1002/dneu.20936. PMC 3246013. PMID 21688402.
- ↑ Bastir, M.; Rosas, A.; Gunz, P.; Peña-Melian, A.; Manzi, G.; Harvati, K.; Kruszynski, R.; Stringer, C.; Hublin, JJ. (2011). "Evolution of the base of the brain in highly encephalized human species". Nat Commun. 2: 588. doi:10.1038/ncomms1593. PMID 22158443.
The increase of brain size relative to body size—encephalization—is intimately linked with human evolution. However, two genetically different evolutionary lineages, Neanderthals and modern humans, have produced similarly large-brained human species. Thus, understanding human brain evolution should include research into specific cerebral reorganization, possibly reflected by brain shape changes. Here we exploit developmental integration between the brain and its underlying skeletal base to test hypotheses about brain evolution in Homo. Three-dimensional geometric morphometric analyses of endobasicranial shape reveal previously undocumented details of evolutionary changes in Homo sapiens. Larger olfactory bulbs, relatively wider orbitofrontal cortex, relatively increased and forward projecting temporal lobe poles appear unique to modern humans. Such brain reorganization, beside physical consequences for overall skull shape, might have contributed to the evolution of H. sapiens' learning and social capacities, in which higher olfactory functions and its cognitive, neurological behavioral implications could have been hitherto underestimated factors.
อ่านเพิ่ม[แก้]
- Shepherd, G. The Synaptic Organization of the Brain, Oxford University Press, 5th edition (November, 2003). ISBN 0-19-515956-X
- Halpern, M; Martínez-Marcos, A (2003). "Structure and function of the vomeronasal system: An update" (PDF). Progress in Neurobiology. 70 (3): 245–318. doi:10.1016/S0301-0082(03)00103-5. PMID 12951145. S2CID 31122845. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2017-11-07.
- Ache, BW; Young, JM (2005). "Olfaction: Diverse species, conserved principles". Neuron. 48 (3): 417–30. doi:10.1016/j.neuron.2005.10.022. PMID 16269360. S2CID 12078554.
แหล่งข้อมูลอื่น[แก้]
- ภาพสมองตัดแต่งสีซึ่งรวมส่วน "Olfactory bulb" at the BrainMaps project
- "Anatomy diagram: 13048.000-1". Roche Lexicon - illustrated navigator. Elsevier. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2014-01-01.
- Glomerular Response Archive Leon & Johnson UC Irvine เก็บถาวร 2006-01-01 ที่ archive.today
- Olfactory Systems Laboratory at University of Utah
