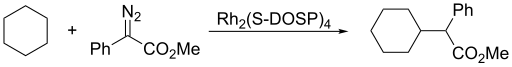คาร์บีน
บทความนี้อาจต้องการตรวจสอบต้นฉบับ ในด้านไวยากรณ์ รูปแบบการเขียน การเรียบเรียง คุณภาพ หรือการสะกด คุณสามารถช่วยพัฒนาบทความได้ |

ในทางเคมี คาร์บีน (อังกฤษ: carbene) เป็นโมเลกุลที่ประกอบด้วยอะตอมของคาร์บอนที่มีสองพันธะและมีแวเลนซ์อิเล็กตรอนที่ไม่มีพันธะอีกสองตัว สูตรทั่วไปคือ RR′C: แต่คาร์บอนอาจมีพันธะคู่กับอีกหมู่แทนก็ได้ คำว่า "carbene" อาจใช้อ้างถึงเพียงแค่สารประกอบ H2C: ซึ่งสามารถเรียกว่าเมทิลีน ซึ่งเป็น parent hydride ที่เกี่ยวข้องกับสารประกอบคาร์บีนอื่นๆ ทั้งหมด[1][2] คาร์บีนอาจจำแนกได้เป็น singlets หรือ triplets โดยขึ้นกับโครงสร้างเชิงอิเล็กตรอนของมัน สารประกอบคาร์บีนส่วนใหญ่มีอายุสั้นมาก แต่สารประกอบคาร์บีนแบบถาวรบางชนิดก็เป็นที่รู้จัก
สารประกอบคาร์บีนชนิดหนึ่งที่มีการศึกษาเป็นอย่างดีได้แก่ Cl2C: หรือ ไดคลอโรคาร์บีน (dichlorocarbene) ซึ่งสามารถสร้างขึ้นแบบ in situ จากคลอโรฟอร์มและเบสแก่
โครงสร้างและพันธะ[แก้]

ประเภททั้งสองของ carbenes ได้แก่ singlet และ triplet โดยที่ carbenes แบบ singlet นั้นเป็นแบบคู่สปิน หรือกล่าวตาม ทฤษฎีพันธะเวเลนซ์ โมเลกุลนี้มีโครงสร้างไฮบริด SP 2 ส่วนกรณี carbenes แบบ Triplet จะมี 2 อิเล็กตรอนโดดเดี่ยว ซึ่งอาจเป็นได้ทั้งแบบเส้นตรงหรือแบบโค้งงอ กล่าวคือ SP หรือแบบไฮบริด SP 2 ก็ได้ carbenes ส่วนใหญ่จะมีสถานะพื้นแบบ triplet นอกจากกลุ่มที่มีไนโตรเจน ออกซิเจน หรือซัลเฟอร์ และฮาไลด์ ที่สร้างพันธะโดยตรงกับคาร์บอนที่มีสองคู่พันธะ
สารประกอบ Carbene อาจเรียกเป็น singlet หรือ triplet โดยขึ้นกับสปินอิเล็กตรอนที่มี สารประกอบ Carbene แบบ Triplet นั้นเป็นสารพาราแมกเนติก และอาจสังเกตได้ด้วยวิธี electron spin resonance spectroscopy หากสารนั้นคงอยู่ได้นานพอสมควร สปินรวมของ Singlet carbenes นั้นเท่ากับศูนย์ ขณะที่สปินรวมของ carbenes triplet เท่ากับหนึ่ง (ในหน่วยของ ) มุมของพันธะคือ 125-140° สำหรับ triplet methylene และ 102° สำหรับ singlet methylene (ตามที่ได้พิจารณาโดย EPR) สาร carbenes triplet โดยทั่วไปมักจะเสถียรในสถานะก๊าซ ในขณะที่ carbenes singlet มักเกิดในตัวกลางที่เป็นของเหลว
สำหรับสารไฮโดรคาร์บอนอย่างง่าย carbenes triplet มักจะมีพลังงาน 8 kcal / mol (33 kJ / mol) ซึ่งต่ำกว่า singlet carbenes (โปรดดูกฎของ Hund ว่าด้วย Maximum Multiplicity) ดังนั้นโดยทั่วไปสถานะ triplet จึงเป็นสภาวะที่เสถียรกว่า (สถานะพื้น) และ singlet เป็นสภาวะถูกกระตุ้น หมู่แทนที่ที่สามารถให้คู่อิเล็กตรอน อาจเพิ่มเสถียรสภาพของสถานะ singlet โดยจะ delocalize คู่อิเล็กตรอนไปยัง p-orbital ที่ว่างอยู่ หากพลังงานของสถานะ singlet ลดลงมากพอ ก็จะทำให้กลายเป็นสถานะพื้นได้ อย่างไรก็ตามยังไม่มีวิธีที่จะรักษาเสถียรภาพ triplet ได้ carbene ที่เรียกว่า 9-fluorenylidene ได้รับการแสดงว่าเป็นส่วนผสมของสถานะ singlet และ triplet ที่เข้าสู่ดุลยภาพอย่างรวดเร็วโดยที่มีส่วนต่างของระดับพลังงานประมาณ 1.1 kcal / mol (4.6 กิโลจูล / โมล) [3] อย่างไรก็ตามยังเป็นที่ถกเถียงกันว่า diaryl carbenes เช่น fluorene carbene นับเป็น carbenes จริงหรือไม่ เนื่องจากอิเล็กตรอนสามารถ delocalize ได้มากจนกระทั่งกลายเป็น biradical ในการทดลอง silico ชี้ให้เห็นว่า carbenes triplet สามารถถูกทำให้เสถียรได้ด้วยกลุ่ม electropositive เช่น trifluorosilyl[4]
ความไวต่อปฏิกิริยา[แก้]

carbenes singlet และ triplet แสดงปฏิกิริยาที่แตกต่างกัน โดยที่ singlet carbenes โดยทั่วไปมีส่วนร่วมในการเกิดปฏิกิริยา cheletropic โดยเป็นทั้ง electrophile s หรือ s nucleophile carbenes singlet ที่มีออร์บิทัล p ว่างอยู่จะมีสมบัติ electrophilic carbenes triplet สามารถพิจารณาให้เป็น diradicals และมีส่วนร่วมในการเพิ่ม radical อย่างเป็นลำดับขั้น carbenes triplet ต้องผ่านสถานะขั้นกลางที่มีสองอิเล็กตรอนไร้คู่ ขณะที่ singlet carbene สามารถทำปฏิกิริยาในขั้นตอนเดียว
เนื่องจากรูปแบบของการเกิดปฏิกิริยาทั้งสองรูปแบบนี้ การเกิดปฏิกิริยาของ singlet methylene จึงเป็น stereospecific ในขณะที่กลุ่ม triplet methylene เป็น stereoselective ความแตกต่างนี้สามารถใช้ในการพิสูจน์ลักษณะธรรมชาติของ carbene ตัวอย่างเช่นปฏิกิริยาของเมทิลีนที่เกิดจากปฏิกิริยา photolysis ของ diazomethane กับ cis -2 butene หรือกับ trans -2-butene ซึ่งจะให้ผลเป็น single diastereomer ของผลิตภัณฑ์ 1, 2 dimethylcyclopropane: cis จาก cis และ trans จาก trans ซึ่งผลดังกล่าวพิสูจน์ให้เห็นว่าเมทิลีนเป็น singlet[5] ถ้าเมทิลีนเป็น triplet เราย่อมไม่หวังผลว่าจะพบผลิตภัณฑ์ที่ขึ้นกับเรขาคณิตเริ่มต้นของอัลคีน แต่จะหวังผลว่าจะได้ส่วนผสมที่เกือบเหมือนกันในแต่ละกรณี
ปฏิกิริยาของ carbene ชนิดใด ๆ โดยเฉพาะนั้นขึ้นอยู่กับกลุ่มแทนที่ ความไวต่อปฏิกิริยาอาจได้รับผลกระทบจากโลหะ สิ่งที่ carbenes ในปฏิกิริยาบางส่วนสามารถทำได้คือการ แทรกตัวลงในพันธะ CH, เปลี่ยนการจัดเรียงโครงร่าง, และการเพิ่มตัวไปยังพันธะคู่ Carbenes สามารถจัดประเภทได้เป็น nucleophilic, electrophilic หรือ ambiphilic ตัวอย่างเช่นถ้าหมู่แทนที่สามารถบริจาคคู่อิเล็กตรอนได้ ก็มีแนวโน้มอย่างมากที่สาร carbene นั้นไม่เป็น electrophilic Alkyl carbenes เกิดการแทรกตัวยากกว่า methylene มาก ซึ่งจะไม่มีความแตกต่างกันระหว่างพันธะ C-H แบบ primary, secondary และ tertiary
การเติมไซโคลโพรเพน (Cyclopropanation)[แก้]

Carbenes จะเพิ่มตัวไปยังพันธะคู่และเปลี่ยนเป็นรูปแบบ cyclopropanes มีกระบวนการแบบขั้นตอนเดียวสำหรับกรณี singlet carbenes ส่วน carbenes Triplet จะไม่รักษาสมบัติ stereochemistry ในโมเลกุลผลิตภัณฑ์ ปฏิกิริยาการเติมโดยทั่วไปจะเกิดอย่างรวดเร็วมากและเป็นปฏิกิริยาคายความร้อน ในกรณีส่วนใหญ่ ขั้นตอนที่ช้าได้แก่ขั้นตอนการสร้าง carbene สารตัวทำปฏิกิริยาที่รู้จักกันดีอย่างหนึ่งสำหรับปฏิกิริยาเปลี่ยนอัลคีนเป็นไซโคลโพรเพน คือ Simmons-Smith reagent สารตัวทำปฏิกิริยานี้เป็นระบบที่ประกอบด้วยทองแดง สังกะสี และไอโอดีน ขณะที่สารตัวทำปฏิกิริยาที่เป็นตัวดำเนินการนั้นเชื่อว่าเป็นiodomethylzinc iodide ตัวทำปฏิกิริยานั้นจะถูกทำเป็นเชิงซ้อนโดยหมู่ไฮดรอกซี เช่นจากการเติมไปยังกลุ่มดังกล่าวตามปกติ
การแทรก C-H[แก้]

การแทรกเป็นอีกปฏิกิริยาของ carbene ที่พบบ่อย โดย carbene นั้นจะเพียงแค่แทรกตัวเองไปยังพันธะที่มีอยู่ ลำดับการเกิดบ่อยโดยทั่วไปได้แก่: 1. พันธะ X-H โดยที่ X ไม่ใช่คาร์บอน 2. พันธะ C-H และ 3. พันธะ C-C การแทรกอาจขึ้นในขั้นตอนเดียวหรือไม่ก็ได้
ปฏิกิริยาการแทรกภายในโมเลกุล เสนอวิธีการสังเคราะห์แบบใหม่ โดยทั่วไปโครงสร้างแข็งเกร็งนั้นมักจะเกิดการแทรกในลักษณะดังกล่าว เมื่อการแทรกแบบภายในโมเลกุลนั้นเป็นไปได้ ก็จะไม่พบการแทรกระหว่างโมเลกุล ในโครงสร้างที่ยืดหยุ่นนั้นมักจะเกิดวงแหวนแบบห้าองค์ประกอบ มากกว่าที่จะเกิดวงแหวนแบบหกองค์ประกอบ ทั้งการแทรกแบบระหว่างโมเลกุลและแบบภายในโมเลกุลนั้น ช่วยการเหนี่ยวนำแบบอสมมาตรโดยการเลือกไครัลลิแกนด์ (chiral ligands) ตามโลหะตรงกลาง
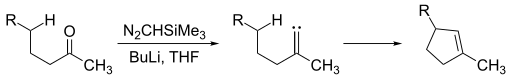
Alkylidene carbenes มีความน่าสนใจเนื่องจากการที่สารนี้ให้การก่อตัว cyclopentene moieties เมื่อต้องการสร้าง carbene alkylidene สามามารถทำโดยให้คีโตนสัมผัสกับ trimethylsilyl diazomethane
ลิแกนด์ Carbene ในโลหะอินทรีย์เคมี[แก้]
ในสารกลุ่มโลหะอินทรีย์ สารเชิงซ้อนโลหะที่มีสูตร LnMCRR' มักจะเรียกว่าเป็นสารเชิงซ้อน carbene อย่างไรก็ตามสารกลุ่มนี้ไม่ได้ทำปฏิกิริยาในลักษณะเดียวกับ carbene อิสระ และมีน้อยมากที่จะเกิดจากสารตั้งต้นของ carbene นอกจากสารคาร์บีนถาวร สารเชิงซ้อน carbene โลหะทรานซิชัน สามารถจำแนกตามความไวต่อปฏิกิริยา โดยที่สองกลุ่มแรกนั้นนิยามได้อย่างชัดเจนว่า :
- Fischer carbenes ซึ่ง carbene สร้างพันธะกับโลหะที่ทำให้เกิดหมู่ที่ดึงอิเล็กตรอน (โดยทั่วไปคือหมู่คาร์บอนิล) ในกรณีดังกล่าว carbenoid carbon จะมีคุณสมบัติ electrophilic อย่างอ่อน
- Schrock carbenes ซึ่ง carbene มีพันธะกับโลหะที่ทำให้เกิดหมู่บริจาคอิเล็กตรอน ในกรณีดังกล่าว carbenoid carbon จะมีคุณสมบัติ nucleophilic และคล้ายกับตัวทำปฏิกิริยา Wittig (ซึ่งไม่จัดว่าเป็นอนุพันธุ์ของ carbene)
- Persistent carbenes หรือที่รู้จักกันในชื่อ Arduengo หรือ Wanzlick carbenes ซึ่งสารกลุ่มนี้รวมถึง N -heterocyclic carbenes (NHCs) ประเภทต่างๆ และมักจะถูกใช้เป็นแอนซิลลารีลิแกนด์ (ancillary ligand) ในทางโลหะอินทรีย์เคมี สาร carbenes ดังกล่าวจะเป็นสเปคเตเตอร์ลิแกนด์ (spectator ligands) ที่มีความไวต่อปฏิกิริยาต่ำ
การสร้าง carbenes[แก้]
- วิธีการที่ใช้ได้อย่างกว้างขวางสำหรับการสังเคราะห์สารอินทรีย์นั้นทำได้โดยการเหนี่ยวนำการกำจัดเฮไลด์จาก gem-dihalide ที่มีตัวทำปฏิกิริยาออร์แกโนลิเทียม (organolithium reagent) ยังคงเป็นที่ไม่แน่นอนว่าจะมีการสร้าง carbene อิสระหรือสารเชิงซ้อน carbene โลหะ ภายใต้สภาวะเหล่านี้หรือไม่ อย่างไรก็ตาม metallocarbenes เหล่านี้ (หรือ carbenoids) จะให้ผลิตภัณฑ์เป็นสารอินทรีย์ที่คาดหวัง
- R2CBr2 + BuLi → R2CLi (Br) + BuBr
- R2CLi (Br) → R2C + LiBr
สำหรับปฏิกิริยา cyclopropanations จะใช้สังกะสี (zinc) ในปฏิกิริยา Simmons-Smith ในกรณีพิเศษแต่อยู่ภายใต้คำแนะนำ สารประกอบ alpha-halomercury สามารถถูกแยกออกและ thermolyzed ต่างหากได้ ตัวอย่างเช่น "Seyferth reagent" C6H5HgCCl3 จะคาย CCl2 เมื่อได้รับความร้อน พร้อมกับสร้าง C6H5HgCl ออกมา
- ในกรณีทั่วไปอย่างที่สุด carbenes จะถูกสร้างขึ้นจาก diazoalkane ผ่านปฏิกิริยา photolytic ความร้อน หรือเส้นทางที่เร่งปฏิกิริยาด้วยโลหะทรานซิชัน [[ทองแดง|ตัวเร่งปฏิกิริยาโดยทั่วไปได้แก่โรเดียมและทองแดง]] ปฏิกิริยา Bamford-Stevens ให้ carbenes ในตัวทำละลายชนิดอะโพรติก (Aprotic solvent) และให้ carbenium ionในตัวทำละลายโพรติก (Protic solvent)
- การกำจัด HX จาก haloforms (CHX3) โดยการเหนี่ยวนำด้วยเบส ภายใต้เงื่อนไขการถ่ายโอนเฟส
- โฟโตไลซิส (Photolysis) จาก diazirines และ epoxides ก็สามารถทำมาใช้ได้ Diazirines คือรูปวงแหวนของ diazoalkanes ความเครียดของแหวนขนาดเล็ก ทำให้เกิดการกระตุ้นด้วยแสง (photoexcitation) ได้ง่าย ปฏิกิริยาโฟโตไลซิส ของ epoxides จะให้สารประกอบคาร์บอนิลเป็นผลข้างเคียง กรณีที่ใช้ epoxides แบบอสมมาตร อาจเกิดสารประกอบคาร์บอนิลสอบแบบที่แตกต่างกันได้ โดยธรรมชาติของหมู่แทนที่นั้นมักจะทำให้เกิดผลแบบหนึ่งมากกว่าอีกแบหนึ่ง หนึ่งในพันธะ C-O จะมีลักษณะพันธะคู่มากกว่า ดังนั้นจึงจะมีความเข็งแรงมากว่าและมีโอกาสถูกทำลายได้ยากกว่า โครงสร้างเรโซแนนสามารถถูกนำมาใช้พิจารณาว่าส่วนใดที่จะมีผลมากกว่าในการก่อตัวของหมู่คาร์บอนิล ขณะที่หมู่ทดแทนหมู่หนึ่งได้แก่ Alkyl และอีกหมู่คือ Aryl คาร์บอนที่ถูกแทนที่โดย Aryl มักจะถูกปล่อยออกมาเป็นชิ้นส่วน carbene
- Carbenes เป็นสารขั้นกลางในปฏิกิริยาการจัดเรียงตัวใหม่ของ Wolff
การประยุกต์ใช้ carbenes[แก้]
มีการประยุกต์ใช้ carbene ขนาดใหญ่ได้แก่การผลิตเชิงอุตสาหกรรมของ tetrafluoroethylene ซึ่งเป็นสารตั้งต้นของเทฟลอน Tetrafluoroethylene ถูกสร้างขึ้นโดยการแทรกของ difluorocarbene: [6]
- CHClF2 → CF2 + HCl
- 2 CF2 → F2C=CF2
ประวัติ[แก้]
Carbenes ได้รับการเสนอโดย Eduard Buchner ในปี 1903 ในการศึกษาปฏิกิริยาการเติมไซโคลโพรเพน (cyclopropanation) ของ ethyl diazoacetate กับ toluene[7] ในปี 1912 Hermann Staudinger [8] ยังทำการแปลงอัลคีนเป็นไซโคลโพรเพนโดยใช้ diazomethane และ CH2 เป็นตัวกลาง ในปี 1954 Doering แสดงการประยุกต์ใช้งานการสังเคระห์ด้วย dichlorocarbene[9]
ดูเพิ่ม[แก้]
- สารเชิงซ้อน carbene โลหะทรานซิชัน ซึ่งรู้จักกันในชื่อ carbenoids
- อะตอมคาร์บอน คาร์บอนอะตอมเดี่ยวซึ่งมีสูตรเคมี C: ซึ่งเท่ากับเป็น carbene แบบสองด้าน และยังสามารถนำมาใช้เพื่อสร้าง "carbenes จริง" ณ ที่เดิม
- Foiled carbenes ได้เสถียรภาพจากความใกล้ชิดของพันธะคู่ (กล่าวคือความสามารถในการสร้างระบบคอนจูเกต)
- สารทดแทน carbene
- Carbenium ion และคาร์บีนที่รับโปรตอน
อ้างอิง[แก้]
- ↑ Hoffmann, Roald (2005). Molecular Orbitals of Transition Metal Complexes. Oxford. p. 7. ISBN 0-19-853093-5.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006-) "carbenes".
- ↑ doi:10.1021/ja00361a014
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ doi:10.1021/jo701615x
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ doi:10.1021/ja01598a087
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ doi:10.1002/0471238961.0914201802011026.a01.pub2
This citation will be automatically completed in the next few minutes. You can jump the queue or expand by hand - ↑ แม่แบบ:Cite DOI
- ↑ แม่แบบ:Cite DOI
- ↑ แม่แบบ:Cite DOI