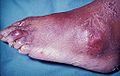
โรคเกาต์
| Gout | |
|---|---|
 เกาต์, ค.ศ. 1799 ภาพล้อเลียนโดย James Gillray | |
| บัญชีจำแนกและลิงก์ไปภายนอก | |
| ICD-10 | M10 |
| ICD-9 | 274.00 274.1 274.8 274.9 |
| OMIM | 138900 300323 |
| DiseasesDB | 29031 |
| MedlinePlus | 000422 |
| eMedicine | emerg/221 med/924 med/1112 oph/506 orthoped/124radio/313 |
| MeSH | D006073 |
โรคเกาต์ (หรือที่รู้จักกันในนาม โพดากรา เมื่อเกิดกับนิ้วหัวแม่เท้า)[1] เป็นภาวะความเจ็บป่วยที่มักสังเกตได้จากอาการไขข้ออักเสบกำเริบเฉียบพลันซ้ำ ๆ—มีอาการแดง ตึง แสบร้อน บวมที่ข้อต่อ ข้อต่อกระดูกฝ่าเท้า-นิ้วเท้าที่โคนนิ้วหัวแม่เท้ามักได้รับผลกระทบบ่อยที่สุด (ประมาณ 50% ของผู้ป่วย) นอกจากนี้ ยังอาจพบได้ในรูปแบบของก้อนโทไฟ นิ่วในไต หรือ โรคไตจากกรดยูริก โรคนี้เกิดจากการมีระดับกรดยูริกในเลือดสูง กรดยูริกตกผลึกแล้วมาจับที่ข้อต่อ เส้นเอ็น และ เนื้อเยื่อโดยรอบ
การวินิจฉัยทางคลินิกทำได้โดยการตรวจผลึกที่มีลักษณะเฉพาะในน้ำไขข้อ รักษาได้โดยยาแก้อักเสบชนิดไม่ใช่สเตอรอยด์ (NSAIDs) สเตอรอยด์ หรือ โคลชิซีน ซึ่งทำให้ผู้ป่วยมีอาการดีขึ้นได้ หลังจากอาการข้ออักเสบกำเริบเฉียบพลันผ่านไปแล้ว ระดับของกรดยูริกในเลือดมักจะลดลงได้โดยการปรับเปลี่ยนวิถีชีวิต และในผู้ที่มีอาการกำเริบบ่อยอาจใช้อัลโลพูรินอลหรือโพรเบเนซิดเพื่อให้การป้องกันในระยะยาว
จำนวนผู้ป่วยโรคเกาต์เพิ่มสูงขึ้นในช่วงหลายสิบปีนี้ โดยมีผลกระทบกับ 1-2% ของชาวตะวันตกในช่วงใดช่วงหนึ่งของชีวิต จำนวนที่เพิ่มขึ้นนี้เชื่อว่าเป็นผลมาจากปัจจัยเสี่ยงที่พบมากขึ้นในประชากร ยกตัวอย่างเช่น กลุ่มอาการเมตาบอลิก อายุขัยที่ยืนยาวขึ้น และ พฤติกรรมการกินอาหารที่เปลี่ยนแปลงไป แต่เดิมนั้นโรคเกาต์เคยได้ชื่อว่าเป็น "โรคของราชา" หรือ "โรคของคนรวย"
สัญญาณและอาการ[แก้]
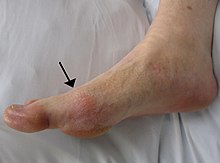
โรคเกาต์สามารถพบได้หลายรูปแบบ ที่พบมากที่สุดคืออาการไขข้ออักเสบกำเริบแบบเฉียบพลัน (ข้อต่อแดง ตึง แสบร้อน บวม)[2] ข้อต่อกระดูกฝ่าเท้า-นิ้วเท้าที่โคนนิ้วหัวแม่เท้ามักได้รับผลกระทบมากที่สุด โดยคิดเป็นจำนวนครึ่งหนึ่งของผู้ป่วยทั้งหมด[3] ข้อต่ออื่น ๆ เช่น ส้นเท้า หัวเข่า ข้อมือ และ นิ้วมือก็อาจได้รับผลกระทบได้เช่นกัน[3] ความเจ็บปวดที่ข้อต่อมักเริ่มขึ้นประมาณ 2–4 ชั่วโมงในเวลากลางคืน[3] เหตุผลที่เกิดอาการกำเริบในเวลากลางคืนเนื่องจากอุณหภูมิของร่างกายลดลงในช่วงเวลานั้น[1] อาจมีอาการอื่น ๆ เกิดขึ้นพร้อมกับอาการปวดข้อบ้าง เช่น ความล้าและมีไข้สูง[1][3]
ระดับของกรดยูริกที่สูงอย่างต่อเนื่องเป็นเวลานาน (ภาวะกรดยูริกในเลือดสูง) อาจส่งผลให้เกิดอาการอื่น ๆ รวมถึงการจับตัวของผลึกกรดยูริกที่แข็งแต่ไม่แสดงอาการเจ็บปวดที่รู้จักกันในนามของ ก้อนโทไฟ การขยายตัวของก้อนโทไฟอาจนำไปสู่โรคไขข้ออักเสบเรื้อรังเนื่องจากการผุกร่อนของกระดูก[4] นอกจากนี้ ระดับที่สูงของกรดยูริกยังอาจนำไปสู่การเกิดผลึกในไต ก่อให้เกิดนิ่วตามด้วยโรคไตจากกรดยูริก[5]
สาเหตุ[แก้]
ภาวะกรดยูริกในเลือดสูง เป็นสาเหตุพื้นฐานของโรคเกาต์ ภาวะนี้อาจเกิดขึ้นได้ด้วยสาเหตุมากมาย ไม่ว่าจะเป็นอาหาร พันธุกรรม หรือ การขับเกลือยูเรทซึ่งเป็นเกลือของกรดยูริกที่ไม่เพียงพอ[2] การขับกรดยูริกไม่เพียงพอของไตเป็นสาเหตุหลักของภาวะกรดยูริกในเลือดสูงในผู้ป่วยประมาณ 90% ในขณะที่การผลิตกรดมากเกินไปเป็นสาเหตุของผู้ป่วยน้อยกว่า 10%[6] ประมาณ 10% ของผู้ป่วยที่มีภาวะกรดยูริกในเลือดสูงจะกลายเป็นโรคเกาต์ในช่วงใดช่วงหนึ่งของชีวิต[7] อย่างไรก็ตาม อัตราความเสี่ยงจะแตกต่างกันไปขึ้นอยู่กับระดับของภาวะกรดยูริกในเลือดสูง หากระดับนี้อยู่ระหว่าง 415 ถึง 530 μmol/l (7 ถึง 8.9 mg/dl) อัตราความเสี่ยงจะอยู่ที่ 0.5% ต่อปี ในขณะที่ผู้ป่วยที่มีระดับกรดยูริกในเลือดสูงกว่า 535 μmol/l (9 mg/dL) อัตราความเสี่ยงจะอยู่ที่ 4.5% ต่อปี[1]
วิถีชีวิต[แก้]
พฤติกรรมการบริโภคอาหารเป็นสาเหตุของการเกิดโรคเกาต์ประมาณ 12%[2] ทั้งนี้รวมถึงการบริโภคเครื่องดื่มแอลกอฮอล์ เครื่องดื่มน้ำหวานที่ผสมฟรักโทส เนื้อสัตว์ และ อาหารทะเล[4][8] ปัจจัยอื่น ๆ ได้แก่ การบาดเจ็บทางร่างกาย และ การผ่าตัด[6] การวิจัยล่าสุดพบว่าปัจจัยเกี่ยวกับพฤติกรรมการบริโภคอาหารที่เคยเชื่อว่าเกี่ยวข้องนั้น ในความเป็นจริงไม่ได้เกี่ยวเลย ไม่ว่าจะเป็นการบริโภคผักที่มีพิวรีนสูง (ตัวอย่างเช่นถั่ว ถั่วลันเตา ถั่วเลนทิล และ ผักโขม) และ โปรตีนทุกชนิด[9][10] การบริโภคกาแฟ วิตามินซี และ ผลิตภัณฑ์นม ตลอดจนการออกกำลังกายดูเหมือนจะช่วยลดความเสี่ยง[11][12][13] ที่เชื่อเช่นนั้นส่วนหนึ่งเนื่องมาจากผลของอาหารเหล่านี้ในการลดภาวะดื้อต่ออินซูลิน[13]
พันธุกรรม[แก้]
การเกิดโรคเกาต์ส่วนหนึ่งมาจากสาเหตุทางพันธุกรรมซึ่งเอื้อต่อประมาณ 60% ของความแปรปรวนในระดับของกรดยูริก[6] ยีนสามตัวคือSLC2A9 SLC22A12 และ ABCG2 ถูกพบว่ามักจะเกี่ยวข้องกับโรคเกาต์และความแปรปรวนของยีนเหล่านี้สามารถเพิ่มความเสี่ยงได้ประมาณสองเท่า[14][15] การกลายพันธุ์ที่ก่อให้เกิดการสูญเสียฟังก์ชันของโปรตีนใน SLC2A9 และ SLC22A12 ก่อให้เกิดภาวะกรดยูริกในเลือดสูงทางพันธุกรรมโดยการลดการดูดซึมและไม่มีการต่อต้านการหลั่งเกลือยูเรท[15] ความผิดปกติทางพันธุกรรมที่หายากบางอย่าง เช่น โรคไตในเด็กที่ถ่ายทอดทางพันธุกรรมจากภาวะกรดยูริกในเลือดสูง โรคถุงน้ำในไตชั้นกลาง การสังเคราะห์ฟอสโฟไรโบซิลไพโรฟอสเฟตมากเกินไป การขาดไฮโปแทนซีน – กวานีนฟอสโฟไรโบซิลทรานสเฟอเรส เช่นที่พบใน กลุ่มอาการ Lesch-Nyhan เกิดความซับซ้อนเพราะโรคเกาต์[6]
ภาวะความเจ็บป่วย[แก้]
โรคเกาต์มักเกิดขึ้นพร้อมกับปัญหาทางการแพทย์อื่น ๆ กลุ่มอาการเมตาบอลิกซึ่งรวมโรคอ้วนลงพุง ความดันโลหิตสูง ภาวะดื้อต่ออินซูลิน และ ระดับไขมันในเลือดผิดปกติ เกิดขึ้นในเกือบ 75% ของผู้ป่วย[3] ภาวะอื่น ๆ ที่มักเกิดความซับซ้อนเพราะโรคเกาต์รวมถึง: ภาวะเม็ดเลือดแดงมาก โรคพิษตะกั่ว ไตวาย โรคโลหิตจาง โรคสะเก็ดเงิน และ การปลูกถ่ายอวัยวะ[6][16] ค่าดัชนีมวลกายที่มากกว่าหรือเท่ากับ 35 เพิ่มความเสี่ยงของการเป็นโรคเกาต์ขึ้นเป็นสามเท่าในเพศชาย[10] การสัมผัสสารตะกั่วเป็นเวลาติดต่อกันและเครื่องดื่มแอลกอฮอล์ที่มีสารตะกั่วปนเปื้อนเป็นปัจจัยเสี่ยงต่อการเกิดโรคเกาต์ เนื่องจากผลกระทบที่เป็นอันตรายของสารตะกั่วต่อการทำงานของไต[17] กลุ่มอาการ Lesch-Nyhan มักจะเกี่ยวข้องกับโรคข้ออักเสบเพราะโรคเกาต์
ยา[แก้]
ยาขับปัสสาวะถูกเชื่อมโยงกับสาเหตุการกำเริบของโรคเกาต์ตลอดมา อย่างไรก็ตาม การใช้ไฮโดรคลอโรไทอาไซด์ในปริมาณน้อยดูเหมือนจะไม่ได้เพิ่มความเสี่ยง[18] ยาอื่น ๆ ที่เกี่ยวข้องรวมถึงไนอาซิน และ แอสไพริน (กรดอะซิทิลซาลิไซลิก)[4] สารกดภูมิคุ้มกันต่าง ๆ ไซโคลสปอริน และ ทาโครลิมุส ก็เกี่ยวข้องกับการเกิดโรคเกาต์ด้วยเช่นกัน[6] โดยเฉพาะอย่างยิ่งยาตัวแรกเมื่อใช้ร่วมกับไฮโดรคลอโรไทอาไซด์[19]
พยาธิสรีรวิทยา[แก้]
โรคเกาต์เป็นความผิดปกติของการเผาผลาญพิวรีน[6]และเกิดขึ้นเมื่อสารสังเคราะห์สุดท้าย กรดยูริก ตกผลึกในรูปแบบของโมโนโซเดียมยูเรทที่ตกตะกอนในข้อต่อ บนเส้นเอ็น และ เนื้อเยื่อรอบ ๆ[4] จากนั้น ผลึกเหล่านี้จะก่อให้เกิดปฏิกิริยาการอักเสบเนื่องจากภูมิคุ้มกัน [4] โดยหนึ่งในโปรตีนที่สำคัญในชั้นการอักเสบได้แก่ อินเตอร์ลูคิน 1β[6] การสูญเสียยูริเคสซึ่งย่อยสลายกรดยูริกทีละน้อยในมนุษย์และไพรเมตชั้นสูงต่าง ๆ ทำให้ภาวะนี้กลายเป็นเรื่องที่พบบ่อย[6]
สารที่มากระตุ้นการตกตะกอนของกรดยูริกนั้นไม่เป็นที่ทราบแน่ชัด แม้ว่ากรดยูริกจะสามารถตกผลึกได้เมื่อปริมาณของมันอยู่ในระดับปกติ แต่ก็มีแนวโน้มที่จะตกผลึกมากขึ้นเมื่อปริมาณเพิ่มขึ้น[4][20] ปัจจัยอื่น ๆ ที่เชื่อว่ามีความสำคัญในการกระตุ้นการอักเสบเฉียบพลันของอาการข้ออักเสบได้แก่อุณหภูมิที่เย็น การเปลี่ยนแปลงอย่างรวดเร็วของระดับกรดยูริก ภาวะกรด[21][22] ความชุ่มชื้นของข้อต่อ และ โปรตีนเคลือบเซลล์ เช่น โปรตีโอไกลแคน คอลลาเจน และ คอนดรอยตินซัลเฟต[6] การตกตะกอนที่เพิ่มขึ้นที่อุณหภูมิต่ำอธิบายได้ส่วนหนึ่งว่าเหตุใดข้อต่อบริเวณเท้าจึงได้รับผลกระทบมากที่สุด[2] การเปลี่ยนแปลงอย่างรวดเร็วของปริมาณกรดยูริกอาจเกิดขึ้นเนื่องจากหลายปัจจัย ไม่ว่าจะเป็นการบาดเจ็บ การผ่าตัด เคมีบำบัด ยาขับปัสสาวะ และ การหยุดหรือการเริ่มใช้อัลโลพูรินอล[1] ในขณะเดียวกัน แคลเซียมแชนแนลบล็อกเกอร์ และ โลซาร์แทน ถูกเชื่อมโยงกับการลดความเสี่ยงจากโรคเกาต์เมื่อเทียบกับยาอื่น ๆ สำหรับโรคความดันโลหิตสูง [23]
การวินิจฉัย[แก้]
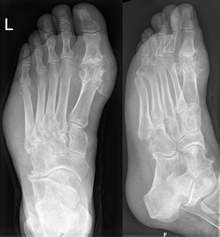

โรคเกาต์อาจจะได้รับการวินิจฉัยและรับการรักษาโดยไม่ต้องสืบหาสาเหตุต่อไปในผู้ป่วยที่มีภาวะกรดยูริกในเลือดสูงและเป็นโรคโพดากราทั่วไปอยู่แล้ว อย่างไรก็ตาม ควรจะทำการวิเคราะห์น้ำไขข้อหากไม่แน่ใจในการวินิจฉัย[1] รังสีเอกซ์นั้นแม้ว่าจะมีประโยชน์ในการระบุโรคเกาต์เรื้อรังแต่ก็ใช้ได้เพียงเล็กน้อยกับการกำเริบเฉียบพลัน[6]
น้ำไขข้อ[แก้]
การวินิจฉัยโรคเกาต์ให้ได้แน่นอนขึ้นอยู่กับการระบุผลึกของเกลือโมโนโซเดียมยูเรทในน้ำไขข้อหรือก้อนโทไฟ[3] ทุกตัวอย่างน้ำไขข้อที่ได้รับจากข้อต่ออักเสบที่ยังไม่ได้รับการวินิจฉัยควรได้รับการตรวจสอบหาผลึกเหล่านี้[6] ภายใต้กล้องจุลทรรศน์แสงโพลาไรซ์ ผลึกเหล่านี้มีรูปร่างเหมือนเข็ม มีความแข็งแรงและมีค่าไบรีฟริงเจนซ์เป็นลบ การทดสอบนี้ทำได้ยากและมักจะต้องใช้ผู้สังเกตการณ์ที่ผ่านการฝึกอบรม[24] นอกจากนี้ ของเหลวยังต้องได้รับการตรวจสอบอย่างรวดเร็วหลังจากการเจาะ เพราะอุณหภูมิและค่าพีเอชมีผลต่อการละลายของผลึก[6]
การตรวจเลือด[แก้]
ภาวะกรดยูริกในเลือดสูงเป็นลักษณะพื้นฐานของโรคเกาต์ แต่โรคเกาต์เกือบครึ่งหนึ่งของทั้งหมดเกิดได้โดยไม่ต้องมีภาวะนี้ และคนส่วนใหญ่ที่มีระดับกรดยูริกสูงไม่เคยเป็นโรคเกาต์[3][25] ดังนั้น ประโยชน์ของการวินิจฉัยโดยการวัดระดับกรดยูริกจึงถูกจำกัด[3] ภาวะกรดยูริกในเลือดสูง หมายถึง การมีระดับของกรดยูริกในพลาสมาสูงกว่า 420 μmol/l (7.0 mg/dl)ในเพศชาย และสูงกว่า 360 μmol/l (6.0 mg/dl)ในเพศหญิง[26] การตรวจเลือดอื่น ๆ ที่ดำเนินการกันทั่วไปได้แก่ การตรวจนับเม็ดเลือดขาว อิเล็กโทรไลต์ การตรวจการทำงานของไต และ การตรวจอัตราการตกตะกอนของเม็ดเลือดแดง (ESR) อย่างไรก็ตาม ทั้งอัตราเซลล์เม็ดเลือดขาวและ ESR อาจจะสูงเนื่องจากโรคเกาต์ในกรณีที่ไม่มีการติดเชื้อ[27][28] เคยมีการบันทึกจำนวนเซลล์เม็ดเลือดขาวที่นับได้สูงถึง 40.0×109/l (40,000/mm3)[1]
การวินิจฉัยแยกโรค[แก้]
การวินิจฉัยแยกโรคที่สำคัญที่สุดของโรคเกาต์คือโรคไขข้ออักเสบจากการติดเชื้อ[3][6]ซึ่งควรได้รับการพิจารณาในผู้ที่มีอาการของการติดเชื้อหรือผู้ที่อาการไม่ดีขึ้นหลังได้รับการรักษา[3] เทคนิคที่ช่วยในการวินิจฉัยโรครวมถึงการย้อมแกรมและการปลูกน้ำไขข้อ[3] ภาวะอื่น ๆ ที่มีลักษณะคล้ายคลึงกันรวมถึงโรคเกาต์เทียมและโรคข้ออักเสบรูมาตอยด์[3] ก้อนโทไฟจากโรคเกาต์ โดยเฉพาะอย่างยิ่งเมื่อไม่ได้อยู่ในข้อต่อสามารถทำให้สับสนกับโรคมะเร็งผิวหนัง[29] หรือ เนื้องอกอื่น ๆ[30]
การป้องกัน[แก้]
ทั้งการเปลี่ยนแปลงวิถีชีวิตและการรักษาทางยาสามารถลดระดับของกรดยูริกได้ การเลือกพฤติกรรมการบริโภคอาหารและการดำเนินชีวิตที่มีประสิทธิภาพรวมถึงการลดการบริโภคอาหารจำพวกเนื้อและอาหารทะเล การบริโภควิตามินซีอย่างเพียงพอ การจำกัดการบริโภคแอลกอฮอล์และฟรักโทสตลอดจนการหลีกเลี่ยงโรคอ้วน[2] พฤติกรรมการบริโภคอาหารที่มีแคลอรี่ต่ำในผู้ชายที่เป็นโรคอ้วนสามารถลดระดับกรดยูริกได้ถึง 100 µmol/l (1.7 mg/dl)[18] การบริโภควิตามิน ซีในปริมาณ 1,500 mg ต่อวันลดความเสี่ยงของโรคเกาต์ได้ถึง 45%[31] การบริโภคกาแฟ (แต่ไม่รวมชา) ช่วยลดความเสี่ยงของโรคเกาต์[32] โรคเกาต์อาจเป็นอาการข้างเคียงของภาวะหยุดหายใจขณะหลับเนื่องจากการปล่อยสารพิวรีนของเซลล์ที่ขาดแคลนออกซิเจน การรักษาภาวะหยุดหายใจสามารถช่วยลดการกำเริบของโรคเกาต์ได้[33]
การรักษา[แก้]
จุดมุ่งหมายเบื้องต้นของการรักษาคือการระงับอาการกำเริบแบบเฉียบพลัน[34] การกำเริบซ้ำ ๆ สามารถป้องกันได้โดยยาชนิดต่าง ๆ ที่ใช้เพื่อลดระดับของกรดยูริก[34] การประคบน้ำแข็งเป็นเวลา 20 ถึง 30 นาทีวันละหลาย ๆ ครั้งจะช่วยลดความเจ็บปวด[2][35] ทางเลือกสำหรับการรักษาแบบเฉียบพลันได้แก่ยาแก้อักเสบชนิดไม่ใช่สเตอรอยด์ (NSAIDs) โคลชิซีน และ สเตอรอยด์[2] ส่วนทางเลือกสำหรับการป้องกันได้แก่อัลโลพูรินอล ฟีบัคโซสตัต และ โพรเบเนซิด การลดระดับกรดยูริกสามารถรักษาโรคนี้ให้หายได้[6] นอกจากนี้ การรักษาแบบการวินิจฉัยร่วมก็มีความสำคัญ[6]
NSAIDs[แก้]
ยาแก้อักเสบชนิดไม่ใช่สเตอรอยด์ หรือ NSAIDs เป็นการรักษาขั้นพื้นฐานสำหรับโรคเกาต์และไม่มีสารตัวใดโดยเฉพาะที่มีประสิทธิภาพมากหรือน้อยกว่าตัวอื่น ๆ อย่างเห็นได้ชัด[2] ยาเหล่านี้อาจช่วยให้อาการดีขึ้นภายในสี่ชั่วโมงและมักได้รับการแนะนำให้ใช้เป็นเวลาหนึ่งถึงสองสัปดาห์[2][6] อย่างไรก็ตาม ตัวยาเหล่านี้ไม่เป็นที่แนะนำสำหรับผู้ที่มีปัญหาสุขภาพอื่น ๆ บางอย่าง เช่น ภาวะเลือดออกในทางเดินอาหาร ไตวาย หรือ ภาวะหัวใจล้มเหลว[36] แม้ว่าอินโดเมตทาซินจะเป็น NSAID ที่ใช้กันมากที่สุดมาเป็นเวลานาน ทางเลือกอื่น เช่น ไอบูโปรเฟน อาจเป็นที่ชื่นชอบมากกว่าเนื่องจากประวัติด้านผลข้างเคียงน้อยกว่าแม้ว่าจะไม่ได้มีประสิทธิภาพเหนือกว่า[18] สำหรับผู้ที่มีความเสี่ยงจากผลข้างเคียงจาก NSAIDs ในกระเพาะอาหาร อาจมีการให้ยายับยั้งการหลั่งกรดเพิ่มเติม[37]
โคลชิซีน[แก้]
โคลชิซีนเป็นอีกทางเลือกหนึ่งสำหรับผู้ที่ไม่สามารถใช้ NSAIDs ได้[2] ผลข้างเคียงของยานี้ (ส่วนใหญ่เป็นความแปรปรวนในระบบทางเดินอาหาร) เป็นตัวจำกัดการใช้งาน[38] อย่างไรก็ตาม ความแปรปรวนในระบบทางเดินอาหารจะขึ้นอยู่กับปริมาณของยาที่ใช้ เราจึงสามารถลดความเสี่ยงได้โดยการลดปริมาณยาลงโดยยังคงให้มีประสิทธิภาพเพียงพอ[18] โคลชิซีนอาจเกิดปฏิกิริยากับยาที่แพทย์มักสั่งอื่น ๆ เช่น อะโทวาสแตติน อีริโทรมัยซิน และอื่น ๆ[38]
สเตอรอยด์[แก้]
จากการวิจัยพบว่ากลูโคคอร์ติคอยด์มีประสิทธิภาพพอ ๆ กับ NSAIDs[39] และสามารถใช้ในกรณีที่ NSAIDs ถูกห้ามใช้[2] นอกจากนี้ ยานี้ยังทำให้อาการดีขึ้นเมื่อฉีดเข้าไปในข้อต่อ; อย่างไรก็ตามไม่ควรใช้ยานี้ในกรณีที่มีการติดเชื้อที่ข้อต่อเพราะสเตอรอยด์จะทำให้อาการแย่ลง[2]
เพลโกลติเคส[แก้]
เพลโกลติเคส (Krystexxa) ได้รับการอนุมัติในประเทศสหรัฐอเมริกาให้ใช้รักษาโรคเกาต์ในปีค.ศ. 2010 (พ.ศ. 2553) [40] ยานี้เป็นทางเลือกสำหรับ 3% ของผู้ป่วยที่ไม่สามารถต้านยาอื่น ๆ ได้[40] เพลโกลติเคสเป็นยาที่ใช้ฉีดเข้าเส้นเลือดดำทุกสองสัปดาห์[40]และได้รับการค้นพบว่าช่วยลดระดับกรดยูริกในผู้ป่วยกลุ่มนี้[41]
มาตรการป้องกัน[แก้]
มียาหลายชนิดที่มีประโยชน์ต่อการป้องกันการกำเริบครั้งต่อไปของโรคเกาต์ ไม่ว่าจะเป็นตัวยับยั้งแซนทีนออกซิเดส (จำพวกอัลโลพูรินอลและ ฟีบัคโซสตัต) และ ยาเร่งการขับกรดยูริกออกทางไต (จำพวกโพรเบเนซิดและซัลฟินพัยราโซน) ยาเหล่านี้มักไม่เริ่มใช้จนกว่าเวลาจะผ่านไปหนึ่งถึงสองสัปดาห์หลังจากอาการกำเริบเฉียบพลันหายไป เนื่องจากความกังวลทางทฤษฎีว่าอาจทำให้อาการกำเริบหนักขึ้น[2] ยาเหล่านี้มักใช้ร่วมกันกับ NSAIDs หรือโคลชิซีนในช่วงสามถึงหกเดือนแรก[6] ไม่แนะนำให้ใช้จนกว่าจะมีการกำเริบของโรคเกาต์สองครั้ง[2] ยกเว้นในกรณีที่มีการเปลี่ยนแปลงของข้อต่อ ก้อนโทไฟ หรือ โรคไตจากกรดยูริกที่อาจเป็นอันตราย[5] เพราะพบว่ายาเหล่านี้ยังมีประสิทธิภาพไม่คุ้มราคาในปัจจุบัน[2] ควรเพิ่มมาตรการลดกรดยูริกจนกว่าระดับของกรดยูริกจะลดต่ำกว่า 300–360 µmol/l (5.0-6.0 mg/dl) และลดลงเรื่อย ๆ แบบไม่จำกัด[2][6] หากมีการใช้ยาเหล่านี้อย่างต่อเนื่องเมื่ออาการกำเริบ ขอแนะนำให้หยุดใช้[3] หากไม่สามารถลดระดับของกรดยูริกลงมาให้ต่ำกว่า 6.0 mg/dl และมีการกำเริบเกิดขึ้นให้ถือว่าเป็นความล้มเหลวของการรักษาหรือโรคเกาต์ดื้อยา[42] โดยรวมแล้ว โพรเบเนซิดดูเหมือนจะมีประสิทธิภาพน้อยกว่าอัลโลพูรินอล[2]
ยาเร่งการขับกรดยูริกออกทางไต เป็นการรักษาที่ได้รับความนิยมเมื่อมีการหลั่งกรดยูริกน้อยเกินไป เช่น ตามที่แสดงในผลการตรวจปัสสาวะในช่วงเวลา 24 ชั่วโมงที่พบปริมาณของกรดยูริกน้อยกว่า 800 mg[43] อย่างไรก็ตาม ยานี้ไม่แนะนำในผู้ป่วยที่มีประวัติเป็นโรคนิ่วในไต[43] หากพบว่ามีการขับถ่ายกรดยูริกทางปัสสาวะในเวลา 24 ชั่วโมงมากกว่า 800 mg ซึ่งบ่งชี้การผลิตมากเกินไป การใช้ตัวยับยั้งแซนทีนออกซิเดสจะได้รับความนิยมมากกว่า[43]
ตัวยับยั้งแซนทีนออกซิเดส (จำพวกอัลโลพูรินอลและ ฟีบัคโซสตัต) ยับยั้งการผลิตกรดยูริก การรักษาในระยะยาวมีความปลอดภัย ผู้ป่วยมักต้านทานยาได้ดีและสามารถนำมาใช้ในผู้ที่เป็นโรคไตหรือนิ่วเกลือยูเรทได้ แม้ว่อัลโลพูรินอลมีประวัติก่อโรคภูมิแพ้ในผู้ป่วยจำนวนหนึ่ง[2] ในกรณีเช่นนี้ ยาทางเลือกฟีบัคโซสตัตได้รับการแนะนำ[44]
พยากรณ์โรค[แก้]
หากไม่ได้รับการรักษา อาการกำเริบเฉียบพลันของโรคเกาต์มักจะหายไปเองภายในห้าถึงเจ็ดวัน อย่างไรก็ตาม 60% ของผู้ป่วยเหล่านี้มีอาการกำเริบอีกครั้งภายในหนึ่งปี[1] ผู้ป่วยโรคเกาต์มีความเสี่ยงที่เพิ่มขึ้นของโรคความดันโลหิตสูง โรคเบาหวาน กลุ่มอาการเมตาบอลิก โรคไต และ โรคระบบหัวใจและหลอดเลือด จึงมีความเสี่ยงที่เพิ่มขึ้นของการเสียชีวิต[6][45]ส่วนหนึ่งอาจเป็นเพราะความเกี่ยวข้องกับภาวะดื้อต่ออินซูลินและโรคอ้วน แต่ความเสี่ยงที่เพิ่มขึ้นมาบางอย่างก็ปรากฏว่าเกิดขึ้นเอง[45]
หากไม่ได้รับการรักษา การกำเริบของโรคเกาต์แบบเฉียบพลันอาจพัฒนาเป็นโรคเกาต์เรื้อรังที่มีการทำลายพื้นผิวข้อต่อ รูปร่างข้อต่อผิดปกติ และ ก้อนโทไฟที่ไม่สร้างความเจ็บปวด[6] ก้อนโทไฟเหล่านี้เกิดขึ้นใน 30% ของผู้ที่ไม่ได้รับการรักษาเป็นเวลาห้าปี โดยส่วนมากเกิดที่วงใบหู เหนือปุ่มปลายศอก หรือบนเอ็นร้อยหวาย[6] ซึ่งหากใช้การรักษาที่รุนแรงก็อาจทำให้สลายไปได้ นอกจากนี้ โรคนิ่วในไตก็มักก่อความซับซ้อนแก่ผู้ป่วยโรคเกาต์โดยมีผลกระทบต่อระหว่าง 10 ถึง 40% ของผู้ป่วย อาการนี้เกิดจากค่าพีเอชปัสสาวะต่ำซึ่งส่งเสริมการตกตะกอนของกรดยูริก[6] รูปแบบอื่น ๆ ของความผิดปกติเรื้อรังของการทำงานของไตอาจเกิดขึ้นได้[6]
-
ตุ่มที่นิ้วมือและวงใบหูที่แสดงถึงก้อนโทไฟที่เกิดจากโรคเกาต์
-
ก้อนโทไฟที่หัวเข่า
-
ก้อนโทไฟที่นิ้วเท้าและเหนือตาตุ่มด้านนอก
-
โรคเกาต์ที่เกิดความซับซ้อนขึ้นเพราะก้อนโทไฟ (ตรวจพบผลึกกรดยูริกในน้ำเหลือง)
ระบาดวิทยา[แก้]
โรคเกาต์เกิดกับประมาณ 1-2% ของประชากรชาวตะวันตก ณ ช่วงใดช่วงหนึ่งของชีวิตและกำลังพบมากขึ้นเรื่อย ๆ[2][6] อัตราการเกิดโรคเกาต์ได้เพิ่มขึ้นประมาณสองเท่าระหว่างปีค.ศ. 1990 และ 2010 (พ.ศ. 2533-2553) [4] การเพิ่มขึ้นนี้เชื่อว่าเกิดจากอายุขัยที่เพิ่มขึ้น การเปลี่ยนแปลงพฤติกรรมการบริโภคอาหาร และ การเพิ่มขึ้นของโรคที่เกี่ยวข้องกับโรคเกาต์ เช่น กลุ่มอาการเมตาบอลิกและภาวะความดันโลหิตสูง[10] มีหลายปัจจัยที่พบว่ามีอิทธิพลต่ออัตราการเกิดโรคเกาต์ ไม่ว่าจะเป็นอายุ เชื้อชาติ และฤดูกาล ในผู้ชายที่มีอายุเกินกว่า 30 และผู้หญิงที่มีอายุเกินกว่า 50 อัตราการเกิดอยู่ที่ 2%[36]
ในประเทศสหรัฐอเมริกา โรคเกาต์มีแนวโน้มการเกิดในชายชาวอเมริกันเชื้อชาติอาฟริกันมากกว่าชายอเมริกันเชื้อชาติยุโรปถึงสองเท่า[46] มีอัตราการเกิดสูงในประชาชนของหมู่เกาะแปซิฟิกและชาวมาวรีในประเทศนิวซีแลนด์ แต่ไม่ค่อยพบในชาวพื้นเมืองออสเตรเลียแม้ว่ากลุ่มหลังจะมีความเข้มข้นของกรดยูริกในเลือดโดยเฉลี่ยสูงกว่า[47] ต่อมามีการพบมากในประเทศจีน โพลีนีเซียและประเทศในอาฟริกาแถบทะเลทรายซาฮารา[6] การวิจัยบางส่วนพบว่าโรคเกาต์มีการกำเริบบ่อยในฤดูใบไม้ผลิ โดยสันนิษฐานว่าเกิดจากการเปลี่ยนแปลงพฤติกรรมการบริโภคอาหารตามฤดูกาล การบริโภคเครื่องดื่มแอลกอฮอล์ กิจกรรมทางกายภาพ และ อุณหภูมิ[48]
ประวัติ[แก้]

คำว่า "เกาต์" ถูกใช้ครั้งแรกโดยแรนดอลฟัส แห่ง บ็อกกิง เมื่อประมาณปีค.ศ. 1200 (พ.ศ. 1743) คำนี้รับมาจากคำในภาษาลาติน gutta แปลว่า "หยด" (ของเหลว)[49] ตามพจนานุกรมภาษาอังกฤษฉบับออกซฟอร์ด (Oxford English Dictionary) คำนี้มาจากธาตุ และ "แนวคิดของ 'การหยด' ของสิ่งแปลกปลอมจากเลือดในข้อต่อและบริเวณรอบ ๆ"[50]
อย่างไรก็ตาม โรคเกาต์เป็นที่รู้จักกันมาตั้งแต่สมัยโบราณ ในอดีตจะถูกเรียกว่า "ราชาของโรคและโรคของราชา"[6][51] หรือ "โรคของคนรวย"[52] หลักฐานชิ้นแรกเกี่ยวกับโรคนี้มาจากประเทศอียิปต์เมื่อ 2,600 ปีก่อนคริสตกาล ในคำอธิบายของโรคข้ออักเสบของนิ้วหัวแม่เท้า แพทย์ชาวกรีกชื่อฮิปพอคราทีสได้ให้ความคิดเห็นเมื่อประมาณ 400 ปีก่อนคริสตกาลในแง่คิด ของเขาโดยตั้งข้อสังเกตว่าโรคเกาต์จะไม่เกิดกับขันทีและสตรีวัยเจริญพันธุ์[49][53] ออร์ลุส คอร์เนลุส เคลซุส (ค.ศ. 30) อธิบายความเกี่ยวข้องกับเครื่องดื่มแอลกอฮอล์ การเริ่มตรวจพบในเพศหญิง และ ปัญหาไตที่เกี่ยวข้อง:
นอกจากนี้ ปัสสาวะข้นที่ตกตะกอนสีขาวแสดงให้เห็นว่าความเจ็บปวดและโรคต้องได้รับการรักษาบริเวณข้อต่อหรืออวัยวะภายใน... ปัญหาข้อต่อมือและเท้าเกิดขึ้นบ่อยมากและกินเวลานานเช่นที่เกิดขึ้นในกรณีของโพดากราและเชอิรากรา อาการเหล่านี้แทบจะไม่เกิดขึ้นกับขันทีหรือเด็กผู้ชายก่อนการมีเพศสัมพันธ์กับผู้หญิงและไม่เกิดกับผู้หญิงยกเว้นผู้ที่อยู่ในวัยหมดประจำเดือน... บางคนมีภูมิคุ้มกันตลอดชีวิตโดยการละเว้นจากไวน์ สุราและ การมีเพศสัมพันธ์[54]
ในปีค.ศ. 1683 (พ.ศ. 2226) โทมัส ซิดเดนแฮม แพทย์ชาวอังกฤษ ได้อธิบายการกำเริบของโรคเกาต์ในช่วงเช้ามืดและการที่เพศชายที่มีอายุมากมักพบปัญหามากกว่า:
ผู้ป่วยที่เป็นโรคเกาต์โดยทั่วไปจะเป็นชายชรา หรือ ชายที่บั่นทอนสุขภาพของตนในวัยเยาว์จนกระทั่งนำมาซึ่งความชราก่อนวัยอันควร ในบรรดาพฤติกรรมเสเพลต่าง ๆ ไม่มีสิ่งใดที่พบบ่อยไปกว่าความหลงระเริงก่อนวัยอันควรและมากเกินไปในกามารมย์ และ ความชอบที่สร้างความเหน็ดเหนื่อยในทำนองเดียวกัน ผู้ป่วยสามารถเข้านอนและหลับเหมือนมีสุขภาพดี ก่อนที่จะถูกปลุกให้ตื่นประมาณตีสองด้วยอาการปวดอย่างรุนแรงที่นิ้วหัวแม่เท้า; บางครั้งที่ส้นเท้า ข้อเท้า หรือ หลังเท้า ความเจ็บปวดเหมือนกับว่าอวัยวะเหล่านั้นเคลื่อน นอกจากนี้บางส่วนยังรู้สึกเหมือนกับถูกราดด้วยน้ำเย็น จากนั้นตามด้วยอาการหนาวสั่น ตัวสั่นและมีไข้เล็กน้อย... ค่ำคืนผ่านไปด้วยความทรมาน การนอนไม่หลับ การพลิกอวัยวะส่วนที่เจ็บและการเปลี่ยนท่านอนตลอดเวลา; ตัวโยนไปมาไม่หยุดหย่อนเพราะความเจ็บปวดของข้อต่อที่ได้รับความทรมาน และยิ่งเลวร้ายเมื่ออาการต่าง ๆ เกิดขึ้นพร้อมกัน[55]
นักวิทยาศาสตร์ชาวเนเธอร์แลนด์ อังตวน แวน เลเวนฮุค ได้อธิบายลักษณะโมเลกุลของผลึกเกลือยูเรทเป็นครั้งแรกในปีค.ศ. 1679 (พ.ศ. 2222)[49] ต่อมาในปีค.ศ. 1848 (พ.ศ. 2391) แพทย์ชาวอังกฤษ อัลเฟรด แบริง แกร์รอด ได้ค้นพบว่ากรดยูริกส่วนเกินในเลือดเป็นสาเหตุของโรคเกาต์[56]
ในสัตว์อื่น ๆ[แก้]
โรคเกาต์ไม่ค่อยเกิดในสัตว์อื่น ๆ สาเหตุส่วนใหญ่เนื่องจากพวกมันสามารถผลิตยูริเคสซึ่งย่อยสลายกรดยูริกได้เอง[57] มนุษย์และวงศ์ลิงใหญ่อื่น ๆ ไม่มีความสามารถนี้ จึงประสบปัญหาโรคเกาต์ได้บ่อย[1][57] อย่างไรก็ตาม เชื่อกันว่าตัวอย่างไทแรนโนซอรัส ที่รู้จักกันดีในชื่อของ "ซู" เคยมีอาการโรคเกาต์[58]
การวิจัย[แก้]
ปัจจุบันมีการศึกษาวิจัยยาใหม่หลายชนิดสำหรับรักษาโรคเกาต์ไม่ว่าจะเป็น อนาคินรา คานาคินูมับ และริโลนาเซ็ปต์[59] การตัดต่อเอนไซม์ยูริเคส (ราสบูริเคส) สามารถใช้ได้; แต่การใช้นั้นถูกจำกัด เพราะอาจก่อให้เกิดภาวะภูมิต้านตนเองได้ รุ่นที่กระตุ้นการสร้างภูมิคุ้มกันน้อยกว่ากำลังได้รับการพัฒนา[1]
อ้างอิง[แก้]
- ↑ 1.00 1.01 1.02 1.03 1.04 1.05 1.06 1.07 1.08 1.09 Eggebeen AT (September 2007). "Gout: an update". Am Fam Physician. 76 (6): 801–8. PMID 17910294.
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 2.10 2.11 2.12 2.13 2.14 2.15 2.16 2.17 2.18 Chen LX, Schumacher HR (October 2008). "Gout: an evidence-based review". J Clin Rheumatol. 14 (5 Suppl): S55–62. doi:10.1097/RHU.0b013e3181896921. PMID 18830092.
- ↑ 3.00 3.01 3.02 3.03 3.04 3.05 3.06 3.07 3.08 3.09 3.10 3.11 3.12 Schlesinger N (March 2010). "Diagnosing and treating gout: a review to aid primary care physicians". Postgrad Med. 122 (2): 157–61. doi:10.3810/pgm.2010.03.2133. PMID 20203467.
- ↑ 4.0 4.1 4.2 4.3 4.4 4.5 4.6 Terkeltaub R (January 2010). "Update on gout: new therapeutic strategies and options". Nat Rev Rheumatol. 6 (1): 30–8. doi:10.1038/nrrheum.2009.236. PMID 20046204.
- ↑ 5.0 5.1 Tausche AK, Jansen TL, Schröder HE, Bornstein SR, Aringer M, Müller-Ladner U (August 2009). "Gout--current diagnosis and treatment". Dtsch Arztebl Int. 106 (34–35): 549–55. doi:10.3238/arztebl.2009.0549. PMC 2754667. PMID 19795010.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 6.00 6.01 6.02 6.03 6.04 6.05 6.06 6.07 6.08 6.09 6.10 6.11 6.12 6.13 6.14 6.15 6.16 6.17 6.18 6.19 6.20 6.21 6.22 6.23 6.24 6.25 6.26 Richette P, Bardin T (January 2010). "Gout". Lancet. 375 (9711): 318–28. doi:10.1016/S0140-6736(09)60883-7. PMID 19692116.
- ↑ Vitart V, Rudan I, Hayward C; และคณะ (April 2008). "SLC2A9 is a newly identified urate transporter influencing serum urate concentration, urate excretion and gout". Nat. Genet. 40 (4): 437–42. doi:10.1038/ng.106. PMID 18327257.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Weaver, AL (Jul 2008). "Epidemiology of gout". Cleveland Clinic journal of medicine. 75 Suppl 5: S9–12. PMID 18819329.
- ↑ Choi HK, Atkinson K, Karlson EW, Willett W, Curhan G (March 2004). "Purine-rich foods, dairy and protein intake, and the risk of gout in men". N. Engl. J. Med. 350 (11): 1093–103. doi:10.1056/NEJMoa035700. PMID 15014182.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 10.0 10.1 10.2 Weaver AL (July 2008). "Epidemiology of gout". Cleve Clin J Med. 75 Suppl 5: S9–12. PMID 18819329.
- ↑ Hak AE, Choi HK (March 2008). "Lifestyle and gout". Curr Opin Rheumatol. 20 (2): 179–86. doi:10.1097/BOR.0b013e3282f524a2. PMID 18349748.
- ↑ Williams PT (May 2008). "Effects of diet, physical activity and performance, and body weight on incident gout in ostensibly healthy, vigorously active men". Am. J. Clin. Nutr. 87 (5): 1480–7. PMID 18469274.
- ↑ 13.0 13.1 Choi HK (March 2010). "A prescription for lifestyle change in patients with hyperuricemia and gout". Curr Opin Rheumatol. 22 (2): 165–72. doi:10.1097/BOR.0b013e328335ef38. PMID 20035225.
- ↑ Merriman, TR; Dalbeth, N (Jan 2011). "The genetic basis of hyperuricaemia and gout". Joint, bone, spine : revue du rhumatisme. 78 (1): 35–40. doi:10.1016/j.jbspin.2010.02.027. PMID 20472486.
- ↑ 15.0 15.1 Reginato AM, Mount DB, Yang I, Choi HK (September 2012). "The genetics of hyperuricaemia and gout". Nat Rev Rheumatol. doi:10.1038/nrrheum.2012.144. PMID 22945592.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Stamp L, Searle M, O'Donnell J, Chapman P (2005). "Gout in solid organ transplantation: a challenging clinical problem". Drugs. 65 (18): 2593–611. PMID 16392875.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Loghman-Adham M (September 1997). "Renal effects of environmental and occupational lead exposure". Environ. Health Perspect. Brogan & Partners. 105 (9): 928–38. doi:10.2307/3433873. JSTOR 3433873. PMC 1470371. PMID 9300927.
- ↑ 18.0 18.1 18.2 18.3 Laubscher T, Dumont Z, Regier L, Jensen B (December 2009). "Taking the stress out of managing gout". Can Fam Physician. 55 (12): 1209–12. PMC 2793228. PMID 20008601.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Firestein, MD, Gary S.; Budd, MD, Ralph C.; Harris Jr., MD, Edward D.; McInnes PhD, FRCP, Iain B.; Ruddy, MD, Shaun; Sergent, MD, John S., บ.ก. (2008). "Chapter 87: Gout and Hyperuricemia". Kelley's Textbook of Rheumatology (8th ed.). Elsevier. ISBN 978-1-4160-4842-8.
- ↑ Virsaladze DK, Tetradze LO, Dzhavashvili LV, Esaliia NG, Tananashvili DE (May 2007). "[Levels of uric acid in serum in patients with metabolic syndrome]" [Levels of uric acid in serum in patients with metabolic syndrome]. Georgian Med News (ภาษารัสเซีย) (146): 35–7. PMID 17595458.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Moyer RA, John DS (April 2003). "Acute gout precipitated by total parenteral nutrition". The Journal of rheumatology. 30 (4): 849–50. PMID 12672211.
- ↑ Halabe A, Sperling O (1994). "Uric acid nephrolithiasis". Mineral and electrolyte metabolism. 20 (6): 424–31. PMID 7783706.
- ↑ Choi HK, Soriano LC, Zhang Y, Rodríguez LA (2012). "Antihypertensive drugs and risk of incident gout among patients with hypertension: population based case-control study". BMJ. 344: d8190. doi:10.1136/bmj.d8190. PMC 3257215. PMID 22240117.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Schlesinger N (December 2007). "Diagnosis of gout". Minerva Med. 98 (6): 759–67. PMID 18299687.
- ↑ Sturrock R (2000). "Gout. Easy to misdiagnose". BMJ. 320 (7228): 132–33. doi:10.1136/bmj.320.7228.132. PMC 1128728. PMID 10634714.
- ↑ Sachs L, Batra KL, Zimmermann B (November 2009). "Medical implications of hyperuricemia". Med Health R I. 92 (11): 353–55. PMID 19999892.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Gout: Differential Diagnoses & Workup - eMedicine Rheumatology".
- ↑ "Gout and Pseudogout: Differential Diagnoses & Workup - eMedicine Emergency Medicine".
- ↑ Jordan DR, Belliveau MJ, Brownstein S, McEachren T, Kyrollos M (2008). "Medial canthal tophus". Ophthal Plast Reconstr Surg. 24 (5): 403–4. doi:10.1097/IOP.0b013e3181837a31. PMID 18806664.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sano K, Kohakura Y, Kimura K, Ozeki S (March 2009). "Atypical Triggering at the Wrist due to Intratendinous Infiltration of Tophaceous Gout". Hand (N Y). 4 (1): 78–80. doi:10.1007/s11552-008-9120-4. PMC 2654956. PMID 18780009.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Choi HK, Gao X, Curhan G (March 2009). "Vitamin C intake and the risk of gout in men: a prospective study". Arch. Intern. Med. 169 (5): 502–7. doi:10.1001/archinternmed.2008.606. PMC 2767211. PMID 19273781.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Choi HK, Curhan G (June 2007). "Coffee, tea, and caffeine consumption and serum uric acid level: the third national health and nutrition examination survey". Arthritis Rheum. 57 (5): 816–21. doi:10.1002/art.22762. PMID 17530681.
- ↑ Abrams B (February 2005). "Gout is an indicator of sleep apnea". Sleep. 28 (2): 275. PMID 16171252.
- ↑ 34.0 34.1 Zhang W, Doherty M, Bardin T; และคณะ (October 2006). "EULAR evidence based recommendations for gout. Part II: Management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT)". Ann. Rheum. Dis. 65 (10): 1312–24. doi:10.1136/ard.2006.055269. PMC 1798308. PMID 16707532.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Schlesinger N; และคณะ (2002). "Local ice therapy during bouts of acute gouty arthritis". J. Rheumatol. 29 (2): 331–4. doi:10.1093/rheumatology/29.5.331. PMID 11838852.
- ↑ 36.0 36.1 Winzenberg T, Buchbinder R (July 2009). "Cochrane Musculoskeletal Group review: acute gout. Steroids or NSAIDs? Let this overview from the Cochrane Group help you decide what's best for your patient". J Fam Pract. 58 (7): E1–4. PMID 19607767.
- ↑ Clinical Knowledge Summaries. "Gout - Management -- What treatment is recommended in acute gout?". National Library for Health. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-12-16. สืบค้นเมื่อ 2008-10-26.
- ↑ 38.0 38.1 "Information for Healthcare Professionals: New Safety Information for Colchicine (marketed as Colcrys)". U.S. Food and Drug Administration.
- ↑ Man CY, Cheung IT, Cameron PA, Rainer TH (2007). "Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double-blind, randomized, controlled trial". Annals of Emergency Medicine. 49 (5): 670–7. doi:10.1016/j.annemergmed.2006.11.014. PMID 17276548.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 40.0 40.1 40.2 "FDA approves new drug for gout". FDA.
- ↑ Sundy JS, Baraf HS, Yood RA, Edwards NL, Gutierrez-Urena SR, Treadwell EL, Vázquez-Mellado J, White WB, Lipsky PE, Horowitz Z, Huang W, Maroli AN, Waltrip RW, Hamburger SA, Becker MA (17 August 2011). "Efficacy and tolerability of pegloticase for the treatment of chronic gout in patients refractory to conventional treatment: two randomized controlled trials". JAMA: The Journal of the American Medical Association. 306 (7): 711–20. doi:10.1001/jama.2011.1169. PMID 21846852.
- ↑ Ali, S; Lally, EV (Nov 2009). "Treatment failure gout". Medicine and health, Rhode Island. 92 (11): 369–71. PMID 19999896.
- ↑ 43.0 43.1 43.2 Elizabeth D Agabegi; Agabegi, Steven S. (2008). Step-Up to Medicine (Step-Up Series). Hagerstwon, MD: Lippincott Williams & Wilkins. p. 251. ISBN 0-7817-7153-6.
{{cite book}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ "Febuxostat for the management of hyperuricaemia in people with gout (TA164) Chapter 4. Consideration of the evidence". Guidance.nice.org.uk. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-10-06. สืบค้นเมื่อ 2011-08-20.
- ↑ 45.0 45.1 Kim SY, De Vera MA, Choi HK (2008). "Gout and mortality". Clin. Exp. Rheumatol. 26 (5 Suppl 51): S115–9. PMID 19026153.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rheumatology Therapeutics Medical Center. "What Are the Risk Factors for Gout?". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2007-03-25. สืบค้นเมื่อ 2007-01-26.
- ↑ Roberts-Thomson RA, Roberts-Thomson PJ (May 1999). "Rheumatic disease and the Australian aborigine". Ann. Rheum. Dis. 58 (5): 266–70. doi:10.1136/ard.58.5.266. PMC 1752880. PMID 10225809.
- ↑ Fam AG (May 2000). "What is new about crystals other than monosodium urate?". Curr Opin Rheumatol. 12 (3): 228–34. doi:10.1097/00002281-200005000-00013. PMID 10803754.
- ↑ 49.0 49.1 49.2 49.3 Pillinger, MH; Rosenthal P, Abeles AM (2007). "Hyperuricemia and gout: new insights into pathogenesis and treatment". Bulletin of the NYU Hospital for Joint Diseases. 65 (3): 215–221. PMID 17922673. คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2008-12-16. สืบค้นเมื่อ 2014-01-09.
- ↑ "gout, n.1". Oxford English Dictionary, Second edition, 1989. สืบค้นเมื่อ 18 September 2011.
- ↑ Kubitz possibly has gout."The Disease Of Kings - Forbes.com". Forbes.
- ↑ "Rich Man's Disease - definition of Rich Man's Disease in the Medical dictionary - by the Free Online Medical Dictionary, Thesaurus and Encyclopedia".
- ↑ "The Internet Classics Archive Aphorisms by Hippocrates". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2010-07-07. สืบค้นเมื่อ July 27, 2010.
- ↑ "LacusCurtius • Celsus — On Medicine — Book IV".
- ↑ "BBC - h2g2 - Gout - The Affliction of Kings". BBC. สืบค้นเมื่อ July 27, 2010.
- ↑ Storey GD (October 2001). "Alfred Baring Garrod (1819-1907)". Rheumatology (Oxford, England). 40 (10): 1189–90. doi:10.1093/rheumatology/40.10.1189. PMID 11600751.
- ↑ 57.0 57.1 Agudelo CA, Wise CM (May 2001). "Gout: diagnosis, pathogenesis, and clinical manifestations". Curr Opin Rheumatol. 13 (3): 234–9. doi:10.1097/00002281-200105000-00015. PMID 11333355.
- ↑ Rothschild, BM; Tanke D, Carpenter K (1997). "Tyrannosaurs suffered from gout". Nature. 387 (6631): 357. doi:10.1038/387357a0. PMID 9163417.
- ↑ "New therapeutic options for gout here and on the horizon - The Journal of Musculoskeletal Medicine".