มะเร็งท่อน้ำดี
| มะเร็งท่อน้ำดี (Cholangiocarcinoma) | |
|---|---|
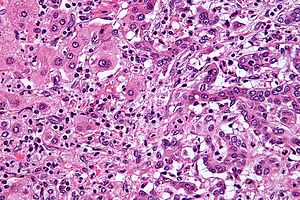 | |
| ภาพกล้องจุลทรรศน์ของมะเร็งท่อน้ำดีชนิดในตับ (ซีกขวาของภาพ) เทียบกับเซลล์ตับปกติ (ซีกซ้าย) สีย้อมเอชแอนด์อี | |
| การออกเสียง |
|
| สาขาวิชา | วิทยามะเร็ง |
| อาการ | ปวดท้อง, ดีซ่าน, น้ำหนักลด, คันทั่วร่าง, ไข้[2] |
| การตั้งต้น | 70 ปี[3] |
| ประเภท | ในตับ, บริเวณขั้วตับ, ส่วนปลาย[3] |
| ปัจจัยเสี่ยง | ท่อน้ำดีอักเสบแข็งปฐมภูมิ, ลำไส้ใหญ่อักเสบเป็นแผล, การติดเชื้อพยาธิใบไม้ตับบางชนิด การผิดรูปของตับแต่กำเนิดบางชนิด[2] |
| วิธีวินิจฉัย | ยืนยันจากการตรวจเนื้องอกภายใต้กล้องจุลทรรศน์[4] |
| การรักษา | การผ่าตัดออก, เคมีบำบัด, รังสีบำบัด, การใส่ท่อค้ำยัน, การปลูกถ่ายตับ[2] |
| พยากรณ์โรค | โดยทั่วไปเลว[5] |
| ความชุก | 1–2 คนต่อ 100,000 คนต่อปี (โลกตะวันตก)[6] 84.6 ต่อ 100000 ประชากร (ชาย) และ 36.8 ต่อ 100000 ประชากร (หญิง) (ประเทศไทย)[7] |
มะเร็งท่อน้ำดี หรือ โคแลงจิโอคาร์ซิโนมา (อังกฤษ: cholangiocarcinoma) เป็นมะเร็งชนิดหนึ่งที่เกิดกับท่อน้ำดี[1] อาการของโรค เช่น ปวดท้อง ดีซ่าน น้ำหนักลด คันทั่วร่าง และไข้[2] นอกจากนี้ อาจพบว่าอุจจาระสีจางและปัสสาวะสีเข้ม[4] มะเร็งในตำแหน่งอื่น ๆ ที่นับเป็นมะเร็งท่อน้ำดี ได้แก่ มะเร็งถุงน้ำดี และมะเร็งของกระเปาะของวาเตอร์[8]
ปัจจัยเสี่ยงของมะเร็งท่อน้ำดี เช่น ท่อน้ำดีอักเสบแข็งปฐมภูมิ ลำไส้ใหญ่อักเสบเป็นแผล ตับแข็ง ตับอักเสบซี ตับอักเสบบี การติดเชื้อพยาธิใบไม้ตับบางชนิด และการผิดรูปของตับบางชนิด[2][3][9] อย่างไรก็ดี บุคคลส่วนใหญ่ไม่สามารถหาปัจจัยเสี่ยงได้[3] การวินิจฉัยเป็นการตั้งข้อสงสัยโดยอาศัยการทดสอบเลือด การถ่ายภาพทางการแพทย์ การส่องกล้องลำไส้ และบางทีรวมถึงการสำรวจโดยผ่าตัด[4] ยืนยันโรคโดยการตรวจสอบเซลล์จากเนื้องอกภายใต้กล้องจุลทรรศน์[4] ตรงแบบเป็นมะเร็งชนิดต่อม[3]
หากผู้ป่วยมะเร็งท่อน้ำดีมีอาการครบตามแบบฉบับ มักอยู่ในระยะที่ไม่สามารถรักษาให้หายขาดได้แล้ว[2] ในผู้ป่วยเหล่านี้การรักษาประทังอาจได้แก่การผ่าตัดออก เคมีบำบัด รังสีบำบัด และการใส่ท่อค้ำยัน[2] การผ่าตัดสามารถตัดเนื้องอกออกได้ในผู้ป่วยประมาณหนึ่งในสามที่มะเร็งเกิดที่ท่อน้ำดีรวม และน้อยกว่านั้นหากเกิดในตำแหน่งอื่น ทำให้มีโอกาสหายขาดได้[2] กระนั้นแม้ผ่าตัดออกได้สำเร็จ แต่โดยทั่วไปยังแนะนำเคมีบำบัดและรังสีบำบัดอยู่[2] ในผู้ป่วยบางส่วนอาจรักษาด้วยการผ่าตัดอาจปลูกถ่ายตับ[3] แม้การผ่าตัดสำเร็จ แต่โดยทั่วไปแล้วจะมีโอกาสรอดชีวิต 5 ปีไม่ถึง 50%[6]
มะเร็งท่อน้ำดีพบน้อยในโลกตะวันตก โดยมีอุบัติการณ์ต่อปีประมาณ 0.5–2 ต่อ 100,000 คนในโลกตะวันตก[2][6] แต่อุบัติการณ์ของมะเร็งท่อน้ำดีในไทยกลับมีสูงมากที่สุดในโลก ในบางพื้นที่สูงถึง 60 ต่อ 100,000 คนต่อปี[7][5] ตรงแบบเกิดในบุคคลวัย 70–79 ปี ทว่า ในผู้ป่วยท่อน้ำดีอักเสบแข็งปฐมภูมิ มะเร็งมักเกิดในบุคคลอายุ 40–49 ปี[3] และในช่วงหลายสิบปีมานี้อัตราอุบัติการณ์ของมะเร็งท่อนำดีทั่วโลกกำลังเพิ่มขึ้น[10]
อาการและอาการแสดง[แก้]

สิ่งตรวจพบที่พบบ่อยที่สุดของมะเร็งท่อน้ำดีคือการมีผลการตรวจการทำงานของตับผิดปกติ ดีซ่าน (เกิดขึ้นเมื่อท่อน้ำดีถูกอุดตันโดยเนื้องอก) ปวดท้อง (30–50%) คันตามตัว (66%) น้ำหนักลด (30–50%) ไข้ (สูงสุด 20%) หรือสีอุจจาระหรือปัสสาวะเปลี่ยน[11][12] อาการส่วนหนึ่งขึ้นอยู่กับตำแหน่งของเนื้องอก ผู้ป่วยมะเร็งท่อน้ำดีในท่อน้ำดีนอกตับมีโอกาสเกิดดีซ่านมากกว่า และผู้ป่วยที่เนื้องอกอยู่ในท่อน้ำดีในตับมักมีอาการปวดโดยไม่มีดีซ่านมากกว่า[13] ในประเทศไทย พบว่าผู้ป่วยบางส่วนมาพบแพทย์ด้วยปัญหาก้อนในตับ (14%) คลำถุงน้ำดีได้ (6.7%) ถุงน้ำดีอักเสบเฉียบพลันแบบไม่มีนิ่วในถุงน้ำดี (7%) มีไข้ไม่ทราบสาเหตุ และพบโดยบังเอิญในขณะที่ผ่าตัดช่องท้องด้วยสาเหตุอื่น[14] อาการค่อนข้างจะขึ้นอยู่กับตำแหน่งของเนื้องอก โดยผู้ป่วยที่มีเนื้องอกอยู่นอกตับมักจะมีอาการดีซ่าน ส่วนผู้ป่วยที่มีเนื้องอกอยู่ในตับมักมีอาการปวดโดยไม่มีดีซ่าน[13]
ผลการตรวจการทำงานของตับในผู้ป่วยมะเร็งท่อน้ำดีมักพบว่ามีลักษณะของการอุดตันท่อน้ำดีโดยมีระดับบิลิรูบินหรือเอนไซม์ตับอย่างอัลคาไลน์ฟอสฟาเทสและแกมมา-กลูตามิลทรานสเฟอเรสสูงขึ้น โดยมีระดับเอนไซม์ตับทรานซามิเนส (Transaminase) ค่อนข้างปกติเมื่อเทียบกัน ผลการตรวจทางห้องปฏิบัติการเหล่านี้เป็นการแสดงว่าการอุดตันของน้ำท่อน้ำดีจะเป็นสาเหตุของดีซ่านมากกว่าจะเป็นจากการอักเสบหรือการติดเชื้อของตับ[15]
ปัจจัยเสี่ยง[แก้]

แม้ผู้ป่วยส่วนใหญ่จะไม่มีปัจจัยเสี่ยงชัดเจนแต่ก็ได้มีการศึกษาพบว่ามีปัจจัยเสี่ยงบางอย่างที่สัมพันธ์กับมะเร็งท่อน้ำดี ในโลกตะวันตกปัจจัยเสี่ยงที่พบมากที่สุดคือการเป็นโรคท่อน้ำดีอักเสบแข็งปฐมภูมิ (primary sclerosing cholangitis) ซึ่งเป็นโรคท่อน้ำดีอักเสบชนิดหนึ่งที่ทำให้มีการหนาแข็งของท่อน้ำดี โรคนี้มีความสัมพันธ์กับโรคลำไส้ใหญ่อักเสบแบบมีแผล (ulcerative colitis) อีกทีหนึ่ง[16] การศึกษาวิจัยทางระบาดวิทยาแสดงให้เห็นว่าอัตราเสี่ยงตลอดชีวิตของผู้ป่วย PSC ที่จะเป็นมะเร็งท่อน้ำดีอยู่ที่ 10–15%[17] ในขณะที่งานวิจัยชุดที่ได้จากการชันสูตรศพพบว่ามีอัตราสูงถึง 30%[18] ส่วนกลไกที่ทำให้ผู้ป่วย PSC เป็นมะเร็งท่อน้ำดีมากขึ้นนั้นยังไม่ได้รับการอธิบายแน่ชัด
โรคติดเชื้อปรสิตบางชนิดก็เป็นปัจจัยเสี่ยงเช่นกัน เช่นการติดเชื้อพยาธิใบไม้ในตับ Opisthorchis viverrini (พบในประเทศไทย ลาว และมาเลเซีย) หรือ Clonorchis sinensis (พบในญี่ปุ่น เกาหลี และเวียดนาม) ซึ่งพบว่ามีความสัมพันธ์กับการเกิดมะเร็งท่อน้ำดี[19][20][21] ผู้ป่วยโรคตับเรื้อรัง (chronic liver disease) ไม่ว่าจะจากการเป็นโรคตับอักเสบจากไวรัส (เช่น ไวรัสตับอักเสบบีหรือซี) [22][23][24] โรคตับจากแอลกอฮอล์ หรือตับแข็งจากสาเหตุอื่น ต่างเพิ่มความเสี่ยงต่อการเป็นมะเร็งท่อน้ำดี[25][26] งานวิจัยหนึ่งพบว่าการติดเชื้อเอชไอวีก็อาจเป็นปัจจัยเสี่ยงต่อการเป็นมะเร็งท่อน้ำดีเช่นกัน แม้ว่าจะยังไม่ชัดเจนว่าเป็นจากการติดเชื้อเอชไอวีเองหรือปัจจัยอื่นที่เกี่ยวข้อง (เช่น การติดเชื้อไวรัสตับอักเสบซี) ก็ตาม[25] การติดเชื้อด้วยแบคทีเรียชนิด Helicobacter bilis และ Helicobacter hepaticus อาจเป็นสาเหตุของมะเร็งท่อน้ำดีได้[27]
ความผิดปกติแต่กำเนิดของตับอย่างเช่นโรคแครอไล (Caroli disease) หรือถุงน้ำของท่อร่วมน้ำดี (choledochal cyst) มีความสัมพันธ์กับการเพิ่มความเสี่ยงตลอดชีวิตของการเป็นมะเร็งท่อน้ำดีประมาณ 15%[28][29] โรคพันธุกรรมที่พบน้อยอย่างกลุ่มอาการลินช์ชนิดที่ 2 (Lynch syndrome II) และโรคติ่งเนื้อในท่อน้ำดี (biliary papillomatosis) ก็มีความสัมพันธ์กับมะเร็งท่อน้ำดี[30][31] ส่วนการมีนิ่วในถุงน้ำดีนั้นยังไม่ชัดเจนว่าเป็นความเสี่ยงต่อการเกิดมะเร็งท่อน้ำดีหรือไม่ อย่างไรก็ดี โรคนิ่วในตับซึ่งพบน้อยในตะวันตกแต่พบได้บ่อยกว่าในบางส่วนของเอเชียกลับมีความสัมพันธ์กับมะเร็งท่อน้ำดีอย่างมาก[32][33][34] รวมทั้งการรับประทานอาหารหมักดอง เช่น ปลาร้า ปลาเจ่า ปลาจ่อม รวมทั้งปลาส้ม จะมีสาร N-Nitrosocompound และไนโตรซามีน (nitrosamine) ซึ่งเป็นปัจจัยเสี่ยงให้เกิดมะเร็งท่อน้ำดีได้[35] การสัมผัสสารทึบรังสีบางชนิดเช่น ทอโรทราสต์ ซึ่งเป็นทอเรียมไดออกไซด์รูปแบบหนึ่งนั้นก็มีความสัมพันธ์กับการเป็นมะเร็งท่อน้ำดีที่เวลา 30–40 ปีหลังสัมผัส จึงสหรัฐห้ามใช้ไปแล้วตั้งแต่คริสต์ทศวรรษ 1950[36][37]
พยาธิสรีรวิทยา[แก้]

มะเร็งท่อน้ำดีอาจเกิดกับท่อน้ำดีตรงส่วนใดก็ได้ ทั้งในและนอกตับ เนื้องอกที่เกิดในท่อน้ำดีในตับจะถูกเรียกเป็นชนิด "ในตับ" (intrahepatic) ส่วนที่เกิดกับท่อน้ำดีนอกตับเรียก "นอกตับ" (extrahepatic) และเนื้องอกที่เกิดกับตำแหน่งที่ท่อน้ำดีออกจากตับพอดีเรียก บริเวณขั้วตับ (perihilar) มะเร็งท่อน้ำดีที่เกิดขึ้นที่ตำแหน่งที่ท่อตับข้างซ้ายและข้างขวามารวมกันเป็นท่อน้ำดีร่วมนั้นอาจเรียกว่าเนื้องอกคลาตสกิน (Klatskin tumor)[38]
แม้จะเป็นที่ทราบกันดีว่ามะเร็งท่อน้ำดีเป็นอะดีโนคาร์ซิโนมาของเซลล์เยื่อบุผิวทางเดินน้ำดี แต่ก็ยังไม่เป็นที่ทราบชัดเจนว่าเซลล์ต้นกำเนิดคือเซลล์ใด แม้หลักฐานใหม่ ๆ ชี้ว่าอาจมีเซลล์ต้นกำเนิดเป็นสเต็มเซลล์หลายสรรพคุณในตับ (pluripotent hepatic stem cell) ก็ตาม[39][40][41] เชื่อกันว่ามะเร็งท่อน้ำดีเกิดขึ้นได้จากการเกิดมะเร็งหลายระยะ ตั้งแต่มีการเจริญเกิน (hyperplasia) ในช่วงแรก กลายเป็นเมตาเพลเชีย (metaplasia) และเป็นการเจริญผิดปรกติ (dysplasia) และเกิดเป็นมะเร็งขึ้นในที่สุด ซึ่งเป็นกระบวนการที่ใกล้เคียงกับที่เกิดในการเกิดมะเร็งลำไส้ใหญ่[42] และเชื่อว่าการอักเสบเรื้อรังของท่อน้ำดี การอุดตันท่อน้ำดี และการมีน้ำดีคั่ง อาจมีส่วนในการเปลี่ยนแปลงเหล่านี้[42][43][44]
ทางมิญชวิทยาพบว่าเซลล์มะเร็งท่อน้ำดีมีความแตกต่างทางการเปลี่ยนสภาพของเซลล์ (cell differentiation) ตั้งแต่ดี (well) ไปจนถึงแย่ (undifferentiated) ส่วนใหญ่ถูกล้อมรอบด้วยการตอบสนองแบบมีเนื้อเยื่อพังผืด (fibrotic tissue) และเนื้อเยื่อเดสโมพลาสติก (desmoplastic tissue) หากมีเนื้อเยื่อพังผืดมากอาจทำให้แยกเซลล์มะเร็งท่อน้ำดีที่มีการเปลี่ยนสภาพของเซลล์ดีออกจากเซลล์เนื้อเยื่อบุผิวที่ถูกกระตุ้น (reactive epithelium) ไม่ได้ ยังไม่มีสารย้อมทางอิมมูโนฮิสโตเคมี (immunohistochemistry) ตัวใดที่สามารถแยกเนื้อเยื่อท่อน้ำดีที่เป็นเนื้อร้ายออกจากเนื้อไม่ร้ายได้ แม้จะมีการย้อมสารไซโตเคราติน (cytokeratin) คาร์ซิโนเอมบริโอนิกแอนติเจน และมิวซินที่อาจช่วยในการวินิจฉัยได้บ้างก็ตาม[45] เนื้องอกส่วนใหญ่ (>90%) เป็นมะเร็งชนิดต่อม[46]
การวินิจฉัย[แก้]
การตรวจเลือด[แก้]
ยังไม่มีการตรวจเลือดที่จำเพาะต่อการวินิจฉัยมะเร็งท่อน้ำดี แม้ระดับของคาร์ซิโนเอมบริโอนิกแอนติเจนและซีเอ 19-9 อาจเพิ่มสูงได้แต่ก็ไม่ได้มีความไวหรือความจำเพาะมากพอที่จะใช้เป็นการตรวจคัดกรองได้ อย่างไรก็ดีการตรวจเหล่านี้อาจเป็นประโยชน์เมื่อใช้ร่วมกับการตรวจภาพรังสีเพื่อสนับสนุนว่ารอยโรคที่เห็นนั้นเป็นมะเร็งท่อน้ำดีหรือไม่[47]
การตรวจภาพรังสีช่องท้อง[แก้]

มักใช้การตรวจอัลตราซาวนด์ของตับและแขนงทางเดินน้ำดีมักถูกใช้เป็นตัวเลือกแรก ๆ ในการตรวจภาพรังสีสำหรับผู้ป่วยที่สงสัยว่ามีการอุดตันของทางเดินน้ำดี[48][49] โดยสามารถตรวจพบการอุดตันและการขยายของท่อน้ำดีได้ บางครั้งก็สามารถได้ข้อมูลที่เพียงพอจะวินิจฉัยมะเร็งท่อน้ำดีได้ด้วย[50] ซีทีสแกนก็อาจมีส่วนสำคัญในการช่วยวินิจฉัยมะเร็งท่อน้ำดีด้วยได้[51][52][53]
การตรวจภาพของแขนงทางเดินน้ำดี[แก้]

แม้การถ่ายภาพรังสีของช่องท้องจะมีประโยชน์ในการช่วยการวินิจฉัยมะเร็งท่อน้ำดี แต่บ่อยครั้งการดูภาพของท่อน้ำดีโดยตรงก็มีความจำเป็น การถ่ายภาพรังสีท่อน้ำดีและตับอ่อนย้อนทางแบบส่องกล้อง (ERCP) ซึ่งเป็นการตรวจโดยการใช้กล้องส่องทางเดินอาหารทำโดยแพทย์ผู้เชี่ยวชาญระบบทางเดินอาหารหรือศัลยแพทย์ที่ได้รับการฝึกฝนพิเศษ เป็นการตรวจที่ใช้กันทั่วไปเพื่อจุดประสงค์นี้ แม้ ERCP จะเป็นการตรวจที่ค่อนข้างรุกล้ำผู้ป่วยและมีความเสี่ยงอยู่ในระดับหนึ่ง แต่ผลดีที่มีคือทำให้สามารถตัดชิ้นเนื้อส่งตรวจทางพยาธิวิทยาได้ สามารถวางท่อคงรูป (stent) ไว้เพื่อใช้ในวิธีการอื่น ๆ เพื่อลดการอุดตันทางเดินน้ำดีได้[15] นอกจากนี้ยังสามารถทำการตรวจอัลตราซาวนด์ผ่านการส่องกล้อง (endoscopic ultrasound) ไปพร้อมกันด้วยได้เพื่อเพิ่มความแม่นยำของการตัดชิ้นเนื้อส่งตรวจทางพยาธิวิทยาและให้ข้อมูลเกี่ยวกับการแพร่กระจายมายังต่อมน้ำเหลืองและการประเมินว่าจะสามารถรักษาด้วยการผ่าตัดได้หรือไม่ด้วย[54] นอกจากการใช้ ERCP แล้วยังมีการใช้การสร้างภาพท่อน้ำดีด้วยการเจาะผ่านผิวหนังและตับ (percutaneous transhepatic cholangiography, PTC) ได้ การสร้างภาพทางเดินน้ำดีและตับอ่อนด้วยเรโซแนนซ์แม่เหล็ก (magnetic resonance cholangiopancreatography, MRCP) ก็เป็นอีกวิธีหนึ่งที่ไม่ทำให้การรุกล้ำผู้ป่วยซึ่งใช้แทน ERCP ได้[55][56][57] ผู้เชี่ยวชาญบางท่านเสนอว่าควรใช้ MRCP แทน ERCP ในการวินิจฉัยมะเร็งท่อน้ำดี เนื่องจากสามารถแสดงให้เห็นขอบเขตของเนื้องอกได้แม่นยำกว่าและลดความเสี่ยงที่เกิดจากการใช้ ERCP ด้วย[58][59][60]
การผ่าตัด[แก้]
บางครั้งอาจจำเป็นต้องมีการผ่าตัดสำรวจช่องท้อง (surgical exploration) เพื่อให้สามารถได้ชิ้นเนื้อที่เหมาะสมกับการส่งตรวจทางพยาธิวิทยาและเพื่อให้สามารถประเมินระยะของผู้ป่วยมะเร็งท่อน้ำดีได้เหมาะสม การผ่าตัดด้วยการส่องกล้อง (laparoscopy) สามารถใช้เพื่อการประเมินระยะได้ และอาจสามารถลดความจำเป็นของการผ่าตัดที่รุกล้ำผู้ป่วยมากกว่าอย่างการผ่าตัดเปิดช่องท้อง (laparotomy) ได้ในผู้ป่วยบางราย[61][62] นอกจากนี้การผ่าตัดยังเป็นวิธีการรักษาให้หายเพียงทางเดียวของมะเร็งท่อน้ำดี แต่ก็ทำได้กับเฉพาะโรคระยะแรกเริ่มเท่านั้น
พยาธิวิทยา[แก้]
ทางมิญชวิทยาพบว่ามะเร็งท่อน้ำดีมักแบ่งเป็นชนิดที่มีการเปลี่ยนสภาพของเซลล์ดี (well) และปานกลาง (moderate) การตรวจทาง immunohistochemistry มีประโยชน์ในการช่วยวินิจฉัย และช่วยในการแยกว่าเนื้องอกนั้นกำเนิดจากท่อน้ำดีหรือแพร่กระจายมาจากอวัยวะอื่นในระบบทางเดินอาหาร[63] การขูดเซลล์ตรวจ (cytological scraping) มักไม่ช่วยในการวินิจฉัย[64]
การแบ่งระยะ[แก้]
แม้จะมีระบบการแบ่งระยะของมะเร็งท่อน้ำดีอยู่ไม่ต่ำกว่า 3 แบบ ก็ตาม (Bismuth, Blumgart, American Joint Committee on Cancer) แต่ไม่มีระบบใดที่แสดงให้เห็นว่ามีประโยชน์ช่วยทำนายอัตราการรอดชีวิตได้[65] ส่วนที่สำคัญที่สุดของการกำหนดระยะคือเพื่อให้ทราบว่าเนื้องอกนั้นยังสามารถผ่าตัดเอาออกได้หรือลุกลามไปมากจนไม่สามารถผ่าตัดได้ บ่อยครั้งที่การประเมินนี้จะทำได้ก็จนกว่าลงมือผ่าตัดแล้วเท่านั้น[15]
แนวทางทั่วไปในการประเมินว่าสามารถผ่าตัดออกได้หรือไม่ ได้แก่[66][67]
- การไม่มีการแพร่กระจายของมะเร็งไปยังต่อมน้ำเหลืองหรือตับ
- การไม่มีการลุกลามของมะเร็งไปยังหลอดเลือดดำพอร์ทัลของตับ
- การไม่มีการลุกลามของมะเร็งไปยังอวัยวะข้างเคียงโดยตรง
- การไม่มีการแพร่กระจายของมะเร็งไปยังอวัยวะที่อยู่ไกล
การรักษา[แก้]
หากไม่สามารถผ่าตัดเอาเนื้องอกออกได้ทั้งหมด มะเร็งท่อน้ำดีก็ถือเป็นมะเร็งที่ไม่มีทางรักษาให้หายได้ ด้วยเหตุว่าการประเมินว่าผ่าตัดเนื้องอกได้หรือไม่ในผู้ป่วยส่วนใหญ่นั้นต้องสำรวจระหว่างผ่าตัดวิธีเดียวเท่านั้น[68] ทำให้ผู้ป่วยจำนวนมากต้องได้รับการผ่าตัดสำรวจช่องท้อง เว้นเสียแต่มีข้อบ่งชี้ชัดเจนแล้วว่าเนื้องอกนั้นอยู่ในระยะที่ไม่สามารถรักษาได้โดยการผ่าตัด[15] อย่างไรก็ดี มาโยคลินิกรายงานความสำเร็จอย่างมีนัยสำคัญในการรักษามะเร็งท่อน้ำดีระยะเริ่มต้นด้วยการปลูกถ่ายตับโดยใช้แนวทางเข้าสู่แบบ protocolized และมีเกณฑ์คัดเลือกที่เข้มงวด[69]
การบำบัดตัวเสริมหลังการปลูกถ่ายตับอาจมีที่ใช้ในการรักษาผู้ป่วยที่ผ่าตัดไม่ได้บางคน[70] การบำบัดที่จำกัดอยู่เฉพาะบางบริเวณ (locoregional) นั้น ได้แก่ การให้สิ่งอุดหลอดเลือดเคมีทางหลอดเลือดแดง (transarterial chemoembolization, TACE) การให้สิ่งอุดหลอดเลือดรังสีทางหลอดเลือดแดง (transarterial radioembolization, TARE) และการบำบัดลอกอาจมีที่ใช้ในมะเร็งท่อน้ำดีชนิดในตับเพื่อให้การรักษาประทังหรืออาจมีโอกาสหายในผู้ป่วยที่ไม่ควรรับการผ่าตัด[71]
การรักษาร่วมด้วยเคมีบำบัดและรังสีรักษา[แก้]
ถ้าสามารถผ่าตัดเอาเนื้องอกออกได้ ผู้ป่วยอาจต้องได้รับการรักษาด้วยเคมีบำบัดร่วม (adjuvant chemotherapy) หรือรังสีรักษาร่วม (adjuvant radiation therapy) หลังการผ่าตัดเพื่อเพิ่มโอกาสการรักษาหายขาด หากขอบชิ้นเนื้อไม่มีเซลล์มะเร็ง (negative tissue margins) หรือสามารถตัดชิ้นมะเร็งออกได้ทั้งหมดแล้วการรักษาร่วมเหล่านี้อาจให้ประโยชน์หรือไม่นั้นยังไม่ได้ข้อสรุป มีการศึกษาวิจัยที่ให้ผลทั้งว่าการรักษาร่วมในกรณีเช่นนี้มีประโยชน์[72][73]และไม่มีประโยชน์[13][74][75] และจนถึงเดือนมีนาคม ค.ศ. 2007 ก็ยังไม่มีการศึกษาวิจัยแบบการวิจัยเชิงทดลองแบบสุ่มและมีกลุ่มควบคุมของเรื่องนี้ออกมา ส่วนบทบาทของการใช้การรักษาทั้งเคมีบำบัดและรังสีรักษาร่วม (combined chemoradiotherapy) ในสถานการณ์เช่นนี้นั้นยังไม่เป็นที่แน่ชัด อย่างไรก็ดี หากผลขอบชิ้นเนื้อพบมีเซลล์มะเร็ง (positive margin) จะเป็นการบ่งชี้ว่ายังไม่สามารถเอาก้อนเนื้องอกออกได้หมดด้วยการผ่าตัด ดังนั้นการรักษาร่วมด้วยการฉายรังสี (และอาจรวมถึงเคมีบำบัด) ในกรณีเช่นนี้จึงได้รับการยอมรับโดยทั่วไปตามข้อมูลที่มีอยู่ในปัจจุบัน[76]
การรักษาโรคในระยะลุกลาม[แก้]
ผู้ป่วยมะเร็งท่อน้ำดีจำนวนมากได้รับการวินิจฉัยโรคเมื่อโรคลุกลามไปมากถึงระยะที่ไม่สามารถรักษาได้ด้วยการผ่าตัดแล้ว[77]ซึ่งผู้ป่วยเหล่านี้มักได้รับการรักษาด้วยเคมีบำบัดแบบบรรเทาอาการ (palliative chemotherapy) โดยอาจใช้ร่วมกับรังสีรักษา มีการวิจัยเชิงทดลองแบบสุ่มและมีกลุ่มควบคุมที่รับรองการรักษาด้วยเคมีบำบัดแล้วว่าสามารถเพิ่มคุณภาพชีวิตและยืดอายุขัยของผู้ป่วยมะเร็งท่อน้ำดีระยะที่ไม่สามารถรักษาด้วยการผ่าตัดได้[78] แต่ยังไม่มีสูตรการรักษาใด ๆ ที่ได้รับการยอมรับเป็นมาตรฐานสากล ทำให้ปัจจุบันยังมีคำแนะนำให้มีการทดลองหาวิธีใหม่ ๆ ในการรักษาต่อไปอีก[76] ยาเคมีบำบัดที่ใช้รักษามะเร็งท่อน้ำดีมีเช่น 5-fluorouracil ร่วมกับ leucovorin[79] gemcitabine ตัวเดียว[80] หรือ gemcitabine ร่วมกับ cisplatin[81] irinotecan[82] หรือ capecitabine[83] การศึกษาวิจัยนำร่องบางชิ้นชี้ว่าผู้ป่วยมะเร็งท่อน้ำดีระยะลุกลามอาจได้รับประโยชน์จากยากลุ่มสารยับยั้งไทโรซีนไคเนส (tyrosine kinase inhibitors) อย่าง erlotinib[84]
การรักษาด้วย Photodynamic therapy เป็นการรักษาเชิงทดลองอย่างหนึ่งซึ่งฉีดสารไวแสง (light-sensitizing agent) เข้าไปในร่างกายผู้ป่วย จากนั้นจึงส่งคลื่นแสงเข้าไปยังเนื้องอกโดยตรงผ่านกล้องส่อง การรักษาวิธีนี้มีผลแสดงในการวิจัยเชิงทดลองแบบสุ่มและมีกลุ่มควบคุมขนาดเล็กสองชิ้นว่าได้ผล แต่ยังไม่เป็นที่แน่ชัดว่าการรักษาด้วยวิธีนี้จะมีบทบาทอย่างไรในการดูแลผู้ป่วยมะเร็งท่อน้ำดี[85][86]
พยากรณ์โรค[แก้]
การรักษาด้วยการผ่าตัดเอาก้อนเนื้อออกยังคงเป็นวิธีการรักษาเพียงวิธีเดียวของมะเร็งท่อน้ำดีที่มีโอกาสหาย สำหรับผู้ป่วยที่ไม่สามารถรักษาได้ด้วยการผ่าตัดเนื่องจากตรวจพบว่ามีการแพร่กระจายไปยังต่อมน้ำเหลืองบริเวณไกลนั้นอัตรารอดชีวิตที่ 5 ปี (5-year survival rate) อยู่ที่ 0%,[87] และโดยทั่วไปอยู่ที่ 5%[88] ค่ามัธยฐานการรอดชีวิตโดยภาพรวม (overall median duration of survival) สำหรับผู้ป่วยที่ไม่สามารถรักษาได้ด้วยการผ่าตัด ไม่ได้รับการรักษา สุขภาพอื่นปกติ และมีเนื้องอกอยู่ในตับผ่านทางท่อน้ำดีในตับและหลอดเลือดดำพอร์ทัลตับ (hepatic portal vein) อยู่ที่น้อยกว่า 6 เดือน[89]
สำหรับผู้ป่วยที่สามารถรักษาได้ด้วยการผ่าตัด โอกาสของการรักษาหายขาดได้นั้นแตกต่างกันไปขึ้นอยู่กับตำแหน่งของเนื้องอกและอยู่ที่ว่าสามารถผ่าเอาเนื้องอกนั้นออกได้ทั้งหมดหรือบางส่วน มะเร็งท่อน้ำดีส่วนปลาย ซึ่งเจริญขึ้นจากท่อน้ำดีร่วมนั้นส่วนใหญ่สามารถรักษาได้ด้วยวิธีการผ่าตัดแบบวิปเปิล (Whipple procedure) โดยมีอัตราการรอดชีวิตระยะยาว (long-term survival rate) อยู่ที่ระหว่าง 15–25% รายงานชุดหนึ่งกล่าวว่าอัตราการรอดชีวิตที่ 5 ปีของผู้ป่วยที่ไม่มีการแพร่กระจายของโรคไปยังต่อมน้ำเหลืองนั้นอยู่ที่ 54%[90] มะเร็งท่อน้ำดีในตับ ซึ่งเจริญขึ้นมาจากท่อน้ำดีส่วนที่อยู่ในเนื้อตับนั้นส่วนใหญ่รักษาด้วยการตัดเอาเนื้อตับออกบางส่วน มีรายงานหลายชุดกล่าวว่าโอกาสการรอดชีวิตหลังรับการรักษาด้วยการผ่าตัดอยู่ที่ 22-66% โดยผลการรักษาอาจแตกต่างกันไปขึ้นอยู่กับว่ามีการแพร่กระจายของมะเร็งไปยังต่อมน้ำเหลืองหรือไม่และการผ่าตัดนั้นสามารถเอาเนื้อมะเร็งออกได้หมดหรือไม่[91] มะเร็งท่อน้ำดีที่อยู่บริเวณขั้วตับ (perihilar cholangiocarcinoma) ซึ่งเจริญขึ้นมาจากบริเวณตำแหน่งที่ท่อน้ำดีออกมาจากตับนั้นมีโอกาสรักษาได้ด้วยการผ่าตัดน้อยกว่า ในกรณีที่สามารถผ่าตัดได้ส่วนใหญ่ก็ต้องผ่าตัดกินบริเวณกว้าง (aggressive) โดยมักต้องผ่าตัดเอาถุงน้ำดีออก และอาจต้องผ่าตัดเอาบางส่วนของตับออกด้วย ผู้ป่วยมะเร็งท่อน้ำดีบริเวณขั้วตับที่สามารถรักษาได้ด้วยการผ่าตัดนั้นมีรายงานอัตราการรอดชีวิตที่ 5 ปีอยู่ที่ระหว่าง 20–50%[92]
พยากรณ์โรคอาจแย่ลงไปอีกสำหรับผู้ป่วยมะเร็งท่อน้ำดีที่เป็นโรคท่อน้ำดีอักเสบแข็งปฐมภูมิอยู่ก่อน ซึ่งน่าจะมีเหตุผลมาจากการที่กว่าจะรู้ว่าเป็นโรคก็เป็นระยะที่โรคลุกลามไปมากแล้ว[18][93] หลักฐานบางชิ้นชี้ว่าผลการรักษาอาจดีกว่าหากได้รับการรักษาผ่าตัดแบบกินบริเวณกว้าง (aggressive) ร่วมกับการบำบัดตัวเสริม[94]
วิทยาการระบาด[แก้]
| ประเทศ | ในตับ (ชาย/หญิง) | นอกตับ (ชาย/หญิง) |
|---|---|---|
| สหรัฐ | 0.60/0.43 | 0.70/0.87 |
| ญี่ปุ่น | 0.23/0.10 | 5.87/5.20 |
| ออสเตรเลีย | 0.70/0.53 | 0.90/1.23 |
| อังกฤษ/เวลส์ | 0.83/0.63 | 0.43/0.60 |
| สกอตแลนด์ | 1.17/1.00 | 0.60/0.73 |
| ฝรั่งเศส | 0.27/0.20 | 1.20/1.37 |
| อิตาลี | 0.13/0.13 | 2.10/2.60 |
มะเร็งท่อน้ำดีเป็นมะเร็งชนิดที่พบค่อนข้างน้อย มีผู้ป่วยได้รับวินิจฉัยในสหรัฐ 2,000 ถึง 3,000 คนต่อปี หรือคิดเป็นอุบัติการณ์ต่อปี 1–2 ต่อ 100,000 คน[96] ประเทศไทยเป็นประเทศที่มีอุบัติการณ์ของมะเร็งท่อน้ำดีสูงที่สุดในโลก คืออยู่ที่ 84.6 ต่อ 100,000 ประชากรชาย และ 36.8 ต่อ 100,000 ประชากรหญิงในภาคตะวันออกเฉียงเหนือของประเทศไทย[7] ข้อมูลโรงพยาบาลศรีนครินทร์ จังหวัดขอนแก่นรายงานว่าพบมะเร็งท่อน้ำดีในตับเป็นอันดับ 1 ของมะเร็งที่กำเนิดขึ้นในตับ มีอุบัติการณ์ 300 รายต่อปี[97] การผ่าศพเป็นชุดรายงานความชุกระหว่าง 0.01% ถึง 0.46%[98][99] มีความชุกของมะเร็งท่อน้ำดีในทวีปเอเชียสูงกว่า ซึ่งระบุว่าสาเหตุมาจากการติดเชื้อพยาธิใบไม้ตับบางชนิด อุบัติการณ์ของมะเร็งท่อน้ำดีเพิ่มขึ้นตามอายุ และพบในชายบ่อยกว่าหญิงเล็กน้อย (อาจเนื่องจากมีอัตราเกิดท่อน้ำดีอักเสบแข็งปฐมภูมิในชายสูงกว่าหญิงซึ่งเป็นปัจจัยเสี่ยงสำคัญ)[46] ความชุกของมะเร็งท่อน้ำดีในผู้ป่วยท่อน้ำดีอักเสบแข็งปฐมภูมิอาจสูงถึง 30% จากการศึกษาด้วยการผ่าศพ[18]
งานวิจัยหลายชิ้นแสดงให้เห็นว่ากำลังมีการเพิ่มขึ้นของอุบัติการณ์ของมะเร็งท่อน้ำดีในตับในช่วงหลายทศวรรษที่ผ่านมา โดยพบผู้ป่วยเพิ่มขึ้นในทวีปอเมริกาเหนือ ยุโรป เอเชีย และออสเตรเลีย[100] สาเหตุที่ทำให้มีการเพิ่มขึ้นของอุบัติการณ์นี้ยังไม่แน่ชัดโดยอาจเป็นจากการพัฒนาของกระบวนการการวินิจฉัยก็เป็นได้ แต่ในขณะเดียวกันความชุกของปัจจัยที่อาจเป็นปัจจัยเสี่ยงของมะเร็งท่อน้ำดีเช่นการติดเชื้อเอชไอวีนั้นก็มีการเพิ่มขึ้นในช่วงเวลาที่ว่านี้เช่นกัน[25]
อ้างอิง[แก้]
- ↑ 1.0 1.1 "NCI Dictionary of Cancer Terms". National Cancer Institute (ภาษาอังกฤษ). 2 February 2011. สืบค้นเมื่อ 21 January 2019.
- ↑ 2.00 2.01 2.02 2.03 2.04 2.05 2.06 2.07 2.08 2.09 "Bile Duct Cancer (Cholangiocarcinoma) Treatment (PDQ®)–Health Professional Version". National Cancer Institute (ภาษาอังกฤษ). 14 March 2018. สืบค้นเมื่อ 21 January 2019.
- ↑ 3.0 3.1 3.2 3.3 3.4 3.5 3.6 Razumilava, N; Gores, GJ (21 June 2014). "Cholangiocarcinoma". Lancet. 383 (9935): 2168–79. doi:10.1016/S0140-6736(13)61903-0. PMC 4069226. PMID 24581682.
- ↑ 4.0 4.1 4.2 4.3 "Bile Duct Cancer (Cholangiocarcinoma) Symptoms, Tests, Prognosis, and Stages". National Cancer Institute (ภาษาอังกฤษ). 5 July 2018. สืบค้นเมื่อ 21 January 2019.
- ↑ 5.0 5.1 Bosman, Frank T. (2014). "Chapter Chapter 5.6: Liver cancer". ใน Stewart, Bernard W.; Wild, Christopher P (บ.ก.). World Cancer Report. the International Agency for Research on Cancer, World Health Organization. pp. Chapter 5.6. ISBN 978-92-832-0443-5.

- ↑ 6.0 6.1 6.2 Bridgewater, JA; Goodman, KA; Kalyan, A; Mulcahy, MF (2016). "Biliary Tract Cancer: Epidemiology, Radiotherapy, and Molecular Profiling". American Society of Clinical Oncology Educational Book. American Society of Clinical Oncology. Annual Meeting. 35 (36): e194–203. doi:10.1200/EDBK_160831. PMID 27249723.
- ↑ 7.0 7.1 7.2 Vatanasapt, V; Sriamporn, S; Vatanasapt, P (2002). "Cancer control in Thailand". Japanese journal of clinical oncology. 32 Suppl: S82–91. PMID 11959881.
- ↑ Benavides, M; Antón, A; Gallego, J; Gómez, MA; Jiménez-Gordo, A; La Casta, A; Laquente, B; Macarulla, T; Rodríguez-Mowbray, JR; Maurel, J (December 2015). "Biliary tract cancers: SEOM clinical guidelines". Clinical & Translational Oncology. 17 (12): 982–7. doi:10.1007/s12094-015-1436-2. PMC 4689747. PMID 26607930.
- ↑ Steele, JA; Richter, CH; Echaubard, P; Saenna, P; Stout, V; Sithithaworn, P; Wilcox, BA (17 May 2018). "Thinking beyond Opisthorchis viverrini for risk of cholangiocarcinoma in the lower Mekong region: a systematic review and meta-analysis". Infectious Diseases of Poverty. 7 (1): 44. doi:10.1186/s40249-018-0434-3. PMC 5956617. PMID 29769113.
- ↑ Patel T (2002). "Worldwide trends in mortality from biliary tract malignancies". BMC Cancer. 2: 10. doi:10.1186/1471-2407-2-10. PMID 11991810.
- ↑ Nagorney DM, Donohue JH, Farnell MB, Schleck CD, Ilstrup DM (August 1993). "Outcomes after curative resections of cholangiocarcinoma". Archives of Surgery. 128 (8): 871–7, discussion 877–9. doi:10.1001/archsurg.1993.01420200045008. PMID 8393652.
- ↑ "Bile duct cancer: cause and treatment". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2018-04-23. สืบค้นเมื่อ 2010-03-06.
- ↑ 13.0 13.1 13.2 Nakeeb A, Pitt HA, Sohn TA, Coleman J, Abrams RA, Piantadosi S, Hruban RH, Lillemoe KD, Yeo CJ, Cameron JL (October 1996). "Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors". Annals of Surgery. 224 (4): 463–73, discussion 473–5. doi:10.1097/00000658-199610000-00005. PMC 1235406. PMID 8857851.
- ↑ ชมรมศัลยแพทย์มะเร็ง (ประเทศไทย), ชมรมศัลยแพทย์ตับ ตับอ่อน และทางเดินน้ำดี. แนวทางการรักษาและตรวจติดตามมะเร็งท่อน้ำดี. [1][ลิงก์เสีย]
- ↑ 15.0 15.1 15.2 15.3 Mark Feldman; Lawrence S. Friedman; Lawrence J. Brandt, บ.ก. (21 July 2006). Sleisenger and Fordtran's Gastrointestinal and Liver Disease (8th ed.). Saunders. pp. 1493–6. ISBN 978-1-4160-0245-1.
- ↑ Chapman R. "Risk factors for biliary tract carcinogenesis". Ann Oncol. 10 Suppl 4: 308–11. PMID 10436847.
- ↑ งานวิจัยทางระบาดวิทยาที่ศึกษาเรื่องอุบัติการณ์ของการเกิดมะเร็งท่อน้ำดีในผู้ป่วยท่อน้ำดีอักเสบแข็งปฐมภูมิเช่นตัวอย่างดังนี้
- Bergquist A, Ekbom A, Olsson R, Kornfeldt D, Lööf L, Danielsson A, Hultcrantz R, Lindgren S, Prytz H, Sandberg-Gertzén H, Almer S, Granath F, Broomé U (2002). "Hepatic and extrahepatic malignancies in primary sclerosing cholangitis". J Hepatol. 36 (3): 321–7. doi:10.1016/S0168-8278(01)00288-4. PMID 11867174.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Bergquist A, Glaumann H, Persson B, Broomé U (1998). "Risk factors and clinical presentation of hepatobiliary carcinoma in patients with primary sclerosing cholangitis: a case-control study". Hepatology. 27 (2): 311–6. doi:10.1002/hep.510270201. PMID 9462625.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Burak K, Angulo P, Pasha T, Egan K, Petz J, Lindor K (2004). "Incidence and risk factors for cholangiocarcinoma in primary sclerosing cholangitis". Am J Gastroenterol. 99 (3): 523–6. doi:10.1111/j.1572-0241.2004.04067.x. PMID 15056096.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
- Bergquist A, Ekbom A, Olsson R, Kornfeldt D, Lööf L, Danielsson A, Hultcrantz R, Lindgren S, Prytz H, Sandberg-Gertzén H, Almer S, Granath F, Broomé U (2002). "Hepatic and extrahepatic malignancies in primary sclerosing cholangitis". J Hepatol. 36 (3): 321–7. doi:10.1016/S0168-8278(01)00288-4. PMID 11867174.
- ↑ 18.0 18.1 18.2 Rosen CB, Nagorney DM, Wiesner RH, Coffey RJ, LaRusso NF (January 1991). "Cholangiocarcinoma complicating primary sclerosing cholangitis". Annals of Surgery. 213 (1): 21–5. doi:10.1097/00000658-199101000-00004. PMC 1358305. PMID 1845927.
- ↑ Watanapa P (1996). "Cholangiocarcinoma in patients with opisthorchiasis". Br J Surg. 83 (8): 1062–64. doi:10.1002/bjs.1800830809. PMID 8869303.
- ↑ Watanapa P, Watanapa W (2002). "Liver fluke-associated cholangiocarcinoma". Br J Surg. 89 (8): 962–70. doi:10.1046/j.1365-2168.2002.02143.x. PMID 12153620.
- ↑ Shin H, Lee C, Park H, Seol S, Chung J, Choi H, Ahn Y, Shigemastu T (1996). "Hepatitis B and C virus, Clonorchis sinensis for the risk of liver cancer: a case-control study in Pusan, Korea". Int J Epidemiol. 25 (5): 933–40. doi:10.1093/ije/25.5.933. PMID 8921477.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Kobayashi M, Ikeda K, Saitoh S, Suzuki F, Tsubota A, Suzuki Y, Arase Y, Murashima N, Chayama K, Kumada H (2000). "Incidence of primary cholangiocellular carcinoma of the liver in Japanese patients with hepatitis C virus-related cirrhosis". Cancer. 88 (11): 2471–7. doi:10.1002/1097-0142(20000601)88:11<2471::AID-CNCR7>3.0.CO;2-T. PMID 10861422.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Yamamoto S, Kubo S, Hai S, Uenishi T, Yamamoto T, Shuto T, Takemura S, Tanaka H, Yamazaki O, Hirohashi K, Tanaka T (2004). "Hepatitis C virus infection as a likely etiology of intrahepatic cholangiocarcinoma". Cancer Sci. 95 (7): 592–5. doi:10.1111/j.1349-7006.2004.tb02492.x. PMID 15245596.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lu H, Ye M, Thung S, Dash S, Gerber M (2000). "Detection of hepatitis C virus RNA sequences in cholangiocarcinomas in Chinese and American patients". Chin Med J (Engl). 113 (12): 1138–41. PMID 11776153.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 25.0 25.1 25.2 Shaib Y, El-Serag H, Davila J, Morgan R, McGlynn K (2005). "Risk factors of intrahepatic cholangiocarcinoma in the United States: a case-control study". Gastroenterology. 128 (3): 620–6. doi:10.1053/j.gastro.2004.12.048. PMID 15765398.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sorensen H, Friis S, Olsen J, Thulstrup A, Mellemkjaer L, Linet M, Trichopoulos D, Vilstrup H, Olsen J (1998). "Risk of liver and other types of cancer in patients with cirrhosis: a nationwide cohort study in Denmark". Hepatology. 28 (4): 921–5. doi:10.1002/hep.510280404. PMID 9755226.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Chang AH, Parsonnet J (October 2010). "Role of bacteria in oncogenesis". Clinical Microbiology Reviews. 23 (4): 837–57. doi:10.1128/CMR.00012-10. PMC 2952975. PMID 20930075.
- ↑ Lipsett P, Pitt H, Colombani P, Boitnott J, Cameron J (1994). "Choledochal cyst disease. A changing pattern of presentation". Ann Surg. 220 (5): 644–52. doi:10.1097/00000658-199411000-00007. PMID 7979612.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Dayton M, Longmire W, Tompkins R (1983). "Caroli's Disease: a premalignant condition?". Am J Surg. 145 (1): 41–8. doi:10.1016/0002-9610(83)90164-2. PMID 6295196.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Mecklin J, Järvinen H, Virolainen M (1992). "The association between cholangiocarcinoma and hereditary nonpolyposis colorectal carcinoma". Cancer. 69 (5): 1112–4. PMID 1310886.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lee S, Kim M, Lee S, Jang S, Song M, Kim K, Kim H, Seo D, Song D, Yu E, Lee S, Min Y (2004). "Clinicopathologic review of 58 patients with biliary papillomatosis". Cancer. 100 (4): 783–93. doi:10.1002/cncr.20031. PMID 14770435.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lee C, Wu C, Chen G (2002). "What is the impact of coexistence of hepatolithiasis on cholangiocarcinoma?". J Gastroenterol Hepatol. 17 (9): 1015–20. doi:10.1046/j.1440-1746.2002.02779.x. PMID 12167124.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Su C, Shyr Y, Lui W, P'Eng F (1997). "Hepatolithiasis associated with cholangiocarcinoma". Br J Surg. 84 (7): 969–73. doi:10.1002/bjs.1800840717. PMID 9240138.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Donato F, Gelatti U, Tagger A, Favret M, Ribero M, Callea F, Martelli C, Savio A, Trevisi P, Nardi G (2001). "Intrahepatic cholangiocarcinoma and hepatitis C and B virus infection, alcohol intake, and hepatolithiasis: a case-control study in Italy". Cancer Causes Control. 12 (10): 959–64. doi:10.1023/A:1013747228572. PMID 11808716.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Haswell-Elkins, MR; Satarug, S; Elkins, DB (1992). "Opisthorchis viverrini infection in northeast Thailand and its relationship to cholangiocarcinoma". Journal of gastroenterology and hepatology. 7 (5): 538–48. PMID 1327263.
- ↑ Sahani D, Prasad S, Tannabe K, Hahn P, Mueller P, Saini S (2003). "Thorotrast-induced cholangiocarcinoma: case report". Abdom Imaging. 28 (1): 72–4. doi:10.1007/s00261-001-0148-y. PMID 12483389.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Zhu A, Lauwers G, Tanabe K (2004). "Cholangiocarcinoma in association with Thorotrast exposure". J Hepatobiliary Pancreat Surg. 11 (6): 430–3. doi:10.1007/s00534-004-0924-5. PMID 15619021.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ KLATSKIN G (1965). "Adenocarcinoma Of The Hepatic Duct At Its Bifurcation Within The Porta Hepatis. An Unusual Tumor With Distinctive Clinical And Pathological Features". Am J Med. 38: 241–56. doi:10.1016/0002-9343(65)90178-6. PMID 14256720.
- ↑ Roskams T (2006). "Liver stem cells and their implication in hepatocellular and cholangiocarcinoma". Oncogene. 25 (27): 3818–22. doi:10.1038/sj.onc.1209558. PMID 16799623.
- ↑ Liu C, Wang J, Ou Q (2004). "Possible stem cell origin of human cholangiocarcinoma". World J Gastroenterol. 10 (22): 3374–6. PMID 15484322.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sell S, Dunsford H (1989). "Evidence for the stem cell origin of hepatocellular carcinoma and cholangiocarcinoma". Am J Pathol. 134 (6): 1347–63. PMID 2474256.
- ↑ 42.0 42.1 Sirica A (2005). "Cholangiocarcinoma: molecular targeting strategies for chemoprevention and therapy". Hepatology. 41 (1): 5–15. doi:10.1002/hep.20537. PMID 15690474.
- ↑ Holzinger F, Z'graggen K, Büchler M. "Mechanisms of biliary carcinogenesis: a pathogenetic multi-stage cascade towards cholangiocarcinoma". Ann Oncol. 10 Suppl 4: 122–6. PMID 10436802.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Gores G (2003). "Cholangiocarcinoma: current concepts and insights". Hepatology. 37 (5): 961–9. doi:10.1053/jhep.2003.50200. PMID 12717374.
- ↑ de Groen P, Gores G, LaRusso N, Gunderson L, Nagorney D (1999). "Biliary tract cancers". N Engl J Med. 341 (18): 1368–78. doi:10.1056/NEJM199910283411807. PMID 10536130.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 46.0 46.1 Henson DE, Albores-Saavedra J, Corle D (September 1992). "Carcinoma of the extrahepatic bile ducts. Histologic types, stage of disease, grade, and survival rates". Cancer. 70 (6): 1498–501. doi:10.1002/1097-0142(19920915)70:6<1498::AID-CNCR2820700609>3.0.CO;2-C. PMID 1516001.
- ↑ งานวิจัยหาประสิทธิภาพของการใช่ตัวชี้วัดในเลือดเพื่อตรวจหามะเร็งท่อน้ำดี (เช่น CEA และ CA19-9) ในผู้ป่วยที่เป็นและไม่เป็นโรคท่อน้ำดีอักเสบแข็งปฐมภูมิเช่นตัวอย่างดังนี้
- Nehls O, Gregor M, Klump B (2004). "Serum and bile markers for cholangiocarcinoma". Semin Liver Dis. 24 (2): 139–54. doi:10.1055/s-2004-828891. PMID 15192787.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Siqueira E, Schoen R, Silverman W, Martin J, Rabinovitz M, Weissfeld J, Abu-Elmaagd K, Madariaga J, Slivka A, Martini J (2002). "Detecting cholangiocarcinoma in patients with primary sclerosing cholangitis". Gastrointest Endosc. 56 (1): 40–7. doi:10.1067/mge.2002.125105. PMID 12085033.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Levy C, Lymp J, Angulo P, Gores G, Larusso N, Lindor K (2005). "The value of serum CA 19-9 in predicting cholangiocarcinomas in patients with primary sclerosing cholangitis". Dig Dis Sci. 50 (9): 1734–40. doi:10.1007/s10620-005-2927-8. PMID 16133981.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Patel A, Harnois D, Klee G, LaRusso N, Gores G (2000). "The utility of CA 19-9 in the diagnoses of cholangiocarcinoma in patients without primary sclerosing cholangitis". Am J Gastroenterol. 95 (1): 204–7. doi:10.1111/j.1572-0241.2000.01685.x. PMID 10638584.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
- Nehls O, Gregor M, Klump B (2004). "Serum and bile markers for cholangiocarcinoma". Semin Liver Dis. 24 (2): 139–54. doi:10.1055/s-2004-828891. PMID 15192787.
- ↑ Saini S (1997). "Imaging of the hepatobiliary tract". N Engl J Med. 336 (26): 1889–94. doi:10.1056/NEJM199706263362607. PMID 9197218.
- ↑ Sharma M, Ahuja V. "Aetiological spectrum of obstructive jaundice and diagnostic ability of ultrasonography: a clinician's perspective". Trop Gastroenterol. 20 (4): 167–9. PMID 10769604.
- ↑ Bloom C, Langer B, Wilson S. "Role of US in the detection, characterization, and staging of cholangiocarcinoma". Radiographics. 19 (5): 1199–218. PMID 10489176.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Valls C, Gumà A, Puig I, Sanchez A, Andía E, Serrano T, Figueras J (2000). "Intrahepatic peripheral cholangiocarcinoma: CT evaluation". Abdom Imaging. 25 (5): 490–6. doi:10.1007/s002610000079. PMID 10931983.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Tillich M, Mischinger H, Preisegger K, Rabl H, Szolar D (1998). "Multiphasic helical CT in diagnosis and staging of hilar cholangiocarcinoma". AJR Am J Roentgenol. 171 (3): 651–8. PMID 9725291.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Zhang Y, Uchida M, Abe T, Nishimura H, Hayabuchi N, Nakashima Y (1999). "Intrahepatic peripheral cholangiocarcinoma: comparison of dynamic CT and dynamic MRI". J Comput Assist Tomogr. 23 (5): 670–7. doi:10.1097/00004728-199909000-00004. PMID 10524843.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Sugiyama M, Hagi H, Atomi Y, Saito M (1997). "Diagnosis of portal venous invasion by pancreatobiliary carcinoma: value of endoscopic ultrasonography". Abdom Imaging. 22 (4): 434–8. doi:10.1007/s002619900227. PMID 9157867.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Schwartz L, Coakley F, Sun Y, Blumgart L, Fong Y, Panicek D (1998). "Neoplastic pancreaticobiliary duct obstruction: evaluation with breath-hold MR cholangiopancreatography". AJR Am J Roentgenol. 170 (6): 1491–5. PMID 9609160.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Zidi S, Prat F, Le Guen O, Rondeau Y, Pelletier G (2000). "Performance characteristics of magnetic resonance cholangiography in the staging of malignant hilar strictures". Gut. 46 (1): 103–6. doi:10.1136/gut.46.1.103. PMID 10601064.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Lee M, Park K, Shin Y, Yoon H, Sung K, Kim M, Lee S, Kang E (2003). "Preoperative evaluation of hilar cholangiocarcinoma with contrast-enhanced three-dimensional fast imaging with steady-state precession magnetic resonance angiography: comparison with intraarterial digital subtraction angiography". World J Surg. 27 (3): 278–83. doi:10.1007/s00268-002-6701-1. PMID 12607051.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Yeh T, Jan Y, Tseng J, Chiu C, Chen T, Hwang T, Chen M (2000). "Malignant perihilar biliary obstruction: magnetic resonance cholangiopancreatographic findings". Am J Gastroenterol. 95 (2): 432–40. doi:10.1111/j.1572-0241.2000.01763.x. PMID 10685746.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Freeman M, Sielaff T (2003). "A modern approach to malignant hilar biliary obstruction". Rev Gastroenterol Disord. 3 (4): 187–201. PMID 14668691.
- ↑ Szklaruk J, Tamm E, Charnsangavej C (2002). "Preoperative imaging of biliary tract cancers". Surg Oncol Clin N Am. 11 (4): 865–76. doi:10.1016/S1055-3207(02)00032-7. PMID 12607576.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Weber S, DeMatteo R, Fong Y, Blumgart L, Jarnagin W (2002). "Staging laparoscopy in patients with extrahepatic biliary carcinoma. Analysis of 100 patients". Ann Surg. 235 (3): 392–9. doi:10.1097/00000658-200203000-00011. PMID 11882761.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Callery M, Strasberg S, Doherty G, Soper N, Norton J (1997). "Staging laparoscopy with laparoscopic ultrasonography: optimizing resectability in hepatobiliary and pancreatic malignancy". J Am Coll Surg. 185 (1): 33–9. PMID 9208958.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Länger F, von Wasielewski R, Kreipe HH (2006). "[The importance of immunohistochemistry for the diagnosis of cholangiocarcinomas]". Pathologe (ภาษาเยอรมัน). 27 (4): 244–50. doi:10.1007/s00292-006-0836-z. PMID 16758167.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Darwin PE, Kennedy A. Cholangiocarcinoma. eMedicine.com. URL: http://www.emedicine.com/med/topic343.htm. Accessed on: May 5, 2007.
- ↑ Zervos E, Osborne D, Goldin S, Villadolid D, Thometz D, Durkin A, Carey L, Rosemurgy A (2005). "Stage does not predict survival after resection of hilar cholangiocarcinomas promoting an aggressive operative approach". Am J Surg. 190 (5): 810–5. doi:10.1016/j.amjsurg.2005.07.025. PMID 16226963.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Tsao J, Nimura Y, Kamiya J, Hayakawa N, Kondo S, Nagino M, Miyachi M, Kanai M, Uesaka K, Oda K, Rossi R, Braasch J, Dugan J (2000). "Management of hilar cholangiocarcinoma: comparison of an American and a Japanese experience". Ann Surg. 232 (2): 166–74. doi:10.1097/00000658-200008000-00003. PMID 10903592.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rajagopalan V, Daines W, Grossbard M, Kozuch P (2004). "Gallbladder and biliary tract carcinoma: A comprehensive update, Part 1". Oncology (Williston Park). 18 (7): 889–96. PMID 15255172.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Su C, Tsay S, Wu C, Shyr Y, King K, Lee C, Lui W, Liu T, P'eng F (1996). "Factors influencing postoperative morbidity, mortality, and survival after resection for hilar cholangiocarcinoma". Ann Surg. 223 (4): 384–94. doi:10.1097/00000658-199604000-00007. PMID 8633917.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Rosen CB, Heimbach JK, Gores GJ (2008). "Surgery for cholangiocarcinoma: the role of liver transplantation". HPB. 10 (3): 186–9. doi:10.1080/13651820801992542. PMC 2504373. PMID 18773052.
- ↑ Heimbach JK, Gores GJ, Haddock MG, Alberts SR, Pedersen R, Kremers W, Nyberg SL, Ishitani MB, Rosen CB (December 2006). "Predictors of disease recurrence following neoadjuvant chemoradiotherapy and liver transplantation for unresectable perihilar cholangiocarcinoma". Transplantation. 82 (12): 1703–7. doi:10.1097/01.tp.0000253551.43583.d1. PMID 17198263.
- ↑ Kuhlmann, Jan B.; Blum, Hubert E. (May 2013). "Locoregional therapy for cholangiocarcinoma". Current Opinion in Gastroenterology. 29 (3): 324–8. doi:10.1097/MOG.0b013e32835d9dea. ISSN 0267-1379. PMID 23337933.
- ↑ Todoroki T, Ohara K, Kawamoto T, Koike N, Yoshida S, Kashiwagi H, Otsuka M, Fukao K (2000). "Benefits of adjuvant radiotherapy after radical resection of locally advanced main hepatic duct carcinoma". Int J Radiat Oncol Biol Phys. 46 (3): 581–7. PMID 10701737.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Alden M, Mohiuddin M (1994). "The impact of radiation dose in combined external beam and intraluminal Ir-192 brachytherapy for bile duct cancer". Int J Radiat Oncol Biol Phys. 28 (4): 945–51. PMID 8138448.
- ↑ Gonz?lez Gonz?lez D, Gouma D, Rauws E, van Gulik T, Bosma A, Koedooder C. "Role of radiotherapy, in particular intraluminal brachytherapy, in the treatment of proximal bile duct carcinoma". Ann Oncol. 10 Suppl 4: 215–20. PMID 10436826.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Pitt H, Nakeeb A, Abrams R, Coleman J, Piantadosi S, Yeo C, Lillemore K, Cameron J (1995). "Perihilar cholangiocarcinoma. Postoperative radiotherapy does not improve survival". Ann Surg. 221 (6): 788–97, discussion 797–8. doi:10.1097/00000658-199506000-00017. PMID 7794082.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ 76.0 76.1 National Comprehensive Cancer Network (NCCN) guidelines on evaluation and treatment of hepatobiliary malignanciesPDF (216 KB). Accessed March 13, 2007.
- ↑ Vauthey J, Blumgart L (1994). "Recent advances in the management of cholangiocarcinomas". Semin. Liver Dis. 14 (2): 109–14. doi:10.1055/s-2007-1007302. PMID 8047893.
- ↑ Glimelius B, Hoffman K, Sjödén P, Jacobsson G, Sellström H, Enander L, Linné T, Svensson C (1996). "Chemotherapy improves survival and quality of life in advanced pancreatic and biliary cancer". Ann Oncol. 7 (6): 593–600. PMID 8879373.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Choi C, Choi I, Seo J, Kim B, Kim J, Kim C, Um S, Kim J, Kim Y (2000). "Effects of 5-fluorouracil and leucovorin in the treatment of pancreatic-biliary tract adenocarcinomas". Am J Clin Oncol. 23 (4): 425–8. doi:10.1097/00000421-200008000-00023. PMID 10955877.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Park J, Oh S, Kim S, Kwon H, Kim J, Jin-Kim H, Kim Y (2005). "Single-agent gemcitabine in the treatment of advanced biliary tract cancers: a phase II study". Jpn J Clin Oncol. 35 (2): 68–73. doi:10.1093/jjco/hyi021. PMID 15709089.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Giuliani F, Gebbia V, Maiello E, Borsellino N, Bajardi E, Colucci G. "Gemcitabine and cisplatin for inoperable and/or metastatic biliary tree carcinomas: a multicenter phase II study of the Gruppo Oncologico dell'Italia Meridionale (GOIM)". Ann Oncol. 17 Suppl 7: vii73–vii77. PMID 16760299.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Bhargava P, Jani C, Savarese D, O'Donnell J, Stuart K, Rocha Lima C (2003). "Gemcitabine and irinotecan in locally advanced or metastatic biliary cancer: preliminary report". Oncology (Williston Park). 17 (9 Suppl 8): 23–6. PMID 14569844.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Knox J, Hedley D, Oza A, Feld R, Siu L, Chen E, Nematollahi M, Pond G, Zhang J, Moore M (2005). "Combining gemcitabine and capecitabine in patients with advanced biliary cancer: a phase II trial". J Clin Oncol. 23 (10): 2332–8. doi:10.1200/JCO.2005.51.008. PMID 15800324.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Philip P, Mahoney M, Allmer C, Thomas J, Pitot H, Kim G, Donehower R, Fitch T, Picus J, Erlichman C (2006). "Phase II study of erlotinib in patients with advanced biliary cancer". J Clin Oncol. 24 (19): 3069–74. doi:10.1200/JCO.2005.05.3579. PMID 16809731.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Ortner M, Caca K, Berr F, Liebetruth J, Mansmann U, Huster D, Voderholzer W, Schachschal G, Mössner J, Lochs H (2003). "Successful photodynamic therapy for nonresectable cholangiocarcinoma: a randomized prospective study". Gastroenterology. 125 (5): 1355–63. doi:10.1016/j.gastro.2003.07.015. PMID 14598251.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Zoepf T, Jakobs R, Arnold J, Apel D, Riemann J (2005). "Palliation of nonresectable bile duct cancer: improved survival after photodynamic therapy". Am J Gastroenterol. 100 (11): 2426–30. doi:10.1111/j.1572-0241.2005.00318.x. PMID 16279895.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Yamamoto M, Takasaki K, Yoshikawa T (1999). ""Lymph Node Metastasis in Intrahepatic Cholangiocarcinoma". Japanese Journal of Clinical Oncology. 29 (3): 147–150. doi:10.1093/jjco/29.3.147. PMID 10225697.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Farley D, Weaver A, Nagorney D (1995). ""Natural history" of unresected cholangiocarcinoma: patient outcome after noncurative intervention". Mayo Clin Proc. 70 (5): 425–9. doi:10.4065/70.5.425. PMID 7537346.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Grove MK, Hermann RE, Vogt DP, Broughan TA (1991). ""Role of radiation after operative palliation in cancer of the proximal bile ducts"". Am J Surg. 161: 454–458. doi:10.1016/0002-9610(91)91111-U.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ งานวิจัยเพื่อหาผลการรักษาด้วยการผ่าตัดของมะเร็งท่อน้ำดีส่วนปลายเช่นตัวอย่างดังนี้
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). "Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors". Ann Surg. 224 (4): 463–73, discussion 473–5. doi:10.1097/00000658-199610000-00005. PMID 8857851.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Nagorney D, Donohue J, Farnell M, Schleck C, Ilstrup D (1993). "Outcomes after curative resections of cholangiocarcinoma". Arch Surg. 128 (8): 871–7, discussion 877–9. PMID 8393652.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Jang J, Kim S, Park D, Ahn Y, Yoon Y, Choi M, Suh K, Lee K, Park Y (2005). "Actual long-term outcome of extrahepatic bile duct cancer after surgical resection". Ann Surg. 241 (1): 77–84. PMID 15621994.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Bortolasi L, Burgart L, Tsiotos G, Luque-De León E, Sarr M (2000). "Adenocarcinoma of the distal bile duct. A clinicopathologic outcome analysis after curative resection". Dig Surg. 17 (1): 36–41. doi:10.1159/000018798. PMID 10720830.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Fong Y, Blumgart L, Lin E, Fortner J, Brennan M (1996). "Outcome of treatment for distal bile duct cancer". Br J Surg. 83 (12): 1712–5. doi:10.1002/bjs.1800831217. PMID 9038548.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). "Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors". Ann Surg. 224 (4): 463–73, discussion 473–5. doi:10.1097/00000658-199610000-00005. PMID 8857851.
- ↑ งานวิจัยเพื่อหาผลการรักษามะเร็งท่อน้ำดีในตับเช่นตัวอย่างดังนี้
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). "Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors". Ann Surg. 224 (4): 463–73, discussion 473–5. doi:10.1097/00000658-199610000-00005. PMID 8857851.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Lieser M, Barry M, Rowland C, Ilstrup D, Nagorney D (1998). "Surgical management of intrahepatic cholangiocarcinoma: a 31-year experience". J Hepatobiliary Pancreat Surg. 5 (1): 41–7. doi:10.1007/PL00009949. PMID 9683753.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Valverde A, Bonhomme N, Farges O, Sauvanet A, Flejou J, Belghiti J (1999). "Resection of intrahepatic cholangiocarcinoma: a Western experience". J Hepatobiliary Pancreat Surg. 6 (2): 122–7. doi:10.1007/s005340050094. PMID 10398898.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Nakagohri T, Asano T, Kinoshita H, Kenmochi T, Urashima T, Miura F, Ochiai T (2003). "Aggressive surgical resection for hilar-invasive and peripheral intrahepatic cholangiocarcinoma". World J Surg. 27 (3): 289–93. doi:10.1007/s00268-002-6696-7. PMID 12607053.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Weber S, Jarnagin W, Klimstra D, DeMatteo R, Fong Y, Blumgart L (2001). "Intrahepatic cholangiocarcinoma: resectability, recurrence pattern, and outcomes". J Am Coll Surg. 193 (4): 384–91. doi:10.1016/S1072-7515(01)01016-X. PMID 11584966.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
- Nakeeb A, Pitt H, Sohn T, Coleman J, Abrams R, Piantadosi S, Hruban R, Lillemoe K, Yeo C, Cameron J (1996). "Cholangiocarcinoma. A spectrum of intrahepatic, perihilar, and distal tumors". Ann Surg. 224 (4): 463–73, discussion 473–5. doi:10.1097/00000658-199610000-00005. PMID 8857851.
- ↑ งานวิจัยเพื่อประมาณการรอดชีวิตหลังการผ่าตัดมะเร็งท่อน้ำดีบริเวณขั้วตับเช่นตัวอย่างดังนี้
- Burke E, Jarnagin W, Hochwald S, Pisters P, Fong Y, Blumgart L (1998). "Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system". Ann Surg. 228 (3): 385–94. doi:10.1097/00000658-199809000-00011. PMID 9742921.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Tsao J, Nimura Y, Kamiya J, Hayakawa N, Kondo S, Nagino M, Miyachi M, Kanai M, Uesaka K, Oda K, Rossi R, Braasch J, Dugan J (2000). "Management of hilar cholangiocarcinoma: comparison of an American and a Japanese experience". Ann Surg. 232 (2): 166–74. doi:10.1097/00000658-200008000-00003. PMID 10903592.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Chamberlain R, Blumgart L (2000). "Hilar cholangiocarcinoma: a review and commentary". Ann Surg Oncol. 7 (1): 55–66. doi:10.1007/s10434-000-0055-4. PMID 10674450.
- Washburn W, Lewis W, Jenkins R (1995). "Aggressive surgical resection for cholangiocarcinoma". Arch Surg. 130 (3): 270–6. PMID 7534059.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Nagino M, Nimura Y, Kamiya J, Kanai M, Uesaka K, Hayakawa N, Yamamoto H, Kondo S, Nishio H. "Segmental liver resections for hilar cholangiocarcinoma". Hepatogastroenterology. 45 (19): 7–13. PMID 9496478.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Rea D, Munoz-Juarez M, Farnell M, Donohue J, Que F, Crownhart B, Larson D, Nagorney D (2004). "Major hepatic resection for hilar cholangiocarcinoma: analysis of 46 patients". Arch Surg. 139 (5): 514–23, discussion 523–5. doi:10.1001/archsurg.139.5.514. PMID 15136352.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Launois B, Reding R, Lebeau G, Buard J (2000). "Surgery for hilar cholangiocarcinoma: French experience in a collective survey of 552 extrahepatic bile duct cancers". J Hepatobiliary Pancreat Surg. 7 (2): 128–34. doi:10.1007/s005340050166. PMID 10982604.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
- Burke E, Jarnagin W, Hochwald S, Pisters P, Fong Y, Blumgart L (1998). "Hilar Cholangiocarcinoma: patterns of spread, the importance of hepatic resection for curative operation, and a presurgical clinical staging system". Ann Surg. 228 (3): 385–94. doi:10.1097/00000658-199809000-00011. PMID 9742921.
- ↑ Kaya M, de Groen P, Angulo P, Nagorney D, Gunderson L, Gores G, Haddock M, Lindor K (2001). "Treatment of cholangiocarcinoma complicating primary sclerosing cholangitis: the Mayo Clinic experience". Am J Gastroenterol. 96 (4): 1164–9. doi:10.1111/j.1572-0241.2001.03696.x. PMID 11316165.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Nakeeb A, Tran K, Black M, Erickson B, Ritch P, Quebbeman E, Wilson S, Demeure M, Rilling W, Dua K, Pitt H (2002). "Improved survival in resected biliary malignancies". Surgery. 132 (4): 555–63, discission 563–4. doi:10.1067/msy.2002.127555. PMID 12407338.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - ↑ Khan SA, Taylor-Robinson SD, Toledano MB, Beck A, Elliott P, Thomas HC (December 2002). "Changing international trends in mortality rates for liver, biliary and pancreatic tumours". Journal of Hepatology. 37 (6): 806–13. doi:10.1016/S0168-8278(02)00297-0. PMID 12445422.
- ↑ Landis SH, Murray T, Bolden S, Wingo PA (1998). "Cancer statistics, 1998". Ca. 48 (1): 6–29. doi:10.3322/canjclin.48.1.6. PMID 9449931.
- ↑ Uttaravichien, T; Bhudhisawasdi, V; Pairojkul, C; Pugkhem, A (1999). "Intrahepatic cholangiocarcinoma in Thailand". Journal of hepato-biliary-pancreatic surgery. 6 (2): 128–35. doi:10.1007/s005340050095. PMID 10398899.
- ↑ Vauthey JN, Blumgart LH (May 1994). "Recent advances in the management of cholangiocarcinomas". Seminars in Liver Disease. 14 (2): 109–14. doi:10.1055/s-2007-1007302. PMID 8047893.
- ↑ Cancer Statistics Home Page — National Cancer Institute
- ↑ งานวิจัยที่ไม่มีความเกี่ยวข้องกันซึ่งแสดงให้เห็นถึงการเพิ่มขึ้นของอุบัติการณ์ของมะเร็งท่อน้ำดีทั่วโลกเช่นตัวอย่างดังนี้
- Patel T (2002). "Worldwide trends in mortality from biliary tract malignancies". BMC Cancer. 2: 10. doi:10.1186/1471-2407-2-10. PMID 11991810.
- Patel T (2001). "Increasing incidence and mortality of primary intrahepatic cholangiocarcinoma in the United States". Hepatology. 33 (6): 1353–7. doi:10.1053/jhep.2001.25087. PMID 11391522.
- Shaib Y, Davila J, McGlynn K, El-Serag H (2004). "Rising incidence of intrahepatic cholangiocarcinoma in the United States: a true increase?". J Hepatol. 40 (3): 472–7. doi:10.1016/j.jhep.2003.11.030. PMID 15123362.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - West J, Wood H, Logan R, Quinn M, Aithal G (2006). "Trends in the incidence of primary liver and biliary tract cancers in England and Wales 1971–2001". Br J Cancer. 94 (11): 1751–8. doi:10.1038/sj.bjc.6603127. PMID 16736026.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Khan S, Taylor-Robinson S, Toledano M, Beck A, Elliott P, Thomas H (2002). "Changing international trends in mortality rates for liver, biliary and pancreatic tumours". J Hepatol. 37 (6): 806–13. doi:10.1016/S0168-8278(02)00297-0. PMID 12445422.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์) - Welzel T, McGlynn K, Hsing A, O'Brien T, Pfeiffer R (2006). "Impact of classification of hilar cholangiocarcinomas (Klatskin tumors) on the incidence of intra- and extrahepatic cholangiocarcinoma in the United States". J Natl Cancer Inst. 98 (12): 873–5. PMID 16788161.
{{cite journal}}: CS1 maint: multiple names: authors list (ลิงก์)
แหล่งข้อมูลอื่น[แก้]
- ศูนย์วิจัยพยาธิใบไม้ตับและมะเร็งท่อน้ำดี เก็บถาวร 2010-07-17 ที่ เวย์แบ็กแมชชีน ของ มหาวิทยาลัยขอนแก่น
- American Cancer Society Detailed Guide to Bile Duct Cancer เก็บถาวร 2007-03-10 ที่ เวย์แบ็กแมชชีน.
- ข้อมูลเกี่ยวกับมะเร็งท่อน้ำดีนอกตับสำหรับผู้ป่วย จาก National Cancer Institute.
- The Cholangiocarcinoma Foundation: แหล่งข้อมูลสำหรับผู้ป่วยมะเร็งท่อน้ำดี ญาติมิตร ผู้ดูแล
- The Alan Morement Memorial Fund มูลนิธิของโรคมะเร็งท่อน้ำดีในอังกฤษ
- Macmillan/Cancerbackup page on Cholangiocarcinoma
